Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Utilisation de dispositifs d’assistance ventriculaire percutanée dans l’infarctus aigu du myocarde compliqué par un choc cardiogénique
Dans cet article
Résumé
Les dispositifs d’assistance ventriculaire percutanée sont de plus en plus utilisés chez les patients atteints d’infarctus aigu du myocarde et de choc cardiogénique. Ici, nous discutons du mécanisme d’action et des effets hémodynamiques de tels dispositifs. Nous passons également en revue les algorithmes et les meilleures pratiques pour l’implantation, la gestion et le sevrage de ces dispositifs complexes.
Résumé
Le choc cardiogénique est défini comme une hypotension persistante, accompagnée de signes d’hypo-perfusion de l’organe final. Les dispositifs d’assistance ventriculaire percutanée (PVAD) sont utilisés pour le traitement du choc cardiogénique dans le but d’améliorer l’hémodynamique. Impella est actuellement le PVAD le plus courant et pompe activement le sang du ventricule gauche dans l’aorte. Les PVAD déchargent le ventricule gauche, augmentent le débit cardiaque et améliorent la perfusion coronaire. Les PVAD sont généralement placés dans le laboratoire de cathétérisme cardiaque sous guidage fluoroscopique via l’artère fémorale lorsque cela est possible. En cas de maladie artérielle périphérique grave, les PVAD peuvent être implantés par un autre accès. Dans cet article, nous résumons le mécanisme d’action du PVAD et les données soutenant leur utilisation dans le traitement du choc cardiogénique.
Introduction
Le choc cardiogénique (CS) est défini comme une hypotension persistante (pression artérielle systolique <90 mmHg pendant 30 minutes >, ou besoin de vasopresseurs ou d’inotropes), hypo-perfusion des organes terminaux (débit urinaire <30 mL/h, extrémités froides ou lactate > 2 mmol/L), congestion pulmonaire (pression du coin capillaire pulmonaire (PCWP) ≥ 15 mmHg) et diminution des performances cardiaques (indice cardiaque <2,2 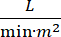 )1, 2 en raison d’un trouble cardiaque primaire. L’infarctus aigu du myocarde (IAM) est la cause la plus fréquente de CS3. Le CS survient dans 5 à 10 % des AMI et a toujours été associé à une mortalité importante3,4. Les dispositifs de soutien circulatoire mécanique (MCS) tels que la pompe à ballonnet intra-aortique (IABP), les dispositifs d’assistance ventriculaire percutanée (PVAD), l’oxygénation par membrane extracorporelle (ECMO) et les dispositifs percutanés auriculaires gauches à aortiques sont fréquemment utilisés chez les patients atteints de CS5. L’utilisation systématique de l’IABP n’a démontré aucune amélioration des résultats cliniques ou de la survie dans AMI-CS1. Compte tenu des mauvais résultats associés à l’AMI-CS, des difficultés à mener des essais dans l’AMI-CS et des résultats négatifs de l’utilisation de l’IABP dans l’AMI-CS, les cliniciens se tournent de plus en plus vers d’autres formes de MCS.
)1, 2 en raison d’un trouble cardiaque primaire. L’infarctus aigu du myocarde (IAM) est la cause la plus fréquente de CS3. Le CS survient dans 5 à 10 % des AMI et a toujours été associé à une mortalité importante3,4. Les dispositifs de soutien circulatoire mécanique (MCS) tels que la pompe à ballonnet intra-aortique (IABP), les dispositifs d’assistance ventriculaire percutanée (PVAD), l’oxygénation par membrane extracorporelle (ECMO) et les dispositifs percutanés auriculaires gauches à aortiques sont fréquemment utilisés chez les patients atteints de CS5. L’utilisation systématique de l’IABP n’a démontré aucune amélioration des résultats cliniques ou de la survie dans AMI-CS1. Compte tenu des mauvais résultats associés à l’AMI-CS, des difficultés à mener des essais dans l’AMI-CS et des résultats négatifs de l’utilisation de l’IABP dans l’AMI-CS, les cliniciens se tournent de plus en plus vers d’autres formes de MCS.
Les PVAD sont de plus en plus utilisés chez les patients atteints d’AMI-CS6. Dans cet article, nous allons concentrer notre discussion principalement sur l’Impella CP, qui est le PVAD le plus couramment utilisé actuellement6. Ce dispositif utilise une pompe à vis d’Archimède à flux axial qui propulse activement et continuellement le sang du ventricule gauche (LV) dans l’aorte ascendante(Figure 1). Le dispositif est le plus souvent placé dans le laboratoire de cathétérisme cardiaque sous guidage fluoroscopique via l’artère fémorale. Alternativement, il peut être implanté par un accès axillaire ou transcaval si nécessaire7,8.
Protocole
Ce protocole est la norme de soins dans notre établissement.
1. Insertion du PVAD (p. ex. Impella CP)
- Obtenir un accès fémoral commun sur la moitié inférieure de la tête fémorale sous guidage fluoroscopique et échographique à l’aide d’une aiguille de micro-ponction9,10. Positionner la gaine de micro-ponction et obtenir une angiographie de l’artère fémorale pour confirmer l’emplacement approprié de l’artériotomie11.
- Insérez une gaine de 6 Fr dans l’artère fémorale.
- En cas de préoccupation pour une maladie ilio-fémorale, insérez un cathéter en queue de cochon dans la partie inférieure de l’aorte abdominale et effectuez une angiographie du système iliofémoral pour vous assurer qu’il n’y a pas de maladie artérielle périphérique (MAP) importante qui pourrait empêcher l’insertion de PVAD. S’il y a une maladie modérée ou une calcification des artères iliaques, envisagez d’utiliser une gaine plus longue de 25 cm 14 Français afin que l’extrémité de la gaine se trouve dans un segment relativement sain de l’aorte abdominale.
- Dilater en série le site d’artériotomie sur un fil rigide de 0,035 » à l’aide de dilatateurs 8, 10 et 12 Fr séquentiellement. Ensuite, insérez la gaine 14 Fr peel away sous guidage fluoroscopique, en veillant à ce que la pointe avance sans résistance.
- Administrer le bolus d’héparine (~ 100 U / kg de poids corporel) pour un objectif ACT de 250 à 300 s. Les anticoagulations alternatives comprennent la bivalirudine et l’argatroban.
- Utilisez un cathéter en queue de cochon pour traverser dans le LV à l’aide d’un fil à pointe J de 0,035 po. Retirez le fil J et vérifiez un LVEDP.
- Façonnez la pointe du fil de longueur d’échange de 0,018 " inclus dans le kit et insérez-le dans le LV afin qu’il forme une courbe stable à l’apex du LV.
- Assurez-vous que ACT est au but (250 à 300 s) avant l’insertion12,13.
- Retirez le cathéter en queue de cochon et insérez la pompe en chargeant le fil sur la lumière rouge de chargement préassemblée (par exemple, EasyGuide) jusqu’à ce qu’il sorte près de l’étiquette.
- Retirez la lumière rouge de chargement en tirant doucement sur l’étiquette tout en tenant le cathéter.
- Avancez l’appareil par petits incréments sous guidage fluoroscopique dans le LV sur le fil de 0,018 « .
- Placez la pompe dans le LV avec son entrée à 4 cm sous la valve aortique et assurez-vous qu’elle est exempte des cordes mitrales. Être trop près de l’apex peut provoquer des PVC et déclencher des « alarmes d’aspiration ». Retirez le fil .018 » et une fois retiré, démarrez la pompe. Enlevez l’excès de mou afin que la pompe repose contre la courbure moindre de l’aorte.
- Surveillez la console pour vous assurer que le courant du moteur est pulsatile et que la forme d’onde aortique est affichée. Si une forme d’onde ventriculaire est affichée, il peut être nécessaire de retirer la pompe.
- Si l’appareil doit être laissé sur place, retirez la gaine et insérez la gaine de repositionnement préchargée sur l’appareil.
- Vérifiez à nouveau la position de l’appareil lors de la fluoroscopie et les formes d’onde sur la console.
- Palper (ou sentir avec Doppler) les impulsions artérielles distales des membres inférieurs, y compris le pedis dorsalis et le tibial postérieur avant et après l’insertion du dispositif. Documentez cela de manière appropriée dans le dossier médical du patient.
- Si des impulsions ou des dopplers ne peuvent pas être obtenus, envisagez de prendre une angiographie des membres inférieurs en utilisant le port de réintroduction du fil situé sur le côté de l’appareil ou en utilisant un autre accès pour assurer un flux non obstructif vers le membre inférieur.
- Si l’écoulement est obstrué, placez une gaine de reperfusion avant de transférer le patient à l’UNITÉ DE SOINSC. Chez les patients atteints d’AOMI qui présentent un risque élevé d’obstruction du flux, envisager fortement d’insérer la gaine de reperfusion avant la mise en place de la gaine 14 Fr (c’est-à-dire après l’étape 1.4 indiquée ci-dessus).
- Surveiller les patients traités avec un PVAD dans l’unité de soins intensifs (CCU) par du personnel formé à son utilisation.
2. Soins post-procéduraux
- Appliquer un pansement stérile.
- Positionnez l’appareil à un angle de 45° lorsque vous entrez dans la peau (la gaze sous la gaine de repositionnement peut être utile pour maintenir cet angle). Ne pas le faire peut entraîner le suintement de l’artériotomie, conduisant à la formation d’un hématome. Il est également utile de placer des sutures avec une pression vers l’avant pour éviter la migration de l’appareil et prévenir les saignements.
REMARQUE: La fixation du membre inférieur avec un dispositif d’immobilisation du genou peut également limiter la migration de l’appareil pour rappeler au patient de ne pas plier / déplacer le membre affecté. Cela ne doit pas être fixé trop étroitement afin de ne pas compromettre la circulation. - Continuez à effectuer des contrôles de pouls de routine (palpables ou Doppler).
3. Positionnement
- Utilisez l’échocardiogramme transthoracique de chevet pour confirmer la position appropriée de l’appareil avant le transfert ou immédiatement à l’arrivée à l’unité de soins intensifs cardiaques, selon la disponibilité d’une échographie au point de service.
- Utilisez une vue parasternale à long axe pour évaluer la position de l’appareil. Une vue subxyphoïde peut également être utilisée si la vue parasternale à long axe n’est pas disponible. Une mesure de la valve aortique à l’entrée de l’appareil devrait idéalement être de 3-4 cm pour un positionnement correct de l’appareil.
- Utilisez des échocardiogrammes pour noter la position de l’appareil par rapport à la valve mitrale.
- Lorsqu’un appareil doit être repositionné, baissez l’appareil sur P2, dévissez le mécanisme de verrouillage sur le couvercle stérile pour avancer ou rétracter l’appareil. On peut coupler en avançant ou en se rétractant si la queue de cochon ou l’entrée est trop proche de la valve mitrale.
- Verrouillez l’appareil dans la nouvelle position et documentez la nouvelle position.
- Ensuite, augmentez l’appareil au niveau de support souhaité.
- Après avoir augmenté le niveau de support, réévaluez la position de l’appareil car l’appareil peut sauter en avant lorsque la vitesse augmente.
REMARQUE: Si l’appareil a été retiré à travers la valve aortique, le repositionnement est préférable dans le laboratoire de cathétérisme sous guidage de fluoroscopie.
4. Sevrage
- Envisagez le sevrage lorsque les vasopresseurs / inotropes sont à faibles doses ou complètement sevrés. L’hémodynamique doit être surveillée en permanence pour maintenir un CPO > 0,6 W. Surveillez attentivement l’hémodynamique ventriculaire droite (RV) dans le but de maintenir la pression auriculaire droite (RAP) <12 mmHg et l’indice de pulsatilité de l’artère pulmonaire (PAPI) >1,014. Envisagez également d’obtenir un pH, des saturations veineuses mélangées et du lactate toutes les 2 à 6 heures pour surveiller le travail cardiaque et la perfusion des organes terminaux.
- Diminuez la puissance de 1 à 2 niveaux sur 2 heures, en notant CPO, PAPI, RAP, MAP et la production d’urine. Si le CPO tombe <0,6 W, le RAP commence à augmenter, la production d’urine tombe > 20 mL / h ou MAP <60 mmHg, augmentez la puissance au niveau précédent.
5. Suppression12
- Utiliser des dispositifs de fermeture vasculaire pour fermer le site d’accès à l’artériotomie avec un déploiement complet du dispositif effectué lorsque la gaine de gros alésage est retirée14. La tamponnade par ballonnet endovasculaire temporaire ou « technique de fermeture en champ sec » est un moyen efficace et sûr d’assurer l’hémostase du site d’accès au grand forage15.
- Descendez à P1 et retirez l’appareil dans l’aorte, puis passez à P0 et déconnectez l’appareil de la console lorsque le cathéter est retiré du corps.
- Notez que l’appareil ne doit pas être laissé à travers la valve aortique à P0 en raison du risque de régurgitation aortique.
- Si vous envisagez une hémostase manuelle, attendez que ACT <150 et maintenez 3 minutes de pression par taille de Français.
Résultats
Le tableau 1 montre l’innocuité et l’efficacité de l’implantation PVAD35,36,37,38,39,40.
Optimisation des résultats PVAD
Les PVAD sont une intervention gourmande en ressources qui nécessite une expérience et une expertise considérables pour optimiser...
Discussion
Minimiser les risques et les complications de la PVAD (Tableau 2)
Les avantages hémodynamiques de la PVAD peuvent être considérablement neutralisés si des complications de l’accès de gros calibre se produisent, telles que des saignements majeurs et une ischémie aiguë des membres28,29. Il est donc essentiel de minimiser les risques et les complications de l’appareil.
Afin de réduire les complications du s...
Déclarations de divulgation
Dr. Aditya Bharadwaj est consultant, surveillant et membre du Speakers Bureau for Abiomed.
Le Dr Mir Basir est consultant pour Abbott Vascular, Abiomed, Cardiovascular System, Chiesi, Procyrion et Zoll.
Remerciements
Aucun
matériels
| Name | Company | Catalog Number | Comments |
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
Références
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O'Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O'neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon