Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Utilización de dispositivos de asistencia ventricular percutánea en el infarto agudo de miocardio complicado por shock cardiogénico
En este artículo
Resumen
Los dispositivos de asistencia ventricular percutánea se utilizan cada vez más en pacientes con infarto agudo de miocardio y shock cardiogénico. Aquí, discutimos el mecanismo de acción y los efectos hemodinámicos de tales dispositivos. También revisamos algoritmos y mejores prácticas para la implantación, manejo y destete de estos dispositivos complejos.
Resumen
El shock cardiogénico se define como hipotensión persistente, acompañada de evidencia de hipoperfusión en el órgano final. Los dispositivos de asistencia ventricular percutánea (PVAD) se utilizan para el tratamiento del shock cardiogénico en un esfuerzo por mejorar la hemodinámica. Impella es actualmente el PVAD más común y bombea activamente sangre desde el ventrículo izquierdo hacia la aorta. Los PVAD descargan el ventrículo izquierdo, aumentan el gasto cardíaco y mejoran la perfusión coronaria. Los PVAD generalmente se colocan en el laboratorio de cateterismo cardíaco bajo guía fluoroscópica a través de la arteria femoral cuando es posible. En casos de enfermedad arterial periférica grave, los PVAD se pueden implantar a través de un acceso alternativo. En este artículo, resumimos el mecanismo de acción de PVAD y los datos que respaldan su uso en el tratamiento del shock cardiogénico.
Introducción
El shock cardiogénico (SC) se define como hipotensión persistente (presión arterial sistólica <90 mmHg durante >30 minutos, o la necesidad de vasopresores o inotrópicos), hipoperfusión de órganos terminales (diuresis <30 ml / h, extremidades frías o lactato > 2 mmol / L), congestión pulmonar (presión de cuña capilar pulmonar [PCWP) ≥ 15 mmHg) y disminución del rendimiento cardíaco (índice cardíaco <2.2 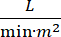 )1, 2 debido a un trastorno cardíaco primario. El infarto agudo de miocardio (IAM) es la causa más común de CS3. El SC ocurre en el 5-10% de los IAM e históricamente se ha asociado con una mortalidad significativa3,4. Los dispositivos de soporte circulatorio mecánico (SQM) como la bomba de balón intraaórtico (IABP), los dispositivos de asistencia ventricular percutánea (PVAD), la oxigenación por membrana extracorpórea (ECMO) y los dispositivos percutáneos de la aurícula izquierda a la aórtica se utilizan con frecuencia en pacientes con CS5. El uso rutinario de IABP no ha demostrado mejoría en los resultados clínicos o la supervivencia en AMI-CS1. Dados los malos resultados asociados con AMI-CS, las dificultades para realizar ensayos en AMI-CS y los resultados negativos del uso de IABP en AMI-CS, los médicos buscan cada vez más otras formas de MCS.
)1, 2 debido a un trastorno cardíaco primario. El infarto agudo de miocardio (IAM) es la causa más común de CS3. El SC ocurre en el 5-10% de los IAM e históricamente se ha asociado con una mortalidad significativa3,4. Los dispositivos de soporte circulatorio mecánico (SQM) como la bomba de balón intraaórtico (IABP), los dispositivos de asistencia ventricular percutánea (PVAD), la oxigenación por membrana extracorpórea (ECMO) y los dispositivos percutáneos de la aurícula izquierda a la aórtica se utilizan con frecuencia en pacientes con CS5. El uso rutinario de IABP no ha demostrado mejoría en los resultados clínicos o la supervivencia en AMI-CS1. Dados los malos resultados asociados con AMI-CS, las dificultades para realizar ensayos en AMI-CS y los resultados negativos del uso de IABP en AMI-CS, los médicos buscan cada vez más otras formas de MCS.
Los PVAD se utilizan cada vez más en pacientes con IAM-CS6. En este artículo, centraremos nuestra discusión principalmente en el Impella CP, que es el PVAD más común utilizado actualmente6. Este dispositivo utiliza una bomba de tornillo Arquímedes de flujo axial que impulsa activa y continuamente la sangre desde el ventrículo izquierdo (VI) hacia la aorta ascendente(Figura 1). El dispositivo se coloca con mayor frecuencia en el laboratorio de cateterismo cardíaco bajo guía fluoroscópica a través de la arteria femoral. Alternativamente, se puede implantar a través de un acceso axilar o transcaval cuando sea necesario7,8.
Protocolo
Este protocolo es el estándar de atención en nuestra institución.
1. Inserción del PVAD (por ejemplo, Impella CP)
- Obtener acceso femoral común sobre la mitad inferior de la cabeza femoral bajo guía fluoroscópica y ecográfica utilizando una aguja de micropinchación9,10. Coloque la vaina de la micropincha y obtenga una angiografía de la arteria femoral para confirmar la ubicación adecuada de la arteriotomía11.
- Inserte una vaina de 6 Fr en la arteria femoral.
- Si hay preocupación por la enfermedad ilio-femoral, inserte un catéter de coleta en la porción inferior de la aorta abdominal y realice una angiografía del sistema iliofemoral para asegurarse de que no haya una enfermedad arterial periférica (EAP) significativa que pueda impedir la inserción de PVAD. Si hay enfermedad moderada o calcificación de las arterias ilíacas, considere usar una vaina francesa más larga de 25 cm 14 para que la punta de la vaina esté en un segmento relativamente saludable de la aorta abdominal.
- Dilatar en serie el sitio de la arteriotomía sobre un cable rígido de .035" utilizando dilatadores de 8, 10 y 12 Fr secuencialmente. Luego, inserte la funda de pelar 14 Fr bajo guía fluoroscópica, asegurando que la punta avance sin resistencia.
- Administrar bolo de heparina (~100 U/kg de peso corporal) para un objetivo de ACT de 250 a 300 s. La anticoagulación alternativa incluye bivalirudina y argatroban.
- Use un catéter de coleta para cruzar al VI usando un cable con punta J de .035 ". Retire el cable J y compruebe un LVEDP.
- Dé forma a la punta del cable de 0.018" de longitud de intercambio incluido en el kit e insértelo en el LV para que forme una curva estable en el ápice del LV.
- Asegúrese de que ACT esté en la meta (250 a 300 s) antes de la inserción12,13.
- Retire el catéter pigtail e inserte la bomba cargando el cable en el lumen rojo de carga premontado (por ejemplo, EasyGuide) hasta que salga cerca de la etiqueta.
- Retire el lumen rojo de carga tirando suavemente de la etiqueta mientras sostiene el catéter.
- Avance el dispositivo en pequeños incrementos bajo guía fluoroscópica hacia el LV sobre el cable de 0.018".
- Coloque la bomba en el VI con su entrada 4 cm por debajo de la válvula aórtica y asegúrese de que esté libre de las cuerdas mitrales. Estar demasiado cerca del ápice puede causar PVC y activar "alarmas de succión". Retire el cable .018" y una vez retirado, encienda la bomba. Elimine el exceso de holgura para que la bomba descanse contra la curvatura menor de la aorta.
- Supervise la consola para asegurarse de que la corriente del motor es pulsátil y se muestra la forma de onda aórtica. Si se muestra una forma de onda ventricular, es posible que sea necesario retirar la bomba.
- Si es necesario dejar el dispositivo in situ, retire la funda de peal-away e inserte la funda de reposicionamiento precargada en el dispositivo.
- Compruebe de nuevo la posición del dispositivo en la fluoroscopia y las formas de onda en la consola.
- Palpar (o detectar con Doppler) los pulsos arteriales distales de las extremidades inferiores, incluidos dorsalis pedis y tibial posterior antes y después de la inserción del dispositivo. Documente esto apropiadamente en el registro médico del paciente.
- Si no se pueden obtener pulsos o dopplers, considere tomar una angiografía de extremidad inferior utilizando el puerto de reintroducción de alambre ubicado en el costado del dispositivo o usando otro acceso para garantizar un flujo no obstructivo a la extremidad inferior.
- Si se obstruye el flujo, coloque una vaina de reperfusión antes de transferir al paciente a la CCU. En pacientes con EAP que tienen un alto riesgo de flujo obstructivo, considere seriamente insertar la vaina de reperfusión antes de la colocación de la vaina de 14 Fr (es decir, después del paso 1.4 mencionado anteriormente).
- Monitorizar a los pacientes tratados con un PVAD en la unidad de cuidados críticos (UCC) por personal capacitado en su uso.
2. Cuidados post-procesales
- Aplicar apósito estéril.
- Coloque el dispositivo en un ángulo de 45 ° al entrar en la piel (una gasa debajo de la vaina de reposicionamiento puede ser útil para mantener este ángulo). Si no lo hace, la arteriotomía puede rezumar, lo que lleva a la formación de un hematoma. También es útil colocar suturas con presión hacia adelante para evitar la migración del dispositivo y prevenir el sangrado.
NOTA: Asegurar la extremidad inferior con un inmovilizador de rodilla también puede limitar la migración del dispositivo como un recordatorio para que el paciente no doble / mueva la extremidad afectada. Esto no debe sujetarse demasiado fuertemente para no comprometer la circulación. - Continúe realizando controles de pulso de rutina (palpables o Doppler).
3. Posicionamiento
- Use el ecocardiograma transtorácico junto a la cama para confirmar la posición adecuada del dispositivo, ya sea antes de la transferencia o inmediatamente después de la llegada a la UCI cardíaca, dependiendo de la disponibilidad de un ultrasonido en el punto de atención.
- Utilice una vista de eje largo paraesternal para evaluar la posición del dispositivo. También se puede utilizar una vista subxifoidea si no se puede obtener una vista de eje largo paraesternal. Una medición desde la válvula aórtica hasta la entrada del dispositivo idealmente debe ser de 3-4 cm para el posicionamiento adecuado del dispositivo.
- Use ecocardiogramas para anotar la posición del dispositivo en relación con la válvula mitral.
- Cuando sea necesario reposicionar un dispositivo, baje el dispositivo a P2, desenrosque el mecanismo de bloqueo en la cubierta estéril para avanzar o retraer el dispositivo. Uno puede torcer como avanzando o retrayéndose si la coleta o la entrada está demasiado cerca de la válvula mitral.
- Bloquee el dispositivo en la nueva posición y documente la nueva posición.
- Después de esto, aumente el dispositivo al nivel de soporte deseado.
- Después de aumentar el nivel de soporte, reevalúe la posición del dispositivo, ya que el dispositivo puede saltar hacia adelante cuando aumenta la velocidad.
NOTA: Si el dispositivo se ha retirado a través de la válvula aórtica, es mejor realizar el reposicionamiento en el laboratorio de cateterismo bajo la guía de fluoroscopia.
4. Destete
- Considere el destete cuando los vasopresores/inotropos estén en dosis bajas o completamente destetados. La hemodinámica debe monitorizarse continuamente para mantener un CPO > 0,6 W. Monitoree cuidadosamente la hemodinámica del ventrículo derecho (RV) con el objetivo de mantener la presión auricular derecha (RAP) <12 mmHg y el índice de pulsatilidad de la arteria pulmonar (PAPI) >1,014. También considere la posibilidad de obtener pH, saturaciones venosas mixtas y lactato cada 2-6 horas para controlar el trabajo cardíaco y la perfusión de los órganos finales.
- Disminuya la potencia en 1-2 niveles durante 2 horas, teniendo en cuenta CPO, PAPI, RAP, MAP y la producción de orina. Si el CPO cae <0.6 W, el RAP comienza a aumentar, la producción de orina disminuye > 20 ml / h o MAP <60 mmHg, aumente la potencia al nivel anterior.
5. Eliminación12
- Utilice dispositivos de cierre vascular para cerrar el sitio de acceso a la arteriotomía con el despliegue completo del dispositivo realizado cuando se retira la vaina de gran diámetro14. El taponamiento temporal con balón endovascular o "técnica de cierre de campo seco" es una forma efectiva y segura de garantizar la hemostasia del sitio de acceso al gran orificio15.
- Marque hacia abajo a P1 y tire hacia atrás del dispositivo en la aorta seguido de un cambio a P0 y desconecte el dispositivo de la consola a medida que el catéter se extrae del cuerpo.
- Tenga en cuenta que el dispositivo no debe dejarse a través de la válvula aórtica en P0 debido al riesgo de regurgitación aórtica.
- Si está considerando la hemostasia manual, espere hasta act <150 y mantenga 3 minutos de presión por tamaño francés.
Resultados
La Tabla 1 muestra la seguridad y eficacia de la implantación de PVAD35,36,37,38,39,40.
Optimización de los resultados de PVAD
Los PVAD son una intervención de muchos recursos que requiere experiencia y conocimientos significativos para optimizar los resultad...
Discusión
Minimización de los riesgos y complicaciones del PVAD (Tabla 2)
Los beneficios hemodinámicos de la PVAD pueden neutralizarse significativamente si se producen complicaciones del acceso de gran diámetro, como sangrado mayor e isquemia aguda de las extremidades28,29. Por lo tanto, es esencial minimizar el riesgo y las complicaciones del dispositivo.
Con el fin de disminuir las complicaciones del sitio de acceso y r...
Divulgaciones
El Dr. Aditya Bharadwaj es consultor, supervisor y miembro de la Oficina de Oradores de Abiomed.
El Dr. Mir Basir es consultor de Abbott Vascular, Abiomed, Cardiovascular System, Chiesi, Procyrion y Zoll.
Agradecimientos
Ninguno
Materiales
| Name | Company | Catalog Number | Comments |
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
Referencias
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O'Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O'neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados