このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
心原性ショックによる急性心筋梗塞における経皮性心室アシスト装置の利用
要約
急性心筋梗塞や心原性ショックを受けた患者では、経皮性心室補助装置がますます利用されています。ここでは、このようなデバイスの作用機序と血行力学的効果について議論する。また、これらの複雑なデバイスの移植、管理、および引き分けのためのアルゴリズムとベストプラクティスについても検討します。
要約
心原性ショックは、持続性低血圧と定義され、末端臓器低灌流の証拠を伴う。経皮性心室補助装置(PVAD)は、ヘモダイナミクスを改善するために心原性ショックの治療に使用されます。インペラは現在最も一般的なPVADであり、積極的に大大体に左心室から血液を送り出す。PVADは左心室をアンロードし、心拍出量を増加させ、冠状動脈灌流を改善する。PVADは、通常、可能であれば大腿動脈を介して蛍視的指導の下で心臓カテーテル検査室に配置される。重篤な末梢動脈疾患の場合、PVADは代替アクセスを介して移植することができる。本稿では、PVADの作用機序と、心因性ショックの治療におけるそれらの使用を支持するデータを要約する。
概要
心原性ショック(CS)は、持続性低血圧(収縮期血圧<90mmHg>30分間、持続性低血圧と定義され、 または血管圧子またはイノトロープの必要性)、末端臓器低灌流(尿出力<30 mL/h、冷却四肢または乳酸塩>2 mmol/L)、肺鬱血(肺毛細血管ウェッジ圧(PCWP)15mmHg)≥、心臓性能低下(心臓 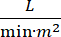 指数<2)1、原発性心疾患による2。急性心筋梗塞(AMI)はCS3の最も一般的な原因である。CSはAMIの5〜10%で発生し、歴史的に有意な死亡率3、4に関連付けられてきた。大動脈バルーンポンプ(IABP)、経皮性心室補助装置(PVAD)、体外膜酸素化(ECMO)および大動脈装置への経皮的左心房などの機械的循環支持(MCS)装置は、CS5患者に頻繁に使用される。IABPの日常的な使用は、AMI-CS1における臨床結果または生存率の改善を示していない。AMI-CSに関連する悪い結果、AMI-CSでの試験実施の難しさを考えると、AMI-CSにおけるIABP使用の否定的な結果を考えると、臨床医はますます他の形態のMCSに目を向けています。
指数<2)1、原発性心疾患による2。急性心筋梗塞(AMI)はCS3の最も一般的な原因である。CSはAMIの5〜10%で発生し、歴史的に有意な死亡率3、4に関連付けられてきた。大動脈バルーンポンプ(IABP)、経皮性心室補助装置(PVAD)、体外膜酸素化(ECMO)および大動脈装置への経皮的左心房などの機械的循環支持(MCS)装置は、CS5患者に頻繁に使用される。IABPの日常的な使用は、AMI-CS1における臨床結果または生存率の改善を示していない。AMI-CSに関連する悪い結果、AMI-CSでの試験実施の難しさを考えると、AMI-CSにおけるIABP使用の否定的な結果を考えると、臨床医はますます他の形態のMCSに目を向けています。
PVADは、AMI-CS6の患者でますます利用されています。この記事では、現在使用されている最も一般的なPVADであるImpella CPに主に焦点を当てます 6.この装置は、左心室(LV)から昇順大動脈に血液を積極的かつ継続的に推進する軸流アルキメデススクリューポンプを利用する(図1)。装置は大腿動脈を介して蛍視的指導の下で心臓カテーテル検査室で最も頻繁に置かれる。あるいは、必要に応じて腋窩または経カバリーアクセスを通して移植することができます7,8.
プロトコル
このプロトコルは、私たちの機関のケアの標準です。
1. PVADの挿入(例えば、インペラCP)
- 微小穿刺針9,10を用いて、大腿骨頭の下半分に対する大腿部の一般的なアクセスを、細小穿刺および超音波誘導で取得する。マイクロ穿刺鞘を位置付け、大腿動脈の血管造影を得て、適切な動脈開法位置11を確認する。
- 大腿動脈に6Frシースを挿入する。
- イリオ大腿疾患に懸念がある場合は、腹部大動脈の下部分にピグテールカテーテルを挿入し、腸骨動脈系の血管造影を行い、PVAD挿入を妨げる可能性のある重大な末梢動脈疾患(PAD)がないことを確認する。腸骨動脈の中等度の疾患または石灰化がある場合は、鞘の先端が腹部大動脈の比較的健康なセグメントにあるように、より長い25cm 14フランスの鞘を使用することを検討する。
- 8、10、12 Fr拡張器を順次使用して、硬い.035インチのワイヤー上で動脈開管部位を連続的に拡張する。次いで、14Frを透視的ガイダンスの下でシースを剥がし、抵抗することなく先端が進むのを保証する。
- 250〜300 sのACT目標に対してヘパリンボーラス(約100 U/kg体重)を投与する。代替抗凝固には、ビバリルジンおよびアルガトロバンが含まれる。
- ピグテールカテーテルを使用して、.035"Jチップワイヤーを使用してLVに渡ります。Jワイヤーを取り外し、LVEDPを確認します。
- キットに含まれる交換長0.018"ワイヤーの先端を形状化し、LV頂点で安定した曲線を形成するようにLVに挿入します。
- 挿入12、13の前に ACT が目標 (250 ~ 300 s) であることを確認します。
- ピグテールカテーテルを取り外し、あらかじめ組み立てられたローディングの赤いルーメン(EasyGuideなど)にワイヤを積み込んで、ラベルの近くに出るまでポンプを挿入します。
- カテーテルを保持したままラベルを軽く引っ張って、ローディングの赤いルーメンを取り除きます。
- 0.018"ワイヤーを介してLVに蛍光ガイダンスの下で小さな増分でデバイスを進めます。
- 大動脈弁の下に4cmの入口を持つLVにポンプを置き、それが僧帽弁から自由であることを確認しなさい。頂点に近すぎると PVC が発生し、「吸引アラーム」がトリガーされる可能性があります。.018"ワイヤを取り外し、一度取り外したら、ポンプを開始します。ポンプが大間のより小さい曲率に対して休むので、余分な緩みを取り除きます。
- コンソールを監視して、モータの電流が脈動性であり、大動脈波形が表示されていることを確認します。心室波形が表示されている場合は、ポンプを戻す必要があります。
- 装置をその場所に残す必要がある場合は、ピールアウェイシースを取り外し、デバイスにあらかじめ装填された再配置シースを挿入します。
- フッ素コピーでデバイスの位置を確認し、コンソール上の波形をもう一度確認します。
- パルパテ(またはドップラーとの感覚)は、デバイスの挿入前後に、背中座のペディスおよび後脛動を含む遠位下肢動脈パルスである。これを患者の医療記録に適切に記録する。
- パルスやドップラーが得られない場合は、デバイスの側面にあるワイヤー再導入ポートを使用して下肢の血管造影を取るか、または下肢への非閉塞性の流れを確実にするために別のアクセスを使用することを検討してください。
- 流れが妨げられる場合は、患者をCCUに移す前に再灌流シースを設置する。閉塞性流れのリスクが高いPAD患者では、14Frシースの配置前に再灌流シースを挿入することを強く検討する(すなわち、上記のステップ1.4の後)。
- その使用の訓練を受けた人員によってクリティカルケアユニット(CCU)でPVADで治療された患者を監視する。
2. 手続き後のケア
- 滅菌ドレッシングを適用します。
- 皮膚に入るとき、装置を45°の角度に置きます(再配置シースの下のガーゼはこの角度を維持するのに役立ちます)。そうしないと、動脈開管がにじみ出て血腫が生じることがある。また、デバイスの移行を避け、出血を防ぐために、前方圧力で縫合糸を配置することも役立ちます。
注:膝イモビライザーで下肢を固定すると、影響を受けた四肢を曲げたり動かしたりしないように患者にリマインダーとしてデバイスの移行を制限することもできます。これは、循環を妥協しないように、あまりにもしっかりと留めるべきではありません。 - 定期的なパルスチェック(触知可能またはドップラー)を実行し続けます。
3. 位置決め
- ベッドサイドトランスソラシック心エコー図を使用して、心臓ICUに到着する前または到着時に適切なデバイス位置を確認します。
- デバイスの位置を評価するには、パラスターナル長軸ビューを使用します。サブキシフォイドビューは、パラスターナル長軸ビューが得られない場合にも使用できます。大動脈弁から装置の入口までの測定は、理想的には装置の適切な位置に3-4 cmでなければならない。
- 心エコー図を使用して、デバイスが僧帽弁に関連する位置をメモします。
- デバイスの位置を変更する必要がある場合は、デバイスを P2 に切り替え、無菌カバーのロック機構を緩めてデバイスを進めるか、または取り消します。ピグテールまたは入口が僧帽弁に近すぎると、前進または後退としてトルクが発生する可能性があります。
- デバイスを新しい位置にロックし、新しい位置を文書化します。
- これに続いて、デバイスを目的のレベルのサポートまで増やします。
- サポートレベルを上げた後、速度が上がったときにデバイスが前方にジャンプできるようにデバイスの位置を再評価します。
注:デバイスが大動脈弁を横切って引き戻された場合、透視検査のガイダンスの下でキャスラボで再配置を行う方が良いです。
4. ウィーニング
- 血管圧器/イトロープが低用量または完全に離離れている場合は離を検討してください。血行力学は、右心房圧(RAP)<12 mmHgおよび肺動脈脈動性指数(PAPI)>1.014を維持することを目標に、右心室(RV)血動態を注意深く監視するCPO>0.6 W.を維持するために継続的に監視されるべきである。また、心臓の仕事とエンド臓器の灌流を監視するために、2〜6時間ごとにpH、混合静脈飽和および乳酸塩を得ることを検討してください。
- CPO、PAPI、RAP、MAP、尿出力を示し、2時間にわたって1〜2レベルの電力を減少させます。CPOが<0.6 W低下すると、RAPは増加し始め、尿の出力は20 mL/hまたはMAP <60 mmHg>低下し、前のレベルまで電力を増加させる。
5. 除去12
- 血管閉鎖装置を用いて、大きなボアシースが取り外されたときに行われる装置の完全な展開で動脈開閉部位を閉鎖する。一時的な血管内バルーンタンコネードまたは「乾燥場閉鎖技術」は、大きなボアアクセス部位15の止止めを確実にする効果的かつ安全な方法である。
- P1にダイヤルダウンし、デバイスを大陸に引き戻し、P0に変更し、カテーテルが本体から引き出されると、コンソールからデバイスを取り外します。
- 大動脈逆流の危険性があるため、P0の大動脈弁を横切って放置してはならないことに注意してください。
- 手動止止めを検討する場合は、ACT <150まで待ち、フランスのサイズごとに3分間の圧力を保持します。
結果
表1はPVAD注入35、36、37、38、39、40の安全性と有効性を示す。
PVAD の結果の最適化
PVADは、結果を最適化するために重要な経験と専門知識を必要とするリソースの重い介入です。次のベスト プラク?...
ディスカッション
PVADのリスクと複雑さを最小限に抑える(表 2)
PVADの血行力学的利点は、大出血および急性四肢虚血28,29のような大孔アクセスからの合併症が起こった場合に著しく中和することができる。したがって、デバイスのリスクと合併症を最小限に抑えることが不可欠です。
アクセス部位の合併症を減らし、アクセス試行?...
開示事項
アディティア・バラドワジ博士は、コンサルタント、プロクター、およびアビオメッドスピーカー局のメンバーです。
博士ミール・バシルは、アボット・レンス、アビオメッド、心血管系、キエシ、プロシリオン、ゾルのコンサルタントです。
謝辞
何一つ
資料
| Name | Company | Catalog Number | Comments |
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
参考文献
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O'Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O'neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved