A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש במכשירי סיוע חדרית עורית באוטם שריר הלב חריף מסובך על ידי הלם קרדיוגני
In This Article
Summary
מכשירי סיוע חדרית עורית מנוצלים יותר ויותר בחולים עם אוטם שריר הלב חריף והלם קרדיוגני. כאן, אנו דנים במנגנון הפעולה וההשפעות המודינמיות של מכשירים כאלה. אנו בודקים גם אלגוריתמים ושיטות עבודה מומלצות להשתלות, ניהול וגגמול של מכשירים מורכבים אלה.
Abstract
הלם קרדיוגני מוגדר תת לחץ דם מתמשך, מלווה בראיות של היפו-זלוף איבר קצה. התקני סיוע חדרית עורית (PVADs) משמשים לטיפול בהלם קרדיוגני במאמץ לשפר את המודינמיקה. אימפלה היא כיום PVAD הנפוצה ביותר ומשאבת דם באופן פעיל מהפתח השמאלי לתוך העורקים. PVADs לפרוק את החדר השמאלי, להגדיל את תפוקת הלב ולשפר זלוף כלילית. PVADs ממוקמים בדרך כלל במעבדת צנתור לב תחת הדרכה פלואורוסקופית דרך עורק הירך כאשר אפשרי. במקרים של מחלת עורקים היקפית חמורה, PVADs ניתן להשתיל באמצעות גישה חלופית. במאמר זה, אנו מסכמים את מנגנון הפעולה של PVAD ואת הנתונים התומכים בשימוש שלהם בטיפול בהלם קרדיוגני.
Introduction
הלם קרדיוגני (CS) מוגדר לחץ דם מתמשך (לחץ דם סיסטולי <90 מ"מ כ"ג למשך >30 דקות, או הצורך במדכאי vasopressors או inotropes), hypo-perfusion של איבר קצה (תפוקת שתן <30 מ"ל לשעה, גפיים קרירות או לקטט > 2 mmol /L), גודש ריאתי (לחץ טריז נימי ריאתי (PCWP) ≥ 15 מ"מ/שעה) ולהפחית את ביצועי הלב (מדד לב <2.2 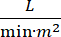 )1, 2 עקב הפרעת לב ראשונית. אוטם שריר הלב חריף (AMI) הוא הגורם הנפוץ ביותר של CS3. CS מתרחשת ב 5-10% של AMI מבחינה היסטורית נקשר עם תמותה משמעותית3,4. התקני תמיכה מכניים במחזור הדם (MCS) כגון משאבת בלון תוך אבי העורקים (IABP), התקני סיוע חדרית עורית (PVAD), חמצון קרום חוץ גופי (ECMO) ופרזדור שמאלי עורי למכשירים אבי העורקים משמשים לעתים קרובות בחולים עם CS5. שימוש שגרתי של IABP לא הראה שיפור בתוצאות קליניות או הישרדות ב- AMI-CS1. בהתחשב בתוצאות הגרועות הקשורות ל- AMI-CS, הקשיים בביצוע ניסויים ב- AMI-CS, והתוצאות השליליות של שימוש ב- IABP ב- AMI-CS, רופאים מחפשים יותר ויותר צורות אחרות של MCS.
)1, 2 עקב הפרעת לב ראשונית. אוטם שריר הלב חריף (AMI) הוא הגורם הנפוץ ביותר של CS3. CS מתרחשת ב 5-10% של AMI מבחינה היסטורית נקשר עם תמותה משמעותית3,4. התקני תמיכה מכניים במחזור הדם (MCS) כגון משאבת בלון תוך אבי העורקים (IABP), התקני סיוע חדרית עורית (PVAD), חמצון קרום חוץ גופי (ECMO) ופרזדור שמאלי עורי למכשירים אבי העורקים משמשים לעתים קרובות בחולים עם CS5. שימוש שגרתי של IABP לא הראה שיפור בתוצאות קליניות או הישרדות ב- AMI-CS1. בהתחשב בתוצאות הגרועות הקשורות ל- AMI-CS, הקשיים בביצוע ניסויים ב- AMI-CS, והתוצאות השליליות של שימוש ב- IABP ב- AMI-CS, רופאים מחפשים יותר ויותר צורות אחרות של MCS.
PVADs מנוצלים יותר ויותר בחולים עם AMI-CS6. במאמר זה, נמקד את הדיון שלנו בעיקר על Impella CP, שהוא PVAD הנפוץ ביותר בשימוש כרגע6. מכשיר זה משתמש במשאבת בורג ארכימדס בזרימה צירית אשר דוחפת באופן פעיל ורציף דם מהפתח השמאלי (LV) לתוך אבי העורקים העולה(איור 1). המכשיר ממוקם בתדירות הגבוהה ביותר במעבדת צנתור הלב תחת הדרכה פלואורוסקופית דרך עורק הירך. לחלופין, זה יכול להיות מושתל באמצעות גישה אקסילרית או transcaval בעת הצורך7,8.
Protocol
פרוטוקול זה הוא סטנדרט הטיפול במוסד שלנו.
1. החדרת PVAD (למשל, אימפלה CP)
- השג גישה נפוצה לירך מעל החצי התחתון של ראש הירך תחת הדרכה פלואורוסקופית ואולטרסאונד באמצעות מחט מיקרו-ניקוב9,10. מקם את נדן המיקרו-ניקוב וקבל אנגיוגרמה של עורק הירך כדי לאשר מיקום העורקיםהמתאים 11.
- מכניסים נדן 6 פרו לעורק הירך.
- אם יש חשש למחלות ilio-הירך, הכנס קטטר צמה בחלק הנחות של אבי העורקים בבטן ולבצע אנגיוגרמה של המערכת iliofemoral כדי להבטיח שאין מחלת עורקים היקפית משמעותית (PAD) שעלולה למנוע החדרת PVAD. אם יש מחלה מתונה או הסתיידות של עורקי הכסל לשקול באמצעות נדן צרפתי ארוך יותר 25 ס"מ 14, כך קצה הנדן הוא בפלח בריא יחסית של אב העורקים בבטן.
- להרחיב באופן סדרתי את אתר arteriotomy על חוט .035 " נוקשה באמצעות 8, 10 ו 12 Fr מרחיבים ברצף. לאחר מכן, הכנס את נדן 14 Fr לקלף משם תחת הדרכה פלואורוסקופית, הבטחת הקצה מתקדם ללא התנגדות.
- ניהול בולוס הפרין (~ 100 U/kg משקל גוף) עבור יעד ACT של 250 עד 300 s. נוגדי קרישה חלופיים כוללים ביבלירודין וארגטרובן.
- השתמש צנתר צמה לחצות לתוך LV באמצעות חוט מוטה .035 "J. הסר את חוט J ולבדוק LVEDP.
- עצב את קצה חוט אורך החליפין 0.018" הכלול בערכה והכנס אותו ל- LV כך שהוא יוצר עקומה יציבה בשיא LV.
- ודא ACT הוא המטרה (250 עד 300 s) לפני החדרה12,13.
- הסר את צנתר צמה ולהכניס את המשאבה על ידי טעינת החוט על לומן אדום טעינה מראש מורכב (למשל, EasyGuide) עד שהוא יוצא ליד התווית.
- הסר את לומן אדום טעינה על ידי משיכה עדינה על התווית תוך החזקת הקטטר.
- לקדם את המכשיר במרווחים קטנים תחת הדרכה פלואורוסקופית לתוך LV מעל חוט 0.018 ".
- מקם את המשאבה ב- LV עם הכניסה שלה 4 ס"מ מתחת שסתום אבי העורקים ולוודא שהוא חופשי מן המקהלה המיטרלית. להיות קרוב מדי לשיא יכול לגרום PVCs ולהפעיל "אזעקות יניקה". הסר את חוט .018" ולאחר הסרת, הפעל את המשאבה. הסר מרווח עודף כך המשאבה נחה נגד עקמומיות פחות של בצטוונים.
- נטר את הקונסולה כדי לוודא שזרם המנוע פועם ומוצגת צורת גל של באצולה. אם מוצגת צורת גל חדרית, ייתכן שיהיה צורך למשוך את המשאבה לאחור.
- אם יש להשאיר את ההתקן במקום, הסר את נדן ה-peal-away והכנס את נדן המיקום מחדש נטען מראש בהתקן.
- בדוק שוב את מיקום ההתקן בפלואורוסקופיה ואת צורות הגל בקונסולה.
- מישוש (או תחושה עם דופלר) פולסים עורקיים גפיים נמוכות דיסטליות כולל פדיקור דורסליס ו tibial אחורי לפני ואחרי החדרת המכשיר. תעד את זה כראוי בתיק הרפואי של המטופל.
- אם לא ניתן להשיג פולסים או דופלרים, שקול לקחת אנגיוגרמה בגפיים התחתונות באמצעות יציאת הצגת החוטים הממוקמת בצד המכשיר או באמצעות גישה אחרת כדי להבטיח זרימה לא חסימתית לגפה התחתונה.
- אם הזרימה חסומה, הנח נדן רפרפוזיה לפני העברת המטופל ל- CCU. בחולים עם PAD הנמצאים בסיכון גבוה לזרימה חסימתית, שקול בחום להכניס את נדן הרזדון לפני מיקום נדן 14 Fr (כלומר, לאחר שלב 1.4 המפורט לעיל).
- לעקוב אחר חולים שטופלו עם PVAD ביחידה לטיפול קריטי (CCU) על ידי אנשי צוות שהוכשרו בשימוש בו.
2. טיפול פוסט-פרוצדורלי
- יש למרוח רוטב סטרילי.
- מקם את ההתקן בזווית של 45° בעת הזנת העור (גזה מתחת למעטפת המיקום מחדש יכולה להיות מועילה לשמירה על זווית זו). כישלון לעשות זאת עלול לגרום נוטף את arteriotomy, המוביל להיווצרות של שטף דם. זה גם מועיל למקם תפרים עם לחץ קדימה כדי למנוע העברת מכשיר ולמנוע דימום.
הערה: אבטחת הגפיים התחתונות עם משתק הברך יכולה גם להגביל את העברת המכשיר כתזכורת למטופל לא לכופף / להזיז את האיבר שהושפע. זה לא צריך להיות מהודק מדי כדי לא להתפשר על זרימת הדם. - המשך לבצע בדיקות דופק שגרתיות (מוחשי או דופלר).
3. מיקום
- השתמש אקו-לב transthoracic ליד המיטה כדי לאשר את מיקום המכשיר המתאים או לפני ההעברה או מיד עם ההגעה לטיפול נמרץ לב, בהתאם לזמינות של נקודת טיפול אולטרסאונד.
- השתמש בתצוגת ציר ארוך משותף כדי להעריך את מיקום ההתקן. ניתן להשתמש בתצוגת תת-ים גם אם תצוגת ציר ארוך משותף אינה ניתנת להשגה. מדידה מ שסתום אבי העורקים לפרצון המכשיר צריך להיות אידיאלי 3-4 ס"מ למיקום נכון של המכשיר.
- השתמש echocardiograms כדי לציין את המיקום של המכשיר כפי שהוא מתייחס שסתום מיטרלי.
- כאשר יש למקם מחדש התקן, הפוך את ההתקן ל- P2, פתח את מנגנון הנעילה בכיסוי הסטרילי כדי להתקדם או לסגת מההתקן. אפשר מומנט כמומנט כמו קידום או לסגת אם הצמה או הכניסה הוא קרוב מדי שסתום מיטרלי.
- נעל את ההתקן במיקום החדש ותיעד את המיקום החדש.
- לאחר מכן, הגדל את ההתקן לרמת התמיכה הרצויה.
- לאחר העלאת רמת התמיכה, להעריך מחדש את מיקום ההתקן מכיוון שההתקן יכול לקפוץ קדימה כאשר המהירות עולה.
הערה: אם המכשיר כבר משך בחזרה על פני שסתום אבי העורקים, מיקום מחדש נעשה טוב יותר במעבדת צנתור תחת הדרכה פלואורוסקופיה.
4. גחם
- שקול לנמם כאשר vasopressors/inotropes הם במינונים נמוכים או נמות לחלוטין. יש לעקוב באופן רציף אחר המודינמיקה של Hemodynamics כדי לשמור על CPO > 0.6 W. בזהירות לפקח על חדרי ימין (RV) hemodynamics במטרה לשמור על לחץ פרזדורים ימני (RAP) <12 מ"מ כ"ג ומדד ריאות עורק ריאות (PAPI) >1.014. שקול גם להשיג pH, רוויות ורידים מעורבים ולהילק כל 2-6 שעות כדי לפקח על עבודת לב זלוף של איברי קצה.
- הפחיתו את ההספק ב-1-2 רמות במשך שעתיים, תוך שים לב לתפוקת CPO, PAPI, RAP, MAP ושתן. אם CPO יורד <0.6 W, RAP מתחיל להגדיל, תפוקת השתן יורדת > 20 mL / שעה או MAP <60 מ"מ כ"ג, להגדיל את הכוח לרמה הקודמת.
5. הסרה12
- השתמש בהתקני סגירת כלי דם כדי לסגור את אתר הגישה לעורקים עם פריסה מלאה של ההתקן המבוצעת כאשר נדן השעמום הגדול מוסר14. טמפונדה זמנית של בלון אנדווסקולרי או "טכניקת סגירת שדה יבש" היא דרך יעילה ובטוחה להבטיח את ההמוסטזיס של אתר הגישה הגדול15.
- חייגו כלפי מטה ל-P1 והחזירו את ההתקן לאף העורקים ולאחר מכן החליפו ל-P0 וניתקו את ההתקן מהקונסולה בזמן שהקטטר נשלף מהגוף.
- שים לב כי המכשיר לא צריך להישאר על פני שסתום אבי העורקים ב P0 בשל הסיכון של regurgitation אבי העורקים.
- אם שוקלים hemostasis ידני, לחכות עד ACT <150 ולהחזיק 3 דקות של לחץ לכל גודל צרפתי.
תוצאות
טבלה 1 מציגה את הבטיחות והיעילות של השתלת PVAD35,36,37,38,39,40.
מיטוב תוצאות PVAD
PVADs הם התערבות עתירת משאבים הדורשת ניסיון ומומחיות משמעותיים כדי למטב את ה...
Discussion
מזעור הסיכונים והסיבוכים של PVAD (טבלה 2)
היתרונות המודינמיים של PVAD ניתן לנטרל באופן משמעותי אם סיבוכים של גישה גדולה נשא להתרחש, כגון דימום גדול איסכמיה איבר חריף28,29. לכן חיוני למזער את הסיכון והסיבוכים של המכשיר.
על מנת להקטין את סיב...
Disclosures
ד"ר אדיטיה בהרדוואג' היא יועצת, משגיחה וחברת לשכת הדוברים של אביומד.
ד"ר מיר בסיר היא יועצת של אבוט ווסקולרי, אביומד, מערכת הלב וכלי הדם, צ'ייסי, פרוצריון וזול.
Acknowledgements
ללא
Materials
| Name | Company | Catalog Number | Comments |
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
References
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O'Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O'neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved