Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verwendung von perkutanen ventrikulären Unterstützungsgeräten bei akutem Myokardinfarkt, der durch kardiogenen Schock kompliziert ist
In diesem Artikel
Zusammenfassung
Perkutane ventrikuläre Unterstützungsgeräte werden zunehmend bei Patienten mit akutem Myokardinfarkt und kardiogenem Schock eingesetzt. Hierin diskutieren wir den Wirkmechanismus und die hämodynamischen Wirkungen solcher Geräte. Wir überprüfen auch Algorithmen und Best Practices für die Implantation, das Management und die Entwöhnung dieser komplexen Geräte.
Zusammenfassung
Der kardiogene Schock ist definiert als anhaltende Hypotonie, begleitet von Hinweisen auf eine Hypoperfusion des Endorgans. Perkutane ventrikuläre Unterstützungsgeräte (PVADs) werden zur Behandlung des kardiogenen Schocks eingesetzt, um die Hämodynamik zu verbessern. Impella ist derzeit die häufigste PVAD und pumpt aktiv Blut aus dem linken Ventrikel in die Aorta. PVADs entladen den linken Ventrikel, erhöhen das Herzzeitvolumen und verbessern die Koronarperfusion. PVADs werden typischerweise im Herzkatheterlabor unter fluoroskopischer Führung über die Oberschenkelarterie platziert, wenn dies möglich ist. Bei schwerer peripherer arterieller Verschlusskrankheit können PVADs durch einen alternativen Zugang implantiert werden. In diesem Artikel fassen wir den Wirkmechanismus von PVAD und die Daten zusammen, die ihre Verwendung bei der Behandlung von kardiogenem Schock unterstützen.
Einleitung
Der kardiogene Schock (CS) ist definiert als persistierende Hypotonie (systolischer Blutdruck <90 mmHg für >30 Minuten oder die Notwendigkeit von Vasopressoren oder Inotropen), Endorgan-Hypoperfusion (Urinausscheidung <30 ml/h, kühle Extremitäten oder Laktat > 2 mmol/L), pulmonale Stauung (pulmonaler Kapillarkeildruck (PCWP) ≥ 15 mmHg) und Verringerung der Herzleistung (Herzindex <2.2 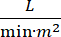 )1, 2 aufgrund einer primären Herzerkrankung. Akuter Myokardinfarkt (AMI) ist die häufigste Ursache für CS3. CS tritt in 5-10% der AMI auf und wurde in der Vergangenheit mit einer signifikanten Mortalität in Verbindung gebracht3,4. Mechanische Kreislaufunterstützungsgeräte (MCS) wie intraaortale Ballonpumpe (IABP), perkutane ventrikuläre Unterstützungsgeräte (PVAD), extrakorporale Membranoxygenierung (ECMO) und perkutane Linksatrium-Aorten-Geräte werden häufig bei Patienten mit CS5eingesetzt. Die routinemäßige Anwendung von IABP hat keine Verbesserung der klinischen Ergebnisse oder des Überlebens bei AMI-CS1gezeigt. Angesichts der schlechten Ergebnisse im Zusammenhang mit AMI-CS, der Schwierigkeiten bei der Durchführung von Studien in AMI-CS und der negativen Ergebnisse der IABP-Anwendung in AMI-CS suchen Kliniker zunehmend nach anderen Formen von MCS.
)1, 2 aufgrund einer primären Herzerkrankung. Akuter Myokardinfarkt (AMI) ist die häufigste Ursache für CS3. CS tritt in 5-10% der AMI auf und wurde in der Vergangenheit mit einer signifikanten Mortalität in Verbindung gebracht3,4. Mechanische Kreislaufunterstützungsgeräte (MCS) wie intraaortale Ballonpumpe (IABP), perkutane ventrikuläre Unterstützungsgeräte (PVAD), extrakorporale Membranoxygenierung (ECMO) und perkutane Linksatrium-Aorten-Geräte werden häufig bei Patienten mit CS5eingesetzt. Die routinemäßige Anwendung von IABP hat keine Verbesserung der klinischen Ergebnisse oder des Überlebens bei AMI-CS1gezeigt. Angesichts der schlechten Ergebnisse im Zusammenhang mit AMI-CS, der Schwierigkeiten bei der Durchführung von Studien in AMI-CS und der negativen Ergebnisse der IABP-Anwendung in AMI-CS suchen Kliniker zunehmend nach anderen Formen von MCS.
PVADs werden zunehmend bei Patienten mit AMI-CS6eingesetzt. In diesem Artikel werden wir unsere Diskussion hauptsächlich auf den Impella CP konzentrieren, der derzeit am häufigsten verwendete PVAD6. Dieses Gerät verwendet eine axiale Archimedes-Schraubenpumpe, die aktiv und kontinuierlich Blut aus dem linken Ventrikel (LV) in die aufsteigende Aorta treibt (Abbildung 1). Das Gerät wird am häufigsten im Herzkatheterlabor unter fluoroskopischer Führung über die Oberschenkelarterie platziert. Alternativ kann es bei Bedarf durch einen axillären oder transkavalen Zugang implantiert werden7,8.
Protokoll
Dieses Protokoll ist der Standard der Pflege in unserer Einrichtung.
1. Einsetzen des PVAD (z.B. Impella CP)
- Erhalten Sie einen gemeinsamen Femurzugang über die untere Hälfte des Femurkopfes unter fluoroskopischer und Ultraschallführung mit einer Mikropunktionsnadel9,10. Positionieren Sie die Mikropunktionsscheide und erhalten Sie ein Angiogramm der Oberschenkelarterie, um die geeignete Arteriotomiestelle11zu bestätigen.
- Führen Sie eine 6 Fr Scheide in die Oberschenkelarterie ein.
- Wenn Bedenken hinsichtlich einer ilio-femoralen Erkrankung bestehen, führen Sie einen Pigtail-Katheter in den unteren Teil der Bauchaorta ein und führen Sie ein Angiogramm des iliofemoralen Systems durch, um sicherzustellen, dass keine signifikante periphere arterielle Verschlusskrankheit (PAD) vorliegt, die eine PVAD-Insertion ausschließen kann. Wenn es eine moderate Erkrankung oder Verkalkung der Beckenarterien gibt, sollten Sie eine längere 25 cm 14 französische Scheide verwenden, so dass sich die Spitze der Scheide in einem relativ gesunden Segment der Bauchaorta befindet.
- Erweitern Sie die Arteriotomiestelle seriell über einen steifen .035"-Draht mit 8, 10 und 12 Fr-Dilatatoren nacheinander. Führen Sie dann die 14 Fr Peel Away Hülle unter fluoroskopischer Führung ein, um sicherzustellen, dass die Spitze ohne Widerstand voranschreitet.
- Verabreichen Sie Heparinbolus (~ 100 U / kg Körpergewicht) für ein ACT-Ziel von 250 bis 300 s. Alternative Antikoagulation umfassen Bivalirudin und Argatroban.
- Verwenden Sie einen Pigtail-Katheter, um mit einem .035 "J-gekippten Draht in den LV zu gelangen. Entfernen Sie den J-Draht und überprüfen Sie einen LVEDP.
- Formen Sie die Spitze des im Kit enthaltenen 0,018-Zoll-Drahtes mit Austauschlänge und führen Sie ihn so in den LV ein, dass er an der LV-Spitze eine stabile Kurve bildet.
- Stellen Sie sicher, dass ACT am Ziel (250 bis 300 s) ist, bevor Sie12,13einfügen.
- Entfernen Sie den Pigtail-Katheter und setzen Sie die Pumpe ein, indem Sie den Draht auf das vormontierte rote Lumen (z. B. EasyGuide) laden, bis er in der Nähe des Etiketts austritt.
- Entfernen Sie das rote Lumen, indem Sie vorsichtig am Etikett ziehen, während Sie den Katheter halten.
- Bringen Sie das Gerät in kleinen Schritten unter fluoroskopischer Führung über den 0,018"-Draht in das LV vor.
- Positionieren Sie die Pumpe im LV mit ihrem Einlass 4 cm unterhalb der Aortenklappe und stellen Sie sicher, dass sie frei von den Mitral-Chordae ist. Zu nahe an der Spitze zu sein, kann PVCs verursachen und "Saugalarme" auslösen. Entfernen Sie den .018"-Draht und starten Sie nach dem Entfernen die Pumpe. Entfernen Sie überschüssigen Durchhang, so dass die Pumpe gegen die geringere Krümmung der Aorta ruht.
- Überwachen Sie die Konsole, um sicherzustellen, dass der Motorstrom pulsierend ist und die Aortenwellenform angezeigt wird. Wenn eine ventrikuläre Wellenform angezeigt wird, muss die Pumpe möglicherweise zurückgezogen werden.
- Wenn das Gerät an Ort und Stelle belassen werden muss, entfernen Sie die Peal-Away-Hülle und führen Sie die auf dem Gerät vorinstallierte Repositionierungshülle ein.
- Überprüfen Sie die Geräteposition auf der Durchleuchtung und die Wellenformen auf der Konsole erneut.
- Palpieren (oder Sense mit Doppler) die distalen arteriellen Pulse der unteren Extremität, einschließlich Dorsalis pedis und hinterem Schienbein vor und nach dem Einsetzen des Geräts. Dokumentieren Sie dies entsprechend in der Krankenakte des Patienten.
- Wenn Impulse oder Doppler nicht erhalten werden können, sollten Sie ein Angiogramm der unteren Extremitäten mit dem Drahtanfangsanschluss an der Seite des Geräts oder mit einem anderen Zugang durchführen, um einen nicht obstruktiven Fluss zur unteren Extremität sicherzustellen.
- Wenn der Fluss behindert ist, legen Sie eine Reperfusionshülle an, bevor Sie den Patienten auf die CCU bringen. Bei Patienten mit PAD, die ein hohes Risiko für einen obstruktiven Fluss haben, sollten Sie das Einsetzen der Reperfusionsscheide vor dem Einsetzen der 14 Fr-Hülle (d. h. nach Schritt 1.4 oben) unbedingt in Betracht ziehen.
- Überwachen Sie Patienten, die mit einem PVAD auf der Intensivstation (CCU) behandelt werden, durch Personal, das in seiner Anwendung geschult ist.
2. Nachsorge
- Sterilen Verband auftragen.
- Positionieren Sie das Gerät beim Betreten der Haut in einem Winkel von 45 ° (Gaze unter der Neupositionierungsscheide kann hilfreich sein, um diesen Winkel beizubehalten). Wenn Sie dies nicht tun, kann dies dazu führen, dass die Arteriotomie nässt, was zur Bildung eines Hämatoms führt. Es ist auch hilfreich, Nähte mit Vorwärtsdruck zu platzieren, um eine Gerätemigration zu vermeiden und Blutungen zu verhindern.
HINWEIS: Die Sicherung der unteren Extremität mit einer Kniewegsperre kann auch die Migration des Geräts einschränken, um den Patienten daran zu erinnern, die betroffene Extremität nicht zu beugen / zu bewegen. Dies sollte nicht zu fest befestigt werden, um die Zirkulation nicht zu beeinträchtigen. - Führen Sie weiterhin routinemäßige Pulskontrollen durch (tastbar oder Doppler).
3. Positionierung
- Verwenden Sie ein transthorakales Echokardiogramm am Krankenbett, um die geeignete Geräteposition entweder vor dem Transfer oder unmittelbar bei der Ankunft auf der Herz-Intensivstation zu bestätigen, abhängig von der Verfügbarkeit eines Point-of-Care-Ultraschalls.
- Verwenden Sie eine parasternale Langachsenansicht, um die Geräteposition zu beurteilen. Eine Subxyphoidansicht kann auch verwendet werden, wenn die parasternale Langachsenansicht nicht erreichbar ist. Eine Messung von der Aortenklappe bis zum Geräteeinlass sollte idealerweise 3-4 cm betragen, um das Gerät richtig zu positionieren.
- Verwenden Sie Echokardiogramme, um die Position des Geräts in Bezug auf die Mitralklappe zu notieren.
- Wenn ein Gerät neu positioniert werden muss, drehen Sie das Gerät auf P2 herunter, schrauben Sie den Verriegelungsmechanismus an der sterilen Abdeckung ab, um das Gerät vor- oder zurückzuziehen. Man kann das Drehmoment als Vor- oder Rückzug drehen, wenn der Pigtail oder Der Einlass zu nahe an der Mitralklappe ist.
- Sperren Sie das Gerät in der neuen Position und dokumentieren Sie die neue Position.
- Erhöhen Sie anschließend das Gerät auf das gewünschte Unterstützungsniveau.
- Nachdem Sie die Unterstützungsstufe erhöht haben, bewerten Sie die Geräteposition neu, da das Gerät vorwärts springen kann, wenn die Geschwindigkeit zunimmt.
HINWEIS: Wenn das Gerät über die Aortenklappe zurückgezogen wurde, erfolgt die Neupositionierung besser im Katheterlabor unter Durchleuchtungsanleitung.
4. Entwöhnung
- Erwägen Sie die Entwöhnung, wenn Vasopressoren / Inotrope in niedrigen Dosen oder vollständig entwöhnt sind. Die Hämodynamik sollte kontinuierlich überwacht werden, um einen CPO-> 0,6 W aufrechtzuerhalten.Überwachen Sie sorgfältig die rechtsventrikuläre (RV) Hämodynamik mit dem Ziel, den rechten Vorhofdruck (RAP) <12 mmHg und den Pulsatilitätsindex der Lungenarterie (PAPI) >1,014aufrechtzuerhalten. Erwägen Sie auch, pH-Wert, gemischte venöse Sättigungen und Laktat alle 2-6 Stunden zu erhalten, um die Herzarbeit und die Endorganperfusion zu überwachen.
- Verringern Sie die Leistung um 1-2 Stufen über 2 Stunden und beachten Sie CPO, PAPI, RAP, MAP und Urinproduktion. Wenn CPO <0,6 W sinkt, RAP beginnt zu steigen, die Urinproduktion sinkt > 20 ml / h oder MAP <60 mmHg, erhöhen Sie die Leistung auf das vorherige Niveau.
5. Entfernung12
- Verwenden Sie Gefäßverschlussvorrichtungen, um die Arteriotomie-Zugangsstelle mit vollständigem Einsatz des Geräts zu schließen, wenn die großeBohrungsscheideentfernt wird 14 . Die temporäre endovaskuläre Ballontamponade oder "Trockenfeldverschlusstechnik" ist ein wirksamer und sicherer Weg, um die Hämostase der Großbohrungszugangsstelle15sicherzustellen.
- Wählen Sie auf P1 und ziehen Sie das Gerät zurück in die Aorta, gefolgt von einem Wechsel zu P0, und trennen Sie das Gerät von der Konsole, während der Katheter aus dem Körper gezogen wird.
- Beachten Sie, dass das Gerät aufgrund des Risikos einer Aorteninsuffizienz nicht über die Aortenklappe bei P0 gelassen werden sollte.
- Wenn Sie eine manuelle Hämostase in Betracht ziehen, warten Sie, bis ACT <150 und halten Sie 3 Minuten Druck pro französischer Größe.
Ergebnisse
Tabelle 1 zeigt die Sicherheit und Wirksamkeit der PVAD-Implantation35,36,37,38,39,40.
Optimierung der PVAD-Ergebnisse
PVADs sind eine ressourcenintensive Intervention, die erhebliche Erfahrung und Fachwissen erfordert, um die Ergebnisse zu optimieren. Die folge...
Diskussion
Minimierung der Risiken und Komplikationen von PVAD (Tabelle 2)
Die hämodynamischen Vorteile von PVAD können signifikant neutralisiert werden, wenn Komplikationen durch großflächigen Zugang auftreten, wie schwere Blutungen und akute Extremitätenischämie28,29. Es ist daher wichtig, das Risiko und die Komplikationen des Geräts zu minimieren.
Um Komplikationen an der Zugangsstelle zu verringern und die Anzahl de...
Offenlegungen
Dr. Aditya Bharadwaj ist Berater, Proctor und Mitglied des Speakers Bureau für Abiomed.
Dr. Mir Basir ist Berater für Abbott Vascular, Abiomed, Cardiovascular System, Chiesi, Procyrion und Zoll.
Danksagungen
Nichts
Materialien
| Name | Company | Catalog Number | Comments |
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
Referenzen
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O'Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O'neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten