A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القياسات القائمة على الفلورسينس من فوسفاتيديلسيرين / فوسفاتيديلينوزيتول 4-تبادل الفوسفات بين الأغشية
In This Article
Summary
هنا، ونحن نصف بروتوكولات باستخدام أجهزة استشعار الدهون الفلورية والدهون لتحديد ما إذا كان البروتين مقتطفات وينقل فوسفاتيديلسيرين أو فوسفاتيديلينوزيتول 4-فوسفات في المختبر.
Abstract
تم العثور مؤخرا على العديد من أعضاء البروتين المرتبط بالأوكسيسترول (OSBP) المرتبط بالبروتينات (ORP) / OSBP homologs (Osh) لتمثيل مجموعة جديدة من بروتين نقل الدهون (LTP) في الخميرة والخلايا البشرية. أنها نقل فوسفاتيديلسيرين (PS) من الشبكية الانتوبلازمية (ER) إلى غشاء البلازما (PM) عن طريق PS /فوسفاتيديلينوزيتول 4-فوسفات (PI(4)P) دورات التبادل. تسمح هذه النتيجة بفهم أفضل لكيفية توزيع PS ، وهو أمر بالغ الأهمية لعمليات الإشارات ، في جميع أنحاء الخلية والتحقيق في الصلة بين هذه العملية واستقلاب فوسفوينوسيتيد (PIP). وكان لتطوير بروتوكولات جديدة قائمة على الفلورسينس دور فعال في اكتشاف وتوصيف هذه الآلية الخلوية الجديدة في المختبر على المستوى الجزيئي. تصف هذه الورقة إنتاج واستخدام جهازي استشعار الدهون المسمى الفلورسنت، NBD-C2Lact و NBD-PHFAPP، لقياس قدرة البروتين على استخراج PS أو PI(4)P ونقل هذه الدهون بين الأغشية الاصطناعية. أولا، يصف البروتوكول كيفية إنتاج وتسمية والحصول على عينات عالية النقاء من هذه الإنشاءات اثنين. ثانيا، تشرح هذه الورقة كيفية استخدام أجهزة الاستشعار هذه مع قارئ لوحة مضانة لتحديد ما إذا كان البروتين يمكن استخراج PS أو PI (4) P من الليبوسومات، وذلك باستخدام Osh6p كدراسة حالة. وأخيرا، يوضح هذا البروتوكول كيفية قياس حركة تبادل PS/PI(4) P بدقة بين الليبوسومات من تكوين الدهون المحدد وتحديد معدلات نقل الدهون عن طريق نقل الطاقة بالرنين الفلوري (FRET) باستخدام مقياس الفلورومتر القياسي.
Introduction
التوزيع الدقيق للدهون بين الأغشية المختلفة وداخل أغشية الخلايا eukaryotic1،2 له آثار بيولوجية عميقة. فك تشفير كيف تعمل LTPs هي قضية هامة في بيولوجيا الخلية3،4،5،6، والنهج في المختبر هي ذات قيمة كبيرة في معالجة هذه المسألة7،8،9،10،11. هنا، يتم تقديم استراتيجية في المختبر، على أساس الفلورسينس التي كانت مفيدة في إثبات أن العديد من البروتينات ORP / Osh تأثير PS / PI (4) P تبادل بين أغشية الخلايا12 وبالتالي تشكل فئة جديدة من LTPs. PS هو glycerophospholipid الأنيوني الذي يمثل 2-10 ٪ من مجموع الدهون الغشاء في الخلايا eukaryotic13،14،16. يتم توزيعه على طول تدرج بين ER و PM ، حيث يمثل 5-7 ٪ وما يصل إلى 30 ٪ من الجليستروفوسفوليبيدات ، على التوالي17،18،19. وعلاوة على ذلك، يتركز PS أساسا في منشور السيتوسوليك من رئيس الوزراء. هذا تراكم وتقسيم متفاوتة من PS في PM حاسمة لعمليات الإشارات الخلوية19. نظرا لشحنة سلبية من جزيئات PS، منشور السيتوسوليك من رئيس الوزراء هو أكثر من ذلك بكثير أنيوني من منشور السيتوسوليك من العضيات الأخرى1،2،19،20. وهذا يمكن التوظيف، عبر القوى الكهروستاتيكية، من البروتينات الإشارات مثل myristoylated ألانين الغنية C-كيناز الركيزة (MARCKS)21، ساركوما (Src)22،كيرستن الفئران ساركوما الفيروسية oncogene (K-Ras)23،وراس ذات الصلة C3 البوتولينوم السم الركيزة 1 (Rac1)24 التي تحتوي على امتداد من الأحماض الأمينية المشحونة إيجابيا والذيل الدهني.
PS معترف بها أيضا من قبل البروتين التقليدي كيناز C بطريقة استريو انتقائية عبر نطاق C225. ومع ذلك، يتم تصنيع PS فيER 26،مما يشير إلى أنه يجب تصديرها إلى رئيس الوزراء قبل أن تتمكن من لعب دورها. لم يكن معروفا كيف تم تحقيق ذلك19 حتى وجدت أنه، في الخميرة، Osh6p وOsh7p نقل PS من ER إلى PM27. تنتمي هذه LTPs إلى عائلة محفوظة تطوريا في eukaryotes التي يكون عضوها المؤسس OSBP والتي تحتوي على بروتينات (ORPs في الإنسان ، بروتينات Osh في الخميرة) تدمج مجالا مرتبطا ب OSBP (ORD) مع جيب لاستضافة جزيء الدهون. Osh6p وOsh7p تتكون فقط من ORD التي يتم تكييفها ملامح الهيكلية لربط PS على وجه التحديد ونقله بين الأغشية. ومع ذلك ، كيف نقلت هذه البروتينات اتجاه PS من ER إلى رئيس الوزراء لم يكن واضحا. Osh6p وOsh7p يمكن فخ PI(4)P كبديل ليغاند الدهون12. في الخميرة، يتم تصنيع PI(4) P من فوسفاتيدلينوزيتول (PI) في غولجي ورئيس الوزراء من قبل PI 4-kinases، Pik1p و Stt4p، على التوالي. في المقابل، لا يوجد PI (4) P في غشاء الرواية، حيث يتم تحلل هذه الدهون إلى PI بواسطة فوسفاتاز Sac1p. وبالتالي، يوجد تدرج PI(4)P في كل من واجهات ER/Golgi وER/PM. Osh6p وOsh7p نقل PS من ER إلى رئيس الوزراء عبر PS / PI (4) P تبادل دورات باستخدام PI(4) P التدرج الموجود بين هذين الأغشية12.
ضمن دورة واحدة, مقتطفات Osh6p PS من ER, تبادل PS لPI(4)P في PM وينقل PI(4)P العودة إلى ER لاستخراج جزيء PS آخر. Osh6p/Osh7p التفاعل مع Ist2p28, واحدة من البروتينات القليلة التي تربط وجلب غشاء ER ورئيس الوزراء على مقربة من بعضها البعض لإنشاء مواقع الاتصال ER-PM في الخميرة29,30,31. وبالإضافة إلى ذلك، فإن ارتباط Osh6p مع الأغشية المشحونة سلبا يصبح ضعيفا بمجرد أن يستخرج البروتين واحدة من ليغند الدهون بسبب تغيير تشكيلي أن يعدل ملامحه الكهروستاتيكي32. هذا يساعد Osh6p عن طريق تقصير وقت سكن الغشاء ، وبالتالي الحفاظ على كفاءة نشاط نقل الدهون. جنبا إلى جنب مع ربط إلى Ist2p، يمكن أن تسمح هذه الآلية Osh6p/7p على حد سواء بسرعة وبدقة تنفيذ تبادل الدهون في واجهة ER / PM. في الخلايا البشرية، ORP5 و ORP8 البروتينات تنفيذ PS / PI(4) P تبادل في مواقع الاتصال ER-PM عبر آليات متميزة33. لديهم ORD المركزية، أقرب إلى Osh6p، ولكن ترتكز مباشرة إلى ER عبر الجزء عبر المبنىC-33 ورسو السفن في PM عبر N-محطة Pleckstrin homology (PH) المجال الذي يتعرف PI(4)P و PI(4,5)P233,34,35. ORP5/8 استخدام PI(4)P لنقل PS, وقد تبين أن ORP5/8 بالإضافة إلى تنظيم PM PI(4,5)P2 مستويات ويفترض تعديل مسارات الإشارات. بدوره، انخفاض في PI(4)P و PI(4,5)P2 يخفض نشاط ORP5/ORP8 حيث ترتبط هذه البروتينات مع PM بطريقة تعتمد على PIP. تركيب PS عالية بشكل غير طبيعي, مما يؤدي إلى متلازمة لينز-Majewski, يؤثر PI(4)P المستويات من خلال ORP5/836. عندما يتم حظر نشاط كل من البروتينات، PS يصبح أقل وفرة في PM، وخفض القدرة على الاونوجينيك للإشارة البروتينات37.
على العكس من ذلك ، يبدو أن التعبير المفرط ORP5 يعزز غزو الخلايا السرطانية والعمليات النقيلية38. وهكذا، يمكن أن التعديلات على النشاط ORP5/8 تعديل السلوك الخلوي بشدة من خلال التغيرات في التوازن الدهون. علاوة على ذلك، تحتل ORP5 و ORP8 مواقع الاتصال ER-الميتوكوندريا والحفاظ على بعض وظائف الميتوكوندريا، ربما عن طريق تزويد PS39. بالإضافة إلى ذلك، ORP5 localizes إلى مواقع الاتصال قطرات ER-الدهون لتقديم PS إلى قطرات الدهون بواسطة PS / PI(4) P تبادل40. الاستراتيجية المذكورة هنا لقياس (1) PS و PI (4) P استخراج من الليبوسومات و (2) PS و PI (4) P النقل بين الليبوسومات وقد وضعت لإنشاء وتحليل PS / PI (4) P نشاط تبادل Osh6p/Osh7p12,32 وتستخدم من قبل مجموعات أخرى لتحليل نشاط ORP5/ORP835 وغيرها LTPs10, 41. وهو يقوم على استخدام قارئ لوحة مضان، مقياس الطيف L-تنسيق القياسية، واثنين من أجهزة الاستشعار الفلورية، NBD-C2Lact و NBD-PHFAPP،التي يمكن الكشف عن PS وPI(4) P، على التوالي.
NBD-C2Lact يتوافق مع المجال C2 من بروتين الجليكوبروتين, لاكتادهيرين, التي أعيد هندستها لتشمل سيستين المذيبات المعرضة فريدة من نوعها بالقرب من موقع ملزم PS المفترض; ويرتبط NBD حساسة للقطبية (7-nitrobenz-2-oxa-1,3-diazol) الفلوروفوري بشكل متناقض لهذه البقايا (الشكل 1A)12. أن نكون أكثر دقة, المجال C2 من lactadherin (بوس الثور, UniProt: Q95114, بقايا 270-427) تم استنساخها في ناقلات pGEX-4T3 ليتم التعبير عنها في الانصهار مع الجلوتاثيون S-transferase (GST) في الإشريكية القولونية. ثم تحور تسلسلC2 Lact ليحل محل اثنين من بقايا السيستين التي يمكن الوصول إليها للمذيبات (C270، C427) مع بقايا ألانين وإدخال بقايا السيستين في منطقة بالقرب من موقع المفترضة PS ملزمة (H352C طفرة) التي يمكن أن توصف في وقت لاحق مع N'N'dimethyl-N-N-(iodoacetyl)-N'-(7-نيترابينز-2-أوكسا-1،3-ديازول-4-yl) ديامين الإيثيلين (IANBD) 12. يوجد موقع انشقاق للثرومبين بين بروتين GST والنهاية N لنطاق C2. ميزة رئيسية هي أن هذا المجال يعترف بشكل انتقائي PS بطريقة Ca2 +-independent خلافا لغيرها من المجالات المعروفة C2 أو Annexin A542. NBD-PHFAPP مشتق من مجال PH من البروتين البشري أربعة فوسفات محول 1 (FAPP1)، الذي أعيد هندسته ليشمل السيستين المذيبات المعرضة واحدة التي يمكن أن تكون وصفت مع مجموعة NBD بالقرب من PI(4) P موقع ملزم (الشكل 1A)43. تم استنساخ تسلسل النيوكليوتيدات من مجال PH من بروتين FAPP البشري (UniProt: Q9HB20 ، الجزء [1-100]) إلى ناقل pGEX-4T3 ليتم التعبير عنه جنبا إلى جنب مع علامة GST. تم تعديل تسلسلPH FAPP لإدراج بقايا السيستين فريدة من نوعها داخل واجهة الغشاء ملزمة للبروتين43. وعلاوة على ذلك، تم إدخال وصلة من تسعة بقايا بين موقع شق الثرومبين والنهيمينوس من مجال PH لضمان إمكانية الوصول إلى البروتيز.
لقياس استخراج PS من الليبوسومات ، يتم خلط NBD-C2Lact مع الليبوسومات المصنوعة من الفوسفاتيديل كولين (PC) التي تحتوي على كميات ضئيلة من PS. نظرا لتقاربها مع PS ، يرتبط هذا البناء بالليبوسومات ، وفلوروفور NBD يشهد تغييرا في القطبية لأنه يتلامس مع البيئة الكارهة للماء في الغشاء ، مما يثير تحولا أزرق وزيادة في الفلور إذا تم استخراج PS بشكل كامل تقريبا من قبل كمية stoichiometric من LTP، والتحقيق لا يرتبط مع الليبوسومات، وإشارة NBD أقل (الشكل 1B)32. ويستخدم هذا الاختلاف في إشارة لتحديد ما إذا كان LTP(على سبيل المثال، Osh6p) مقتطفات PS. وتستخدم استراتيجية مماثلة مع NBD-PHFAPP لقياس PI(4) P استخراج (الشكل 1B), كما هو موضح سابقا12,32. تم تصميم اثنين من المقايسات FRET المستندة إلى (1) قياس PS النقل من LA إلى LB liposomes، والتي تحاكي غشاء ER وPM، على التوالي، و (2) PI (4) P النقل في الاتجاه العكسي. يتم إجراء هذه المقايسات في نفس الظروف(أي نفس العازلة ودرجة الحرارة وتركيز الدهون) لقياس تبادل PS /PI(4) P. لقياس PS النقل، NBD-C2لاكت مختلطة مع LA ليبوسومات تتألف من جهاز الكمبيوتر ومنشطات مع 5 مول٪ PS و 2 مول٪ من الفلورسنت رودامين المسمى فوسفاتيديليثانلامينامين (رود-PE)-وLB ليبوسومات دمج 5 مول٪ PI(4)P.
في الوقت صفر، FRET مع رود PE يروي مضان NBD. إذا تم نقل PS من LA إلى LB ليبوسومات(على سبيل المثال، عند حقن Osh6p)، يحدث صرير سريع بسبب نقل جزيئات NBD-C2Lact من LA إلى LB ليبوسومات(الشكل 1C). ونظرا لكمية PS يمكن الوصول إليها، NBD-C2Lact لا يزال أساسا في حالة غشاء ملزمة على مدار التجربة12. وهكذا، فإن كثافة إشارة NBD ترتبط مباشرة مع توزيع NBD-C2Lact بين LA و LB liposomes ويمكن تطبيعها بسهولة لتحديد مقدار PS المنقول. لقياس نقل PI(4)P في الاتجاه المعاكس، يتم خلط NBD-PHFAPP مع LA و LB ليبوسومات؛ وبالنظر إلى أنه يربط فقط إلى LB الليبوسومات التي تحتوي على PI(4)P, ولكن ليس رود PE, مضان عالية. إذا تم نقل PI(4) P إلى LA liposomes، فإنه ينقل إلى هذه الليبوسومات، وتنخفض الإشارة بسبب FRET مع رود-PE(الشكل 1C). يتم تطبيع الإشارة لتحديد مقدار PI(4) P يتم نقل43.
Protocol
1. تنقية NBD-C2Lact
ملاحظة: على الرغم من أن هذا البروتوكول تفاصيل استخدام جهاز تعطيل الخلية لكسر البكتيريا، فإنه يمكن تعديلها لاستخدام استراتيجيات تحلل أخرى(على سبيل المثال، الصحافة الفرنسية). في بداية تنقية, فمن الإلزامي لاستخدام العازلة التي يتم degassed حديثا, تصفية, وتكمل مع 2 م dithiothreitol (DTT) لمنع أكسدة السيستين. ومع ذلك ، بالنسبة لخطوة وضع العلامات على البروتين ، من المهم إزالة DTT تماما. يجب تنفيذ العديد من الخطوات على الجليد أو في غرفة باردة لتجنب أي تدهور البروتين. يجب جمع عينات من حجم 30 ميكرولتر في خطوات مختلفة من البروتوكول لإجراء تحليل بواسطة الصوديوم دودسيلسلفات-البولي أكريلاميد هلام electrophoresis (SDS-PAGE) باستخدام هلام الأكريلاميد 15٪ للتحقق من التقدم المحرز في تنقية. مزيج ما يكفي من إزالة التوريد Laemmli عينة عازلة مع كل aliquot، وتسخين الخليط في 95 درجة مئوية. تجميد وتخزين الأنابيب في -20 درجة مئوية حتى التحليل.
- التعبير عن GST-C2Lact في الإشريكية القولونية
- مزيج 20 ميكرولتر من BL21 الذهب الخلايا المختصة مع 18 ميكرولتر من الماء المعقم. ثم، مزيج 2 ميكرولتر من pGEX-C2لاكت بلازميد (في ~ 65 نانوغرام / ميكرولتر) مع البكتيريا، وتحويلها عن طريق الكهربائي. Resuspend البكتيريا مع 150 ميكرولتر من autoclaved لينوكس Lysogeny-Broth (LB) المتوسطة (10 غرام / لتر تريبتون، 5 غرام / لتر استخراج الخميرة، 5 غرام / لتر NaCl في الماء المؤين، خالية من الجلوكوز). دع البكتيريا تنمو عند 37 درجة مئوية لمدة ساعة واحدة في أنبوب طرد دقيق صغير سعة 2 مل.
- تلقيح 25 مل من LB المتوسطة, تستكمل مع 50 ميكروغرام / مل أمبيسلين, مع 150 ميكرولتر من تعليق البكتيرية في قارورة Erlenmeyer 125 مل معقمة. ضع القارورة في شاكر مداري عند 37 درجة مئوية ، ودع البكتيريا تنمو بين عشية وضحاها مع الهياج عند 185 دورة في الدقيقة.
- ملء اثنين من العقيمة 2 L Erlenmeyer قوارير مع 500 مل من LB المتوسطة تكملها مع 50 ميكروغرام / مل أمبيسلين, وإضافة 5 مل من تعليق ما قبل الثقافة. دع البكتيريا تنمو عند 37 درجة مئوية مع الهياج عند 220 دورة في الدقيقة.
- قياس دوري للكثافة البصرية (OD) للتعليق على طول موجي (λ) من 600 نانومتر. عندما تصل إلى قيمة OD ~ 0.6-0.7، إضافة 500 ميكرولتر من محلول المخزون من 1 M isopropyl β-D-1-thiogalactopyranoside (IPTG) إلى كل قارورة لبدء التعبير عن GST-C2Lact. هز قوارير في 185 دورة في الدقيقة لمدة 4 ساعة في 37 درجة مئوية.
- نقل محتويات كل قارورة إلى زجاجة طرد مركزي البولي بروبلين. الطرد المركزي الزجاجتين لمدة 30 دقيقة في 4600 × ز في 4 درجة مئوية بيليه البكتيريا. تجاهل supernatant، وإعادة إنفاق كل بيليه في 50 مل من المالحة الباردة الفوسفات المخزنة.
- نقل تعليق البكتيرية الواردة في كل زجاجة إلى أنبوب الطرد المركزي مخروطي 50 مل. الطرد المركزي أنبوبين لمدة 30 دقيقة في 2300 × غرام في 4 درجة مئوية. إزالة supernatant، وتخزين الأنابيب، كل منها يحتوي على بيليه البكتيرية، في -20 درجة مئوية.
- تنقية C2لاكت
- على الجليد، وملء اثنين من أنابيب الطرد المركزي المخروطية 50 مل مع 50 مل من العازلة التي تحتوي على 50 mM تريس-HCl، درجة الحموضة 7.4، و 150 mM NaCl (تسمى فيما بعد TN العازلة)، تصفيتها سابقا وإزالة الغاز عن طريق الترشيح فراغ الغشاء.
- لإعداد العازلة تحلل في كل أنبوب، حل قرص من إيثيلينديامين رباعي الأسيتيك خالية من حمض البروتيز كوكتيل المانع في العازلة TN عن طريق سونيكيشن خفيفة أو دوامة. إضافة مضادات بروتياز أخرى، (10 ميكرومتر بيستاتين، 1 ميكروغرام/مل بيبستاتين A، و10 ميكرومتر فوسفوراميدون). الأهم من ذلك، تكملة المخزن المؤقت مع DTT 2 mM.
- ملء أنبوبين التي تحتوي على الكريات البكتيرية المعدة في الخطوة 1.1.6، مع العازلة تحلل للحصول على حجم نهائي من 30 مل في كل أنبوب، وتذويب الجليد ببطء الكريات على الجليد لمدة 10 دقيقة. سحق كل بيليه مع ملعقة الفولاذ المقاوم للصدأ، وإعادة إنفاقها عن طريق دوامة الأنابيب و / أو عن طريق pipetting تعليق ذهابا وإيابا مع وحدة تحكم ماصة وماصة 25 مل حتى يتم الحصول على تعليق متجانسة.
- قم بإجراء التحلل باستخدام جهاز تعطيل الخلايا المبرد مسبقا (انظر جدول المواد) عنطريق تحميل 30 مل من العينة داخل الخزان وتشغيل دورة كسر في الوضع المستمر بضغط 1.6 بار. جمع lysate في نفس الأنبوب، والحفاظ على أنبوب على الجليد، وإضافة فورا 250 ميكرولتر من محلول المخزون من 200 mM فلوريد الفينيل ميثيل سلفونيل (PMSF) أعدت في ايزوبروبانول.
- Lyse العينة الأخرى التالية نفس الإجراء. استخدم ما تبقى من المخزن المؤقت للتحلل لغسل جهاز تعطيل الخلية، وجمع الغسيل لضبط حجم كل تحلل (~ 30 مل) إلى حجم نهائي قدره 50 مل.
- تكملة كل lysate مع 5 mM MgCl2،وإضافة 20 ميكروغرام / مل من DNAse I لتفتيت الحمض النووي وبالتالي تقليل لزوجة العينة. احتضان على الجليد لمدة 30 دقيقة. جمع عينة لتحليل هلام.
- نقل كل lysate 50 مل إلى أنبوب طارد فائق الكربونات prechilled (اثنان في المجموع، انظر جدول المواد). جهاز طرد مركزي عند 186,000 × غرام عند 4 درجات مئوية لمدة ساعة واحدة على الأقل باستخدام جهاز طرد مركزي فائق.
- بالتوازي مع خطوة الطرد المركزي، الاستغناء عن 1.4 مل من الطين التي تحتوي على الجلوتاثيون مقرونة 4٪ حبات agarose في اثنين من أنابيب الطرد المركزي المخروطية 50 مل، إضافة 20 مل من العازلة TN تكملها 1 MM DTT (TND العازلة) إلى كل أنبوب، والطرد المركزي في 1200 × غرام لمدة 5 دقائق، والتخلص من supernatant. كرر خطوة الغسيل هذه مرتين.
- بعد الطرد المركزي للlysate البكتيرية، وإزالة عينة 30 ميكرولتر من supernatant، ونقل supernatant من كل أنبوب الطرد المركزي الفائق إلى المقابلة 50 مل أنبوب الطرد المركزي المخروطي الذي يحتوي على الخرز نظيفة. لتحليل هلام، resuspend بيليه الحطام في واحدة من أنابيب الطرد المركزي الفائق مع 50 مل من العازلة TND، وجمع عينة 30 ميكرولتر.
- ضع الأنابيب على دوار لمدة 3-4 ساعة عند 4 درجات مئوية للحصول على تعليق حبة متجانس. تجمع تعليق حبة في عمود كروماتوغرافي فارغ 25 مل. السماح للخرزات decant، وإزالة العازلة والبروتينات غير المنضمة عن طريق تدفق الجاذبية. خذ عينة من الغوات للتحليل.
- Resuspend الخرز مع 20 مل من TND العازلة، وجمع eluate بواسطة تدفق الجاذبية. كرر هذه الخطوة مرتين لغسل الخرز تماما. تجمع الملوات التي تم جمعها، وتحتفظ بعينة 30 ميكرولتر لمزيد من التحليل.
ملاحظة: بعد إزالة قصيرة، حجم ~2 مل من تعليق حبة، التي يتم إرفاق GST-C2Lact، الرواسب في الجزء السفلي من العمود. - أضف 1 مل من تعليق الخرز إلى أنبوبي طرد دقيق سعة كل منهما 2 مل. ملء كل أنبوب مع TND المخزن المؤقت إلى حجم النهائي من 1.970 مل. خذ عينة 30 ميكرولتر من أنبوب واحد لمزيد من التحليل (عينة B1). إضافة 10 ميكرولتر من محلول 10 mM CaCl2 و 25 ميكرولتر من محلول مخزون من محلول بروتياز الثرومبين البشري عند 0.02 U/μL.
- ضع الأنبوبين على دوار عند 4 درجات مئوية بين عشية وضحاها للسماح للثرومبين بالانقباض من علامة GST من نطاق C2Lact. في اليوم التالي، في كل أنبوب، مزيج 10 ميكرولتر من 200 م م PMSF الحل مع تعليق حبة لمنع عمل الثرومبين.
- الطرد المركزي أنابيب في 700 × غرام لمدة 5 دقائق، وجمع supernatant، الذي يحتوي على نطاق C2Lact قابلة للذوبان، من كل أنبوب، دون أخذ الخرز. تجمع الشعيرات الفائقة في أنبوب الطرد المركزي الصغير 2 مل المفاجئة كاب (E1 eluate) التي يتم الاحتفاظ بها على الجليد.
- إضافة 1 مل من العازلة TND إلى كل أنبوب لإعادة إنفاق الخرز، وغسلها؛ كرر الخطوة 1.2.14. تنفيذ هذه الخطوة ثلاث مرات أكثر لاسترداد كمية قصوى من البروتين. في كل مرة، تجمع المضادات العملاقة التي تم جمعها في أنبوب جديد 2 مل (E2، E3، E4، وE5 eluates)، واتخاذ aliquot لمزيد من التحليل. في نهاية خطوات الغسيل، واتخاذ aliquot من تعليق حبة (aliquot B2).
- تحليل 30 ميكرولتر العينات التي تم جمعها في الخطوات المختلفة من بروتوكول تنقية بواسطة فصل SDS-PAGE على هلام الأكريلاميد 15٪.
- إزالة الخرز الملوث المحتمل عن طريق تجميع جميع الحشرات الفائقة(أي، ~ 10 مل) التي تم جمعها خلال الخطوتين 1.2.14 و 1.2.15 في عمود كروماتوغرافيا 10 مل. جمع eluate بواسطة تدفق الجاذبية، والاحتفاظ الخرز في الجزء السفلي من العمود.
- ركز عينة C2Lact باستخدام وحدة فلتر طرد مركزي مع خفض الوزن الجزيئي (MWCO) من 3 كيلودا وسرعة طرد مركزي تبلغ 2300 × ز. وقف إجراء التركيز عندما يكون حجم عينة البروتين ~ 1 مل.
- إعداد وتنقية NBD-C2لاكت
- توازن عمود تحلية (راجع جدول المواد)مع المخزن المؤقت TN. تحميل العمود مع 1 مل من عينة C2Lact المركزة. السماح للعينة لدخول السرير هلام تماما، إضافة 1.5 مل من العازلة TN خالية من DTT degassed حديثا إلى العمود، وجمع eluate بواسطة تدفق الجاذبية في أنبوب microcentrifuge المفاجئة كاب 2 مل.
- تمييع 50 ميكرولتر من اليواتي في حجم نهائي قدره 300 ميكرولتر TN العازلة، وتسجيل طيف امتصاص من 230 إلى 450 نانومتر باستخدام المخزن المؤقت TN نقية باعتبارها فارغة. تحديد تركيزC2 Lact على أساس الامتصاص الذي يقاس عند 280 نانومتر ، مع الأخذ في الاعتبار معامل الانقراض ε يساوي 44920 M-1.cm-1.
- لتسمية بناء C2Lact مع فلوروفور NBD ، اخلط البروتين مع فائض الضرس عشرة أضعاف N ، N '- dimethyl -N-(iodoacetyl) -N '-(7-nitrobenz-2-oxa-1،3-diazol-4-yl)الإيثيلينديامين (IANBD Amide).
- حل 1 ملغ من IANBD في ثنائي ميثيلفورماميد اللامائية (DMF)، مع الأخذ في الاعتبار أن الحجم النهائي للDMF المستخدمة لوضع العلامات على بناء C2Lact يجب ألا يتجاوز 5٪ (v/v) من حجم عينة البروتين.
- لتحديد حجم DMF (VDMF) لإذابة IANBD، أولا حساب الكمية المطلوبة من IANBD (م، وأعرب في ملغ) لتسمية البروتين باستخدام الصيغة 1.
م = 10,000 × C × V × MWIANBD (1)
حيث C هو تركيز C2Lact مقاسا في الخطوة 1.3.2، V هو حجم عينة C2Lact، وMWIANBD هو الوزن الجزيئي للفلوروفور (420 غرام/مول). - حساب VDMF باستخدام الصيغ 2 (مع م0= 1) و 3.
VDMF= (م0/م) × VIANBD (2)
VIANBD= 0.05 × الخامس (3)
حيث M 0 هوكمية مسحوق IANBD في ملغ، والخامسIANBD هو حجم حل IANBD لإضافتها إلى عينةC2 لاكت. - أضف المجلد VIANBD من محلول IANBD الطازج إلى عينة C2Lact، وهز خليط التفاعل عند 800-900 دورة في الدقيقة لمدة 30 دقيقة عند 25 درجة مئوية باستخدام مixer حراري محمي من الضوء. دع رد الفعل يستمر لمدة 90 دقيقة على الجليد. في غضون ذلك، قم بتنظيف وحدة فلتر الطرد المركزي (MWCO = 3 kDa) مع 10 مل من المخزن المؤقت TN.
- إضافة L-السيستين (في 10 أضعاف الضرس الزائدة إلى IANBD) إلى خليط رد فعل ل inactivate IANBD الحرة.
- أضف 15 مل من المخزن المؤقت TN إلى حل NBD-C2Lact، ثم قم بنقل محلول NBD-C2Lact إلى وحدة التصفية الطرد المركزي. ركز العينة على 2 مل لفصل معظم NBD المجاني عن البروتين عن طريق الطرد المركزي عند 2300 × g. كرر خطوة الغسيل هذه مرتين. طرد مركزي العينة في أنبوب الطرد المركزي المفاجئة 2 مل لمدة 10 دقيقة في 19000 × غرام في 4 درجة مئوية لبيليه المجاميع المحتملة، وجمع supernatant.
- تمييع 50 ميكرولتر من اليواتي في حجم نهائي قدره 300 ميكرولتر من العازلة TN. سجل طيف الامتصاص من 230 إلى 650 نانومتر باستخدام اليواتي الذي تم جمعه أثناء إجراء التركيز كفراغ. تحديد تركيز NBD-C2Lact باستخدام الامتصاص الأقصى عند λ=280 و495 نانومتر ومعاملات الانقراض ε= 44,920 م-1.cm-1 (بروتين) و25,000 م-1.cm-1 (NBD fluorophore).
ملاحظة: إذا كانت قيم التركيز اثنين متشابهة، يشير هذا إلى أن يتم تسمية بناءC2 Lact في نسبة 1:1 مع مجموعة NBD. - إذا كان تركيز NBD-C2Lact المقدر من قياس امتصاص NBD يتجاوز التركيز المقدر من امتصاص بقايا التربتوفان (Trp)، كرر الخطوة 1.3.5 لإزالة NBD مجانا.
- إضافة الجلسرين إلى العينة للحصول على تركيز النهائي من 10٪ (v/v) لحماية التبريد بناء NBD-C2Lact أثناء تجميد الفلاش. قياس تركيز البروتين النهائي.
- إعداد 50 ميكرولتر aliquots من البروتين في أنابيب 0.5 مل المفاجئة كاب microcentrifuge. فلاش تجميد الأنابيب في النيتروجين السائل، وتخزينها في -80 درجة مئوية.
2. تنقية NBD-PHFAPP
ملاحظة: إجراء إنتاج وتسميةPH FAPP مطابق للإجراء NBD-C2Lact حتى نقل حل NBD-C2Lact إلى وحدة فلتر الطرد المركزي في الخطوة 1.3.4. من هذه الخطوة فصاعدا، اتبع البروتوكول الموضح أدناه.
- بعد خطوة التركيز، احتفظ ب 2 مل من NBD-PHFAPP عند 4 درجات مئوية في الظلام لمدة لا تزيد عن يوم واحد قبل إجراء التصوير الكروماتوغرافيا لاستبعاد الحجم. قبل كروماتوغرافيا استبعاد الحجم، تحقق من عدم وجود رواسب برتقالية (تجميع أثناء التركيز) في الجزء السفلي من الأنبوب. إذا كان هذا هو الحال، طرد مركزي العينة في 540،000 × غرام لمدة 10 دقيقة في 4 درجة مئوية، وتنقية supernatant بواسطة الكروماتوغرافيا استبعاد الحجم.
ملاحظة: يتم إجراء كروماتوغرافيا استبعاد الحجم على عمود معبأة مع كروسلينكد ديكتران-أكريلاميد copolymer (انظر جدول المواد)،سابقا متساوية مع المخزن المؤقت TND، وذلك باستخدام نظام كروماتوغرافيا السائل البروتين سريع (انظر جدول المواد). يجب حماية العمود من الضوء. واستخدم معدل تدفق قدره 1 مل/دقيقة، وأعقب ذلك تأليه بناء NBD-PHFAPP بتسجيل الامتصاص عند λ=280 (بروتين) و480 نانومتر (NBD) عند مخرج العمود.- حقن عينةFAPP NBD-PH تحميلها في حلقة حقن 2 مل على العمود، وجمع على الفور 2.5 مل كسور من eluate.
- تحليل جميع الكسور التي تتوافق مع الذروة الرئيسية التي تم الكشف عنها في 280 و 480 نانومتر على هلام SDS-PAGE 15٪. اخلط عينة 25 ميكرولتر من كل كسر مع 15 ميكرولتر من مخزن عينة Laemmli المؤقت قبل التدفئة والتحميل على الجل.
ملاحظة: تظهر الذروة الرئيسية، التي يتم اكتشافها في نفس الوقت عند λ= 280 و 480 نانومتر، بمجرد تمرير حجم المخزن المؤقت ~150 مل عبر العمود. - تجمع الكسور التي تحتوي حصرا على البروتين NBD-PHFAPP (~ 12.2 كيلودا)، وإضافة الجلسرين بتركيز نهائي قدره 10٪ (v/v). ركز العينة باستخدام وحدة فلتر طرد مركزي مع MWCO من 3 كيلو دا إلى حجم نهائي قدره 1 مل باستخدام سرعة طرد مركزي تبلغ 2300 × ز.
- إعداد aliquots، وتسجيل الطيف امتصاص كما هو موضح ل NBD-C2Lact. استخدم معامل الانقراض ε = 29,450 M-1.cm-1 لتحديد تركيز البروتين استنادا إلى الامتصاص الذي يقاس عند λ= 280 نانومتر.
3. إعداد الليبوسومات لPS وPI(4) P استخراج أو نقل المقايسات
ملاحظة: تنفيذ كافة الخطوات في درجة حرارة الغرفة ما لم يتم تحديد خلاف ذلك. التعامل مع المذيبات العضوية، rotavapor، والنيتروجين السائل بحذر.
- إعداد الطازجة، وتصفيتها، وdgassed 50 M 4-(2-هيدروكسيثيل)-1-حمض بيبرازينيثانسولفونيك (HEPES)-هيدروكسيد البوتاسيوم (KOH)، درجة الحموضة 7.4، 120 خلات البوتاسيوم (هونج كونج) العازلة.
- لكل نوع من الليبوسوم، خذ كميات دقيقة من الدهون المختلفة من حلول المخزون، واخلطها في قارورة زجاجية على شكل كمثرى سعة 25 مل (الجدول 1). إضافة الكلوروفورم النقي لضبط حجم كل خليط إلى 1 مل. تسمية كل قارورة مع اسم ليبوسوم. التفاف القوارير التي تحتوي على خليط الدهون مخدر مع رود PE مع رقائق الألومنيوم.
- ضع القارورة على المبخر الدوار. جفف الدهون تحت الفراغ وعلى 25 درجة مئوية لمدة 30 دقيقة على الأقل بسرعة دوران 500 دورة في الدقيقة. للأفلام الدهنية التي تحتوي على PI(4)P، قبل الحرب قارورة في 32-34 درجة مئوية لمدة 5 دقائق، تحت تناوب لطيف، لخلط بشكل صحيح PI(4)P مع الدهون الأخرى قبل خلق فراغ في القارورة لإزالة المذيبات، والتي سوف تترك وراءها فيلم من الدهون الجافة على جدار قارورة.
- فصل القارورة من المبخر، ووضعها في غرفة فراغ لمدة 45 دقيقة لإزالة أي آثار المتبقية من المذيبات. ملء القارورة مع 2 مل من المخزن المؤقت HK، وإضافة عدد قليل من الخرز الزجاج قطرها 4 ملم إلى الحل. دوامة بلطف قارورة لمدة 2 دقيقة لإعادة إنفاق الدهون وإعداد الحويصلات الدهنية متعددةlamellar (MLVs) مع تركيز الدهون من 4 MM. إعداد 0.5 مل aliquots من MLVs في 1.5 مل المسمار كاب أنابيب الطرد الدقيق.
- تجميد ذوبان الأنابيب 5x (باستخدام النيتروجين السائل وحمام الماء في 37 درجة مئوية، على التوالي). قم بقذف الليبوسومات أو تخزينها عند -20 درجة مئوية.
- استخدام مقذوف مصغرة لإعداد الليبوسومات(أي الحويصلات unilamellar كبيرة) من MLVs وفقا للمبادئ التوجيهية للشركة المصنعة. استخدم مرشح البولي مع المسام أسطواني موحدة من قطر 200 نانومتر.
- لإعداد كل نوع من الليبوسوم، قم بقذف ما لا يقل عن 250 ميكرولتر من التعليق المقابل ل MLVs. قم بتخزين الليبوسومات الطاردة عند 4 درجات مئوية وفي الظلام إذا كانت تحتوي على رود-PE. استخدام الليبوسومات في غضون 2 أيام.
| تكوين الدهون (مول / مول) | الدهون | |||||
| اسم ليبوسوم | DOPC (25 ملغم/مل) | الفرقعات (10 ملغم/مل) | 16:0 ليس رود-PE (1 ملغم/مل) | C16:0/C16:0-PI(4)P (1 ملغم/مل) | ||
| مقايسات الاستخراج | ليبوسوم 2 مول٪ PS | جهاز كمبيوتر/ PS 98/2 | 247 ميكرولتر | 12.5 ميكرولتر | ||
| ليبوسوم 2 مول٪ PI(4)P | PC/PI(4)P 98/2 | 247 ميكرولتر | 153 ميكرولتر | |||
| ليبوسوم الكمبيوتر | جهاز كمبيوتر 100 | 252 ميكرولتر | ||||
| مقايسات النقل | لامأ | PC/PS/رود-PE 93/5/2 | 234 ميكرولتر | 31.4 ميكرولتر | 200 ميكرولتر | |
| LA بدون PS | PC/رود-PE 98/2 | 247 ميكرولتر | 200 ميكرولتر | |||
| لب | PC/PI(4)P 95/5 | 237 ميكرولتر | 383 ميكرولتر | |||
| LB بدون PI(4)P | جهاز كمبيوتر 100 | 252 ميكرولتر | ||||
| لأ-إك | PC/PS/PI(4)P/رود-PE 93/2.5/2.5/2 | 234 ميكرولتر | 15.7 ميكرولتر | 200 ميكرولتر | 191 ميكرولتر | |
| لب-Eq | PC/PS/PI(4)P 95/2.5/2.5 | 239 ميكرولتر | 15.7 ميكرولتر | 191 ميكرولتر | ||
الجدول 1: كميات من الدهون الأسهم حلول مختلطة لإعداد الدهون. المختصرات: PS = فوسفاتيديلسيرين; PC = فوسفاتيديلكولين; PI(4)P = فوسفاتيدلينوزيتول 4-فوسفات; رود-PE = الفوسفاتيديليثانولامين المسمى رودامين؛ DOPC = ثنائي الفوسفاتيديل كولين; POPS = 1-بالميتويل-2-أوليويل-إس إن-غليسيرو-3-فوسفو-ل-سيرين; 16:0 ليس رود-PE = 1,2-ديبالميتويل-ز-غليسيرو-3-فوسفويثانولامين-ن-(ليسامين رودامين ب سلفونيل).
4. قياس PS أو PI(4) P استخراج
ملاحظة: يجب إجراء القياسات باستخدام لوحة سوداء من 96 بئرا وقارئ لوحة مضان مجهز بألوان أحادية: واحد لإثارة الفلورسينس وآخر للانبعاثات، مع عرض نطاق ترددي متغير.
- إعداد جديدة، وتصفيتها، وإزالة الغاز المخزن المؤقت هونج كونج تكملها مع 1 م م2 (HKM العازلة). إعداد الليبوسومات PC نقية وpPC liposomes مخدر مع 2 mol٪ PS أو 2 مول٪ PI(4)P (4 mM تركيز الدهون النهائي, انظر الجدول 1).
ملاحظة: حافظ على الأنابيب مليئة بتعليق الليبوسومات الطاردة في درجة حرارة الغرفة طوال التجربة، والحفاظ على البروتينات على الجليد. بالإضافة إلى ذلك، حماية أجهزة استشعار الدهون من الضوء. - بالنسبة لمقايسة الاستخراج PS، في بئر واحد، اخلط الليبوسومات التي تحتوي على 2 مول٪ PS (تركيز الدهون النهائي 80 ميكرومتر، تركيز PS يمكن الوصول إليه 0.8 ميكرومتر) مع NBD-C2Lact (تركيز نهائي 250 nM) في حجم نهائي قدره 100 ميكرولتر. ملء بئر ثانية مع نفس الكمية من الليبوسوم (80 ميكرومتر، 2 مول٪ PS) و NBD-C2Lact (250 نانومتر) مختلطة مع 3 ميكرومتر LTP (Osh6p كتحكم إيجابي أو بروتين من الفائدة).
ملاحظة: وقت الحضانة من 5 دقيقة كافية لOsh6p لتحقيق استخراج الدهون. - ملء بئر ثالثة مع NBD-C2Lact (250 nM) مختلطة مع ليبوسومات PC النقية (80 ميكرومتر). ملء بئر الرابع فقط مع الليبوسومات PC نقية (80 ميكرومتر). كرر الخطوات 4.2-4.3 لإعداد ثلاث سلاسل إضافية من أربعة آبار.
- لكل بئر، سجل طيف NBD من 505 إلى 650 نانومتر (عرض النطاق الترددي 5 نانومتر) عند الإثارة عند 490 نانومتر (عرض النطاق الترددي 5 نانومتر) عند 25 درجة مئوية. لكل سلسلة، طرح الطيف المسجل مع الليبوسومات فقط من الأطياف الأخرى.
ملاحظة: F و Fماكس تتوافق مع كثافة في 536 نانومتر تقاس مع الليبوسومات التي تحتوي على PS في وجود أو عدم وجود LTP، على التوالي، في حين F0 هو كثافة في نفس الطول الموجي مع الليبوسومات PC نقية. لكل سلسلة، يتم إعطاء النسبة المئوية من PS يمكن الوصول إليها التي يتم استخراجها من البروتين باستخدام الصيغة التالية.
100 × (1-(F-F0)/(Fماكس-F0)))(4) - بالنسبة إلى المقايسة الاستخراجية PI(4)P، قم بإعداد الليبوسومات المخدرة ب 2 مول٪ PI(4)P، واضطلع بقياسات باستخدام مسبار NBD-PHFAPP. إجراء تجارب التحكم وتحديد نسبة الاستخراج بنفس الطريقة الموضحة أعلاه.
ملاحظة: تركيز الليبوسوم والبروتين متطابقة لتلك المستخدمة في المقايسة استخراج PS.
5. قياس الوقت الحقيقي للنقل PS
ملاحظة: يستخدم مقياس فلوريمتر قياسي (90 درجة) مجهز بحامل خلايا يتم التحكم في درجة حرارته وستيرر مغناطيسي لتسجيل حركة نقل الدهون. للحصول على البيانات بدقة، من المهم الحفاظ على العينة بشكل دائم في نفس درجة الحرارة (تعيين ما بين 25 و 37 درجة مئوية اعتمادا على أصل البروتين(على سبيل المثال،الخميرة أو الإنسان)) وتحريكه باستمرار. البروتوكول المذكور أدناه هو لقياس نقل الدهون في عينة 600 ميكرولتر الواردة في خلية الكوارتز أسطواني.
- إعداد العازلة HKM degassed حديثا وتصفيتها. حافظ على الأنابيب التي تحتوي على ليبوسومات مقذوفة في درجة حرارة الغرفة. التفاف أنابيب تحتوي على الليبوسومات مع رود PE في رقائق الألومنيوم، و / أو تخزينها في مربع مبهمة لمنع أي photobleaching.
- ضبط الإثارة والانبعاثات أحادية اللون في λ = 460 نانومتر (مع عرض نطاق ترددي قصير (1-3 نانومتر)) وعلى λ = 530 نانومتر (مع عرض نطاق ترددي كبير (≥ 10 نانومتر)) ، على التوالي. تعيين وقت الاستحواذ في 25 دقيقة مع حل الوقت ≤ 1 s.
- في كوفيت الكوارتز، تمييع 30 ميكرولتر من تعليق LA ليبوسوم وحجم NBD-C2لاكت الأسهم الحل في العازلة HKM قبل الحرب لإعداد عينة 570 ميكرولتر التي تحتوي على 200 ميكرومتر مجموع الدهون و 250 nM NBD-C2Lact. إضافة شريط صغير اثارة المغناطيسي، ووضع cuvette في حامل الفلورومتر.
- بمجرد أن يتم توازن العينة حراريا (بعد 3-5 دقائق) ، تشغيل القياس. بعد دقيقة واحدة، أضف 30 ميكرولتر من تعليق الليبوسوم LB (التركيز النهائي من 200 ميكرومتر من مجموع الدهون) إلى العينة. بعد 3 دقائق، حقن LTP في العينة بحيث يكون التركيز النهائي لل LTP 200 nM، والحصول على إشارة لمدة 21 دقيقة المتبقية.
- إجراء تجربة موازية لتطبيع إشارة NBD. مزيج 30 ميكرولتر من LA-Eq تعليق الليبوسوم مع 250 nM NBD-C2Lact في المخزن المؤقت HKM (الحجم النهائي من 570 ميكرولتر). بعد 1 دقيقة، حقن 30 ميكرولتر من LB-Eq تعليق الدهون.
ملاحظة: تركيبة الدهون من LA-Eq و LB-Eq ليبوسومات مماثلة لتلك التي LA و LB ليبوسومات المستخدمة في الفحص نقل, إلا أن كل واحد منهم يحتوي على 2.5 mol٪ PS و 2.5 مول٪ PI(4)P. ونتيجة لذلك، فإن إشارة NBD التي يتم قياسها، ويشار إليها باسم FEq،تتوافق مع الإشارة التي ينبغي قياسها إذا تم تماثل PS تماما بين LA و LB liposomes من خلال عملية نقل. - تحويل المنحنيات الحركية التي تقاس مع LTP من الفائدة لتحديد كمية PS (في μM) نقلها من LA إلى LB ليبوسومات مع مرور الوقت. تطبيع كل نقطة بيانات (F) من المنحنى باستخدام الصيغة التالية.
FNorm = (F-F0)/(FEq-F0) (5)
حيث F 0 يتوافق معإشارة NBD قبل إضافة LTP، و F Eq هوإشارة تقاس في الخطوة 5.5.
ملاحظة: كمية PS (في μM) المنقولة من LA إلى LB liposomes يتوافق مع 2.5 × FNorm، بالنظر إلى أن التوازن يتوافق مع حالة حيث نصف جزيئات PS التي يمكن الوصول إليها ، الواردة في المنشور الخارجي للليبوسومات LA، (أي،المقابلة ل5 مول٪ من 0.5 × 200 ميكرومتر مجموع الدهون) تم نقلها إلى LB ليبوسومات.
6. قياس الوقت الحقيقي للنقل PI(4)P
- تعيين الفلوريمتر (الإثارة والموجة الموجية للانبعاثات، وعرض النطاق الترددي، ووقت الامتلاك، ودقة الوقت) كما فعلت لإجراء اختبار نقل PS. وبالمثل، استخدم نفس العازلة، cuvette، وليبوسومس لإجراء التجارب تحت التحريك المستمر في نفس درجة الحرارة.
- في cuvette، مزيج 30 ميكرولتر من تعليق ليبوسوم LB وNBD-PHFAPP مع العازلة HKM prewarmed للحصول على حجم نهائي من 570 ميكرولتر (200 ميكرومتر مجموع الدهون، 250 nM NBD- PHFAPP). بمجرد الوصول إلى التوازن الحراري للعينة ، ابدأ القياس ، وبعد دقيقة واحدة ، قم بحقن 30 ميكرولتر من تعليق LA للدهون. بعد 3 دقائق، حقن LTP من الفائدة (تركيز النهائي من 200 nM)، وتسجيل إشارة.
- إجراء تجربة ثانية لتطبيع إشارة NBD. مزيج 30 ميكرولتر من LB-Eq تعليق ليبوسوم مع 250 NM NBD-PHFAPP في 570 ميكرولتر من المخزن المؤقت HKM. بعد 1 دقيقة، حقن 30 ميكرولتر من تعليق ليبوسوم LA-Eq.
ملاحظة: هنا، تتوافق إشارة NBD، المشار إليها ب FEq،مع الإشارة التي يجب قياسها إذا كان PI(4) P متوازنا تماما بين الليبوسومات LA و LB. - تحويل المنحنيات الحركية لتحديد كمية PI (4) P (في μM) المنقولة من LB إلى LA ليبوسومات مع مرور الوقت. يتم تسوية كل نقطة بيانات (F) باستخدام الصيغة 5 التي يتوافق F 0 معإشارة NBD قبل إضافة LTP، وF Eq هوالإشارة التي تقاس في الخطوة 6.3.
ملاحظة: كمية PI (4) P (في μM) المنقولة من LB إلى LA liposomes يتوافق مع 2.5 × FNorm، مع الأخذ في الاعتبار أن التوازن يتوافق مع حالة حيث نصف PI (4) P الواردة في المنشور الخارجي للليبوسومات LB (أي ، 0.5 × 5 ميكرومتر) تم نقلها في LA ليبوسومات.
7. تحليل منحنيات الحركية
- قياس مدى كفاءة LTP من خلال تحديد السرعة التي ينقل بها LTP الدهون من مجموعة ليبوزوم واحدة إلى أخرى في الثواني القليلة الأولى بعد حقنها إلى cuvette.
- إجراء انحدار خطي من نقاط البيانات الأولى من الحركية نقل للحصول على منحدر. تقسيم قيمة المنحدر من تركيز LTP في خليط التفاعل لتحديد عدد جزيئات الدهون المنقولة لكل بروتين في وحدة الوقت (دقيقة أو ق).
النتائج
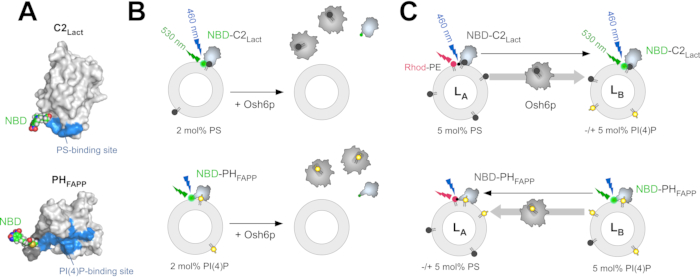
الشكل 1: وصف أجهزة الاستشعار الدهون الفلورية والمقاسات في المختبر. (أ) نماذج ثلاثية الأبعاد من NBD-C2Lact و NBD-PHFAPP استنادا إلى الهيكل البلوري لنطاق C2 من اللاكتاديرين البقري (PDB ID: 3...
Discussion
تعتمد نتائج هذه المقايسات بشكل مباشر على إشارات أجهزة استشعار الدهون الفلورية. وبالتالي، فإن تنقية هذه المسابير التي تحمل علامة 1:1 مع بنك دبي الوطني وبدون تلوث حر بالفلوروفور من NBD هي خطوة حاسمة في هذا البروتوكول. كما أنه من الإلزامي التحقق مما إذا كان LTP قيد الفحص مطويا بشكل صحيح وليس مجمع?...
Disclosures
ويعلن أصحاب البلاغ أنه لا يوجد تضارب في المصالح.
Acknowledgements
ونحن ممتنون للدكتورة أ. كوتريس على تدقيقها الدقيق للمخطوطة. ويمول هذا العمل منحة الوكالة الوطنية الفرنسية للبحوث (ANR-16-CE13-0006) ومن المجلس الوطني للبحوث العلمية.
Materials
| Name | Company | Catalog Number | Comments |
| L-cysteine ≥97 % (FG) | Sigma | W326305-100G | Prepare a 10 mM L-cysteine stock solution in water. Aliquots are stored at -20 °C |
| 2 mL Amber Vial, PTFE/Rub Lnr, for lipids storage in CHCL3 | Wheaton | W224681 | |
| 4 mm-diameter glass beads | Sigma | Z265934-1EA | |
| 50 mL conical centrifuge tube | Falcon | ||
| ÄKTA purifier | GE healthcare | FPLC | |
| Aluminium foil | |||
| Amicon Ultra-15 with a MWCO of 3 and 10 kDa | Merck | UFC900324, UFC901024 | |
| Amicon Ultra-4 with a MWCO of 3 and 10 kDa | Merck | UFC800324, UFC801024 | |
| Ampicillin | Prepare a 50 mg/mL stock solution with filtered and sterilized water and store it at -20 °C. | ||
| Bestatin | Sigma | B8385-10mg | |
| BL21 Gold Competent Cells | Agilent | ||
| C16:0 Liss (Rhod-PE) in CHCl3 (1 mg/mL) | Avanti Polar Lipids | 810158C-5MG | |
| C16:0/C16:0-PI(4)P | Echelon Lipids | P-4016-3 | Dissolve 1 mg of C16:0/C16:0-PI(4)P powder in 250 µL of MeOH and 250 µL of CHCl3. Then complete with CHCl3 to 1 mL. The solution must become clear. |
| C16:0/C18:1-PS (POPS) in CHCl3 (10 mg/mL) | Avanti Polar Lipids | 840034C-25mg | |
| C18:1/C18:1-PC (DOPC) in CHCl3 (25 mg/mL) | Avanti Polar Lipids | 850375C-500mg | |
| CaCl2 | Sigma | Prepare 10 mM CaCl2 stock solution in water. | |
| Cell Disruptor | Constant Dynamics | ||
| Chloroform (CHCl3) RPE-ISO | Carlo Erba | 438601 | |
| Complete EDTA-free protease inhibitor cocktail | Roche | 5056489001 | |
| Deionized (Milli-Q) water | |||
| Dimethylformamide (DMF), anhydrous, >99% pure | |||
| DNAse I Recombinant, RNAse free, in powder | Roche | 10104159001 | |
| DTT | Euromedex | EU0006-B | Prepare 1 M DTT stock solution in Milli-Q water. Prepare 1 mL aliquots and store them at -20 °C. |
| Econo-Pac chromatography columns (1.5 × 12 cm). | Biorad | 7321010 | |
| Electroporation cuvette 2 mm | Ozyme | EP102 | |
| Electroporator Eppendorf 2510 | Eppendorf | ||
| Fixed-Angle Rotor Ti45 and Ti45 tubes | Beckman | Spinning the batcerial lysates | |
| Glass-syringes (10, 25, and 50 µL) for fluorescence experiment | Hamilton | ||
| Glass-syringes (25 , 100, 250, 500, and 1000 µL) to handle lipid stock solutions | Hamilton | 1702RNR, 1710RNR, 1725RNR, 1750RN type3, 1001RN | |
| Glutathione Sepharose 4B beads | GE Healthcare | 17-0756-05 | |
| Glycerol (99% pure) | Sigma | G5516-500ML | |
| Hemolysis tubes with a cap | |||
| HEPES , >99 % pure | Sigma | H3375-500G | |
| Illustra NAP 10 desalting column | GE healthcare | GE17-0854-02 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Euromedex | EU0008-B | Prepare 1 M IPTG stock solution in Milli-Qwater. Prepare 1 mL aliquots and store them at -20 °C. |
| K-Acetate | Prolabo | 26664.293 | |
| Lennox LB Broth medium without glucose | Prepared with milli-Q water and autoclaved. | ||
| Liquid nitrogen | Linde | ||
| Methanol (MeOH) ≥99.8% | VWR | 20847.24 | |
| MgCl2 | Sigma | Prepare a 2 M MgCl2 solution. Filter the solution using a 0.45 µm filter. | |
| Microplate 96 Well PS F-Botom Black Non-Binding | Greiner Bio-one | 655900 | |
| Mini-Extruder with two 1 mL gas-tight Hamilton syringes | Avanti Polar Lipids | 610023 | |
| Monochromator-based fluorescence plate reader | TECAN | M1000 Pro | |
| N,N'-Dimethyl-N-(Iodoacetyl)-N'-(7-Nitrobenz-2-Oxa-1,3-Diazol-4-yl)Ethylenediamine) (IANBD Amide) | Molecular Probes | Dissolve 25 mg of IANBD in 2.5 mL of dimethylsulfoxide (DMSO) and prepare 25 aliquot of 100 µL in 1.5 mL screw-cap tubes. Do not completely screw the cap. Then, remove DMSO in a freeze-dryer to obtain 1 mg of dry IANBD per tube. Tubes are closed and stored at -20 °C in the dark. | |
| NaCl | Sigma | S3014-1KG | |
| PBS | 137 mM NaCl, 2.7 mM KCl, 10 mM NaH2PO4, 1.8 mM KH2PO4, autoclaved and stored at 4 °C. | ||
| Pear-shaped glass flasks (25 mL, 14/23, Duran glass) | Duran Group | ||
| Pepstatin | Sigma | p5318-25mg | |
| pGEX-C2LACT plasmid | Available on request from our lab | ||
| pGEX-PHFAPP plasmid | Available on request from our lab | ||
| Phenylmethylsulfonyl fluoride (PMSF) ≥98.5% (GC) | Sigma | P7626-25g | Prepare a 200 mM PMSF stock solution in isopropanol |
| Phosphoramidon | Sigma | R7385-10mg | |
| Polycarbonate filters (19 mm in diameter) with pore size of 0.2 µm | Avanti Polar Lipids | 610006 | |
| Poly-Prep chromatography column (with a 0-2 mL bed volume and a 10 mL reservoir) | Biorad | 7311550 | |
| Prefilters (10 mm in diameter). | Avanti Polar Lipids | 610014 | |
| PyMOL | http://pymol.org/ | Construction of the 3D models of the proteins (Figure 1A) | |
| Quartz cuvette for UV/visible fluorescence (minimum volume of 600 µL) | Hellma | ||
| Quartz cuvettes | Hellma | ||
| Refrigerated centrifuge Eppendorf 5427R | Eppendorf | ||
| Rotary evaporator | Buchi | B-100 | |
| Screw-cap microcentriguge tubes (1.5 mL) | Sarsted | ||
| Small magnetic PFTE stirring bar (5 × 2 mm) | |||
| Snap-cap microcentriguge tubes (0.5, 1, and 2 mL) | Eppendorf | ||
| SYPRO orange | fluorescent stain to detect protein in SDS-PAGE gel | ||
| Thermomixer | Starlab | ||
| THROMBIN, FROM HUMAN PLASMA | Sigma | 10602400001 | Dissolve 20 units in 1 mL of milli-Q water and prepare 25 µL aliquots in 0.5 mL Eppendorf tubes. Then freeze and store at -80 °C. |
| Tris, ultra pure | MP | 819623 | |
| Ultracentrifuge L90K | Beckman | ||
| UV/Visible absorbance spectrophotometer | SAFAS | ||
| UV/visible spectrofluorometer with a temperature-controlled cell holder and stirring device | Jasco or Shimadzu | Jasco FP-8300 or Shimadzu RF-5301PC | |
| Vacuum chamber | |||
| Water bath | Julabo | ||
| XK 16/70 column packed with Sephacryl S200HR | GE healthcare |
References
- Drin, G. Topological regulation of lipid balance in cells. Annual Review of Biochemistry. 83, 51-77 (2014).
- Bigay, J., Antonny, B. Curvature, lipid packing, and electrostatics of membrane organelles: defining cellular territories in determining specificity. Developmental Cell. 23 (5), 886-895 (2012).
- Prinz, W. A. Lipid trafficking sans vesicles: where, why, how. Cell. 143 (6), 870-874 (2010).
- Holthuis, J. C., Menon, A. K. Lipid landscapes and pipelines in membrane homeostasis. Nature. 510 (7503), 48-57 (2014).
- Wong, L. H., Copic, A., Levine, T. P. Advances on the transfer of lipids by lipid transfer proteins. Trends in Biochemical Sciences. 42 (7), 516-530 (2017).
- Wong, L. H., Gatta, A. T., Levine, T. P. Lipid transfer proteins: the lipid commute via shuttles, bridges and tubes. Nature Reviews Molecular Cell Biology. 20 (2), 85-101 (2019).
- Iaea, D. B., Dikiy, I., Kiburu, I., Eliezer, D., Maxfield, F. R. STARD4 membrane interactions and sterol binding. Biochemistry. 54 (30), 4623-4636 (2015).
- Wilhelm, L. P., et al. STARD3 mediates endoplasmic reticulum-to-endosome cholesterol transport at membrane contact sites. The EMBO Journal. 36 (10), 1412-1433 (2017).
- Bian, X., Saheki, Y., De Camilli, P. Ca(2+) releases E-Syt1 autoinhibition to couple ER-plasma membrane tethering with lipid transport. The EMBO Journal. 37 (2), 219-234 (2018).
- Horenkamp, F. A., Valverde, D. P., Nunnari, J., Reinisch, K. M. Molecular basis for sterol transport by StART-like lipid transfer domains. The EMBO Journal. 37 (6), 98002 (2018).
- Jentsch, J. A., et al. Structural basis of sterol binding and transport by a yeast StARkin domain. The Journal of Biological Chemistry. 293 (15), 5522-5531 (2018).
- Moser von Filseck, J., et al. INTRACELLULAR TRANSPORT. Phosphatidylserine transport by ORP/Osh proteins is driven by phosphatidylinositol 4-phosphate. Science. 349 (6246), 432-436 (2015).
- Daum, G., et al. Systematic analysis of yeast strains with possible defects in lipid metabolism. Yeast. 15 (7), 601-614 (1999).
- Ejsing, C. S., et al. Global analysis of the yeast lipidome by quantitative shotgun mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 106 (7), 2136-2141 (2009).
- Leidl, K., Liebisch, G., Richter, D., Schmitz, G. Mass spectrometric analysis of lipid species of human circulating blood cells. Biochimica et Biophysica Acta. 1781 (10), 655-664 (2008).
- Sampaio, J. L., et al. Membrane lipidome of an epithelial cell line. Proceedings of the National Academy of Sciences of the United States of America. 108 (5), 1903-1907 (2011).
- Vance, J. E., Steenbergen, R. Metabolism and functions of phosphatidylserine. Progress in Lipid Research. 44 (4), 207-234 (2005).
- Zinser, E., et al. Phospholipid synthesis and lipid composition of subcellular membranes in the unicellular eukaryote Saccharomyces cerevisiae. Journal of Bacteriology. 173 (6), 2026-2034 (1991).
- Leventis, P. A., Grinstein, S. The distribution and function of phosphatidylserine in cellular membranes. Annual Review of Biophysics. 39, 407-427 (2010).
- Yeung, T., et al. Membrane phosphatidylserine regulates surface charge and protein localization. Science. 319 (5860), 210-213 (2008).
- Kim, J., Shishido, T., Jiang, X., Aderem, A., McLaughlin, S. Phosphorylation, high ionic strength, and calmodulin reverse the binding of MARCKS to phospholipid vesicles. Journal of Biological Chemistry. 269 (45), 28214-28219 (1994).
- Sigal, C. T., Zhou, W., Buser, C. A., McLaughlin, S., Resh, M. D. Amino-terminal basic residues of Src mediate membrane binding through electrostatic interaction with acidic phospholipids. Proceedings of the National Academy of Sciences. 91 (25), 12253-12257 (1994).
- Gal Bivona, T., et al. PKC regulates a farnesyl-electrostatic switch on K-Ras that promotes its association with Bcl-XL on mitochondria and induces apoptosis. Molecular Cell. 21 (4), 481-493 (2006).
- Finkielstein, C. V., Overduin, M., Capelluto, D. G. Cell migration and signaling specificity is determined by the phosphatidylserine recognition motif of Rac1. The Journal of Biological Chemistry. 281 (37), 27317-27326 (2006).
- Bolsover, S. R., Gomez-Fernandez, J. C., Corbalan-Garcia, S. Role of the Ca2+/Phosphatidylserine Binding Region of the C2 Domain in the Translocation of Protein Kinase Cα to the Plasma Membrane. Journal of Biological Chemistry. 278 (12), 10282-10290 (2003).
- Vance, J. E., Tasseva, G. Formation and function of phosphatidylserine and phosphatidylethanolamine in mammalian cells. Biochimica et Biophysica Acta. 1831 (3), 543-554 (2013).
- Maeda, K., et al. Interactome map uncovers phosphatidylserine transport by oxysterol-binding proteins. Nature. 501 (7466), 257-261 (2013).
- D'Ambrosio, J. M., et al. Osh6 requires Ist2 for localization to ER-PM contacts and efficient phosphatidylserine transport in budding yeast. Journal of Cell Science. 133 (11), 243733 (2020).
- Manford, A. G., Stefan, C. J., Yuan, H. L., Macgurn, J. A., Emr, S. D. ER-to-plasma membrane tethering proteins regulate cell signaling and ER morphology. Developmental Cell. 23 (6), 1129-1140 (2012).
- Collado, J., et al. Tricalbin-mediated contact sites control ER curvature to maintain plasma membrane integrity. Developmental Cell. 51 (4), 476-487 (2019).
- Hoffmann, P. C., et al. Tricalbins contribute to cellular lipid flux and form curved ER-PM contacts that are bridged by rod-shaped structures. Developmental Cell. 51 (4), 488-502 (2019).
- Lipp, N. F., et al. An electrostatic switching mechanism to control the lipid transfer activity of Osh6p. Nature Communications. 10 (1), 3926 (2019).
- Chung, J., et al. INTRACELLULAR TRANSPORT. PI4P/phosphatidylserine countertransport at ORP5- and ORP8-mediated ER-plasma membrane contacts. Science. 349 (6246), 428-432 (2015).
- Sohn, M., et al. PI(4,5)P2 controls plasma membrane PI4P and PS levels via ORP5/8 recruitment to ER-PM contact sites. The Journal of Cell Biology. 217 (5), 1797-1813 (2018).
- Ghai, R., et al. ORP5 and ORP8 bind phosphatidylinositol-4, 5-biphosphate (PtdIns(4,5)P 2) and regulate its level at the plasma membrane. Nature Communications. 8 (1), 757 (2017).
- Sohn, M., et al. Lenz-Majewski mutations in PTDSS1 affect phosphatidylinositol 4-phosphate metabolism at ER-PM and ER-Golgi junctions. Proceedings of the National Academy of Sciences of the United States of America. 113 (16), 4314-4319 (2016).
- Kattan, W. E., et al. Targeting plasma membrane phosphatidylserine content to inhibit oncogenic KRAS function. Life Science Alliance. 2 (5), 00431 (2019).
- Du, X., Turner, N., Yang, H. The role of oxysterol-binding protein and its related proteins in cancer. Seminars in Cell & Developmental Biology. 81, 149-153 (2018).
- Galmes, R., et al. ORP5/ORP8 localize to endoplasmic reticulum-mitochondria contacts and are involved in mitochondrial function. EMBO reports. 17 (6), 800-810 (2016).
- Du, X., et al. ORP5 localizes to ER-lipid droplet contacts and regulates the level of PI(4)P on lipid droplets. The Journal of Cell Biology. 219 (1), 201905162 (2020).
- Wang, H., et al. ORP2 delivers cholesterol to the plasma membrane in exchange for phosphatidylinositol 4, 5-bisphosphate (PI(4,5)P2). Molecular Cell. 73 (3), 458-473 (2019).
- Kay, J. G., Grinstein, S. Sensing phosphatidylserine in cellular membranes. Sensors (Basel). 11 (2), 1744-1755 (2011).
- Moser von Filseck, J., Vanni, S., Mesmin, B., Antonny, B., Drin, G. A phosphatidylinositol-4-phosphate powered exchange mechanism to create a lipid gradient between membranes. Nature Communications. 6, 6671 (2015).
- Wills, R. C., Goulden, B. D., Hammond, G. R. V. Genetically encoded lipid biosensors. Molecular Biology of the Cell. 29 (13), 1526-1532 (2018).
- Raychaudhuri, S., Im, Y. J., Hurley, J. H., Prinz, W. A. Nonvesicular sterol movement from plasma membrane to ER requires oxysterol-binding protein-related proteins and phosphoinositides. The Journal of Cell Biology. 173 (1), 107-119 (2006).
- Lenoir, M., et al. Structural basis of wedging the Golgi membrane by FAPP pleckstrin homology domains. EMBO reports. 11 (4), 279-284 (2010).
- Liu, Y., Kahn, R. A., Prestegard, J. H. Interaction of Fapp1 with Arf1 and PI4P at a membrane surface: an example of coincidence detection. Structure. 22 (3), 421-430 (2014).
- Shao, C., Novakovic, V. A., Head, J. F., Seaton, B. A., Gilbert, G. E. Crystal structure of lactadherin C2 domain at 1.7A resolution with mutational and computational analyses of its membrane-binding motif. The Journal of Biological Chemistry. 283 (11), 7230-7241 (2008).
- Lipp, N. F., Ikhlef, S., Milanini, J., Drin, G. Lipid exchangers: cellular functions and mechanistic links with phosphoinositide metabolism. Frontiers in Cell and Developmental Biology. 8, 663 (2020).
- Venditti, R., et al. Molecular determinants of ER-Golgi contacts identified through a new FRET-FLIM system. The Journal of Cell Biology. 218 (3), 1055-1065 (2019).
- Pemberton, J. G., et al. Defining the subcellular distribution and metabolic channeling of phosphatidylinositol. The Journal of Cell Biology. 219 (3), (2020).
- Nakanishi, H., de los Santos, P., Neiman, A. M. Positive and negative regulation of a SNARE protein by control of intracellular localization. Molecular Biology of the Cell. 15 (4), 1802-1815 (2004).
- Maekawa, M., Yang, Y., Fairn, G. D. Perfringolysin O theta toxin as a tool to monitor the distribution and inhomogeneity of cholesterol in cellular membranes. Toxins. 8 (3), 67 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved