Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Флуоресцентные измерения обмена фосфатидилсерина/фосфатидилинозитола 4-фосфата между мембранами
В этой статье
Резюме
Здесь мы описываем протоколы с использованием флуоресцентных липидных датчиков и липосом, чтобы определить, извлекает ли белок и транспортирует ли он фосфатидилсерин или фосфатидилинозитол 4-фосфат in vitro.
Аннотация
Недавно было обнаружено, что несколько членов семейства гомологов (Ош), связанных с оксистерол-связывающим белком (OSBP) / OSBP (Osh), представляют собой новую группу липидных трансферных белков (LTP) в дрожжах и клетках человека. Они переносят фосфатидилсерин (PS) из эндоплазматического ретикулума (ER) в плазматическую мембрану (PM) через циклы обмена PS/фосфатидилинозитол 4-фосфат (PI(4)P). Это открытие позволяет лучше понять, как PS, который имеет решающее значение для сигнальных процессов, распределяется по всей клетке, и исследование связи между этим процессом и метаболизмом фосфоинозитида (PIP). Разработка новых протоколов на основе флуоресценции сыграла важную роль в открытии и характеристике этого нового клеточного механизма in vitro на молекулярном уровне. В данной работе описывается производство и использование двух флуоресцентно меченых липидных датчиков, NBD-C2Lact и NBD-PHFAPP,для измерения способности белка извлекать PS или PI(4)P и переносить эти липиды между искусственными мембранами. Во-первых, протокол описывает, как производить, маркировать и получать образцы высокой чистоты этих двух конструкций. Во-вторых, в этой статье объясняется, как использовать эти датчики с флуоресцентным считывателем микропластин, чтобы определить, может ли белок извлекать PS или PI(4)P из липосом, используя Osh6p в качестве тематического исследования. Наконец, этот протокол показывает, как точно измерить кинетику обмена PS/PI(4)P между липосомами определенного липидного состава и определить скорость переноса липидов путем флуоресцентного резонансного переноса энергии (FRET) с использованием стандартного флуорометра.
Введение
Точное распределение липидов между различными мембранами и внутри мембран эукариотических клеток1,2 имеет глубокие биологические последствия. Расшифровка того, как функционируют LFP, является важным вопросом в клеточной биологии3,4,5,6,и подходы in vitro имеют большое значение для решения этой проблемы7,8,9,10,11. Здесь представлена стратегия in vitro,основанная на флуоресценции, которая сыграла важную роль в установлении того, что несколько белков ОВП/Ош влияют на обмен PS/PI(4)P между клеточными мембранами12 и тем самым составляют новый класс ЛТП. PS представляет собой анионный глицерофосфолипид, который составляет 2-10% от общего количества мембранных липидов в эукариотических клетках13,14,16. Он распределяется по градиенту между ER и PM, где составляет 5-7% и до 30% глицерофосфолипидов соответственно17,18,19. Кроме того, PS по существу концентрируется в цитозольном листке ТЧ. Это накопление и неравномерное разделение PS в PM имеют решающее значение для клеточных сигнальных процессов19. Благодаря отрицательному заряду молекул PS, цитозольный листок PM гораздо более анионный, чем цитозольный листок других органелл1,2,19,20. Это позволяет рекрутировать с помощью электростатических сил сигнальные белки, такие как миритоилированный богатый аланином субстрат С-киназы (MARCKS)21,саркома (Src)22,вирусный онкоген саркомы Кирстен-крысы (K-Ras)23и связанный с Ras субстрат ботулинического токсина C3 1 (Rac1)24, которые содержат участок положительно заряженных аминокислот и липидный хвост.
PS также распознается обычной протеинкиназой C стереоселективным образом через домен C225. Однако PS синтезируется в ER26,что указывает на то, что он должен быть экспортирован в PM, прежде чем он сможет играть свою роль. Не было известно, как это было достигнуто19, пока не было обнаружено, что в дрожжах Osh6p и Osh7p переносят PS из ER в PM27. Эти LFP принадлежат к эволюционно сохраненной семье у эукариот, членом-основателем которых является OSBP и который содержит белки (ОВП у человека, Ошские белки в дрожжах), интегрируя связанный с OSBP домен (ORD) с карманом для размещения липидной молекулы. Osh6p и Osh7p состоят только из ОРД, структурные особенности которого адаптированы для специфическиго связывания ПС и переноса его между мембранами. Тем не менее, как эти белки направленно передавали PS из ER в PM, было неясно. Osh6p и Osh7p могут захватывать PI(4)P в качестве альтернативного липидного лиганда12. В дрожжах PI(4)P синтезируется из фосфатидилинозитала (PI) в Гольджи и PM с помощью PI 4-киназ, Pik1p и Stt4p соответственно. Напротив, в мембране ER нет PI(4)P, так как этот липид гидролизуется в PI фосфатазой Sac1p. Следовательно, градиент PI(4)P существует как на интерфейсах ER/Golgi, так и на интерфейсах ER/PM. Osh6p и Osh7p передают PS из ER в PM через обменные циклы PS/PI(4)P с использованием градиента PI(4)P, который существует между этими двумя мембранами12.
В течение одного цикла Osh6p извлекает PS из ER, обменивает PS на PI(4)P в PM и передает PI(4)P обратно в ER для извлечения другой молекулы PS. Osh6p / Osh7p взаимодействуют с Ist2p28, одним из немногих белков, которые соединяют и приводят мембрану ER и PM в непосредственное соседство друг с другом для создания контактных сайтов ER-PM в дрожжах29,30,31. Кроме того, ассоциация Osh6p с отрицательно заряженными мембранами становится слабой, как только белок извлекает один из своих липидных лигандов из-за конформационного изменения, которое изменяет его электростатические особенности32. Это помогает Osh6p, сокращая время пребывания мембраны, тем самым поддерживая эффективность его активности переноса липидов. В сочетании с привязкой к Ist2p этот механизм может позволить Osh6p/7p быстро и точно выполнять липидный обмен на интерфейсе ER/PM. В клетках человека белки ORP5 и ORP8 осуществляют обмен PS/PI(4)P в контактных местах ER-PM с помощью различных механизмов33. Они имеют центральный ORD, похожий на Osh6p, но непосредственно привязаны к ER через C-концевой трансмембранный сегмент33 и стыкуются с PM через N-концевую область гомологии Плекстрина (PH), которая распознает PI(4)P и PI(4,5)P233,34,35. ORP5/8 используют PI(4)P для передачи PS, и было показано, что ORP5/8 дополнительно регулируют уровни PI(4,5)P2 и, предположительно, модулируют сигнальные пути. В свою очередь, снижение уровней PI(4)P и PI(4,5)P2 снижает активность ORP5/ORP8, поскольку эти белки связываются с PM в зависимости от PIP. Аномально высокий синтез PS, который приводит к синдрому Ленца-Маевского, влияет на уровни PI(4)P через ORP5/836. Когда активность обоих белков блокируется, PS становится менее обильным в PM, снижая онкогенную способность сигнальных белков37.
И наоборот, сверхэкспрессия ОВП5, по-видимому, способствует инвазии раковых клеток и метастатическим процессам38. Таким образом, изменения активности ORP5/8 могут серьезно модифицировать клеточное поведение через изменения липидного гомеостаза. Кроме того, ORP5 и ORP8 занимают контактные участки ER-митохондрий и сохраняют некоторые митохондриальные функции, возможно, путем поставки PS39. Кроме того, ORP5 локализуется в местах контакта ER-липидных капель для доставки PS к липидным каплям путем обмена PS/PI(4)P40. Описанная в настоящем документе стратегия измерения (i) экстракции PS и PI(4)P из липосом и (ii) переноса PS и PI(4)P между липосомами была разработана для установления и анализа обменной активности PS/PI(4)P Osh6p/Osh7p12,32 и используется другими группами для анализа активности ORP5/ORP835 и других ЛТП10, 41г. Он основан на использовании флуоресцентного пластинчатого считывателя, стандартного спектрофлуфультометра L-формата и двух флуоресцентных датчиков, NBD-C2Lact и NBD-PHFAPP,которые могут обнаруживать PS и PI(4)P соответственно.
NBD-C2Lact соответствует домену C2 гликопротеина, лактадхерина, который был реконтруирован, чтобы включить уникальный цистеин, подвергающийся воздействию растворителя, вблизи предполагаемого места связывания PS; чувствительный к полярности ФБД (7-нитробенз-2-окса-1,3-диазол) флуорофор ковалентно связан с этимостатком (рисунок 1А)12. Чтобы быть более точным, домен C2 лактадерина (Bos taurus, UniProt: Q95114, остатки 270-427) был клонирован в вектор pGEX-4T3 для экспрессии в слиянии с глутатион S-трансферазой (GST) в Escherichia coli. Затем последовательность C2Lact мутировали, чтобы заменить два доступных растворителями остатка цистеина (C270, C427) остатками аланина и ввести остаток цистеина в область вблизи предполагаемого ps-сайта связывания (мутация H352C), которая впоследствии может быть помечена N,N'-диметил-N-(йодоацетил)-N'-(7-нитробенз-2-окса-1,3-диазол-4-ил)этилендиамином (IANBD) 12. Участок расщепления тромбина присутствует между белком GST и N-концем домена C2. Основным преимуществом является то, что этот домен выборочно распознает PS в Ca2+-независимом порядке, в отличие от других известных доменов C2 или Annexin A542. NBD-PHFAPP получен из домена PH человеческого четырехфосфат-адапторного белка 1 (FAPP1), который был реинжининерирован для включения одного цистеина, подвергающегося воздействию растворителя, который может быть помечен группой NBD вблизи сайта связывания PI(4)P(рисунок 1A)43. Нуклеотидная последовательность домена PH человеческого белка FAPP (UniProt: Q9HB20, сегмент [1-100]) была клонирована в вектор pGEX-4T3 для экспрессии в тандеме с меткой GST. Последовательность PHFAPP была модифицирована для вставки уникального остатка цистеина в мембраносвязывающий интерфейс белка43. Кроме того, между участком расщепления тромбина и N-конечной стороной домена PH был введен линкер с девятью остатками для обеспечения доступности протеазы.
Для измерения экстракции PS из липосом NBD-C2Lact смешивают с липосомами, состоящими из фосфатидилхолина (PC), содержащими следовые количества PS. Благодаря своему сродству к PS, эта конструкция связывается с липосомами, и флуорофор NBD испытывает изменение полярности при контакте с гидрофобной средой мембраны, что вызывает синий сдвиг и увеличение флуоресценции. Если PS извлекается почти полностью стехиометрическим количеством LTP, зонд не связывается с липосомами, а сигнал NBD ниже(Рисунок 1B)32. Эта разница в сигнале используется для определения того, извлекает ли LTP(например, Osh6p) PS. Аналогичная стратегия используется с NBD-PHFAPP для измерения извлечения PI(4)P(рисунок 1B),как описаноранее 12,32. Два анализа на основе ФРЕТ были разработаны для (i) измерения переноса PS от LA до LB липосом, которые имитируют мембрану ER и PM, соответственно, и (ii) перенос PI(4)P в обратном направлении. Эти анализы выполняются в одинаковых условиях(т.е. одинаковый буфер, температура и концентрация липидов) для измерения обмена PS/PI(4)P. Для измерения транспорта PS NBD-C2Lact смешивают с липосомами LA, состоящими из PC, и легируют 5 моль% PS и 2 моль% флуоресцентного фосфатидилэтаноламина(Rhod-PE)-и LB липосом, включающих 5 моль% PI(4)P.
В нулевое время FRET с Rhod-PE гасят флуоресценцию NBD. Если PS транспортируется из липосом LA в LB (например, при инъекции Osh6p), происходит быстрое закапливание за счет транслокации молекуллакта NBD-C2 из липосом LA в LB (рисунок 1C). Учитывая количество доступного PS, NBD-C2Lact остается по существу в мембранно-связанном состоянии в течение эксперимента12. Таким образом, интенсивность сигнала NBD напрямую коррелирует с распределением NBD-C2Lact между липосомами LA и LB и может быть легко нормализована для определения того, сколько PS передается. Для измерения переноса PI(4)P в противоположном направлении NBD-PHFAPP смешивают с липосомами LA и LB; учитывая, что он связывается только с липосомами LB, которые содержат PI(4)P, но не Rhod-PE, его флуоресценция высока. Если PI(4)P переносится в липосомы LA, он переносится на эти липосомы, и сигнал уменьшается из-за FRET с Rhod-PE(рисунок 1C). Сигнал нормализуется, чтобы определить, сколько PI(4)P передается43.
протокол
1. Очисткалакта NBD-C2
ПРИМЕЧАНИЕ: Хотя этот протокол подробно описывает использование разрушителя клеток для разрушения бактерий, он может быть модифицирован для использования других стратегий лизиса(например, французская пресса). В начале очистки в обязательном порядке используется буфер, который только что дегазирован, отфильтрован и дополнен 2 мМ дитиотрейтолом (DTT) для предотвращения окисления цистеина. Однако для этапа маркировки белка крайне важно полностью удалить DTT. Многие шаги должны быть выполнены на льду или в холодном помещении, чтобы избежать деградации белка. Образцы объемом 30 мкл должны быть собраны на разных этапах протокола для выполнения анализа методом электрофореза додецилсульфат-полиакриламидного геля натрия (SDS-PAGE) с использованием 15% акриламидного геля для проверки хода очистки. Смешайте достаточное количество денатурировавого буфера образца Laemmli с каждой аликвотой и нагрейте смесь при 95 °C. Заморозьте и храните трубки при -20 °C до анализа.
- Экспрессия GST-C2Lact в кишечной палочке
- Смешайте 20 мкл компетентных клеток BL21 Gold с 18 мкл стерилизованной воды. Затем смешайте 2 мкл плазмиды pGEX-C2Lact (при ~ 65 нг / мкл) с бактериями и преобразуйте их электропорацией. Повторное суспендирование бактерий 150 мкл автоклавной среды Lennox Lysogeny-Broth (LB) (10 г / л триптона, 5 г / л дрожжевого экстракта, 5 г / л NaCl в деионизированной воде, без глюкозы). Дайте бактериям расти при 37 °C в течение 1 ч в микроцентрифуге емкостью 2 мл.
- Инокулируют 25 мл LB-среды, дополненной ампициллином 50 мкг/мл, 150 мкл бактериальной суспензии в 125 мл стерильной колбы Эрленмейера. Поместите колбу в орбитальный шейкер при 37 °C и дайте бактериям расти в течение ночи с перемешиванием при 185 оборотах в минуту.
- Заполните две стерильные 2-л колбы Эрленмейера 500 мл среды LB, дополненной 50 мкг/мл ампициллина, и добавьте 5 мл прекультурной суспензии. Дайте бактериям расти при 37 °C с перемешиванием при 220 оборотах в минуту.
- Периодически измеряют оптическую плотность (OD) суспензии на длине волны (λ) 600 нм. Когда ОД достигнет значения ~0,6-0,7, добавьте 500 мкл запасного раствора 1 М изопропил β-D-1-тиогалакопиранозида (IPTG) в каждую колбу, чтобы инициировать экспрессию GST-C2Lact. Встряхните колбы при 185 об/мин в течение 4 ч при 37 °C.
- Перенесите содержимое каждой колбы в бутылку полипропиленоцентрифуги. Центрифугировать две бутылки в течение 30 мин при 4600 × г при 4 °C, чтобы гранулировать бактерии. Выбросьте супернатант и повторно суспендировать каждую гранулу в 50 мл холодного фосфатно-буферного физиологического раствора.
- Перенесите бактериальную суспензию, содержащуюся в каждом флаконе, в коническую центрифужную трубку объемом 50 мл. Центрифугировать две трубки в течение 30 мин при 2300 × г при 4°C. Удалите супернатант и храните пробирки, каждая из которых содержит бактериальную гранулу, при -20 °C.
- Очистка C2Лакт
- На льду заполните две конические центробежные трубки объемом 50 мл 50 мл буфера, содержащего 50 мМ Tris-HCl, pH 7,4 и 150 мМ NaCl (далее называемый буфером TN), предварительно отфильтрованный и дегазированный мембранной вакуумной фильтрацией.
- Чтобы приготовить буфер лизиса в каждой пробирке, растворите таблетку этилендиамина тетрауксусного бескислотного коктейля ингибитора протеазы в буфере TN путем мягкой ультразвуковой облицовки или вихря. Добавьте другие антипротеазы (10 мкМ бестатина, 1 мкг/мл пепстатина А и 10 мкМ фосфорамидона). Важно дополнить буфер 2 мМ DTT.
- Заполните две пробирки, содержащие бактериальные гранулы, приготовленные на этапе 1.1.6, буфером лизиса для получения окончательного объема 30 мл в каждой пробирке и медленно разморозьте гранулы на льду в течение 10 мин. Раздавите каждую гранулу шпателем из нержавеющей стали и повторно суспендируем их путем вихрения трубок и/или пипетки подвески вперед и назад с помощью контроллера пипетки и пипетки 25 мл до получения однородной суспензии.
- Выполняют лизис с использованием предварительно охлажденного разрушителя клеток (см. Таблицу материалов),загружая 30 мл образца внутрь резервуара и запуская разрывной цикл в непрерывном режиме с давлением 1,6 бар. Соберите лизат в ту же пробирку, держите трубку на льду и немедленно добавьте 250 мкл из запасного раствора фенилметилсульфонилфторида 200 мМ (PMSF), приготовленного в изопропаноле.
- Выполуйте другой образец, выполнив ту же процедуру. Используйте оставшуюся часть буфера лизиса для промывки разрушителя клеток и соберите промывку, чтобы отрегулировать объем каждого лизата (~ 30 мл) до конечного объема 50 мл.
- Дополняйте каждый лизат 5 мМMgCl2и добавляйте 20 мкг/мл DNAse I, чтобы фрагментировать ДНК и, таким образом, уменьшить вязкость образца. Насиживать на льду в течение 30 мин. Соберите образец для анализа на гель.
- Переложите каждые 50 мл лизакта в предварительно охлажденный поликарбонат ультрацентрифужный трубок (всего два, см. Таблицу материалов). Центрифуга при 186 000 × г при 4 °C в течение не менее 1 ч с использованием ультрацентрифуги.
- Параллельно со скоростью центрифугирования дозируют 1,4 мл суспензии, содержащей глутатион, соединенные с 4% шариками агарозы, в две конические центробежные трубки по 50 мл, добавляют 20 мл буфера TN, дополненного 1 мМ DTT (буфер TND) в каждую трубку, центрифугируют при 1200 × г в течение 5 мин и отбрасывают супернатант. Повторите этот шаг стирки дважды.
- После центрифугирования бактериального лисата удалите образец 30 мкл из супернатанта и перенесите супернатант из каждой ультрацентрифужной трубки в соответствующую коническую центрифужную трубку размером 50 мл, которая содержит чистые шарики. Для анализа геля повторно суспендируют гранулы мусора в одной из ультрацентрифужных пробирок с буфером TND 50 мл и соберут образец 30 мкл.
- Поместите трубки на ротатор на 3-4 ч при 4 °C для получения однородной шариковой суспензии. Суспензии шариков совмещают в пустой колонок хроматографии 25 мл. Дайте шарикам декант и удалите буферные и несвязанные белки гравитационным потоком. Возьмите образец из элюата для анализа.
- Повторно суспендировать шарики с 20 мл буфера TND и собрать элюат гравитационным потоком. Повторите этот шаг дважды, чтобы полностью вымыть бусины. Объедините собранные элюаты и сохраните образец 30 мкл для дальнейшего анализа.
ПРИМЕЧАНИЕ: После короткого декантирования объем ~2 мл суспензии бусины, к которой прикрепляется GST-C2Lact, отложения на дне колонны. - Добавьте 1 мл бисероплетения в две микроцентрифужные трубки с защелкивающейся крышкой по 2 мл. Заполните каждую трубку буфером TND до конечного объема 1,970 мл. Возьмите образец 30 мкл из одной пробирки для дальнейшего анализа (образец B1). Добавляют 10 мкл 10 мМ раствораCaCl2 и 25 мкл из запасного раствора раствора тромбинпротеазы человека при 0,02 Ед/мкл.
- Поместите две трубки на ротатор при 4 °C в течение ночи, чтобы тромбин отщепил метку GST от домена C2Lact. На следующий день в каждой пробирке смешайте 10 мкл 200 мМ раствора PMSF со суспензией шарика для ингибирования тромбиновой деятельности.
- Центрифугируют пробирки при 700 × г в течение 5 мин и собирают из каждой трубки супернатант, который содержит растворимый домен C2Lact, не беря шарики. Объедините супернатанты в микроцентрифужную трубку с защелкивающейся крышкой 2 мл (элюат E1), которая хранится на льду.
- Добавьте 1 мл буфера TND в каждую трубку, чтобы повторно суспендировать бусины, и промыть их; повторите шаг 1.2.14. Выполните этот шаг еще трижды, чтобы восстановить максимальное количество белка. Каждый раз объединяйте собранные супернатанты в новую трубку размером 2 мл (элюаты E2, E3, E4 и E5) и принимайте аликвоту для дальнейшего анализа. В конце шагов стирки возьмите аликвоту из шариковой суспензии (аликвота В2).
- Проанализируйте образцы 30 мкл, которые были собраны на различных этапах протокола очистки с помощью разделения SDS-PAGE на 15% акриламидном геле.
- Удалите потенциальные загрязняющие шарики, объединив все супернатанты(т.е.~ 10 мл), собранные на этапах 1.2.14 и 1.2.15, в 10 мл хроматографическую колонку. Соберите элюат гравитационным потоком и сохраните бусины в нижней части колонны.
- Концентрируйте образец C2Lact с помощью центробежного фильтрующего блока с отсечкой молекулярной массы (MWCO) 3 кДа и скоростью центрифугирования 2300 × г. Прекратите процедуру концентрации, когда объем образца белка составляет ~1 мл.
- Приготовление и очистка NBD-C2Лакт
- Уравновешивание обессоливляющего столбца (см. Таблицу материалов)с помощью буфера TN. Загрузите колонну 1 мл концентрированного образца C2Lact. Дайте образцу полностью войти в гель-слое, добавьте 1,5 мл свежегазированного буфера TN без DTT в колонку и соберите элюат гравитационным потоком в микроцентрифужную трубку с защелкивающейся крышкой 2 мл.
- Разбавить 50 мкл элюата в конечном объеме 300 мкл TN буфера и записать спектр поглощения от 230 до 450 нм, используя чистый TN-буфер в качестве заготовки. Определить концентрацию C2Lact на основе поглощения, измеренной при 280 нм, учитывая коэффициент вымирания ε равный 44 920 М-1,см-1.
- Чтобы маркировать конструкцию C2Lact флуорофором NBD, смешайте белок с десятикратным молярным избытком N,N'-диметил-N-(йодоацетил)-N' -(7-нитробенз-2-окса-1,3-диазол-4-ил)этилендиамин (АМИД IANBD).
- Растворить 1 мг IANBD в безводном диметилформамиде (DMF), имея в виду, что конечный объем DMF, используемый для маркировки конструкции C2Lact, не должен превышать 5% (v/v) от объема образца белка.
- Чтобы определить объем DMF (VDMF)для растворения IANBD, сначала рассчитайте необходимое количество IANBD (m, выраженное в мг) для маркировки белка с помощью формулы 1.
m = 10 000 × C × В ×МВт IANBD (1)
где C - концентрация C2Lact, измеренная на этапе 1.3.2, V - объем образца C2Lact, а MWIANBD - молекулярная масса флуорофора (420 г/моль). - Вычисление VDMF по формулам 2 (с m0= 1) и 3.
VДМФ=(м 0/м) × VИАНБД (2)
VИАНБД=0,05 × В (3)
Где m0 - количество порошка IANBD в мг, а VIANBD - объем раствора IANBD, добавляемого к образцу C2Lact. - Добавьте объем VIANBD свежеприготовленного раствора IANBD к образцу C2Lact и встряхните реакционную смесь при 800-900 об/мин в течение 30 мин при 25 °C с помощью термомикшера, защищенного от света. Дайте реакции продолжаться в течение 90 минут на льду. Тем временем очистите центробежный фильтрующий блок (MWCO= 3 кДа) с буфером TN 10 мл.
- Добавьте L-цистеин (в 10-кратном молярном избытке к IANBD) в реакционную смесь для инактивации свободного IANBD.
- Добавьте 15 мл буфера TN в раствор NBD-C2Lact и перенесите раствор NBD-C2Lact в центробежный фильтрующий блок. Сконцентрируйте образец до 2 мл, чтобы отделить большую часть свободного NBD от белка путем центрифугирования при 2300 × г. Повторите этот шаг стирки два раза. Центрифугируйте образец в центрифужной трубке с защелкивающейся крышкой 2 мл в течение 10 мин при 19 000 × г при 4 °C в гранулированные потенциальные агрегаты и соберите супернатант.
- Разбавить 50 мкл элюата в конечном объеме 300 мкл буфера TN. Регистрируют спектр поглощения от 230 до 650 нм с использованием элюата, собранного во время процедуры концентрации, в виде заготовки. Определяют концентрацию NBD-C2Lact с использованием максимальной абсорбции при λ=280 и 495 нм и коэффициентов вымирания ε= 44 920М-1,см-1(белок) и 25 000 М-1,см-1 (флуорофор NBD).
ПРИМЕЧАНИЕ: Если два значения концентрации одинаковы, это указывает на то, что конструкция C2Lact помечена в соотношении 1:1 с группой NBD. - Если концентрация NBD-C2Lact, рассчитанная на основе измерения абсорбции NBD, превышает концентрацию, рассчитанную по абсорбции остатков триптофана (Trp), повторите этап 1.3.5 для дальнейшего удаления свободного NBD.
- Добавьте глицерин в образец для получения конечной концентрации 10% (v/v) для криозащиты конструкции NBD-C2Lact во время мгновенного замораживания. Измерьте конечную концентрацию белка.
- Приготовьте 50 мкл аликвот белка в микроцентрифужных трубках с защелкивающейся крышкой 0,5 мл. Воспыхивайте трубки в жидком азоте и храните их при -80 °C.
2. Очистка NBD-PHFAPP
ПРИМЕЧАНИЕ: Процедура производства и маркировки PHFAPP идентична процедуре NBD-C2Lact до переноса раствора NBD-C2Lact в центробежный фильтрующий блок на этапе 1.3.4. Начиная с этого шага, следуйте протоколу, описанного ниже.
- После этапа концентрации хранить 2 мл NBD-PHFAPP при 4 °C в темноте не более 1 дня перед выполнением хроматографии с исключением размера. Перед хроматографией с исключением размера убедитесь, что на дне трубки нет оранжевого отложения (агрегации во время концентрации). Если это так, центрифугируют образец при 540 000 × г в течение 10 мин при 4 °C и очищают супернатант с помощью размерно-исключающей хроматографии.
ПРИМЕЧАНИЕ: Размерно-исключаемую хроматографию выполняют на колонке, заполненной сшитым декстран-акриламидным сополимером (см. Таблицу материалов),предварительно уравновешенной буфером TND, с использованием системы быстрой жидкостной хроматографии белка (см. Таблицу материалов). Колонна должна быть защищена от света. Использовался расход 1 мл/мин, а за элюцией конструкции NBD-PHFAPP следовала регистрация поглощения при λ=280 (белок) и 480 нм (NBD) на выходе из колонны.- Впрыскивайте в колонку образец NBD-PHFAPP, загруженный в инжекционную петлю 2 мл, и немедленно соберите фракции элюата 2,5 мл.
- Проанализируйте все фракции, которые соответствуют основному пику, обнаруженной при 280 и 480 нм на 15% геле SDS-PAGE. Смешайте образец каждой фракции объемом 25 мкл с 15 мкл буфера образцов Laemmli перед нагреванием и загрузкой на гель.
ПРИМЕЧАНИЕ: Основной пик, который одновременно обнаруживается при λ= 280 и 480 нм, появляется после пропускания через столбец буфера объемом ~150 мл. - Объедините фракции, которые содержат исключительно белок NBD-PHFAPP (~ 12,2 кДа), и добавьте глицерин в конечной концентрации 10% (v/v). Сконцентрировать образец с помощью центробежного фильтрующего блока с MWCO 3 кДа до конечного объема 1 мл с использованием скорости центрифугирования 2300 × г.
- Подготовьте аликвоты и запишите спектр поглощения, как описано для NBD-C2Lact. Используйте коэффициент вымирания ε = 29 450М -1,см-1 для определения концентрации белка на основе поглощения, измеренной при λ = 280 нм.
3. Подготовка липосом для экстракции ИЛИ ПЕРЕНОСА PS и PI(4)P
ПРИМЕЧАНИЕ: Выполните все шаги при комнатной температуре, если не указано иное. С осторожностью относитесь к органическим растворителям, ротавапору и жидкому азоту.
- Готовят свежий, отфильтрованный и дегазированный 50 мМ 4-(2-гидроксиэтил)-1-пиперазинеэтансульфоновая кислота (HEPES)-гидроксид калия (KOH), буфер рН 7,4, 120 мМ буфер ацетата калия (HK).
- Для каждого типа липосом берут точное количество различных липидов из бульонных растворов и смешивают их в грушевидной стеклянной колбе объемом 25 мл(таблица 1). Добавьте чистый хлороформ, чтобы отрегулировать объем каждой смеси до 1 мл. Пометьте каждую колбу названием липосомы. Оберните колбы, содержащие липидную смесь, легированную Род-ПЭ, алюминиевой фольгой.
- Поместите колбу на вращающийся испаритель. Сушите липиды под вакуумом и при 25 °C в течение не менее 30 мин со скоростью вращения 500 об/мин. Для липидных пленок, содержащих PI(4)P, предварительно прогрейте колбу при 32-34 °C в течение 5 мин, при мягком вращении, чтобы правильно смешать PI(4)P с другими липидами перед созданием вакуума в колбе для удаления растворителя, который оставит после себя пленку сухих липидов на стенке колбы.
- Отсоедините колбу от испарителя и поместите ее в вакуумную камеру на 45 минут, чтобы удалить оставшиеся следы растворителя. Наполните колбу 2 мл буфера HK и добавьте в раствор несколько стеклянных шариков диаметром 4 мм. Осторожно вихрьте колбу в течение 2 мин, чтобы повторно суспендировать липиды и приготовить многоламелярные липидные везикулы (MLV) с концентрацией липидов 4 мМ. Приготовьте 0,5 мл аликвот МЛВ в трубках микроцентрифуги с винтовой крышкой 1,5 мл.
- Заморозьте-разморозьте трубки в 5 раз (используя жидкий азот и водяную баню при 37 °C соответственно). Экструдировать липосомы или хранить их при -20 °C.
- Используйте мини-экструдер для подготовки липосом(т.е. больших одноламелярных везикул) из MVS в соответствии с рекомендациями производителя. Используйте поликарбонатный фильтр с однородными цилиндрическими порами диаметром 200 нм.
- Для приготовления каждого типа липосом экструдируют по меньшей мере 250 мкл соответствующей суспензии MVS. Храните экструдированные липосомы при 4 °C и в темноте, если они содержат Rhod-PE. Используйте липосомы в течение 2 дней.
| Липидный состав (моль/моль) | Липид | |||||
| Название липосомы | ДОПК (25 мг/мл) | СОЗ (10 мг/мл) | 16:0 Лисс Род-ПЭ (1 мг/мл) | C16:0/C16:0-PI(4)P (1 мг/мл) | ||
| Экстракционные анализы | Липосома 2 моль% PS | ПК/ПС 98/2 | 247 мкл | 12.5 мкл | ||
| Липосома 2 моль% PI(4)P | ПК/ПИ(4)P 98/2 | 247 мкл | 153 мкл | |||
| PC липосома | ПК 100 | 252 мкл | ||||
| Транспортные анализы | ЛА | ПК/ПС/Род-ПЭ 93/5/2 | 234 мкл | 31.4 мкл | 200 мкл | |
| LA без PS | ПК/Род-ПЭ 98/2 | 247 мкл | 200 мкл | |||
| ЛБ | ПК/ПИ(4)P 95/5 | 237 мкл | 383 мкл | |||
| LB без PI(4)P | ПК 100 | 252 мкл | ||||
| LA-Eq | ПК/ПС/ПИ(4)П/Род-ПЕ 93/2.5/2.5/2 | 234 мкл | 15.7 мкл | 200 мкл | 191 мкл | |
| LB-Eq | ПК/ПС/ПИ(4)P 95/2.5/2.5 | 239 мкл | 15.7 мкл | 191 мкл | ||
Таблица 1: Объемы растворов липидного запаса, которые необходимо смешать для получения липосом. Сокращения: PS= фосфатидилсерин; PC = фосфатидилхолин; PI(4)P = фосфатидилинозитол 4-фосфат; Род-ПЭ = меченый родамином фосфатидилэтаноламин; DOPC = диолеоилфосфатидилхолин; POPS= 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфо-L-серин; 16:0 Liss Rhod-PE = 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-(лиссамин родамин B сульфонил).
4. Измерение извлечения PS или PI(4)P
ПРИМЕЧАНИЕ: Измерения должны проводиться с использованием черной 96-скважинной пластины и считывателя флуоресцентных пластин, оснащенных монохроматорами: один для флуоресцентного возбуждения и один для излучения, с переменной полосой пропускания.
- Приготовьте свежий, отфильтрованный и дегазированный HK-буфер, дополненный 1 мМ MgCl2 (буфер HKM). Готовят чистые липосомы PC и липосомы PC, легированные 2 моль% PS или 2 моль% PI(4)P (конечная концентрация липидов 4 мМ, см. Таблицу 1).
ПРИМЕЧАНИЕ: Держите трубки, заполненные суспензией экструдированных липосом, при комнатной температуре на протяжении всего эксперимента и храните белки на льду. Кроме того, защитите липидные датчики от света. - Для экстракционного анализа PS в одной скважине смешайте липосомы, содержащие 2 моль% PS (конечная концентрация липидов 80 мкМ, доступная концентрация PS 0,8 мкМ) с NBD-C2Lact (конечная концентрация 250 нМ) в конечном объеме 100 мкл. Заполните вторую скважину таким же количеством липосом (80 мкМ, 2 моль% PS) и NBD-C2Lact (250 нМ), смешанных с 3 мкМ LTP (Osh6p в качестве положительного контрольного или интересуемого белка).
ПРИМЕЧАНИЕ: Время инкубации 5 мин достаточно для Osh6p для достижения экстракции липидов. - Заполните третью скважинулактом NBD-C2 (250 нМ), смешанным с чистыми липосомами ПК (80 мкМ). Заполните четвертую скважину только чистыми липосомами ПК (80 мкМ). Повторите шаги 4.2-4.3 для подготовки трех дополнительных серий из четырех скважин.
- Для каждой скважины регистрируют спектр NBD от 505 до 650 нм (полоса пропускания 5 нм) при возбуждении при 490 нм (полоса пропускания 5 нм) при 25 °C. Для каждого ряда вычтите спектр, записанный только с липосомами, из других спектров.
ПРИМЕЧАНИЕ: F и Fmax соответствуют интенсивности при 536 нм, измеренной PS-содержащими липосомами в присутствии или отсутствии LTP, соответственно, тогда как F0 - это интенсивность на той же длине волны с чистыми липосомами PC. Для каждой серии процент доступного PS, который извлекается белком, дается с помощью следующей формулы.
100 × (1-((F-F0)/(Fмакс-F0))) (4) - Для экстракционного анализа PI(4)P подготовьте липосомы, легированные 2 моль% PI(4)P, и провести измерения с помощью зонда NBD-PHFAPP. Выполните контрольные эксперименты и определите процент извлечения таким же образом, как описано выше.
ПРИМЕЧАНИЕ: Концентрация липосом и белка идентична тем, которые используются в экстракционном анализе PS.
5. Измерение транспорта PS в режиме реального времени
ПРИМЕЧАНИЕ: Для регистрации кинетики переноса липидов используется стандартный флуориметр (формат 90°), оснащенный держателем ячейки с контролируемой температурой и магнитной мешалкой. Для точного получения данных важно постоянно поддерживать образец при той же температуре (установленной между 25 и 37 ° C в зависимости от происхождения белка(например,дрожжей или человека)) и постоянно перемешивать его. Протокол, описанный ниже, предназначен для измерения переноса липидов в образце 600 мкл, содержащемся в цилиндрической кварцевой ячейке.
- Приготовьте свежевыжатый дегазированный и отфильтрованный буфер HKM. Храните трубки, содержащие экструдированные липосомы, при комнатной температуре. Оберните трубки, содержащие липосомы, род-ПЭ в алюминиевую фольгу и/или храните их в непрозрачной коробке для предотвращения фотоотбеливания.
- Регулируют возбуждение и эмиссию монохроматоров при λ = 460 нм (с короткой полосой пропускания (1-3 нм)) и при λ = 530 нм (с большой полосой пропускания (≥ 10 нм)) соответственно. Установите время захвата на 25 мин с временным разрешением ≤ 1 с.
- В кварцевой кювете разбавляют 30 мкл суспензии липосомы LA и объемраствора NBD-C2 Lact в предварительно выгремленном буфере HKM для приготовления образца объемом 570 мкл, который содержит 200 мкМ общих липидов и 250 нМ NBD-C2Lact. Добавьте небольшую магнитную мешалку и поместите кювету в держатель флуорометра.
- Как только образец будет термически уравновешиваться (через 3-5 минут), запустите измерение. Через 1 мин добавьте к образцу 30 мкл суспензии липосомы LB (конечная концентрация 200 мкМ общих липидов). Через 3 мин вводят LTP в образец так, чтобы конечная концентрация LTP была 200 нМ, и получают сигнал в течение оставшихся 21 мин.
- Провести параллельный эксперимент по нормализации сигнала NBD. Смешайте 30 мкл липосомной суспензии LA-Eq с 250 нМ NBD-C2Lact в буфере HKM (конечный объем 570 мкл). Через 1 мин вводят 30 мкл суспензии липосом LB-Eq.
ПРИМЕЧАНИЕ: Липидный состав липосом LA-Eq и LB-Eq аналогичен липосомам LA и LB, используемым в анализе переноса, за исключением того, что каждый из них содержит 2,5 моль% PS и 2,5 моль% PI(4)P. В результате измеряемый сигнал NBD, называемый FEq,соответствует сигналу, который должен быть измерен, если PS был полностью уравновешен между липосомами LA и LB процессом передачи. - Преобразуйте кинетические кривые, измеренные с помощью интересующего LTP, чтобы определить количество PS (в мкМ), переданного из LA в LB липосом с течением времени. Нормализуйте каждую точку данных (F) кривой с помощью следующей формулы.
F Норма = (F-F0)/(Fэкв-Ф0) (5)
в котором F0 соответствует сигналу NBD непосредственно перед добавлением LTP, а FEq - сигнал, измеренный на шаге 5.5.
ПРИМЕЧАНИЕ: Количество PS (в мкМ), перенесенного из LA в LB липосомы, соответствует 2,5 ×F нормы,учитывая, что равновесие соответствует ситуации, когда половина доступных молекул PS, содержащихся во внешнем листке липосом LA, (т.е., соответствующая 5 моль% от 0,5 × 200 мкМ общих липидов) была перенесена в липосомы LB.
6. Измерение переноса PI(4)P в режиме реального времени
- Установите флуориметр (длина волны возбуждения и излучения, пропускная способность, время захвата, временное разрешение), как это сделано для анализа передачи PS. Аналогичным образом, используйте один и тот же буфер, кювету и липосомы для выполнения экспериментов при постоянном перемешивание при одной и той же температуре.
- В кювете смешайте 30 мкл липосомной суспензии LB и NBD-PHFAPP с предварительно выровненным буфером HKM для получения конечного объема 570 мкл (200 мкМ общих липидов, 250 нМ NBD-PHFAPP). Как только тепловое равновесие образца достигнуто, начните измерение и через 1 мин вводят 30 мкл суспензии липосомы LA. Через 3 мин вводят интересующей LTP (конечная концентрация 200 нМ) и записывают сигнал.
- Выполните второй эксперимент для нормализации сигнала NBD. Смешайте 30 мкл суспензии липосом LB-Eq с 250 нМ NBD-PHFAPP в 570 мкл буфера HKM. Через 1 мин вводят 30 мкл суспензии липосом LA-Eq.
ПРИМЕЧАНИЕ: Здесь сигнал NBD, называемый FEq,соответствует тому, который следует измерить, если PI(4)P был полностью уравновешен между липосомами LA и LB. - Преобразование кинетических кривых для определения количества PI(4)P (в мкМ), переносимых из LB в LA липосом с течением времени. Каждая точка данных (F) нормализуется с помощью формулы 5, в которой F0 соответствует сигналу NBD до добавления LTP, а FEq - сигнал, измеренный на шаге 6.3.
ПРИМЕЧАНИЕ: Количество PI(4)P (в мкМ), перенесенного из липосом LB в LA, соответствует 2,5 ×нормеF, учитывая, что равновесие соответствует ситуации, когда половина PI(4)P, содержащаяся во внешнем листке липосом LB (т.е. 0,5 × 5 мкм), была перенесена в липосомы LA.
7. Анализ кривых кинетики
- Количественно оценить степень эффективности LTP, определив скорость, с которой этот LTP передает липиды из одной популяции липосом в другую в первые несколько секунд после ее инъекции в кювету.
- Выполните линейную регрессию первых точек данных кинетики переноса для получения наклона. Разделите значение наклона на концентрацию LTP в реакционной смеси, чтобы определить количество молекул липидов, переносимых на белок за единицу времени (мин или с).
Результаты
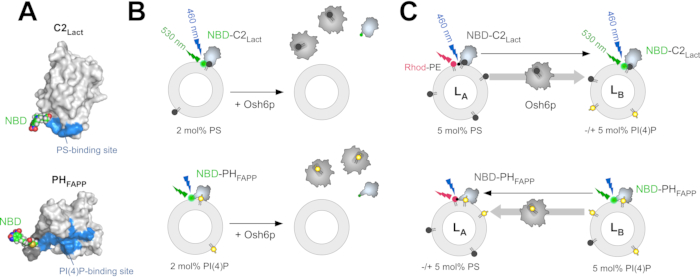
Рисунок 1:Описание флуоресцентных липидных датчиков и анализов in vitro. (A) Трехмерные модели NBD-C2Lact и NBD-PHFAPP на основе кристаллической структуры домена C2 бычих лактадерина (PDB...
Обсуждение
Результаты этих анализов напрямую зависят от сигналов флуоресцентных липидных датчиков. Таким образом, очистка этих зондов, помеченных в соотношении 1:1 с NBD и без свободного загрязнения флуорофором NBD, является критическим шагом в этом протоколе. Также в обязательном порядке проверяет?...
Раскрытие информации
Авторы заявляют, что конфликта интересов нет.
Благодарности
Мы благодарны доктору А. Каттрисс за тщательную корректуру рукописи. Эта работа финансируется грантом Французского национального исследовательского агентства ExCHANGE (ANR-16-CE13-0006) и CNRS.
Материалы
| Name | Company | Catalog Number | Comments |
| L-cysteine ≥97 % (FG) | Sigma | W326305-100G | Prepare a 10 mM L-cysteine stock solution in water. Aliquots are stored at -20 °C |
| 2 mL Amber Vial, PTFE/Rub Lnr, for lipids storage in CHCL3 | Wheaton | W224681 | |
| 4 mm-diameter glass beads | Sigma | Z265934-1EA | |
| 50 mL conical centrifuge tube | Falcon | ||
| ÄKTA purifier | GE healthcare | FPLC | |
| Aluminium foil | |||
| Amicon Ultra-15 with a MWCO of 3 and 10 kDa | Merck | UFC900324, UFC901024 | |
| Amicon Ultra-4 with a MWCO of 3 and 10 kDa | Merck | UFC800324, UFC801024 | |
| Ampicillin | Prepare a 50 mg/mL stock solution with filtered and sterilized water and store it at -20 °C. | ||
| Bestatin | Sigma | B8385-10mg | |
| BL21 Gold Competent Cells | Agilent | ||
| C16:0 Liss (Rhod-PE) in CHCl3 (1 mg/mL) | Avanti Polar Lipids | 810158C-5MG | |
| C16:0/C16:0-PI(4)P | Echelon Lipids | P-4016-3 | Dissolve 1 mg of C16:0/C16:0-PI(4)P powder in 250 µL of MeOH and 250 µL of CHCl3. Then complete with CHCl3 to 1 mL. The solution must become clear. |
| C16:0/C18:1-PS (POPS) in CHCl3 (10 mg/mL) | Avanti Polar Lipids | 840034C-25mg | |
| C18:1/C18:1-PC (DOPC) in CHCl3 (25 mg/mL) | Avanti Polar Lipids | 850375C-500mg | |
| CaCl2 | Sigma | Prepare 10 mM CaCl2 stock solution in water. | |
| Cell Disruptor | Constant Dynamics | ||
| Chloroform (CHCl3) RPE-ISO | Carlo Erba | 438601 | |
| Complete EDTA-free protease inhibitor cocktail | Roche | 5056489001 | |
| Deionized (Milli-Q) water | |||
| Dimethylformamide (DMF), anhydrous, >99% pure | |||
| DNAse I Recombinant, RNAse free, in powder | Roche | 10104159001 | |
| DTT | Euromedex | EU0006-B | Prepare 1 M DTT stock solution in Milli-Q water. Prepare 1 mL aliquots and store them at -20 °C. |
| Econo-Pac chromatography columns (1.5 × 12 cm). | Biorad | 7321010 | |
| Electroporation cuvette 2 mm | Ozyme | EP102 | |
| Electroporator Eppendorf 2510 | Eppendorf | ||
| Fixed-Angle Rotor Ti45 and Ti45 tubes | Beckman | Spinning the batcerial lysates | |
| Glass-syringes (10, 25, and 50 µL) for fluorescence experiment | Hamilton | ||
| Glass-syringes (25 , 100, 250, 500, and 1000 µL) to handle lipid stock solutions | Hamilton | 1702RNR, 1710RNR, 1725RNR, 1750RN type3, 1001RN | |
| Glutathione Sepharose 4B beads | GE Healthcare | 17-0756-05 | |
| Glycerol (99% pure) | Sigma | G5516-500ML | |
| Hemolysis tubes with a cap | |||
| HEPES , >99 % pure | Sigma | H3375-500G | |
| Illustra NAP 10 desalting column | GE healthcare | GE17-0854-02 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Euromedex | EU0008-B | Prepare 1 M IPTG stock solution in Milli-Qwater. Prepare 1 mL aliquots and store them at -20 °C. |
| K-Acetate | Prolabo | 26664.293 | |
| Lennox LB Broth medium without glucose | Prepared with milli-Q water and autoclaved. | ||
| Liquid nitrogen | Linde | ||
| Methanol (MeOH) ≥99.8% | VWR | 20847.24 | |
| MgCl2 | Sigma | Prepare a 2 M MgCl2 solution. Filter the solution using a 0.45 µm filter. | |
| Microplate 96 Well PS F-Botom Black Non-Binding | Greiner Bio-one | 655900 | |
| Mini-Extruder with two 1 mL gas-tight Hamilton syringes | Avanti Polar Lipids | 610023 | |
| Monochromator-based fluorescence plate reader | TECAN | M1000 Pro | |
| N,N'-Dimethyl-N-(Iodoacetyl)-N'-(7-Nitrobenz-2-Oxa-1,3-Diazol-4-yl)Ethylenediamine) (IANBD Amide) | Molecular Probes | Dissolve 25 mg of IANBD in 2.5 mL of dimethylsulfoxide (DMSO) and prepare 25 aliquot of 100 µL in 1.5 mL screw-cap tubes. Do not completely screw the cap. Then, remove DMSO in a freeze-dryer to obtain 1 mg of dry IANBD per tube. Tubes are closed and stored at -20 °C in the dark. | |
| NaCl | Sigma | S3014-1KG | |
| PBS | 137 mM NaCl, 2.7 mM KCl, 10 mM NaH2PO4, 1.8 mM KH2PO4, autoclaved and stored at 4 °C. | ||
| Pear-shaped glass flasks (25 mL, 14/23, Duran glass) | Duran Group | ||
| Pepstatin | Sigma | p5318-25mg | |
| pGEX-C2LACT plasmid | Available on request from our lab | ||
| pGEX-PHFAPP plasmid | Available on request from our lab | ||
| Phenylmethylsulfonyl fluoride (PMSF) ≥98.5% (GC) | Sigma | P7626-25g | Prepare a 200 mM PMSF stock solution in isopropanol |
| Phosphoramidon | Sigma | R7385-10mg | |
| Polycarbonate filters (19 mm in diameter) with pore size of 0.2 µm | Avanti Polar Lipids | 610006 | |
| Poly-Prep chromatography column (with a 0-2 mL bed volume and a 10 mL reservoir) | Biorad | 7311550 | |
| Prefilters (10 mm in diameter). | Avanti Polar Lipids | 610014 | |
| PyMOL | http://pymol.org/ | Construction of the 3D models of the proteins (Figure 1A) | |
| Quartz cuvette for UV/visible fluorescence (minimum volume of 600 µL) | Hellma | ||
| Quartz cuvettes | Hellma | ||
| Refrigerated centrifuge Eppendorf 5427R | Eppendorf | ||
| Rotary evaporator | Buchi | B-100 | |
| Screw-cap microcentriguge tubes (1.5 mL) | Sarsted | ||
| Small magnetic PFTE stirring bar (5 × 2 mm) | |||
| Snap-cap microcentriguge tubes (0.5, 1, and 2 mL) | Eppendorf | ||
| SYPRO orange | fluorescent stain to detect protein in SDS-PAGE gel | ||
| Thermomixer | Starlab | ||
| THROMBIN, FROM HUMAN PLASMA | Sigma | 10602400001 | Dissolve 20 units in 1 mL of milli-Q water and prepare 25 µL aliquots in 0.5 mL Eppendorf tubes. Then freeze and store at -80 °C. |
| Tris, ultra pure | MP | 819623 | |
| Ultracentrifuge L90K | Beckman | ||
| UV/Visible absorbance spectrophotometer | SAFAS | ||
| UV/visible spectrofluorometer with a temperature-controlled cell holder and stirring device | Jasco or Shimadzu | Jasco FP-8300 or Shimadzu RF-5301PC | |
| Vacuum chamber | |||
| Water bath | Julabo | ||
| XK 16/70 column packed with Sephacryl S200HR | GE healthcare |
Ссылки
- Drin, G. Topological regulation of lipid balance in cells. Annual Review of Biochemistry. 83, 51-77 (2014).
- Bigay, J., Antonny, B. Curvature, lipid packing, and electrostatics of membrane organelles: defining cellular territories in determining specificity. Developmental Cell. 23 (5), 886-895 (2012).
- Prinz, W. A. Lipid trafficking sans vesicles: where, why, how. Cell. 143 (6), 870-874 (2010).
- Holthuis, J. C., Menon, A. K. Lipid landscapes and pipelines in membrane homeostasis. Nature. 510 (7503), 48-57 (2014).
- Wong, L. H., Copic, A., Levine, T. P. Advances on the transfer of lipids by lipid transfer proteins. Trends in Biochemical Sciences. 42 (7), 516-530 (2017).
- Wong, L. H., Gatta, A. T., Levine, T. P. Lipid transfer proteins: the lipid commute via shuttles, bridges and tubes. Nature Reviews Molecular Cell Biology. 20 (2), 85-101 (2019).
- Iaea, D. B., Dikiy, I., Kiburu, I., Eliezer, D., Maxfield, F. R. STARD4 membrane interactions and sterol binding. Biochemistry. 54 (30), 4623-4636 (2015).
- Wilhelm, L. P., et al. STARD3 mediates endoplasmic reticulum-to-endosome cholesterol transport at membrane contact sites. The EMBO Journal. 36 (10), 1412-1433 (2017).
- Bian, X., Saheki, Y., De Camilli, P. Ca(2+) releases E-Syt1 autoinhibition to couple ER-plasma membrane tethering with lipid transport. The EMBO Journal. 37 (2), 219-234 (2018).
- Horenkamp, F. A., Valverde, D. P., Nunnari, J., Reinisch, K. M. Molecular basis for sterol transport by StART-like lipid transfer domains. The EMBO Journal. 37 (6), 98002 (2018).
- Jentsch, J. A., et al. Structural basis of sterol binding and transport by a yeast StARkin domain. The Journal of Biological Chemistry. 293 (15), 5522-5531 (2018).
- Moser von Filseck, J., et al. INTRACELLULAR TRANSPORT. Phosphatidylserine transport by ORP/Osh proteins is driven by phosphatidylinositol 4-phosphate. Science. 349 (6246), 432-436 (2015).
- Daum, G., et al. Systematic analysis of yeast strains with possible defects in lipid metabolism. Yeast. 15 (7), 601-614 (1999).
- Ejsing, C. S., et al. Global analysis of the yeast lipidome by quantitative shotgun mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 106 (7), 2136-2141 (2009).
- Leidl, K., Liebisch, G., Richter, D., Schmitz, G. Mass spectrometric analysis of lipid species of human circulating blood cells. Biochimica et Biophysica Acta. 1781 (10), 655-664 (2008).
- Sampaio, J. L., et al. Membrane lipidome of an epithelial cell line. Proceedings of the National Academy of Sciences of the United States of America. 108 (5), 1903-1907 (2011).
- Vance, J. E., Steenbergen, R. Metabolism and functions of phosphatidylserine. Progress in Lipid Research. 44 (4), 207-234 (2005).
- Zinser, E., et al. Phospholipid synthesis and lipid composition of subcellular membranes in the unicellular eukaryote Saccharomyces cerevisiae. Journal of Bacteriology. 173 (6), 2026-2034 (1991).
- Leventis, P. A., Grinstein, S. The distribution and function of phosphatidylserine in cellular membranes. Annual Review of Biophysics. 39, 407-427 (2010).
- Yeung, T., et al. Membrane phosphatidylserine regulates surface charge and protein localization. Science. 319 (5860), 210-213 (2008).
- Kim, J., Shishido, T., Jiang, X., Aderem, A., McLaughlin, S. Phosphorylation, high ionic strength, and calmodulin reverse the binding of MARCKS to phospholipid vesicles. Journal of Biological Chemistry. 269 (45), 28214-28219 (1994).
- Sigal, C. T., Zhou, W., Buser, C. A., McLaughlin, S., Resh, M. D. Amino-terminal basic residues of Src mediate membrane binding through electrostatic interaction with acidic phospholipids. Proceedings of the National Academy of Sciences. 91 (25), 12253-12257 (1994).
- Gal Bivona, T., et al. PKC regulates a farnesyl-electrostatic switch on K-Ras that promotes its association with Bcl-XL on mitochondria and induces apoptosis. Molecular Cell. 21 (4), 481-493 (2006).
- Finkielstein, C. V., Overduin, M., Capelluto, D. G. Cell migration and signaling specificity is determined by the phosphatidylserine recognition motif of Rac1. The Journal of Biological Chemistry. 281 (37), 27317-27326 (2006).
- Bolsover, S. R., Gomez-Fernandez, J. C., Corbalan-Garcia, S. Role of the Ca2+/Phosphatidylserine Binding Region of the C2 Domain in the Translocation of Protein Kinase Cα to the Plasma Membrane. Journal of Biological Chemistry. 278 (12), 10282-10290 (2003).
- Vance, J. E., Tasseva, G. Formation and function of phosphatidylserine and phosphatidylethanolamine in mammalian cells. Biochimica et Biophysica Acta. 1831 (3), 543-554 (2013).
- Maeda, K., et al. Interactome map uncovers phosphatidylserine transport by oxysterol-binding proteins. Nature. 501 (7466), 257-261 (2013).
- D'Ambrosio, J. M., et al. Osh6 requires Ist2 for localization to ER-PM contacts and efficient phosphatidylserine transport in budding yeast. Journal of Cell Science. 133 (11), 243733 (2020).
- Manford, A. G., Stefan, C. J., Yuan, H. L., Macgurn, J. A., Emr, S. D. ER-to-plasma membrane tethering proteins regulate cell signaling and ER morphology. Developmental Cell. 23 (6), 1129-1140 (2012).
- Collado, J., et al. Tricalbin-mediated contact sites control ER curvature to maintain plasma membrane integrity. Developmental Cell. 51 (4), 476-487 (2019).
- Hoffmann, P. C., et al. Tricalbins contribute to cellular lipid flux and form curved ER-PM contacts that are bridged by rod-shaped structures. Developmental Cell. 51 (4), 488-502 (2019).
- Lipp, N. F., et al. An electrostatic switching mechanism to control the lipid transfer activity of Osh6p. Nature Communications. 10 (1), 3926 (2019).
- Chung, J., et al. INTRACELLULAR TRANSPORT. PI4P/phosphatidylserine countertransport at ORP5- and ORP8-mediated ER-plasma membrane contacts. Science. 349 (6246), 428-432 (2015).
- Sohn, M., et al. PI(4,5)P2 controls plasma membrane PI4P and PS levels via ORP5/8 recruitment to ER-PM contact sites. The Journal of Cell Biology. 217 (5), 1797-1813 (2018).
- Ghai, R., et al. ORP5 and ORP8 bind phosphatidylinositol-4, 5-biphosphate (PtdIns(4,5)P 2) and regulate its level at the plasma membrane. Nature Communications. 8 (1), 757 (2017).
- Sohn, M., et al. Lenz-Majewski mutations in PTDSS1 affect phosphatidylinositol 4-phosphate metabolism at ER-PM and ER-Golgi junctions. Proceedings of the National Academy of Sciences of the United States of America. 113 (16), 4314-4319 (2016).
- Kattan, W. E., et al. Targeting plasma membrane phosphatidylserine content to inhibit oncogenic KRAS function. Life Science Alliance. 2 (5), 00431 (2019).
- Du, X., Turner, N., Yang, H. The role of oxysterol-binding protein and its related proteins in cancer. Seminars in Cell & Developmental Biology. 81, 149-153 (2018).
- Galmes, R., et al. ORP5/ORP8 localize to endoplasmic reticulum-mitochondria contacts and are involved in mitochondrial function. EMBO reports. 17 (6), 800-810 (2016).
- Du, X., et al. ORP5 localizes to ER-lipid droplet contacts and regulates the level of PI(4)P on lipid droplets. The Journal of Cell Biology. 219 (1), 201905162 (2020).
- Wang, H., et al. ORP2 delivers cholesterol to the plasma membrane in exchange for phosphatidylinositol 4, 5-bisphosphate (PI(4,5)P2). Molecular Cell. 73 (3), 458-473 (2019).
- Kay, J. G., Grinstein, S. Sensing phosphatidylserine in cellular membranes. Sensors (Basel). 11 (2), 1744-1755 (2011).
- Moser von Filseck, J., Vanni, S., Mesmin, B., Antonny, B., Drin, G. A phosphatidylinositol-4-phosphate powered exchange mechanism to create a lipid gradient between membranes. Nature Communications. 6, 6671 (2015).
- Wills, R. C., Goulden, B. D., Hammond, G. R. V. Genetically encoded lipid biosensors. Molecular Biology of the Cell. 29 (13), 1526-1532 (2018).
- Raychaudhuri, S., Im, Y. J., Hurley, J. H., Prinz, W. A. Nonvesicular sterol movement from plasma membrane to ER requires oxysterol-binding protein-related proteins and phosphoinositides. The Journal of Cell Biology. 173 (1), 107-119 (2006).
- Lenoir, M., et al. Structural basis of wedging the Golgi membrane by FAPP pleckstrin homology domains. EMBO reports. 11 (4), 279-284 (2010).
- Liu, Y., Kahn, R. A., Prestegard, J. H. Interaction of Fapp1 with Arf1 and PI4P at a membrane surface: an example of coincidence detection. Structure. 22 (3), 421-430 (2014).
- Shao, C., Novakovic, V. A., Head, J. F., Seaton, B. A., Gilbert, G. E. Crystal structure of lactadherin C2 domain at 1.7A resolution with mutational and computational analyses of its membrane-binding motif. The Journal of Biological Chemistry. 283 (11), 7230-7241 (2008).
- Lipp, N. F., Ikhlef, S., Milanini, J., Drin, G. Lipid exchangers: cellular functions and mechanistic links with phosphoinositide metabolism. Frontiers in Cell and Developmental Biology. 8, 663 (2020).
- Venditti, R., et al. Molecular determinants of ER-Golgi contacts identified through a new FRET-FLIM system. The Journal of Cell Biology. 218 (3), 1055-1065 (2019).
- Pemberton, J. G., et al. Defining the subcellular distribution and metabolic channeling of phosphatidylinositol. The Journal of Cell Biology. 219 (3), (2020).
- Nakanishi, H., de los Santos, P., Neiman, A. M. Positive and negative regulation of a SNARE protein by control of intracellular localization. Molecular Biology of the Cell. 15 (4), 1802-1815 (2004).
- Maekawa, M., Yang, Y., Fairn, G. D. Perfringolysin O theta toxin as a tool to monitor the distribution and inhomogeneity of cholesterol in cellular membranes. Toxins. 8 (3), 67 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены