需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基于荧光的测量磷酸酯/磷酸二醇 4-磷酸盐膜之间的交换
摘要
在这里,我们描述协议使用荧光脂质传感器和脂质体,以确定蛋白质提取物和运输磷酸二醇或磷二醇4磷酸盐 体外。
摘要
进化保存的氧固醇结合蛋白(OSBP)相关蛋白质(ORP)/OSBP同源(Osh)家族的几个成员最近被发现代表了酵母和人类细胞中一种新的脂质转移蛋白(LTP)组。他们 通过 PS/磷脂蛋白4磷酸(PI(4)P)交换周期将磷脂蛋白(PS)从内质质视网膜(ER)转移到等离子体膜(PM)。这一发现有助于更好地了解PS,这对信号过程至关重要,如何在整个细胞中分布,并调查这个过程与磷酸二胺(PIP)代谢之间的联系。新的荧光协议的开发有助于在分子水平上发现和描述这种新的细胞机制 在体外 。本文描述了两个荧光标记脂质传感器NBD-C2乳酸 和NBD-PHFAPP的生产和使用,以测量蛋白质提取PS或PI(4)P的能力,并在人造膜之间转移这些脂质。首先,协议描述了如何生产、标记和获取这两种结构的高纯度样品。其次,本文解释了如何使用这些传感器与荧光微板读取器,以确定蛋白质是否可以提取PS或PI(4)P从脂质体,使用Osh6p作为案例研究。最后,本协议展示了如何准确测量定义脂质成分脂质体之间的 PS/PI (4)P 交换,以及使用标准荧光共振能量转移 (FRET) 确定脂质转移速率。
引言
不同膜之间和真核细胞膜内脂质的精确分布1、2具有深远的生物学意义。解密LTP功能如何是细胞生物学中一个重要的问题,3、4、5、6和体外方法对于解决这个问题有重要价值。在这里,提出了一种体外、荧光为基础的策略,有助于确定几个ORP/Osh蛋白对PS/PI(4)P细胞膜12之间的交换有作用,从而构成一类新的LTP。 PS是一种阴离子血糖磷脂,占真核细胞总膜脂质的2-10%13、14、16。它沿着急诊器和PM之间的梯度分布,分别代表5-7%和高达30%的甘油磷脂,分别为17、18、19。此外,PS 基本上集中在 PM 的细胞溶胶传单中。这种积累和下午PS的不均匀分割对于细胞信号过程19至关重要。由于PS分子的负电荷,PM的细胞溶胶传单比其他细胞器1,2,19,20的细胞溶胶传单要电性得多。这使得通过静电部队进行招募, 信号蛋白,如富含肌酸丙氨酸的C-激酶基板(MARCKS)21,肉瘤(Src)22,柯尔斯滕-鼠肉瘤病毒肿瘤病毒肿瘤23,和拉斯相关的C3肉毒杆菌毒素基板1 (Rac1)24,含有一段带正电荷的氨基酸和脂质尾巴。
PS也通过C2域25以立体选择的方式被传统蛋白激酶C识别。但是,PS 在 ER26中合成,表明它必须导出到 PM 才能发挥作用。直到发现,在酵母,Osh6p和Osh7p转移PS从ER到PM27,不知道这是如何完成19。这些LTP属于真核生物的进化保护家族,其创始成员是OSBP,含有蛋白质(人类中的ORP,酵母中的奥什蛋白),结合了OSBP相关领域(ORD),口袋承载脂质分子。Osh6p 和 Osh7p 仅由 ORD 组成,其结构特征被调整为专门绑定 PS 并在膜之间传输。然而,这些蛋白质如何定向地将PS从ER转移到PM尚不清楚。Osh6p 和 Osh7p 可以捕获 PI (4)P 作为替代脂质配体12.在酵母中,PI (4)P 分别由高尔吉的磷酸二醇 (PI) 和 PM 的 PI 4 激酶、Pik1p 和 Stt4p 合成。相比之下,ER 膜中没有 PI(4)P,因为这种脂质由 Sac1p 磷酸酶水解到 PI。因此,PI (4)P 梯度存在于 ER/高尔吉和 ER/PM 接口中。Osh6p 和 Osh7p 通过 PS/PI (4)P 交换周期将PS 从 ER 传输到 PM,使用这两个膜12之间的 PI (4)P 梯度。
在一个周期内,Osh6p 从 ER 中提取 PS,在 PM 将 PS 交换为 PI (4)P,并将 PI (4)P 传输回 ER 以提取另一个 PS 分子。Osh6p/Osh7p 与 Ist2p28相互作用,这是连接并使 ER 膜和 PM 彼此紧密相连的少数蛋白质之一,可在酵母29、30、31中创建 ER-PM 接触点。此外,Osh6p 与负电压膜的关联在蛋白质提取脂质配体之一后立即变得弱,因为构象变化改变了其静电特征32。这有助于Osh6p缩短其膜停留时间,从而保持脂质转移活动的效率。结合与 Ist2p 的结合,此机制可以使 Osh6p/7p 在 ER/PM 接口快速准确地执行脂质交换。在人体细胞中,ORP5和ORP8蛋白通过不同的机制33在ER-PM接触点执行PS/PI(4)P交换。他们有一个中央ORD,类似于Osh6p,但直接锚定到ER通过C终端跨膜段33和停靠到PM通过N终端普莱克斯特林同源(PH)域,识别PI(4)P和PI(4,5)P233,34,35。ORP5/8 使用 PI (4)P 传输 PS,并且已经表明 ORP5/8 还会调节 PM PI (4,5)P2级别,并可能调节信号通路。反过来,PI (4)P 和 PI (4,5)P2水平的降低降低了 ORP5/ORP8 活性,因为这些蛋白质以基于 PIP 的方式与 PM 相关联。异常高的PS合成,导致伦茨-马耶夫斯基综合征,影响PI(4)P水平通过ORP5/836。当两种蛋白质的活动被阻断时,PS在下午变得不那么丰富,降低了信号蛋白37的致癌能力。
相反,ORP5过度表达似乎促进癌细胞入侵和转移过程38。因此,对ORP5/8活性的改变可以通过脂质平衡的变化来严重改变细胞行为。此外,ORP5 和 ORP8 占据 ER-线粒体接触点,并保留一些线粒体功能,可能通过提供 PS39。此外,ORP5 本地化到 ER 脂液滴接触站点,通过 PS/PI (4)P 交换40将 PS 输送到脂质液滴。此处描述的测量 (i) PS 和 PI (4) P 从脂质体中提取和 (ii) PS 和 PI (4)P 在脂质体之间的传输的策略已被设计用于建立和分析 PS/PI (4)P 交换活动 Osh6p/Osh7p12,32并用于分析 ORP5/ORP835和其他 LTP10的活动, 41.它基于荧光板读取器、标准L格式光谱仪和两个荧光传感器(NBD-C2乳酸盐和NBD-PHFAPP)的使用,分别可以检测PS和PI(4)P。
NBD-C2乳酸对应于糖蛋白(乳酸丙胺)的 C2 域,该域重新设计,以包括假定的 PS 结合部位附近的一个独特的溶剂暴露的赛因子:极性敏感NBD(7-硝基苯甲酸-2-oxa-1,3-diazol)氟与这种残留物(图1A)12有共价关系。更确切地说,乳酸杆菌的C2域(博斯金牛座,UniProt:Q95114,残留物270-427)被克隆成pGEX-4T3载体,与大肠杆菌中的谷胱甘肽S-转移酶(GST)融合。然后,C2乳酸序列发生变异,以替换两个可溶剂访问的赛因子残留物(C270, C427)与丙氨酸残留物,并引入一个赛因素残留物到附近的区域假定PS绑定位点(H352C突变),随后可以标记为N,N'-二甲基-N-(二恶英)-N'-(7-硝基苯-2-奥萨-1,3-二醇-4-yl)二胺乙烯(IANBD)12。 在 GST 蛋白和 C2 域的 N 终点之间存在血栓的位点。一个主要的优势是,这个域选择性地识别PS在Ca2+独立的方式与其他已知的C2域或附件A542相反。NBD-PHFAPP来自人类四磷酸盐适配蛋白1(FAPP1)的PH域,该蛋白被重新设计,包括一个溶剂暴露的赛因子,可以在PI(4)P结合位点(图1A)43附近标注NBD组。人类FAPP蛋白PH域的核苷酸序列(UniProt:Q9HB20,段[1-100])已被克隆成pGEX-4T3载体,与GST标签一起表达。PHFAPP序列已修改,在蛋白质43的膜结合界面内插入独特的赛因子残留物。此外,在血栓裂口站点和 PH 域的 N 终点之间引入了九残联,以确保蛋白酶的可访问性。
要测量脂质体中的 PS 提取量, NBD-C2乳酸酯与含有微量PS的磷脂质素(PC)制成的脂质体混合。由于它对PS的亲和力,这种结构与脂质体结合,NBD荧光片在与膜的疏水环境接触时会经历极性的变化,从而引起蓝移和荧光的增加。如果PS几乎完全由LTP的气压量提取,探测器与脂质体没有关联,NBD信号较低(图1B)32。信号中的此差异用于确定 LTP(例如Osh6p)是否提取 PS。NBD-PHFAPP也采用了类似的策略来测量PI(4)P提取(图1B),如前所述的12,32。两个基于 FRET 的测定设计用于 (i) 测量从 LA到 LB脂质体的 PS 传输,分别模拟 ER 膜和 PM,以及 (ii) PI(4)P 向相反方向传输。这些检测在相同的条件下(即相同的缓冲、温度和脂质浓度)进行,以测量PS/PI(4)P交换。为了测量 PS 传输, NBD-C2乳酸盐与由 PC 组成的 LA脂质体混合, 掺杂 5 摩尔 % PS 和 2 摩尔% 的荧光罗丹标签磷酸乙醇胺 (Rhod-PE) - 和 LB脂质体, 包括 5 摩尔% PI (4) P.
在时间零,FRET与罗德-佩淬火NBD荧光。如果PS从LA运输到LB脂质体(例如,注射Osh6p后),由于NBD-C2乳酸分子从LA转移到LB脂体(图1C),就会发生快速排解。鉴于可访问的PS量,NBD-C2乳酸盐在实验过程中基本上保持膜绑定状态。因此,NBD 信号的强度直接与 LA和 LB脂体之间的 NBD-C2乳酸盐分布相关,并且可以轻松正常化以确定传输的 PS 量。为了测量 PI (4)P 朝相反的方向转移,NBD-PHFAPP与 LA和 LB脂质体混合:鉴于它只与含有PI(4)P的LB脂质体结合,而不是Rhod-PE,它的荧光很高。如果 PI (4)P 转移到 LA脂质体,则它转移到这些脂质体,并且信号因 Rhod-PE (图 1C)的 FRET 而降低。信号正常化,以确定 PI (4)P 传输43的量。
研究方案
1. 净化NBD-C2乳酸
注:虽然此协议详细说明了使用细胞干扰器来分解细菌,但可以修改它以使用其他裂解策略(例如, 法国媒体)。在净化开始时,必须使用新鲜脱气、过滤和补充 2 mM 二恶英 (DTT) 的缓冲器,以防止西斯坦的氧化。然而,对于蛋白质标签步骤,完全去除DTT至关重要。许多步骤必须在冰上或寒冷的房间里进行,以避免任何蛋白质降解。必须按照协议的不同步骤收集 30 μL 体积的样品,以便使用 15% 的丙烯酰胺凝胶(SDS-PAGE) 使用多乙酰硫化物- 聚丙烯酰胺凝胶电泳 (SDS-PAGE) 进行分析,以检查净化进度。将足够变性的Laemmli样品缓冲器与每个阿利奎特混合,并在95°C下加热混合物。 将管子冻结并储存在 -20 °C 下,直到分析。
- 大肠杆菌中 GST-C2乳酸的表达
- 将 20 μL 的 BL21 金质电池与 18 μL 的消毒水混合。然后,将 2 μL 的 pGEX-C2乳酸 质粒(在 +65 ng/μL)与细菌混合,并通过电击将其转化。用150微升的自克隆伦诺克斯莱索根-布罗斯(LB)介质(10克/升试剂,5克/升酵母提取物,5克/升NaCl在去离子水中,无葡萄糖)重新使用细菌。让细菌在 2 mL 的夹盖微中心管中以 37 °C 1 h 的速度生长。
- 接种 25 mL 的 LB 介质,辅以 50 μg/mL 安培林,在 125 mL 无菌 Erlenmeyer 烧瓶中含有 150 μL 的细菌悬浮剂。将烧瓶置于37°C的轨道摇床中,让细菌在185转时随着搅拌而生长过夜。
- 填充两个无菌 2 L Erlenmeyer 烧瓶,加入 500 mL 的 LB 介质,辅以 50 μg/mL 安培林,并添加 5 mL 的预栽培悬浮液。让细菌在 37 °C 下生长,在 220 rpm 时搅拌。
- 定期测量悬架的光学密度 (OD) 在波长 (\) 600 nm。当 OD 达到 +0.6-0.7 值时,在每个烧瓶中加入 500 μL 的 1 M 异丙基β-D-硫高拉托皮拉诺赛德 (IPTG) 的库存溶液,以启动 GST-C2乳酸盐的表达。在 185 rpm 时在 37 °C 下摇动烧瓶 4 小时。
- 将每个烧瓶的含量转移到聚丙烯离心机瓶中。将两瓶在 4600 × g 在 4 °C 下离心 30 分钟,以颗粒细菌。丢弃超高酸酯,将每个颗粒重新沉浸在50兆L的冷磷酸盐缓冲盐水中。
- 将每个瓶子中所含的细菌悬浮液转移到 50 mL 圆锥形离心机管中。在 2300 × g 在 4 °C 下将两根管子离心 30 分钟。 取出超高分子,并将管子(每个管子都含有细菌颗粒)储存在 -20 °C 下。
- C2 的净化乳酸
- 在冰上,用50mL的缓冲器填充两个50mL圆锥形离心管,内含50mM Tris-HCl、pH 7.4和150mM NaCl(以下简称TN缓冲器),以前通过膜真空过滤过滤过滤和除气。
- 要准备每个管子中的裂解缓冲器,通过轻度声波或涡流溶解TN缓冲器中的四乙酰胺四乙酰酸抑制剂鸡尾酒片剂。添加其他抗蛋白酶(10 μM 贝他汀、1 μg/mL 肽 A 和 10 μM 磷酸酯)。重要的是,用 2 mM DTT 补充缓冲。
- 将包含第 1.1.6 步制备的细菌颗粒的两根管子填充,用裂解缓冲器在每个管中获取 30 mL 的最终体积,并缓慢地将颗粒在冰上解冻 10 分钟。用不锈钢铲粉碎每个颗粒,然后通过旋转管子和/或用移液器控制器和 25 mL 移液器来回管道悬架来重新支撑它们,直到获得均匀的悬架。
- 使用预制电池干扰器(参见 材料表)进行裂解,在储层内装载 30 mL 的样品,并在 1.6 bar 的压力下连续运行一个断裂循环。在同一管中收集裂解物,将管子放在冰上,并立即从用异丙酚制备的 200 m 苯甲基硫化物 (PMSF) 库存溶液中加入 250 μL。
- 按照相同的程序对其他样本进行莱西。使用裂解缓冲器的剩余部分洗净细胞干扰器,并收集洗涤液,将每个裂解物 (+30 mL) 的体积调整为最终体积为 50 mL。
- 用5mMMgCl2补充每个裂解物,加入20微克/毫升的DNAse I来分割DNA,从而降低样品的粘度。在冰上孵育30分钟。收集样本进行凝胶分析。
- 将每根50mL的解盐转移到一个预碳酸酯超中心管(总共两个,见 材料表)。离心机在 186,000 × g 在 4 °C 至少 1 小时使用超中心。
- 在离心步骤的同时, 将含有谷胱甘肽的泥浆 1.4 mL 耦合到 4% 的玫瑰珠中,放入两个 50 mL 圆锥形离心管中,在每个管子上加入 20 mL 的 TN 缓冲器,在 1200 × g 下离心机 5 分钟,并丢弃超高纳特。重复此洗涤步骤两次。
- 细菌解剖离心后,从超分子中取出 30 μL 样品,并将超离心剂从每个超中心管转移到相应的 50 mL 圆锥形离心机管中,该离心剂管中含有干净的珠子。对于凝胶分析,将碎屑颗粒重新沉积在一个具有 50 mL TND 缓冲器的超中心气管中,并收集 30 μL 样品。
- 将管子在 4 °C 下旋转 3-4 小时,以获得均匀的珠子悬架。将珠子悬架池入空的 25 mL 色谱柱中。让珠子倒掉,通过重力流动去除缓冲和未绑定的蛋白质。从 eluate 中取出样本进行分析。
- 用 20 mL 的 TND 缓冲器重新悬浮珠子,并通过重力流收集水。重复此步骤两次,以完全洗涤珠子。将收集的 eluates 池,并保留 30 μL 样本以供进一步分析。
注:经过短暂的倾角,一个体积为+2mL的珠子悬浮,GST-C2乳酸盐 连接,沉积物在柱子的底部。 - 将 1 mL 的珠子悬架添加到两个 2 mL 的扣盖微中心管中。将每个管子填充 TND 缓冲器,最终体积为 1.970 mL。从一根管子中取出 30 μL 样品进行进一步分析(B1 样本)。在 0.02 U/μL的人类血栓蛋白蛋白酶溶液库存溶液中加入 10 μL 的 10 mM CaCl 2 溶液和 25 μL。
- 将两根管子在 4 °C 的旋转器上过夜,让血栓从 C2乳酸 域切开 GST 标签。第二天,在每个管子中,将 10 μL 的 200 mM PMSF 溶液与珠子悬浮液混合,以抑制血栓作用。
- 将管子以 700 × g 离心 5 分钟,并从每个管中收集含有可溶性 C2乳酸 域的超高纳特,而无需取珠子。将超分子池入冰上保持的 2 mL 扣盖微中心管(E1 eluate)中。
- 在每个管子中加入1兆瓦的TND缓冲器,以重新悬浮珠子并清洗它们:重复步骤 1.2.14。执行此步骤三次以上,以恢复最大量的蛋白质。每次,将收集的超高分子汇集到一个新的 2 mL 管(E2、E3、E4 和 E5 等位)中,并取一个引线进行进一步分析。在洗涤步骤结束时,从珠子悬架(白玉B2)中取出一个小白条。
- 分析在 15% 丙烯酰胺凝胶上通过 SDS-PAGE 分离在净化协议的不同步骤收集的 30 μL 样品。
- 将步骤 1.2.14 和 1.2.15 期间收集的所有超高分子(即+10 mL)汇集到 10 mL 色谱柱中,去除潜在的污染珠。通过重力流收集水分,并将珠子保留在柱子底部。
- 使用分子重量截止 (MWCO) 为 3 kDa 且离心速度为 2300 ×克的离心速度,将 C2乳酸盐样品集中使用离心过滤器单元。当蛋白质样品的体积为 ±1 mL 时,停止浓度过程。
- NBD-C2的制备和净化乳酸
- 用 TN 缓冲器将脱盐柱(参见 材料表)等价。用 1 mL 浓缩 C2乳酸盐 样品加载柱子。允许样品完全进入凝胶床,在柱子上加入1.5兆升新鲜脱气的无DTT TN缓冲器,并通过重力流将水母收集到2mL扣盖微中心管中。
- 将 50 μL 的 eluate 稀释到 300 μL TN 缓冲器的最终体积中,并使用纯 TN 缓冲器作为空白记录 230 到 450 nm 的吸水光谱。根据测量到的 280 nm 的吸收量确定 C2乳酸浓度,考虑灭绝系数ε等于 44,920 M-1。cm-1。
- 要将 C2乳酸结构标记为 NBD 荧光素,将蛋白质与N、N'-二甲基- N - (二恶英) -N'(7-硝基苯甲酸酯-2-oxa-1,3-diazol-4-yl) 乙烯胺 (IANBD 合二苯二甲胺) 混合。
- 在无水二甲基甲酰胺 (DMF) 中溶解 1 毫克 IANBD,请记住,用于标记 C2乳酸盐 结构的 DMF 最终体积不得超过蛋白质样本量的 5% (v/v)。
- 要确定DMF(VDMF)溶解IANBD的体积,首先计算使用公式 1标记蛋白质所需的IANBD(m,用毫克表示)。
m = 10,000 × C × V × MWIANBD (1)
其中C是C2乳酸盐 的浓度测量步骤1.3.2,V是C2乳酸盐 样品的体积,MWIANBD 是荧光(420克/摩尔)的分子量。 - 使用公式 2(使用 m 0 =1)和3计算 VDMF。
VDMF= (m0/m) × VIANBD (2)
VIANBD+0.05 × V(3)
m0 是 mg 中的 IANBD 粉末数量,VIANBD 是要添加到 C2乳酸盐 样品中的 IANBD 溶液的体积。 - 将新制备的 IANBD 溶液的体积 VIANBD 添加到 C2乳酸 样品中,使用不受光线保护的热混合器在 800-900 rpm 下摇动反应混合物 30 分钟,时间为 30 分钟。让反应在冰上进行90分钟。同时,用 10 mL 的 TN 缓冲器清洁离心过滤器单元 (MWCO® 3 kDa)。
- 将 L-半胱氨酸(在 IANBD 的 10 倍摩尔过量中)添加到反应混合物中,以灭活免费 IANBD。
- 在 NBD-C2乳酸 溶液中加入 15 mL 的 TN 缓冲器,并将 NBD-C2乳酸盐 溶液转移到离心滤芯单元。将样品浓缩到2mL,以2300× 克的离心离心将大部分免费NBD与蛋白质分离。重复此洗涤步骤两次。在 2 mL 的夹盖离心机管中将样品离心 10 分钟,在 19,000 × g 在 4 °C 下颗粒潜在聚合物,并收集超高分子。
- 在 TN 缓冲器的最终体积中稀释 50 μL 的 eluate。使用浓度过程中收集的 eluate 作为空白记录 230 到 650 nm 的吸收光谱。使用最大吸水量 [280 和 495 nm 和灭绝系数ε] 44,920 M-1.cm-1 (蛋白质) 和 25,000 M-1.cm-1 (NBD 荧光) 确定 NBD-C2乳酸浓度。
注:如果两个浓度值相同,则表示 C2乳酸 结构与 NBD 组的比率为 1:1。 - 如果从 NBD 吸收量测量中估计的 NBD-C2乳酸 浓度超过色氨酸 (Trp) 残留物吸收估计的浓度,请重复步骤 1.3.5 以进一步去除免费 NBD。
- 在样品中加入甘油,获得 10% (v/v) 的最终浓度,在闪存冻结期间冷冻保护 NBD-C2乳酸 结构。测量最终蛋白质浓度。
- 在 0.5 mL 捕捉帽微中心管中准备 50 微升蛋白质。将管子闪存到液氮中,并将它们储存在 -80 °C 下。
2. 净化NBD-PH法普
注:生产和标记 PHFAPP 的程序与 NBD-C2乳酸 相同,直到 NBD-C2乳酸 溶液在步骤 1.3.4 中传输到离心滤芯单元。从此步骤开始,请遵循下面描述的协议。
- 浓度步骤后,在进行尺寸排除色谱之前,将 2 mL 的 NBD-PHFAPP 在黑暗中保持在 4 °C,不超过 1 天。在排除尺寸色谱之前,请验证管底没有橙色沉积(浓度期间聚合)。如果是这样的话,在 4 °C 下以 540,000 × g 离心取样 10 分钟,并通过大小排除色谱净化超高纳特。
注:使用快速蛋白质液体色谱系统(参见材料表),在装有交叉链路脱氟乙烯-丙烯酰胺聚合物(见材料表)的柱子上执行尺寸排除色谱。必须保护柱子免受光线的照射。使用了 1 mL/min 的流量,随后在柱出口处记录了 280 ±280 (蛋白质) 和 480 nm (NBD) 的吸水量。- 将装在 2 mL 注射回路中的 NBD-PHFAPP 样品注入柱子,并立即收集 2.5 mL 的 eluate 分数。
- 分析在 15% SDS-PAGE 凝胶上检测到的 280 和 480 nm 的主要峰值对应的所有分数。在加热和装载到凝胶之前,将每个分数的 25 μL 样品与 15 μL 的 Laemmli 样品缓冲器混合。
注:主峰值在 [280+ 280 和 480 nm 处同时检测到],一旦通过柱子,就会出现 150 mL 缓冲器的体积。 - 将仅含有 NBD-PHFAPP 蛋白(+12.2 kDA)的分数集中起来,并在最后浓度为 10% (v/v) 时添加甘油。使用离心过滤器单元将样品集中到 3 kDa 的 MWCO 中,使用 2300 × g的离心速度将样品最终体积集中到 1 mL 的体积中。
- 准备小品,并记录NBD-C2乳酸的吸收光谱。使用灭绝系数ε 29,450 M-1.cm-1, 根据在 ±280 nm 测量的吸水量确定蛋白质的浓度。
3. 为PS和PI(4)P提取或转移检测准备脂质体
注意:除非另有说明,否则在室温下执行所有步骤。小心处理有机溶剂、旋转剂和液氮。
- 准备新鲜、过滤和脱气的 50 mM 4-(2-羟基乙基)-1-管道酸氢氧化钾 (KOH)、pH 7.4、120 m 醋酸钾(HK)缓冲器。
- 对于每种类型的脂质体,从库存溶液中精确取出不同量的脂质,并将其混合在 25 毫升梨形玻璃瓶(表 1)中。加入纯氯仿,将每个混合物的体积调整为1 mL。将每个烧瓶标上脂质体名称。用铝箔包裹含有脂质混合物的烧瓶,并掺入 Rhod-PE。
- 将烧瓶放在旋转蒸发器上。在真空下和 25 °C 下干燥脂质,以 500 rpm 的旋转速度至少 30 分钟。对于含有 PI (4)P 的脂质薄膜,在 32-34 °C 下预温烧瓶 5 分钟,在轻柔的旋转下,将 PI (4)P 与其他脂质正确混合,然后在烧瓶中产生真空以去除溶剂,这将在烧瓶壁上留下干燥脂质膜。
- 将烧瓶与蒸发器分离,放在真空室中45分钟,以去除剩余的溶剂痕迹。将烧瓶装满 2 毫升的 HK 缓冲器,并在溶液中加入几个直径为 4 mm 的玻璃珠。轻轻地将烧瓶旋涡2分钟,以重新悬浮脂质,并准备多拉梅拉脂囊泡(MLV),脂质浓度为4mM。在 1.5 mL 螺杆盖微中心管中准备 0.5 mL 的 MLV 阿利奎特。
- 冻结解冻管5倍(分别使用液氮和水浴在37°C)。挤出脂质体或将其存储在 -20 °C。
- 根据制造商的指南,使用迷你挤出器从MLV中制备脂质体(即 大单拉菌囊泡)。使用直径为 200 nm 的均匀圆柱形孔隙的聚碳酸酯过滤器。
- 要准备每种类型的脂质体,挤出至少 250 μL 的相应悬架 MLV. 将挤出的脂质体存放在 4 °C 下,如果它们含有 Rhod-PE,则在黑暗中存储。在 2 天内使用脂质体。
| 脂质成分(摩尔/摩尔) | 脂质 | |||||
| 脂质体名称 | 多普克 (25毫克/毫升) | 流行音乐 (10毫克/毫升) | 16:0 利斯·罗德-佩 (1毫克/毫升) | C16:0/C16:0-PI (4)P (1毫克/毫升) | ||
| 提取分析 | 脂质体 2 摩尔% PS | PC/PS 98/2 | 247 μL | 12.5 微升 | ||
| 脂质体 2 摩尔% PI (4)P | PC/PI (4)P 98/2 | 247 μL | 153 μL | |||
| PC 脂质体 | PC 100 | 252 μL | ||||
| 运输分析 | LA | PC/PS/罗德-佩 93/5/2 | 234 μL | 31.4 微升 | 200 μL | |
| LA无 Ps | PC/罗德-佩 98/2 | 247 μL | 200 μL | |||
| LB | PC/PI (4)P 95/5 | 237 μL | 383 μL | |||
| LB 无 PI (4)P | PC 100 | 252 μL | ||||
| LA-Eq | PC/PS/PI (4)P/罗德-PE 93/2.5/2.5/2 | 234 μL | 15.7 μL | 200 μL | 191 μL | |
| LB-Eq | PC/PS/PI (4)P 95/2.5/2.5 | 239 μL | 15.7 μL | 191 μL | ||
表1:脂质库存溶液的量,用于脂质体制备。 缩写:PS®磷酸酯;PC = 磷脂酰胆碱;PI (4)P = 磷酸二醇 4 磷酸盐;罗德-PE = 罗丹胺标签磷酸二醇胺;多普克 = 二甲苯丙胺磷酸碱;POPS® 1-棕榈-2-奥莱奥-斯恩-甘油-3-磷-L-塞林;16:0 利斯罗德-PE = 1,2-二苯二甲酰-sn-甘油-3-磷乙醇胺-N-(利沙明罗达明B磺胺)。
4. 测量PS或PI(4)P提取
注:测量必须使用黑色 96 井板和配备单色器的荧光板读取器进行:一个用于荧光激发,一个用于排放,带宽可变。
- 准备新鲜、过滤和脱气的HK缓冲器,辅以1mM MgCl2(HKM缓冲器)。准备纯PC脂质体和PC脂质体掺杂2摩尔%PS或2摩尔%PI(4)P(4mM最终脂质浓度,见表1)。
注意:在整个实验过程中,在室温下保持充满挤出脂质体悬浮物的管子,并将蛋白质保留在冰上。此外,保护脂质传感器免受光线照射。 - 对于 PS 提取检测,在一口井中,将含有 2 mol% PS(80 μM 最终脂质浓度,0.8 μM 可访问 PS 浓度)的脂质体与 NBD-C2乳酸盐 (250 nM 最终浓度)混合在 100 μL 的最终体积中。 用相同数量的脂质体(80 μM,2 mol% PS)和NBD-C2乳酸盐 (250 nM)与3 μM LTP(Osh6p作为正控或感兴趣的蛋白质)混合,填充第二口井。
注:5分钟的孵化时间足以让Osh6p实现脂质提取。 - 用 NBD-C2乳酸 (250 nM) 与纯 PC 脂质体 (80 μM) 混合,填充第三口井。仅用纯 PC 脂质体(80 μM)填充第四口井。重复步骤 4.2-4.3,以准备另外三个系列的四口井。
- 对于每口井,在 25 °C 下以 490 nm(带宽 5 nm) 的激发记录 505 到 650 nm(带宽 5 nm)的 NBD 频谱。 对于每个系列,减去仅从其他光谱中记录的脂质体记录的光谱。
注:F 和 F最大值 分别与 LTP 存在或不存在 PS 的脂质体测量的 536 nm 强度相对应,而 F0 的强度与纯 PC 脂质体的强度相同波长。对于每个系列,蛋白质提取的可访问PS的百分比通过使用以下公式给出。
100 × (1-(F-F0) /(F最大-F0))(4) - 对于 PI (4) P 提取检测,准备掺杂 2 mol% PI (4)P 的脂质体,并使用 NBD-PHFAPP 探头进行测量。执行控制实验,并以与上文相同的方式确定提取百分比。
注:脂质体和蛋白质浓度与PS提取检测中使用的相同。
5. PS 传输的实时测量
注:配备温度控制电池支架和磁搅拌器的标准荧光仪(90°格式)用于记录脂质转移动能学。为了准确获取数据,在相同的温度下永久保持样品(根据蛋白质的来源(例如酵母或人类)设置在 25 到 37 °C 之间),并不断搅拌它是关键。下面描述的协议用于测量圆柱石英电池中 600 μL 样品中的脂质输送。
- 准备新鲜脱气和过滤的 HKM 缓冲器。在室温下保持含有挤出脂质体的管子。用铝箔中含有 Rhod-PE 的脂质体包裹管,并/或将其存放在不透明的盒子中,以防止任何光斑。
- 分别调整 =460 nm(带宽短(1-3 nm)和 +530 nm(带宽大(≥ 10 nm)的激发和发射单色器。将采集时间设置为 25 分钟,时间分辨率为 1 ≤。
- 在石英库韦特,稀释30微升的LA 脂质体悬架和一卷NBD-C2乳酸 股票溶液在预温HKM缓冲器准备570微升样品,其中含有200微米总脂质和250 nM NBD-C2乳酸盐。添加一个小磁搅拌棒,并将 cuvette 放置在荧计支架中。
- 一旦样品热平衡(3-5分钟后),触发测量。1 分钟后,在样品中加入 30 μL LB 脂质体悬浮液(最终浓度为 200 μM 总脂质)。3 分钟后,将 LTP 注入样品中,使 LTP 的最终浓度达到 200 nM,并获取剩余 21 分钟的信号。
- 进行并行实验,使 NBD 信号正常化。将 30 μL LA-Eq 脂质体悬架与 250 nM NBD-C2乳酸 混合在 HKM 缓冲器中(最终体积为 570 μL)。1分钟后,注射30微升LB-Eq 脂质体悬浮液。
注:LA-Eq 和 LB-Eq 脂质体的脂质成分与转移检测中使用的 LA 和 LB 脂 质体相似,但每个脂质成分分别含有 2.5 摩尔% PS 和 2.5 mol% PI(4)P。因此,测量的 NBD 信号(称为 FEq)与应测量的信号相对应,如果 PS 通过传输过程在 LA 和 LB 脂质体之间完全平衡,则应测量该信号。 - 转换使用感兴趣的 LTP 测量的动能曲线,以确定随着时间的推移从 LA 传输到 LB 脂质体的 PS(以 μM 为单位)的数量。使用以下公式使曲线的每个数据点 (F) 正常化。
F规范 = (F-F0) /(FEq-F0) (5)
其中 F0 在添加 LTP 之前对应 NBD 信号,FEq 是第 5.5 步测量的信号。
注:从 LA 到 LB 脂质体传输的 PS(以 μM 为内)量对应于 2.5 × FNorm,因为均衡对应于一半可访问的 PS 分子的情况, LA 脂质体的外页(即相当于0.5×200微米总脂质的5摩尔%)已转移到LB 脂质体中。
6. PI (4)P 传输的实时测量
- 设置荧光计(激发和排放波长、带宽、采集时间、时间分辨率),用于 PS 传输检测。同样,使用相同的缓冲器、小面包和脂质体在相同温度下持续搅拌下执行实验。
- 在 cuvette 中,将 LB 脂质体悬架和 NBD-PHFAPP 的 30 μL 与预温的 HKM 缓冲器混合,获得 570 μL(200 μM 总脂质、250 nM NBD-PHFAPP)的最终体积。一旦达到样品的热平衡,开始测量,1分钟后,注射30微升LA 脂质体悬浮液。3分钟后,注入感兴趣的LTP(最终浓度为200 nM),并记录信号。
- 执行第二个实验以使 NBD 信号正常化。将 30 μL LB-Eq 脂质体悬架与 250 nM NBD-PHFAPP 混合在 570 μL 的 HKM 缓冲器中。1分钟后,注射30微升LA-Eq 脂质体悬浮液。
注:在这里,NBD信号,称为FEq,对应于如果PI(4)P在LA 和LB 脂体之间完全平衡时应该测量的信号。 - 转换动能曲线,以确定随着时间的推移从 LB 传输到 LA 脂质体的 PI (4)P (以 μM 为内) 的数量。每个数据点 (F) 都通过使用公式 5 进行规范化,其中 F0 在添加 LTP 之前与 NBD 信号相对应,FEq 是第 6.3 步测量的信号。
注:从 LB到 LA脂质体传输的 PI (4)P (在 μM 中) 的金额对应于 2.5 × FNorm,因为均衡值对应于 LB 脂质体外页中包含 PI (4)P 的一半的情况(即, 0.5 × 5 μM) 已在 LA 脂质体中转移。
7. 动能曲线分析
- 通过确定 LTP 在注射到 cuvette 后的最初几秒钟内将脂质从一个脂质体组群转移到另一个脂质组的速度,量化 LTP 的效率程度。
- 对传输动力学的第一个数据点进行线性回归以获得坡度。将坡度值除以反应混合物中的 LTP 浓度,以确定每个蛋白质每次单位传输的脂质分子数量(最小或 s)。
结果
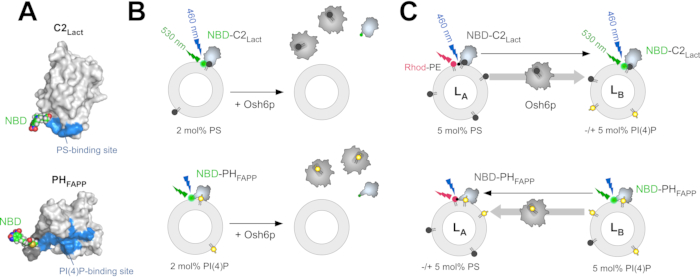
图1:荧光脂质传感器和 体外 测定说明。 (A) NBD-C2乳酸 酯和NBD-PHFAPP 的三维模型基于牛乳酸(PDB ID:3BN648)的C2域晶体结构和人类FAPP1蛋白PH域的NMR结构(PDB ID:2KCJ46)。一个 N, N '二甲基 -N-...
讨论
这些检测的结果直接取决于荧光脂质传感器的信号。因此,这些探针的净化标有与 NBD 的 1:1 比率,并且没有免费的 NBD 氟污染,这是本协议中的关键步骤。还必须检查所检查的 LTP 是否正确折叠而不是聚合。在提取检测中测试的LTP量必须等于或高于可访问的PS或PI(4)P分子,以正确测量该LTP是否有效提取这些脂质。事实上,NBD-C2乳酸和 NBD-PHFAPP分别与 PS 和 PI (4)P 结合,遵循经典...
披露声明
作者宣称不存在利益冲突。
致谢
我们感谢卡特里斯博士对手稿的仔细校对。这项工作由法国国家研究机构赠款ExCHANGE(ANR-16-CE13-0006)和全国研究中心资助。
材料
| Name | Company | Catalog Number | Comments |
| L-cysteine ≥97 % (FG) | Sigma | W326305-100G | Prepare a 10 mM L-cysteine stock solution in water. Aliquots are stored at -20 °C |
| 2 mL Amber Vial, PTFE/Rub Lnr, for lipids storage in CHCL3 | Wheaton | W224681 | |
| 4 mm-diameter glass beads | Sigma | Z265934-1EA | |
| 50 mL conical centrifuge tube | Falcon | ||
| ÄKTA purifier | GE healthcare | FPLC | |
| Aluminium foil | |||
| Amicon Ultra-15 with a MWCO of 3 and 10 kDa | Merck | UFC900324, UFC901024 | |
| Amicon Ultra-4 with a MWCO of 3 and 10 kDa | Merck | UFC800324, UFC801024 | |
| Ampicillin | Prepare a 50 mg/mL stock solution with filtered and sterilized water and store it at -20 °C. | ||
| Bestatin | Sigma | B8385-10mg | |
| BL21 Gold Competent Cells | Agilent | ||
| C16:0 Liss (Rhod-PE) in CHCl3 (1 mg/mL) | Avanti Polar Lipids | 810158C-5MG | |
| C16:0/C16:0-PI(4)P | Echelon Lipids | P-4016-3 | Dissolve 1 mg of C16:0/C16:0-PI(4)P powder in 250 µL of MeOH and 250 µL of CHCl3. Then complete with CHCl3 to 1 mL. The solution must become clear. |
| C16:0/C18:1-PS (POPS) in CHCl3 (10 mg/mL) | Avanti Polar Lipids | 840034C-25mg | |
| C18:1/C18:1-PC (DOPC) in CHCl3 (25 mg/mL) | Avanti Polar Lipids | 850375C-500mg | |
| CaCl2 | Sigma | Prepare 10 mM CaCl2 stock solution in water. | |
| Cell Disruptor | Constant Dynamics | ||
| Chloroform (CHCl3) RPE-ISO | Carlo Erba | 438601 | |
| Complete EDTA-free protease inhibitor cocktail | Roche | 5056489001 | |
| Deionized (Milli-Q) water | |||
| Dimethylformamide (DMF), anhydrous, >99% pure | |||
| DNAse I Recombinant, RNAse free, in powder | Roche | 10104159001 | |
| DTT | Euromedex | EU0006-B | Prepare 1 M DTT stock solution in Milli-Q water. Prepare 1 mL aliquots and store them at -20 °C. |
| Econo-Pac chromatography columns (1.5 × 12 cm). | Biorad | 7321010 | |
| Electroporation cuvette 2 mm | Ozyme | EP102 | |
| Electroporator Eppendorf 2510 | Eppendorf | ||
| Fixed-Angle Rotor Ti45 and Ti45 tubes | Beckman | Spinning the batcerial lysates | |
| Glass-syringes (10, 25, and 50 µL) for fluorescence experiment | Hamilton | ||
| Glass-syringes (25 , 100, 250, 500, and 1000 µL) to handle lipid stock solutions | Hamilton | 1702RNR, 1710RNR, 1725RNR, 1750RN type3, 1001RN | |
| Glutathione Sepharose 4B beads | GE Healthcare | 17-0756-05 | |
| Glycerol (99% pure) | Sigma | G5516-500ML | |
| Hemolysis tubes with a cap | |||
| HEPES , >99 % pure | Sigma | H3375-500G | |
| Illustra NAP 10 desalting column | GE healthcare | GE17-0854-02 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Euromedex | EU0008-B | Prepare 1 M IPTG stock solution in Milli-Qwater. Prepare 1 mL aliquots and store them at -20 °C. |
| K-Acetate | Prolabo | 26664.293 | |
| Lennox LB Broth medium without glucose | Prepared with milli-Q water and autoclaved. | ||
| Liquid nitrogen | Linde | ||
| Methanol (MeOH) ≥99.8% | VWR | 20847.24 | |
| MgCl2 | Sigma | Prepare a 2 M MgCl2 solution. Filter the solution using a 0.45 µm filter. | |
| Microplate 96 Well PS F-Botom Black Non-Binding | Greiner Bio-one | 655900 | |
| Mini-Extruder with two 1 mL gas-tight Hamilton syringes | Avanti Polar Lipids | 610023 | |
| Monochromator-based fluorescence plate reader | TECAN | M1000 Pro | |
| N,N'-Dimethyl-N-(Iodoacetyl)-N'-(7-Nitrobenz-2-Oxa-1,3-Diazol-4-yl)Ethylenediamine) (IANBD Amide) | Molecular Probes | Dissolve 25 mg of IANBD in 2.5 mL of dimethylsulfoxide (DMSO) and prepare 25 aliquot of 100 µL in 1.5 mL screw-cap tubes. Do not completely screw the cap. Then, remove DMSO in a freeze-dryer to obtain 1 mg of dry IANBD per tube. Tubes are closed and stored at -20 °C in the dark. | |
| NaCl | Sigma | S3014-1KG | |
| PBS | 137 mM NaCl, 2.7 mM KCl, 10 mM NaH2PO4, 1.8 mM KH2PO4, autoclaved and stored at 4 °C. | ||
| Pear-shaped glass flasks (25 mL, 14/23, Duran glass) | Duran Group | ||
| Pepstatin | Sigma | p5318-25mg | |
| pGEX-C2LACT plasmid | Available on request from our lab | ||
| pGEX-PHFAPP plasmid | Available on request from our lab | ||
| Phenylmethylsulfonyl fluoride (PMSF) ≥98.5% (GC) | Sigma | P7626-25g | Prepare a 200 mM PMSF stock solution in isopropanol |
| Phosphoramidon | Sigma | R7385-10mg | |
| Polycarbonate filters (19 mm in diameter) with pore size of 0.2 µm | Avanti Polar Lipids | 610006 | |
| Poly-Prep chromatography column (with a 0-2 mL bed volume and a 10 mL reservoir) | Biorad | 7311550 | |
| Prefilters (10 mm in diameter). | Avanti Polar Lipids | 610014 | |
| PyMOL | http://pymol.org/ | Construction of the 3D models of the proteins (Figure 1A) | |
| Quartz cuvette for UV/visible fluorescence (minimum volume of 600 µL) | Hellma | ||
| Quartz cuvettes | Hellma | ||
| Refrigerated centrifuge Eppendorf 5427R | Eppendorf | ||
| Rotary evaporator | Buchi | B-100 | |
| Screw-cap microcentriguge tubes (1.5 mL) | Sarsted | ||
| Small magnetic PFTE stirring bar (5 × 2 mm) | |||
| Snap-cap microcentriguge tubes (0.5, 1, and 2 mL) | Eppendorf | ||
| SYPRO orange | fluorescent stain to detect protein in SDS-PAGE gel | ||
| Thermomixer | Starlab | ||
| THROMBIN, FROM HUMAN PLASMA | Sigma | 10602400001 | Dissolve 20 units in 1 mL of milli-Q water and prepare 25 µL aliquots in 0.5 mL Eppendorf tubes. Then freeze and store at -80 °C. |
| Tris, ultra pure | MP | 819623 | |
| Ultracentrifuge L90K | Beckman | ||
| UV/Visible absorbance spectrophotometer | SAFAS | ||
| UV/visible spectrofluorometer with a temperature-controlled cell holder and stirring device | Jasco or Shimadzu | Jasco FP-8300 or Shimadzu RF-5301PC | |
| Vacuum chamber | |||
| Water bath | Julabo | ||
| XK 16/70 column packed with Sephacryl S200HR | GE healthcare |
参考文献
- Drin, G. Topological regulation of lipid balance in cells. Annual Review of Biochemistry. 83, 51-77 (2014).
- Bigay, J., Antonny, B. Curvature, lipid packing, and electrostatics of membrane organelles: defining cellular territories in determining specificity. Developmental Cell. 23 (5), 886-895 (2012).
- Prinz, W. A. Lipid trafficking sans vesicles: where, why, how. Cell. 143 (6), 870-874 (2010).
- Holthuis, J. C., Menon, A. K. Lipid landscapes and pipelines in membrane homeostasis. Nature. 510 (7503), 48-57 (2014).
- Wong, L. H., Copic, A., Levine, T. P. Advances on the transfer of lipids by lipid transfer proteins. Trends in Biochemical Sciences. 42 (7), 516-530 (2017).
- Wong, L. H., Gatta, A. T., Levine, T. P. Lipid transfer proteins: the lipid commute via shuttles, bridges and tubes. Nature Reviews Molecular Cell Biology. 20 (2), 85-101 (2019).
- Iaea, D. B., Dikiy, I., Kiburu, I., Eliezer, D., Maxfield, F. R. STARD4 membrane interactions and sterol binding. Biochemistry. 54 (30), 4623-4636 (2015).
- Wilhelm, L. P., et al. STARD3 mediates endoplasmic reticulum-to-endosome cholesterol transport at membrane contact sites. The EMBO Journal. 36 (10), 1412-1433 (2017).
- Bian, X., Saheki, Y., De Camilli, P. Ca(2+) releases E-Syt1 autoinhibition to couple ER-plasma membrane tethering with lipid transport. The EMBO Journal. 37 (2), 219-234 (2018).
- Horenkamp, F. A., Valverde, D. P., Nunnari, J., Reinisch, K. M. Molecular basis for sterol transport by StART-like lipid transfer domains. The EMBO Journal. 37 (6), 98002 (2018).
- Jentsch, J. A., et al. Structural basis of sterol binding and transport by a yeast StARkin domain. The Journal of Biological Chemistry. 293 (15), 5522-5531 (2018).
- Moser von Filseck, J., et al. INTRACELLULAR TRANSPORT. Phosphatidylserine transport by ORP/Osh proteins is driven by phosphatidylinositol 4-phosphate. Science. 349 (6246), 432-436 (2015).
- Daum, G., et al. Systematic analysis of yeast strains with possible defects in lipid metabolism. Yeast. 15 (7), 601-614 (1999).
- Ejsing, C. S., et al. Global analysis of the yeast lipidome by quantitative shotgun mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 106 (7), 2136-2141 (2009).
- Leidl, K., Liebisch, G., Richter, D., Schmitz, G. Mass spectrometric analysis of lipid species of human circulating blood cells. Biochimica et Biophysica Acta. 1781 (10), 655-664 (2008).
- Sampaio, J. L., et al. Membrane lipidome of an epithelial cell line. Proceedings of the National Academy of Sciences of the United States of America. 108 (5), 1903-1907 (2011).
- Vance, J. E., Steenbergen, R. Metabolism and functions of phosphatidylserine. Progress in Lipid Research. 44 (4), 207-234 (2005).
- Zinser, E., et al. Phospholipid synthesis and lipid composition of subcellular membranes in the unicellular eukaryote Saccharomyces cerevisiae. Journal of Bacteriology. 173 (6), 2026-2034 (1991).
- Leventis, P. A., Grinstein, S. The distribution and function of phosphatidylserine in cellular membranes. Annual Review of Biophysics. 39, 407-427 (2010).
- Yeung, T., et al. Membrane phosphatidylserine regulates surface charge and protein localization. Science. 319 (5860), 210-213 (2008).
- Kim, J., Shishido, T., Jiang, X., Aderem, A., McLaughlin, S. Phosphorylation, high ionic strength, and calmodulin reverse the binding of MARCKS to phospholipid vesicles. Journal of Biological Chemistry. 269 (45), 28214-28219 (1994).
- Sigal, C. T., Zhou, W., Buser, C. A., McLaughlin, S., Resh, M. D. Amino-terminal basic residues of Src mediate membrane binding through electrostatic interaction with acidic phospholipids. Proceedings of the National Academy of Sciences. 91 (25), 12253-12257 (1994).
- Gal Bivona, T., et al. PKC regulates a farnesyl-electrostatic switch on K-Ras that promotes its association with Bcl-XL on mitochondria and induces apoptosis. Molecular Cell. 21 (4), 481-493 (2006).
- Finkielstein, C. V., Overduin, M., Capelluto, D. G. Cell migration and signaling specificity is determined by the phosphatidylserine recognition motif of Rac1. The Journal of Biological Chemistry. 281 (37), 27317-27326 (2006).
- Bolsover, S. R., Gomez-Fernandez, J. C., Corbalan-Garcia, S. Role of the Ca2+/Phosphatidylserine Binding Region of the C2 Domain in the Translocation of Protein Kinase Cα to the Plasma Membrane. Journal of Biological Chemistry. 278 (12), 10282-10290 (2003).
- Vance, J. E., Tasseva, G. Formation and function of phosphatidylserine and phosphatidylethanolamine in mammalian cells. Biochimica et Biophysica Acta. 1831 (3), 543-554 (2013).
- Maeda, K., et al. Interactome map uncovers phosphatidylserine transport by oxysterol-binding proteins. Nature. 501 (7466), 257-261 (2013).
- D'Ambrosio, J. M., et al. Osh6 requires Ist2 for localization to ER-PM contacts and efficient phosphatidylserine transport in budding yeast. Journal of Cell Science. 133 (11), 243733 (2020).
- Manford, A. G., Stefan, C. J., Yuan, H. L., Macgurn, J. A., Emr, S. D. ER-to-plasma membrane tethering proteins regulate cell signaling and ER morphology. Developmental Cell. 23 (6), 1129-1140 (2012).
- Collado, J., et al. Tricalbin-mediated contact sites control ER curvature to maintain plasma membrane integrity. Developmental Cell. 51 (4), 476-487 (2019).
- Hoffmann, P. C., et al. Tricalbins contribute to cellular lipid flux and form curved ER-PM contacts that are bridged by rod-shaped structures. Developmental Cell. 51 (4), 488-502 (2019).
- Lipp, N. F., et al. An electrostatic switching mechanism to control the lipid transfer activity of Osh6p. Nature Communications. 10 (1), 3926 (2019).
- Chung, J., et al. INTRACELLULAR TRANSPORT. PI4P/phosphatidylserine countertransport at ORP5- and ORP8-mediated ER-plasma membrane contacts. Science. 349 (6246), 428-432 (2015).
- Sohn, M., et al. PI(4,5)P2 controls plasma membrane PI4P and PS levels via ORP5/8 recruitment to ER-PM contact sites. The Journal of Cell Biology. 217 (5), 1797-1813 (2018).
- Ghai, R., et al. ORP5 and ORP8 bind phosphatidylinositol-4, 5-biphosphate (PtdIns(4,5)P 2) and regulate its level at the plasma membrane. Nature Communications. 8 (1), 757 (2017).
- Sohn, M., et al. Lenz-Majewski mutations in PTDSS1 affect phosphatidylinositol 4-phosphate metabolism at ER-PM and ER-Golgi junctions. Proceedings of the National Academy of Sciences of the United States of America. 113 (16), 4314-4319 (2016).
- Kattan, W. E., et al. Targeting plasma membrane phosphatidylserine content to inhibit oncogenic KRAS function. Life Science Alliance. 2 (5), 00431 (2019).
- Du, X., Turner, N., Yang, H. The role of oxysterol-binding protein and its related proteins in cancer. Seminars in Cell & Developmental Biology. 81, 149-153 (2018).
- Galmes, R., et al. ORP5/ORP8 localize to endoplasmic reticulum-mitochondria contacts and are involved in mitochondrial function. EMBO reports. 17 (6), 800-810 (2016).
- Du, X., et al. ORP5 localizes to ER-lipid droplet contacts and regulates the level of PI(4)P on lipid droplets. The Journal of Cell Biology. 219 (1), 201905162 (2020).
- Wang, H., et al. ORP2 delivers cholesterol to the plasma membrane in exchange for phosphatidylinositol 4, 5-bisphosphate (PI(4,5)P2). Molecular Cell. 73 (3), 458-473 (2019).
- Kay, J. G., Grinstein, S. Sensing phosphatidylserine in cellular membranes. Sensors (Basel). 11 (2), 1744-1755 (2011).
- Moser von Filseck, J., Vanni, S., Mesmin, B., Antonny, B., Drin, G. A phosphatidylinositol-4-phosphate powered exchange mechanism to create a lipid gradient between membranes. Nature Communications. 6, 6671 (2015).
- Wills, R. C., Goulden, B. D., Hammond, G. R. V. Genetically encoded lipid biosensors. Molecular Biology of the Cell. 29 (13), 1526-1532 (2018).
- Raychaudhuri, S., Im, Y. J., Hurley, J. H., Prinz, W. A. Nonvesicular sterol movement from plasma membrane to ER requires oxysterol-binding protein-related proteins and phosphoinositides. The Journal of Cell Biology. 173 (1), 107-119 (2006).
- Lenoir, M., et al. Structural basis of wedging the Golgi membrane by FAPP pleckstrin homology domains. EMBO reports. 11 (4), 279-284 (2010).
- Liu, Y., Kahn, R. A., Prestegard, J. H. Interaction of Fapp1 with Arf1 and PI4P at a membrane surface: an example of coincidence detection. Structure. 22 (3), 421-430 (2014).
- Shao, C., Novakovic, V. A., Head, J. F., Seaton, B. A., Gilbert, G. E. Crystal structure of lactadherin C2 domain at 1.7A resolution with mutational and computational analyses of its membrane-binding motif. The Journal of Biological Chemistry. 283 (11), 7230-7241 (2008).
- Lipp, N. F., Ikhlef, S., Milanini, J., Drin, G. Lipid exchangers: cellular functions and mechanistic links with phosphoinositide metabolism. Frontiers in Cell and Developmental Biology. 8, 663 (2020).
- Venditti, R., et al. Molecular determinants of ER-Golgi contacts identified through a new FRET-FLIM system. The Journal of Cell Biology. 218 (3), 1055-1065 (2019).
- Pemberton, J. G., et al. Defining the subcellular distribution and metabolic channeling of phosphatidylinositol. The Journal of Cell Biology. 219 (3), (2020).
- Nakanishi, H., de los Santos, P., Neiman, A. M. Positive and negative regulation of a SNARE protein by control of intracellular localization. Molecular Biology of the Cell. 15 (4), 1802-1815 (2004).
- Maekawa, M., Yang, Y., Fairn, G. D. Perfringolysin O theta toxin as a tool to monitor the distribution and inhomogeneity of cholesterol in cellular membranes. Toxins. 8 (3), 67 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。