Method Article
TGF-β بوساطة البطانية إلى الانتقال المتوسط (EndMT) والتقييم الوظيفي لمؤثري EndMT باستخدام CRISPR/Cas9 تحرير الجينات
In This Article
Summary
نحن نصف طرق التحقيق في EndMT الناجم عن TGF-β2 في الخلايا البطانية من خلال مراقبة تغيرات مورفولوجيا الخلايا وفحص التغيرات في علامة EndMT ذات الصلة باستخدام تلطيخ immunofluorescence. تم وصف تحرير الجينات CRISPR/Cas9 واستخدامه لاستنفاد ترميز الجينات الحلزون للتحقيق في دورها في EndMT الناجم عن TGF-β2.
Abstract
استجابة للإشارات الخارجية المحددة وتنشيط بعض عوامل النسخ ، يمكن للخلايا البطانية التفريق إلى نمط الظاهرية الشبيه بالميزنشيمال ، وهي عملية يطلق عليها الانتقال البطاني إلى المتوسط (EndMT). وقد أشارت النتائج الناشئة إلى أن EndMT مرتبط سببيا بأمراض بشرية متعددة، مثل التليف والسرطان. وبالإضافة إلى ذلك، يمكن تطبيق الخلايا المتوسطة المشتقة من البطانية في إجراءات تجديد الأنسجة، حيث يمكن تمييزها بشكل أكبر إلى أنواع مختلفة من الخلايا (مثل الأروميات العظمية والخلايا الشوندروسيتية). وبالتالي ، فإن التلاعب الانتقائي في EndMT قد يكون له إمكانات سريرية. مثل الانتقال الظهاري-mesenchymal (EMT)، يمكن أن يكون سبب EndMT بقوة من قبل السيتوكين إفراز تحويل عامل النمو بيتا (TGF-β)، الذي يحفز التعبير عن ما يسمى عوامل النسخ EndMT (EndMT-TFs)، بما في ذلك الحلزون والرخوة. هذه EndMT-TFs ثم صعودا وهبوطاتغييد مستويات البروتينات المتوسطة والظهارية، على التوالي. هنا، نقوم بوصف طرق التحقيق في EndMT الناجم عن β TGF في المختبر، بما في ذلك بروتوكول لدراسة دور TFs معينة في EndMT الناجم عن β TGF. باستخدام هذه التقنيات، ونحن نقدم دليلا على أن TGF-α2 يحفز EndMT في خلايا بطانة الأوعية الدموية الدقيقة البنكرياس مورين (خلايا MS-1)، وأن الاستنفاد الوراثي للحلزون باستخدام تتجمع بانتظام يكرر palindromic قصيرة (CRISPR) / CRISPR المرتبطة البروتين 9 (Cas9) بوساطة تحرير الجينات، يلغي هذه الظاهرة. وقد يكون هذا النهج بمثابة نموذج لاستجواب التشكيلات المحتملة لعلم الأحياء البطاني، ويمكن استخدامه لأداء الشاشات الوراثية أو الدوائية من أجل تحديد المنظمين مستجدات EndMT، مع إمكانية تطبيقها في الأمراض البشرية.
Introduction
إن الانتقال البطاني إلى المتوسط (EndMT) هو ظاهرة بيولوجية متعددة الخطوات وديناميكية تم ربطها بعمليات فسيولوجية ومرضية متنوعة1و2. عند EndMT الخلايا البطانية تفقد تدريجيا الصفات البطانية، في حين الحصول على خصائص mesenchymal3; وهكذا، فإن الخلايا البطانية المضغوطة بإحكام والمنظمة تنظيما جيدا تفرق إلى خلايا ممدودة تشبه الخلايا المتوسطة. التغيرات المورفولوجية في EndMT تتزامن مع التعديلات في التعبير عن جينات وبروتينات معينة. بشكل عام ، ينخفض التعبير عن البروتينات التي تحافظ على الخصائص البطانية ، بما في ذلك البطانية الوعائية (VE) - cadherin ، الصفائح الدموية / EC جزيء الالتصاق -1 (CD31/Pecam-1). في وقت واحد، تتراكم البروتينات المتعلقة بوظائف العضلات الملساء، مثل أكتين العضلات α (α-Sma) وبروتين العضلات الملساء 22α (Sm22α). وقد أظهرت النتائج الناشئة أن EndMT بعد الولادة يساهم في تطور الأمراض البشرية، مثل السرطان، تليف القلب، ارتفاع ضغط الدم الشرياني الرئوي (PAH)، تصلب الشرايين (AS)، تليف الأعضاء، الخ2،4،5،6،7. إن الفهم الأعمق للآليات الأساسية ل EndMT وكيفية توجيه عملية EndMT سيوفر أساليب علاجية جديدة للأمراض المرتبطة ب EndMT والطب التجديدي.
TGF-β هي واحدة من الحث EndMT الرئيسية، وغيرها من العوامل المعروفة المعنية تشمل Wnt /β-catenin، نوتش، وبعض السيتوكينات الالتهابية1. وبما أن السياق الخلوي هو المفتاح للاستجابات التي أثارها TGF-β، فإن تفاعل TGF-β مع إشارات ترويج EndMT الأخرى وثيق الصلة ب TGF-β للحصول على استجابة EndMT. عند تفعيل TGF-β نوع سطح الخلية الأول والنوع الثاني مستقبلات سيرين / ثريونين كيناز، يتم تنشيط مسار Smad الكنسي داخل الخلايا. TGF-β مستقبلات بوساطة الفوسفورية Smad2/3 شكل المجمعات غير الرقمية مع Smad4 التي تنقل إلى النواة، حيث أنها upregulate التعبير عن عوامل النسخ EndMT ذات الصلة. على غرار الانتقال الظهاري -mesenchymal (EMT) ، يتم تحريض عوامل النسخ مثل الحلزون ، سبيكة ، تويست ، Zeb1 و Zeb2 عن طريق إشارات TGF-β والمساهمة في إعادة برمجة الجينات في EndMT8.
وقد تم تحديد الحلزون في كثير من الأحيان كعامل رئيسي في EndMT. الحلزون يربط إلى المروج من الجينات ترميز بروتينات الالتصاق الخلية ويقمع النسخ الخاصة بهم، وهو ما يقابله تعزيز التعبير عن البروتينات mesenchymal9. الخلايا البطانية تضم مجموعة غير متجانسة جدا والتأثير النسبي للمحفزات خارج الخلية المتنوعة على EndMT قد تختلف بين السياقات الخلوية البطانية أو أنواع الخلايا10. نظرا لتشابهها مع EMT ، فإن بعض المنهجيات مفيدة للتحقيق في كل من آليات EMT و EndMT8. وفي هذا الصدد، تؤكد الرابطة الدولية ل EMT بقوة على الحاجة إلى تقنيات تكميلية لإثبات حدوث EMT/EndMT11في نهاية المطاف.
هنا نحن نصف طريقة لرصد وتصور عملية EndMT الناجمة عن TGF-β. يوفر تلطيخ immunofluorescence المعلومات الأساسية حول تغيرات التعبير في البروتينات / العلامات المستهدفة ، والتي تستخدم كمؤشرات على ما إذا كانت عملية EndMT تحدث. بالإضافة إلى ذلك ، يمكن أن يتصور تلطيخ immunofluorescence توطين البروتينات / العلامات ومورفولوجيا الخلايا. لدراسة النشاط المحتمل لصناديق TFs محددة (أو غيرها من المنظمين المنبع أو المصب) المشاركة في TGF-β بوساطة EndMT، ونحن نصف بروتوكول باستخدام تتجمع بانتظام يكرر palindromic قصيرة متباعدة (CRISPR) / CRISPR المرتبطة البروتين 9 (Cas9) تحرير الجينات لاستنفاد جينات محددة من الخلايا، وذلك باستخدام الحلزون TF كمثال. Cas9 هو ثنائي الحمض النووي الريبي الموجهة الإندونوكلياز الذي يتعرف ويلتصق تسلسل مكملة لتسلسل CRISPR في البكتيريا12. يستخدم نظام CRISPR/Cas9 حاليا على نطاق واسع لأنه يسهل الهندسة الوراثية في المختبر وفي الجسم الحي13. بتوجيه من دليل واحد الجيش الملكي النيبالي (sgRNA) ، وأعرب عن ectopically Cas9 يولد كسر حبلا مزدوجة في تسلسل الاستهداف المحدد مسبقا في مكان معين الجينات. يتم الانضمام إلى النهاية غير المتجانسة (NHEJ) لإصلاح فواصل الخيط الناجمة عن Cas9 ، عن طريق عمليات إدراج أو حذف النيوكليوتيدات العشوائية مما يؤدي إلى تعطيل وتعطيل الجين المستهدف. ونصف بالتفصيل أساليب تصميم الزغازات الانتقائية وتوليد ناقلات متوافقة مع العدسية تحتوي على الزغازات الزغازة المصممة. ونتيجة لذلك، يمكن توليد خلايا بطانة الرحم المستقرة المستنفدة للجين بطريقة فعالة وموثوقة.
في هذه الدراسة، استخدمنا الخلايا البطانية الأوعية الدموية الدقيقة المورين (MS-1)14 كنظام نموذجي لفحص عملية EndMT الناجمة عن TGF-β2. أظهرت دراستنا السابقة أن الحلزون هو عامل النسخ الرئيسي الذي زاده TGF-β2 ، والذي يتم من خلاله تحريض EndMT في خلايا MS-115. عند تحرير الجينات CRISPR/Cas9 يبطل التعبير الحلزوني في خلايا MS-1، فشل TGF-β2 في التوسط EndMT. يمكن تطبيق سير العمل هذا لدراسة جينات أخرى (مشتبه بها) مرتبطة ب EndMT.
Protocol
1. تحريض EndMT بواسطة TGF-β2
- خلايا MS-1 في متوسط النسر المعدل في دولبيكو (DMEM) الذي يحتوي على 10٪ مصل البقر الجنيني (FBS) و 100 U/mL البنسلين / العقدية في حاضنة (5٪ CO2، 37 درجة مئوية). معطف جميع الأطباق الثقافة / لوحات مع 0.1٪ ث / الخامس الجيلاتين لمدة 10 دقيقة قبل الاستخدام.
- غسل بلطف MS-1 الخلايا مع 1x الفوسفات المالحة المخزنة (PBS)، إضافة 2 مل من محلول تريبسين-EDTA (0.25٪ تريبسين و 0.02٪ EDTA) إلى طبق 10 سم، واحتضان لمدة 2 دقيقة في 37 درجة مئوية لفصلها. في وقت لاحق، إضافة 5 مل من الثقافة كاملة المتوسطة لإرواء رد الفعل.
- نقل تعليق الخلية إلى أنبوب 15 مل و الطرد المركزي في 200 x ز لمدة 3 دقائق في درجة حرارة الغرفة.
- تجاهل supernatant وإعادة إنفاق الخلايا في 4 مل من المتوسطة الطازجة التي تحتوي على FBS وبينسلين / streptomycin. عد الخلايا باستخدام عداد الخلايا التلقائي.
- البذور 1 × 103 خلايا لكل سم2 لمزيد من الثقافة. على سبيل المثال، البذور 9.5 × 103 خلايا / جيدا ل6 لوحات الآبار، أو 1.9 × 103 خلايا / جيدا لوحات 24 بئر.
- احتضان الخلايا بين عشية وضحاها للسماح لهم بالالتصاق والتعافي، ثم تحفيز خلايا MS-1 مع TGF-β2 لمدة 3 أيام. إضافة مستقبلات TGF-β كيناز المانع SB431542 (5 ميكرومتر) 30 دقيقة قبل التحفيز TGF-β2. علاج الخلايا الأخرى مع السيارة (DMSO).
ملاحظة: حل TGF-β2 في 4 MM HCl تحتوي على 0.1٪ مصل البقري البشري الألبومين (جيش الأمن العام). إضافة نفس الكمية من المخزن المؤقت ليغاند دون TGF-β2 إلى مجموعة التحكم. يمكن تكييف تركيز TGF-β2 ليكون 0.1-1 نانوغرام / مل لإجراء فحوصات محددة. انظر المؤشرات في الأرقام المقابلة. - بعد 3 أيام، قم بفحص مورفولوجيا الخلية بالتصوير الميداني الساطع (بالمجهر المقلوب) وإجراء تلطيخ immunofluorescence (انظر الخطوة 2) لتقييم التغيرات في العلامة المرتبطة ب EndMT. إجراء ما لا يقل عن ثلاث تجارب مستقلة للحصول على ثلاثية الليكات البيولوجية.
2. تلطيخ المناعة
- جرب زراعة خلايا MS-1 (الخطوة 1.2) ثم أعد زراعة 1.9 × 103 خلايا على زجاج تغطية مستدير 12 مم مطلي بالجيلاتين 0.1٪ على الجزء السفلي من لوحة 24 جيدا.
- بعد زراعة الخلايا بين عشية وضحاها، إضافة TGF-β2 (التركيز النهائي 1 نانوغرام / مل) إلى الخلايا لمدة 3 أيام. استخدم وسيطا يحتوي على المخزن المؤقت ليغاند كعنصر تحكم سالب.
- أداء Pecam-1 وSM22α تلطيخ.
- بعد تحفيز الخلايا مع TGF-β2 (أو التحكم) لمدة 3 أيام، وإزالة المتوسطة، وغسل الخلايا مع برنامج تلفزيوني 1x.
- إضافة 300 ميكرولتر من 4٪ الفورمالديهايد إلى كل بئر واحتضان لمدة 10 دقيقة في درجة حرارة الغرفة لإصلاح الخلايا. غسل 3x مع برنامج تلفزيوني 1x بعد الحضانة.
- إضافة 300 ميكرولتر من 0.1٪ تريتون X-100 في برنامج تلفزيوني 1x إلى كل بئر واحتضان لمدة 10 دقيقة في درجة حرارة الغرفة ل permeabilize الخلايا. بعد الحضانة، قم بإزالة محلول Triton X-100 وغسل الخلايا 3x مع برنامج تلفزيوني 1x.
- منع الخلايا مع 3٪ ألبوم مصل البقر (BSA) في برنامج تلفزيوني 1x لمدة 45 دقيقة في درجة حرارة الغرفة.
- تمييع الأجسام المضادة Pecam-1 و Sm22α الأولية التي تتعرف على بروتينات المورين 1:500 مع برنامج تلفزيوني 1x. ثم احتضان الخلايا الثابتة مع الأجسام المضادة الأولية لمدة 45 دقيقة في درجة حرارة الغرفة.
- بعد غسل 3x مع برنامج تلفزيوني 1x ، واحتضان الخلايا مع 1000x الأجسام المضادة الثانوية المخففة ، بما في ذلك الحمار المضادة للفئران اليكسا 488 والماعز المضادة للأرنب اليكسا 594 ، لمدة 45 دقيقة في درجة حرارة الغرفة.
ملاحظة: حماية العينات من الضوء أثناء تلطيخ. - بعد الشطف 3x مع برنامج تلفزيوني 1x، ضع الزجاج غطاء المبذر مع الخلايا وجهه إلى أسفل على قطرة من المتوسطة المتصاعدة التي تحتوي على 4'،6-diamidino-2-phenylindole (DAPI) على شريحة لتلطيخ النوى.
- إصلاح محيط الزجاج الغطاء مع طلاء الأظافر شفافة وتخزينها في 4 درجة مئوية.
- الحصول على صور تمثيلية مع المجهر confocal. تعيين أطوال موجية ليزر في 405 نانومتر، 488 نانومتر و 552 نانومتر للكشف عن DAPI، Pecam-1 و Sm22α، على التوالي. لكل قناة، تم التقاط جميع الصور بنفس الإعدادات ووقت التعرض. إجراء ما لا يقل عن ثلاث تجارب مستقلة للحصول على ثلاثية الليكات البيولوجية.
3. ضرب من الحلزون باستخدام CRISPR / Cas9 التحرير
- تصميم اثنين من sgRNAs مستقلة تستهدف الحلزون مورين.
- تصميم sgRNAs باستخدام أدوات على الانترنت CHOPCHOP (https://chopchop.cbu.uib.no/) وكاس OFFinder (http://www.rgenome.net/cas-offinder/) وفقا لاسم الجينات المستهدفة والأنواع.
- توقع النشاط غير المستهدف للSgRNAs المصممة التي تستهدف الحلزون مع خوارزميتين مستقلتين ، بما في ذلك Cas-OFFinder (http://www.rgenome.net/cas-offinder/) و CHOPCHOP (http://chopchop.cbu.uib.no/).
- اختر اثنين من sgRNAs مع أدنى خارج النشاط. تصميم اثنين من oligos sgRNA التكميلية مع Bveالأول قطع الموقع. يبدأ الإحساس أوليغو مع 5'-ACCG-3 'والقلة antisense يبدأ مع 5'-AAAC-3'.
- اطلب أن يتم تصنيع أوليغو تجاريا لمزيد من الاستخدام.
- استنساخ دليل تكميلية RNA oligos في BveI-هضم AA19 pLKO.1-puro.U6.sgRNA. بيف I-stuffer لينتيفيرال ناقل البلازميد لتوليد AAA19 pLKO.1-الحلزون-sgRNA16.
- قطع AA19 pLKO.1-puro.U6.sgRNA. بيف I-stuffer plasmid مع إنزيم BveI16. مزيج 2 ميكروغرام من AA19 pLKO.1-puro.U6.sgRNA. بيف I-stuffer plasmid، 5 ميكرولتر من 10x العازلة O، و 5 ميكرولتر من إنزيم BveI وإضافة الماء العقيم للوصول إلى حجم إجمالي قدره 50 ميكرولتر.
- دوامة وتدور لفترة وجيزة أسفل مزيج رد الفعل. احتضان رد الفعل عند 37 درجة مئوية لمدة ساعة واحدة.
- تحميل مزيج رد الفعل على هلام agarose 1٪ وتشغيل في 1x تريس خلات-EDTA (TAE، 50x TAE المخزون: 242 غرام من قاعدة تريس المذابة في الماء، 57.1 مل من حمض الخليك الجليدي، 100 مل من 500 mM EDTA (درجة الحموضة 8.0) الحل، وإضافة الماء إلى ما مجموعه 1 لتر) العازلة حتى يتم تحقيق فصل جيد.
- قطع جزء العمود الفقري من هلام، عزله مع عدة استخراج هلام وفقا لبروتوكول الشركة المصنعة (انظر جدول المواد)وelute العمود الفقري في 40 ميكرولتر elution العازلة (EB).
- مزيج 5 ميكرولتر من 100 pmol / μL الشعور أوليغو و 5 ميكرولتر من 100 pmol / μL المضادة للاستشعار أوليغو مع 1 ميكرولتر من 1 M تريس-HCl (درجة الحموضة 8.0) وإضافة المياه العقيمة للوصول إلى ما مجموعه 100 ميكرولتر لصلاة القلة الحمض النووي الريبي. احتضان الخليط لمدة 5 دقائق في 100 درجة مئوية، ومن ثم تغطية الأنابيب مع رقائق الألومنيوم. بعد ذلك، تبريد ببطء الحل لدرجة حرارة الغرفة لمزيد من الاستخدام وادراج.
- لligate أوليغوس gRNA التكميلية والعمود الفقري BveI-هضم، مزيج 1 ميكرولتر من Bveالمعزولة أنا قطع AA19 pLKO.1-puro.U6.sgRNA.BveI-stuffer العمود الفقري و 2 ميكرولتر من إدراج (المخفف 1:300) مع 2 ميكرولتر من 10x T4 الحمض النووي ليغان العازلة و 1 ميكرولتر من T4 الحمض النووي ليغانيس، وإضافة المياه العقيمة للوصول إلى ما مجموعه 20 ميكرولتر. تدور لفترة وجيزة الأنبوب، واحتضان لمدة 4 ساعة في درجة حرارة الغرفة لمزيد من الاستخدام.
ملاحظة: عند تنفيذ الربط، تأكد من تضمين مجموعتي تحكم. بالنسبة لمجموعة تحكم واحدة، اخلط 1 ميكرولتر من العمود الفقري المعزول، و2 ميكرولتر من مخزن الحمض النووي 10x T4، و1 ميكرولتر من ليغانز الحمض النووي T4 وأضف الماء العقيم للوصول إلى ما مجموعه 20 ميكرولتر، ولكن دون حمض القلة النووي. بالنسبة لمجموعة التحكم الأخرى ، اخلط 1 ميكرولتر من العمود الفقري المعزول و 2 ميكرولتر من مخزن الحمض النووي 10x T4 ، وأضف الماء العقيم للوصول إلى ما مجموعه 20 ميكرولتر ، ولكن بدون أوليغوس الملدن و T4 ligase. يتم استخدام ربط التحكم هذان لتحديد خلفية التفاعل في خطوة التحويل التالية والإشارة إلى مدى كفاءة الربط.
- تحويل خليط التفاعل إلى TOP10 المختصة E. القولونية.
- جمع TOP10 المختصة E. القولونية. خلايا من -80 درجة مئوية الفريزر، وتذوب لهم على الجليد.
- إضافة 2 ميكرولتر من خليط الربط إلى 50 ميكرولتر من الخلايا المختصة والحفاظ على أنبوب على الجليد لمدة 30 دقيقة.
- الحرارة صدمة الأنبوب في 42 درجة مئوية لمدة 30 s. وضع أنبوب على الجليد لمدة 2 دقيقة.
- إضافة 950 ميكرولتر من مرق الليوجيني الطازج (LB) المتوسطة إلى الخليط ويهز بقوة في 37 درجة مئوية لمدة 60 دقيقة.
- تدور أسفل ولوحة الخلايا على أمبيسلين دافئ (100 ميكروغرام / مل) لوحة LB المقاومة. احتضان لوحة في 37 درجة مئوية بين عشية وضحاها.
- تحقق من الإدراج الناجح لقلة الحمض النووي الريبي في البلازميد.
- اختيار 3-5 مستعمرات على لوحة في 1 مل من أمبيسلين (100 ميكروغرام / مل) التي تحتوي على LB المتوسطة ويهز بين عشية وضحاها في 30 درجة مئوية.
- عزل الحمض النووي البلازميد مع عدة البلازميد وفقا لبروتوكول الشركةالمصنعة (جدول المواد)وتسلسل ذلك مع التمهيدي U6 المروج 5'- GAGGGCCTATTTCCCATGATT -3' للتحقق من الإدراج الناجح للقلة GRNA.
4. توليد الحلزون خروج المغلوب MS-1 الخلايا
- إنتاج جزيئات العدسية التي تحمل Cas9 أو الحلزون استهداف gRNAs.
- ثقافة خلايا HEK 293T في DMEM تحتوي على 10٪ مصل البقر الجنيني و 100 U/mL البنسلين / العقدية في أطباق 14.5 سم (أو قوارير T75) في حاضنة (5٪ CO2، 37 درجة مئوية).
- مزيج 9.9 ميكروغرام من استهداف الجين البلازميد، AA19 pLKO.1-الحلزون-sgRNA أو pLV-Cas917 البلازميد، جنبا إلى جنب مع مساعد plasmids 3.5 ميكروغرام من pCMV-VSVG (ترميز البروتين G من فيروس التهاب الفم الحويصلات، VSV-G)، 6.6 ميكروغرام من عنصر rev-responsive plasmid pMDLg-RRE (ترميز Gag وبول)، و 5.0 ميكروغرام من pRSV-REV (ترميز القس) في 500 ميكرولتر من المتوسط الخالي من المصل. ريسوسبند 50 ميكرولتر من البولي إيثيلينمين (PEI) (2.5 ملغم/ مل) في 500 ميكرولتر من المتوسط الخالي من المصل. مزيج بلطف البلازميدات والاستعدادات جزيرة الأمير إدوارد عن طريق الأنابيب صعودا وهبوطا. احتضان الخليط لمدة 20 دقيقة في درجة حرارة الغرفة.
- خلايا 293T HEK Transfect بإضافة وسيط الخليط من الخطوة 4.1.2 إلى 80٪ خلايا التقاء في أطباق 14.5 سم (أو قوارير T75) التي تحتوي على متوسط DMEM مع 10٪ FBS و 100 U/mL البنسلين / ستريبتوميسين. وتستخدم خلايا HEK293T لأنها يمكن تحويلها بسهولة وتوليد مستويات عالية من الفيروس18.
- نقل خلايا HEK 293T المصابة إلى السلامة البيولوجية في المختبر الميكروبيولوجي والطب الحيوي (BMBL) استزراعها لمدة 24 ساعة.
- في مختبر BMBL، استبدل وسيط العدوى من خلايا HEK 293T ب 12 مل من DMEM الكامل الطازج الذي يحتوي على FBS والبنسلين / العقديبتومايسين. احتضان الخلايا لمدة 24 ساعة.
- جمع وتصفية المتوسطة مع حقنة 20 مل ومرشح 0.45 ميكرومتر. نقل المتوسطة مشروطة في أنبوب البولي بروبلين 15 مل.
- إضافة 12 مل من DMEM كاملة جديدة تحتوي على FBS وpenicillin / streptomycin إلى طبق ثقافة HEK 293T والثقافة لمدة 24 ساعة إضافية.
- جمع وتصفية المتوسطة مع حقنة 20 مل ومرشح 0.45 ميكرومتر. نقل المتوسطة مشروطة في أنبوب البولي بروبلين 15 مل. تخزين المتوسطة التي تحتوي على جزيئات العدسية كما aliquots 1 مل في -80 درجة مئوية لمزيد من الاستخدام.
- تصيب خلايا MS-1 مع فيروس pLV-Cas9.
- البذور 1 × 105 خلايا MS-1 لكل بئر في لوحة 6-جيدا لمدة 24 ساعة قبل عدوى الفيروس العدسي.
- تذوب المغذيات المجمدة من فيروس pLV-Cas9 في حمام مائي 37 درجة مئوية.
- مزيج 1 مل من الفيروس المتوسط مع 1 مل من المتوسط DMEM الطازجة التي تحتوي على FBS وبينسلين / ستريبتوميسين. إضافة polybrene إلى المتوسط (التركيز النهائي كما 10 ميكروغرام / مل) لزيادة كفاءة العدوى.
- إزالة المتوسطة من لوحة 6-جيدا واستبداله مع مزيج الفيروس / البوليبرين المتوسطة والثقافة الخلايا في حاضنة لمدة 24 ساعة 24 ساعة بعد العدوى، واستبدال المتوسط مع المتوسطة الطازجة والثقافة الخلايا لمدة 24 ساعة أخرى.
ملاحظة: دوما الاحتفاظ غير المصابة جيدا كما مجموعة تحكم. - يستنشق المتوسط من المجموعة المصابة ومجموعة التحكم واستبداله مع متوسط DMEM مع 4 ميكروغرام / مل blasticidin.
- أعد الطبق إلى حاضنة 37 درجة مئوية وزرع الخلايا لمدة أسبوع واحد. الخلايا غير المصابة ستموت بسبب تأثير ال"بستيسيدين". تقسيم الخلايا الباقية عندما تصل إلى التقاء الخلايا 80٪ والاستمرار في اختيار blasticidin.
- تأكيد التعبير عن Cas9 في خلايا MS-1 عن طريق النشاف الغربي باستخدام الأجسام المضادة ضد Cas9 (الوزن الجزيئي للكاس9 هو حوالي 160 كيلودا).
- تصيب بشكل منفصل pLV-Cas9 MS-1 الخلايا مع اثنين من الفيروسات العدسية gRNA مستقلة.
- البذور 1 × 105 pLV-Cas9 MS-1 خلايا لكل بئر في لوحة 6-جيدا لمدة 24 ساعة قبل العدوى.
- اتبع نفس البروتوكول كما هو موضح في 4.2 لتصيب الخلايا بشكل منفصل مع اثنين من الفيروسات العدسية الحمض النووي الريبي.
- بعد 24 ساعة من العدوى بفيروس الحمض النووي الريبي، قم بتحديث الوسط والثقافة الخلايا لمدة 24 ساعة أخرى.
- استبدل الوسط ب DMEM مع 1 ميكروغرام / مل بوروميسين. أعد الطبق إلى حاضنة 37 درجة مئوية وزرع الخلايا لمدة أسبوع واحد. تأكد من أن الخلايا غير المصابة ميتة تماما. تقسيم الخلايا عندما تصل إلى التقاء 80٪ ومواصلة اختيار بوروميسين.
- تأكيد خروج المغلوب من الحلزون في الخلايا MS-1 عن طريق النشاف الغربي باستخدام الأجسام المضادة ضد الحلزون (الوزن الجزيئي للحلزون هو ما يقرب من 35 كيلودا).
النتائج
TGF-β2 يحفز EndMT ويحفز التعبير الحلزوني في الخلايا البطانية MS-1
TGF-β هي واحدة من السيتوكينات مع أكبر إمكانات للحث EndMT. بعد علاج خلايا MS-1 مع TGF-β2 (1 نانوغرام / مل) لمدة 3 أيام ، تفقد خلايا MS-1 البطانية هيكلها الشبيه بالحصى وتفرق إلى خلايا تشبه المغزل على شكل مغزل (الشكل 1A)15. لمزيد من التحقق من دور TGF-β2 في إحداث تغييرات في الخلايا الظاهري, نحن تعاملنا مسبقا مع الخلايا مع جزيء صغير أكتيفين مستقبلات مثل كيناز (ALK)4/ALK5/ALK7 المانع SB431542 قبل التحفيز TGF-β219. SB431542 إلغاء تماما TGF-β2 الناجمة عن التغيرات في مورفولوجيا الخلية(الشكل 1A). تم إجراء مزيد من التحقيق في عملية EndMT المستحثة TGF-β2 من خلال دراسة التغيرات في التعبير عن العلامات المتعلقة ب EndMT. كما هو مبين في الشكل 1B، انخفض البروتين البطاني Pecam-1 بقوة بعد تحفيز TGF-β2 ، في حين تم رفع عامل Sm22α المتوسط بشكل عميق من قبل TGF-β215. هذه البيانات تتفق مع فكرة أن TGF-β2 أثار EndMT في خلايا MS-1. بعد ذلك ، حققنا في آثار TGF-β2 على تعبير الحلزون والرخوة. كما هو مبين في الشكل 1C، تم تنظيم Snail بشكل ملحوظ من قبل TGF-β2 ، في حين لم يتأثر تعبير Slug ب TGF-β2 في خلايا MS-115. يظهر القياس الكمي لتعبير الحلزون من ثلاث تجارب مستقلة في الشكل 1D.
استنفاد الحلزون بواسطة CRISPR/Cas9 في الخلايا البطانية MS-1
كما تم تحريض الحلزون من قبل TGF-β2 والمشاركة على الأرجح في TGF-β2 بوساطة EndMT، قمنا كريسبر / Cas9 تحرير الجينات لاستنفاد وراثيا التعبير الحلزون في خلايا MS-1. افترضنا أن استنفاد الحلزون سيكون كافيا لمنع TGF-β2 الناجم عن EndMT. كما هو مبين في الشكل 2A، قمنا بتوليد خلايا الحلزون بالضربة القاضية في خطوتين. أولا، تم التعبير عن Cas9 خارج الرحم عن طريق إصابة خلايا MS-1 ب Cas9 تعبر عن الفيروس العدسي. منذ هناك كاسيت مقاومة blasticidin في بناء pLV-Cas9، ونحن فحص التعبير عن Cas9 من قبل تحليل لطخة الغربية في الخلايا المقاومة blasticidin(الشكل 2D). في وقت لاحق، قدمنا sgRNAs التي استهدفت على وجه التحديد الحلزون لتعطيل التعبير البروتين. كما تم تنفيذ هذا الإجراء عن طريق العدوى مع الجسيمات العدسية التي تحمل AA19 pLKO.1-Snail-sgRNA بناء، والذي يتضمن كاسيت التعبير بوروميسين. أصيبت الخلايا المعبرة عن Cas9 مرة أخرى بالرنا الذي يحتوي على فيروس العدسة وتم اختيارها بشكل أكبر مع البوريميسين. تم تصميم اثنين من أوليغو SGRNA التكميلية التي تستهدف الحلزون مورين مع نشاط منخفض خارج الهدف المتوقع(الشكل 2B, C). بعد إدخال اثنين من SgRNAs الحلزون مستقلة في Cas9 التعبير عن MS-1 الخلايا, تم إلغاء التعبير عن بروتين الحلزون(الشكل 2D)15.
نقص الحلزون يمنع TGF-β2 الناجمة عن EndMT في الخلايا MS-1
لإثبات وظيفة الحلزون في TGF-β2 بوساطة EndMT ، قمنا بإجراء فحص EndMT في الخلايا المستنفدة للحلزون وقارنناه بخلايا MS-1 الأبوية. كما هو مبين في الشكل 3A، كانت الضربة القاضية من الحلزون كافية لمنع مورفولوجيا الخلايا الشبيهة بالخلايا الليفية التي يقودها TGF-β2 في خلايا MS-115. وبالإضافة إلى ذلك، تم حظر تماما انخفاض TGF-β2 بوساطة في Pecam-1 وتعزيز Sm22α في الخلايا MS-1 الحلزون المنضب. باختصار، أثبتنا أن الحلزون أمر بالغ الأهمية لTGF-β2 بوساطة EndMT في خلايا MS-1 (الشكل 3B)15.
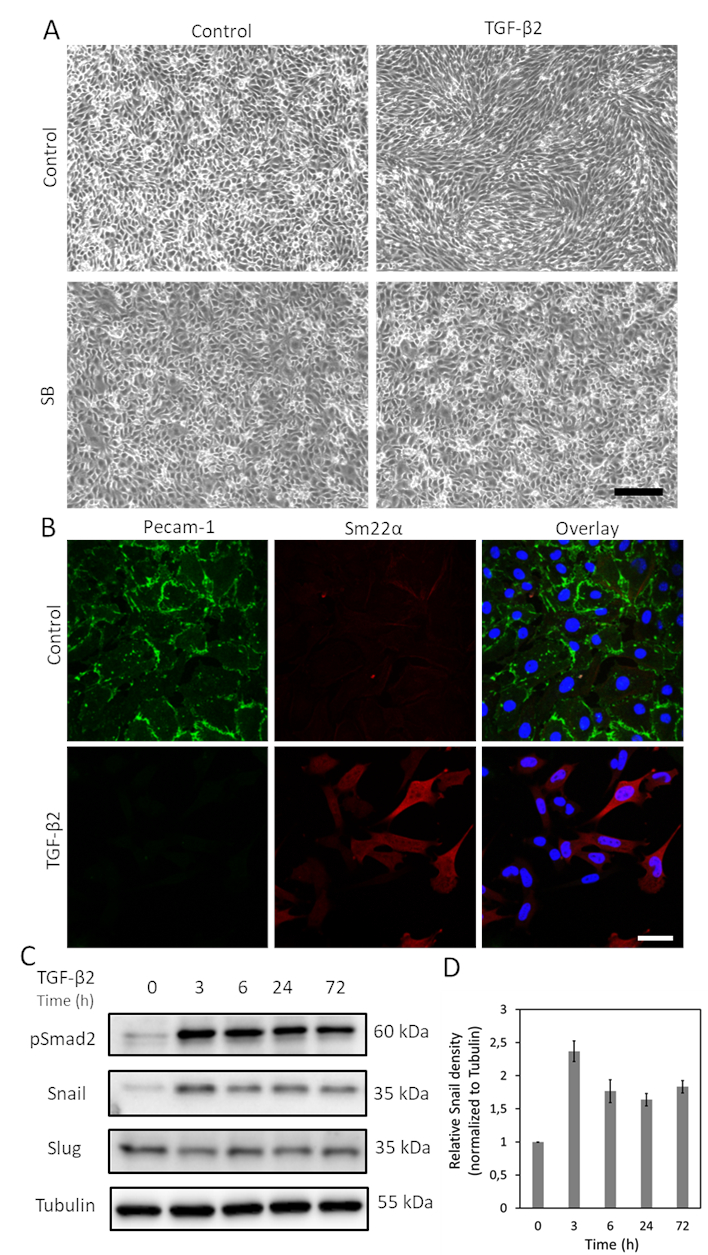
الشكل 1. TGF-β2 يحفز EndMT وتعبير الحلزون في خلايا MS-1. أ. آثار TGF-β2 و / أو TGF-β نوع I مستقبلات كيناز المانع SB-431542 على مورفولوجيا الخلية. صور برايتفيلد لخلايا MS-1 عند العلاج مع TGF-β2 (1 نانوغرام / مل) و / أو SB-431542 (SB، 5 ميكرومتر، تدار 30 دقيقة قبل TGF-β2) لمدة 2 أيام. يمثل شريط المقياس 200 ميكرومتر. تلطيخ immunofluorescence من Pecam-1 (الأخضر) وSM22α (أحمر) في خلايا MS-1 المستزرعة في المتوسطة التي تحتوي على TGF-β2 (1 نانوغرام / مل) لمدة 3 أيام. يتم تصور النوى باللون الأزرق (DAPI). شريط المقياس: 50 ميكرومتر. تم تعزيز التعبير عن الحلزون ، ولكن ليس سبيكة ، من خلال تحفيز TGF-β2 ، كما ذكر سابقا في Ma et al15. د- القياس الكمي للتعبير الحلزون من خلال دمج النتائج من ثلاث تجارب لطخة الغربية المستقلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
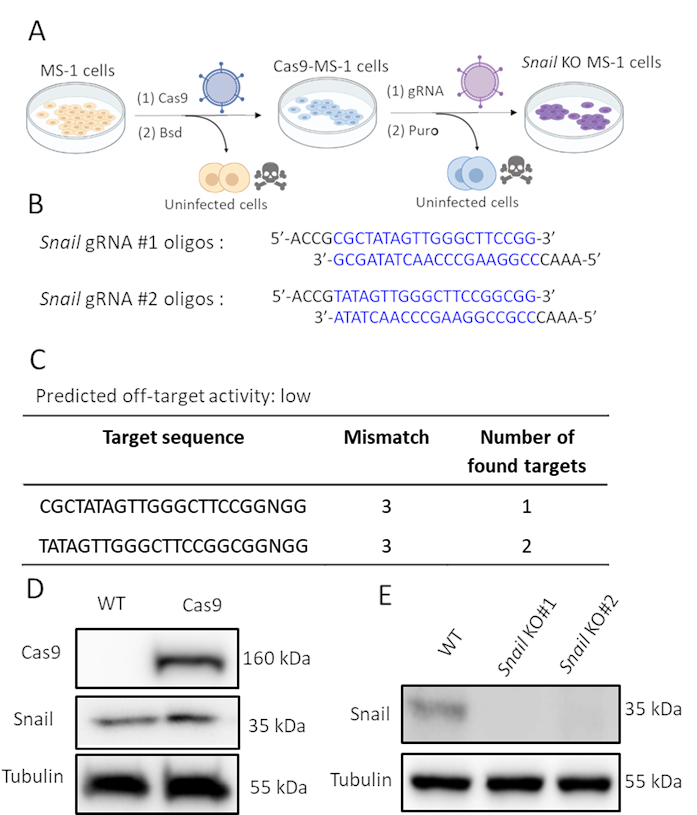
الشكل 2. استنفاد الحلزون بواسطة تحرير الجينات CRISPR-Cas9. أ. مخطط يصور كيفية توليد خلايا الضربة القاضية الحلزون. بسيد: بلاستسيدين. بورو: بوروميسين. باء - ال 20 في المائ أوليغونوكليوتيدات من اثنين من sgRNAs مستقلة تستهدف الحلزون باستخدام CHOPCHOP (http://chopchop.cbu.uib.no/) وكاس أوففايندر (http://www.rgenome.net/cas-offinder/). جيم - الدوائر التي لا يمكن أن النشاط المتوقع خارج الهدف من gRNAs اثنين للحلزون باستخدام كاس-OFFinder (http://www.rgenome.net/cas-offinder/). د- Cas9 وتعبير الحلزون في نوع البرية (WT) و Cas9-overexpressed MS-1 تقاس بتحليل لطخة الغربية. هاء - ال هاء خروج المغلوب من الحلزون مع اثنين من gRNAs مستقلة في خلايا MS-1 كما يقاس تحليل لطخة الغربية. أبلغنا عن نتائج مماثلة في Ma et al15. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
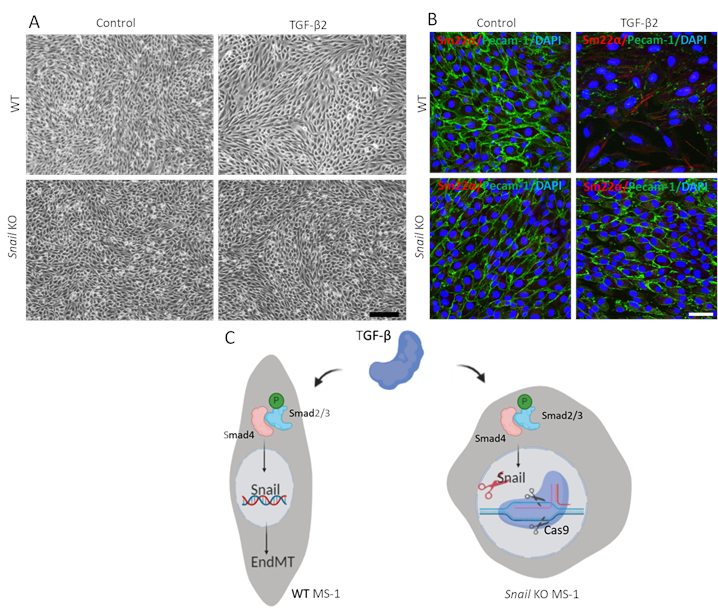
الشكل 3. الاستنفاد الوراثي للحلزون يمنع TGF-β2 الناجمة عن EndMT في خلايا MS-1. أ. صور برايتفيلد من خلايا MS-1 عند العلاج مع TGF-β2 (0.1 نانوغرام / مل) لمدة 3 أيام في wildtype (WT، لوحة العليا) والحلزون خرج (لوحة السفلى) الخلايا. يمثل شريط المقياس 200 ميكرومتر. B. تلطيخ Immunofluorescent لPecam-1 (أخضر) و Sm22α (أحمر) ونوى (أزرق) من خلايا MS-1 المستزرعة في المتوسطة التي تحتوي على TGF-β2 (1 نانوغرام / مل) لمدة 3 أيام. استنفاد الحلزون إلغاء TGF-β2 الناجمة عن انخفاض Pecam-1 وزيادة التعبير Sm22α. يمثل شريط المقياس تمثيل تخطيطي 50 ميكرومترا مئويا لتأثير الضربة القاضية الحلزونية على EndMT الناجم عن β TGF في خلايا MS-1. TGF-β يحفز التعبير عن الحلزون من خلال مسار Smad عن طريق الفوسفورية Smad2/3 ويدفع كذلك EndMT. ضرب الحلزون باستخدام CRISPR / Cas9 القائم على تحرير الجينات إلغاء TGF - β بوساطة EndMT. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
فهم آلية EndMT أمر بالغ الأهمية لتعديل هذه العملية واستهداف الأمراض المرتبطة EndMT. هنا ، وصفنا أساليب لإجراء اختبار EndMT الناجم عن β TGF واستجواب دور الحلزون EndMT-TF في EndMT الذي يسببه TGF-β ، من خلال إجراء استنفاد الجينات المستقرة CRISPR/Cas9 بوساطة الحلزون من الخلايا. استنفاد الحلزون باستخدام CRISPR / Cas9 النهج بنجاح إلغاء TGF-β2 مدفوعة EndMT في الخلايا MS-1 (الشكل 3C). لدراسة آثار أي السيتوكينات، مثل TGF-β، على EndMT، تعرضت ECs للسيتوكينات ومن ثم تم تقييم حدوث EndMT وفقا للتغيرات المورفولوجية والتغيرات في التعبير عن العلامة البطانية والميكنشيمالية في الخلايا. TGF-β2 المستحثة بقوة EndMT في خلايا MS-1 يرافقه زيادة قوية في التعبير عن عامل النسخ الحلزون. يمكن أن تختلف EndMT-TFs الناجمة عن TGF-β وفقا للأنواع أو نوع الخلية البطانية الخاصة بالأنسجة. على سبيل المثال، لاحظنا أن الحلزون ولكن ليس سبيكة كان أعلى تنظيما بشكل ملحوظ من قبل TGF-β في خلايا MS-1، بينما في الخلايا البطانية الوريد السري البشري (HUVECs)، يتم زيادة كل من الحلزون والرخوة بعد التعرض ل TGF-β20.
قمنا بتقييم مدى عملية EndMT بطريقتين من خلال فحص تغييرات مورفولوجيا الخلايا ومن ثم عن طريق التحقيق في التغييرات في تعبير العلامات المتعلقة ب EndMT. بعد التعرض TGF-β لمدة 3 أيام، خضعت الخلايا EndMT مع اختلافات مورفولوجية متسقة والتغيرات في التعبير عن علامات EndMT ذات الصلة. بالإضافة إلى تلطيخ immunofluorescence قمنا به هنا، ويمكن أيضا رصد الاختلافات علامة عن طريق النشاف الغربية على مستوى التعبير البروتين أو عن طريق qRT-PCR (في الوقت الحقيقي النسخ العكسي الكمي PCR) في مستويات الجينات21. بالإضافة إلى هاتين الطريقتين لتوفير الوقت والتكاليف التي أظهرناها في هذا البروتوكول، هناك طرق أخرى لفحص EndMT. على سبيل المثال، يمكن إجراء تحليل النسخ (عن طريق تسلسل الحمض النووي الريبي أو qPCR) لمقارنة مستويات التعبير من الجينات ذات الصلة بطانة الرحم وميسينشيمال بين الخلايا المعالجة والسيطرة على تقييم دقيق EndMT22،23. وبالإضافة إلى ذلك، EndMT غالبا ما ينطوي على فقدان مستقر لوظيفة الحاجز، والتي يمكن تقييمها عن طريق التحليل الطيفي المعاوقة24. وعلاوة على ذلك، يمكن فحص دليل إضافي على اقتناء خلايا شبيهة بالخلايا الجذعية بواسطة خلايا مشتقة من EndMT. على سبيل المثال، في ظل ظروف ثقافية محددة، يمكن تمييز الخلايا الشبيهة بالميسينشيمال EndMT إلى أوبلاستات عظمية أو خلايا شوندروسيتي أو خلايا دهونية أو (ميو) الخلايا الليفية. لذلك، فإن التحليل الإضافي لتأكيد التمايز إلى أنواع مختلفة من الخلايا التي تنتمي إلى نسب ميسودرم (أي التعبير الجيني وتلطيخ المصفوفة) مفيد لإظهار الطبيعة المتعددة القدرات للخلايا المشتقة من EndMT. وأخيرا، لا تقتصر طرق تقييم EndMT على الدراسات المختبرية، ولكن يمكن استقرائها للتحقيق في العلاقة بين EndMT وبعض الأمراض في الجسم الحي أو في أعضاء الجسم الحي السابق. وبهذا المعنى، فإن استخدام استراتيجيات تتبع النسب الخاصة بالنسب يمتد على نطاق واسع ليشمل الأبحاث المتعلقة ب EndMT25.
للتحقيق في دور الحلزون خلال EndMT ، في هذه الدراسة CRISPR / Cas9 تم استخدام تحرير الجينات لضرب هذا الجين. وأظهرت البيانات أن TGF-β2 فشلت في التوسط EndMT في الحلزون ناقص MS-1 الخلايا. أظهرت هذه الملاحظة أن الحلزون ضروري ل TGF-β2 المستحث EndMT في خلايا MS-1. استخدمنا شريطتعبير SgRNA مستقل يحركه U6 لإدخال sgRNAs محددة ل Cas9 لاستهداف Snail. وبالإضافة إلى هذه الطريقة، وصف ران وآخرون26 استراتيجية أخرى لاستنساخ تسلسل أوليغوس sgRNA في سقالة Cas9 لتوليد بناء يحتوي على كل من Cas9 وgRNAs. وتتيح النهج الجديدة الناشئة ل CRISPR/Cas دمج وظائف إضافية. على سبيل المثال، يمكن تحقيق الضربة القاضية المزدوجة أو الثلاثية من خلال تقديم المزيد من sgRNAs في الخلايا التي تعبر عن Cas927. يستهدف البروتين Cas13 المهندس ويهضم جزيئات الحمض النووي الريبي دون تعطيل الحمض النووي الداخلي28. إلى جانب ضرب الجينات مع CRISPR / Cas ، يمكن استخدام RNAs دبوس الشعر القصير (shRNAs) كبدائل لإسقاط التعبير الجيني المستهدف29بشكل ثابت. لجميع CRISPR / كاس طرق تحرير الجينات ، وينبغي دائما أن تؤخذ في الاعتبار الانقسام خارج الهدف. وبالإضافة إلى ذلك، يتم تخفيف الحمض النووي الريبي التدخل الصغيرة (siRNAs) التعبير الجيني عابرة وتركيز سيرنا مع انقسام الخلية30. كل من هذه الطرق قمع جزئيا التعبير الجيني المستهدف. في المقابل، يستخدم التعبير الجيني خارج الرحم أيضا للتحقق من وظيفة الجينات أثناء EndMT/EMT31. يمكن لهذا النهج تحديد ما إذا كان التنظيم التنظيمي للجين كافيا للحصول على استجابة EndMT. لذلك، يوجد حاليا العديد من الاستراتيجيات التقنية التي يمكن استخدامها لتحديد الجهات التنظيمية المحتملة ل EndMT والتحقق منها. إلى جانب ذلك ، يمكن أن يكون التحليل النسخي خيارا جيدا في تحديد وتحليل شامل للمنظمين ذوي الصلة EndMT. نوصي باستخدام نهج تكميلية مختلفة للتحقيق في تعديل EndMT.
باختصار، قدمنا سير عمل لتحديد العوامل التي قد تلعب أدوارا وظيفية أثناء EndMT الناجم عن β TGF. ويمكن أيضا استخدام هذه الطريقة لدراسة ما إذا كان يمكن تعديل المحفزات الأخرى (أي السيتوكينات وعوامل النمو والمحفزات الميكانيكية والتفاعلات بين الخلية والخلية) EndMT ، والتفاعل بين TGF-β مع المحفزات الأخرى. بالإضافة إلى ذلك، سلطنا الضوء على نهج باستخدام تحرير الجينات CRIPSR/Cas لتوضيح ما إذا كان هناك حاجة إلى جين معين ل EndMT الناجم عن β TGF. لتوضيح هذه المنهجية، استخدمنا محفز EndMT القوي TGF-α2 في خلايا MS-1، ولكن يمكن تكييف البروتوكولات مع السيتوكينات الأخرى وأنواع الخلايا الأخرى. ونتوقع أن يكون هذا البروتوكول المفصل الموصوف بمثابة نقطة انطلاق للدراسات المستقبلية المتعلقة ب EndMT.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد دعم البحث CGC.NL ومبادرة أبحاث القلب والأوعية الدموية الهولندية: مؤسسة القلب الهولندية، والاتحاد الهولندي للمراكز الطبية الجامعية، والمنظمة الهولندية للبحث والتطوير الصحي، ومنح منحة الأكاديمية الملكية الهولندية للعلوم إلى فيدرا إمباكت (http://www.phaedraresearch.nl). JM مدعوم من قبل مجلس المنح الدراسية الصينية. ويدعم GSD منحة الترامبولين من AFM-Telethon [22379]، FOP إيطاليا ومنحة من La Fundació La Marató de TV3 (#202038).
Materials
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | Pall Corporation, USA | 4614 | |
| 10× T4 DNA ligase buffer | Thermofisher Scientific, USA | B69 | |
| 12 mm round glass slice | Knittel Glass,Germany | VD10012Y1A.01 | |
| 20 mL syringe | BD Eclipse, USA | 300629 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Vector Laboratories, USA | H-1200 | VECTASHIELD Antifade Mounting Media |
| AA19_PLKO vector | Dr. M Gonçalves, Leiden University Medical Center, Netherlands | Gift | |
| Ampicillin | Serva Electrophoresis, USA | 1339903 | |
| Anti-Mouse IgG | GE Healthcare, USA | NA931 | |
| Anti-Rabbit IgG | Cell signaling, USA | 7074 | |
| Agarose | Roche, Switzerland | 11388991001 | |
| Blasticidin | Invitrogen, USA | R21001 | |
| Buffer O (10X) | Thermofisher Scientific, USA | BO5 | |
| BveI (Bspm1) | Thermofisher Scientific, USA | ER 1741 | |
| Confocal microscope | Leica Microsystems, Germany | SP8 | |
| DMEM | Thermo Fisher Scientific, USA | 11965092 | |
| Donkey anti-rat Alexa 488 | Invitrogen, USA | A21208 | |
| FBS | Thermo Fisher Scientific, USA | 16000044 | |
| Formaldehyde | Thermo Fisher Scientific, USA | 28908 | |
| Inverted microscope | Leica Microsystems, Germany | DMi8 | |
| Goat anti-rabbit Alexa 594 | Invitrogen,USA | A11012 | |
| LabNed Plasmid kit | LabNed, USA | LN2400004 | |
| MS-1 cell line | American Type Culture Collection (ATCC) | ||
| Nail polish | HEMA, Netherlands | Transparent | |
| Pecam-1 antibody | Becton Dickinson,USA | 553370 | |
| PEI | Polysciences, USA | 23966-1 | |
| PLV-Cas9 plasmid | Sigma-Aldrich, USA | Cas9BST-1EA | |
| Puromycin | Sigma-Aldrich, USA | P9620 | |
| QIAquick gel extraction kit | Qiagen, Germany | 28706 | |
| Sm22a antibody | Abcam, UK | ab14106 | |
| Snail | Cell signaling, USA | 3879 | |
| T4 DNA ligase | Thermofisher Scientific, USA | EL 0014 | |
| TC20 automated Cell Counter | Bio-Rad, USA | 1450102 | |
| Human TGF-β2 | Joachim Nickel, University of Wurzburg | Gift | Other commercial recommendation: 302-B2, R&D systems |
| Triton X-100 | Merck, USA | 1086031000 | |
| SB431542 | Tocris Bioscience, UK | 1614 | |
| Tris | Roche, Switzerland | 11814273001 |
References
- Ma, J., Sanchez-Duffhues, G., Goumans, M. -J., Ten Dijke, P. TGF-β-induced endothelial to mesenchymal transition in disease and tissue engineering. Frontiers in Cell and Developmental Biology. 8, (2020).
- Piera-Velazquez, S., Jimenez, S. A. Endothelial to mesenchymal transition: role in physiology and in the pathogenesis of human diseases. Physiological Reviews. 99 (2), 1281-1324 (2019).
- Sánchez-Duffhues, G., de Vinuesa, G. A., ten Dijke, P. Endothelial-to-mesenchymal transition in cardiovascular diseases: developmental signaling pathways gone awry. Developmental Dynamics. 247 (3), 492-508 (2018).
- Evrard, S. M., et al. Endothelial to mesenchymal transition is common in atherosclerotic lesions and is associated with plaque instability. Nature Communications. 7 (1), 1-16 (2016).
- Qiao, L., et al. Endothelial fate mapping in mice with pulmonary hypertension. Circulation. 129 (6), 692-703 (2014).
- Zeisberg, E. M., et al. Endothelial-to-mesenchymal transition contributes to cardiac fibrosis. Nature Medicine. 13 (8), 952-961 (2007).
- Clere, N., Renault, S., Corre, I. Endothelial-to-mesenchymal transition in cancer. Frontiers in Cell and Developmental Biology. 8, (2020).
- Saito, A. EMT and EndMT: regulated in similar ways. The Journal of Biochemistry. 153 (6), 493-495 (2013).
- Bolós, V., et al. The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions: a comparison with Snail and E47 repressors. Journal of Cell Science. 116 (3), 499-511 (2003).
- Aird, W. C. Endothelial cell heterogeneity. Cold Spring Harbor Perspectives in Medicine. 2 (1), 006429(2012).
- Yang, J., et al. Guidelines and definitions for research on epithelial-mesenchymal transition. Nature Reviews Molecular Cell Biology. , 1-12 (2020).
- Doudna, J. A., Charpentier, E. The new frontier of genome engineering with CRISPR-Cas9. Science. 346 (6213), (2014).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Arbiser, J. L., et al. Oncogenic H-ras stimulates tumor angiogenesis by two distinct pathways. Proceedings of the National Academy of Sciences USA. 94 (3), 861-866 (1997).
- MA, J., et al. TGF-?-induced endothelial to mesenchymal transition results from a balance between SNAIL and ID factors. Frontiers in Cell and Developmental Biology. 182 (9), (2021).
- Chen, X., et al. Probing the impact of chromatin conformation on genome editing tools. Nucleic Acids Research. 44 (13), 6482-6492 (2016).
- Hunter, F. W., et al. Functional CRISPR and shRNA screens identify involvement of mitochondrial electron transport in the activation of evofosfamide. Molecular Pharmacology. 95 (6), 638-651 (2019).
- Mao, Y., et al. Lentiviral vectors mediate long-term and high efficiency transgene expression in HEK 293T cells. International Journal of Medical Sciences. 12 (5), 407(2015).
- Liu, S., et al. Deubiquitinase activity profiling identifies UCHL1 as a candidate oncoprotein that promotes TGFβ-induced breast cancer metastasis. Clinical Cancer Research. 26 (6), 1460-1473 (2020).
- Medici, D., et al. Conversion of vascular endothelial cells into multipotent stem-like cells. Nature Medicine. 16 (12), 1400(2010).
- Kokudo, T., et al. Snail is required for TGFβ-induced endothelial-mesenchymal transition of embryonic stem cell-derived endothelial cells. Journal of Cell Science. 121 (20), 3317-3324 (2008).
- Dong, J., et al. Single-cell RNA-seq analysis unveils a prevalent epithelial/mesenchymal hybrid state during mouse organogenesis. Genome Biology. 19 (1), 1-20 (2018).
- Oatley, M., et al. Single-cell transcriptomics identifies CD44 as a marker and regulator of endothelial to haematopoietic transition. Nature communications. 11 (1), 1-18 (2020).
- Halaidych, V., et al. Inflammatory responses and barrier function of endothelial cells derived from human induced pluripotent stem cells. Stem Cell Reports. 10 (5), 1642-1656 (2018).
- Li, Y., Lui, K. O., Zhou, B. Reassessing endothelial-to-mesenchymal transition in cardiovascular diseases. Nature Reviews Cardiology. 15 (8), 445-456 (2018).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Grav, L. M., et al. One-step generation of triple knockout CHO cell lines using CRISPR/Cas9 and fluorescent enrichment. Biotechnology Journal. 10 (9), 1446-1456 (2015).
- Abudayyeh, O. O., et al. RNA targeting with CRISPR-Cas13. Nature. 550 (7675), 280-284 (2017).
- Paddison, P. J., et al. Cloning of short hairpin RNAs for gene knockdown in mammalian cells. Nature Methods. 1 (2), 163-167 (2004).
- Reynolds, A., et al. Rational siRNA design for RNA interference. Nature Biotechnology. 22 (3), 326-330 (2004).
- Lourenço, A. R., et al. C/EBPɑ is crucial determinant of epithelial maintenance by preventing epithelial-to-mesenchymal transition. Nature Communications. 11 (1), 1-18 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved