Method Article
אנדותל בתיווך TGF-β למעבר מסנצ'ימלי (EndMT) וההערכה הפונקציונלית של אפקטי EndMT באמצעות עריכת גנים CRISPR/Cas9
In This Article
Summary
אנו מתארים שיטות לחקור TGF-β2-induced EndMT בתאי אנדותל על ידי התבוננות בשינויים במורפולוגיה של התא ובחינת הביטוי שינויי סמן הקשורים EndMT באמצעות כתמי כשל חיסוני. עריכת גנים CRISPR/Cas9 תוארה ושימשה לרוקן את חילזון קידוד הגנים כדי לחקור את תפקידה ב- EndMT הנגרמת על ידי TGF-β2.
Abstract
בתגובה לרמזים חיצוניים ספציפיים והפעלת גורמי שעתוק מסוימים, תאי אנדותל יכולים להתמיין לפנוטיפ דמוי mesenchymal, תהליך שמכונה אנדותל למעבר mesenchymal (EndMT). תוצאות המתעוררים הראו כי EndMT קשורה סיבתי למחלות אנושיות מרובות, כגון פיברוזיס וסרטן. בנוסף, תאים mesenchymal נגזר אנדותל עשוי להיות מיושם בהליכים התחדשות רקמות, כפי שהם יכולים להיות מובחנים עוד יותר לתוך סוגי תאים שונים (למשל, osteoblasts וכונדרוציטים). לכן, המניפולציה הסלקטיבית של EndMT עשויה להיות בעלת פוטנציאל קליני. כמו מעבר אפיתל-mesenchymal (EMT), EndMT יכול להיות המושרה בחוזקה על ידי ציטוקינים מופרשים שינוי פקטורי גדילה-בטא (TGF-β), אשר מגרה את הביטוי של מה שמכונה גורמי שעתוק EndMT (EndMT-TFs), כולל חילזון שבלול. אלה EndMT-TFs אז למעלה ולמטה את רמות החלבונים mesenchymal ו אנדותל, בהתאמה. כאן, אנו מתארים שיטות לחקור TGF-β-induced EndMT במבחנה, כולל פרוטוקול ללמוד את התפקיד של TFs מסוימים ב- EndMT הנגרמת על ידי TGF-β. באמצעות טכניקות אלה, אנו מספקים ראיות לכך ש- TGF-β2 מגרה את EndMT בתאי אנדותל מיקרו-וסקולריים של הלבלב מורין (תאי MS-1), וכי הדלדול הגנטי של חילזון באמצעות חזרות פלינדרומיות קצרות (CRISPR)/CRISPR הקשורות לחלבון 9 (Cas9)-בתיווך עריכת גנים, מטשטש תופעה זו. גישה זו עשויה לשמש כמודל לחקור מאפננים פוטנציאליים של ביולוגיה אנדותל, והוא יכול לשמש לביצוע מסכים גנטיים או תרופתיים על מנת לזהות הרגולטורים החדשים של EndMT, עם יישום פוטנציאלי במחלה האנושית.
Introduction
אנדותל למעבר mesenchymal (EndMT) היא תופעה ביולוגית רב-שלבית ודינמית הקשורה לתהליכים פיזיולוגיים ופתולוגיים מגוונים1,2. על תאי אנדותל EndMT מאבדים בהדרגה את תכונות האנדותל שלהם, תוך רכישת תכונות mesenchymal3; לפיכך, תאי אנדותל דחוסים ומאורגנים היטב מבדילים לתאים מוארכים דמויי מסנצ'יאלית. שינויים מורפולוגיים ב- EndMT חופפים לשינויים בביטוי של גנים וחלבונים מסוימים. באופן כללי, הביטוי של חלבונים השומרים על מאפייני אנדותל, כולל אנדותל כלי הדם (VE)-cadherin, טסיות דם / EC הידבקות מולקולה-1 (CD31/Pecam-1) פוחתת. במקביל, חלבונים הקשורים לתפקודים mesenchymal, כגון α חלקה שריר actin (α-Sma) וחלבון שריר חלק 22α (Sm22α) לצבור. תוצאות חדשות הראו כי EndMT לאחר הלידה תורם להתפתחות של מחלות אנושיות, כגון סרטן, פיברוזיס לב, יתר לחץ דם עורקי ריאתי (PAH), טרשת עורקים (AS), איבר פיברוזיס, וכו'2,4,5,6,7. הבנה מעמיקה יותר של המנגנונים הבסיסיים של EndMT וכיצד לכוון את תהליך EndMT תספק שיטות טיפוליות חדשניות למחלות הקשורות ל- EndMT ולרפואה רגנרטיבית.
TGF-β הוא אחד הגורמים העיקריים EndMT, וגורמים מעורבים ידועים אחרים כוללים Wnt / β קטנין, חריץ, וכמה ציטוקינים דלקתיים1. כמו ההקשר הסלולרי הוא המפתח לתגובות המופעלות על ידי TGF-β, יחסי הגומלין של TGF-β עם אותות קידום EndMT אחרים רלוונטי עבור TGF-β לעורר תגובת EndMT. עם ההפעלה של TGF-β סוג פני התא I וסוג II סרין / threonine קינאז קולטנים, מסלול Smad קנוני תאיים מופעל. TGF-β קולטן בתיווך phosphorylated Smad2/3 טופס קומפלקסים הטרומריים עם Smad4 כי טרנסלוקציה לתוך הגרעין, שם הם upregulate הביטוי של גורמי שעתוק הקשורים EndMT. בדומה למעבר אפיתל-mesenchymal (EMT), גורמי שעתוק כגון חילזון, שבלול, טוויסט, Zeb1 ו Zeb2 נגרמים על ידי איתות TGF-β ולתרום תכנות גנים ב EndMT8.
חילזון זוהה לעתים קרובות כגורם מפתח ב- EndMT. חילזון נקשר המקדם של גנים קידוד חלבוני הידבקות תאים ומדכא שעתוק שלהם, אשר מאוזנת על ידי שיפור הביטוי של חלבונים mesenchymal9. תאי אנדותל מהווים אוכלוסייה הטרוגנית מאוד ואת ההשפעה היחסית של גירויים חוץ תאיים מגוונים על EndMT עשוי להיות שונה בין הקשרים תאיים אנדותל או סוגי תאים10. בשל הדמיון שלה עם EMT, כמה מתודולוגיות שימושיות כדי לחקור את שני המנגנונים EMT ו EndMT8. בהקשר זה, האגודה הבינלאומית EMT (TEMTIA) מדגישה מאוד את הצורך בטכניקות משלימות כדי להדגים בסופו של דבר את התרחשות EMT / EndMT11.
כאן אנו מתארים שיטה לניטור וויזוואליות של תהליך EndMT הנגרם על-ידי TGF-β. כתמי כשל חיסוני מספקים את המידע הבסיסי על שינויי ביטוי בחלבונים/סמנים ממוקדים, המשמשים כאינדיקטורים לשאלה אם תהליך EndMT מתרחש. בנוסף, כתמי כשל חיסוני יכולים לדמיין לוקליזציה של חלבונים/סמנים ומורפולוגיה של תאים. כדי לחקור את הפעילות הפוטנציאלית של TFs ספציפיים (או רגולטורים אחרים במעלה הזרם או במורד הזרם) המעורבים בעריכת גנים בתיווך TGF-β EndMT, אנו מתארים פרוטוקול באמצעות חזרות פלינדרומיות קצרות מקובצים באופן קבוע (CRISPR) / חלבון הקשור ל- CRISPR 9 (Cas9) כדי לרוקן גנים ספציפיים מתאים, תוך שימוש בחילזון TF כדוגמה. Cas9 הוא אנדונוקלאאז DNA מונחה RNA כפול המזהה ורצפי cleaves משלימים רצפי CRISPR בחיידקים12. מערכת CRISPR/Cas9 מנוצלת כיום באופן נרחב משום שהיא מאפשרת הנדסה גנטית במבחנה וב-vivo13. בבימויו של מדריך יחיד RNA (sgRNA), מבוטא באופן חוץ רחמי Cas9 יוצר שבר גדיל כפול ברצף מיקוד שנבחר מראש בלוקוס גן מסוים. הצטרפות קצה לא הומולוגית (NHEJ) מתרחשת כדי לתקן שברי גדילים הנגרמים על ידי Cas9, באמצעות הכנסות או מחיקות נוקלאוטידים אקראיות ובכך מובילה להפרעה ולהשבתה של הגן הממוקד. אנו מתארים בפירוט שיטות לעיצוב sgRNAs סלקטיביים ויצירת וקטורים תואמי lentiviral המכילים sgRNAs מעוצב. כתוצאה מכך, תאי אנדותל מרוקנים גנים יציבים יכולים להיווצר בצורה יעילה ואמינה.
במחקר זה, השתמשנו בתאי אנדותל מיקרו-וסקולריים של הלבלב מורין (MS-1)14 כמערכת מודל לבחינת תהליך EndMT הנגרם על ידי TGF-β2. המחקר הקודם שלנו הראה כי חילזון הוא גורם שעתוק העיקרי גדל על ידי TGF-β2, שבאמצעותו EndMT הוא המושרה בתאי MS-115. לאחר עריכת גנים CRISPR/Cas9 כדי abrogate ביטוי חילזון בתאי MS-1, TGF-β2 נכשל לתווך EndMT. ניתן להחיל זרימת עבודה זו כדי לחקור גנים אחרים (חשודים) הקשורים ל- EndMT.
Protocol
1. אינדוקציה של EndMT על ידי TGF-β2
- תאי MS-1 במדיום הנשר (DMEM) של Dulbecco המכיל 10% סרום שור עוברי (FBS) ו-100 U/mL פניצילין/סטרפטומיצין באינקובטור (5% CO2, 37 °C (37 °F). מצפים את כל מנות התרבות / צלחות עם 0.1% w / v ג'לטין במשך 10 דקות לפני השימוש.
- לשטוף בעדינות תאי MS-1 עם 1 x פוספט אגירה מלוחים (PBS), להוסיף 2 מ"ל של פתרון טריפסין-EDTA (0.25% טריפסין ו 0.02% EDTA) לצלחת 10 ס"מ, ואת הדגירה במשך 2 דקות ב 37 °C (37 °F) כדי לנתק אותם. לאחר מכן, להוסיף 5 מ"ל של מדיום תרבות מלאה כדי להרוות את התגובה.
- מעבירים את השעיית התא לצינור של 15 מ"ל וצנטריפוגה ב-200 x גרם למשך 3 דקות בטמפרטורת החדר.
- השלך את supernatant ו resuspend התאים ב 4 מ"ל של מדיום טרי המכיל FBS ופניצילין / סטרפטומיצין. ספירת התאים באמצעות מונה תאים אוטומטי.
- זרע 1 x 103 תאים לס"מ2 לתרבות נוספת. לדוגמה, זרע 9.5 x 103 תאים / באר עבור צלחות 6-well, או 1.9 x 103 תאים / גם עבור לוחות 24-well.
- דגירה התאים לילה כדי לאפשר להם לדבוק ולהתאושש, ולאחר מכן לעורר MS-1 תאים עם TGF-β2 במשך 3 ימים. הוסף את מעכב קולטן קינאז β TGF SB431542 (5 מיקרומטר) 30 דקות לפני גירוי TGF-β2. לטפל בתאים אחרים עם רכב (DMSO).
הערה: להמיס TGF-β2 ב 4 mM HCl המכיל 0.1% אלבומין סרום שור אנושי (BSA). הוסף את אותה כמות של מאגר ליגנד ללא TGF-β2 לקבוצת הביקורת. ריכוז TGF-β2 עשוי להיות מותאם להיות 0.1-1 ng/mL עבור מבחנים ספציפיים. ראה אינדיקציות בנתונים המתאימים. - לאחר 3 ימים, לבחון את מורפולוגיה התא עם הדמיה שדה בהיר (עם מיקרוסקופ הפוך) ולבצע כתמי כשל חיסוני (ראה שלב 2) כדי להעריך שינויים סמן הקשורים EndMT. לבצע לפחות שלושה ניסויים עצמאיים כדי להשיג משולשים ביולוגיים.
2. כתמי כשל חיסוני
- טריפסינייז תאי MS-1 מתורבתים (שלב 1.2) ולאחר מכן reseed 1.9 x 103 תאים על 0.1% w / v ג'לטין מצופה 12 מ"מ עגול כיסוי זכוכית להציב על החלק התחתון של צלחת 24-well.
- לאחר culturing התאים לילה, להוסיף TGF-β2 (ריכוז סופי 1 ng/mL) לתאים במשך 3 ימים. השתמש במאגר ליגנד המכיל בינוני כפקד שלילי.
- בצע כתמי Pecam-1 ו- Sm22α.
- לאחר גירוי התאים עם TGF-β2 (או בקרה) במשך 3 ימים, להסיר את המדיום, ולשטוף את התאים עם 1x PBS.
- הוסף 300 μL של 4% פורמלדהיד לכל באר דגירה במשך 10 דקות בטמפרטורת החדר כדי לתקן את התאים. לשטוף 3x עם 1x PBS לאחר הדגירה.
- הוסף 300 μL של 0.1% טריטון X-100 ב 1x PBS לכל באר דגירה במשך 10 דקות בטמפרטורת החדר כדי לחלחל התאים. לאחר הדגירה, להסיר את הפתרון טריטון X-100 ולשטוף את התאים 3x עם 1x PBS.
- חסום את התאים עם 3% אלבומין סרום שור (BSA) ב 1x PBS במשך 45 דקות בטמפרטורת החדר.
- לדלל את הנוגדנים העיקריים Pecam-1 ו- Sm22α המזהים חלבוני מורין 1:500 עם 1x PBS. ואז להדגיר את התאים הקבועים עם נוגדנים ראשוניים במשך 45 דקות בטמפרטורת החדר.
- לאחר שטיפת 3x עם 1x PBS, דגירה התאים עם נוגדנים משניים מדוללים 1000x, כולל חמור נגד עכברוש Alexa 488 ו עז נגד ארנב אלקסה 594, במשך 45 דקות בטמפרטורת החדר.
הערה: יש להגן על הדגימות מפני אור במהלך הכתמה. - לאחר שטיפה 3x עם 1x PBS, מניחים את זכוכית הכיסוי זרעים עם תאים עם הפנים כלפי מטה על טיפה של מדיום הרכבה המכיל 4',6-diamidino-2-פנילינדול (DAPI) על שקופית כדי להכתים את הגרעינים.
- לתקן את הפריפריה של זכוכית הכיסוי עם לק שקוף ולאחסן אותו ב 4 מעלות צלזיוס.
- השג תמונות מייצגות באמצעות מיקרוסקופ קונפוקאלי. הגדר את אורכי הגל בלייזר ב- 405 ננומטר, 488 ננומטר ו- 552 ננומטר כדי לזהות DAPI, Pecam-1 ו- Sm22α, בהתאמה. עבור כל ערוץ, כל התמונות צולמו עם אותן הגדרות וזמן חשיפה. לבצע לפחות שלושה ניסויים עצמאיים כדי להשיג משולשים ביולוגיים.
3. נוק אאוט של חילזון באמצעות עריכת CRISPR /Cas9
- תכנן שני SGRNAs עצמאיים המכוונים לחילזוןמורין .
- עיצוב sgRNAs באמצעות הכלים המקוונים CHOPCHOP (https://chopchop.cbu.uib.no/) ו Cas-OFFinder (http://www.rgenome.net/cas-offinder/) על פי שם הגן הממוקד ומינים.
- לחזות את הפעילות מחוץ ליעד של SgRNAs מתוכנן מיקוד חילזון עם שני אלגוריתמים עצמאיים, כולל Cas-OFFinder (http://www.rgenome.net/cas-offinder/) ו CHOPCHOP (http://chopchop.cbu.uib.no/).
- בחר שני sgRNAs עם הפעילות הנמוכה ביותר מחוץ לפעילות. עיצוב שני אוליגוס sgRNA משלימים עם אתר Bveאני לחתוך. אוליגו תחושה מתחיל עם 5 '-ACCG-3' ואת אוליגו antisense מתחיל עם 5'-AAAC-3 '.
- הזמינו את האוליגוס להיות מסונתזים מסחרית לשימוש נוסף.
- שכפל את אוליגוס RNA המדריך המשלים לתוך BveI מתעכל AA19 pLKO.1-puro.U6.sgRNA. Bve I-stuffer פלסמיד וקטורי לנטיבירלי כדי ליצורAA19 pLKO.1-חילזון-sgRNA16.
- חותכים את AA19 pLKO.1-puro.U6.sgRNA. Bve I-ממולא פלסמיד עם האנזים BveI16. יש לערבב 2 מיקרוגרם של AA19 pLKO.1-puro.U6.sgRNA. Bve I-stuffer פלסמיד, 5 μL של 10x Buffer O, ו 5 μL של אנזים Bveאני ולהוסיף מים סטריליים כדי להגיע לנפח כולל של 50 μL.
- וורטקס בקצרה לסובב את תערובת התגובה. דגירה התגובה ב 37 °C (69 °F) עבור 1 שעות.
- לטעון את תערובת התגובה על 1% ג'ל agarose ולרוץ 1x טריס-אצטט-EDTA (TAE, 50x מניית TAE: 242 גרם של בסיס Tris מומס במים, 57.1 מ"ל של חומצה אצטית קרחונית, 100 מ"ל של 500 מ"מ EDTA (pH 8.0) פתרון, ולהוסיף מים סך של 1 L) חוצץ עד הפרדה טובה מושגת.
- חותכים את שבר עמוד השדרה מהג'ל, מבודדים אותו עם ערכת מיצוי ג'ל על פי פרוטוקול היצרן (ראו טבלת החומרים)ומחלישים את עמוד השדרה במאגר μL elution 40 (EB).
- מערבבים 5 μL של 100 pmol / μL חוש אוליגו ו 5 μL של 100 pmol / μL אנטיסנס אוליגו עם 1 μL של 1 M Tris-HCl (pH 8.0) ולהוסיף מים סטריליים כדי להגיע סך של 100 μL כדי anneal אוליגוס gRNA. דגירה את התערובת במשך 5 דקות ב 100 מעלות צלזיוס, ולאחר מכן לכסות את הצינורות עם רדיד אלומיניום. לאחר מכן, מצננים לאט את הפתרון לטמפרטורת החדר לשימוש נוסף כהכנסה.
- כדי לוותר על אוליגוס gRNA המשלים ועמוד השדרה של BveI מתעכל, לערבב 1 μL של Bveמבודד אני חותך AA19 pLKO.1-puro.U6.sgRNA.BveI-מלית עמוד השדרה ו 2 μL של הכנס (מדולל 1:300) עם 2 μL של 10x T4 מאגר ליגאז DNA ו 1 μL של T4 ליגאז DNA, ולהוסיף מים סטריליים כדי להגיע סך של 20 μL. בקצרה לסובב את הצינור, ולהדגיר אותו במשך 4 שעות בטמפרטורת החדר לשימוש נוסף.
הערה: בעת ביצוע החיבור, ודא ששתי קבוצות בקרה נכללות. עבור קבוצת ביקורת אחת, לערבב 1 μL של עמוד שדרה מבודד, 2 μL של 10x T4 מאגר קשירת DNA, ו 1 μL של T4 DNA ליגאז ולהוסיף מים סטריליים כדי להגיע סך של 20 μL, אבל ללא DNA אוליגו. עבור קבוצת הביקורת האחרת, לערבב 1 μL של עמוד שדרה מבודד 2 μL של 10x T4 מאגר ליגאז DNA, ולהוסיף מים סטריליים כדי להגיע סך של 20 μL, אבל בלי אוליגוס annealed ו T4 ליגאז. שני ליגציות בקרה אלה משמשות כדי לקבוע את רקע התגובה בשלב הטרנספורמציה הבא ולציין עד כמה יעילה הקשירה.
- להפוך את תערובת התגובה לתוך TOP10 E. coliמוסמך .
- לאסוף את TOP10 E. coliמוסמך. תאים מהמקפיא של 80 מעלות צלזיוס, ומפשירים אותם על קרח.
- מוסיפים 2 μL של תערובת קשירה ל 50 μL של תאים מוסמכים ולשמור את הצינור על הקרח במשך 30 דקות.
- חום הלם הצינור ב 42 מעלות צלזיוס במשך 30 s. שים את הצינור על קרח במשך 2 דקות.
- מוסיפים 950 μL של מרק לימוגנטי טרי (LB) בינוני לתערובת ומנערים במרץ ב 37 מעלות צלזיוס במשך 60 דקות.
- ספין למטה צלחת התאים על אמפילין חם (100 מיקרוגרם / מ"ל) התנגדות צלחת LB. דגירה את הצלחת ב 37 מעלות צלזיוס לילה.
- אמת את הכניסה המוצלחת של אוליגוס gRNA בפלסמיד.
- בחר 3-5 מושבות על הצלחת ב 1 מ"ל של ampicillin (100 מיקרוגרם / מ"ל) המכיל LB בינוני לנער לילה ב 30 מעלות צלזיוס.
- לבודד את ה-DNA פלסמיד עם ערכת פלסמיד על פי פרוטוקול היצרן (טבלה של חומרים) ולרצף אותו עם פריימר מקדם U6 5 '- GAGGGCCTTTCCCATGATT -3' כדי לאמת את הכניסה המוצלחת של אוליגו gRNA.
4. צור חילזון נוקאאוט MS-1 תאים
- לייצר חלקיקים lentiviral נושאת Cas9 או חילזון מיקוד gRNAs.
- תרבות HEK 293T תאים ב DMEM המכיל 10% סרום שור עוברי ו 100 U / mL פניצילין / סטרפטומיצין ב 14.5 ס"מ מנות (או T75 בקבוקונים) באינקובטור (5% CO2, 37 °C (77 °F).
- לערבב 9.9 מיקרוגרם של פלסמיד גנים מיקוד, AA19 pLKO.1-חילזון-sgRNA או pLV-Cas917 פלסמיד, יחד עם פלסמידים עוזר 3.5 מיקרוגרם של pCMV-VSVG (קידוד חלבון G של וירוס stomatitis הרכב, VSV-G), 6.6 מיקרוגרם של אלמנט מגיב rev pMDLg-RRE (קידוד Gag ופול), ו 5.0 מיקרוגרם של pRSV-REV (קידוד Rev) ב 500 μL של מדיום ללא סרום. Resuspend 50 μL של פוליאתילנימין (PEI) (2.5 מ"ג / מ"ל) ב 500 μL של מדיום ללא סרום. מערבבים בעדינות פלסמידים והכנות PEI על ידי צנרת למעלה ולמטה. דגירה את התערובת במשך 20 דקות בטמפרטורת החדר.
- Transfect HEK 293T תאים על ידי הוספת מדיום התערובת משלב 4.1.2 כדי 80% תאים confluent ב 14.5 ס"מ כלים (או T75 בקבוקונים) המכילים מדיום DMEM עם 10% FBS ו 100 U / mL פניצילין / סטרפטומיצין. HEK293T תאים משמשים כי הם בקלות transfected וליצור רמות גבוהות של וירוס18.
- העבר תאי HEK 293T שעברו חוצה למאגר ביולוגי במעבדה מיקרוביולוגית וביו-רפואית (BMBL) כדי לתרבת אותם למשך 24 שעות.
- במעבדת BMBL, החלף את מדיום הטרנס-פפיקציה מתאי HEK 293T ב- 12 מ"ל של DMEM מלא טרי המכיל FBS ופניצילין/סטרפטומיצין. דגירה התאים במשך 24 שעות.
- לאסוף ולסנן את המדיום עם מזרק 20 מ"ל ומסנן 0.45 מיקרומטר. מעבירים את המדיום המותנה לצינור פוליפרופילן של 15 מ"ל.
- הוסיפו 12 מ"ל של DMEM מלא טרי המכיל FBS ופניצילין/סטרפטומיצין לתבשיל התרבות לתרבות HEK 293T ל-24 שעות נוספות.
- לאסוף ולסנן את המדיום עם מזרק 20 מ"ל ומסנן 0.45 מיקרומטר. מעבירים את המדיום המותנה לצינור פוליפרופילן של 15 מ"ל. אחסן את המדיום המכיל חלקיקים lentiviral כמו 1 aliquots מ"ל ב -80 מעלות צלזיוס לשימוש נוסף.
- להדביק תאי MS-1 עם וירוס pLV-Cas9.
- זרע 1 x 105 MS-1 תאים לבאר בצלחת 6-באר עבור 24 שעות לפני זיהום lentivirus.
- להפשיר את aliquots קפוא של וירוס pLV-Cas9 באמבט מים 37 מעלות צלזיוס.
- יש לערבב 1 מ"ל של מדיום וירוסים עם 1 מ"ל של מדיום DMEM טרי המכיל FBS ופניצילין/סטרפטומיצין. הוסף פוליברן למדיום (ריכוז סופי כמו 10 מיקרוגרם / מ"ל) כדי להגדיל את יעילות הזיהום.
- מוציאים את המדיום מהצלחת 6-well ומחליפים אותו עם הנגיף / פוליברן לערבב בינוני ותרבות התאים באינקובטור עבור 24 h. 24 שעות לאחר ההדבקה, להחליף את המדיום עם מדיום טרי תרבות התאים עוד 24 שעות.
הערה: שמור תמיד על קבוצת ביקורת לא מושפעת. - לשאוף את המדיום מהקבוצה הנגועה ואת קבוצת הביקורת ולהחליף אותו עם מדיום DMEM עם 4 מיקרוגרם / מ"ל blasticidin.
- להחזיר את הצלחת לחממה 37 מעלות צלזיוס ותרבות התאים במשך שבוע אחד. תאים לא מושפעים ימותו עקב ההשפעה של blasticidin. לפצל את התאים ששרדו כאשר הם מגיעים 80% מפגש התא ולהמשיך עם בחירת blasticidin.
- אשר את הביטוי של Cas9 בתאי MS-1 על ידי כתמים מערביים באמצעות נוגדן נגד Cas9 (המשקל המולקולרי של Cas9 הוא כ 160 kDa).
- להדביק בנפרד pLV-Cas9 MS-1 תאים עם שני lentiviruses gRNA עצמאית.
- זרע 1 x 105 pLV-Cas9 MS-1 תאים לבאר בצלחת 6-באר במשך 24 שעות לפני ההדבקה.
- בצע את אותו פרוטוקול כמתואר ב 4.2 כדי להדביק בנפרד תאים עם שני לנטיוירוסים gRNA.
- לאחר 24 שעות של זיהום בנגיף gRNA, לרענן את המדיום ותרבות התאים עוד 24 שעות.
- החלף את המדיום עם DMEM עם 1 מיקרוגרם / מ"ל puromycin. להחזיר את הצלחת לחממה 37 מעלות צלזיוס ותרבות התאים במשך שבוע אחד. ודא שהתאים הלא מחוברים מתים לחלוטין. לפצל את התאים כאשר הם מגיעים 80% confluency ולהמשיך הבחירה puromycin.
- אשר את הנוקאאוט של חילזון בתאי MS-1 על ידי כתמים מערביים באמצעות נוגדן נגד חילזון (משקל מולקולרי של חילזון הוא כ 35 kDa).
תוצאות
TGF-β2 גורם EndMT וממריץ ביטוי חילזון בתאי אנדותל MS-1
TGF-β הוא אחד הציטוקינים עם הפוטנציאל הגדול ביותר לגרום EndMT. לאחר טיפול בתאי MS-1 עם TGF-β2 (1 ng/mL) במשך 3 ימים, תאי MS-1 אנדותל מאבדים את המבנה המרוצף שלהם ומבדילים לתאים דמויי מסנצ'יאלית בצורת ציר (איור 1A)15. כדי לאמת עוד יותר את התפקיד של TGF-β2 בגרימת שינויים phenotypic התא, טיפלנו מראש התאים עם קולטן מולקולה קטנה activin כמו קינאז (ALK)4/ALK5/ALK7 מעכב SB431542 לפני TGF-β2גירוי 19. SB431542 בטל לחלוטין את השינויים במורפולוגיה של התאים הנגרמים על ידי TGF-β2 (איור 1A). תהליך EndMT המושרה TGF-β2 נחקר עוד יותר על ידי לימוד שינויים בביטוי של סמנים הקשורים EndMT. כפי שמוצג באיור 1B, חלבון האנדותל Pecam-1 ירד בעוצמה לאחר גירוי TGF-β2, בעוד הגורם mesenchymal Sm22α היה עמוק upregulated על ידי TGF-β215. נתונים אלה עולים בקנה אחד עם הרעיון כי TGF-β2 מופעל EndMT בתאי MS-1. לאחר מכן, חקרנו את ההשפעות של TGF-β2 על ביטוי חילזון שבלול. כפי שמוצג באיור 1C, חילזון היה מסומן במידה ניכרת על ידי TGF-β2, בעוד ביטוי שבלול לא הושפע TGF-β2 בתאי MS-115. הכימות של ביטוי חילזון משלושה ניסויים עצמאיים מוצג באיור 1D.
דלדול חילזון על ידי CRISPR/Cas9 בתאי אנדותל MS-1
כמו חילזון היה המושרה על ידי TGF-β2 וככל הנראה מעורב EndMT בתיווך TGF-β2, ביצענו עריכת גנים CRISPR / Cas9 כדי לרוקן גנטית ביטוי חילזון בתאי MS-1. שיערנו כי דלדול חילזון יהיה מספיק כדי לעכב TGF-β2-induced EndMT. כפי שמוצג באיור 2A, יצרנו תאי הסתרה של חילזון בשני שלבים. ראשית, Cas9 התבטא באופן חוץ רחמי על ידי הדבקת תאי MS-1 עם Cas9 המבטא lentivirus. מכיוון שיש קלטת התנגדות של Blasticidin במבנה pLV-Cas9, בדקנו את הביטוי של Cas9 על ידי ניתוח כתמים מערביים בתאים עמידים לבסטצידין(איור 2D). לאחר מכן, הצגנו sgRNAs כי במיוחד ממוקד חילזון לשבש את ביטוי החלבון שלה. הליך זה בוצע גם על ידי זיהום עם חלקיקים lentiviral נושאת את AA19 pLKO.1-חילזון-sgRNA מבנה, הכולל קלטת ביטוי puromycin. תאים המבטאים Cas9 נדבקו שוב gRNA המכיל lentivirus ונבחר עוד יותר עם puromycin. שני אוליגוס SgRNA משלימים המכוונים לחילזון מורין תוכננו עם פעילות נמוכה צפויה מחוץ ליעד(איור 2B,C). לאחר שהציג שני SgRNAs חילזון עצמאי ב Cas9 המבטא תאי MS-1, ביטוי חלבון חילזון בוטל (איור 2D)15.
מחסור בחילזון מעכב את ה-EndMT שנגרם על ידי TGF-β2 בתאי MS-1
כדי להדגים את הפונקציה של חילזון ב- EndMT בתיווך TGF-β2, ביצענו בדיקת EndMT בתאים מרוקנים חילזון והשווינו אותו עם תאי MS-1 הורים. כפי שמוצג באיור 3A, הנוקאאוט של חילזון הספיק כדי לעכב את מורפולוגיה התא דמוי פיברובלסט מונע על ידי TGF-β2 בתאי MS-115. בנוסף, הירידה בתיווך TGF-β2 ב Pecam-1 ושיפור של Sm22α נחסמו לחלוטין בתאי MS-1 מדולדל חילזון. לסיכום, הוכחנו כי חילזון הוא קריטי עבור EndMT בתיווך TGF-β2 בתאי MS-1 (איור 3B)15.
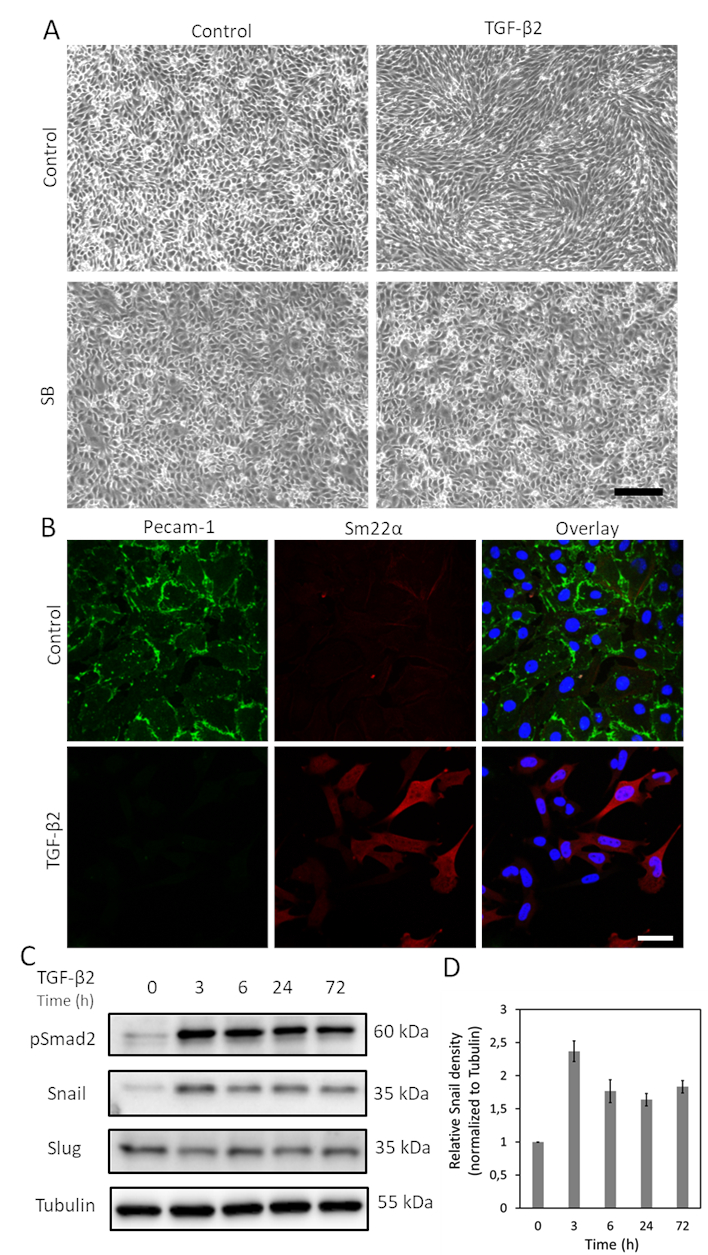
איור 1. TGF-β2 גורם לביטוי EndMT וחילזון בתאי MS-1. א. ההשפעות של TGF-β2 ו/או TGF-β סוג אני קולטן מעכב קינאז SB-431542 על מורפולוגיה של התא. תמונות Brightfield של תאי MS-1 בעת הטיפול עם TGF-β2 (1 ng/mL) ו/או SB-431542 (SB, 5 מיקרומטר, מנוהל 30 דקות לפני TGF-β2) במשך 2 ימים. סרגל קנה המידה מייצג 200 מיקרומטר B. כתמי שפעת של Pecam-1 (ירוק) ו- Sm22α (אדום) בתאי MS-1 בתרבית בינוני המכיל TGF-β2 (1 ng/mL) במשך 3 ימים. גרעינים מוצגים בכחול (DAPI). סרגל קנה מידה: 50 מיקרומטר. C. כתם מערבי עם ליזלת תא שלם של תאי TGF-β2 מגורה MS-1 תאים. הביטוי של חילזון, אבל לא שבלול, שופרה על ידי גירוי TGF-β2, כפי שדווח בעבר ב Ma et al15. ד. כימות ביטוי חילזון על ידי שילוב התוצאות משלושה ניסויים עצמאיים כתם מערבי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
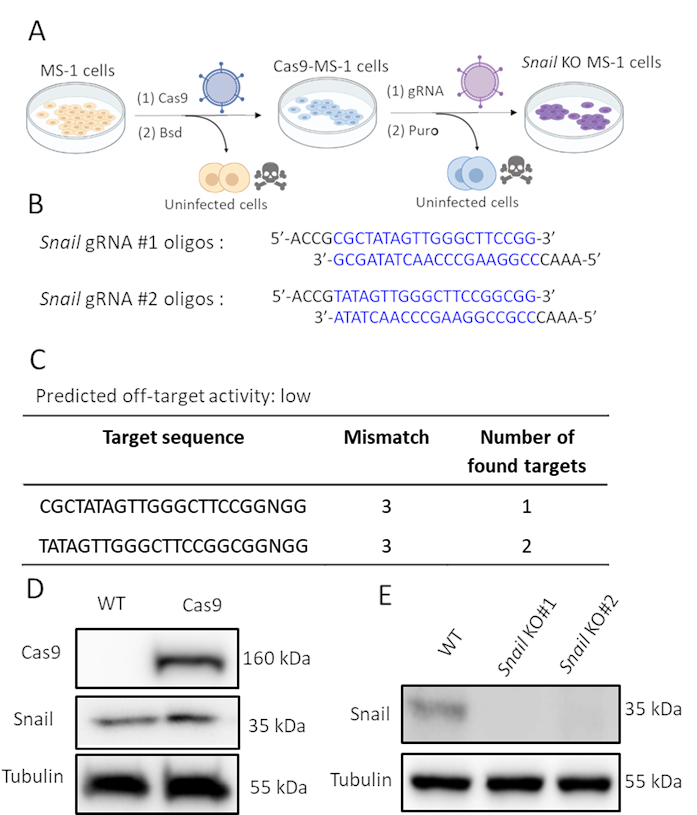
איור 2. דלדול חילזון על ידי עריכת גנים CRISPR-Cas9. א. ערכה המתארת כיצד ליצור תאי הסתרה של חילזון. ב.ס.ד: בלסטויצ'ידין. פורו: פורומיצין. ב. ב. Oligonucleotides של שני sgRNAs עצמאי מיקוד חילזון באמצעות CHOPCHOP (http://chopchop.cbu.uib.no/) ו Cas-OFFinder (http://www.rgenome.net/cas-offinder/). ג. ג. הפעילות החזויה מחוץ ליעד של שני gRNAs עבור חילזון באמצעות Cas-OFFinder (http://www.rgenome.net/cas-offinder/). ד. ביטוי Cas9 וחילזון בסוג פראי (WT) ו- MS-1 מבוטא יתר על ה- Cas9 נמדד על-ידי ניתוח כתמים מערבי. אי, אי. נוקאאוט של חילזון עם שני gRNAs עצמאיים בתאי MS-1 כפי שנמדד על ידי ניתוח כתם מערבי. דיווחנו על תוצאות דומות ב- Ma et al15. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
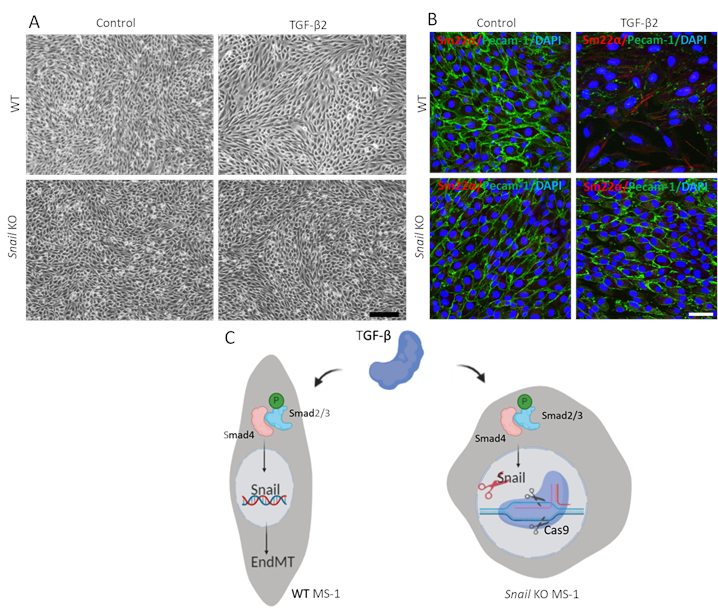
איור 3. דלדול גנטי של חילזון מעכב TGF-β2-induced EndMT בתאי MS-1. א. תמונות Brightfield של תאי MS-1 עם טיפול עם TGF-β2 (0.1 ng/mL) במשך 3 ימים ב wildtype (WT, הלוח העליון) ו חילזון בנוקאאוט (הלוח התחתון) תאים. סרגל קנה המידה מייצג 200 מיקרומטר. B. כתמי אימונופלואורסצנטיים עבור Pecam-1 (ירוק), Sm22α (אדום) וגרעינים (כחולים) של תאי MS-1 בתרבית בינונית המכילה TGF-β2 (1 ng/mL) במשך 3 ימים. דלדול של חילזון בטל TGF-β2-induced ירידה של Pecam-1 ועלייה של ביטוי Sm22α. סרגל קנה המידה מייצג 50 מיקרומטר C. ייצוג סכמטי של ההשפעה של הסתרת חילזון על EndMT הנגרמת על-ידי TGF-β בתאי MS-1. TGF-β מגרה את הביטוי של חילזון דרך מסלול Smad על ידי phosphorylating Smad2/3 וכוננים נוספים EndMT. לדפוק חילזון באמצעות CRISPR / Cas9 מבוססי עריכת גנים בוטלה TGF-β בתיווך EndMT. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
הבנת המנגנון של EndMT היא קריטית עבור אפנון תהליך זה ומיקוד מחלות הקשורות EndMT. כאן, תיארנו שיטות לביצוע בדיקת EndMT הנגרמת על ידי TGF-β ולחקור את התפקיד של חילזון EndMT-TF ב- EndMT המופעל על-ידי TGF-β, על-ידי ביצוע דלדול גנים יציבים של חילזון מתאים בתיווך CRISPR/Cas9. דלדול החילזון באמצעות גישת CRISPR/Cas9 התפוגג בהצלחה את EndMT מונחה TGF-β2 בתאי MS-1(איור 3C). כדי לחקור את ההשפעות של ציטוקינים כלשהם, כמו TGF-β, על EndMT, ECs נחשפו ציטוקינים ולאחר מכן המופע של EndMT הוערך על פי שינויים מורפולוגיים ושינויים ביטוי סמן אנדותל ו mesenchymal בתאים. TGF-β2 מאוד המושרה EndMT בתאי MS-1 מלווה עלייה חזקה בביטוי של חילזון גורם שעתוק. EndMT-TFs המושרה על ידי TGF-β יכול להיות שונה בהתאם למין או סוג תא אנדותל ספציפי לרקמות. לדוגמה, ראינו כי חילזון אבל לא שבלול היה upregulated באופן משמעותי על ידי TGF-β בתאי MS-1, בעוד בתאי אנדותל וריד טבור אנושי (HUVECs), הן חילזון סלאג גדלים לאחר חשיפה TGF-β20.
הערכנו את היקף תהליך EndMT בשתי דרכים על ידי בחינת שינויים במורפולוגיה של התאים ולאחר מכן על ידי חקירת שינויים בביטוי סמנים הקשורים ל- EndMT. לאחר חשיפה β TGF במשך 3 ימים, תאים עברו EndMT עם וריאציות מורפולוגיות עקביות ושינויים בביטוי של סמנים הקשורים EndMT. בנוסף לכתם האימונופלואורסצנטי שביצענו כאן, וריאציות סמן יכולות להיות מנוטרות גם על ידי כתמים מערביים ברמת ביטוי החלבון או על ידי qRT-PCR (PCR שעתוק הפוך כמותי בזמן אמת) ברמות הגן21. בנוסף לשתי שיטות אלה לחיסכון בזמן ובעלויות שהראינו בפרוטוקול זה, קיימות שיטות אחרות לבחינת EndMT. לדוגמה, ביצוע ניתוח תעתיק (על ידי רצף RNA או qPCR) כדי להשוות את רמות הביטוי של גנים הקשורים אנדותל ו mesenchymal בין תאי מטופלים ובקרה יכול להעריך במדויק EndMT22,23. בנוסף, EndMT כרוך לעתים קרובות באובדן יציב של פונקציית מחסום, אשר ניתן להעריך על ידי ספקטרוסקופיהעכבה 24. יתר על כן, ניתן לבחון הוכחה נוספת לרכישת נכסים דמויי תאי גזע על ידי תאים שמקורם ב- EndMT. לדוגמה, בתנאי תרבות ספציפיים, תאים דמויי Mesenchymal EndMT ניתן להבדיל עוד יותר לתוך osteoblasts, chondrocytes, adipocytes או (myo)fibroblasts. לכן, ניתוח נוסף כדי לאשר את הבידול לסוגי תאים שונים השייכים לשושלת mesoderm (כלומר, ביטוי גנים וכתמי מטריצה) שימושי להדגמת האופי הרב-פוטנטי של תאים שמקורם ב- EndMT. לבסוף, שיטות הערכת EndMT אינן מוגבלות למחקרים במבחנה, אך ניתן לשער אותן כדי לחקור את הקשר בין EndMT לבין מחלות מסוימות ב- vivo או באיברי vivo לשעבר. במובן זה, השימוש באסטרטגיות מעקב שושלת ספציפיות לאנדוטליות מורחב באופן נרחב למחקר הקשור ל- EndMT25.
כדי לחקור את התפקיד של חילזון במהלך EndMT, במחקר זה CRISPR / Cas9 עריכת גנים שימש לדפוק את הגן הזה. הנתונים הראו כי TGF-β2 נכשל לתווך EndMT בתאי MS-1 חסר חילזון. תצפית זו הוכיחה כי חילזון חיוני עבור TGF-β2 המושרה EndMT בתאי MS-1. השתמשנו בקלטת ביטוי SgRNA עצמאית מונחית U6 כדי להציג sgRNAs ספציפיים עבור Cas9 כדי למקד חילזון. בנוסף לשיטה זו, Ran et al.26 תיאר אסטרטגיה נוספת לשיבוט רצף אוליגוס sgRNA לתוך הפיגום Cas9 כדי ליצור מבנה המכיל הן Cas9 ו gRNAs. גישות חדשניות מתפתחות מאפשרות ל-CRISPR/Cas לשלב פונקציות נוספות. לדוגמה, ניתן להשיג נוקאאוטים כפולים או משולשים על ידי אספקת יותר sgRNAs לתאים המבטאים Cas927. חלבון Cas13 מהונדס מטרות מעכל מולקולות RNA מבלי לשבש DNA אנדוגני28. מלבד לדפוק את הגנים עם CRISPR / Cas, סיכת ראש קצרה RNAs (shRNAs) יכול לשמש חלופות להפיל ביציבות ביטויגנים ממוקדים 29. עבור כל שיטות עריכת הגנים CRISPR/Cas, יש לקחת בחשבון תמיד מחשוף מחוץ ליעד. בנוסף, RNAs מפריעים קטנים (siRNAs) להשתיק ביטוי גנים ארעי ואת ריכוז siRNA מדולל עם חלוקתתאים 30. שתי שיטות אלה מדכאות חלקית ביטוי גנים ממוקדים. לעומת זאת, ביטוי גנים חוץ רחמיים משמש גם כדי לאמת את תפקוד הגנים במהלך EndMT / EMT31. גישה זו יכולה לקבוע אם הסרת הפיקוח על גן מספיקה כדי לעורר תגובת EndMT. לכן, כיום יש שפע של אסטרטגיות טכניות שניתן להשתמש בהם כדי לזהות ולאמת רגולטורים פוטנציאליים של EndMT. חוץ מזה, ניתוח תעתיק יכול להיות אפשרות טובה בזיהוי וניתוח מקיף של הרגולטורים הקשורים EndMT. אנו ממליצים להשתמש בגישות משלימות שונות כדי לחקור את אפנון EndMT.
לסיכום, הצגנו זרימת עבודה כדי לזהות גורמים שעשויים למלא תפקידים פונקציונליים במהלך EndMT הנגרמת על-ידי β TGF. שיטה זו יכולה לשמש גם כדי ללמוד אם גירויים אחרים (כלומר, ציטוקינים, גורמי גדילה, גירויים מכניים, אינטראקציות תא-תא) יכול לווסת EndMT, ואת יחסי הגומלין של TGF-β עם גירויים אחרים. בנוסף, הדגשנו גישה באמצעות עריכת גנים CRIPSR / Cas כדי להבהיר אם גן מסוים נדרש עבור EndMT הנגרמת על ידי TGF-β. כדי להמחיש מתודולוגיה זו, השתמשנו חזק EndMT לגרום TGF-β2 בתאי MS-1, אבל הפרוטוקולים יכולים להיות מותאמים ציטוקינים אחרים וסוגי תאים אחרים. אנו מצפים כי פרוטוקול מפורט זה המתואר ישמש קרש קפיצה למחקרים עתידיים הקשורים EndMT.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחקר נתמך על ידי CGC.NL והיוזמה ההולנדית לחקר כלי הדם: קרן הלב ההולנדית, הפדרציה ההולנדית של המרכזים הרפואיים האוניברסיטאיים, הארגון ההולנדי למחקר ופיתוח בריאות, והאקדמיה המלכותית ההולנדית למדעים גרנט הוענקה לפידרה-אימפקט (http://www.phaedraresearch.nl). JM נתמכת על ידי מועצת המלגות הסינית. GSD נתמך על ידי מענק טרמפולינה מ AFM-Telethon [22379], FOP איטליה ומענק מלה פונדאסיו לה מאראטו דה TV3 (#202038).
Materials
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | Pall Corporation, USA | 4614 | |
| 10× T4 DNA ligase buffer | Thermofisher Scientific, USA | B69 | |
| 12 mm round glass slice | Knittel Glass,Germany | VD10012Y1A.01 | |
| 20 mL syringe | BD Eclipse, USA | 300629 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Vector Laboratories, USA | H-1200 | VECTASHIELD Antifade Mounting Media |
| AA19_PLKO vector | Dr. M Gonçalves, Leiden University Medical Center, Netherlands | Gift | |
| Ampicillin | Serva Electrophoresis, USA | 1339903 | |
| Anti-Mouse IgG | GE Healthcare, USA | NA931 | |
| Anti-Rabbit IgG | Cell signaling, USA | 7074 | |
| Agarose | Roche, Switzerland | 11388991001 | |
| Blasticidin | Invitrogen, USA | R21001 | |
| Buffer O (10X) | Thermofisher Scientific, USA | BO5 | |
| BveI (Bspm1) | Thermofisher Scientific, USA | ER 1741 | |
| Confocal microscope | Leica Microsystems, Germany | SP8 | |
| DMEM | Thermo Fisher Scientific, USA | 11965092 | |
| Donkey anti-rat Alexa 488 | Invitrogen, USA | A21208 | |
| FBS | Thermo Fisher Scientific, USA | 16000044 | |
| Formaldehyde | Thermo Fisher Scientific, USA | 28908 | |
| Inverted microscope | Leica Microsystems, Germany | DMi8 | |
| Goat anti-rabbit Alexa 594 | Invitrogen,USA | A11012 | |
| LabNed Plasmid kit | LabNed, USA | LN2400004 | |
| MS-1 cell line | American Type Culture Collection (ATCC) | ||
| Nail polish | HEMA, Netherlands | Transparent | |
| Pecam-1 antibody | Becton Dickinson,USA | 553370 | |
| PEI | Polysciences, USA | 23966-1 | |
| PLV-Cas9 plasmid | Sigma-Aldrich, USA | Cas9BST-1EA | |
| Puromycin | Sigma-Aldrich, USA | P9620 | |
| QIAquick gel extraction kit | Qiagen, Germany | 28706 | |
| Sm22a antibody | Abcam, UK | ab14106 | |
| Snail | Cell signaling, USA | 3879 | |
| T4 DNA ligase | Thermofisher Scientific, USA | EL 0014 | |
| TC20 automated Cell Counter | Bio-Rad, USA | 1450102 | |
| Human TGF-β2 | Joachim Nickel, University of Wurzburg | Gift | Other commercial recommendation: 302-B2, R&D systems |
| Triton X-100 | Merck, USA | 1086031000 | |
| SB431542 | Tocris Bioscience, UK | 1614 | |
| Tris | Roche, Switzerland | 11814273001 |
References
- Ma, J., Sanchez-Duffhues, G., Goumans, M. -. J., Ten Dijke, P. TGF-β-induced endothelial to mesenchymal transition in disease and tissue engineering. Frontiers in Cell and Developmental Biology. 8, (2020).
- Piera-Velazquez, S., Jimenez, S. A. Endothelial to mesenchymal transition: role in physiology and in the pathogenesis of human diseases. Physiological Reviews. 99 (2), 1281-1324 (2019).
- Sánchez-Duffhues, G., de Vinuesa, G. A., ten Dijke, P. Endothelial-to-mesenchymal transition in cardiovascular diseases: developmental signaling pathways gone awry. Developmental Dynamics. 247 (3), 492-508 (2018).
- Evrard, S. M., et al. Endothelial to mesenchymal transition is common in atherosclerotic lesions and is associated with plaque instability. Nature Communications. 7 (1), 1-16 (2016).
- Qiao, L., et al. Endothelial fate mapping in mice with pulmonary hypertension. Circulation. 129 (6), 692-703 (2014).
- Zeisberg, E. M., et al. Endothelial-to-mesenchymal transition contributes to cardiac fibrosis. Nature Medicine. 13 (8), 952-961 (2007).
- Clere, N., Renault, S., Corre, I. Endothelial-to-mesenchymal transition in cancer. Frontiers in Cell and Developmental Biology. 8, (2020).
- Saito, A. EMT and EndMT: regulated in similar ways. The Journal of Biochemistry. 153 (6), 493-495 (2013).
- Bolós, V., et al. The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions: a comparison with Snail and E47 repressors. Journal of Cell Science. 116 (3), 499-511 (2003).
- Aird, W. C. Endothelial cell heterogeneity. Cold Spring Harbor Perspectives in Medicine. 2 (1), 006429 (2012).
- Yang, J., et al. Guidelines and definitions for research on epithelial-mesenchymal transition. Nature Reviews Molecular Cell Biology. , 1-12 (2020).
- Doudna, J. A., Charpentier, E. The new frontier of genome engineering with CRISPR-Cas9. Science. 346 (6213), (2014).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Arbiser, J. L., et al. Oncogenic H-ras stimulates tumor angiogenesis by two distinct pathways. Proceedings of the National Academy of Sciences USA. 94 (3), 861-866 (1997).
- MA, J., et al. TGF-?-induced endothelial to mesenchymal transition results from a balance between SNAIL and ID factors. Frontiers in Cell and Developmental Biology. 182 (9), (2021).
- Chen, X., et al. Probing the impact of chromatin conformation on genome editing tools. Nucleic Acids Research. 44 (13), 6482-6492 (2016).
- Hunter, F. W., et al. Functional CRISPR and shRNA screens identify involvement of mitochondrial electron transport in the activation of evofosfamide. Molecular Pharmacology. 95 (6), 638-651 (2019).
- Mao, Y., et al. Lentiviral vectors mediate long-term and high efficiency transgene expression in HEK 293T cells. International Journal of Medical Sciences. 12 (5), 407 (2015).
- Liu, S., et al. Deubiquitinase activity profiling identifies UCHL1 as a candidate oncoprotein that promotes TGFβ-induced breast cancer metastasis. Clinical Cancer Research. 26 (6), 1460-1473 (2020).
- Medici, D., et al. Conversion of vascular endothelial cells into multipotent stem-like cells. Nature Medicine. 16 (12), 1400 (2010).
- Kokudo, T., et al. Snail is required for TGFβ-induced endothelial-mesenchymal transition of embryonic stem cell-derived endothelial cells. Journal of Cell Science. 121 (20), 3317-3324 (2008).
- Dong, J., et al. Single-cell RNA-seq analysis unveils a prevalent epithelial/mesenchymal hybrid state during mouse organogenesis. Genome Biology. 19 (1), 1-20 (2018).
- Oatley, M., et al. Single-cell transcriptomics identifies CD44 as a marker and regulator of endothelial to haematopoietic transition. Nature communications. 11 (1), 1-18 (2020).
- Halaidych, V., et al. Inflammatory responses and barrier function of endothelial cells derived from human induced pluripotent stem cells. Stem Cell Reports. 10 (5), 1642-1656 (2018).
- Li, Y., Lui, K. O., Zhou, B. Reassessing endothelial-to-mesenchymal transition in cardiovascular diseases. Nature Reviews Cardiology. 15 (8), 445-456 (2018).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Grav, L. M., et al. One-step generation of triple knockout CHO cell lines using CRISPR/Cas9 and fluorescent enrichment. Biotechnology Journal. 10 (9), 1446-1456 (2015).
- Abudayyeh, O. O., et al. RNA targeting with CRISPR-Cas13. Nature. 550 (7675), 280-284 (2017).
- Paddison, P. J., et al. Cloning of short hairpin RNAs for gene knockdown in mammalian cells. Nature Methods. 1 (2), 163-167 (2004).
- Reynolds, A., et al. Rational siRNA design for RNA interference. Nature Biotechnology. 22 (3), 326-330 (2004).
- Lourenço, A. R., et al. C/EBPɑ is crucial determinant of epithelial maintenance by preventing epithelial-to-mesenchymal transition. Nature Communications. 11 (1), 1-18 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved