Method Article
Transition endothéliale à mésenchymateuse médiée par TGF-β (EndMT) et évaluation fonctionnelle des effecteurs EndMT à l’aide de l’édition du gène CRISPR/Cas9
Dans cet article
Résumé
Nous décrivons des méthodes pour étudier l’EndMT induite par le TGF-β2 dans les cellules endothéliales en observant les changements de morphologie cellulaire et en examinant les changements de marqueur liés à l’endMT d’expression à l’aide de la coloration par immunofluorescence. L’édition du gène CRISPR/Cas9 a été décrite et utilisée pour épuiser le gène codant pour l’escargot afin d’étudier son rôle dans l’EndMT induite par le TGF-β2.
Résumé
En réponse à des indices externes spécifiques et à l’activation de certains facteurs de transcription, les cellules endothéliales peuvent se différencier en un phénotype de type mésenchymateux, un processus appelé transition endothéliale à mésenchymateuse (EndMT). De nouveaux résultats suggèrent que l’EndMT est causalement liée à de multiples maladies humaines, telles que la fibrose et le cancer. En outre, les cellules mésenchymateuses endothéliales dérivées peuvent être appliquées dans les procédures de régénération tissulaire, car elles peuvent être différenciées en divers types de cellules (par exemple, ostéoblastes et chondrocytes). Ainsi, la manipulation sélective d’EndMT peut avoir le potentiel clinique. Comme la transition épithéliale-mésenchymateuse (EMT), EndMT peut être fortement induite par la cytokine sécrétée transformant le facteur de croissance bêta (TGF-β), qui stimule l’expression des facteurs de transcription endMT (EndMT-TFs), y compris l’escargot et la limace. Ces EndMT-TFs régulent ensuite à la hausse et à la baisse les niveaux de protéines mésenchymateuses et endothéliales, respectivement. Ici, nous décrivons des méthodes pour étudier l’EndMT induite par TGF-β in vitro, y compris un protocole pour étudier le rôle de TFs particuliers dans l’EndMT causé par TGF-β. À l’aide de ces techniques, nous fournissons des preuves que le TGF-β2 stimule l’EndMT dans les cellules endothéliales microvasculaires pancréatiques murines (cellules MS-1), et que l’épuisement génétique de l’escargot à l’aide de courtes répétitions palindromiques régulièrement espacées (CRISPR) / crispr-associated protein 9 (Cas9) -médiée par l’édition de gènes, abroge ce phénomène. Cette approche peut servir de modèle pour interroger les modulateurs potentiels de la biologie endothéliale, et peut être utilisée pour effectuer des tests génétiques ou pharmacologiques afin d’identifier de nouveaux régulateurs de l’EndMT, avec une application potentielle dans les maladies humaines.
Introduction
La transition endothéliale à mésenchymateuse (EndMT) est un phénomène biologique dynamique et en plusieurs étapes qui a été lié à divers processus physiologiques et pathologiques1,2. A l’EndMT les cellules endothéliales perdent progressivement leurs traits endothéliaux, tout en acquérant des propriétés mésenchymateuses3; ainsi, les cellules endothéliales étroitement compactées et bien organisées se différencient en cellules allongées de type mésenchymatel. Les changements morphologiques dans EndMT coïncident avec des altérations dans l’expression de certains gènes et protéines. En général, l’expression des protéines qui maintiennent des caractéristiques endothéliales, y compris endothéliale vasculaire (VE) - cadhérine, plaquette/EC adhérence molecule-1 (CD31/Pecam-1) diminue. Simultanément, les protéines liées aux fonctions mésenchymateuses, telles que l’actine du muscle α lisse (α-Sma) et la protéine du muscle lisse 22α (Sm22α) s’accumulent. Les résultats émergents ont démontré que l’EndMT postnatal contribue au développement de maladies humaines, telles que le cancer, la fibrose cardiaque, l’hypertension artérielle pulmonaire (HTAP), l’athérosclérose (SA), la fibrose d’organe,etc. 2,4,5,6,7. Une compréhension plus approfondie des mécanismes sous-jacents de l’EndMT et de la façon de diriger le processus endMT fournira de nouvelles méthodes thérapeutiques pour les maladies liées à l’EndMT et la médecine régénérative.
TGF-β est l’un des principaux inducteurs d’EndMT, et d’autres facteurs impliqués connus incluent Wnt/β-caténoïne, Notch, et quelques cytokines inflammatoires1. Étant donné que le contexte cellulaire est essentiel pour les réponses déclenchées par TGF-β, l’interaction de TGF-β avec d’autres signaux de promotion EndMT est pertinente pour que TGF-β pour obtenir une réponse EndMT. Lors de l’activation du type I de surface cellulaire TGF-β et des récepteurs kinases de sérine/thréonine de type II, la voie canonique intracellulaire de Smad est activée. Les Smad2/3 phosphorylé médiés par les récepteurs TGF-β forment des complexes hétéromériques avec Smad4 qui se translocalisent dans le noyau, où ils régulent à la hausse l’expression des facteurs de transcription liés à EndMT. Similaires à la transition épithéliale-mésenchymateuse (EMT), les facteurs de transcription tels que Snail, Slug, Twist, Zeb1 et Zeb2 sont induits par la signalisation TGF-β et contribuent à la reprogrammation des gènes dans EndMT8.
L’escargot a souvent été identifié comme un facteur clé dans EndMT. L’escargot se lie au promoteur des gènes codant pour les protéines d’adhésion cellule-cellule et supprime leur transcription, qui est contrebalancée par l’amélioration de l’expression des protéines mésenchymateuses9. Les cellules endothéliales comprennent une population très hétérogène et l’influence relative de divers stimuli extracellulaires sur EndMT peut différer parmi les contextes cellulaires endothéliaux ou les types de cellules10. En raison de ses similitudes avec EMT, certaines méthodologies sont utiles pour étudier à la fois les mécanismes EMT et EndMT8. À cet égard, l’Association internationale EMT (TEMTIA) souligne fortement la nécessité de techniques complémentaires pour démontrer à terme l’occurrence de l’EMT/EndMT11.
Nous décrivons ici une méthode pour surveiller et visualiser le processus EndMT induit par TGF-β. La coloration par immunofluorescence fournit les informations de base sur les changements d’expression dans les protéines / marqueurs ciblés, qui sont utilisés comme indicateurs de la survie du processus EndMT. De plus, la coloration par immunofluorescence peut visualiser la localisation des protéines/marqueurs et la morphologie cellulaire. Pour étudier l’activité potentielle de TFs spécifiques (ou d’autres régulateurs en amont ou en aval) impliqués dans l’EndMT médiée par TGF-β, nous décrivons un protocole utilisant des répétitions palindromiques courtes régulièrement interespaced groupées (CRISPR) / CRISPR-associated protein 9 (Cas9) édition du gène pour épuiser des gènes spécifiques des cellules, en utilisant l’escargot TF comme exemple. Cas9 est une endonucléase d’ADN guidée par double ARN qui reconnaît et fend des séquences complémentaires aux séquences CRISPR chez les bactéries12. Le système CRISPR/Cas9 est actuellement largement utilisé car il facilite le génie génétique in vitro et in vivo13. Dirigé par un ARN guide unique (SGRNA), Cas9 exprimé ectopiquement génère une rupture double brin à une séquence de ciblage présélectionnée dans un locus de gène spécifique. L’assemblage d’extrémité non homologue (NHEJ) a lieu pour réparer les ruptures de brin induites par Cas9, via des insertions ou des délétions de nucléotides aléatoires conduisant ainsi à la perturbation et à l’inactivation du gène ciblé. Nous décrivons en détail des méthodes pour concevoir des sgRNAs sélectifs et générer des vecteurs lentiviral-compatibles contenant les sgRNAs conçus. En conséquence, des cellules endothéliales stables appauvries en gènes peuvent être générées d’une manière efficace et fiable.
Dans cette étude, nous avons utilisé des cellules endothéliales microvasculaires pancréatiques murines (MS-1)14 comme système modèle pour examiner le processus EndMT induit par le TGF-β2. Notre étude précédente a démontré que l’escargot est le principal facteur de transcription augmenté par TGF-β2, par lequel EndMT est induit dans les cellulesMS-1 15. Lors de l’édition du gène CRISPR/Cas9 pour abroger l’expression de l’escargot dans les cellules MS-1, TGF-β2 n’a pas réussi à arbitrer EndMT. Ce flux de travail peut être appliqué pour étudier d’autres gènes (suspects) liés à l’EndMT.
Protocole
1. Induction de EndMT par TGF-β2
- Cellules MS-1 dans le milieu Eagle modifié (DMEM) de Dulbecco contenant 10 % de sérum fœtal bovin (FBS) et 100 U/mL de pénicilline/streptomycine dans un incubateur (5 % deCO2,37 °C). Enrober tous les plats/assiettes de culture de 0,1 % p/v de gélatine pendant 10 min avant utilisation.
- Laver délicatement les cellules MS-1 avec 1x solution saline tamponnée au phosphate (PBS), ajouter 2 mL de solution de trypsine-EDTA (0,25 % de trypsine et 0,02 % d’EDTA) dans un plat de 10 cm et incuber pendant 2 min à 37 °C pour les détacher. Par la suite, ajouter 5 mL de milieu de culture complet pour éteindre la réaction.
- Transférer la suspension cellulaire dans un tube de 15 mL et centrifuger à 200 x g pendant 3 min à température ambiante.
- Jeter le surnageant et résurendre les cellules dans 4 ml de milieu frais contenant du FBS et de la pénicilline/streptomycine. Comptez les cellules à l’aide d’un compteur de cellules automatique.
- Graine 1 x 103 cellules par cm2 pour une culture ultérieure. Par exemple, ensemencez 9,5 x10 3 cellules/puits pour les plaques de 6 puits, ou 1,9 x 103 cellules/puits pour les plaques de 24 puits.
- Incuber les cellules pendant la nuit pour leur permettre d’adhérer et de récupérer, puis stimuler les cellules MS-1 avec TGF-β2 pendant 3 jours. Ajouter l’inhibiteur de la kinase du récepteur TGF-β SB431542 (5 μM) 30 min avant la stimulation du TGF-β2. Traiter d’autres cellules avec un véhicule (DMSO).
NOTA : Dissoudre le TGF-β2 dans 4 mM de HCl contenant 0,1 % d’albumine sérique humaine bovine (BSA). Ajouter la même quantité de tampon de ligand sans TGF-β2 au groupe témoin. La concentration de TGF-β2 peut être adaptée pour être de 0,1-1 ng/mL pour des dosages spécifiques. Voir les indications dans les figures correspondantes. - Après 3 jours, examinez la morphologie cellulaire avec une imagerie en champ lumineux (avec un microscope inversé) et effectuez une coloration par immunofluorescence (voir l’étape 2) pour évaluer les changements de marqueurs liés à EndMT. Effectuer au moins trois expériences indépendantes pour obtenir des triplicates biologiques.
2. Coloration par immunofluorescence
- Trypsiniser les cellules MS-1 cultivées (étape 1.2), puis réensemêner 1,9 x 103 cellules sur un verre de couverture rond de 12 mm enduit de gélatine à 0,1 % p/v placé sur le fond d’une plaque de 24 puits.
- Après avoir culture les cellules pendant une nuit, ajouter du TGF-β2 (concentration finale 1 ng/mL) aux cellules pendant 3 jours. Utilisez un milieu contenant un tampon de ligand comme témoin négatif.
- Effectuez des colorations Pecam-1 et Sm22α.
- Après avoir stimulé les cellules avec TGF-β2 (ou Control) pendant 3 jours, retirez le milieu et lavez les cellules avec 1x PBS.
- Ajouter 300 μL de formaldéhyde à 4 % à chaque puits et incuber pendant 10 min à température ambiante pour fixer les cellules. Laver 3x avec 1x PBS après incubation.
- Ajouter 300 μL de Triton X-100 à 0,1 % dans 1x PBS à chaque puits et incuber pendant 10 min à température ambiante pour perméabiliser les cellules. Après incubation, retirez la solution Triton X-100 et lavez les cellules 3x avec 1x PBS.
- Bloquer les cellules avec 3% d’albumine sérique bovine (BSA) dans 1x PBS pendant 45 min à température ambiante.
- Diluer les anticorps primaires Pecam-1 et Sm22α qui reconnaissent les protéines murines 1:500 avec 1x PBS. Incuber ensuite les cellules fixes avec des anticorps primaires pendant 45 min à température ambiante.
- Après avoir lavé 3x avec 1x PBS, incuber les cellules avec 1000x anticorps secondaires dilués, y compris l’âne anti-rat Alexa 488 et l’anti-lapin de chèvre Alexa 594, pendant 45 min à température ambiante.
REMARQUE: Protégez les échantillons de la lumière pendant la coloration. - Après rinçage 3x avec 1x PBS, placez le verre de couverture ensemencé avec des cellules face vers le bas sur une goutte de milieu de montage contenant du 4',6-diamidino-2-phénylindole (DAPI) sur une lame pour tacher les noyaux.
- Fixez la périphérie du verre de couverture avec du vernis à ongles transparent et rangez-le à 4 °C.
- Acquérir des images représentatives avec un microscope confocal. Réglez les longueurs d’onde laser à 405 nm, 488 nm et 552 nm pour détecter DAPI, Pecam-1 et Sm22α, respectivement. Pour chaque canal, toutes les photos ont été prises avec les mêmes paramètres et le même temps d’exposition. Effectuer au moins trois expériences indépendantes pour obtenir des triplicates biologiques.
3. Knock out of Snail en utilisant l’édition CRISPR / Cas9
- Concevoir deux sgRNAs indépendants ciblant l’escargot murin.
- Concevez des sgRNAs à l’aide des outils en ligne CHOPCHOP (https://chopchop.cbu.uib.no/) et Cas-OFFinder (http://www.rgenome.net/cas-offinder/) en fonction du nom du gène et de l’espèce ciblés.
- Prédire l’activité hors cible des sgRNAs conçus ciblant à Snail avec deux algorithmes indépendants, y compris Cas-OFFinder (http://www.rgenome.net/cas-offinder/) et CHOPCHOP (http://chopchop.cbu.uib.no/).
- Choisissez deux sgRNAs avec la plus faible hors activité. Concevez deux oligos sgRNA complémentaires avec le site de coupe BveI. L’oligo de sens commence par 5'-ACCG-3' et l’oligo antisens commence par 5'-AAAC-3'.
- Ordonner que les oligos soient synthétisés commercialement pour une utilisation ultérieure.
- Cloner les oligos d’ARN guide complémentaire dans l’AA19 digéré par BveI pLKO.1-puro.U6.sgRNA. Bve I-stuffer Plasmide vectoriel lentiviral pour générerAA19 pLKO.1-Escargot-sgRNA16.
- Couper l’AA19 pLKO.1-puro.U6.sgRNA. Bve Plasmide I-stuffer avec l’enzyme BveI16. Mélanger 2 μg d’AA19 pLKO.1-puro.U6.sgRNA. Bve Plasmide I-stuffer, 5 μL de 10x Buffer O, et 5 μL d’enzyme BveI et ajouter de l’eau stérile pour atteindre un volume total de 50 μL.
- Vortex et tournez brièvement vers le bas le mélange de réaction. Incuber la réaction à 37 °C pendant 1 h.
- Chargez le mélange réactionnel sur un gel d’agarose à 1% et utilisez 1x Tris-acétate-EDTA (TAE, 50x TAE stock: 242 g de base tris dissoute dans l’eau, 57,1 mL d’acide acétique glacial, 100 mL de solution d’EDTA 500 mM (pH 8.0) et ajoutez de l’eau à un tampon total de 1 L) jusqu’à ce qu’une bonne séparation soit réalisée.
- Couper le fragment de colonne vertébrale du gel, l’isoler avec un kit d’extraction de gel selon le protocole du fabricant (voir la table des matériaux)et éluer la colonne vertébrale dans un tampon d’élution de 40 μL (EB).
- Mélanger 5 μL d’oligo sensor 100 pmol/μL et 5 μL d’oligo-sens antisens 100 pmol/μL avec 1 μL de Tris-HCl 1 M (pH 8,0) et ajouter de l’eau stérile pour atteindre un total de 100 μL pour recuit les oligos d’ARNr. Incuber le mélange pendant 5 min à 100 °C, puis recouvrir les tubes de papier d’aluminium. Après cela, refroidissez lentement la solution à température ambiante pour une utilisation ultérieure en tant qu’insert.
- Pour ligater les oligos d’ARNr complémentaires et le squelette digéré par BveI, mélanger 1 μL de Bveisolé, je coupe AA19 pLKO.1-puro.U6.sgRNA.BveI-stuffer backbone et 2 μL d’insert (dilué 1:300) avec 2 μL de tampon de ligase d’ADN T4 10x et 1 μL d’ADN ligase T4, et ajouter de l’eau stérile pour atteindre un total de 20 μL. Tournez brièvement le tube et incuber pendant 4 h à température ambiante pour une utilisation ultérieure.
Remarque : lorsque vous effectuez la ligature, assurez-vous que deux groupes de contrôle sont inclus. Pour un groupe témoin, mélanger 1 μL de squelette isolé, 2 μL de tampon d’ADN ligase 10x T4 et 1 μL d’ADN ligase T4 et ajouter de l’eau stérile pour atteindre un total de 20 μL, mais sans oligo-ADN. Pour l’autre groupe témoin, mélanger 1 μL de squelette isolé et 2 μL de tampon d’ADN ligase 10x T4, et ajouter de l’eau stérile pour atteindre un total de 20 μL, mais sans les oligos recuits et la ligase T4. Ces deux ligatures de contrôle sont utilisées pour déterminer le fond de réaction à l’étape de transformation suivante et indiquer l’efficacité de la ligature.
- Transformez le mélange réactionnel en E. coliTOP10 compétent.
- Recueillir le TOP10 E. colicompétent. les cellules du congélateur à -80 °C et les décongeler sur de la glace.
- Ajouter 2 μL de mélange de ligature à 50 μL de cellules compétentes et maintenir le tube sur la glace pendant 30 min.
- Choc thermique du tube à 42 °C pendant 30 s. Mettez le tube sur de la glace pendant 2 min.
- Ajouter 950 μL de bouillon de lysogenèse frais (LB) au mélange et agiter vigoureusement à 37 °C pendant 60 min.
- Faites tourner vers le bas et plaquez les cellules sur une plaque LB de résistance à l’ampicilline chaude (100 μg/mL). Incuber la plaque à 37 °C pendant la nuit.
- Vérifier l’insertion réussie des oligos d’ARNr dans le plasmide.
- Choisir 3 à 5 colonies sur la plaque dans 1 mL d’ampicilline (100 μg/mL) contenant du milieu LB et agiter pendant la nuit à 30 °C.
- Isoler l’ADN plasmidique avec un kit plasmidique selon le protocole du fabricant(Table des Matériaux)et le séquencer avec l’amorce promotrice U6 5'- GAGGGCCTATTTCCCATGATT -3' pour vérifier l’insertion réussie de l’oligo-ARN g.
4. Générer des cellules MS-1 knockout Escargot
- Produire des particules lentivirales porteuses d’ARNm Cas9 ou ciblant les escargots.
- Culture de cellules HEK 293T dans du DMEM contenant 10 % de sérum fœtal bovin et 100 U/mL de pénicilline/streptomycine dans des plats de 14,5 cm (ou fioles T75) dans un incubateur (5 % deCO2,37 °C).
- Mélanger 9,9 μg de plasmide de gène de ciblage, AA19 pLKO.1-Snail-sgRNA ou pLV-Cas917 plasmide, avec les plasmides auxiliaires 3,5 μg de pCMV-VSVG (codant pour la protéine G du virus de la stomatite vésiculeuse, VSV-G), 6,6 μg de plasmide d’élément sensible au régime pMDLg-RRE (codant pour Gag et Pol), et 5,0 μg de pRSV-REV (codant pour Rev) dans 500 μL de milieu libre sérique. Remise en suspension de 50 μL de polyéthylénimine (Î.-P.-É.) (2,5 mg/mL) dans 500 μL de milieu sérique libre. Mélangez doucement les plasmides et les préparations de l’Île-du-Prince-Édouard en les pipetant de haut en bas. Incuber le mélange pendant 20 min à température ambiante.
- Transfecter les cellules HEK 293T en ajoutant le milieu de mélange de l’étape 4.1.2 à 80% de cellules confluentes dans des plats de 14,5 cm (ou flacons T75) qui contiennent du milieu DMEM avec 10% FBS et 100 U/mL de pénicilline/streptomycine. Les cellules HEK293T sont utilisées car elles sont facilement transfectées et génèrent des niveaux élevés de virus18.
- Transférer les cellules HEK 293T transfectées à un laboratoire microbiologique et biomédical (BMBL) pour les faire passer pendant 24 h.
- Dans un laboratoire de BMBL, remplacer le milieu de transfection des cellules HEK 293T par 12 mL de DMEM complet frais contenant du FBS et de la pénicilline/streptomycine. Incuber les cellules pendant 24 h.
- Recueillir et filtrer le milieu avec une seringue de 20 mL et un filtre de 0,45 μm. Transférer le milieu conditionné dans un tube en polypropylène de 15 mL.
- Ajouter 12 mL de DMEM complet frais contenant du FBS et de la pénicilline/streptomycine à la culture HEK 293T et à la culture pendant 24 h supplémentaires.
- Recueillir et filtrer le milieu avec une seringue de 20 mL et un filtre de 0,45 μm. Transférer le milieu conditionné dans un tube en polypropylène de 15 mL. Conserver le milieu contenant des particules lentivirales sous forme de aliquotes de 1 mL à -80 °C pour une utilisation ultérieure.
- Infecter les cellules MS-1 avec le virus pLV-Cas9.
- Graine 1 x 105 cellules MS-1 par puits dans une plaque de 6 puits pendant 24 h avant l’infection à lentivirus.
- Décongeler les aliquotes congelées du virus pLV-Cas9 dans un bain-marie à 37 °C.
- Mélanger 1 mL de milieu viré avec 1 mL de milieu DMEM frais contenant du FBS et de la pénicilline/streptomycine. Ajouter du polybrene au milieu (concentration finale de 10 μg/mL) pour augmenter l’efficacité de l’infection.
- Retirez le milieu de la plaque à 6 puits et remplacez-le par le milieu mixte virus/polybrene et faites la culture des cellules dans un incubateur pendant 24 h 24 après l’infection, remplacez le milieu par un milieu frais et faites la culture des cellules pendant encore 24 h.
Remarque : toujours garder un puits non infecté comme un groupe témoin. - Aspirer le milieu du groupe infecté et du groupe témoin et le remplacer par un milieu DMEM contenant 4 μg/mL de blasticidine.
- Remettre la plaque dans un incubateur à 37 °C et faire la culture des cellules pendant 1 semaine. Les cellules non infectées mourront en raison de l’effet de la blasticidine. Divisez les cellules survivantes lorsqu’elles atteignent 80% de confluence cellulaire et poursuivez la sélection de la blasticidine.
- Confirmer l’expression de Cas9 dans les cellules MS-1 par éponger occidental à l’aide d’un anticorps contre Cas9 (le poids moléculaire de Cas9 est d’environ 160 kDa).
- Infecter séparément les cellules pLV-Cas9 MS-1 avec deux lentivirus indépendants de gRNA.
- Graines 1 x 105 cellules pLV-Cas9 MS-1 par puits dans une plaque à 6 puits pendant 24 h avant l’infection.
- Suivez le même protocole que celui décrit à la section 4.2 pour infecter séparément les cellules avec deux lentivirus à ARNr.
- Après 24 h d’infection par le virus de l’ARNl, rafraîchir le milieu et faire la culture des cellules pendant encore 24 h.
- Remplacer le milieu par du DMEM avec 1 μg/mL de puromycine. Remettre la plaque dans un incubateur à 37 °C et faire la culture des cellules pendant 1 semaine. Assurez-vous que les cellules non infectées sont complètement mortes. Divisez les cellules lorsqu’elles atteignent 80% de confluence et poursuivez la sélection de la puromycine.
- Confirmer l’élimination de l’escargot dans les cellules MS-1 par éponger occidental à l’aide d’un anticorps contre l’escargot (le poids moléculaire de l’escargot est d’environ 35 kDa).
Résultats
TGF-β2 induit EndMT et stimule l’expression de l’escargot dans les cellules endothéliales MS-1
TGF-β est l’une des cytokines avec le plus grand potentiel d’induire EndMT. Après avoir traité les cellules MS-1 avec du TGF-β2 (1 ng/mL) pendant 3 jours, les cellules endothéliales MS-1 perdent leur structure en forme de pavé et se différencient en cellules de type mésenchymateux en forme de fuseau(figure 1A)15. Pour vérifier davantage le rôle du TGF-β2 dans l’induction de changements phénotypiques cellulaires, nous avons pré-traité les cellules avec la petite molécule activine receptor-like kinase (ALK)4/ALK5/ALK7 inhibitor SB431542 avant la stimulation TGF-β219. SB431542 changements de morphologie cellulaire induits par le TGF-β2 complètement abrogés (Figure 1A). Le processus EndMT induit par TGF-β2 a été étudié plus en détail en étudiant les changements dans l’expression des marqueurs liés à EndMT. Comme le montre la figure 1B,la protéine endothéliale Pecam-1 a été puissamment diminuée après stimulation du TGF-β2, tandis que le facteur mésenchymate Sm22α a été profondément régulé par le TGF-β215. Ces données sont compatibles avec la notion que TGF-β2 a déclenché EndMT dans les cellules MS-1. Ensuite, nous avons étudié les effets du TGF-β2 sur l’expression de l’escargot et de la limace. Comme le montre la figure 1C,l’escargot a été nettement régulé à la hausse par le TGF-β2, tandis que l’expression du slug n’a pas été influencée par le TGF-β2 dans les cellules MS-115. La quantification de l’expression de l’escargot à partir de trois expériences indépendantes est illustrée à la figure 1D.
Épuisement de l’escargot par CRISPR/Cas9 dans les cellules endothéliales MS-1
Comme l’escargot a été induit par le TGF-β2 et probablement impliqué dans l’EndMT médiée par le TGF-β2, nous avons effectué l’édition du gène CRISPR/Cas9 pour épuiser génétiquement l’expression de l’escargot dans les cellules MS-1. Nous avons émis l’hypothèse que l’épuisement de l’escargot serait suffisant pour inhiber l’EndMT induite par le TGF-β2. Comme le montre la figure 2A,nous avons généré des cellules knockout escargot en deux étapes. Tout d’abord, Cas9 a été exprimé ectopiquement en infectant les cellules MS-1 avec un lentivirus exprimant Cas9. Puisqu’il existe une cassette de résistance à la blasticidine dans la construction pLV-Cas9, nous avons vérifié l’expression de Cas9 par analyse western blot dans des cellules résistantes à la blasticidine (Figure 2D). Par la suite, nous avons introduit des sgARN qui ciblaient spécifiquement l’escargot pour perturber son expression protéique. Ce procédé a été également exécuté par l’infection avec les particules lentiviral portant la construction AA19 pLKO.1-Snail-sgRNA, qui inclut une cassette d’expression de puromycine. Cas9-expressing cellules ont été de nouveau infectées par le lentivirus contenant le gRNA et encore sélectionnées avec du puromycin. Deux oligos sgRNA complémentaires ciblant l’escargot murin ont été conçus avec une faible activité hors cible prédite(Figure 2B,C). Après l’introduction de deux sgARN d’escargot indépendants dans Cas9 exprimant des cellules MS-1, l’expression de la protéine d’escargot a été abrogée (Figure 2D)15.
Une carence en escargot inhibe l’EndMT induite par le TGF-β2 dans les cellules MS-1
Pour démontrer la fonction de l’escargot dans l’EndMT médiée par le TGF-β2, nous avons effectué un test EndMT dans des cellules appauvries par l’escargot et l’avons comparé aux cellules MS-1 parentales. Comme le montre la figure 3A,l’élimination de l’escargot a été suffisante pour inhiber la morphologie cellulaire de type fibroblaste entraînée par TGF-β2 dans les cellules MS-115. En outre, le déclin médié par le TGF-β2 dans Pecam-1 et l’amélioration de Sm22α ont été complètement bloqués dans les cellules MS-1 appauvries par l’escargot. En résumé, nous avons démontré que l’escargot est critique pour l’EndMT médiée par le TGF-β2 dans les cellules MS-1 (Figure 3B)15.
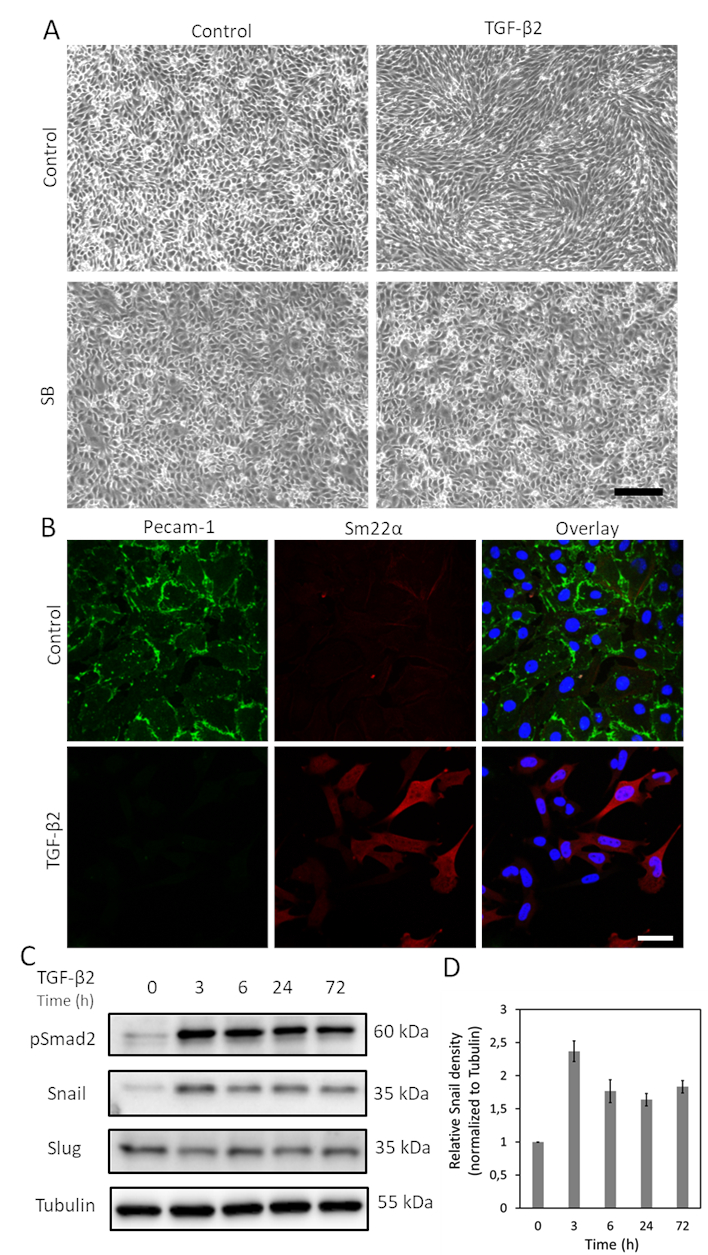
Figure 1. TGF-β2 induit l’endMT et l’expression de l’escargot dans les cellules MS-1. A. Effets du TGF-β2 et/ou du TGF-β l’inhibiteur de la kinase du récepteur I SB-431542 sur la morphologie cellulaire. Images brightfield de cellules MS-1 lors d’un traitement au TGF-β2 (1 ng/mL) et/ou au SB-431542 (SB, 5 μM, administré 30 min avant le TGF-β2) pendant 2 jours. La barre d’échelle représente 200 μm. B. Coloration par immunofluorescence de Pecam-1 (vert) et Sm22α (rouge) dans des cellules MS-1 cultivées en milieu contenant du TGF-β2 (1 ng/mL) pendant 3 jours. Les noyaux sont visualisés en bleu (DAPI). Barre d’échelle: 50 μm. C. Western blot avec lysat de cellules entières de cellules TGF-β2 stimulées ms-1. L’expression de l’escargot, mais pas de la limace, a été renforcée par la stimulation du TGF-β2, comme indiqué précédemment dans Ma et al15. D. Quantification de l’expression de l’escargot en intégrant les résultats de trois expériences indépendantes de western blot. Veuillez cliquer ici pour voir une version plus grande de cette figure.
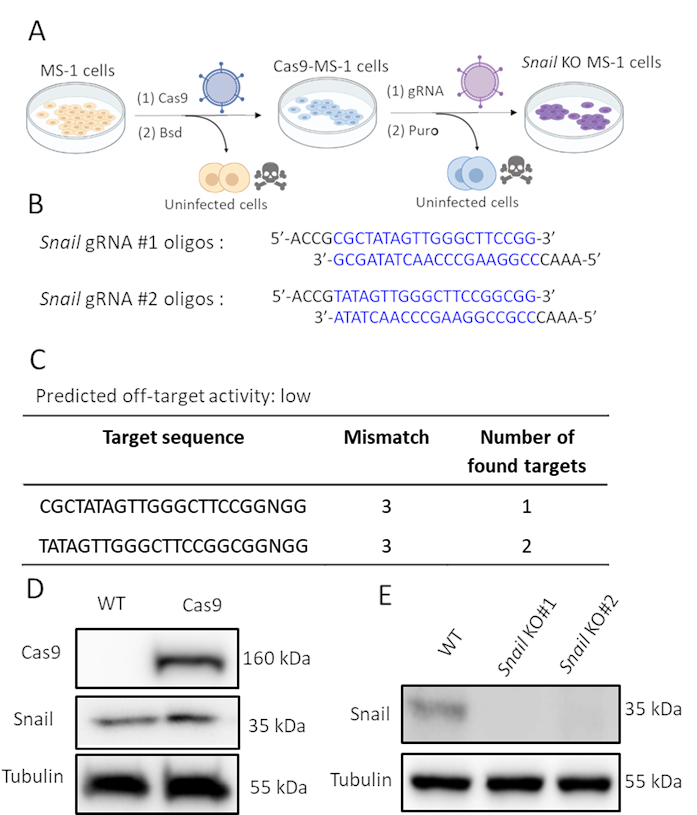
Figure 2. Épuisement de l’escargot par l’édition du gène CRISPR-Cas9. A. Schéma illustrant comment générer des cellules knockout Escargot. Bsd: Blasticidin. Puro: Puromycine. B. Oligonucléotides de deux sgARN indépendants ciblant l’escargot à l’aide de CHOPCHOP (http://chopchop.cbu.uib.no/) et cas-OFFinder (http://www.rgenome.net/cas-offinder/). C. L’activité hors cible prévue des deux ARNr pour Snail à l’aide de Cas-OFFinder (http://www.rgenome.net/cas-offinder/). D. Cas9 et l’expression de l’escargot dans le type sauvage (WT) et cas9-overexpressed MS-1 mesurée par analyse western blot. E. Knockout de l’escargot avec deux ARN g indépendants dans les cellules MS-1 tel que mesuré par analyse western blot. Nous avons rapporté des résultats similaires dans Ma et al15. Veuillez cliquer ici pour voir une version plus grande de cette figure.
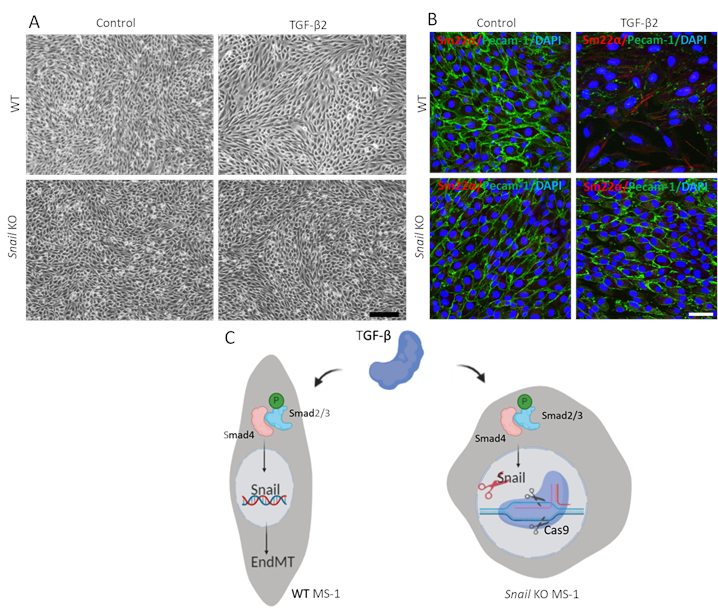
Figure 3. L’épuisement génétique de l’escargot inhibe l’EndMT induite par le TGF-β2 dans les cellules MS-1. A. Images brightfield de cellules MS-1 lors du traitement avec TGF-β2 (0,1 ng/mL) pendant 3 jours dans des cellules de type sauvage (WT, panneau supérieur) et d’escargot assommé (panneau inférieur). La barre d’échelle représente 200 μm. B. Coloration immunofluorescente pour Pecam-1 (vert), Sm22α (rouge) et noyaux (bleu) des cellules MS-1 cultivées en milieu contenant du TGF-β2 (1 ng/mL) pendant 3 jours. Épuisement de l’escargot abroge TGF-β2-induite diminution de Pecam-1 et augmentation de l’expression Sm22α. La barre d’échelle représente 50 μm. C. Représentation schématique de l’effet de l’élimination de l’escargot sur l’EndMT induite par TGF-β dans les cellules MS-1. TGF-β stimule l’expression de l’escargot par la voie smad en phosphoryléant Smad2/3 et en outre conduit EndMT. L’élimination de l’escargot à l’aide de l’édition de gènes à base de CRISPR/Cas9 a abrogé l’EndMT médiée par TGF-β. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
Comprendre le mécanisme d’EndMT est essentiel pour moduler ce processus et cibler les maladies liées à EndMT. Ici, nous avons décrit des méthodes pour exécuter un essai EndMT induit par TGF-β et interroger le rôle de l’escargot EndMT-TF dans l’endMT déclenché par TGF-β, en exécutant l’épuisement stable de gène CRISPR/Cas9-négocié de l’escargot des cellules. L’épuisement de l’escargot à l’aide de l’approche CRISPR/Cas9 a réussi à abroger L’EndMT entraîné par TGF-β2 dans les cellules MS-1(figure 3C). Pour étudier les effets de toutes les cytokines, comme TGF-β, sur EndMT, des ECs ont été exposés aux cytokines et puis l’occurrence d’EndMT a été évaluée selon les changements morphologiques et les changements endothéliaux et mesenchymal d’expression de marqueur des cellules. TGF-β2 fortement induit EndMT dans les cellules MS-1 accompagné d’une forte augmentation de l’expression du facteur de transcription Escargot. Les EndMT-TFs induits par TGF-β peuvent différer selon l’espèce ou le type de cellule endothéliale tissu-spécifique. Par exemple, nous avons observé que l’escargot mais pas la limace était significativement régulé à la hausse par le TGF-β dans les cellules MS-1, tandis que dans les cellules endothéliales de la veine ombilicale humaine (HUVECs), l’escargot et la limace sont augmentés après une exposition au TGF-β20.
Nous avons évalué l’étendue du processus EndMT de deux manières en examinant les changements de morphologie cellulaire, puis en étudiant les changements dans l’expression des marqueurs liés à EndMT. Après exposition de TGF-β pendant 3 jours, les cellules ont subi EndMT avec des variations morphologiques cohérentes et des changements dans l’expression des marqueurs EndMT-connexes. En plus de la coloration par immunofluorescence que nous avons effectuée ici, les variations de marqueurs peuvent également être surveillées par western blotting au niveau de l’expression protéique ou par qRT-PCR (Real-Time Quantitative Reverse Transcription PCR) aux niveaux des gènes21. En plus de ces deux méthodes d’économie de temps et de coûts que nous avons montrées dans ce protocole, il existe d’autres méthodes pour examiner EndMT. Par exemple, effectuer une analyse du transcriptome (par séquençage de l’ARN ou qPCR) pour comparer les niveaux d’expression des gènes endothéliaux et mésenchymates entre les cellules traitées et les cellules témoins peut évaluer avec précision EndMT22,23. En outre, EndMT implique souvent la perte stable de la fonction barrière, qui peut être évaluée par spectroscopie d’impédance24. En outre, des preuves supplémentaires de l’acquisition de propriétés de type cellules souches par les cellules dérivées d’EndMT peuvent être examinées. Par exemple, dans des conditions de culture spécifiques, les cellules de type mésenchymateux EndMT peuvent être différenciées en ostéoblastes, chondrocytes, adipocytes ou (myo)fibroblastes. Par conséquent, une analyse supplémentaire pour confirmer la différenciation en différents types de cellules appartenant à la lignée mésodermique (c.-à-d. expression génique et coloration de la matrice) est utile pour démontrer la nature multipotente des cellules dérivées de l’EndMT. Enfin, les méthodes d’évaluation EndMT ne se limitent pas aux études in vitro, mais peuvent être extrapolées pour étudier la relation entre EndMT et certaines maladies in vivo ou dans des organes ex vivo. En ce sens, l’utilisation de stratégies de traçage de lignées spécifiques à l’endothélial est largement étendue à la recherche liée à l’EndMT25.
Pour étudier le rôle de l’escargot pendant EndMT, dans cette étude, l’édition du gène CRISPR/Cas9 a été utilisée pour éliminer ce gène. Les données ont montré que le TGF-β2 n’a pas réussi à arbitrer EndMT dans les cellules MS-1 déficientes en escargot. Cette observation a démontré que l’escargot est essentiel pour l’EndMT induite par le TGF-β2 dans les cellules MS-1. Nous avons utilisé une cassette d’expression sgRNA indépendante pilotée par U6 pour introduire des sgARN spécifiques pour Cas9 afin de cibler Snail. En plus de cette méthode, Ran et al.26 ont décrit une autre stratégie pour cloner la séquence d’oligos sgRNA dans l’échafaudage Cas9 pour générer une construction contenant à la fois Cas9 et gARN. Les nouvelles approches émergentes permettent à CRISPR/Cas d’intégrer des fonctions supplémentaires. Par exemple, des knockouts doubles ou triples peuvent être obtenus en délivrant plus de sgRNAs dans les cellules exprimant Cas927. La protéine Cas13 modifiée cible et digère les molécules d’ARN sans perturber l’ADN endogène28. En plus d’assommer les gènes avec CRISPR/Cas, les ARN en épingle à cheveux courts (shARN) peuvent être utilisés comme alternatives pour faire tomber de manière stable l’expression des gènes ciblés29. Pour toutes les méthodes d’édition de gènes CRISPR/Cas, le clivage hors cible doit toujours être pris en considération. De plus, les petits ARN interférents (ARNi) réduisent transitoirement l’expression des gènes et la concentration d’ARNsi est diluée avec la division cellulaire30. Ces deux méthodes suppriment partiellement l’expression des gènes ciblés. En revanche, l’expression des gènes ectopiques est également utilisée pour vérifier la fonction des gènes au cours de l’EndMT/EMT31. Cette approche peut déterminer si la régulation à la hausse d’un gène est suffisante pour obtenir une réponse EndMT. Par conséquent, il existe actuellement une multitude de stratégies techniques qui peuvent être utilisées pour identifier et vérifier les régulateurs potentiels d’EndMT. En outre, l’analyse transcriptomique peut être une bonne option dans l’identification et l’analyse complète des régulateurs liés à EndMT. Nous vous recommandons d’utiliser différentes approches complémentaires pour étudier la modulation d’EndMT.
En résumé, nous avons introduit un flux de travail pour identifier les facteurs qui peuvent jouer des rôles fonctionnels pendant l’EndMT induite par TGF-β. Cette méthode peut également être utilisée pour étudier si d’autres stimuli (c’est-à-dire cytokines, facteurs de croissance, stimuli mécaniques, interactions cellule-cellule) peuvent moduler EndMT, et l’interaction de TGF-β avec d’autres stimuli. En outre, nous avons mis en évidence une approche utilisant l’édition du gène CRIPSR/Cas pour élucider si un certain gène est requis pour l’EndMT induite par TGF-β. Pour illustrer cette méthodologie, nous avons utilisé le puissant inducteur EndMT TGF-β2 dans les cellules MS-1, mais les protocoles peuvent être adaptés à d’autres cytokines et à d’autres types de cellules. Nous nous attendons à ce que ce protocole détaillé décrit serve de tremplin pour de futures études liées à l’EndMT.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
La recherche a été soutenue par CGC.NL et l’Initiative de recherche cardio-vasculaire des Pays-Bas: la Fondation néerlandaise du cœur, la Fédération néerlandaise des centres médicaux universitaires, l’Organisation néerlandaise pour la recherche et le développement en santé et la bourse de l’Académie royale des sciences des Pays-Bas accordée à Phaedra-Impact (http://www.phaedraresearch.nl). JM est soutenu par le Conseil chinois des bourses d’études. GSD est soutenu par une subvention trampoline de l’AFM-Téléthon [22379], FOP Italia et une subvention de La Fundació La Marató de TV3 (#202038).
matériels
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | Pall Corporation, USA | 4614 | |
| 10× T4 DNA ligase buffer | Thermofisher Scientific, USA | B69 | |
| 12 mm round glass slice | Knittel Glass,Germany | VD10012Y1A.01 | |
| 20 mL syringe | BD Eclipse, USA | 300629 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Vector Laboratories, USA | H-1200 | VECTASHIELD Antifade Mounting Media |
| AA19_PLKO vector | Dr. M Gonçalves, Leiden University Medical Center, Netherlands | Gift | |
| Ampicillin | Serva Electrophoresis, USA | 1339903 | |
| Anti-Mouse IgG | GE Healthcare, USA | NA931 | |
| Anti-Rabbit IgG | Cell signaling, USA | 7074 | |
| Agarose | Roche, Switzerland | 11388991001 | |
| Blasticidin | Invitrogen, USA | R21001 | |
| Buffer O (10X) | Thermofisher Scientific, USA | BO5 | |
| BveI (Bspm1) | Thermofisher Scientific, USA | ER 1741 | |
| Confocal microscope | Leica Microsystems, Germany | SP8 | |
| DMEM | Thermo Fisher Scientific, USA | 11965092 | |
| Donkey anti-rat Alexa 488 | Invitrogen, USA | A21208 | |
| FBS | Thermo Fisher Scientific, USA | 16000044 | |
| Formaldehyde | Thermo Fisher Scientific, USA | 28908 | |
| Inverted microscope | Leica Microsystems, Germany | DMi8 | |
| Goat anti-rabbit Alexa 594 | Invitrogen,USA | A11012 | |
| LabNed Plasmid kit | LabNed, USA | LN2400004 | |
| MS-1 cell line | American Type Culture Collection (ATCC) | ||
| Nail polish | HEMA, Netherlands | Transparent | |
| Pecam-1 antibody | Becton Dickinson,USA | 553370 | |
| PEI | Polysciences, USA | 23966-1 | |
| PLV-Cas9 plasmid | Sigma-Aldrich, USA | Cas9BST-1EA | |
| Puromycin | Sigma-Aldrich, USA | P9620 | |
| QIAquick gel extraction kit | Qiagen, Germany | 28706 | |
| Sm22a antibody | Abcam, UK | ab14106 | |
| Snail | Cell signaling, USA | 3879 | |
| T4 DNA ligase | Thermofisher Scientific, USA | EL 0014 | |
| TC20 automated Cell Counter | Bio-Rad, USA | 1450102 | |
| Human TGF-β2 | Joachim Nickel, University of Wurzburg | Gift | Other commercial recommendation: 302-B2, R&D systems |
| Triton X-100 | Merck, USA | 1086031000 | |
| SB431542 | Tocris Bioscience, UK | 1614 | |
| Tris | Roche, Switzerland | 11814273001 |
Références
- Ma, J., Sanchez-Duffhues, G., Goumans, M. -J., Ten Dijke, P. TGF-β-induced endothelial to mesenchymal transition in disease and tissue engineering. Frontiers in Cell and Developmental Biology. 8, (2020).
- Piera-Velazquez, S., Jimenez, S. A. Endothelial to mesenchymal transition: role in physiology and in the pathogenesis of human diseases. Physiological Reviews. 99 (2), 1281-1324 (2019).
- Sánchez-Duffhues, G., de Vinuesa, G. A., ten Dijke, P. Endothelial-to-mesenchymal transition in cardiovascular diseases: developmental signaling pathways gone awry. Developmental Dynamics. 247 (3), 492-508 (2018).
- Evrard, S. M., et al. Endothelial to mesenchymal transition is common in atherosclerotic lesions and is associated with plaque instability. Nature Communications. 7 (1), 1-16 (2016).
- Qiao, L., et al. Endothelial fate mapping in mice with pulmonary hypertension. Circulation. 129 (6), 692-703 (2014).
- Zeisberg, E. M., et al. Endothelial-to-mesenchymal transition contributes to cardiac fibrosis. Nature Medicine. 13 (8), 952-961 (2007).
- Clere, N., Renault, S., Corre, I. Endothelial-to-mesenchymal transition in cancer. Frontiers in Cell and Developmental Biology. 8, (2020).
- Saito, A. EMT and EndMT: regulated in similar ways. The Journal of Biochemistry. 153 (6), 493-495 (2013).
- Bolós, V., et al. The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions: a comparison with Snail and E47 repressors. Journal of Cell Science. 116 (3), 499-511 (2003).
- Aird, W. C. Endothelial cell heterogeneity. Cold Spring Harbor Perspectives in Medicine. 2 (1), 006429(2012).
- Yang, J., et al. Guidelines and definitions for research on epithelial-mesenchymal transition. Nature Reviews Molecular Cell Biology. , 1-12 (2020).
- Doudna, J. A., Charpentier, E. The new frontier of genome engineering with CRISPR-Cas9. Science. 346 (6213), (2014).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Arbiser, J. L., et al. Oncogenic H-ras stimulates tumor angiogenesis by two distinct pathways. Proceedings of the National Academy of Sciences USA. 94 (3), 861-866 (1997).
- MA, J., et al. TGF-?-induced endothelial to mesenchymal transition results from a balance between SNAIL and ID factors. Frontiers in Cell and Developmental Biology. 182 (9), (2021).
- Chen, X., et al. Probing the impact of chromatin conformation on genome editing tools. Nucleic Acids Research. 44 (13), 6482-6492 (2016).
- Hunter, F. W., et al. Functional CRISPR and shRNA screens identify involvement of mitochondrial electron transport in the activation of evofosfamide. Molecular Pharmacology. 95 (6), 638-651 (2019).
- Mao, Y., et al. Lentiviral vectors mediate long-term and high efficiency transgene expression in HEK 293T cells. International Journal of Medical Sciences. 12 (5), 407(2015).
- Liu, S., et al. Deubiquitinase activity profiling identifies UCHL1 as a candidate oncoprotein that promotes TGFβ-induced breast cancer metastasis. Clinical Cancer Research. 26 (6), 1460-1473 (2020).
- Medici, D., et al. Conversion of vascular endothelial cells into multipotent stem-like cells. Nature Medicine. 16 (12), 1400(2010).
- Kokudo, T., et al. Snail is required for TGFβ-induced endothelial-mesenchymal transition of embryonic stem cell-derived endothelial cells. Journal of Cell Science. 121 (20), 3317-3324 (2008).
- Dong, J., et al. Single-cell RNA-seq analysis unveils a prevalent epithelial/mesenchymal hybrid state during mouse organogenesis. Genome Biology. 19 (1), 1-20 (2018).
- Oatley, M., et al. Single-cell transcriptomics identifies CD44 as a marker and regulator of endothelial to haematopoietic transition. Nature communications. 11 (1), 1-18 (2020).
- Halaidych, V., et al. Inflammatory responses and barrier function of endothelial cells derived from human induced pluripotent stem cells. Stem Cell Reports. 10 (5), 1642-1656 (2018).
- Li, Y., Lui, K. O., Zhou, B. Reassessing endothelial-to-mesenchymal transition in cardiovascular diseases. Nature Reviews Cardiology. 15 (8), 445-456 (2018).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Grav, L. M., et al. One-step generation of triple knockout CHO cell lines using CRISPR/Cas9 and fluorescent enrichment. Biotechnology Journal. 10 (9), 1446-1456 (2015).
- Abudayyeh, O. O., et al. RNA targeting with CRISPR-Cas13. Nature. 550 (7675), 280-284 (2017).
- Paddison, P. J., et al. Cloning of short hairpin RNAs for gene knockdown in mammalian cells. Nature Methods. 1 (2), 163-167 (2004).
- Reynolds, A., et al. Rational siRNA design for RNA interference. Nature Biotechnology. 22 (3), 326-330 (2004).
- Lourenço, A. R., et al. C/EBPɑ is crucial determinant of epithelial maintenance by preventing epithelial-to-mesenchymal transition. Nature Communications. 11 (1), 1-18 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon