Method Article
TGF-β aracılı Endotelden Mezenkimal Geçişe (EndMT) ve CRISPR/Cas9 Gen Düzenleme Kullanarak EndMT Efektörlerinin Fonksiyonel Değerlendirmesi
Bu Makalede
Özet
Endotel hücrelerinde TGF-β2 kaynaklı EndMT'yi araştırmak için hücre morfolojisi değişikliklerini gözlemleyerek ve immünofluoresans boyama kullanarak EndMT ile ilgili belirteç değişiklikleri ifadesini inceleyerek yöntemleri açıklıyoruz. CRISPR/Cas9 gen düzenlemesi, TGF-β2 kaynaklı EndMT'deki rolünü araştırmak için gen kodlama Salyangozunu tükenmek için tanımlanmış ve kullanılmıştır.
Özet
Belirli dış ipuçlarına ve belirli transkripsiyon faktörlerinin aktivasyonuna yanıt olarak, endotel hücreleri mezenkimal geçişe (EndMT) endotel olarak verilen bir işlem olan mezenkimal benzeri bir fenotipe dönüşebilir. Ortaya çıkan sonuçlar, EndMT'nin fibrozis ve kanser gibi birden fazla insan hastalığıyla nedensel olarak bağlantılı olduğunu ileri sürmektedir. Ek olarak, endotel türevi mezenkimal hücreler doku rejenerasyon prosedürlerinde uygulanabilir, çünkü çeşitli hücre tiplerine (örneğin, osteoblastlar ve kondrositler) daha da ayırt edilebilirler. Bu nedenle, EndMT'nin seçici manipülasyonu klinik potansiyele sahip olabilir. Epitel-mezenkimal geçiş (EMT) gibi, EndMT, Salyangoz ve Sümüklüböcek de dahil olmak üzere EndMT transkripsiyon faktörlerinin (EndMT-TF) ekspresyonunu uyaran salgılanan sitokin dönüşüm büyüme faktörü-beta (TGF-β) tarafından güçlü bir şekilde indüklenebilir. Bu EndMT-TF'ler daha sonra sırasıyla mezenkimal ve endotel proteinlerinin seviyelerini yukarı ve aşağı doğru düzenler. Burada, TGF-β kaynaklı EndMT in vitro'yu araştırma yöntemlerini, belirli TF'lerin TGF-β kaynaklı EndMT'deki rolünü incelemek için bir protokol de dahil olmak üzere açıklıyoruz. Bu teknikleri kullanarak, TGF-β2'nin murine pankreas mikrovasküler endotel hücrelerinde (MS-1 hücreleri) EndMT'yi uyardığı ve düzenli olarak kümelenmiş kısa palindromik tekrarlar (CRISPR)/CRISPR ile ilişkili protein 9 (Cas9) aracılı gen düzenleme kullanılarak Salyangozun genetik tükenmesinin bu fenomeni yok ettiğine dair kanıtlar sunuyoruz. Bu yaklaşım, endotel biyolojisinin potansiyel modülatörlerini sorgulamak için bir model görevi görebilir ve insan hastalığında potansiyel uygulama ile EndMT'nin yeni düzenleyicilerini tanımlamak için genetik veya farmakolojik ekranlar gerçekleştirmek için kullanılabilir.
Giriş
Endotelden mezenkimal geçişe (EndMT), çeşitli fizyolojik ve patolojik süreçlere bağlanmış çok yönlü ve dinamik bir biyolojik olgudur1,2. EndMT endotel hücreleri yavaş yavaş endotel özelliklerini kaybederken, mezenkimal özelliklerelde ederken 3; böylece, sıkıca sıkıştırılmış ve iyi organize edilmiş endotel hücreleri uzun mezenkimal benzeri hücrelere ayırır. EndMT'deki morfolojik değişiklikler, bazı genlerin ve proteinlerin ekspresyonunda değişikliklerle çakışmaktadır. Genel olarak, vasküler endotel (VE)-cadherin, trombosit/EC yapışma molekülü-1 (CD31/Pecam-1) dahil olmak üzere endotel özelliklerini koruyan proteinlerin ekspresyonu azalır. Aynı zamanda, α-düz kas aktisin (α-Sma) ve düz kas proteini 22α (Sm22α) gibi mezenkimal fonksiyonlarla ilgili proteinler birikir. Ortaya çıkan sonuçlar, postnatal EndMT'nin kanser, kardiyak fibrozis, pulmoner arteriyel hipertansiyon (PAH), ateroskleroz (AS), organ fibrozisvb. EndMT'nin temel mekanizmalarının ve EndMT sürecinin nasıl yönlendirılacağının daha derin bir şekilde anlaşılması, EndMT ile ilgili hastalıklar ve rejeneratif tıp için yeni terapötik yöntemler sağlayacaktır.
TGF-β ana EndMT indükleyicilerinden biridir ve bilinen diğer ilgili faktörler arasında Wnt / β-catenin, Çentik ve bazı enflamatuar sitokinler1bulunur. Hücresel bağlam, TGF-β tarafından tetiklenen yanıtlar için anahtar olduğundan, TGF-β diğer EndMT tanıtım sinyalleriyle etkileşimi, TGF-β'ın endmt yanıtı ortaya çıkarmak için uygun olmasıdır. TGF-β hücre yüzey tipi I ve tip II serine/threonine kinaz reseptörlerinin aktivasyonu üzerine hücre içi kanonik Smad yolu aktive edilir. TGF-β reseptör aracılı fosforilasyonlu Smad2/3, Smad4 ile çekirdeğe yerleştiği heteromerik kompleksler oluşturur ve burada EndMT ile ilgili transkripsiyon faktörlerinin ekspresyonunu yükseltirler. Epitel-mezenkimal geçişe (EMT) benzer şekilde, Salyangoz, Sümüklüböcek, Twist, Zeb1 ve Zeb2 gibi transkripsiyon faktörleri TGF-β sinyali ile indüklenir ve EndMT8'degen yeniden programlanmasına katkıda bulunur.
Salyangoz, EndMT'de sıklıkla önemli bir faktör olarak tanımlanmıştır. Salyangoz, hücre-hücre yapışıklık proteinlerini kodlayan genlerin promotörüne bağlanır ve mezenkimal proteinlerin ekspresyonunun arttırılmasıyla dengelenen transkripsiyonlarını bastırır9. Endotel hücreleri çok heterojen bir popülasyondan oluşur ve çeşitli hücre dışı uyaranların EndMT üzerindeki göreceli etkisi endotel hücresel bağlamları veya hücre tipleri arasında farklılık gösterebilir10. EMT ile benzerlikleri nedeniyle, bazı metodolojiler emt ve EndMT8her iki mekanizmayı araştırmak için yararlıdır. Bu bağlamda, EMT International Association (TEMTIA), EMT/ EndMT11'inoluşumunu nihayetinde göstermek için tamamlayıcı tekniklere duyulan ihtiyacı güçlü bir şekilde vurgulamaktadır.
Burada, TGF-β kaynaklı EndMT sürecini izlemek ve görselleştirmek için bir yöntem açıklıyoruz. İmmünofluoresans lekeleme, EndMT işleminin gerçekleşip gerçekleşmediğinin göstergesi olarak kullanılan hedeflenen protein/belirteçlerdeki ifade değişiklikleri hakkında temel bilgileri sağlar. Ek olarak, immünofluoresans lekelenmesi proteinlerin / belirteçlerin lokalizasyonunu ve hücre morfolojisini görselleştirebilir. TGF-β aracılı EndMT'de yer alan belirli TF'lerin (veya diğer yukarı veya aşağı akış düzenleyicilerinin) potansiyel aktivitesini incelemek için, örnek olarak TF Salyangozunu kullanarak hücrelerden belirli genleri tükenmek için kümelenmiş düzenli aralıklı kısa palindromik tekrarlar (CRISPR) /CRISPR ile ilişkili protein 9 (Cas9) gen düzenlemesini kullanan bir protokol açıklıyoruz. Cas9, bakterilerde CRISPR dizilerini tamamlayıcı olarak tanıyan ve parçalayan çift RNA güdümlü DNA endonuclease12. CRISPR/Cas9 sistemi şu anda yaygın olarak kullanılmaktadır, çünkü genetik mühendisliğini in vitro ve in vivo13kolaylaştırır. Tek bir kılavuz RNA (sgRNA) tarafından yönetilen ektopik olarak ifade edilen Cas9, belirli bir gen lokusunda önceden belirlenmiş bir hedefleme dizisinde çift iplikçik kırılması oluşturur. Homolog olmayan uç birleştirme (NHEJ), rastgele nükleotid eklemeleri veya silmeleri yoluyla Cas9 kaynaklı iplikçik kırılmalarını onarmak ve böylece hedeflenen genin bozulmasına ve inaktivasyonuna yol açmak için gerçekleşir. Seçici sgRNA'lar tasarlamak ve tasarlanmış sgRNA'ları içeren lentiviral uyumlu vektörler üretmek için ayrıntılı yöntemler açıklıyoruz. Sonuç olarak, gen tükenmiş stabil endotel hücreleri verimli ve güvenilir bir şekilde üretilebilir.
Bu çalışmada TGF-β2 kaynaklı EndMT sürecini incelemek için model sistem olarak murine pankreas mikrovasküler endotel hücreleri (MS-1)14'ü kullandık. Önceki çalışmamız Salyangozun, MS-1 hücrelerinde EndMT'nin indüklediği TGF-β2 tarafından artırılan ana transkripsiyon faktörü olduğunugöstermiştir 15. CRISPR/Cas9 gen düzenlemesi ile MS-1 hücrelerindeki Salyangoz ekspresyonunu yok eden TGF-β2, EndMT'ye aracılık edemedi. Bu iş akışı, EndMT ile ilgili diğer (şüpheli) genleri incelemek için uygulanabilir.
Protokol
1. EndMT'nin TGF-β2 tarafından indüksiyonu
- Dulbecco'nun modifiye Kartal ortamındaki (DMEM) MS-1 hücreleri% 10 fetal sığır serumu (FBS) ve 100 U/mL penisilin / streptomisin içeren bir inkübatörde (% 5 CO2, 37 °C). Tüm kültür yemeklerini / tabaklarını kullanmadan önce 10 dakika boyunca% 0.1 w / v jelatin ile kaplayın.
- MS-1 hücrelerini 1x fosfat tamponlu salin (PBS) ile hafifçe yıkayın, 10 cm'lik bir yemeğe 2 mL tripsin-EDTA çözeltisi (%0,25 tripsin ve%0,02 EDTA) ekleyin ve ayırmak için 37 °C'de 2 dakika kuluçkaya yatırın. Daha sonra, reaksiyonun söndürülmek için 5 mL tam kültür ortamı ekleyin.
- Hücre süspansiyonu oda sıcaklığında 3 dakika boyunca 200 x g'da 15 mL tüp ve santrifüje aktarın.
- Süpernatantı atın ve hücreleri FBS ve penisilin/streptomisin içeren 4 mL taze ortamda yeniden biriktirin. Otomatik hücre sayacı kullanarak hücreleri sayın.
- Daha fazla kültür için cm 2 başınatohum 1 x 103 hücre. Örneğin, tohum 9.5 x 103 hücre / kuyu 6 kuyu plakaları için, veya 1.9 x10 3 hücre / kuyu 24 kuyu plakaları için.
- Hücreleri bir gecede kuluçkaya yatırarak yapışmalarını ve iyileşmelerini sağlamak için, daha sonra MS-1 hücrelerini 3 gün boyunca TGF-β2 ile uyarın. TGF-β2 stimülasyonundan 30 dakika önce TGF-β reseptör kinaz inhibitörü SB431542'yi (5 μM) ekleyin. Diğer hücreleri araçla (DMSO) tedavi edin.
NOT: TGF-β2'yi %0,1 insan sığır serumu albümin (BSA) içeren 4 mM HCl'de çözün. Kontrol grubuna TGF-β2 olmadan aynı miktarda ligand tamponu ekleyin. TGF-β2 konsantrasyonu spesifik tahliller için 0.1-1 ng/mL olacak şekilde uyarlanabilir. İlgili rakamlardaki endikasyonlara bakın. - 3 gün sonra, hücre morfolojisini parlak alan görüntülemesi (ters mikroskopla) ile inceleyin ve EndMT ile ilgili işaret değişikliklerini değerlendirmek için immünofluoresans boyama (bkz. adım 2) gerçekleştirin. Biyolojik triplikat elde etmek için en az üç bağımsız deney gerçekleştirin.
2. İmmünofluoresans boyama
- Trypsinize MS-1 hücrelerini kültürledi (adım 1.2) ve ardından 24 kuyulu bir plakanın altına yerleştirilen % 0.1 w/v jelatin kaplı 12 mm yuvarlak kapak camına 1.9 x 103 hücreyi yeniden yapıştırdı.
- Hücreleri bir gecede kült ettikten sonra, 3 gün boyunca hücrelere TGF-β2 (son konsantrasyon 1 ng / mL) ekleyin. Negatif kontrol olarak ligand tampon içeren ortamı kullanın.
- Pecam-1 ve Sm22α boyama gerçekleştirin.
- Hücreleri 3 gün boyunca TGF-β2 (veya Kontrol) ile uyardıktan sonra, ortamı çıkarın ve hücreleri 1x PBS ile yıkayın.
- Her kuyuya 300 μL% 4 formaldehit ekleyin ve hücreleri sabitlemek için oda sıcaklığında 10 dakika kuluçkaya yatırın. Kuluçkadan sonra 1x PBS ile 3x yıkayın.
- Her kuyuya 1x PBS'de %0,1 Triton X-100'ün 300 μL'sini ekleyin ve hücrelere nüfuz etmek için oda sıcaklığında 10 dakika kuluçkaya yatırın. Kuluçkadan sonra Triton X-100 çözeltisini çıkarın ve hücreleri 1x PBS ile 3x yıkayın.
- 1x PBS'de %3 sığır serum albümini (BSA) içeren hücreleri oda sıcaklığında 45 dakika boyunca engelleyin.
- 1:500 murine proteinlerini tanıyan birincil Pecam-1 ve Sm22α antikorlarını 1x PBS ile seyreltin. Daha sonra sabit hücreleri oda sıcaklığında 45 dakika boyunca birincil antikorlarla kuluçkaya yatırın.
- 1x PBS ile 3x yıkadıktan sonra, hücreleri eşek anti-sıçan Alexa 488 ve keçi anti-tavşan Alexa 594 dahil olmak üzere 1000x seyreltilmiş ikincil antikorlarla oda sıcaklığında 45 dakika kuluçkaya yatırın.
NOT: Lekeleme sırasında numuneleri ışıktan koruyun. - 1x PBS ile 3x duruladıktan sonra, çekirdekleri lekelamak için bir slaytta 4',6-diamidino-2-fenilindole (DAPI) içeren bir montaj ortamı damlasına yüzüstü hücrelerin tohumlu kapak camını yerleştirin.
- Kapak camının çevresini şeffaf oje ile sabitlayın ve 4 °C'de saklayın.
- Konfokal mikroskopla temsili görüntüler elde edin. DAPI, Pecam-1 ve Sm22α'yı algılamak için lazer dalga boylarını sırasıyla 405 nm, 488 nm ve 552 nm olarak ayarlayın. Her kanal için, tüm resimler aynı ayarlar ve pozlama süresi ile çekildi. Biyolojik triplikat elde etmek için en az üç bağımsız deney gerçekleştirin.
3. CRISPR/Cas9 düzenleme kullanarak Salyangozu nakavt edin
- Murine Salyangoz hedefleyen iki bağımsız sgRNA tasarlayın.
- Hedeflenen gen adına ve türlerine göre CHOPCHOP (https://chopchop.cbu.uib.no/) ve Cas-OFFinder (http://www.rgenome.net/cas-offinder/) çevrimiçi araçlarını kullanarak sgRNA'lar tasarlayın.
- Cas-OFFinder (http://www.rgenome.net/cas-offinder/) ve CHOPCHOP (http://chopchop.cbu.uib.no/) dahil olmak üzere iki bağımsız algoritma ile Salyangoz'u hedefleyen tasarlanmış sgRNA'ların hedef dışı etkinliğini tahmin edin.
- En düşük etkinlik dışı aktiviteye sahip iki sgRNA seçin. BveI kesim bölgesi ile iki tamamlayıcı sgRNA oligo tasarlayın. Oligo duyusu 5'-ACCG-3' ile başlar ve antisense oligo 5'-AAAC-3' ile başlar.
- Daha fazla kullanım için oligoların ticari olarak sentezlenmesi için sipariş edin.
- Tamamlayıcı kılavuz RNA oligos'u BveI sindirilmiş AA19 pLKO.1-puro.U6.sgRNA'ya klonla. Bve I-dolması Lentiviral vektör plazmid üretmek içinAA19 pLKO.1-Salyangoz-sgRNA16.
- AA19 pLKO.1-puro.U6.sgRNA'yı kesin. Bve BveI enzimi16ile I-dolması plazmid. 2 μg AA19 pLKO.1-puro.U6.sgRNA karıştırın. Bve I-dolma plazmid, 5 μL 10x Buffer O ve 5 μL BveI enzimi ve toplam 50 μL hacme ulaşmak için steril su ekleyin.
- Girdap ve kısaca reaksiyon karışımını aşağı döndürün. Reaksiyonun 37 °C'de 1 saat kuluçkaya yatması.
- Reaksiyon karışımını % 1 agarose jel üzerine yükleyin ve 1x Tris-asetat-EDTA'da (TAE, 50x TAE stoğu: Suda çözünmüş 242 g Tris tabanı, 57,1 mL buzul asetik asit, 100 mL 500 mM EDTA (pH 8,0) çözeltisi ve iyi bir ayırma elde edilene kadar toplam 1 L) tampona su ekleyin.
- Omurga parçasını jelden kesin, üreticinin protokolüne göre jel çıkarma kiti ile izole edin (Malzeme Tablosunabakın) ve omurgayı 40 μL elüasyon tamponunda (EB) elüte edin.
- 5 μL 100 pmol/μL duyu oligo ve 5 μL 100 pmol/μL antisense oligoyu 1 μL 1 M Tris-HCl (pH 8.0) ile karıştırın ve gRNA oligolarını tavlamak için toplam 100 μL'ye ulaşmak için steril su ekleyin. Karışımı 100 ° C'de 5 dakika kuluçkaya yatırın ve ardından tüpleri alüminyum folyo ile örtün. Bundan sonra, kesici uç olarak daha fazla kullanım için çözeltiyi oda sıcaklığına yavaşça soğutun.
- Tamamlayıcı gRNA oligos ve BveI sindirilmiş omurgayı lige almak için, 1 μL izole BveI'yi 2 μL 10x T4 DNA ligaz tamponu ve 1 μL T4 DNA ligase tamponu ve 1 μL T4 DNA ligase ile AA19 pLKO.1-puro.U6.sgRNA.BveI-dolma omurgası ve 2 μL kesici uç (seyreltilmiş 1:300) ile karıştırın, ve toplam 20 μL'ye ulaşmak için steril su ekleyin. Tüpü kısaca döndürün ve daha fazla kullanım için oda sıcaklığında 4 saat kuluçkaya yatırın.
NOT: Ligasyonu gerçekleştirirken iki kontrol grubunun dahil edildiğinden emin olun. Bir kontrol grubu için, 1 μL izole omurga, 2 μL 10x T4 DNA ligaz tamponu ve 1 μL T4 DNA ligazını karıştırın ve toplam 20 μL'ye ulaşmak için steril su ekleyin, ancak oligo DNA'sı olmadan. Diğer kontrol grubu için, 1 μL izole omurga ve 2 μL 10x T4 DNA ligaz tamponunu karıştırın ve toplam 20 μL'ye ulaşmak için steril su ekleyin, ancak tavlanmış oligolar ve T4 ligaz olmadan. Bu iki kontrol ligasyonu, bir sonraki dönüştürme adımında reaksiyon arka planını belirlemek ve ligasyonun ne kadar verimli olduğunu belirtmek için kullanılır.
- Reaksiyon karışımını yetkin TOP10 E. coli'yedönüştürün.
- Yetkili TOP10 E. coli'itoplayın. -80 °C dondurucudan hücreler ve buz üzerinde çözün.
- 50 μL yetkin hücrelere 2 μL ligasyon karışımı ekleyin ve tüpü 30 dakika boyunca buzda tutun.
- Tüpü 30 sn boyunca 42 °C'de ısı şoku. Tüpü 2 dakika boyunca buza koyun.
- Karışıma 950 μL taze lysojeny et suyu (LB) ortamı ekleyin ve 60 dakika boyunca 37 °C'de kuvvetlice çalkalayın.
- Hücreleri ılık bir ampisilin (100 μg/mL) direnç LB plakası üzerinde döndürün ve plakalayın. Plakayı gece boyunca 37 °C'de kuluçkaya yatırın.
- gRNA oligolarının plazmid içine başarılı bir şekilde yerleştirildiğinden doğrulayın.
- LB ortamı içeren 1 mL ampisilin (100 μg/mL) içinde plaka üzerinde 3-5 koloni seçin ve 30 °C'de gece boyunca çalkalayın.
- Plazmid DNA'sını üreticinin protokolüne (Malzeme Masası)göre bir plazmid kiti ile izole edin ve gRNA oligosunun başarılı bir şekilde yerleştirilmesini doğrulamak için U6 promotör astarı 5'- GAGGGCCTATTTCCCATGATT -3' ile sıralayın.
4. Salyangoz nakavt MS-1 hücreleri oluşturun
- Cas9 veya Salyangoz hedefleme gRNA'ları taşıyan lentiviral parçacıklar üretin.
- DMEM'de bir inkübatörde (%5 CO 2 , 37 °C) 14,5 cm'lik yemeklerde (veya T75 mataralarında) %10 fetal sığır serumu ve 100 U/mL penisilin/streptomisinin bulunduğu Kültür HEK293Thücreleri.
- 9.9 μg hedefleme gen plazmidini, AA19 pLKO.1-Salyangoz-sgRNA veya pLV-Cas917 plazmid'i, yardımcı plazmidler 3.5 μg pCMV-VSVG ile karıştırın (veziküler stomatit virüsünün G proteinini kodlama, VSV-G), 6,6 μg devir duyarlı eleman plazmid pMDLg-RRE (Gag ve Pol kodlaması) ve 500 μL serumsuz ortamda 5,0 μg pRSV-REV (kodlama Rev). Serumsuz ortamda 50 μL polietilenini (PEI) (2,5 mg/mL) yeniden dirsindirin. Plazmidleri ve PEI preparatlarını yukarı ve aşağı pipetleme yaparak hafifçe karıştırın. Karışımı oda sıcaklığında 20 dakika kuluçkaya yatırın.
- HEK 293T hücrelerini, %10 FBS ve 100 U/mL penisilin/streptomisinin bulunduğu DMEM ortamı içeren 14,5 cm'lik yemeklere (veya T75 şişelerine) 4,1,2 ila %80 birikme hücrelerindeki karışım ortamını ekleyerek transfect. HEK293T hücreleri kolayca transfected oldukları ve yüksek düzeyde virüs ürettikleri için kullanılır18.
- Transk 293T hücrelerini mikrobiyolojik ve biyomedikal laboratuvarda (BMBL) bir biyogüveniye aktarın ve 24 saat boyunca kültüre edin.
- Bir BMBL laboratuvarında, HEK 293T hücrelerindeki transfeksiyon ortamını FBS ve penisilin/streptomisidin içeren 12 mL taze komple DMEM ile değiştirin. Hücreleri 24 saat kuluçkaya yatır.
- Ortamı 20 mL şırınna ve 0,45 μm filtre ile toplayın ve filtreleyin. Şartlandırılmış ortamı 15 mL polipropilen tüpe aktarın.
- EK 24 saat boyunca HEK 293T kültür yemeğine ve kültürüne FBS ve penisilin/streptomisin içeren 12 mL taze komple DMEM ekleyin.
- Ortamı 20 mL şırınna ve 0,45 μm filtre ile toplayın ve filtreleyin. Şartlandırılmış ortamı 15 mL polipropilen tüpe aktarın. Lentiviral parçacıklar içeren ortamı daha fazla kullanım için -80 °C'de 1 mL aliquots olarak saklayın.
- MS-1 hücrelerine pLV-Cas9 virüsünü bulaştırın.
- Tohum 1 x 105 MS-1 hücreleri lentivirüs enfeksiyonu öncesi 24 saat boyunca 6 kuyulu bir tabakta.
- PLV-Cas9 virüsünün donmuş aliquotlarını 37 °C su banyosunda çözün.
- 1 mL virüs ortamını FBS ve penisilin/streptomisidin içeren 1 mL taze DMEM ortamı ile karıştırın. Enfeksiyon verimliliğini artırmak için ortama polibren ekleyin (10 μg/ mL olarak son konsantrasyon).
- Ortamı 6 kuyulu plakadan çıkarın ve virüs / polibren karışımı ortamı ile değiştirin ve bir inkübatördeki hücreleri enfeksiyon sonrası 24 saat kültüre edin, ortamı taze ortamla değiştirin ve hücreleri 24 saat daha kültüre edin.
NOT: Her zaman enfekte olmayan bir kuyu ve bir kontrol grubu bulundurun. - Ortamı enfekte grup ve kontrol grubundan epire edin ve 4 μg/mL blasticidin ile DMEM ortamı ile değiştirin.
- Plakayı 37 °C inkübatöre döndürün ve hücreleri 1 hafta boyunca kültüre edin. Enfekte olmayan hücreler blasticidin etkisiyle ölecektir. %80 hücre konfluensi sağ kalan hücreleri bölün ve blasticidin seçimine devam edin.
- CAS9'a karşı bir antikor kullanarak batı şişkinliği ile MS-1 hücrelerinde Cas9 ekspresyonunu onaylayın (Cas9'un moleküler ağırlığı yaklaşık 160 kDa'dır).
- pLV-Cas9 MS-1 hücrelerini iki bağımsız gRNA lentivirüs ile ayrı ayrı enfekte edin.
- Tohum 1 x 105 pLV-Cas9 MS-1 hücreleri enfeksiyondan önce 24 saat boyunca 6 kuyulu bir tabakta kuyu başına.
- Hücreleri iki gRNA lentivirüs ile ayrı ayrı enfekte etmek için 4.2'de açıklanan protokolü izleyin.
- GRNA virüsü ile 24 saat enfeksiyondan sonra, ortamı yenileyin ve hücreleri 24 saat daha kültüre edin.
- Ortamı DMEM ile 1 μg/mL puromycin ile değiştirin. Plakayı 37 °C inkübatöre döndürün ve hücreleri 1 hafta boyunca kültüre edin. Enfekte olmayan hücrelerin tamamen öldüğünden emin olun. Hücreleri % 80 izdiah süresine ulaştıklarında bölün ve puromycin seçimine devam edin.
- Salyangoz'a karşı bir antikor kullanarak batı şişkinliği ile MS-1 hücrelerindeki Salyangozun nakavtını onaylayın (Salyangozun moleküler ağırlığı yaklaşık 35 kDa'dır).
Sonuçlar
TGF-β2, ENDMT'yi indükler ve MS-1 endotel hücrelerinde salyangoz ekspresyonını uyarır
TGF-β EndMT'yi teşvik etme potansiyeli en yüksek sitokinlerden biridir. MS-1 hücrelerini 3 gün boyunca TGF-β2 (1 ng/mL) ile tedavi ettikten sonra, endotel MS-1 hücreleri parke taşı benzeri yapılarını kaybeder ve iğ şeklindeki mezenkimal benzeri hücrelere farklılık verir (Şekil 1A)15. TGF-β2'nin hücre fenotipik değişikliklere neden olmadaki rolünü daha fazla doğrulamak için, hücreleri TGF-β2 stimülasyonu19'danönce küçük molekül aktivin reseptör benzeri kinaz (ALK)4/ALK5/ALK7 inhibitörü SB431542 ile önceden tedavi ettik. SB431542 tamamen abrogated TGF-β2-indüklenmiş hücre morfolojisi değişiklikleri (Şekil 1A). TGF-β2 indüklenen EndMT süreci, EndMT ile ilgili belirteçlerin ifadesindeki değişiklikler incelenerek daha fazla araştırılmıştır. Şekil 1B'degösterildiği gibi, endotel proteini Pecam-1, TGF-β2 stimülasyonundan sonra güçlü bir şekilde azalırken, mezenkimal faktör Sm22α, TGF-β215tarafından derinden yukarı yönlü olarak gösterilmiştir. Bu veriler, TGF-β2'nin MS-1 hücrelerinde EndMT'yi tetiklediği düşüncesiyle tutarlıdır. Daha sonra, TGF-β2'nin Salyangoz ve Sümüklüböcek ekspresyişi üzerindeki etkilerini araştırdık. Şekil 1C'degösterildiği gibi, Salyangoz TGF-β2 tarafından belirgin bir şekilde yukarı doğru düzenlenirken, Sümüklüböcek ifadesi MS-1 hücrelerinde TGF-β2'den etkilenmedi15. Salyangoz ifadesinin üç bağımsız deneyden nicelemesi Şekil 1D'de gösterilmiştir.
MS-1 endotel hücrelerinde Salyangozun CRISPR/Cas9 tarafından tükenmesi
Salyangoz TGF-β2 tarafından indüklendi ve muhtemelen TGF-β2 aracılı EndMT'de yer aldığı için, MS-1 hücrelerinde salyangoz ekspresyonunu genetik olarak tükenmek için CRISPR/Cas9 gen düzenlemesini gerçekleştirdik. Salyangozun tükenmesinin TGF-β2 kaynaklı EndMT'yi inhibe etmek için yeterli olacağını varsaydık. Şekil 2A'dagösterildiği gibi, salyangoz nakavt hücrelerini iki adımda oluşturduk. İlk olarak, Cas9, MS-1 hücrelerine lentivirüs ifade eden bir Cas9 bulaşarak ektopik olarak ifade edildi. pLV-Cas9 yapısında bir blasticidin direnç kaseti olduğundan, blastisidin dirençli hücrelerde Batı blot analizi ile Cas9 ifadesini kontrol ettik (Şekil 2D). Daha sonra, salyangozu protein ekspresyonunu bozmak için özellikle hedef alan sgRNA'ları tanıttık. Bu prosedür ayrıca puromycin ifade kaseti içeren AA19 pLKO.1-Salyangoz-sgRNA yapısını taşıyan lentiviral parçacıklarla enfeksiyonla gerçekleştirildi. Cas9 ekspresyon hücreleri yine lentivirüs içeren gRNA ile enfekte edildi ve daha fazla puromycin ile seçildi. Murine Salyangozunu hedefleyen iki tamamlayıcı sgRNA oligo, tahmin edilen düşük hedef dışı aktivite ile tasarlanmıştır (Şekil 2B,C). Cas9'da MS-1 hücrelerini ifade eden iki bağımsız Salyangoz sgRNA'sı tanıtıldıktan sonra, Salyangoz proteini ekspresyürü kırıldı (Şekil 2D)15.
Salyangoz eksikliği MS-1 hücrelerinde TGF-β2 kaynaklı EndMT'i inhibe eder
Salyangozun işlevini TGF-β2 aracılı EndMT'de göstermek için salyangoz tükenmiş hücrelerde endmt tahlili yaptık ve ebeveyn MS-1 hücreleri ile karşılaştırdık. Şekil 3A'dagösterildiği gibi, Salyangozun nakavtı MS-1 hücrelerinde TGF-β2 tarafından yönlendirilen fibroblast benzeri hücre morfolojisini inhibe etmek için yeterliydi15. Buna ek olarak, Pecam-1'deki TGF-β2 aracılı düşüş ve Salyangoz tükenmiş MS-1 hücrelerinde Sm22α'nın geliştirilmesi tamamen engellendi. Özetle, Salyangozun MS-1 hücrelerinde TGF-β2 aracılı EndMT için kritik olduğunu gösterdik (Şekil 3B)15.
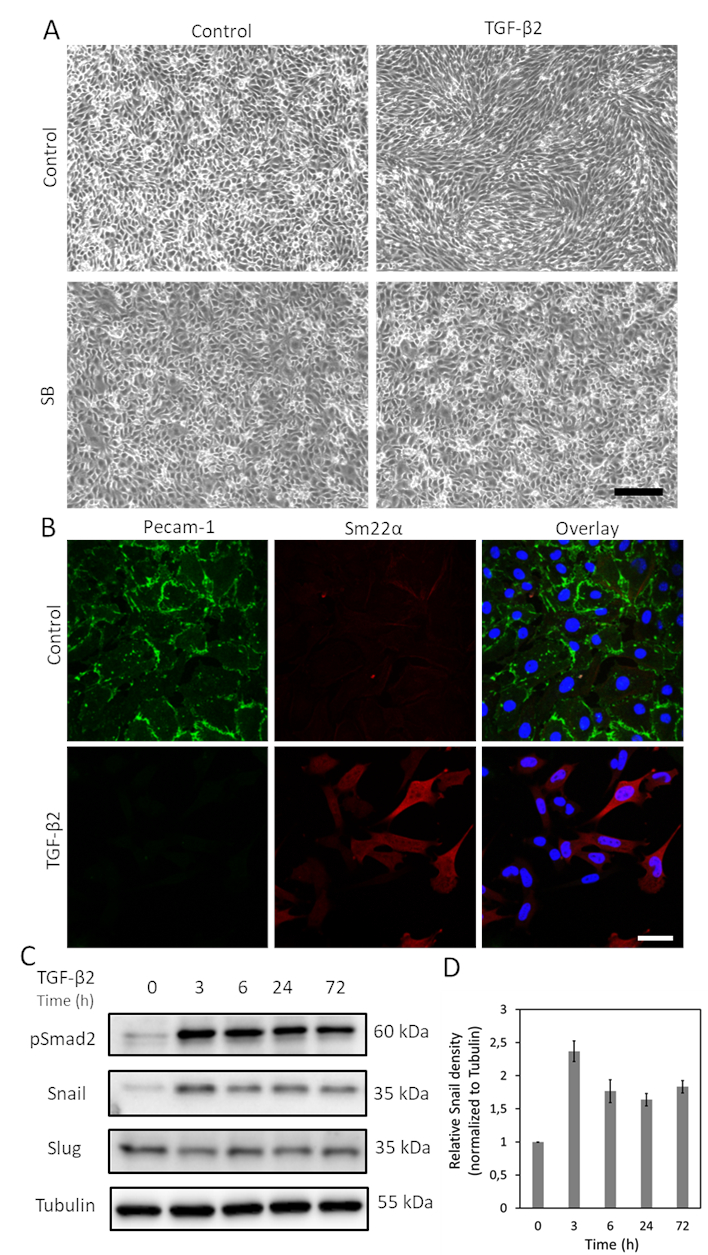
Şekil 1. TGF-β2, MS-1 hücrelerinde EndMT ve Salyangoz ekspresyonlarına neden olarak gelir. A. TGF-β2 ve/veya TGF-β tip I reseptör kinaz inhibitörü SB-431542'nin hücre morfolojisi üzerine etkileri. TGF-β2 (1 ng/mL) ve/veya SB-431542 (SB, 5 μM, TGF-β2'den önce 30 dk) ile 2 gün boyunca tedavi üzerine MS-1 hücrelerinin brightfield görüntüleri. Ölçek çubuğu 200 μm. B'dir. MS-1 hücrelerinde Pecam-1 (yeşil) ve Sm22α (kırmızı) immünoresans lekesi 3 gün boyunca TGF-β2 (1 ng/mL) içeren ortamda kültürlenir. Çekirdekler mavi (DAPI) ile görselleştirilir. Ölçek çubuğu: 50 μm. C. TGF-β2'nin tüm hücre lisatı ile batı lekesi MS-1 hücrelerini uyardı. Salyangoz ifadesi, ancak Slug değil, daha önce Ma ve ark15'te bildirildiği gibi TGF-β2 stimülasyonu ile geliştirilmiştir. D. Üç bağımsız batı blot deneyinden elde edilen sonuçları entegre ederek Salyangoz ekspresyonunun ölçülmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
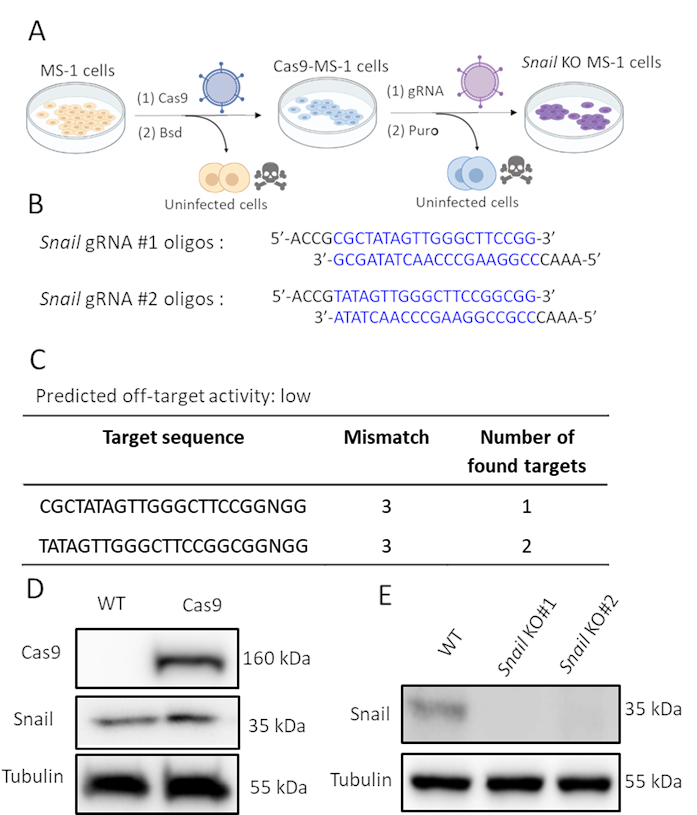
Şekil 2. CRISPR-Cas9 gen düzenleme ile Salyangozun tükenmesi. A. Salyangoz nakavt hücrelerinin nasıl oluşturulanın nasıl oluşturulanın şeması. Bsd: Blasticidin. Puro: Puromycin. B. CHOPCHOP (http://chopchop.cbu.uib.no/) ve Cas-OFFinder (http://www.rgenome.net/cas-offinder/) kullanarak Salyangozu hedefleyen iki bağımsız sgRNA'nın oligonükleotidleri. C. Cas-OFFinder (http://www.rgenome.net/cas-offinder/) kullanarak Salyangoz için iki gRNA'nın tahmin edilen hedef dışı etkinliği. D. Batı blot analizi ile ölçülen vahşi tipte (WT) cas9 ve salyangoz ifadesi ve Cas9-overexpressed MS-1. E. Batı blot analizi ile ölçülen MS-1 hücrelerinde iki bağımsız gRNA ile Salyangozun nakavtı. Benzer sonuçları Ma ve ark15. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
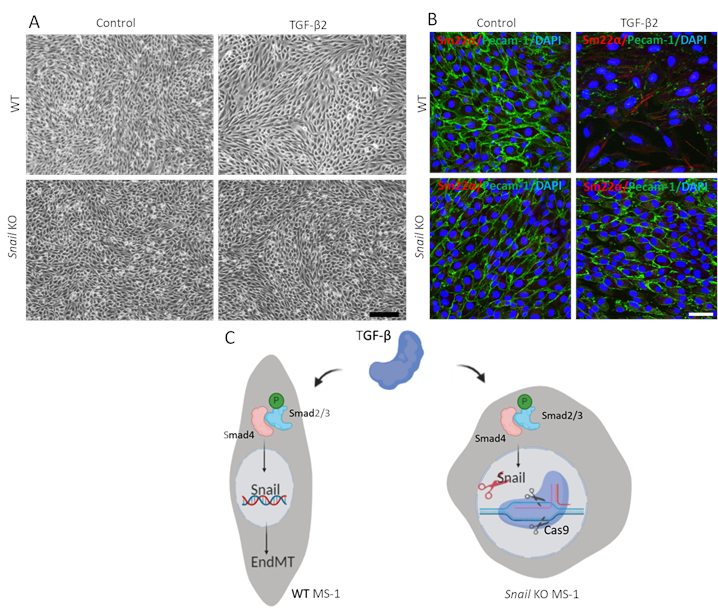
Şekil 3. Salyangozun genetik tükenmesi MS-1 hücrelerinde TGF-β2 kaynaklı EndMT'i inhibe eder. A. Wildtype (WT, üst panel) ve Salyangoz (alt panel) hücrelerinde 3 gün boyunca TGF-β2 (0.1 ng/mL) ile tedavi üzerine MS-1 hücrelerinin parlak alan görüntüleri. Ölçek çubuğu, 3 gün boyunca TGF-β2 (1 ng/mL) içeren ortamda kültürlenmiş MS-1 hücrelerinin Pecam-1 (yeşil), Sm22α (kırmızı) ve çekirdekleri (mavi) için 200 μm. B. immunofluoresan boyamayı temsil eder. Salyangozun tükenmesi TGF-β2 kaynaklı Pecam-1'in azalması ve Sm22α ekspresyonunun artması. Ölçek çubuğu, MS-1 hücrelerinde Salyangoz nakavtının TGF-β kaynaklı EndMT üzerindeki etkisinin şematik gösterimini temsil eder. TGF-β, Smad2/3 fosforilasyon yaparak Salyangoz'un Smad yolu ile ekspresyonunun uyarıldığını ve EndMT'yi daha da yönlendirdiğini gösterir. CRISPR/Cas9 tabanlı gen düzenlemesini kullanarak Salyangozu nakavt etmek, TGF-β aracılı EndMT'yi yok etti. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
EndMT mekanizmasını anlamak, bu sürecin modülei ve EndMT ile ilgili hastalıkların hedeflenesi için kritik öneme sahiptir. Burada, TGF-β kaynaklı endmt tahlili yapmak ve TGF-β tetiklenen EndMT'de EndMT-TF Salyangozunun rolünü sorgulamak için crispr/cas9 aracılı hücrelerden salyangozun stabil gen tükenmesini gerçekleştirerek yöntemleri tanımladık. CRISPR/Cas9 yaklaşımı kullanılarak salyangozun tükenmesi, MS-1 hücrelerinde TGF-β2 tahrikli EndMT'i başarıyla bozuyor (Şekil 3C). TGF-β gibi herhangi bir sitokinin EndMT üzerindeki etkilerini incelemek için, VC'ler sitokinlere maruz kaldı ve daha sonra EndMT oluşumu morfolojik değişikliklere ve hücrelerdeki endotel ve mezenkimal belirteç ifade değişikliklerine göre değerlendirildi. TGF-β2, TRANSKRIPSiyon faktörü Salyangoz ekspresyonunda güçlü bir artış eşliğinde MS-1 hücrelerinde EndMT'ye güçlü bir şekilde indüklenmiş. TGF-β tarafından indüklenen EndMT-TF'ler türe veya dokuya özgü endotel hücre tipine göre farklılık gösterebilir. Örneğin, Salyangoz ama Sümüklüböcek'in MS-1 hücrelerinde TGF-β tarafından önemli ölçüde yukarı doğru ayarlandığını, insan göbek damarı endotel hücrelerinde (HUVEC) ise TGF-β20'yemaruz kaldıktan sonra hem Salyangoz hem de Sümüklüböcek arttığını gözlemledik.
EndMT sürecinin kapsamını hücre morfolojisi değişikliklerini inceleyerek ve daha sonra EndMT ile ilgili belirteçler ifadesindeki değişiklikleri araştırarak iki şekilde değerlendirdik. 3 gün boyunca TGF-β maruz kaldıktan sonra, hücrelere EndMT ile ilgili belirteçlerin ifadesinde tutarlı morfolojik varyasyonlar ve değişiklikler yapıldı. Burada gerçekleştirdiğimiz immünofluoresans lekelemesine ek olarak, marker varyasyonları protein ekspresyon seviyesinde batı şişkinliği veya gen seviyelerinde qRT-PCR (Gerçek Zamanlı Nicel Ters Transkripsiyon PCR) ile de izlenebilir21. Bu protokolde gösterdiğimiz bu iki zaman ve maliyet tasarrufu yöntemine ek olarak, EndMT'yi incelemek için başka yöntemler de vardır. Örneğin, tedavi edilen ve kontrol hücreleri arasındaki endotel ve mezenkimal ile ilgili genlerin ekspresyon seviyelerini karşılaştırmak için transkriptom analizi (RNA dizilimi veya qPCR ile) yapmak EndMT22,23'ühassas bir şekilde değerlendirebilir. Ek olarak, EndMT genellikle empedans spektroskopisi24ile değerlendirilebilen bariyer fonksiyonunun kararlı kaybını içerir. Ayrıca, EndMT türevi hücreler tarafından kök hücre benzeri özelliklerin elde edildiğine dair ek kanıtlar incelenebilir. Örneğin, belirli kültür koşullarında, EndMT mezenkimal benzeri hücreler osteoblastlara, kondrositlere, adipositlere veya (myo)fibroblastlara daha da ayırt edilebilir. Bu nedenle, mezoderm soyuna ait farklı hücre tiplerine farklılaşmayı doğrulamak için ek analiz (yani gen ekspresyonu ve matris boyama) EndMT türevi hücrelerin çokpotent doğasını göstermek için yararlıdır. Son olarak, EndMT değerlendirme yöntemleri in vitro çalışmalarla sınırlı değildir, ancak EndMT ile bazı hastalıklar arasındaki ilişkiyi vivo veya ex vivo organlarda araştırmak için tahmin edilebilir. Bu anlamda, endotel spesifik soy izleme stratejilerinin kullanımı EndMT ile ilgili araştırmaya geniş ölçüde genişletilmiştir25.
EndMT sırasında Salyangozun rolünü araştırmak için, bu çalışmada CRISPR/Cas9 gen düzenlemesi bu geni nakavt etmek için kullanılmıştır. Veriler, TGF-β2'nin salyangoz eksikliği MS-1 hücrelerinde EndMT'ye aracılık edemediğini gösterdi. Bu gözlem, SALYANGOZ'un MS-1 hücrelerinde TGF-β2 indüklenen EndMT için gerekli olduğunu göstermiştir. Cas9'un Salyangozu hedeflemesi için belirli sgRNA'ları tanıtmak için bağımsız bir U6 tahrikli sgRNA ifade kaseti kullandık. Bu yönteme ek olarak, Ran ve ark.26, hem Cas9 hem de gRNA'ları içeren bir yapı oluşturmak için sgRNA oligos dizisini Cas9 iskelesine klonlamak için başka bir strateji tanımladı. Ortaya çıkan yeni yaklaşımlar CRISPR/Cas'ın ek işlevler içermesine olanak sağlar. Örneğin, Cas927'yi ifade eden hücrelere daha fazla sgRNA teslim ederek çift veya üçlü nakavtlar elde edilebilir. Tasarlanan Cas13 proteini, endojen DNA28'ibozmadan RNA moleküllerini hedefler ve sindirir. CRISPR/ Cas ile genleri nakavt etmenin yanı sıra, kısa saç tokası RNA'ları (shRNA'lar) hedeflenen gen ekspresyonunu saptanmak için alternatif olarak kullanılabilir29. Tüm CRISPR/Cas gen düzenleme yöntemleri için hedef dışı bölünme her zaman göz önünde bulundurulmalıdır. Ek olarak, küçük müdahaleci RNA'lar (siRNA'lar) gen ekspresyonını geçici olarak susturur ve siRNA konsantrasyonu hücre bölünmesi30ile seyreltilir. Her iki yöntem de hedeflenen gen ekspresyonlarını kısmen bastırır. Buna karşılık, EndMT/EMT31sırasında gen fonksiyonunu doğrulamak için ektopik gen ekspresyonu da kullanılır. Bu yaklaşım, bir genin yukarıgülasyonunun endmt yanıtı vermek için yeterli olup olmadığını belirleyebilir. Bu nedenle, şu anda EndMT'nin potansiyel düzenleyicilerini tanımlamak ve doğrulamak için kullanılabilecek çok sayıda teknik strateji vardır. Ayrıca, transkriptomik analiz EndMT ile ilgili düzenleyicilerin tanımlanmasında ve kapsamlı analizinde iyi bir seçenek olabilir. EndMT modülasyonunu araştırmak için farklı tamamlayıcı yaklaşımlar kullanmanızı öneririz.
Özetle, TGF-β kaynaklı EndMT sırasında işlevsel roller oynayabilecek faktörleri belirlemek için bir iş akışı sunduk. Bu yöntem, diğer uyaranların (örneğin sitokinler, büyüme faktörleri, mekanik uyaranlar, hücre-hücre etkileşimleri) EndMT'yi modüle edip edemeyebileceğini ve TGF-β diğer uyaranlarla etkileşimini incelemek için de kullanılabilir. Buna ek olarak, TGF-β kaynaklı EndMT için belirli bir genin gerekli olup olmadığını ortaya çıkarmak için CRIPSR/Cas gen düzenlemesini kullanarak bir yaklaşımı vurguladık. Bu metodolojiyi göstermek için MS-1 hücrelerinde güçlü EndMT indükleyici TGF-β2'yi kullandık, ancak protokoller diğer sitokinlere ve diğer hücre tiplerine uyarlanabilir. Açıklanan bu detaylı protokolün gelecekteki EndMT ile ilgili çalışmalar için bir basamak görevi göreceğiz.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Araştırma CGC.NL ve Hollanda Kardiyo Vasküler Araştırma Girişimi tarafından desteklendi: Hollanda Kalp Vakfı, Hollanda Üniversite Tıp Merkezleri Federasyonu, Hollanda Sağlık Araştırma ve Geliştirme Örgütü ve Phaedra-Impact'e (http://www.phaedraresearch.nl) verilen Hollanda Kraliyet Bilimler Akademisi Hibesi. JM, Çin Burs Konseyi tarafından desteklenmektedir. GSD, AFM-Telethon [22379], FOP Italia'dan Trambolin hibesi ve La Fundació La Marató de TV3'ten (#202038) bir hibe ile desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | Pall Corporation, USA | 4614 | |
| 10× T4 DNA ligase buffer | Thermofisher Scientific, USA | B69 | |
| 12 mm round glass slice | Knittel Glass,Germany | VD10012Y1A.01 | |
| 20 mL syringe | BD Eclipse, USA | 300629 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Vector Laboratories, USA | H-1200 | VECTASHIELD Antifade Mounting Media |
| AA19_PLKO vector | Dr. M Gonçalves, Leiden University Medical Center, Netherlands | Gift | |
| Ampicillin | Serva Electrophoresis, USA | 1339903 | |
| Anti-Mouse IgG | GE Healthcare, USA | NA931 | |
| Anti-Rabbit IgG | Cell signaling, USA | 7074 | |
| Agarose | Roche, Switzerland | 11388991001 | |
| Blasticidin | Invitrogen, USA | R21001 | |
| Buffer O (10X) | Thermofisher Scientific, USA | BO5 | |
| BveI (Bspm1) | Thermofisher Scientific, USA | ER 1741 | |
| Confocal microscope | Leica Microsystems, Germany | SP8 | |
| DMEM | Thermo Fisher Scientific, USA | 11965092 | |
| Donkey anti-rat Alexa 488 | Invitrogen, USA | A21208 | |
| FBS | Thermo Fisher Scientific, USA | 16000044 | |
| Formaldehyde | Thermo Fisher Scientific, USA | 28908 | |
| Inverted microscope | Leica Microsystems, Germany | DMi8 | |
| Goat anti-rabbit Alexa 594 | Invitrogen,USA | A11012 | |
| LabNed Plasmid kit | LabNed, USA | LN2400004 | |
| MS-1 cell line | American Type Culture Collection (ATCC) | ||
| Nail polish | HEMA, Netherlands | Transparent | |
| Pecam-1 antibody | Becton Dickinson,USA | 553370 | |
| PEI | Polysciences, USA | 23966-1 | |
| PLV-Cas9 plasmid | Sigma-Aldrich, USA | Cas9BST-1EA | |
| Puromycin | Sigma-Aldrich, USA | P9620 | |
| QIAquick gel extraction kit | Qiagen, Germany | 28706 | |
| Sm22a antibody | Abcam, UK | ab14106 | |
| Snail | Cell signaling, USA | 3879 | |
| T4 DNA ligase | Thermofisher Scientific, USA | EL 0014 | |
| TC20 automated Cell Counter | Bio-Rad, USA | 1450102 | |
| Human TGF-β2 | Joachim Nickel, University of Wurzburg | Gift | Other commercial recommendation: 302-B2, R&D systems |
| Triton X-100 | Merck, USA | 1086031000 | |
| SB431542 | Tocris Bioscience, UK | 1614 | |
| Tris | Roche, Switzerland | 11814273001 |
Referanslar
- Ma, J., Sanchez-Duffhues, G., Goumans, M. -J., Ten Dijke, P. TGF-β-induced endothelial to mesenchymal transition in disease and tissue engineering. Frontiers in Cell and Developmental Biology. 8, (2020).
- Piera-Velazquez, S., Jimenez, S. A. Endothelial to mesenchymal transition: role in physiology and in the pathogenesis of human diseases. Physiological Reviews. 99 (2), 1281-1324 (2019).
- Sánchez-Duffhues, G., de Vinuesa, G. A., ten Dijke, P. Endothelial-to-mesenchymal transition in cardiovascular diseases: developmental signaling pathways gone awry. Developmental Dynamics. 247 (3), 492-508 (2018).
- Evrard, S. M., et al. Endothelial to mesenchymal transition is common in atherosclerotic lesions and is associated with plaque instability. Nature Communications. 7 (1), 1-16 (2016).
- Qiao, L., et al. Endothelial fate mapping in mice with pulmonary hypertension. Circulation. 129 (6), 692-703 (2014).
- Zeisberg, E. M., et al. Endothelial-to-mesenchymal transition contributes to cardiac fibrosis. Nature Medicine. 13 (8), 952-961 (2007).
- Clere, N., Renault, S., Corre, I. Endothelial-to-mesenchymal transition in cancer. Frontiers in Cell and Developmental Biology. 8, (2020).
- Saito, A. EMT and EndMT: regulated in similar ways. The Journal of Biochemistry. 153 (6), 493-495 (2013).
- Bolós, V., et al. The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions: a comparison with Snail and E47 repressors. Journal of Cell Science. 116 (3), 499-511 (2003).
- Aird, W. C. Endothelial cell heterogeneity. Cold Spring Harbor Perspectives in Medicine. 2 (1), 006429(2012).
- Yang, J., et al. Guidelines and definitions for research on epithelial-mesenchymal transition. Nature Reviews Molecular Cell Biology. , 1-12 (2020).
- Doudna, J. A., Charpentier, E. The new frontier of genome engineering with CRISPR-Cas9. Science. 346 (6213), (2014).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Arbiser, J. L., et al. Oncogenic H-ras stimulates tumor angiogenesis by two distinct pathways. Proceedings of the National Academy of Sciences USA. 94 (3), 861-866 (1997).
- MA, J., et al. TGF-?-induced endothelial to mesenchymal transition results from a balance between SNAIL and ID factors. Frontiers in Cell and Developmental Biology. 182 (9), (2021).
- Chen, X., et al. Probing the impact of chromatin conformation on genome editing tools. Nucleic Acids Research. 44 (13), 6482-6492 (2016).
- Hunter, F. W., et al. Functional CRISPR and shRNA screens identify involvement of mitochondrial electron transport in the activation of evofosfamide. Molecular Pharmacology. 95 (6), 638-651 (2019).
- Mao, Y., et al. Lentiviral vectors mediate long-term and high efficiency transgene expression in HEK 293T cells. International Journal of Medical Sciences. 12 (5), 407(2015).
- Liu, S., et al. Deubiquitinase activity profiling identifies UCHL1 as a candidate oncoprotein that promotes TGFβ-induced breast cancer metastasis. Clinical Cancer Research. 26 (6), 1460-1473 (2020).
- Medici, D., et al. Conversion of vascular endothelial cells into multipotent stem-like cells. Nature Medicine. 16 (12), 1400(2010).
- Kokudo, T., et al. Snail is required for TGFβ-induced endothelial-mesenchymal transition of embryonic stem cell-derived endothelial cells. Journal of Cell Science. 121 (20), 3317-3324 (2008).
- Dong, J., et al. Single-cell RNA-seq analysis unveils a prevalent epithelial/mesenchymal hybrid state during mouse organogenesis. Genome Biology. 19 (1), 1-20 (2018).
- Oatley, M., et al. Single-cell transcriptomics identifies CD44 as a marker and regulator of endothelial to haematopoietic transition. Nature communications. 11 (1), 1-18 (2020).
- Halaidych, V., et al. Inflammatory responses and barrier function of endothelial cells derived from human induced pluripotent stem cells. Stem Cell Reports. 10 (5), 1642-1656 (2018).
- Li, Y., Lui, K. O., Zhou, B. Reassessing endothelial-to-mesenchymal transition in cardiovascular diseases. Nature Reviews Cardiology. 15 (8), 445-456 (2018).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Grav, L. M., et al. One-step generation of triple knockout CHO cell lines using CRISPR/Cas9 and fluorescent enrichment. Biotechnology Journal. 10 (9), 1446-1456 (2015).
- Abudayyeh, O. O., et al. RNA targeting with CRISPR-Cas13. Nature. 550 (7675), 280-284 (2017).
- Paddison, P. J., et al. Cloning of short hairpin RNAs for gene knockdown in mammalian cells. Nature Methods. 1 (2), 163-167 (2004).
- Reynolds, A., et al. Rational siRNA design for RNA interference. Nature Biotechnology. 22 (3), 326-330 (2004).
- Lourenço, A. R., et al. C/EBPɑ is crucial determinant of epithelial maintenance by preventing epithelial-to-mesenchymal transition. Nature Communications. 11 (1), 1-18 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır