Method Article
TGF-β 매개 내피- 중간엽 전환(EndMT)과 CRISPR/Cas9 유전자 편집을 사용하여 EndMT 이펙터의 기능평가
요약
당사는 세포 형태 변화를 관찰하고 면역형성 염색을 이용한 발현 EndMT 관련 마커 변경을 검사함으로써 내피 세포에서 TGF-β2 유도 EndMT를 조사하는 방법을 설명합니다. CRISPR/Cas9 유전자 편집은 TGF-β2 유도 EndMT에서의 역할을 조사하기 위해 달팽이를 코딩하는 유전자를 고갈시키기 위해 기술및 사용되었다.
초록
특정 외부 단서 및 특정 전사 인자의 활성화에 응하여, 내피 세포는 중간엽 과 같은 표현형, 중간엽 전이(EndMT)에 내피성이라고 불리는 과정으로 분화할 수 있다. 신흥 결과는 EndMT가 섬유증과 암과 같은 다중 인간 적인 질병에 인과관계가 있다는 것을 건의했습니다. 또한, 내피 유래 중간엽 세포는 조직 재생 절차에 적용될 수 있으며, 다양한 세포 유형(예를 들어, 골세포 및 연골세포)으로 더 분화될 수 있다. 따라서, EndMT의 선택적 조작은 임상 잠재력을 가질 수 있다. 상피-중간엽 전이(EMT)와 마찬가지로 EndMT는 달팽이 및 슬러그를 포함한 소위 EndMT 전사 인자(EndMT-TFs)의 발현을 자극하는 분비된 사이토카인 변환 성장 인자-베타(TGF-β)에 의해 강하게 유도될 수 있다. 이러한 EndMT-TFs는 각각 중간엽 및 내피 단백질의 수준을 상하 조절합니다. 여기서, 우리는 TGF-β 유도된 EndMT를 시험관내에서 조사하는 방법을 설명하며, TGF-β 유도된 EndMT에서 특정 TF의 역할을 연구하는 프로토콜을 포함한다. 이러한 기술을 이용하여, TGF-β2가 뮤린 췌장 내피 세포(MS-1 세포)에서 EndMT를 자극하고, 정기적으로 간격이 있는 짧은 palindromic 반복(CRISPR)/CRISPR 관련 단백질 9(Cas9)를 매개한 유전자 편집을 사용하여 달팽이의 유전고갈약이 이 현상을 분석한다는 증거를 제공합니다. 이 접근법은 내피 생물학의 잠재적인 변조기를 심문하는 모형으로 봉사할 수 있고, 인간 적인 질병에 있는 잠재적인 응용으로 EndMT의 새로운 레귤레이터를 확인하기 위하여 유전 또는 약리학적인 스크린을 능력을 발휘하기 위하여 이용될 수 있습니다.
서문
중간엽 전이(EndMT)에 내피는 다양한 생리학적 및 병리학적 과정1,2에연결된 다단계 및 동적 생물학적 현상이다. EndMT 내피 세포는 중간 엽 특성3을획득하면서 점차적으로 내피 특성을 잃습니다. 따라서, 단단히 압축되고 잘 조직된 내피 세포는 길쭉한 중간엽 같이 세포로 분화합니다. EndMT의 형태학적 변화는 특정 유전자와 단백질의 발현의 변화와 일치합니다. 일반적으로, 혈관 내피(VE)-카데린, 혈소판/EC 접착 분자-1(CD31/Pecam-1)을 포함하는 내피특성을 유지하는 단백질의 발현이 감소한다. 동시에, α-부드러운 근육 액틴(α-Sma) 및 부드러운 근육 단백질(22α)과 같은 중간엽 기능과 관련된 단백질이 축적된다. 신생아 후 엔드MT가 암, 심장 섬유증, 폐 동맥 고혈압 (PAH), 죽상 동맥 경화증 (AS), 장기 섬유증 등2,4,5,6,7과같은 인간 질환의발달에기여한다는 것을입증했습니다. EndMT의 기본 메커니즘과 EndMT 프로세스를 지시하는 방법에 대한 심층적인 이해는 EndMT 관련 질병 및 재생 의학에 대한 새로운 치료 방법을 제공 할 것입니다.
TGF-β 주요 EndMT 유도제 중 하나이며, 다른 알려진 관련 요인은 Wnt/β-카테닌, 노치 및 일부 염증성 사이토카인1을포함한다. 세포 컨텍스트는 TGF-β 의해 트리거 응답에 대 한 키, 다른 EndMT 홍보 신호와 TGF-β 상호 작용은 TGF-β 대 한 EENDMT 응답을 유도 하는 관련. TGF-β 세포 표면 유형 I 및 타입 II 세린/threonine 키나아제 수용체의 활성화시, 세포내 정경성 스마드 통로가 활성화된다. TGF-β 수용체 매개 인은 Smad2/3 형태의 이종복합체를 핵으로 배회하여 EndMT 관련 전사 인자의 발현을 조절합니다. 상피-중간엽 전이(EMT)와 유사하게, 달팽이, 슬러그, 트위스트, Zeb1 및 Zeb2와 같은 전사 인자는 TGF-β 신호에 의해 유도되고 EndMT8에서유전자 재프로그래밍에 기여한다.
달팽이는 EndMT의 핵심 요소로 자주 확인되었습니다. 달팽이는 세포 세포 접착 단백질을 코딩하는 유전자의 프로모터에 결합하고 중간엽 단백질9의발현의 향상에 의해 균형을 이루는 그들의 전사를 억제합니다. 내피 세포는 매우 이질적인 집단을 포함하고 EndMT에 대한 다양한 세포 외 자극의 상대적 영향은 내피 세포 맥락 또는 세포유형(10)과다를 수 있다. EMT와의 유사성으로 인해 일부 방법론은 EMT 및 EndMT8메커니즘을 모두 조사하는 데 유용합니다. 이와 관련하여 EMT 국제협회(TEMTIA)는 EMT/EndMT11의발생을 궁극적으로 입증하기 위한 보완 기술의 필요성을 강력히 강조하고 있다.
여기서는 TGF-β 유도된 EndMT 프로세스를 모니터링하고 시각화하는 방법을 설명합니다. 면역 형광 염색은 EndMT 프로세스가 일어나는지 여부의 지표로 사용되는 표적 단백질 / 마커의 발현 변화에 대한 기본 정보를 제공합니다. 추가적으로, 면역 형광 염색은 단백질/마커 및 세포 형태학의 현지화를 시각화할 수 있습니다. TGF-β 중재 된 EndMT에 관여하는 특정 TFs (또는 다른 업스트림 또는 다운스트림 레귤레이터)의 잠재적 인 활성을 연구하기 위해, 우리는 정기적으로 간격짧은 palindromic 반복 (CRISPR) / CRISPR 관련 단백질 9 (Cas9) 유전자 편집을 사용하여 프로토콜을 사용하여 TF 달팽이를 예로 사용하여 세포에서 특정 유전자를 고갈. Cas9는 박테리아12에서CRISPR 서열에 보완적인 서열을 인식하고 갈라지는 이중 RNA 유도 DNA 엔도나클레스이다. CRISPR/Cas9 시스템은 현재 시험관내 및 생체 내 유전 공학을 용이하게 하기 때문에 광범위하게 활용되고있다. 단일 가이드 RNA(sgRNA)에 의해 지시된, ectopically 발현된 Cas9는 특정 유전자 궤적에서 미리 선택된 표적 시퀀스에서 이중 가닥 브레이크를 생성한다. 비동상적 종결(NHEJ)은 무작위로 뉴클레오티드 삽입 또는 삭제를 통해 Cas9 유도 가닥 나누기를 복구하여 표적 유전자의 중단 및 불활성화로 이어진다. 우리는 선택적 sgRNAs를 설계하고 설계된 sgRNA를 포함하는 렌티 바이러스 호환 벡터를 생성하기위한 세부 방법을 설명합니다. 그 결과, 안정적인 유전자 고갈된 내피 세포는 효율적이고 신뢰할 수 있는 방식으로 생성될 수 있다.
본 연구에서는, TGF-β2 유도 EndMT 공정을 검사하기 위한 모델 시스템으로 뮤린 췌장 내피 세포(MS-1)14를 사용했다. 우리의 이전 연구는 달팽이가 TGF-β2에 의해 증가된 주요 전사 인자임을 입증했으며, 이는 EndMT가 MS-1세포(15)에서유도된다. CRISPR/Cas9 유전자편집시 MS-1 세포에서 달팽이 발현을 아브로게이트하도록 편집하면 TGF-β2는 EndMT를 중재하지 못했습니다. 이 워크플로우는 다른 (의심) EndMT 관련 유전자를 연구하기 위해 적용 될 수있다.
프로토콜
1. TGF-β2에 의한 EndMT 유도
- Dulbecco의 수정된 독수리 배지(DMEM)에 있는 MS-1 세포는 인큐베이터(5% CO2,37°C)에서 10% 태아 소 혈청(FBS)과 100U/mL 페니실린/연쇄절제술신을 함유하고 있다. 모든 문화 요리/접시에 0.1% w/v 젤라틴을 10분 간 코팅합니다.
- 1x 인산완충식식염(PBS)으로 MS-1 세포를 부드럽게 세척하고, 트립신-EDTA 용액 2mL(트립신 0.25%, EDTA 0.02% EDTA)을 10cm 접시에 넣고 37°C에서 2분간 배양하여 분리한다. 이어서, 완전한 배양 배지의 5mL를 추가하여 반응을 담금질한다.
- 셀 서스펜션을 실온에서 3분 동안 200 x g에서 15mL 튜브 및 원심분리기로 옮긴다.
- 상체를 버리고 FBS 및 페니실린 /연쇄 절제술을 포함하는 신선한 배지의 4 mL에서 세포를 다시 중단하십시오. 자동 셀 카운터를 사용하여 셀을 계산합니다.
- 씨앗 1 x 10 3 cm 당3 세포2 추가 배양에 대 한. 예를 들어, 종자 9.5 x 103 셀/잘 6웰 플레이트에 대 한, 또는 1.9 x 103 셀/잘 24 웰 플레이트에 대 한.
- 세포를 밤새 배양하여 부착하고 회복한 다음 TGF-β2로 MS-1 세포를 3일 동안 자극합니다. TGF-β 수용체 키나아제 억제제 SB431542 (5 μM) 30분 전에 TGF-β2 자극을 추가한다. 다른 셀을 차량(DMSO)으로 치료합니다.
참고: 0.1% 인간소 혈청 알부민(BSA)을 함유하는 4m HCl에서 TGF-β2를 용해한다. 대조군에 TGF-β2 없이 동일한 양의 리간드 버퍼를 첨가한다. TGF-β2 농도는 특정 에세이에 대해 0.1-1 ng/mL로 적응될 수 있다. 해당 수치의 표시를 참조하십시오. - 3 일 후, 밝은 필드 이미징 (반전 된 현미경으로) 세포 형태를 검사하고 면역 형광 염색 (2 단계 참조)을 수행하여 EndMT 관련 마커 변화를 평가합니다. 생물학적 삼중 생물을 얻기 위해 적어도 세 가지 독립적 인 실험을 수행합니다.
2. 면역 형광 염색
- 배양된 MS-1 셀(1.2단계)을 트립시화한 다음 1.9 x 103 셀을 0.1%w/v 젤라틴 코팅 12mm 원형 커버 글래스로 재시드하여 24웰 플레이트 바닥에 놓습니다.
- 하룻밤 동안 세포를 배양 한 후, 3 일 동안 세포에 TGF-β2 (최종 농도 1 ng/mL)를 추가합니다. 리간드 버퍼를 포함하는 매체를 음수 컨트롤로 사용합니다.
- 페캄-1 및 Sm22α 염색을 수행합니다.
- 3일 동안 TGF-β2(또는 대조군)로 세포를 자극한 후, 배지를 제거하고 1x PBS로 세포를 세척한다.
- 각 우물에 4% 포름알데히드의 300 μL을 추가하고 실온에서 10 분 동안 배양하여 세포를 수정합니다. 인큐베이션 후 PBS 1x로 3배 세척합니다.
- 각 웰에 1x PBS에 0.1% Triton X-100의 300 μL을 추가하고 세포를 충마화하기 위해 실온에서 10 분 동안 배양하십시오. 인큐베이션 후 트리톤 X-100 용액을 제거하고 1x PBS로 셀을 3배 세척합니다.
- 실온에서 45분 동안 1x PBS에서 3% 소 세럼 알부민(BSA)으로 세포를 차단한다.
- 1x PBS로 뮤린 단백질 1:500을 인식하는 1차 페캄-1 및 Sm22α 항체를 희석시 희석한다. 그런 다음 상온에서 45 분 동안 1 차 적인 항체로 고정 된 세포를 배양합니다.
- 1x PBS로 3배 세척한 후 당나귀 항래액 알렉사(488)와 염소 안티래빗 알렉사 594를 포함한 1000x 희석 이차 항체로 세포를 실내 온도에서 45분 동안 배양합니다.
참고: 염색 중에 시료를 빛으로부터 보호합니다. - 1x PBS로 3배 헹구고, 세포로 시드된 커버 글래스를 4',6-디아미드노-2-페닐린돌(DAPI)을 함유한 마운팅 배지 의 드롭에 내려놓아 핵을 염색한다.
- 투명 매니큐어로 커버 글래스의 주변을 고정하고 4 °C에 보관하십시오.
- 공초점 현미경으로 대표적인 이미지를 획득합니다. 레이저 파장을 각각 405nm, 488nm 및 552nm로 설정하여 DAPI, Pecam-1 및 Sm22α를 각각 감지합니다. 각 채널에 대해 모든 사진은 동일한 설정 및 노출 시간으로 촬영되었습니다. 생물학적 삼중 생물을 얻기 위해 적어도 세 가지 독립적 인 실험을 수행합니다.
3. CRISPR/Cas9 편집을 사용하여 달팽이를 노크
- 뮤린 달팽이를 대상으로 두 개의 독립적 인 sgRNAs를 설계합니다.
- 표적 유전자 이름과 종에 따라 온라인 도구 CHOPCHOP (https://chopchop.cbu.uib.no/)와 Cas-OFFinder (http://www.rgenome.net/cas-offinder/)를 사용하여 sgRNAs를 설계합니다.
- Cas-OFFinder(http://www.rgenome.net/cas-offinder/) 및 CHOPCHOP(http://chopchop.cbu.uib.no/)을 포함한 두 개의 독립적인 알고리즘을 사용하여 달팽이를 대상으로 설계된 sgRNAs의 오프 타겟 활동을 예측합니다.
- 활동이 가장 낮은 두 개의 sgRNA를 선택합니다. BveI 컷 사이트와 두 개의 보완 sgRNA 올리고를 디자인합니다. 감각 올리고5'-ACCG-3'로 시작하고 안티 센스 올리고 5'-AAAC-3'로 시작합니다.
- 올리고를 상업적으로 합성하여 추가 사용을 주문하십시오.
- Bve I-소화 AA19 pLKO.1-puro.U6.sgRNA로 보완 가이드 RNA 올리고스를 복제합니다. Bve I-stuffer 렌즈바이러스 벡터 플라스미드를 생성AAA19 pLKO.1-달팽이-sgRNA16.
- AA19 pLKO.1-puro.U6.sgRNA를 잘라냅니다. Bve BveI 효소16와I-stuffer 플라스미드 . AA19 pLKO.1-puro.U6.sgRNA의 2 μg를 혼합합니다. Bve I-stuffer 플라스미드, 10x 버퍼 O의 5 μL, BveI 효소의 5 μL 및 멸균 수를 추가하여 총 부피 50 μL에 도달합니다.
- 소용돌이와 짧게 반응 믹스를 스핀다운. 1 h에 대한 37 °C에서 반응을 배양.
- 반응 믹스를 1% 아가로즈 젤에 적재하고 1x 트리스 아세테이트-EDTA(TAE, 50x TAE 스톡: 물에 용해된 트리스 베이스 242g, 빙하 아세트산 57.1mL, 500mM EDTA(pH 8.0) 용액100mL에 작용하여 총 100mM의 용액을 L에 첨가하여 총 1개의 분리를 달성하였다.
- 젤에서 백본 조각을 잘라 제조업체의 프로토콜에 따라 젤 추출 키트로 분리하고(재료 표참조) 40 μL 용출 버퍼(EB)로 백본을 엘로우트합니다.
- 100 pmol/μL 감각 올리고의 5 μL과 100 pmol/μL 안티센스 올리고의 5 μL을 1M Tris-HCl(pH 8.0)의 1μL과 혼합하고 멸균 수를 추가하여 총 100 μL에 도달하여 gRNA 올리고를 음닐합니다. 혼합물을 100°C에서 5분 동안 배양한 다음 튜브를 알루미늄 호일로 덮습니다. 그 후, 천천히 삽입으로 추가 사용을 위해 실온에 용액을 냉각.
- 보완적인 gRNA 올리고스와 BveI 소화 백본을 리게이트하려면 AA19 pLKO.1-puro.U6.sgRNA.BveI-stuffer 백본과 2 μL의 삽입물(희석 1:300)의 10x T4 DNA ligas 및 DNAL 의 2μL을 혼합하여 분리된 Bve를혼합합니다. 멸균수를 추가하여 총 20μL에 도달하십시오.
참고: 결찰을 수행할 때 두 개의 제어 그룹이 포함되어 있는지 확인합니다. 한 대조군의 경우, 절연 백본 1μL, 10x T4 DNA 리구아제 완충제 2μL, T4 DNA 리개갈 1μL을 혼합하고 멸균 수를 추가하여 총 20 μL에 도달하지만 올리고 DNA없이. 다른 대조군의 경우, 절연 백본 1μL과 10x T4 DNA 리구아제 버퍼의 2 μL을 혼합하고 멸균 수를 추가하여 총 20 μL에 도달하지만, 아닐올리고와 T4 리개갈은 없이. 이 두 컨트롤 결찰은 다음 변환 단계의 반응 배경을 결정하고 결찰이 얼마나 효율적인지를 나타내는 데 사용됩니다.
- 반응 혼합물을 유능한 TOP10 대장균으로 변환합니다.
- 유능한 TOP10 대장균을 수집합니다. -80°C 냉동고에서 세포를 해동하여 얼음 위에 해동합니다.
- 유능한 셀의 50 μL에 2 μL의 결찰 혼합물을 추가하고 튜브를 얼음에 30 분 동안 유지합니다.
- 튜브를 42°C에서 30s에 열 충격. 2 분 동안 얼음에 튜브를 넣어.
- 신선한 리소제니 국물(LB) 배지 950μL을 혼합물에 넣고 60분 동안 37°C에서 힘차게 흔들어 줍니다.
- 스핀 다운 및 따뜻한 암피실린에 세포를 플레이트 (100 μg/mL) 저항 LB 플레이트. 하룻밤 사이에 37 °C에서 플레이트를 배양하십시오.
- 플라스미드에서 gRNA 올리고스의 성공적인 삽입을 확인한다.
- LB 배지를 함유한 암피실린(100 μg/mL)의 1mL에서 플레이트에 3-5개의 콜로니를 선택하고 30°C에서 하룻밤 동안 흔들어 놓습니다.
- 제조업체의프로토콜(재료표)에따라 플라스미드 키트로 플라스미드 DNA를 분리하고 U6 프로모터 프라이머 5'-GAGGGCCTATTTCCCATGATT -3'로 시퀀스를 사용하여 gRNA 올리고의 성공적인 삽입을 검증한다.
4. 달팽이 녹아웃 MS-1 셀 생성
- Cas9 또는 달팽이 표적 gRNA를 운반하는 렌티바이러스 입자를 생성합니다.
- 배양 HEK 293T 세포는 인큐베이터(5% CO2,37°C)에서 14.5cm 요리(또는 T75 플라스크)에서 10%의 태아 소 혈청 및 100U/mL 페니실린/연쇄절제술을 함유하고 있다.
- 표적 유전자 플라스미드, AA19 pLKO.1-달팽이-sgRNA 또는 pLV-Cas917 플라스미드의 9.9 μg를 혼합, pCMV-VSVG의 도우미 플라스미드 3.5 μg(vesicular 구내염 바이러스, VSV-G의 G 단백질 코딩), rev 반응형 요소 플라스미드 pMDLg-RRE(개그 및 폴 인코딩) 6.6 μg, pRSV-REV(인코딩 개그 및 폴)의 5.0 μg(인코딩 개그)와 5.0 μg(배구 개그 및 폴) 및 5.0 μg(인코딩 개그)와 함께 프리 50μg의 pRSV-REV(인코딩). 혈청 프리 배지의 500 μL에서 폴리에틸렌민(PEI)(PEI)(2.5 mg/mL)의 50 μL을 재중단한다. 플라스미드와 PEI 제제를 위아래로 부드럽게 섞어 주세요. 상온에서 20 분 동안 혼합물을 배양하십시오.
- Transfect HEK 293T 세포는 10% FBS 및 100 U/mL 페니실린/연쇄상 구균신을 포함하는 14.5 cm 접시 (또는 T75 플라스크)에 4.1.2 에서 80 % 컨부유 성 세포에서 혼합물 배지를 첨가하여. HEK293T 세포는 쉽게 전과되어 높은 수준의바이러스(18)를생성하기 때문에 사용된다.
- 24시간 동안 이를 배양하기 위해 감염된 HEK 293T 세포를 미생물 및 생물 의학 실험실(BMBL)의 생물안전으로 이송합니다.
- BMBL 실험실에서 HEK 293T 세포에서 의 경피 배지를 FBS 및 페니실린/연쇄 절제술을 포함하는 신선한 완전 DMEM 12mL로 대체합니다. 24 시간 동안 세포를 배양합니다.
- 20mL 주사기와 0.45 μm 필터로 배지를 수집하고 필터링합니다. 조건된 배지를 15mL 폴리프로필렌 튜브로 옮기다.
- HEK 293T 문화 요리와 문화에 FBS와 페니실린/연쇄 절제술이 포함된 12mL의 신선한 완전 DMEM을 추가하여 24시간 추가로 사용할 수 있습니다.
- 20mL 주사기와 0.45 μm 필터로 배지를 수집하고 필터링합니다. 조건된 배지를 15mL 폴리프로필렌 튜브로 옮기다. 렌티바이러스 입자를 함유하는 배지를 -80°C에서 1mL 알리쿼트로 저장하여 추가 사용을 위해 한다.
- pLV-Cas9 바이러스로 MS-1 세포를 감염시다.
- 씨앗 1 x 105 MS-1 세포는 렌티 바이러스 감염 전에 24 시간 동안 6 웰 플레이트에서 잘 당.
- 37°C 수조에서 pLV-Cas9 바이러스의 냉동 알리쿼트를 해동합니다.
- FBS 및 페니실린/연쇄 절제술을 함유한 신선한 DMEM 배지 1mL와 바이러스 배지 1mL를 혼합합니다. 폴리브레인을 배지에 추가하여 감염 효율을 높입니다(10 μg/mL의 최종 농도).
- 6웰 플레이트에서 배지를 제거하고 바이러스/폴리브레인 믹스 배지로 교체하고 24시간 후 감염에 대한 인큐베이터에서 세포를 배양하고, 배지를 신선한 배지로 대체하고 세포를 다른 24h에 배양한다.
참고: 항상 감염되지 않은 컨트롤 그룹으로 잘 보관하십시오. - 감염된 그룹 및 대조군으로부터 배지를 흡인하고 4 μg/mL 블라스팅시딘으로 DMEM 배지로 대체한다.
- 플레이트를 37°C 인큐베이터로 반환하고 1주일 동안 세포를 배양한다. 감염되지 않은 세포는 블라시딘의 효과로 인해 죽을 것입니다. 그들은 80 %의 세포 합류에 도달하고 블라시딘 선택을 계속할 때 살아남은 세포를 분할합니다.
- Cas9에 대한 항체를 사용하여 서양 블로팅에 의해 MS-1 세포에서 Cas9의 발현을 확인한다(Cas9의 분자량은 약 160 kDa).
- 별도로 두 개의 독립적인 gRNA 렌즈바이러스와 pLV-Cas9 MS-1 세포를 감염.
- 종자 1 x 105 pLV-Cas9 MS-1 세포감염 전에 24 시간 동안 6 웰 플레이트에서 잘 당.
- 4.2에 설명된 것과 동일한 프로토콜을 따라 두 개의 gRNA 렌티바이러스로 세포를 별도로 감염시다.
- gRNA 바이러스를 가진 감염의 24 시간 후에, 매체를 새로 고치고 다른 24 시간 동안 세포를 배양합니다.
- 매체를 DMEM으로 1 μg/mL 퓨로마이신으로 바꿉다. 플레이트를 37°C 인큐베이터로 반환하고 1주일 동안 세포를 배양한다. 감염되지 않은 세포가 완전히 죽는지 확인합니다. 80%의 합류에 도달하면 세포를 분할하고 푸오마이신 선택을 계속합니다.
- 달팽이에 대한 항체를 사용하여 서양 블로팅에 의해 MS-1 세포에서 달팽이의 노크 아웃을 확인하십시오 (달팽이의 분자량은 약 35 kDa입니다).
결과
TGF-β2는 ENDMT를 유도하고 MS-1 내피 세포에서 달팽이 발현을 자극합니다.
TGF-β EndMT를 유도 하는 가장 큰 잠재력을 가진 사이토 카인 중 하나입니다. 3일 동안 TGF-β2(1 ng/mL)로 MS-1 세포를 치료한 후, 내피성 MS-1 세포는 조약돌 과 같은 구조를 잃고 스핀들 모양의 중간엽 세포로 분화한다(도1A)15. TGF-β2의 역할을 더 유도하는 세포 페노티픽 변화를 유도하기 위해, 우리는 TGF-β2 자극19전에 작은 분자 활성수용체와 같은 키나아제(ALK)4/ALK5/ALK7 억제제 SB431542로 세포를 미리 처리하였다. SB431542 완전 하방TGF-β2 유도 세포 형태 변화(도 1A). TGF-β2 유도 된 EndMT 과정은 EndMT 관련 마커의 발현의 변화를 연구함으로써 더욱 조사되었다. 도 1B에나타낸 바와 같이, 내피 단백질 페캄-1은 TGF-β2 자극 후 강력하게 감소하였고, 중간두인자 Sm22α는 TGF-β215에의해 심오하게 조절되었다. 이러한 데이터는 TGF-β2가 MS-1 세포에서 EndMT를 유발한다는 개념과 일치한다. 다음으로, 우리는 달팽이및 슬러그 발현에 TGF-β2의 효력을 조사했습니다. 도 1C에도시된 바와 같이, 달팽이는 TGF-β2에 의해 현저하게 강화되었고, 슬러그 발현은 MS-1세포(15)에서TGF-β2에 의해 영향을 받지 않았다. 세 가지 독립적인 실험에서 달팽이 발현의 정량화는 도 1D에도시된다.
MS-1 내피 세포에서 CRISPR/Cas9에 의한 달팽이 고갈
달팽이가 TGF-β2에 의해 유도되고 TGF-β2 매개 EndMT에 관여할 가능성이 있는 바와 같이, 우리는 MS-1 세포에서 달팽이 발현을 유전적으로 고갈시키기 위하여 CRISPR/Cas9 유전자 편집을 수행했습니다. 우리는 달팽이의 고갈이 TGF-β2 유도 EndMT를 억제하기에 충분하다고 가설. 도 2A에도시된 바와 같이, 우리는 두 단계로 달팽이 녹아웃 세포를 생성했습니다. 첫째, Cas9는 렌즈티바이러스를 발현하는 Cas9로 MS-1 세포를 감염시킴으로써 ectopically 표현되었다. pLV-Cas9 구조에 블라시시딘 저항 카세트가 있기 때문에, 우리는 블라실시딘 내성세포(도 2D)에서서양 얼룩 분석에 의한 Cas9의 발현을 점검하였다. 그 후, 우리는 특히 단백질 표현을 방해하기 위해 달팽이를 대상으로 sgRNAs를 도입했습니다. 이 절차는 또한 푸오마이신 발현 카세트를 포함하는 AA19 pLKO.1-달팽이-sgRNA 구조를 운반하는 렌티바이러스 입자를 가진 감염에 의해 수행되었다. Cas9 발현 세포는 다시 렌티바이러스를 포함하는 gRNA에 감염되고 puromycin로 더 선택되었습니다. 뮤린 달팽이를 표적으로 하는 두 개의 보완적인 sgRNA 올리고는 예측된 낮은 오프 타겟활동(그림 2B, C)으로설계되었다. MS-1 세포를 발현하는 Cas9에서 2개의 독립적인 달팽이 sgRNAs를 소개한 후, 달팽이 단백질 발현은 멸망하였다(도2D)15.
달팽이결핍은 MS-1 세포에서 TGF-β2 유도 EndMT를 억제합니다.
TGF-β2 매개 EndMT에서 달팽이의 기능을 입증하기 위해, 우리는 달팽이 고갈 된 세포에서 EndMT 분석기를 수행하고 부모 MS-1 세포와 비교했다. 도 3A에도시된 바와 같이, 달팽이의 녹아웃은 MS-1 세포 에서 TGF-β2에 의해 구동된 섬유아세포 같은 세포 형태를 억제하기에 충분했다(15). 또한, TGF-β2-중재된 페캄-1의 감소 및 Sm22α의 향상은 달팽이 고갈된 MS-1 세포에서 완전히 차단되었다. 요약하자면, 우리는 달팽이가 MS-1 세포에서 TGF-β2-매개 EndMT에 중요하다는 것을 입증하였다(도3B)15.
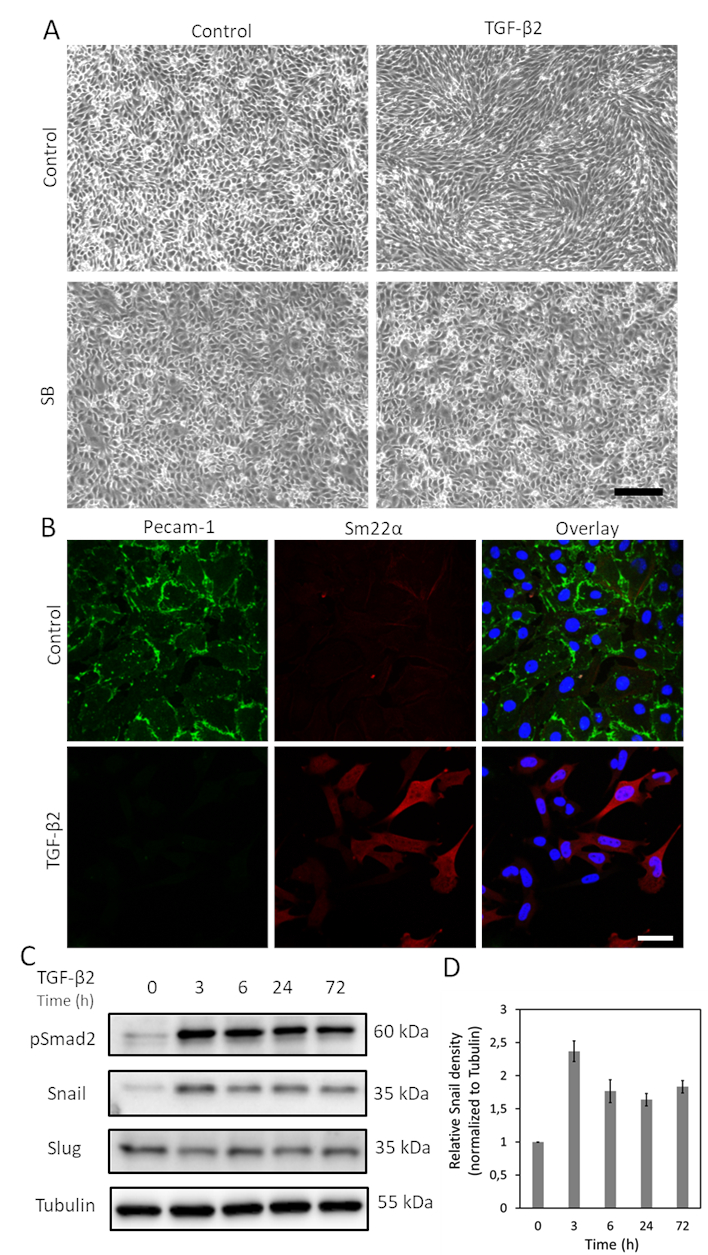
그림 1. TGF-β2는 MS-1 세포에서 EndMT 및 달팽이 발현을 유도한다. A. TGF-β2 및/또는 TGF-β 타입 I 수용체 키나아제 억제제 SB-431542의 세포 형태에 미치는 영향. TGF-β2(1ng/mL) 및/또는 SB-431542(SB, 5 μM, TGF-β2 이전 30분 투여)를 2일 동안 치료시 MS-1 세포의 브라이트필드 영상. 스케일 바는 200 μm. B를 나타냅니다. 3일 동안 TGF-β2(1ng/mL)를 함유하는 배지에서 배양된 MS-1 세포에서 페캄-1(녹색) 및 Sm22α(red)의 면역형 염색. 핵은 파란색(DAPI)으로 시각화됩니다. 스케일 바: TGF-β2의 전체 세포 용해가 있는 50 μm. C. 웨스턴 블롯이 MS-1 세포를 자극하였다. 달팽이의 발현은 슬러그가 아닌, 이전에 Ma 외15에서보고된 TGF-β2 자극에 의해 강화되었다. D. 세 가지 독립적인 서부 블롯 실험의 결과를 통합하여 달팽이 발현의 정량화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
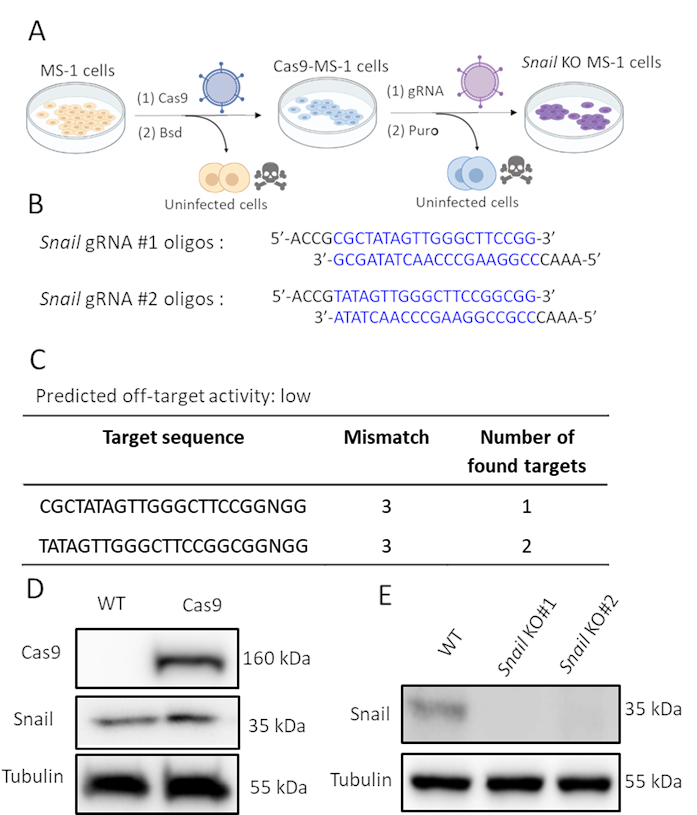
그림 2. CRISPR-Cas9 유전자 편집에 의해 달팽이의 고갈. A. 달팽이 녹아웃 세포를 생성하는 방법을 묘사하는 구성표입니다. Bsd: 블라시딘. 푸로: 푸로미신. B. CHOPCHOP (http://chopchop.cbu.uib.no/)와 카스 -OFFinder (http://www.rgenome.net/cas-offinder/)를 사용하여 달팽이를 대상으로 두 개의 독립적 인 sgRNAs의 올리고 뉴클레오티드. C. Cas-OFFinder(http://www.rgenome.net/cas-offinder/)를 사용하여 달팽이에 대한 두 gRNA의 예상 오프 타겟 활성입니다. D. Cas9 및 달팽이 발현은 서양 얼룩 분석에 의해 측정된 야생형(WT) 및 Cas9 과발현 MS-1에서 측정하였다. E. 서양 얼룩 분석에 의해 측정된 MS-1 세포에 있는 2개의 독립적인 gRNA를 가진 달팽이의 녹아웃. 우리는 Ma 외 15에서 유사한 결과를보고했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
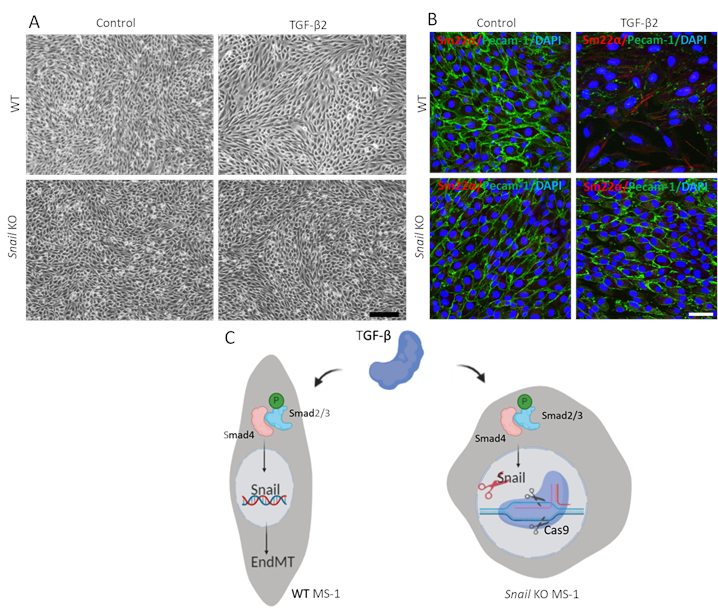
그림 3. 달팽이의 유전 고갈은 MS-1 세포에서 TGF-β2 유도 EndMT를 억제한다. A. TGF-β2(0.1 ng/mL)로 치료시 MS-1 세포의 브라이트필드 이미지는 야생형(WT, 상부 패널)과 달팽이에서 3일간 (하부 패널) 세포를 기절시켰다. 스케일 바는 3일 동안 TGF-β2(1ng/mL)를 함유하는 배지에서 배양된 MS-1 세포의 펙암-1(녹색), Sm22α(red) 및 핵(blue)에 대한 200 μm. 면역형광 염색을 나타낸다. 달팽이의 고갈은 TGF-β2 유도 된 페캄-1의 감소 및 Sm22α 발현의 증가. 스케일 바는 MS-1 세포에서 TGF-β 유도 된 EndMT에 달팽이 녹아웃의 효과의 50 μm. C. 회로도 표현을 나타냅니다. TGF-β Smad2/3을 인광하여 스마드 경로를 통해 달팽이의 표정을 자극하고 EndMT를 더 구동합니다. CRISPR/Cas9 기반 유전자 편집을 사용하여 달팽이를 노크 하는 abrogated TGF-β 매개 EndMT. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
EndMT의 메커니즘을 이해하는 것은 이 과정을 변조하고 EndMT 관련 질병을 표적으로 하는 데 중요합니다. 여기서, 우리는 TGF-β 유도된 EndMT 분석법을 수행하고 TGF-β-트리거된 EndMT에서 EndMT-TF 달팽이의 역할을 심문하는 방법을 설명했으며, 세포로부터 달팽이의 CRISPR/Cas9 매개 안정 유전자 고갈을 수행함으로써. CRISPR/Cas9 접근법을 이용한 달팽이의 고갈은 MS-1 세포에서 TGF-β2 구동EndMT(도 3C)를성공적으로 제거하였다. 어떤 사이토카인의 효과를 연구하기 위하여는, TGF-β, EndMT에, IC는 세포사동에 드러나고 그 때 EndMT의 발생은 세포에 있는 형태학적 변화 및 내피성 및 관상 마커 발현 변화에 따라 평가되었다. TGF-β2 강하게 유도 된 ENDMT MS-1 세포에 전사 인자 달팽이의 발현에 강한 증가와 함께. TGF-β 의해 유도된 EndMT-TFs종 또는 조직 별 내피 세포 유형에 따라 다를 수 있다. 예를 들어, 우리는 달팽이가 MS-1 세포에서 TGF-β 의해 크게 강화된 것을 관찰하고, 인간 적인 탯줄 정맥 내피 세포(HUVECs)에서는, 달팽이와 슬러그 둘 다 TGF-β20에노출된 후에 증가된다.
우리는 세포 형태 변화를 검사한 다음 EndMT 관련 마커 발현의 변화를 조사하여 두 가지 방법으로 EndMT 프로세스의 정도를 평가했습니다. 3일 동안 TGF-β 노출 후, 세포는 EndMT 관련 마커의 발현에 일관된 형태학적 변화와 함께 EndMT를 시행하였다. 여기서 수행한 면역형광 염색 외에도, 마커 변이는 단백질 발현 수준 또는 qRT-PCR(실시간 정량적 역전사 PCR)에 의해 서체 블로팅에 의해 유전자수준(21)에의해 모니터링될 수 있다. 이 프로토콜에서 보여 준 이 두 시간 및 비용 절감 방법 외에도 EndMT를 검사하는 다른 방법이 있습니다. 예를 들어, 전사 분석(RNA 염기서열 분석 또는 qPCR에 의한)을 수행하여 치료 및 대조세포 간의 내피 및 중간엽 관련 유전자의 발현 수준을 비교하여 EndMT22,23을정밀하게 평가할 수 있다. 또한, EndMT는 종종 임피던스분광기(24)에의해 평가될 수 있는 장벽 기능의 안정적인 손실을 수반한다. 더욱이, EndMT 유래 세포에 의한 줄기 세포 유사 특성의 취득에 대한 추가적인 증거를 검토할 수 있다. 예를 들어, 특정 배양 조건하에서, EndMT 중간엽과 같은 세포는 골세포, 연골세포, 선포세포 또는 (myo) 섬유아세포로 더 분화될 수 있다. 따라서, 중피계(즉, 유전자 발현 및 매트릭스 염색)에 속하는 상이한 세포 유형으로 분화되는 것을 확인하기 위한 추가 분석은 EndMT 유래 세포의 다능성 특성을 입증하는 데 유용하다. 마지막으로, EndMT 평가 방법은 시험관 내 연구에 국한되지 않고, 생체 내 또는 전 생체 기관에서 EndMT와 일부 질병 사이의 관계를 조사하기 위해 추정될 수 있다. 이러한 의미에서 내피별 계보 추적 전략의 사용은 EndMT 관련연구(25)로광범위하게 확장된다.
EndMT 도중 달팽이의 역할을 조사하기 위하여는, 이 연구 결과 CRISPR/Cas9 유전자 편집이 이 유전자를 노크하기 위하여 이용되었습니다. 데이터는 TGF-β2가 달팽이 결핍 MS-1 세포에서 EndMT를 중재하지 못했다는 것을 보여주었습니다. 이 관찰은 달팽이가 MS-1 세포에서 TGF-β2 유도 EndMT에 필수적이라는 것을 입증했다. 우리는 Snail을 대상으로 Cas9에 대한 특정 sgRNA를 소개하기 위해 독립적 인 U6 구동 sgRNA 발현 카세트를 사용했습니다. 이 방법 외에도 Ran etal.26은 SgRNA 올리고시퀀스를 Cas9 스캐폴드로 복제하여 Cas9 및 gRNAs를 모두 포함하는 구조를 생성하는 또 다른 전략을 설명했습니다. 새로운 새로운 접근 방식을 통해 CRISPR/Cas는 추가 기능을 통합할 수 있습니다. 예를 들어, 더블 또는 트리플 녹아웃은 Cas927을발현하는 세포에 더 많은 sgRNA를 전달함으로써 달성될 수 있다. 설계 된 Cas13 단백질은 내인성 DNA28을방해하지 않고 RNA 분자를 표적으로 하고 소화합니다. CRISPR/Cas로 유전자를 노크하는 것 외에도 짧은 헤어핀 RNA(shRNA)는 표적 유전자발현(29)을안정적으로 노크하는 대안으로 사용될 수 있다. 모든 CRISPR/Cas 유전자 편집 방법에 대 한, 오프 타겟 분열 은 항상 고려 되어야 한다. 또한, 작은 간섭 RNA(siRNAs)는 과도 침묵 유전자 발현및 siRNA 농도가 세포분열(30)으로희석된다. 이 두 방법 모두 표적 유전자 발현을 부분적으로 억제합니다. 대조적으로, ectopic 유전자 발현은 또한 EndMT/EMT31도중 유전자 기능을 확인하기 위하여 이용됩니다. 이 접근법은 유전자의 강화 조절이 EndMT 반응을 유도하기에 충분한지 확인할 수 있습니다. 따라서 현재 EndMT의 잠재적 인 레귤레이터를 식별하고 확인하는 데 사용할 수있는 수많은 기술 전략이 있습니다. 게다가, 전사 분석은 EndMT 관련 레귤레이터의 식별 및 포괄적인 분석에 좋은 선택이 될 수 있습니다. EndMT의 변조를 조사하기 위해 다양한 보완 적 접근 법을 사용하는 것이 좋습니다.
요약하자면, TGF-β 유도된 EndMT 동안 기능적 역할을 할 수 있는 요소를 식별하는 워크플로우를 도입했습니다. 이 방법은 또한 다른 자극 (즉, 사이토카인, 성장 인자, 기계적 자극, 세포 세포 상호 작용)이 EndMT를 조절 할 수 있는지 여부를 연구하는 데 사용할 수 있으며, TGF-β 다른 자극과 상호 작용할 수 있습니다. 또한, 우리는 특정 유전자가 TGF-β 유도 EndMT에 필요한지 여부를 해명하기 위하여 CRIPSR/Cas 유전자 편집을 사용하여 접근을 강조했습니다. 이러한 방법론을 설명하기 위해, 우리는 MS-1 세포에서 강력한 EndMT 유도자 TGF-β2를 사용했지만, 프로토콜은 다른 사이토카인 및 기타 세포 유형에 적응될 수 있다. 우리는 설명된 이 상세한 프로토콜이 미래 EndMT 관련 연구를 위한 디딤돌역할을 할 것으로 기대합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
연구는 CGC.NL 네덜란드 심장 혈관 연구 이니셔티브에 의해 지원되었다: 네덜란드 심장 재단, 대학 의료 센터의 네덜란드 연맹, 건강 연구 및 개발을위한 네덜란드 조직, 왕립 네덜란드 과학 아카데미 그랜트파에드라 - 영향 (http://www.phaedraresearch.nl)에 수여. JM은 중국 장학위원회의 지원을 받고 있습니다. GSD는 AFM-텔레톤 [22379], FOP 이탈리아, 라 펀다시오 라 마라토 드 TV3 (#202038)의 보조금에서 트램폴린 보조금에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | Pall Corporation, USA | 4614 | |
| 10× T4 DNA ligase buffer | Thermofisher Scientific, USA | B69 | |
| 12 mm round glass slice | Knittel Glass,Germany | VD10012Y1A.01 | |
| 20 mL syringe | BD Eclipse, USA | 300629 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Vector Laboratories, USA | H-1200 | VECTASHIELD Antifade Mounting Media |
| AA19_PLKO vector | Dr. M Gonçalves, Leiden University Medical Center, Netherlands | Gift | |
| Ampicillin | Serva Electrophoresis, USA | 1339903 | |
| Anti-Mouse IgG | GE Healthcare, USA | NA931 | |
| Anti-Rabbit IgG | Cell signaling, USA | 7074 | |
| Agarose | Roche, Switzerland | 11388991001 | |
| Blasticidin | Invitrogen, USA | R21001 | |
| Buffer O (10X) | Thermofisher Scientific, USA | BO5 | |
| BveI (Bspm1) | Thermofisher Scientific, USA | ER 1741 | |
| Confocal microscope | Leica Microsystems, Germany | SP8 | |
| DMEM | Thermo Fisher Scientific, USA | 11965092 | |
| Donkey anti-rat Alexa 488 | Invitrogen, USA | A21208 | |
| FBS | Thermo Fisher Scientific, USA | 16000044 | |
| Formaldehyde | Thermo Fisher Scientific, USA | 28908 | |
| Inverted microscope | Leica Microsystems, Germany | DMi8 | |
| Goat anti-rabbit Alexa 594 | Invitrogen,USA | A11012 | |
| LabNed Plasmid kit | LabNed, USA | LN2400004 | |
| MS-1 cell line | American Type Culture Collection (ATCC) | ||
| Nail polish | HEMA, Netherlands | Transparent | |
| Pecam-1 antibody | Becton Dickinson,USA | 553370 | |
| PEI | Polysciences, USA | 23966-1 | |
| PLV-Cas9 plasmid | Sigma-Aldrich, USA | Cas9BST-1EA | |
| Puromycin | Sigma-Aldrich, USA | P9620 | |
| QIAquick gel extraction kit | Qiagen, Germany | 28706 | |
| Sm22a antibody | Abcam, UK | ab14106 | |
| Snail | Cell signaling, USA | 3879 | |
| T4 DNA ligase | Thermofisher Scientific, USA | EL 0014 | |
| TC20 automated Cell Counter | Bio-Rad, USA | 1450102 | |
| Human TGF-β2 | Joachim Nickel, University of Wurzburg | Gift | Other commercial recommendation: 302-B2, R&D systems |
| Triton X-100 | Merck, USA | 1086031000 | |
| SB431542 | Tocris Bioscience, UK | 1614 | |
| Tris | Roche, Switzerland | 11814273001 |
참고문헌
- Ma, J., Sanchez-Duffhues, G., Goumans, M. -. J., Ten Dijke, P. TGF-β-induced endothelial to mesenchymal transition in disease and tissue engineering. Frontiers in Cell and Developmental Biology. 8, (2020).
- Piera-Velazquez, S., Jimenez, S. A. Endothelial to mesenchymal transition: role in physiology and in the pathogenesis of human diseases. Physiological Reviews. 99 (2), 1281-1324 (2019).
- Sánchez-Duffhues, G., de Vinuesa, G. A., ten Dijke, P. Endothelial-to-mesenchymal transition in cardiovascular diseases: developmental signaling pathways gone awry. Developmental Dynamics. 247 (3), 492-508 (2018).
- Evrard, S. M., et al. Endothelial to mesenchymal transition is common in atherosclerotic lesions and is associated with plaque instability. Nature Communications. 7 (1), 1-16 (2016).
- Qiao, L., et al. Endothelial fate mapping in mice with pulmonary hypertension. Circulation. 129 (6), 692-703 (2014).
- Zeisberg, E. M., et al. Endothelial-to-mesenchymal transition contributes to cardiac fibrosis. Nature Medicine. 13 (8), 952-961 (2007).
- Clere, N., Renault, S., Corre, I. Endothelial-to-mesenchymal transition in cancer. Frontiers in Cell and Developmental Biology. 8, (2020).
- Saito, A. EMT and EndMT: regulated in similar ways. The Journal of Biochemistry. 153 (6), 493-495 (2013).
- Bolós, V., et al. The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions: a comparison with Snail and E47 repressors. Journal of Cell Science. 116 (3), 499-511 (2003).
- Aird, W. C. Endothelial cell heterogeneity. Cold Spring Harbor Perspectives in Medicine. 2 (1), 006429 (2012).
- Yang, J., et al. Guidelines and definitions for research on epithelial-mesenchymal transition. Nature Reviews Molecular Cell Biology. , 1-12 (2020).
- Doudna, J. A., Charpentier, E. The new frontier of genome engineering with CRISPR-Cas9. Science. 346 (6213), (2014).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Arbiser, J. L., et al. Oncogenic H-ras stimulates tumor angiogenesis by two distinct pathways. Proceedings of the National Academy of Sciences USA. 94 (3), 861-866 (1997).
- MA, J., et al. TGF-?-induced endothelial to mesenchymal transition results from a balance between SNAIL and ID factors. Frontiers in Cell and Developmental Biology. 182 (9), (2021).
- Chen, X., et al. Probing the impact of chromatin conformation on genome editing tools. Nucleic Acids Research. 44 (13), 6482-6492 (2016).
- Hunter, F. W., et al. Functional CRISPR and shRNA screens identify involvement of mitochondrial electron transport in the activation of evofosfamide. Molecular Pharmacology. 95 (6), 638-651 (2019).
- Mao, Y., et al. Lentiviral vectors mediate long-term and high efficiency transgene expression in HEK 293T cells. International Journal of Medical Sciences. 12 (5), 407 (2015).
- Liu, S., et al. Deubiquitinase activity profiling identifies UCHL1 as a candidate oncoprotein that promotes TGFβ-induced breast cancer metastasis. Clinical Cancer Research. 26 (6), 1460-1473 (2020).
- Medici, D., et al. Conversion of vascular endothelial cells into multipotent stem-like cells. Nature Medicine. 16 (12), 1400 (2010).
- Kokudo, T., et al. Snail is required for TGFβ-induced endothelial-mesenchymal transition of embryonic stem cell-derived endothelial cells. Journal of Cell Science. 121 (20), 3317-3324 (2008).
- Dong, J., et al. Single-cell RNA-seq analysis unveils a prevalent epithelial/mesenchymal hybrid state during mouse organogenesis. Genome Biology. 19 (1), 1-20 (2018).
- Oatley, M., et al. Single-cell transcriptomics identifies CD44 as a marker and regulator of endothelial to haematopoietic transition. Nature communications. 11 (1), 1-18 (2020).
- Halaidych, V., et al. Inflammatory responses and barrier function of endothelial cells derived from human induced pluripotent stem cells. Stem Cell Reports. 10 (5), 1642-1656 (2018).
- Li, Y., Lui, K. O., Zhou, B. Reassessing endothelial-to-mesenchymal transition in cardiovascular diseases. Nature Reviews Cardiology. 15 (8), 445-456 (2018).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Grav, L. M., et al. One-step generation of triple knockout CHO cell lines using CRISPR/Cas9 and fluorescent enrichment. Biotechnology Journal. 10 (9), 1446-1456 (2015).
- Abudayyeh, O. O., et al. RNA targeting with CRISPR-Cas13. Nature. 550 (7675), 280-284 (2017).
- Paddison, P. J., et al. Cloning of short hairpin RNAs for gene knockdown in mammalian cells. Nature Methods. 1 (2), 163-167 (2004).
- Reynolds, A., et al. Rational siRNA design for RNA interference. Nature Biotechnology. 22 (3), 326-330 (2004).
- Lourenço, A. R., et al. C/EBPɑ is crucial determinant of epithelial maintenance by preventing epithelial-to-mesenchymal transition. Nature Communications. 11 (1), 1-18 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유