Method Article
TGF β媒介性間葉転移(EndMT)およびCRISPR/Cas9遺伝子編集を用いたEndMTエフェクターの機能評価
要約
細胞形態変化を観察し、免疫蛍光染色を用いたEndMT関連マーカー変化の発現を調べることにより、内皮細胞におけるTGF-β2誘導EndMTを調べる方法について述べる。CRISPR/Cas9遺伝子編集は、TGF-β2誘導EndMTにおけるその役割を調査するためにカタツムリをコードする遺伝子を枯渇させるために記述され、使用された。
要約
特定の外部の手掛かりおよび特定の転写因子の活性化に対して、内皮細胞は間葉様表現型に分化することができ、間葉間質遷移(EndMT)に内皮転移と呼されるプロセスである。新たな結果は、EndMTが線維症や癌などの複数のヒト疾患に因果関係を示すことを示唆している。さらに、内皮由来間葉系細胞は、組織再生手順に適用され、さらに様々な細胞タイプ(骨芽細胞および軟骨細胞)に分化することができる。したがって、EndMTの選択的操作は、臨床的可能性を有し得る。上皮間葉転移(EMT)と同様に、EndMTは、カタツムリやスラグを含むいわゆるEndMT転写因子(EndMT-TF)の発現を刺激する分泌されたサイトカイン変換成長因子β(TGF-β)によって強く誘導することができる。これらのEndMT-TFは、それぞれ間葉系および内皮タンパク質のレベルを上下に調節します。ここでは、TGF β誘導EndMT in vitroを調べる方法について説明し、TGF誘導EndMTにおける特定のTFsの役割を調べるプロトコルβ含む。これらの技術を用いて、TGF-β2がマウス膵臓微小血管内皮細胞(MS-1細胞)におけるEndMTを刺激し、クラスター化された定期的に間隔をあけられた短いパリンドロミック反復(CRISPR)/CRISPR関連タンパク質9(Cas9)媒介性遺伝子編集を用いて カタツムリの 遺伝的枯渇がこの現象を促進するという証拠を提供する。このアプローチは、内皮生物学の潜在的な調節因子を尋問するモデルとして役立ち、ヒト疾患における潜在的な適用を伴うEndMTの新しい調節因子を同定するために遺伝的または薬理学的スクリーンを実行するために使用することができる。
概要
間葉間遷移(EndMT)は、多様な生理学的および病理学的プロセス1,2に関連した多段階および動的生物学的現象である。EndMTの内皮細胞は徐々に間葉性を獲得しながら、その内皮形質を失う3;したがって、緊密に圧縮され、よく組織化された内皮細胞は、細長い間葉様細胞に分化する。EndMTの形態学的変化は、特定の遺伝子およびタンパク質の発現における変化と一致する。一般に、血管内皮(VE)カドヘリン、血小板/EC接着分子-1(CD31/Pecam-1)を含む内皮特性を維持するタンパク質の発現が低下します。同時に、α平滑筋アクチン(α-Sma)や平滑筋タンパク質22α(Sm22α)などの間葉機能に関連するタンパク質が蓄積する。新たな結果は、出生後EndMTが、癌、心臓線維症、肺動脈性高血圧(PAH)、アテローム性動脈硬化症(AS)、臓器線維症、2、4、5、6、7などのヒト疾患の発症に寄与することを実証した。EndMTの根本的なメカニズムとEndMTプロセスを導く方法のより深い理解はEndMT関連疾患および再生医療のための新しい治療方法を提供する。
TGF-βは、主なEndMT誘導因子の1つであり、他の既知の関与因子には、Wnt/β-カテニン、ノッチ、およびいくつかの炎症性サイトカイン1が含まれる。細胞コンテキストはTGF-βによって引き起こされる応答の鍵であるため、TGF-βの相互作用は、他のEndMT促進シグナルとの関係は、TGF-βがEndMT応答を引き出すために関連する。TGF-β細胞表面I型およびII型セリン/スレオニンキナーゼ受容体の活性化に際して、細胞内の正規性スマド経路が活性化される。TGF-β受容体媒介型Smad2/3は、核に転写するSmad4とヘロマー複合体を形成し、そこでEndMT関連転写因子の発現をアップレレートする。上皮間葉転移(EMT)と同様に、カタツムリ、スラグ、ツイスト、Zeb1およびZeb2などの転写因子は、TGF-βシグナル伝達によって誘導され、EndMT8における遺伝子再プログラミングに寄与する。
カタツムリは、EndMTの重要な要因として頻繁に識別されています。カタツムリは、細胞細胞接着タンパク質をコードする遺伝子のプロモーターに結合し、それらの転写を抑制し、これは間葉系タンパク質の発現の増強によって相殺される9。内皮細胞は非常に異種集団を含み、EndMTに対する多様な細胞外刺激の相対的な影響は、内皮細胞コンテキストまたは細胞タイプ10の間で異なることがある。EMT との類似性により、EMT と EndMT8の両方のメカニズムを調査するのに役立つ方法論もあります。この点に関して、EMT国際協会(TEMTIA)は、最終的にEMT/EndMT11の発生を実証するための補完的な技術の必要性を強く強調しています。
ここでは、TGF β誘導EndMTプロセスを監視し、可視化する方法について説明します。免疫蛍光染色は、EndMTプロセスが発生するかどうかの指標として使用される標的タンパク質/マーカーの発現変化に関する基本的な情報を提供します。さらに、免疫蛍光染色は、タンパク質/マーカーおよび細胞形態の局在を可視化することができる。TGF β媒介EndMTに関与する特定のTF(または他の上流または下流の調節因子)の潜在的な活性を研究するために、TF カタツムリ を例に使用して、クラスター化された定期的に間隔を合わせた短いパリンドローム反復(CRISPR)/CRISPR関連タンパク質9(Cas9)遺伝子編集を使用してプロトコルを記述する。Cas9は、細菌12におけるCRISPR配列を相補的に認識し、配列を切断するRNA誘導型DNAエンドヌクレアーゼである。CRISPR/Cas9システムは、インビトロおよびin vivo13で遺伝子工学を容易にするため、現在広く利用されています。単一ガイドRNA(sgRNA)によって指示され、異所性発現Cas9は、特定の遺伝子遺伝子座における事前選択された標的配列において二本鎖破断を発生させる。非相同末端加入(NHEJ)は、Cas9誘発ストランドブレイクを修復するために、ランダムなヌクレオチド挿入または欠失を介して行われ、それによって標的遺伝子の破壊および不活性化をもたらす。選択的なsgRNAを設計し、設計されたsgRNAを含むレンチウイルス適合ベクターを生成するための方法を詳細に述べる。その結果、安定した遺伝子枯渇した内皮細胞を効率的かつ信頼性の高い方法で生成することができる。
本研究では、マウス膵臓微小血管内皮細胞(MS-1)14をモデルとしてTGF-β2誘導EndMTプロセスを調べるモデルとして用いた。我々の以前の研究は、SnailがTGF-β2によって増加した主な転写因子であり、それによってEndMTがMS-1細胞15で誘導されることを実証した。CRISPR/Cas9遺伝子がMS-1細胞のカタツムリ発現をアブロゲートする際に、TGF-β2はEndMTを仲介できなかった。このワークフローは、他の(疑わしい)EndMT 関連遺伝子を研究するために適用できます。
プロトコル
1. TGF-β2によるエンドMTの誘導
- インキュベーター中の10%のウシ胎児血清(FBS)および100 U/mLペニシリン/ストレプトマイシン(5%CO2、37°C)を含むダルベックコの改変イーグル培地(DMEM)のMS-1細胞。すべての培養皿/プレートに0.1%のゼラチンを10分間コーティングしてから使用してください。
- MS-1細胞を1倍のリン酸緩衝生理食塩水(PBS)で静かに洗浄し、トリプシン-EDTA溶液(0.25%トリプシンと0.02%EDTA)を10cm皿に2mL加え、37°Cで2分間インキュベートして取り外します。続いて、5 mLの完全な培養培地を加え、反応を焼入れさせた。
- セル懸濁液を15mLチューブに移し、200 x g で遠心分離機を室温で3分間移動します。
- 上清を捨て、FBSとペニシリン/ストレプトマイシンを含む新鮮な培地の4mLで細胞を再懸濁します。セルの自動カウンタを使用してセルをカウントします。
- さらに培養するために、1cm2当たり1x103細胞をシードする。 たとえば、6 ウェルプレートの場合は 9.5 x 103細胞/ウェル、24 ウェルプレートの場合は 1.9 x 103細胞/ウェルのシードです。
- 細胞を一晩インキュベートして接着して回収し、TGF-β2でMS-1細胞を3日間刺激します。TGF-β2刺激の前にTGF-β受容体キナーゼ阻害剤SB431542(5μM)30分を加える。他のセルを車両(DMSO)で処理します。
注:0.1%ヒトウシ血清アルブミン(BSA)を含む4 mM HClにTGF-β2を溶解します。TGF-β2を含まないリガンドバッファーの同量をコントロールグループに加えます。TGF-β2濃度は、特定のアッセイに対して0.1-1 ng/mLに適合することができる。対応する図の表示を参照してください。 - 3日後、明視野イメージング(逆顕微鏡で)で細胞形態を調べ、免疫蛍光染色(ステップ2参照)を行い、EndMT関連マーカーの変化を評価します。生物学的トリプライケートを得るために少なくとも3つの独立した実験を行う。
2. 免疫蛍光染色
- 培養したMS-1細胞(ステップ1.2)をトリプシン化し、24ウェルプレートの底部に置かれた0.1%w/vゼラチンコーティング12mmの丸いカバーガラスに1.9 x 103 細胞を再播種します。
- 細胞を一晩培養した後、TGF-β2(最終濃度1 ng/mL)を3日間細胞に加える。リガンド緩衝液を含む培地を陰性対照として用いる。
- ペカム-1およびSm22α染色を行う。
- TGF-β2(またはコントロール)で細胞を3日間刺激した後、培地を取り出し、1x PBSで細胞を洗浄します。
- 各ウェルに4%ホルムアルデヒドの300 μLを加え、室温で10分間インキュベートして細胞を固定します。インキュベーション後に1x PBSで3倍洗浄します。
- 1x PBSに0.1%トリトンX-100の300 μLを各ウェルに加え、室温で10分間インキュベートして細胞を透過させます。インキュベーション後、トリトンX-100溶液を取り出し、細胞3xを1x PBSで洗浄します。
- 室温で45分間PBSで3%ウシ血清アルブミン(BSA)で細胞をブロックします。
- マウスタンパク質を認識する一次Pecam-1およびSm22α抗体を1x PBSで1:500希釈します。その後、固定細胞を一次抗体で室温で45分間インキュベートします。
- 1x PBSで3倍洗浄した後、ロバの抗ラットAlexa 488とヤギの抗ウサギAlexa 594を含む1000x希釈二次抗体で細胞を室温で45分間インキュベートします。
メモ:染色中にサンプルを光から保護します。 - 3xを1x PBSですすいだ後、細胞で播種したカバーガラスをスライド上に4',6-ジミディノ-2-フェニリンドール(DAPI)を含む取り付け媒体の滴に下に置き、核を染色します。
- カバーガラスの周囲を透明なマニキュアで固定し、4°Cで保管します。
- 共焦点顕微鏡で代表的な画像を取得します。レーザー波長を405nm、488nm、552 nmに設定し、それぞれDAPI、Pecam-1、Sm22αを検出します。チャンネルごとに、すべての写真は同じ設定と露出時間で撮影されました。生物学的トリプライケートを得るために少なくとも3つの独立した実験を行う。
3. CRISPR/Cas9編集を使用して カタツムリ をノックアウト
- マウス カタツムリをターゲットにした2つの独立したsgRNAを設計します。
- オンラインツールCHOPCHOP(https://chopchop.cbu.uib.no/)とCas-OFFinder(http://www.rgenome.net/cas-offinder/)をターゲット遺伝子の名前と種に応じて使用してsgRNAを設計します。
- Cas-OFFinder(http://www.rgenome.net/cas-offinder/)とCHOPCHOP(http://chopchop.cbu.uib.no/)を含む2つの独立したアルゴリズムを使用して、カタツムリをターゲットに設計されたsgRNAのオフターゲット活動を予測します。
- 最低の活動状態の 2 つの sgRNA を選択します。 BveIカット部位を使用して、2つの相補的なsgRNAオリゴを設計します。センスオリゴは5'-ACCG-3'から始まり、アンチセンスオリゴは5'-AAAC-3'から始まります。
- オリゴを更に使用するために商業的に合成するように注文する。
- 相補ガイドRNAオリゴを BveI消化AA19 pLKO.1-puro.U6.sgRNAにクローン化します。BveI-stuffer レンチウイルスベクタープラスミドを生成する AA19 pLKO.1-カタツムリ-sgRNA16.
- AA19 pLKO.1-puro.U6.sgRNAをカットします。BveBveI酵素16とのI-stufferプラスミド.AA19 pLKO.1-puro.U6.sgRNAの2 μgを混ぜます。BveI-stufferプラスミド、5 μLの10xバッファO、および5 μLのBveI酵素を加え、滅菌水を加え、全容量50μLに達します。
- 渦と簡単に反応ミックスをスピンダウン。反応を37°Cで1時間インキュベートする。
- 反応ミックスを1%アガロースゲルにロードし、1xトリス酢酸-EDTA(TAE、50x TAEストック:水に溶解したトリスベースの242 g、氷酢酸57.1 mL、500 mM EDTA(pH 8.0)溶液の100 mLを加え、Lバッファーの全分離に水を加える。
- ゲルから骨格断片を切り取り、メーカーのプロトコルに従ってゲル抽出キットで分離し( 材料表を参照)、40 μL溶出バッファー(EB)で骨格を溶出します。
- 100 pmol/μLセンスオリゴの5 μLと100 pmol/μLアンチセンスオリゴの5 μLを1 Mトリス-HCl(pH 8.0)の1 μLと混合し、滅菌水を加え、gRNAオリゴをアニールするために合計100 μLに達します。100°Cで5分間インキュベートし、チューブをアルミホイルで覆います。その後、溶液を室温までゆっくりと冷却し、さらに挿入物として使用します。
- 相補的なgRNAオリゴと BveI消化された骨格をリゲートするには、単離された BveIの1μLを混ぜてAA19 pLKO.1-puro.U6.u6.sgRNA.BveI-stufferバックボーンと2μLのインサート(希釈1:300)を2μLのT4 DNAリガリガバッファーと1μL 滅菌水を加えて合計20μLに達し、チューブを短時間回転させ、室温で4時間インキュベートしてさらに使用します。
注:ライゲーションを行う場合は、2つのコントロールグループが含まれていることを確認してください。1つの対照群では、1μLの単離された骨格、10x T4 DNAリガーゼバッファーの2μL、T4 DNAリガーゼの1μLを混合し、滅菌水を加え、オリゴDNAを含まない合計20μLに達する。他の対照群では、1μLの単離された骨格と2μLの10x T4 DNAリガーゼバッファーを混合し、無菌水を加え、合計20μLに達しますが、アニールオリゴとT4リガーゼは含みません。これら2つの対照ライゲーションは、次の変換ステップにおける反応の背景を決定し、ライゲーションの効率を示すために使用されます。
- 反応混合物を有能なTOP10 大腸菌に変換します。
- 有能なTOP10 大腸菌を収集します。80°Cの冷凍庫から細胞を、氷の上で解凍します。
- 50 μLの有能な細胞に2 μLのライゲーション混合物を加え、チューブを氷の上に30分間置きます。
- 42°Cで30sのヒートショックを受けます。チューブを氷の上に2分間置きます。
- 950 μLの新鮮なリソジニーブロス(LB)培地を混合物に加え、37°Cで60分間激しく振ります。
- セルを回転させ、温かいアンピシリン(100 μg/mL)抵抗LBプレートに入れなさい。プレートを一晩37°Cでインキュベートします。
- プラスミド中のgRNAオリゴの挿入が成功したことを確認します。
- LB培地を含むアンピシリン(100 μg/mL)の1 mLでプレートに3〜5コロニーを選び、30°Cで一晩振ります。
- メーカーのプロトコルに従ってプラスミドキットでプラスミドDNAを分離し、U6プロモータープライマー5'-GAGGGCCTATTCCCATATT -3'で配列し、gRNAオリゴの挿入に成功したことを確認します。
4. カタツムリノックアウトMS-1細胞を生成する
- Cas9またはカタツムリターターゲットgRNAを運ぶレンチウイルス粒子を生成します。
- 培養HEK 293T細胞は、10%のウシ胎児血清と100U/mLペニシリン/ストレプトマイシンを14.5cmの皿(またはT75フラスコ)の培養器(5%CO2、37°C)に含む。
- 9.9 μgの標的遺伝子プラスミド、AA19 pLKO.1-カタツムリ-sgRNAまたはpLV-Cas917 プラスミドを混合し、 ヘルパープラスミド3.5μgのpCMV-VSVG(胞性口内炎ウイルスのGタンパク質をコードするVSV-G)、6.6μgの回転応答性元素プラスミドpMDLg-RRE(GagおよびPolをコードする)、および5.0μgのpRSV-REV(符号化)を無料培地の500μLで示した。50μLのポリエチレンイミン(PEI)(2.5mg/mL)を500μLの無血清培地で再懸濁します。プラスミドとPEI製剤を上下にピペットしてそっと混ぜます。室温で20分間、混合物をインキュベートします。
- ステップ4.1.2から80%コンフルエント細胞の混合物培地を10%FBSおよび100 U/mLペニシリン/ストレプトマイシンを有するDMEM培地を含む14.5cmの皿(またはT75フラスコ)に混合物培地を加えることによってHEK 293T細胞をトランスフェクト。HEK293T細胞は、簡単にトランスフェクションされ、ウイルス18の高レベルを生成するので使用されます。
- トランスフェクトしたHEK 293T細胞を微生物学および生物医学研究所(BMBL)のバイオセーフティに移し、24時間培養します。
- BMBLの実験室では、FBSおよびペニシリン/ストレプトマイシンを含む新鮮な完全なDMEMの12 mLにHEK 293T細胞からのトランスフェクション媒体を置き換えます。細胞を24時間培養する。
- 20 mLシリンジと0.45 μmのフィルターで媒体を収集し、フィルターします。コンディショルションされた培地を15 mLのポリプロピレンチューブに移します。
- FBSとペニシリン/ストレプトマイシンを含む新鮮な完全なDMEMの12 mLをHEK 293T培養皿と培養物にさらに24時間加えます。
- 20 mLシリンジと0.45 μmのフィルターで媒体を収集し、フィルターします。コンディショルションされた培地を15 mLのポリプロピレンチューブに移します。レンチウイルス粒子を含む培地を-80°Cで1mLのアリコートとして保存し、さらに使用してください。
- PLV-Cas9ウイルスにMS-1細胞を感染させる。
- レンチウイルス感染前に24時間6ウェルプレートでウェルあたり1 x 105 MS-1細胞をシードします。
- pLV-Cas9ウイルスの凍結アリコートを37°Cの水浴で解凍する。
- 1 mLのウイルス培地と、FBSとペニシリン/ストレプトマイシンを含む新鮮なDMEM培地を1 mL混合します。感染効率を高めるために、ポリブレンを培地(最終濃度を10μg/mL)に加えます。
- 6ウェルプレートから培地を取り出し、ウイルス/ポリブレンミックス培地と交換し、感染後24時間培養器内の細胞を培養し、培地を新鮮な培地に置き換え、さらに24時間培養します。
注: 常にコントロール グループとして感染していない状態に保ちます。 - 感染したグループおよびコントロールグループから培地を吸引し、4 μg/mLブラストシジンでDMEM培地に交換します。
- プレートを37°Cインキュベーターに戻し、細胞を1週間培養した。未感染細胞はブラストシジンの効果により死ぬ。生存細胞が80%の細胞合流に達したときに分割し、ブラストシジジンの選択を続ける。
- CAS9に対する抗体を用いたウェスタンブロッティング(Cas9の分子量は約160kDa)を用いてMS-1細胞におけるCas9の発現を確認する。
- pLV-Cas9 MS-1細胞に2つの独立したgRNAレンチウイルスを別に感染させる。
- 感染前に24時間の6ウェルプレートに1ウェルあたりシード1 x 105 pLV-Cas9 MS-1細胞。
- 2つのgRNAレンチウイルスを有する細胞に別々に感染するために4.2に記載されているのと同じプロトコルに従ってください。
- gRNAウイルスによる感染の24時間後、培地をリフレッシュし、細胞を別の24時間培養する。
- 培地を1 μg/mLのピューロマイシンで交換してください。プレートを37°Cインキュベーターに戻し、細胞を1週間培養した。感染していない細胞が完全に死んでいることを確認します。彼らは80%の合流に達したときに細胞を分割し、ピューロマイシンの選択を続けます。
- Snailに対する抗体を用いたウェスタンブロット法により、MS-1細胞のカタツムリのノックアウトを確認します(カタツムリの分子量は約35kDa)。
結果
TGF-β2は、エンドMTを誘導し、MS-1内皮細胞のカタツムリ発現を刺激する
TGF-βは、エンドMTを誘導する最大の可能性を持つサイトカインの一つです。.Ms-1細胞をTGF-β2(1ng/mL)で3日間処理した後、内皮MS-1細胞は石畳状の構造を失い、紡錘形の間葉様細胞に分化する(図1A)15。さらに、細胞表現型変化を誘導する際のTGF-β2の役割を検証するために、TGF-β2刺激前の低分子アクチビン受容体様キナーゼ(ALK)4/ALK5/ALK7阻害剤SB431542をTGF-β2刺激19に先ず処理した。SB431542は完全にTGF-β2誘導細胞形態変化を取り込んだ(図1A)。TGF-β2誘導EndMTプロセスを、EndMT関連マーカーの発現の変化を研究することによってさらに調査した。図1Bに示すように、内皮タンパク質Pecam-1はTGF-β2刺激後に強力に減少し、間葉因子Sm22αはTGF-β215によって深くアップレギュレートされた。これらのデータは、TGF-β2がMS-1細胞においてEndMTをトリガしたという考え方と一致している。次に、カタツムリおよびスラッグ発現に対するTGF-β2の効果を調べた。図1Cに示すように、カタツムリはTGF-β2によって著しくアップレギュレートされたが、スラッグ発現はMS-1細胞15におけるTGF-β2の影響を受けなかった。3つの独立した実験からのカタツムリの発現の定量化を図1Dに示す。
MS-1内皮細胞におけるCRISPR/Cas9によるカタツムリの枯渇
カタツムリはTGF-β2によって誘導され、TGF-β2媒介EndMTに関与している可能性が高いため、MS-1細胞で遺伝的にカタツムリ発現を枯渇させるCRISPR/Cas9遺伝子編集を行いました。我々は、カタツムリの枯渇はTGF-β2誘導EndMTを阻害するのに十分であると仮定した。図2Aに示すように、2つのステップでSnailノックアウト細胞を生成しました。まず、Cas9は、レンチウイルスを発現するCas9をMS-1細胞に感染させることにより異所性発現した。pLV-Cas9コンストラクトにはブラストシジン耐性カセットがあるため、ブラストシジン耐性細胞におけるウェスタンブロット解析によりCas9の発現を確認した(図2D)。その後、カタツムリを特異的に標的とするsgRNAを導入し、そのタンパク質発現を破壊しました。この手順はまた、ピューロマイシン発現カセットを含むAA19 pLKO.1-Snail-sgRNA構築物を運ぶレンチウイルス粒子による感染によっても行われた。Cas9発現細胞は再びレンチウイルスを含むgRNAに感染し、さらにピューロマイシンで選択した。マウスカタツムリを標的とする2つの相補的なsgRNAオリゴは、予測された低いオフターゲット活性で設計された(図2B,C)。MS-1細胞を発現するCas9に2つの独立したカタツムリsgRNAを導入した後、カタツムリタンパク質発現をアブロゲートした(図2D)15.
カタツムリの欠乏は、MS-1細胞におけるTGF-β2誘導の終末MTを阻害する
TGF-β2媒介EndMTにおけるカタツムリの機能を実証するために、カタツムリが枯渇した細胞でEndMTアッセイを行い、それを親のMS-1細胞と比較した。図3Aに示すように、Snailのノックアウトは、MS-1細胞15におけるTGF-β2によって駆動される線維芽細胞様細胞形態を阻害するのに十分であった。さらに、TGF-β2媒介性Pecam-1の減少およびSm22αの増強は、カタツムリ枯渇MS-1細胞において完全に遮断された。要約すると、SカタツムリがMS-1細胞におけるTGF-β2媒介EndMTにとって重要であることを示した(図3B)15。
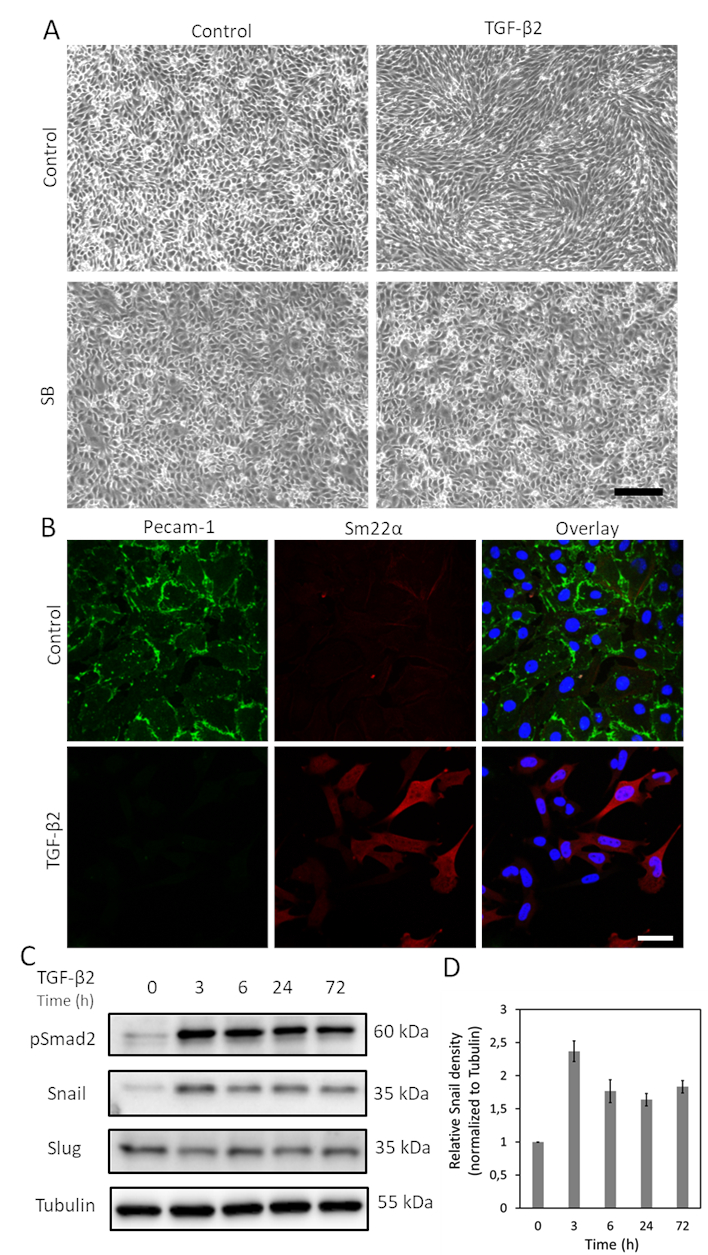
図 1.TGF-β2は、MS-1細胞においてエンドMTおよびカタツムリの発現を誘導する。A. TGF-β2および/またはTGF-β型I型キナーゼ阻害剤SB-431542の細胞形態に及ぼす影響TGF-β2(1 ng/mL)および/またはSB-431542(SB、5 μM、TGF-β2の30分前)で2日間投与したMS-1細胞の明視野画像。スケールバーは200 μmBを表 します。 TGF-β2(1 ng/mL)を含む培地で培養したMS-1細胞におけるPecam-1(緑色)およびSm22α(赤色)の免疫蛍光染色を3日間用いた。核は青色(DAPI)で視覚化されます。スケールバー:50 μm. C. TGF-β2刺激MS-1細胞の全細胞ライセートを有するウェスタンブロット。スラグではなくカタツムリの発現は、以前にMa et al15で報告されたように、TGF-β2刺激によって増強された。 D. 3つの独立したウェスタンブロット実験の結果を統合することにより、カタツムリ発現の定量化。 この図の大きなバージョンを表示するには、ここをクリックしてください。
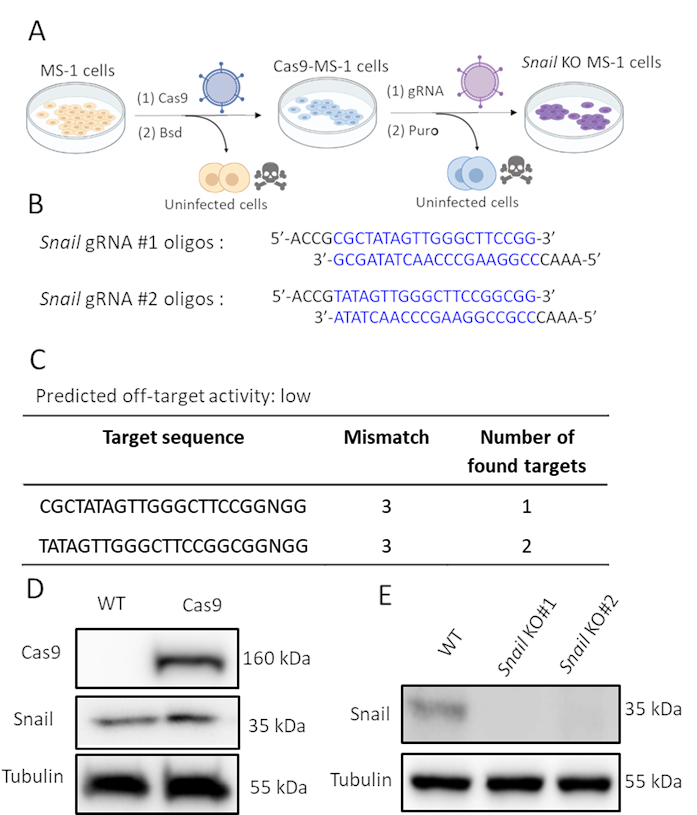
図 2.CRISPR-Cas9遺伝子編集によるカタツムリの枯渇。A.カタツムリノックアウト細胞を生成する方法を描いたスキーム。Bsd: ブラストシジン.プロ:プロマイシン。B.CHOPCHOP(http://chopchop.cbu.uib.no/)およびCas-OFFinder(http://www.rgenome.net/cas-offinder/)を用いてカタツムリを標的とする2つの独立したsgRNAのオリゴヌクレオチド。C.Cas-OFFinder(http://www.rgenome.net/cas-offinder/)を使用したカタツムリの2つのgRNAの予測オフターゲット活性。D.野生型(WT)およびCas9発現過大発現MS-1におけるCas9およびカタツムリ発現をウェスタンブロット解析で測定した。E.ウェスタンブロット分析で測定したMS-1細胞内の2つの独立したgRNAを有するカタツムリのノックアウト。我々はMa et al15で同様の結果を報告した。この図の大きなバージョンを表示するには、ここをクリックしてください。
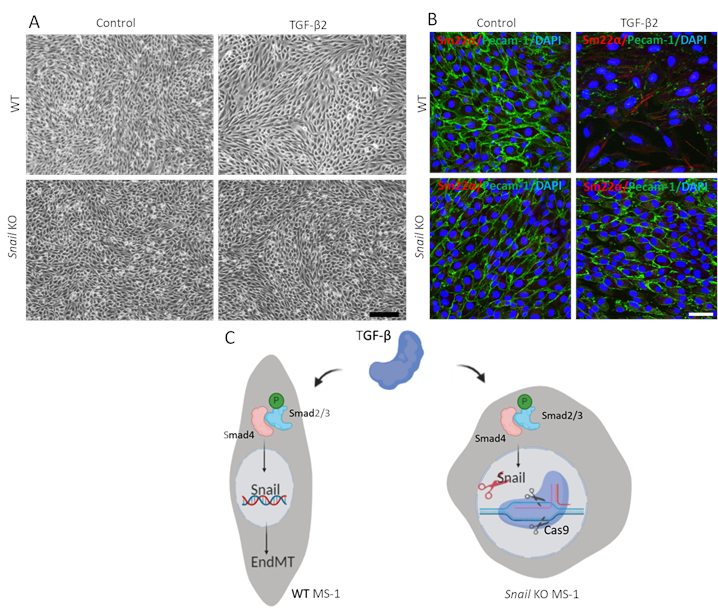
図 3.カタツムリの遺伝的枯渇は、MS-1細胞におけるTGF-β2誘導EndMTを阻害する。A.野生型(WT、上部パネル)およびカタツムリ(下パネル)細胞で3日間TGF-β2(0.1 ng/mL)で治療したMS-1細胞のブライトフィールド画像。スケールバーは、200 μm B. Pecam-1 (緑色)、Sm22α (赤)および核 (青) の TGF-β2 (1 ng/mL) を含む培地で培養した MS-1 細胞の免疫蛍光染色を 3 日間表します。カタツムリの枯渇は、Pecam-1のTGF-β2誘発性減少およびSm22α発現の増加を伴う。スケールバーは、MS-1細胞におけるTGF β誘導EndMTに対するカタツムリノックアウトの効果を模式的に表す50μm.TGF-β Smad2/3をリン酸化することによってスマド経路を介してカタツムリの発現を刺激し、さらにEndMTを駆動します。CRISPR/Cas9ベースの遺伝子編集を使用してカタツムリをノックアウト β仲介EndMT.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
このプロセスを調節し、EndMT関連疾患を標的にする上で、EndMTのメカニズムを理解することは重要です。ここでは、TGF-β誘導EndMTアッセイを実行し、TGF-βトリガーEndMTにおけるEndMT-TFカタツムリの役割を問い合める方法を、CRISPR/Cas9媒介した細胞からのカタツムリの安定な遺伝子枯渇を行う方法について説明した。CRISPR/Cas9アプローチを用いたカタツムリの枯渇は、MS-1細胞におけるTGF-β2駆動EndMTの消耗に成功した(図3C)。TGF-βのようなサイトカインがEndMTに及ぼす影響を調べ、その後、細胞の形態学的変化と内皮および間葉マーカー発現の変化に応じてEndMTの発生を評価した。TGF-β2は、転写因子カタツムリの発現の強い増加を伴うMS-1細胞においてEndMTを強く誘導した。TGF-βによって誘導されるEndMT-TFsは、種または組織特異的内皮細胞の種類によって異なる場合がある。例えば、SnailがSlugではなくSlugはMS-1細胞のTGF-βによって有意にアップレギュレートされ、ヒト臍帯静脈内皮細胞(HUVECs)では、TGF-β 20への暴露後にカタツムリとスラグの両方が増加することを観察した。
細胞形態変化を調べ、EndMT関連マーカー発現の変化を調べることにより、EndMTプロセスの範囲を2つの方法で評価した。TGF-βの3日間の曝露後、細胞は一貫した形態学的変化およびEndMT関連マーカーの発現の変化を有するEndMTを受けた。ここで行った免疫蛍光染色に加えて、マーカーの変異は、タンパク質発現レベルでのウェスタンブロッティングまたはqRT-PCR(リアルタイム定量逆転写PCR)によって、遺伝子レベル21でモニタリングすることもできる。このプロトコルで示した 2 つの時間とコスト削減の方法に加えて、EndMT を調べる方法は他にもあります。例えば、処理細胞と対照細胞の間で内皮および間葉関連遺伝子の発現レベルを比較するために(RNAシーケンシングまたはqPCRによる)トランスクリプトーム解析を行い、EndMT22,23を正確に評価することができる。さらに、EndMTはしばしばバリア機能の安定的な損失を伴い、インピーダンス分光法24によって評価することができる。さらに、EndMT由来細胞による幹細胞様物の取得のさらなる証明が検討され得る。例えば、特定の培養条件下では、EndMT間葉様細胞は、骨芽細胞、軟骨細胞、葉細胞または(筋)線維芽細胞にさらに分化することができる。したがって、中皮系譜に属する異なる細胞型への分化を確認するための追加解析(すなわち、遺伝子発現およびマトリックス染色)は、EndMT由来細胞の多能性を実証するのに有用である。最後に、EndMT評価方法は、インビトロ研究に限定されるものではなく、生体内またはエキビボ器官におけるEndMTといくつかの疾患との関係を調査するために外挿することができる。この意味で、内皮特異的な系統トレース戦略の使用は、EndMT関連研究25に広く拡張されている。
EndMT中のカタツムリの役割を調べるには、この研究ではCRISPR/Cas9遺伝子編集がこの遺伝子をノックアウトするために使用されました。データは、TGF-β2がカタツムリ欠損MS-1細胞のEndMTを仲介できなかったことを示した。この観察は、SカタツムリがMS-1細胞におけるTGF-β2誘導EndMTに不可欠であることを示した。独立したU6駆動のsgRNA発現カセットを使用して、Cas9が カタツムリ を標的とする特定のsgRNAを導入しました。この方法に加えて、Ranら26 は、Cas9とgRNAの両方を含む構築物を生成するために、SgRNAオリゴ配列をCas9足場にクローニングするための別の戦略を説明した。新しい新しいアプローチは、CRISPR /Casが追加機能を組み込むことを可能にします。たとえば、二重または三重のノックアウトは、Cas927を発現する細胞に多くのsgRNAを送達することによって達成することができる。設計されたCas13タンパク質標的および内因性DNA28を破壊することなくRNA分子を消化する。CRISPR/Casを用いて遺伝子をノックアウトする以外に、短いヘアピンRNA(shRNA)を、安定的に標的遺伝子発現29をノックダウンする代替手段として使用することができる。CRISPR/Cas遺伝子の編集方法はすべて、オフターゲット切断を常に考慮する必要があります。また、小さな干渉RNA(siRNA)は一過性の沈黙遺伝子発現およびsiRNA濃度を細胞分割30で希釈する。これらの方法はいずれも、標的遺伝子発現を部分的に抑制する。対照的に、異所性遺伝子発現は、EndMT/EMT31の間に遺伝子機能を検証するためにも使用される。このアプローチは、遺伝子のアップレギュレーションがEndMT応答を引き出すのに十分かどうかを判断できます。したがって、現在、EndMT の潜在的な規制を特定して検証するために使用できる多数の技術戦略があります。さらに、トランスクリプト分析は、EndMT関連レギュレータの同定と包括的な分析に適した選択肢となります。EndMT の変調を調査するために、さまざまな補完的なアプローチを使用することをお勧めします。
要約すると、TGF β誘発型の EndMT の間に機能する可能性のある要因を特定するワークフローを導入しました。この方法は、他の刺激(すなわち、サイトカイン、成長因子、機械的刺激、細胞-細胞相互作用)がEndMTを調節できるかどうか、および他の刺激とTGF-βの相互作用を研究するためにも使用することができる。さらに、TGF誘導EndMTに特定の遺伝子が必要かどうかを解明するためにCRIPSR/Cas遺伝子編集を用いたアプローチβ強調した。この方法論を例示するために、MS-1細胞において強力なEndMT誘導体TGF-β2を用いたが、プロトコルは他のサイトカインおよび他の細胞タイプに適応することができる。我々は、この詳細なプロトコルが今後のEndMT関連研究の足掛かりとなることを期待する。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、オランダ心臓財団、オランダ大学医療センター連盟、オランダ保健研究開発機構、オランダ王立科学アカデミー助成金(http://www.phaedraresearch.nl))の CGC.NL とオランダの心臓血管研究イニシアチブによって支援されました。JMは中国奨学金協議会の支援を受け、支援を受け付け、支援を受け付け、中国奨学金協議会の支援をGSDは、AFMテレソン[22379]、FOPイタリアからのトランポリン助成金、ラ・フンダシオ・ラ・マラト・デ・TV3(#202038)からの助成金によって支えられます。
資料
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | Pall Corporation, USA | 4614 | |
| 10× T4 DNA ligase buffer | Thermofisher Scientific, USA | B69 | |
| 12 mm round glass slice | Knittel Glass,Germany | VD10012Y1A.01 | |
| 20 mL syringe | BD Eclipse, USA | 300629 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Vector Laboratories, USA | H-1200 | VECTASHIELD Antifade Mounting Media |
| AA19_PLKO vector | Dr. M Gonçalves, Leiden University Medical Center, Netherlands | Gift | |
| Ampicillin | Serva Electrophoresis, USA | 1339903 | |
| Anti-Mouse IgG | GE Healthcare, USA | NA931 | |
| Anti-Rabbit IgG | Cell signaling, USA | 7074 | |
| Agarose | Roche, Switzerland | 11388991001 | |
| Blasticidin | Invitrogen, USA | R21001 | |
| Buffer O (10X) | Thermofisher Scientific, USA | BO5 | |
| BveI (Bspm1) | Thermofisher Scientific, USA | ER 1741 | |
| Confocal microscope | Leica Microsystems, Germany | SP8 | |
| DMEM | Thermo Fisher Scientific, USA | 11965092 | |
| Donkey anti-rat Alexa 488 | Invitrogen, USA | A21208 | |
| FBS | Thermo Fisher Scientific, USA | 16000044 | |
| Formaldehyde | Thermo Fisher Scientific, USA | 28908 | |
| Inverted microscope | Leica Microsystems, Germany | DMi8 | |
| Goat anti-rabbit Alexa 594 | Invitrogen,USA | A11012 | |
| LabNed Plasmid kit | LabNed, USA | LN2400004 | |
| MS-1 cell line | American Type Culture Collection (ATCC) | ||
| Nail polish | HEMA, Netherlands | Transparent | |
| Pecam-1 antibody | Becton Dickinson,USA | 553370 | |
| PEI | Polysciences, USA | 23966-1 | |
| PLV-Cas9 plasmid | Sigma-Aldrich, USA | Cas9BST-1EA | |
| Puromycin | Sigma-Aldrich, USA | P9620 | |
| QIAquick gel extraction kit | Qiagen, Germany | 28706 | |
| Sm22a antibody | Abcam, UK | ab14106 | |
| Snail | Cell signaling, USA | 3879 | |
| T4 DNA ligase | Thermofisher Scientific, USA | EL 0014 | |
| TC20 automated Cell Counter | Bio-Rad, USA | 1450102 | |
| Human TGF-β2 | Joachim Nickel, University of Wurzburg | Gift | Other commercial recommendation: 302-B2, R&D systems |
| Triton X-100 | Merck, USA | 1086031000 | |
| SB431542 | Tocris Bioscience, UK | 1614 | |
| Tris | Roche, Switzerland | 11814273001 |
参考文献
- Ma, J., Sanchez-Duffhues, G., Goumans, M. -. J., Ten Dijke, P. TGF-β-induced endothelial to mesenchymal transition in disease and tissue engineering. Frontiers in Cell and Developmental Biology. 8, (2020).
- Piera-Velazquez, S., Jimenez, S. A. Endothelial to mesenchymal transition: role in physiology and in the pathogenesis of human diseases. Physiological Reviews. 99 (2), 1281-1324 (2019).
- Sánchez-Duffhues, G., de Vinuesa, G. A., ten Dijke, P. Endothelial-to-mesenchymal transition in cardiovascular diseases: developmental signaling pathways gone awry. Developmental Dynamics. 247 (3), 492-508 (2018).
- Evrard, S. M., et al. Endothelial to mesenchymal transition is common in atherosclerotic lesions and is associated with plaque instability. Nature Communications. 7 (1), 1-16 (2016).
- Qiao, L., et al. Endothelial fate mapping in mice with pulmonary hypertension. Circulation. 129 (6), 692-703 (2014).
- Zeisberg, E. M., et al. Endothelial-to-mesenchymal transition contributes to cardiac fibrosis. Nature Medicine. 13 (8), 952-961 (2007).
- Clere, N., Renault, S., Corre, I. Endothelial-to-mesenchymal transition in cancer. Frontiers in Cell and Developmental Biology. 8, (2020).
- Saito, A. EMT and EndMT: regulated in similar ways. The Journal of Biochemistry. 153 (6), 493-495 (2013).
- Bolós, V., et al. The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions: a comparison with Snail and E47 repressors. Journal of Cell Science. 116 (3), 499-511 (2003).
- Aird, W. C. Endothelial cell heterogeneity. Cold Spring Harbor Perspectives in Medicine. 2 (1), 006429 (2012).
- Yang, J., et al. Guidelines and definitions for research on epithelial-mesenchymal transition. Nature Reviews Molecular Cell Biology. , 1-12 (2020).
- Doudna, J. A., Charpentier, E. The new frontier of genome engineering with CRISPR-Cas9. Science. 346 (6213), (2014).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Arbiser, J. L., et al. Oncogenic H-ras stimulates tumor angiogenesis by two distinct pathways. Proceedings of the National Academy of Sciences USA. 94 (3), 861-866 (1997).
- MA, J., et al. TGF-?-induced endothelial to mesenchymal transition results from a balance between SNAIL and ID factors. Frontiers in Cell and Developmental Biology. 182 (9), (2021).
- Chen, X., et al. Probing the impact of chromatin conformation on genome editing tools. Nucleic Acids Research. 44 (13), 6482-6492 (2016).
- Hunter, F. W., et al. Functional CRISPR and shRNA screens identify involvement of mitochondrial electron transport in the activation of evofosfamide. Molecular Pharmacology. 95 (6), 638-651 (2019).
- Mao, Y., et al. Lentiviral vectors mediate long-term and high efficiency transgene expression in HEK 293T cells. International Journal of Medical Sciences. 12 (5), 407 (2015).
- Liu, S., et al. Deubiquitinase activity profiling identifies UCHL1 as a candidate oncoprotein that promotes TGFβ-induced breast cancer metastasis. Clinical Cancer Research. 26 (6), 1460-1473 (2020).
- Medici, D., et al. Conversion of vascular endothelial cells into multipotent stem-like cells. Nature Medicine. 16 (12), 1400 (2010).
- Kokudo, T., et al. Snail is required for TGFβ-induced endothelial-mesenchymal transition of embryonic stem cell-derived endothelial cells. Journal of Cell Science. 121 (20), 3317-3324 (2008).
- Dong, J., et al. Single-cell RNA-seq analysis unveils a prevalent epithelial/mesenchymal hybrid state during mouse organogenesis. Genome Biology. 19 (1), 1-20 (2018).
- Oatley, M., et al. Single-cell transcriptomics identifies CD44 as a marker and regulator of endothelial to haematopoietic transition. Nature communications. 11 (1), 1-18 (2020).
- Halaidych, V., et al. Inflammatory responses and barrier function of endothelial cells derived from human induced pluripotent stem cells. Stem Cell Reports. 10 (5), 1642-1656 (2018).
- Li, Y., Lui, K. O., Zhou, B. Reassessing endothelial-to-mesenchymal transition in cardiovascular diseases. Nature Reviews Cardiology. 15 (8), 445-456 (2018).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Grav, L. M., et al. One-step generation of triple knockout CHO cell lines using CRISPR/Cas9 and fluorescent enrichment. Biotechnology Journal. 10 (9), 1446-1456 (2015).
- Abudayyeh, O. O., et al. RNA targeting with CRISPR-Cas13. Nature. 550 (7675), 280-284 (2017).
- Paddison, P. J., et al. Cloning of short hairpin RNAs for gene knockdown in mammalian cells. Nature Methods. 1 (2), 163-167 (2004).
- Reynolds, A., et al. Rational siRNA design for RNA interference. Nature Biotechnology. 22 (3), 326-330 (2004).
- Lourenço, A. R., et al. C/EBPɑ is crucial determinant of epithelial maintenance by preventing epithelial-to-mesenchymal transition. Nature Communications. 11 (1), 1-18 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved