Method Article
إجراء استئصال القحف لتصور الأنشطة العصبية في قرن آمون من الفئران Behaving
In This Article
Summary
توضح هذه المقالة إعداد نافذة تصوير مصنوعة خصيصا تكملها قنية التسريب وزرعها على منطقة CA1 في قرن آمون في الفئران.
Abstract
تصوير الأنشطة العصبية في قرار خلية واحدة في الحيوانات يتصرف مستيقظا هو نهج قوي جدا للتحقيق في وظائف الدائرة العصبية في نظم علم الأعصاب. ومع ذلك، فإن ارتفاع امتصاص وتناثر الضوء في أنسجة الثدييات يحد من التصوير داخل الجسم في الغالب إلى مناطق الدماغ السطحية، مما يترك مناطق الدماغ العميق، مثل قرن آمون، بعيدة المنال لإجراء المجهر البصري. في هذا الفيديو، نعرض إعداد وزرع نافذة التصوير المصنوعة خصيصا لتمكين التصوير المزمن في الجسم الحي لمنطقة فرس النهر الظهري CA1 في الفئران التي تتصرف بشكل ثابت. يتم استكمال النافذة المصنوعة خصيصا بقنية ضخ تسمح بالتسليم المستهدف لناقلات الفيروس والأدوية إلى منطقة التصوير. من خلال الجمع بين هذا الإعداد والتصوير على نطاق واسع المجال، قمنا بتسجيل طويل الأجل لنشاط الخلايا العصبية باستخدام مؤشر الكالسيوم الفلوري من مجموعات فرعية كبيرة من الخلايا العصبية في الفئران behaving على مدى عدة أسابيع. كما أظهرنا إمكانية تطبيق هذا الإعداد للتصوير الجهد مع قرار ارتفاع واحد. سمحت المؤشرات المشفرة وراثيا عالية الأداء لنشاط الخلايا العصبية وكاميرات CMOS العلمية بالتصور المتكرر للتفاصيل المورفولوجية دون الخلوية للخلايا العصبية الفردية بدقة زمنية عالية. كما نناقش مزايا والقيود المحتملة للطريقة الموصوفة وتوافقها مع تقنيات التصوير الأخرى.
Introduction
الحصين هو منطقة الدماغ الرئيسية المسؤولة عن التعلم والذاكرة1 وكذلك للملاحة المكانية2. ويرتبط ضمور فرس النهر مع الاضطرابات العصبية والنفسية التي تنطوي على فقدان الذاكرة والتدهور المعرفي3,4,5. في الفئران، قرن آمون هو نموذج راسخ جدا لدراسة المكانية والسياقية، والتعلم النقابي وتكوين الذاكرة على مستويات الخلوية والشبكة4،5. تتطلب الدراسات الميكانيكية للتعلم والذاكرة استجوابا طوليا للبنية العصبية والوظيفة في سلوك الفئران. التصوير الفلوري في تركيبة مع المجسات المشفرة وراثيا6 يوفر قدرات غير مسبوقة لتسجيلدينامياتالجهد الغشاء 7،8، عابري الكالسيوم9، والتغيرات الهيكلية10 على مجموعات فرعية كبيرة من الخلايا العصبية intravitally. ومع ذلك ، يتم إعاقة الوصول البصري إلى قرن آمون في الفئران من قبل القشرة ، والتي يمكن أن تصل إلى أكثر من 1 مم في السماكة. هنا ، وصفنا إجراء لتجميع جهاز تصوير مصنوع خصيصا وزرعه المزمن في رأس الماوس للوصول البصري على المدى الطويل إلى منطقة CA1 دون الإقليمية في قرن آمون الظهري في الفئران behaving. ضخ cannula متكاملة في زرع التصوير يسمح إدارة الفيروسات أو الأدوية مباشرة على الخلايا العصبية في مجال الرؤية. الإعداد الموصوف في تركيبة مع المجهر واسعة المجال تمكن التصوير المتكرر للمجموعات الفرعية الكبيرة من الخلايا العصبية في الفئران تتصرف على مدى فترات طويلة من الزمن. لقد استخدمنا هذا الإعداد للتعبير عن مؤشرات الكالسيوم والجهد المشفرة وراثيا في منطقة فرس النهر CA1 عن طريق الحقن المستهدف للفيروس المرتبط بال أدينو المؤتلف (rAAV) لتسجيلات نشاط الخلايا العصبية بدقة خلية واحدة. كما قمنا بتصوير الكالسيوم الطولي للمجموعات الفرعية العصبية المقابلة بدقة عالية في سلوك الحيوانات. بالإضافة إلى ذلك ، يتوافق هذا الإعداد مع المجهر متعدد الفوتون والتنظير الدقيق ، وبالتالي توسيع مجموعة أدوات تقنيات التصوير لدراسة شبكات الخلايا العصبية على المستويات الخلوية ودون الخلوية في الفئران behaving. وصفنا الخطوات الهامة واستكشاف الأخطاء وإصلاحها للبروتوكول. كما ناقشنا المزالق والقيود المحتملة للطريقة.
Protocol
تمت الموافقة على جميع الطرق المذكورة هنا من قبل اللجنة المؤسسية لرعاية الحيوانات واستخدامها (IACUC) في جامعة ويستليك.
1. زرع تجميع
ملاحظة: تجميع زرع التصوير بسيط تقنيا ويتطلب فقط العناصر المتاحة تجاريا(الشكل 1، انظر أيضا جدول المواد). يمكن تصنيع لوحات الرأس في متجر الآلات المحلي باستخدام ألواح الفولاذ المقاوم للصدأ أو التيتانيوم. نقترح إعداد مخزون من الغرسات المجمعة بالكامل قبل بدء العمليات الجراحية. بعد إجراء تجارب الجسم الحي ، يمكن استرداد الغرسات وإعادة استخدامها عدة مرات. في بعض الحالات، قد يتطلب فقط إعادة ربط قنية التسريب عن طريق لحام أو استبدال الزجاج الغطاء.
- إعداد جميع مكونات الأجهزة الرئيسية الستة لتجميع وتركيب غرسات التصوير(الشكل 1).
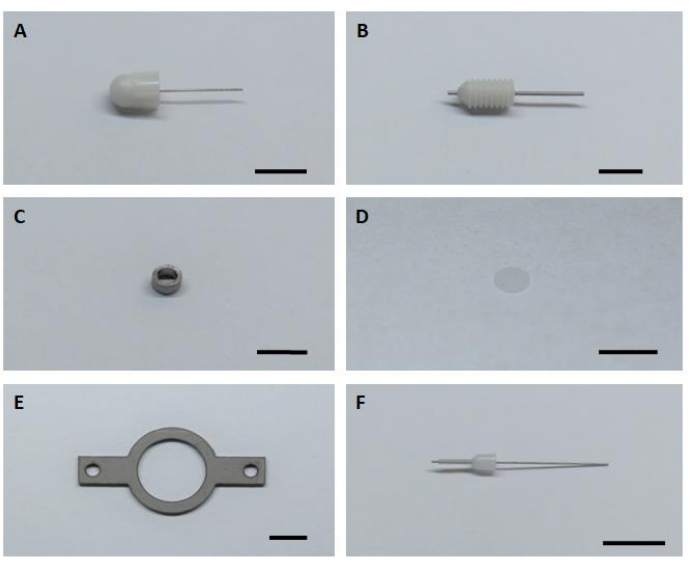
الشكل 1: ستة مكونات الأجهزة الرئيسية لتجميع وتركيب زرع التصوير. (أ) قنية وهمية. (ب) قنية الدليل. (ج) كانولا التصوير. (د) زجاج غطاء زجاجي. (ه) لوحة الرأس. (F) قنية داخلية. شريط المقياس: 5 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- قم بتشغيل آلة اللحام وسخنيها إلى درجة الحرارة المطلوبة.
ملاحظة: درجة الحرارة تعتمد على القصدير لحام المستخدمة. - البولندية السطح الجانبي للقنية التصوير باستخدام الصنفرة غرامة لإزالة طبقة الأكسدة، وبالتالي تسهيل لحام أقوى.
- ضبط موقف من قنية التصوير وقنية الحقن (قنية دليل مع القنية دمية إدراج) باستخدام يد العون (الشكل 2A، ب).
- باستخدام حقنة مع إبرة، وتطبيق كمية صغيرة من النوع المناسب من تدفق على بقعة الاتصال بين التصوير وحقن القنية لمدة 5 ثوان، ومن ثم إزالة القطيرات.
ملاحظة: لهذا الإعداد، استخدمنا تدفق المتاحة تجاريا التي تم تحديدها من قبل الشركة المصنعة لتكون لحام قطع الفولاذ المقاوم للصدأ والتصوير والتسريب القنية مصنوعة من الفولاذ المقاوم للصدأ. في حالة المواد الأخرى المستخدمة في تصنيع القنية ، يجب على المستخدم النهائي تحديد التدفق الذي يمكنه لحام المواد المختارة. - تذوب القصدير لحام وتطبيقه على بقعة اتصال تعامل مع تدفق (الشكل 2).
ملاحظة: تجنب زيادة القصدير لحام، كما أنها سوف تتطلب أكبر لا لزوم لها فغر القحف أثناء الجراحة.
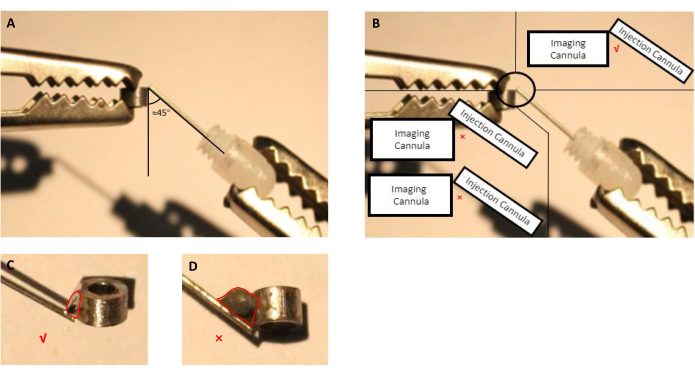
الشكل 2: التخطيطي لتجميع قنية الحقن، التي تتكون من قنية دليل مع قنية دمية إدراجها، مع قنية التصوير. (أ)يجب أن تكون الزاوية بين قنية الحقن وقنية التصوير قريبة من 45 درجة. (ب)يجب أن يكون طرف قنية الحقن على حافة قنية التصوير مباشرة. (ج) حجم مناسب من القصدير لحام المستخدمة لتصوير لحام والحقن cannulas (الخط الأحمر يشير إلى مخطط قطرة القصدير). (D) حجم غير مناسب من القصدير لحام التي ينبغي تجنبها أثناء إعداد زرع (الخط الأحمر يشير إلى الخطوط العريضة لقطرات القصدير). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- انتظر القصدير لحام لتهدئة. عادة، يستغرق عدة ثوان.
- تأكد من عدم حظر قنية الحقن عن طريق إدخال القنية الوهمية من كلا الاتجاهين.
- تطبيق الأشعة فوق البنفسجية علاج لاصق بصري على الجانب السفلي من قنية التصوير باستخدام مسواك أو إبرة حقنة 26 G.
- استخدام ملاقط غرامة لوضع بعناية غطاء الزجاج من حجم المقابلة لقنية التصوير.
ملاحظة: يجب أن يتم تحديد موضع الزجاج بدقة على قنية التصوير دون تحريك الزجاج كثيرا بمجرد لمسه للمادة اللاصقة البصرية. خلاف ذلك ، يحصل على الزجاج القذرة ، وبالتالي تقليل جودة التصوير. - علاج لاصق لمدة ساعة على الأقل من قبل 350-400 نانومتر الأشعة فوق البنفسجية الإضاءة من مصباح الأشعة فوق البنفسجية المحمولة القياسية.
ملاحظة: يجب أن تكون المادة اللاصقة المستخدمة شفافة بصريا. وإلا، فإنه سيتم تقليل جودة إطار التصوير.
تنبيه: تجنب التعرض للجلد والعين من خلال ارتداء نظارات وقفازات ومعطف مختبر يحمي الأشعة فوق البنفسجية. - غسل القنية في 70٪ الإيثانول والهواء الجاف، وتخزينها في وعاء معقم حتى الجراحة.
ملاحظة: من المهم جدا الحفاظ على الزجاج غطاء نظيفة وسليمة قدر الإمكان. لاصق البصرية المستخدمة مستقر كيميائيا في الإيثانول 70٪.
2. زرع نافذة
- خطوات التحضير قبل الجراحة
- تعقيم جميع الأدوات الجراحية في الأوتوكلاف.
- إعداد 1x PBS و 70٪ الإيثانول في اثنين من أطباق بيتري منفصلة.
- اختياريا: تطهير منطقة الجراحة باستخدام الأشعة فوق البنفسجية لمدة 20 دقيقة على الأقل قبل بدء العملية الجراحية.
ملاحظة: تعمل تحت ظروف أكثر عقيمة ممكنة سيؤدي إلى نجاح وطويلة الأمد (طالما 6 أشهر) نوافذ الجمجمة المغطاة بالزجاج. التلوث قد يؤدي إلى انخفاض شفافية النافذة أو التهاب شديد في معظم الحالات.
- إجراء جراحي
- تعقيم المنطقة الجراحية مع الإيثانول 70٪ الحق قبل الجراحة.
- وزن الحيوان وإعطاء جرعة ما قبل الجراحة من مسكن تحت الجلد وفقا لبروتوكول IACUC الحيوانية المعتمدة.
- تخدير الماوس مع isoflurane (4٪ للتحريض، 1.5-2٪ للحفاظ على، 0.3-0.5 لتر / دقيقة معدل تدفق الهواء). استخدم تقنية قرصة الذيل وقرصة إصبع القدم لضمان تخدير الحيوان بالكامل. لاحظ العلامات الحيوية للحيوان ، مثل التنفس ، SpO2، ومعدل ضربات القلب طوال مدة الإجراء.
- استخدم كريم التشذيب أو مزيل الشعر لإزالة الفراء من الجزء الخلفي من الرقبة حتى العينين.
- ضع الماوس في إطار ستيريوتاكسيك على لوحة التدفئة الجراحة (الحفاظ على 37 درجة مئوية). قم بتأمين الرأس بقضبان الأذن. دفع الرأس قليلا في جميع الاتجاهات للتأكد من تأمين الرأس بحزم.
- ضعي مرهم العين لمنع جفاف عيون الحيوان أثناء الجراحة.
- تعقيم موقع الجراحية مع بيتادين تليها 70٪ الإيثانول ثلاث مرات قبل إجراء شق.
- إزالة الجلد على الجزء العلوي من الجمجمة، بدءا من قطع أفقي على طول قاعدة الرأس، تليها قطعتين في الاتجاه الوردي، والوصول تقريبا الجفون، ثم اثنين من التخفيضات المائلة التي تتلاقى في خط الوسط.
- مع مسحتين من القطن المعقم ، اسحب النسيج الرابط ، وكذلك عضلات الجزء الخلفي من الرقبة ، إلى حواف الجمجمة.
ملاحظة: حاول تجنب إتلاف الأوعية الدموية (خاصة تلك المخفية في العضلات) أثناء التلاعب. - تطبيق قطرة من محلول الليدوكائين (~ 0.1 مل) على سطح periosteum لمدة 2 دقيقة لتجنب الألم المفرط. اختياريا للحد من الدماغ من تورم بعد إزالة الجمجمة, 0.1 مل من 1٪ ديكساميثازون يمكن حقن تحت الجلد.
- كشط بلطف كامل المنطقة المكشوفة من الجمجمة مع مشرط لخلق سطح جاف وخام يسمح الغراء وأسمنت الأسنان على الالتزام بشكل أفضل، وبالتالي مما أدى إلى زرع المزمن.
- ضع طرف الإبرة المثبتة على المحطة المجسمة على البريغما ، وحدد جميع الإحداثيات الثلاثة (AP: Anterior-Posterior ؛ ML: الوسيط الجانبي; DV: دورسال-فنترال) كما 0.
- ضع طرف الإبرة على اللامدا وانظر إذا كان تنسيق AP هو 0 لتأكيد أن موضع الرأس عمودي ، وكذلك إذا كان تنسيق ML هو 0 لتأكيد وضع الرأس أفقيا. إذا لم يكن الأمر كذلك، ضبط المقابض المقابلة على محطة ستيريوتاكسيك، حتى إحداثيات AP و ML على حد سواء داخل 0.1 ملم.
- تحريك غيض من الإبرة للعثور على النقاط المقابلة لاستئصال القحف ووضع علامة على مواقفها على الجمجمة باستخدام علامة غرامة. في حالة زرع قرن آمون، هناك 4 نقاط مع الإحداثيات التالية (AP: -0.68، ML: -2.0) (AP: -3.68، ML: -2.0) (AP: -2.18، ML: -0.5) و (AP: -2.18، ML: -3.5)11،وكذلك (AP: -4.0، ML: -2.0) للنقطة الأكثر caudal من قنية الحقن.
ملاحظة: يجب تعقيم العلامة المستخدمة في هذه الخطوة باستخدام إضاءة الأشعة فوق البنفسجية لمدة ساعة على الأقل قبل الجراحة. الإحداثيات الموضحة هنا هي لفئران C57BL/6J التي يبلغ عمرها 6-8 أسابيع. قد تختلف الإحداثيات بسبب اختلاف أعمار الفئران أو سلالاتها. - رسم دائرة على أساس أربع نقاط ملحوظ، فضلا عن الخطوط العريضة لمنطقة قنية الحقن على الجانب caudal من الدائرة (الشكل 3).
- استخدام الحفر الهوائية بسرعة 10،000 دورة في الدقيقة إلى بلطف "رسم" على طول المخطط ملحوظ على الجمجمة.
- حفر الجمجمة حتى يتم ترك طبقة رقيقة جدا من العظام، والتي عادة ما يبدأ في تذبذب تحت لمسة لطيف في المركز.
- تطبيق قطرة من برنامج تلفزيوني 1x عقيمة إلى مركز فغر القحف، ورفع رفرف العظام من الجمجمة مع ملقط طرف رقيقة جدا أو اثنين من الإبر 26 G تقترب من الجانبين المعاكس.
ملاحظة: سوف يساعد برنامج تلفزيوني إزالة قطعة من الجمجمة ومنع النزيف المحتمل من دورا12. - تطبيق برنامج تلفزيوني، تليها طموح لطيف من خلال إبرة حادة 26G عدة مرات لتنظيف سطح دورا.
- إزالة بلطف دورا، إما عن طريق الطموح أو عن طريق مقص العيون. تطبيق شفط لطيف (~-60kPa) ل أبتلاء القشرة، فضلا عن كالوسوم الجسم فوق قرن آمون.
ملاحظة: القشرة غالبا ما تكون أكثر صفراء من كالوسوم الجسم، وكالوسوم الجسم عادة ما يكون أكثر بياضا من قرن آمون. عادة ما يكون من السهل تمييز الكالوسوم بالألياف العصبية التي تسير في الاتجاهات الرأسية والأفقية عند ملاحظتها من الأعلى(الشكل 3).
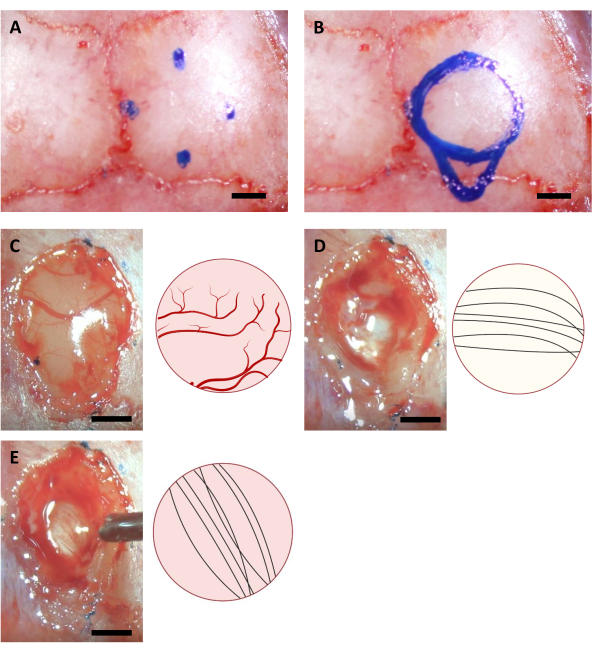
الشكل 3: إحداثيات ستيريوتاكسيك لموقع قرن آمون وعملية استئصال الدماغ. (أ) أربعة إحداثيات ل حواف منطقة استئصال القحف. (ب) منطقة استئصال القحف كاملة. (C-E) الصور التمثيلية التي تم الحصول عليها أثناء الجراحة (يسار) ورسمها التخطيطي (يمين) تشير إلى الألوان والاتجاهات المختلفة للألياف العصبية من (A) Cortex (B) Corpus Callosum ، و (C) قرن آمون مرئي أثناء استئصال القشرة. شريط المقياس: 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- النزيف في هذه المرحلة سيؤثر على رؤية أنسجة الدماغ في عملية استئصال القحف. تطبيق برنامج تلفزيوني 1x، تليها شفط لطيف، في حين قرصنة القشرة للتخلص من الدم.
ملاحظة: النزيف المستمر أمر لا مفر منه خلال هذه الخطوة، وإلى حد ما، النزيف المستمر هو علامة على ضغط الدم الطبيعي. على عكس زرع نافذة التصوير القشري ، فإن وجود الدم تحت النافذة البصرية مقبول لأنه سيتم مسحه بعد عدة أيام من الجراحة. إدراج قنية التصوير إلى التجويف المنشأ في أقرب وقت ممكن بعد اجتثاث القشرة هو الأمثل. - إذا كان استئصال القحف أكبر بمقدار <0.5 مم من قنية التصوير ، فقم بإنقاذ تركيب القنية إلى حد ما باستخدام ختم كويك سيل الإضافي قبل إصلاح الغرسة باستخدام SuperBond.
- إذا كان استئصال القحف أصغر بمقدار <0.5 مم من قنية التصوير ، فنقذ العملية الجراحية إلى حد ما عن طريق تشذيب حافة فغر القرنية باستخدام ملاقط ناعم أو مقص عيون لأن العظام المتبقية على حافة استئصال القحف أرق من الجمجمة نفسها نتيجة الحفر.
ملاحظة: لا يمكن إنقاذ الشقوق التي تتجاوز النطاقات التي تزيد عن 0.5 مم. وينبغي أن تتبع الإجراءات المقابلة في تلك الحالات إجراء الإنهاء وفقا لبروتوكول الحيوان.
- أدخل الغرسة برفق في عملية استئصال القحف.
- اضغط بقوة على رأس الغرسة مع إبرة على شكل حرف L لوضع النافذة البصرية للزرع في أقرب وقت ممكن إلى السطح المكشوف من قرن آمون. تطبيق برنامج تلفزيوني مرارا وتكرارا على الجمجمة حول زرع تليها شفط لإزالة الدم قدر الإمكان أثناء زرع الإدراج. ثم تطبيق طبقة رقيقة من كويك سيل بين زرع والجمجمة لمنع أسمنت الأسنان من اختراق تحت الجمجمة (الشكل 4).
- تأكد من وضع النافذة البصرية للزرع هو حق ضد قرن آمون لتجنب الدم أو تراكم السائل الأخرى تحت.
ملاحظة: النقطة الحرجة هي التأكد من أن الزجاج غطاء من قنية التصوير يتم وضعها الحق ضد قرن آمون، والتي قد تتطلب ضغط لطيف على رأس القنية أثناء عملية التثبيت وختم. ما إذا كان الجانب العلوي من قنية التصوير موازيا للجمجمة ليس أمرا حاسما للوصول البصري النهائي طالما يتم وضع النافذة البصرية ضد قرن آمون. - وفقا لمتوسط سمك القشرة فوق منطقة CA1 ، حافظ على السطح العلوي من قنية التصوير فوق سطح الجمجمة بمقدار ~ 0.5 مم لتسهيل تعلق القنية بالجمجمة(الشكل 4).
- تأكد من وضع النافذة البصرية للزرع هو حق ضد قرن آمون لتجنب الدم أو تراكم السائل الأخرى تحت.
- بمجرد شفاء كويك سيل ، والذي لا يستغرق عادة أكثر من ~ 1 دقيقة ، قم بتطبيق Super-Bond C&,B بالتساوي على سطح الجمجمة ، وسطح كويك سيل ، والسطح العلوي للغرسة.
- مرة واحدة يتم علاج سوبر بوند C&؛B، وتطبيق الراتنج قاعدة طقم الأسنان فوق سوبر بوند C&؛B، فضلا عن الجلد حول شق المحرز في بداية الجراحة.
ملاحظة: تتوفر أنواع بديلة من الاسمنت من موردين متعددين. اتبع إرشادات الشركة المصنعة المطابقة. - بعد علاج راتنج قاعدة طقم الأسنان ، ضع لوحة الرأس على الراتنج حول الغرسة وجعلها متحدة المركز مع قنية التصوير. تطبيق المزيد من الراتنج قاعدة طقم الأسنان حول وفوق لوحة الرأس لإصلاح موقفها. دعه يشفي لعدة دقائق.
- تجنب بناء طبقة سميكة من الاسمنت حول القنية لضمان وصول أفضل إلى نافذة التصوير مع عدسة الهدف (الشكل 4).
الشكل 4:رسم تخطيطي لعملية زرع النوافذ في (أ) عرض تاجي و(ب) برج القوس. (أ)لوحة الرأس؛ (ب) راتنج قاعدة طقم الأسنان؛ (ج)سوبرفوند؛ (د) كويك سيل؛ (ه) قنية التصوير؛ (و) قنية الحقن; (ز) القصدير لحام. (ج): الماوس مع زرع تثبيت بعد الجراحة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تمييع الراتنج قاعدة طقم الأسنان لتقليل لزوجته، مما يسمح لها لملء المحاذير التي يصعب الوصول إليها مع قضيب.
- ضع شريط مطاطي معزول بلطف فوق النافذة لحماية النافذة من التلوث المحتمل من الفراش الحيواني.
- عند الانتهاء من الجراحة ، حقن المخدرات المضادة للالتهابات تحت الجلد لمنع استجابة التهابية.
- ضع الحيوان في قفص دافئ حتى يتعافى من التخدير.
- تحقق من الحالة الصحية للفأرة لمدة 72 ساعة بعد الجراحة من خلال مراقبة السلوك العام. يتم حقن الدواء المضاد للالتهابات والمسكنات تحت الجلد لمدة يومين إلى ثلاثة أيام بعد الجراحة كل 24 ساعة لإطلاق الألم وتقليل الاستجابة الالتهابية.
ملاحظة: إجراءات الرصد البديلة والأدوية والجرعات ممكنة للرعاية بعد الجراحة، راجع بروتوكول الحيوان المعتمد من IUCAC للإجراء الدقيق. - تحقق من النافذة 5-7 أيام بعد الجراحة لمراقبة الأوعية الدموية تحت النافذة. في حالة وجود نافذة واضحة ، يكون الحيوان جاهزا لحقن الفيروس.
3. حقن الفيروسات
ملاحظة: عادة ما يتم حقن الفيروسات في 5-7 أيام بعد الجراحة. قبل حقن الفيروس، لا بد من التأكد من أن نافذة التصوير واضحة، وأنه من الممكن لمراقبة الأوعية الدموية في الدماغ(الشكل 5). في بعض الحالات، قد يستغرق الأمر ما يصل إلى 14-16 يوما لمسح النافذة، وهو أمر مقبول أيضا إذا لم يتم الكشف عن التهاب في الدماغ.
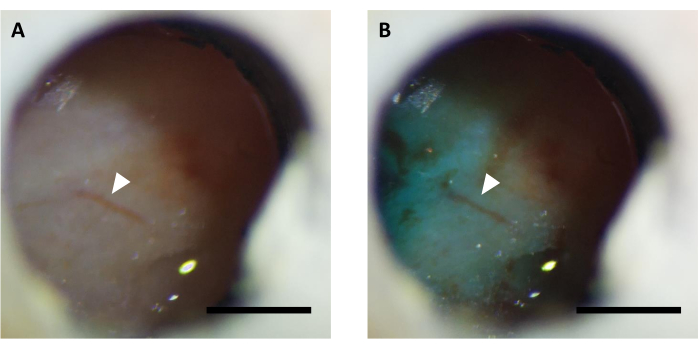
الشكل 5:صورة تمثيلية للنافذة البصرية (A) قبل و (ب) بعد حقن الفيروسات المكملة بصبغ FastGreen. السهم يشير إلى نفس بنية الأوعية الدموية. شريط المقياس: 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- إضافة سريع الأخضر محلول مخزون صبغة إلى حل الفيروسات، المخفف إلى التيتر المطلوب، في نسبة 1:9 في أنبوب PCR.
ملاحظة: يتم إضافة صبغة خضراء سريعة لتسهيل التصور من محلول الفيروس أثناء الحقن. - ربط أنابيب البولي ايثيلين مع الحقنة، ثم ملء الأنابيب مع النفط المعدني باستخدام مضخة حقنة.
- ربط القنية الداخلية إلى الطرف الآخر من الأنابيب، غرس وسحب الزيوت المعدنية عدة مرات للتأكد من أن القنية الداخلية ليست مسدودة.
- تخدير الحيوان مع isoflurane (4٪ للتحريض، 1.5-2٪ للحفاظ على، 0.3-0.5 لتر / دقيقة معدل تدفق الهواء)، وإصلاح الرأس في إطار ستيريوتاكسيك على لوحة التدفئة (الحفاظ على 37 درجة مئوية)، وتطبيق مرهم العين.
- سحب 600 nL من محلول الفيروس، وإزالة قنية وهمية وإدراج القنية الداخلية متصلة حقنة الحقن في cannula دليل، غرس الفيروس بسرعة 50 nL/min لمدة 10 دقائق في المجموع.
ملاحظة: تحقق مما إذا كانت الصبغة مرئية من خلال النافذة باستخدام مجسم لتأكيد حقن الفيروسات الناجحة (الشكل 5). - بعد الحقن، حافظ على اتصال القنية الداخلية لمدة 10 دقائق للسماح للفيروس بالانتشار تحت النافذة.
- إزالة بلطف القنية الداخلية من قنية دليل وتلخيص ذلك مع قنية وهمية.
- ضع الحيوان في قفص دافئ حتى يتعافى من التخدير.
ملاحظة: عادة، الفئران جاهزة للتصوير في 10-20 يوما بعد الحقن الفيروسي. مستوى التعبير والوقت تعتمد على الفيروس المصلي والمروج المستخدمة لدفع التعبير الجيني.
4. تصوير الفئران مستيقظا تحت المجهر واسعة المجال.
ملاحظة: لوحة الرأس المعدة توفر استقرار غير عادي لزرع التصوير، وبالتالي يسمح للتصوير الطولي في الفئران مستيقظا ويتصرف مع الحد الأدنى من القطع الأثرية الحركة.
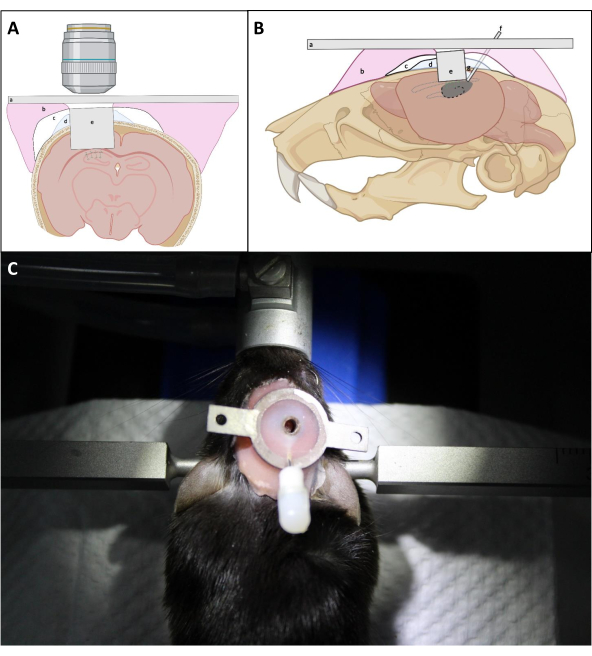
- حث الماوس مع isoflurane 4٪ لبضع دقائق، وإصلاح لوحة رأسه إلى شوكة الرأس، ومن ثم إصلاح شوكة الرأس إلى حلقة مفرغة.
ملاحظة: يتم تخصيص شوكة الرأس وجهاز المشي للسطلة المستخدمة في هذه الدراسة، يرجى الاطلاع على المواد الداعمة لملفات cad المقابلة. تحريض الماوس قبل تثبيت الرأس اختياري لأنه من الممكن أن تعود الحيوان لهذا الإجراء. - تحريك جهاز المشي تحت مرحلة المجهر ووضع النافذة البصرية تحت عدسة الهدف.
- استخدم عدسة موضوعية منخفضة التكبير للعثور على أفضل مجال رؤية (FOV) للتصوير الوظيفي ، ثم قم بالتبديل إلى عدسة هدف NA أعلى لتسجيل الأنشطة العصبية بدقة خلية واحدة.
ملاحظة: إذا كانت قنية الحقن لا تزال عقبة أمام العدسة الهدف لتحقيق مسافة عملها، استخدم مقص الأسلاك لقطع قنية الحقن من لوحة الرأس.
النتائج
في تصوير الجسم الحي للنشاط العصبي باستخدام مؤشر الكالسيوم المشفرة وراثيا. في المتوسط ، يبدأ التصوير في الجسم الحي بعد 3-4 أسابيع من الزرع إذا تم تحقيق مستوى كاف من التعبير المتحول. بحلول هذا الوقت ، عادة ما يتم حل الوذمة الدماغية والنزيف تماما ، ويمكن ملاحظة الأوعية الدموية في الدماغ بسهولة من خلال النافذة البصرية. هنا استخدمنا الإعداد الموصوف لأداء التسجيلات المتكررة للنشاط العصبي في منطقة فرس النهر الظهري CA1 في تصرف الفئران تحت المجهر الفلوري واسع المجال. لتسجيل نشاط الخلايا العصبية، استخدمنا مؤشر الكالسيوم المشفر وراثيا مشرق، واسمه NCaMP713،والذي يظهر حساسية الكالسيوم مماثلة والقرار الزمني لتلك التي GCaMP6s14. للتعبير عن مؤشر NCaMP7 في قرن آمون، حقننا فيروس rAAV/DJ-CAG-NCaMP7 باستخدام قنية التسريب وبدأنا تصوير خط الطول في 14 يوما بعد الحقن. لتسجيل نشاط الخلايا العصبية، استخدمنا عدسة هدف الهواء 10x NA 0.3 وكاميرا هاماماتسو أوركافوسيون SCMOS التي سمحت بالتصوير عند ~1.5x1.5 مم FOV بتردد يصل إلى 100 هرتز. كانت الفلورسينس الخضراء متحمسة من خلال LED 470 نانومتر متاح تجاريا باستخدام مجموعة فلتر GFP قياسية. متوسط عمق التصوير الذي تحقق في القناة الخضراء حوالي 50-120 ميكرومتر ، والذي يسمح بتسجيل نشاط الخلايا العصبية بشكل رئيسي في طبقة الأوريان والطبقات الهرمية. يمكن أن يصل عمق التصوير في القنوات القريبة من الأشعة تحت الحمراء إلى 200 ميكرومتر للوصول إلى الطبقات الأعمق من قرن آمون8. وكان متوسط وقت التسجيل لكل FOV 6-12 دقيقة، على الرغم من أن جلسات التصوير أطول بكثير ممكنة كما يتميز NCaMP7 من قبل phototability عالية للغاية ولوحظت أي سمية ضوئية يمكن الكشف عنها (الشكل 6).
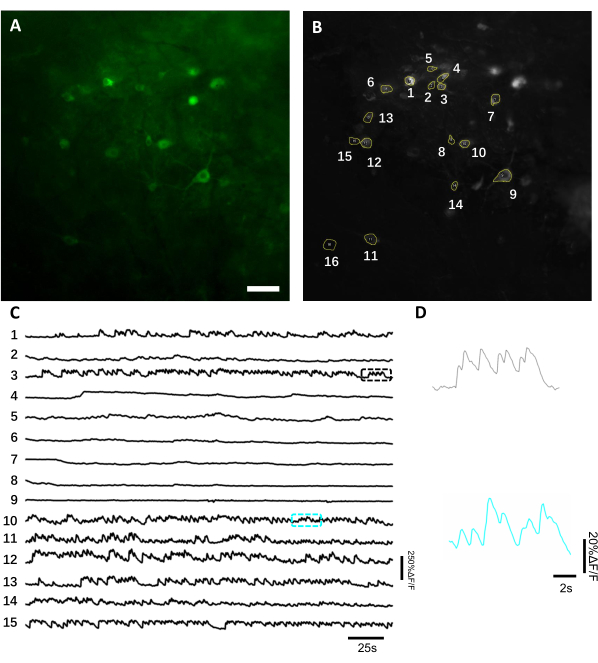
الشكل 6:تسجيل النشاط العصبي في الخلايا العصبية فرس النهر باستخدام مضان أخضر مؤشر الكالسيوم المشفرة وراثيا. (أ) FOV مختارة صورت تحت المجهر الفلوري واسعة المجال في القناة الخضراء. (ب) 15 ROIs المقابلة للخلايا العصبية واحد هو مبين في A واختار باستخدام إسقاط الانحراف المعياري للتسجيل كله. (ج) ممثل مضان آثار تجربة واحدة من الخلايا العصبية المختارة 15 في B. (D)عرض ممثل التكبير في 2 آثار الكالسيوم هو مبين في مربعات اللون المقابلة هو مبين في شريط مقياس C. ، 100 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
للحصول على آثار الفلورية ، تم تقسيم المناطق ذات الاهتمام (ROIs) المقابلة ل somas العصبية يدويا وتحليلها بواسطة برنامج ImageJ. قبل تصحيح حركة تحليل الصور ، لم تكن هناك حاجة إلى إجراءات شائعة بعد التسجيل في الحيوانات المستيقظة لأن مجموعات البيانات المكتسبة لم تعرض القطع الأثرية للحركة بسبب الاستقرار العالي لزرع التصوير. يتم تقديم تسجيل بصري تمثيلي لتجربة واحدة لأنشطة الخلايا العصبية من قرن آمون في فأر يتصرف مستيقظا في الشكل 6. 15 تم اختيار ROIs المقابلة لs somas الخلايا العصبية يدويا من نفس FOV هو مبين في الشكل 6B، وتظهر آثار مضان تجربة واحدة داخل كل عائد الاستثمار في الشكل 6C. ويبين الشكل 6D جزأين تمثيليين من آثار الفلورسينس من اثنين من ROIs مختلفة. قمنا بإجراء 4 جلسات تصوير متتالية لنفس FOV مع فترات 3 أيام. كان من الممكن تحديد وتصوير نفس الخلايا العصبية في بعض FOVs لمدة أسبوعين على الأقل (لم يتم إجراء جلسات تصوير أطول لهذه الدراسة ، ومع ذلك ، تم استخدام نفس التحضير لدراسة تصوير تصل إلى 6 أشهر في الفئران سابقا7؛ الشكل 7). في هذه الدراسة، استخدمنا AAV / DJ-CAG ناقلات، الذي كان يقود تعبيرا قويا عن جين الفائدة حتى بعد 21 يوما من تسليم الفيروس(الشكل التكميلي 1). التعبير المستمر معقدة على المدى الطويل تحديد نفس الخلايا العصبية بسبب زيادة خلفية مضان وظهور الخلايا العصبية الجديدة التي تعبر عن مؤشر الكالسيوم. لذلك ، يجب أن يكون اختيار النمط المصلي AAV والمروج لدفع التعبير الجيني المستهدف أحد الاعتبارات الهامة أثناء التصميم التجريبي على وجه الخصوص إذا كان التصوير الطولي لنفس المجموعة الفرعية من الخلايا العصبية مطلوبا. تسمح جودة التصوير بحل التشعبات القريبة وكذلك تصور الأوعية الدموية.
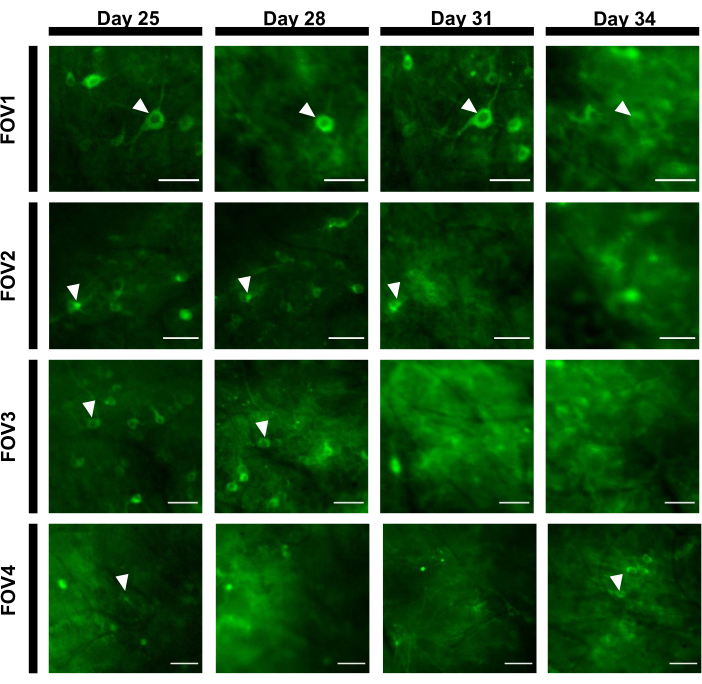
الشكل 7: تسلسل صورة من أربعة FOVs مختلفة من منطقة فرس النهر تتبع أكثر من 12 يوما. تم زرع الحيوان مع النافذة في اليوم 0 وتم حقنه بفيروس rAAV/DJ-CAG-NCaMP7 في اليوم السابع. تشير رؤوس الأسهم إلى الخلايا العصبية التي تم تعقبها داخل FOV. أشرطة المقياس: 80 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
في التصوير الحي للنشاط العصبي باستخدام جهاز استشعار الجهد المشفرة وراثيا.
في هذه الدراسة، استخدمنا أيضا جهاز استشعار الجهد المشفرة وراثيا رواية، واسمه SomArchon7،والذي يسمح للتصوير الجهد مع خلية واحدة واحد ارتفاع القرار في سلوكالحيوانات 7،8. للتعبير عن SomArchon ، حقننا فيروس rAAV / DJ-CAG-SomArchon باستخدام قنية التسريب وأجرينا تصوير الجهد في فأرة سلوك ثابتة الرأس بعد عدة أيام من الحقن. لتسجيل نشاط الخلايا العصبية، استخدمنا عدسة 40x NA 0.8 الهدف وكاميرا هاماماتسو أوركافوسيون SCMOS التي سمحت لنا بتصوير 150x40 ميكرومتر FOV بمعدل اكتساب يصل إلى 830 هرتز. يمكن تصوير بروتين GFP ، الذي هو جزء من بناء SomArchon لتسهيل تصور التعبير في النطاق المرئي للطيف ، بسهولة في القناة الخضراء (الإثارة LED عند 470/20 نانومتر ، الانبعاثات 525/50 نانومتر) لتحديد الخلايا ذات الأهمية للتصوير الجهد. تم إجراء تسجيلات الجهد البصري في قناة الأشعة تحت الحمراء القريبة (الإثارة بالليزر 637 نانومتر في 3.4 واط / ملم2، الانبعاثات 665 نانومتر تمريرة طويلة) مع 4 × 4 binning بمعدل اكتساب 830 هرتز. سجلنا النشاط العفوي للخلية العصبية فرس النهر في فأر مستيقظا مع متوسط SNR من 7 لكل عمل المحتملة (الشكل 8).
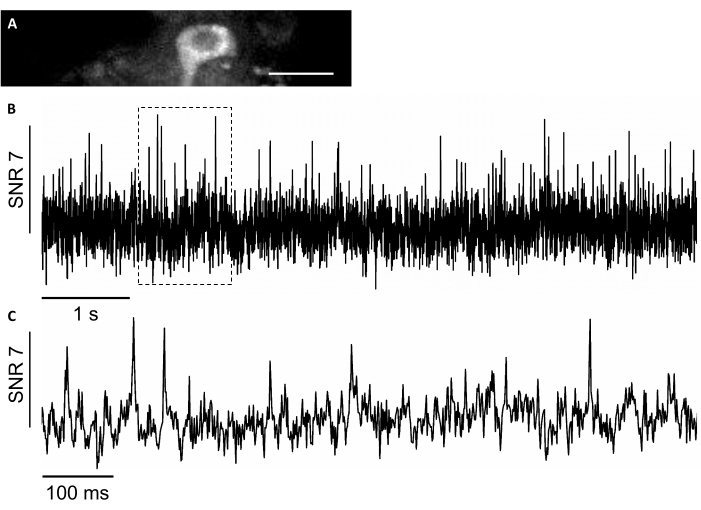
الشكل 8: تسجيل النشاط العصبي في الخلايا العصبية فرس النهر باستخدام مضان الأشعة تحت الحمراء القريبة من مؤشر الجهد المشفرة وراثيا SomArchon. (أ)FOV مختارة مصورة تحت المجهر الفلوري واسع المجال في قناة الأشعة تحت الحمراء القريبة. (ب) تتبع مضان تجربة واحدة من الخلايا العصبية في A. (C) عرض ممثل التكبير في تتبع الجهد في المربع المقابل هو مبين في شريط مقياس B. : 25 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
علم الأنسجة
بعد إجراء دراسة التصوير الوظيفي ، يتم استخدام تحليل ما بعد الوفاة لتأكيد الموضع الصحيح للزرع ، ومنطقة التعبير عن الفيروس ، وتوطين بروتين ذي أهمية في الخلايا العصبية المصورة. للتحقق النسيجي من التعبير عن الفيروس ووضع الزرع، تم فحص المقاطع التاجية من الدماغ الثابت PFA تحت المجهر الفلوري واسع المجال(الشكل 9A، C). تم استخدام مجهر كونفوجكال للحصول على صور عالية الدقة للخلايا العصبية الفردية التي تعبر عن مؤشر الكالسيوم ، وكذلك مؤشر الجهد(الشكل 9B، D). تم استخدام تلطيخ DAPI لتصور مورفولوجيا العام لشريحة الدماغ. بالإضافة إلى ذلك ، يمكن تقييم شرائح الدماغ باستخدام الكيمياء المناعية للتحقق من الإصابة بخلايا الأستروغليز أو الدبقية الناجمة عن زرع النافذة والتعبير الفيروسي. أظهرت دراساتنا السابقة أن الإجراء لم يحفز جليوسيس ملحوظ7.
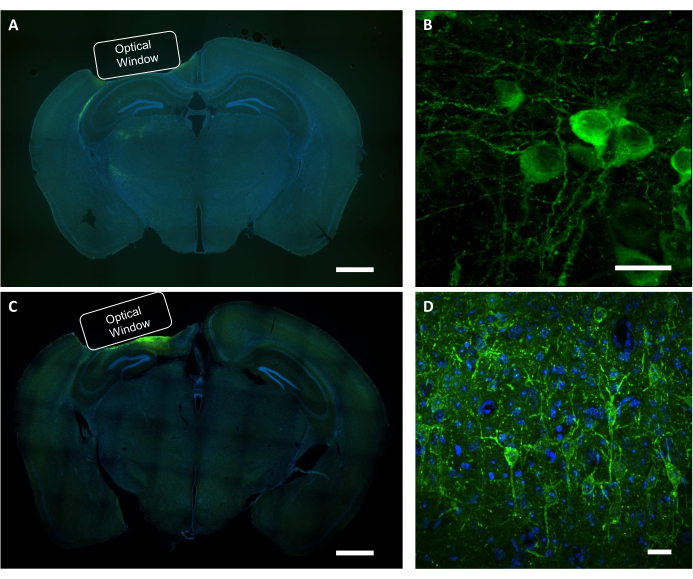
الشكل 9: التحقق النسيجي من موضع النافذة البصرية والتعبير عن الفيروس. (أ) صورة فلورية تمثيلية لشريحة الدماغ القسم التاجي تظهر موضع النافذة البصرية من الماوس NCaMP التعبير. شريط المقياس: 1 مم (B) صورة كونفوجكال تمثيلية للخلايا العصبية تعبر عن مؤشرات NCaMP7. شريط المقياس: 25 ميكرومتر (C) صورة مضانة تمثيلية لشريحة الدماغ القسم التاجي تظهر موضع النافذة البصرية من فأرة التعبير عن SomArchon. شريط المقياس: 1 مم (D) صورة كونفوجكال تمثيلية للخلايا العصبية تعبر عن مؤشرات SomArchon. شريط المقياس: 25 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1:التحليل الكمي لشدة الفلورسينس النسبية جنبا إلى جنب مع وقت التعبير. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
هنا نصف طريقة للتصوير على المدى الطويل لمنطقة قرن آمون CA1 في الفئران behaving. وتستند هذه الطريقة على زرع مزمن من نافذة التصوير حسب الطلب، والتي تمكن أيضا الإدارة المستهدفة من الفيروسات أو الأدوية مباشرة إلى الخلايا العصبية ذات الاهتمام. يتكون هذا البروتوكول من أربعة أجزاء رئيسية: 1) تجميع زرع التصوير؛ و (2) تركيب الغرسات؛ و (2) زراعة الأسنان؛ و (3) زراعة الأسنان؛ و (3) زراعة الأسنان؛ و (ه 2) تركيب زرع التصوير؛ 3) حقن الفيروس عن طريق زرع التصوير؛ 4) التصوير الوظيفي في الفئران behaving. فيما يلي وصف ومناقشة الخطوات الهامة في البروتوكول واستكشاف الأخطاء وإصلاحها والتعديلات والقيود المفروضة على الأسلوب. كما نناقش أهمية الأسلوب وتطبيقاته البديلة المحتملة.
هناك العديد من الخطوات الحاسمة في البروتوكول الموصوف التي هي مهمة إلى حد ما لعملية جراحية ناجحة: (1) إعداد زرع التصوير عالية الجودة; '2' الحالات الجراحية العقيمة؛ '3' طموح القشرة؛ '4' وضع غرسة التصوير بدقة؛ '5' الحقن الفيروسي. وكما تشير الخطوة 1.6، فإن القصدير اللحام الزائد سيتطلب استئصال قرنية أكبر وبالتالي يزيد من خطر الالتهاب. من المهم جدا أيضا استخدام كمية مناسبة من الغراء البصري اللاصق عند تثبيت زجاج الغطاء إلى قنية التصوير ، كما هو مبين في الخطوة 1.11 ، حيث أن كمية غير كافية قد تؤدي إلى تسرب السائل النخاعي إلى قنية التصوير وجعلها مبهمة. من ناحية أخرى، يمكن أن يؤدي لاصق بصري الزائدة في انخفاض الشفافية من النافذة الزجاجية. يمكن أن يسبب التلوث المحتمل لزرع التصوير انتشارا نشطا للأنسجة الضامة تحت النافذة البصرية و / أو التهابا شديدا ، مما سيؤدي إلى الإنهاء المبكر للتجربة. لذلك ، فإن تجميع وإعداد غرسة التصوير قبل الجراحة لا يقل أهمية تقريبا عن العملية الجراحية نفسها.
أثناء الجراحة ، يتم استئصال جزء القشرة تحت استئصال القحف من خلال الطموح اللطيف ، مما يؤدي إلى نزيف لا مفر منه. الدم في موقع الجراحة يقلل بشكل كبير من رؤية أنسجة الدماغ التي يجب إزالتها. وهذا يعقد التقييم الدقيق للعمق المطلوب من استئصال الأنسجة. التنظيف الدقيق للموقع الجراحي مع برنامج تلفزيوني في كل مرة قبل تطبيق شفط لإزالة الجزء التالي من الأنسجة يوفر تحكما أفضل في العمق. يجب دائما إزالة أنسجة الدماغ في أجزاء صغيرة خطوة بخطوة مما يؤكد عمق الأنسجة الاجتثاث قبل الشروع في المزيد من الشفط. ويمكن أيضا السيطرة الدقيقة على الشفط يمكن أن يتحقق مع إبرة حادة أرق. نقترح استخدام إبرة 26 G، ومع ذلك، أصغر من قطر 26 G هو أكثر عرضة للانسداد. وعلاوة على ذلك، فإنه عادة ما يستغرق الكثير من الممارسة لتحديد عمق دقيق للطموح المطلوب لكل حيوان، كما لون القشرة، كالوسوم الجسم، وفرس النهر قد تختلف من الماوس إلى الماوس(الشكل 3).
يجب أن يتم إدخال وتأمين زرع التصوير بدقة شديدة لضمان أقرب موضع ممكن لنافذة التصوير إلى السطح الظهري للقرن آمون. يجب أن يتطابق حجم استئصال القحف المعد بشكل وثيق مع الغرسة ويسمح بإدخالها دون مقاومة كبيرة. وفي الوقت نفسه، لا ينبغي أن تكون هناك فجوة مرئية بين الجمجمة والزرع لضمان الختم السليم وتجنب التعرض لأنسجة الدماغ. يجب تطبيق ضغط لطيف ومستقر على الجزء العلوي من الزرع أثناء ختمه على الجمجمة. يكاد يكون من المحتم أن يكون الدم تحت نافذة التصوير أثناء تركيب زرع. إذا تم إجراء العملية الجراحية بشكل صحيح ، فيجب إزالة النافذة في غضون 3-7 أيام ، ويصبح الأوعية الدموية في الدماغ مرئية بوضوح. ومن المهم أيضا التأكد من أن الفيروس يتم حقنه بشكل صحيح تحت النافذة. في حالة فشل التعبير، يمكن إعادة حقن الفيروسات عدة مرات.
المضاعفات الرئيسية التي واجهناها في بعض الحالات هي انخفاض الرؤية لنافذة التصوير. هناك عدة أسباب محتملة لضعف جودة التصوير: '1' الالتهاب المستمر؛ '2' الالتهاب المستمر؛ '2' الإصابة بالالتهاب؛ '2' الإصابة بالالتهاب؛ '2' ال 2) نمو النسيج الضام على الزجاج؛ 3) فجوة كبيرة بين النافذة والحصين. وعادة ما يحدث الالتهاب بسبب التلوث أثناء الجراحة أو عن طريق زرع التصوير غير المعقم بشكل صحيح. نقترح الاستئصال التلقائي للأدوات الجراحية قبل وبعد كل عملية جراحية، وتطهير منطقة الجراحة قبل العملية مباشرة، وارتداء معدات الحماية الشخصية النظيفة أثناء الجراحة. يجب تنظيف غرسات التصوير بعد التجميع والتعقيم وتخزينها في ظروف معقمة. يمكن أن يكون نمو النسيج الضام على زجاج زرع التصوير بسبب التلوث الميكانيكي على سطح الزجاج أو الصدمة المفرطة لأنسجة الدماغ أثناء استئصال القشرة. بعد تجميع الزرع ، من المهم التأكد من أن السطح الزجاجي نظيف وسلس. أيضا، يجب إزالة جميع قطع أنسجة الدماغ التالفة بعناية قبل إدخال زرع التصوير في استئصال القحف. في بعض الحالات، تؤدي الفجوة بين النافذة الزجاجية والحصين إلى تراكم السائل النخاعي، مما يقلل من جودة التصوير. لذلك، أثناء تركيب الزرع، من المهم إدراج كل ذلك في ضمان اتصال جيد بين قرن آمون ونافذة زجاجية. في بعض الأحيان ، من الصعب تحديد السبب الدقيق لنافذة التصوير المبهمة. نقترح إجراء تحليل ما بعد الوفاة للكشف عن الظروف تحت النافذة البصرية وتعديل العمليات الجراحية اللاحقة.
وبهذه الطريقة عدة قيود أساسية وتقنية ينبغي أن تؤخذ في الاعتبار قبل وأثناء التصوير في الجسم الحي. أحد القيود الرئيسية هو استئصال القشرة. تتم إزالة جزء من القشرة البصرية والحسية أثناء الجراحة. في حين أنه من الصعب تقييم تأثير استئصال القشرة بدقة ، حيث أن أنسجة الدماغ التي تمت إزالتها لا تظهر مباشرة على قرن آمون ، أظهرت العديد من الدراسات عدم وجود ضعف ملحوظ في التعلم المعتمد على فرس النهر أو وظائف قرن آمون الأخرى ذات الصلة15،16. وينبغي أيضا النظر في القيود البصرية ، وخصوصا عندما تستخدم العدسات عالية NA الهدف. على سبيل المثال، في هذه الدراسة، استخدمنا قنية طولها 1.75 مم بقطر داخلي 1.9 ملم. هندسة هذه القنية لن تحافظ على NA الكامل من هدف الهواء مع NA أكثر من ~ 0.5 أو هدف المياه مع NA أكثر من ~ 0.6 كما أنها سوف مقطع بعض الضوء. وهناك قيد آخر، شائع لجميع يزرع تصوير الدماغ، هو أن جزءا من الدماغ هو الحصول على يتعرض، وبالتالي تعزيز فقدان الحرارة17،18. ومع ذلك، يمكن استعادة درجة حرارة الدماغ الفسيولوجية بسهولة أثناء التصوير عن طريق التشوه من عازل دافئ.
يمكن تعديل الطريقة الموصوفة بسهولة أو تعديلها للتطبيقات الأخرى. على سبيل المثال، يمكن تكييف التحضير لتصوير المخطط7. كما يضع المخطط أعمق قليلا من قرن آمون، وينبغي استخدام قنية التصوير أطول لتجميع زرع التصوير. نقترح استخدام قنية تصوير 2.0 مم. يجب تعديل إحداثيات استئصال القحف في المقابل (AP: +0.8 مم، ML: −1.8 مم). وبالإضافة إلى ذلك، حقن الفيروس عن طريق ضخ cannula يسمح تحقيق التعبير عن متحولة في طبقة رقيقة من الخلايا العصبية عند استخدام النمط المصلي AAV مع انتشار مقيد19،20. وهو مفيد بشكل خاص للتصوير الفوتون الواحد بسبب انخفاض الفلورسينس خارج التركيز من الطبقات العميقة ، ونتيجة لذلك ، تحسين التصوير بدقة الخلية الواحدة. وعلاوة على ذلك، يمكن أيضا استخدام قنية الحقن أثناء التصوير الوظيفي لإدارة الأدوية أو غيرها من المواد الكيميائية مباشرة على الخلايا العصبية في FOV(الشكل 5B). يضيف القنية التسريبية بشكل عام وظائف مفيدة لزرع التصوير ، مما يحسن جودة التصوير بسبب التعبير الفيروسي المستهدف وتمكين التحفيز الدوائي للخلايا العصبية في FOV. لوحة الرأس المستخدمة يوفر الاستقرار غير عادية من زرع التصوير التقليل من القطع الأثرية الحركة حتى في الحيوانات تتحرك بنشاط على حلقة مفرغة. لوحة الرأس صغيرة وخفيفة ، مما يسبب الحد الأدنى من عدم الراحة للحيوانات ، ويظل مستقرا لعدة أشهر بعد التثبيت. كما تتوافق عملية زرع التصوير مع التصوير المتعدد الفوتون15و16و21 ويمكن دمجها مع المناظير الدقيقة22و23. كما تم استخدام زرع تصوير مماثل للتصوير متعدد الفوتون لهياكل قرن آمون الأعمق ، بما في ذلك stratum radiatum ، لاكونوز ستراتوم ، وgyrus dentate16،24،25،26،27. ومع ذلك، قد استهداف هياكل قرن آمون أعمق مع AAVs عن طريق قنية التسريب تتطلب المزيد من التحسين من النمط المصلي AAV وحجم19.
ونحن نعتقد أن البروتوكول الموصوف سيسهل الدراسات التي تهدف إلى التحقيق في نشاط الخلايا العصبية مع ارتفاع دقة الصدغية في قرن آمون من الفئران behaving باستخدام بسيطة وبأسعار معقولة واحد فوتون التصوير الاجهزة.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نود أن نشكر جميع أعضاء مجموعة الهندسة الحيوية الجزيئية في جامعة ويستليك على كل المساعدة والمناقشة المفيدة. كما نشكر جينزي لي وجي مين جيا من جامعة ويستليك على المساعدة في تصوير العملية الجراحية.
وقد تم دعم هذا العمل بتمويل من مؤسسة جامعة ويستليك، ومنحة المحقق الشاب لعام 2020 من BBRF، ومنحة المؤسسة الوطنية للعلوم الطبيعية في الصين 32050410298 كل ذلك إلى K.D.P.
Materials
| Name | Company | Catalog Number | Comments |
| Cover glass | Deckgläser | 72296-03 | |
| Denture Base Resin | ShangHai New Centery Dentel Material | N/A | Type I, self-solidifying |
| Dummy Cannula | RWD Life Science Co.,LTD | 62102 | OD 0.30mm |
| Guide Cannula | RWD Life Science Co.,LTD | 62003 | 26G |
| Head Fork | N/A | N/A | Custom made |
| Head Plate | N/A | N/A | Custom made |
| Imaging Cannula | N/A | N/A | Custom Made; OD 3mm, ID 2.7mm, Height 1.8mm, #108 stainless steel |
| Internal Cannula | RWD Life Science Co.,LTD | 62203 | 0.30*0.14 (OD*ID, mm) |
| Kwik Sil | World Precision Instruments | KWIK-SIL | |
| SuperBond C&B | SUN MEDICAL | N/A | SuperBond C&B kit |
| Treadmill Kit | N/A | N/A | Custom made |
| UV-cured Adhesive | NORLAND PRODUCTS | NOA 60 |
References
- Leutgeb, S., et al. Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science. 309 (5734), 619-623 (2005).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Polanco, J. C., et al. Amyloid-β and tau complexity - towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2018).
- Henneman, W. J. P., et al. Hippocampal atrophy rates in Alzheimer disease. Added value over whole brain volume measures. 72 (11), 999-1007 (2009).
- Camicioli, R., et al. Parkinson's disease is associated with hippocampal atrophy. Mov Disord. 18 (7), 784-790 (2003).
- Piatkevich, K. D., Murdock, M. H., Subach, F. V. Advances in Engineering and Application of Optogenetic Indicators for Neuroscience. Applied Sciences. 9 (3), 562 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Fan, L. Z., et al. All-Optical Electrophysiology Reveals the Role of Lateral Inhibition in Sensory Processing in Cortical Layer 1. Cell. 180 (3), 521-535 (2020).
- Shemesh, O. A., et al. Precision Calcium Imaging of Dense Neural Populations via a Cell-Body-Targeted Calcium Indicator. Neuron. 107 (3), 470-486 (2020).
- Villa, K. L., et al. Inhibitory Synapses Are Repeatedly Assembled and Removed at Persistent Sites In Vivo. Neuron. 89 (4), 756-769 (2016).
- Franklin, K. B. J., Paxinos, G. . Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , (2013).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Subach, O. M., et al. Novel Genetically Encoded Bright Positive Calcium Indicator NCaMP7 Based on the mNeonGreen Fluorescent Protein. International Journal of Molecular Sciences. 21 (5), 1644 (2020).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Kalmbach, A. S., Waters, J. Brain surface temperature under a craniotomy. Journal of neurophysiology. 108 (11), 3138-3146 (2012).
- Roche, M., et al. In vivo imaging with a water immersion objective affects brain temperature, blood flow and oxygenation. eLife. 8, 47324 (2019).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neuroscience Research. 93, 144-157 (2015).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H., Manfredssonn, F. P. . Gene Therapy for Neurological Disorders: Methods and Protocols. , 133-149 (2016).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), (2016).
- Yashiro, H., Nakahara, I., Funabiki, K., Riquimaroux, H. Micro-endoscopic system for functional assessment of neural circuits in deep brain regions: Simultaneous optical and electrical recordings of auditory responses in mouse's inferior colliculus. Neuroscience Research. 119, 61-69 (2017).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution In Vivo Imaging of Hippocampal Dendrites and Spines. The Journal of Neuroscience. 24 (13), 3147 (2004).
- Busche, M. A., et al. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proceedings of the National Academy of Sciences. 109 (22), 8740 (2012).
- Attardo, A., et al. Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Castello-Waldow, T. P., et al. Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. PLOS Biology. 18 (11), 3000928 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved