Method Article
Процедура краниотомии для визуализации нейронной активности в гиппокампе мышей
В этой статье
Резюме
В этой статье демонстрируется подготовка специального окна визуализации, дополненного инфузионной канюли, и ее имплантация в область CA1 гиппокампа у мышей.
Аннотация
Визуализация нейронной активности при одноклеточном разрешении у бодрствующих животных является очень мощным подходом к исследованию функций нейронных цепей в системной нейробиологии. Однако высокая абсорбция и рассеяние света в тканях млекопитающих ограничивают прижизальную визуализацию в основном поверхностными областями мозга, оставляя глубокие области мозга, такие как гиппокамп, недоступными для оптической микроскопии. В этом видео мы показываем подготовку и имплантацию специально изготовленного окна визуализации для обеспечения хронической визуализации in vivo дорсальной области ГИПпокампа CA1 у мышей с фиксированным головой. Изготовленное на заказ окно дополнено инфузионной канюли, которая позволяет целенаправленно доставлять вирусные векторы и лекарства в область визуализации. Объединив этот препарат с широкоугольной визуализацией, мы выполнили долгосрочную запись активности нейронов с использованием флуоресцентного индикатора кальция от больших подмножеств нейронов у мышей в течение нескольких недель. Мы также продемонстрировали применимость этого препарата для визуализации напряжения с односколовым разрешением. Высокоэффективные генетически закодированные показатели активности нейронов и научные КМОП-камеры позволили рекуррентно визуализировать субклеточные морфологические детали одиночных нейронов при высоком временном разрешении. Мы также обсуждаем преимущества и потенциальные ограничения описанного метода и его совместимость с другими методами визуализации.
Введение
Гиппокамп является ключевой областью мозга, ответственной за обучение и память1, а также за пространственную навигацию2. Атрофия гиппокампа связана с неврологическими и психическими расстройствами, включающими потерю памяти и снижение когнитивных функций3,4,5. У мышей гиппокамп является очень устоявшейся моделью для изучения пространственного, контекстуального и ассоциативного обучения и формирования памяти на клеточном и сетевом уровнях4,5. Механистические исследования обучения и памяти требуют продольного опроса структуры и функции нейронов у поведения мышей. Флуоресцентная визуализация в сочетании с генетически закодированными зондами6 обеспечивает беспрецедентные возможности для регистрации динамики напряжения мембраны7,8,переходных процессов кальция9и структурных изменений10 над большими подмножествами нейронов прижизочно. Однако оптический доступ к гиппокампу у мышей затруднен корой, которая может достигать более 1 мм в толщину. Здесь мы описали процедуру сборки изготовленного на заказ устройства визуализации и его хронической имплантации в голову мыши для долгосрочного оптического доступа к субрегиону CA1 дорсального гиппокампа у поведения мышей. Инфузионные канюли, интегрированные в имплантат визуализации, позволяют ввести вирусы или лекарства непосредственно в нейроны в поле зрения. Описанный препарат в сочетании с широкоугольной микроскопией позволяет получать рекуррентную визуализацию больших подмножеств нейронов у мышей в течение длительных периодов времени. Мы использовали этот препарат для экспрессии генетически закодированных индикаторов кальция и напряжения в области CA1 гиппокампа путем целенаправленной инъекции рекомбинантного аденоациированного вируса (rAAV) для записи активности нейронов с разрешением одной клетки. Мы также выполнили продольную кальциевую визуализацию соответствующих подмножеств нейронов с высоким пространственно-временным разрешением у животных. Кроме того, этот препарат совместим с многофотонной микроскопией и микроэндоскопией, тем самым еще больше расширяя набор инструментов методов визуализации для изучения нейронных сетей на клеточном и субклеточном уровнях у мышей. Мы описали критические шаги и устранение неполадок протокола. Мы также обсудили возможные подводные камни и ограничения метода.
протокол
Все методы, описанные здесь, были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC) Университета Уэстлейк.
1. Сборка имплантатов
ПРИМЕЧАНИЕ: Сборка имплантата для визуализации технически проста и требует только коммерчески доступных предметов(рисунок 1,см. также Таблица материалов). Головные пластины могут быть изготовлены в местном механическом цехе с использованием нержавеющей стали или титановых пластин. Мы предлагаем подготовить запас полностью собранных имплантатов перед началом операций. После проведения экспериментов in vivo имплантаты могут быть восстановлены и повторно используются несколько раз. В некоторых случаях может потребоваться только повторное присоединение инфузионной канюли путем пайки или замены покровного стекла.
- Подготовьте все шесть ключевых аппаратных компонентов для сборки и установки имплантатов визуализации(рисунок 1).
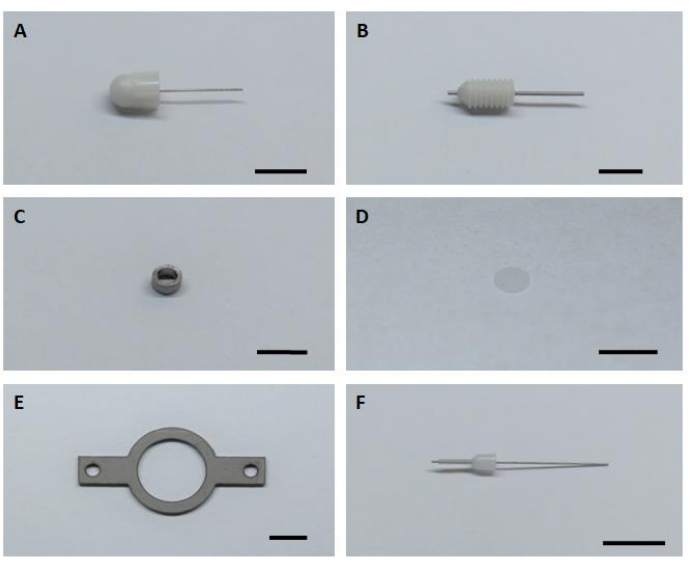
Рисунок 1:Шесть ключевых аппаратных компонентов для сборки и установки имплантата визуализации. (A) Фиктивная канюля. (B) Направляющая канюля. (C) Визуализация канюли. (D) Стеклянное стекло. (E) Головная панель. (F) Внутренняя канюля. Шкала: 5 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Включите сварочный аппарат и нагрейте его до необходимой температуры.
ПРИМЕЧАНИЕ: Температура зависит от используемого сварочного олова. - Отполировать боковую поверхность канюли для визуализации с помощью мелкой наждачной пасты, чтобы удалить слой окисления и, таким образом, облегчить более сильную пайку.
- Отрегулируйте положение канюли для визуализации и инъекционной канюли (направляющая канюля со вставленным манекеном канюли) с помощью рук помощи(рисунок 2A,B).
- Используя шприц с иглой, нанесите небольшое количество соответствующего типа флюса на место соединения между визуализацией и инъекционными канюлями в течение 5 секунд, а затем удалите каплю.
ПРИМЕЧАНИЕ: Для этого препарата мы использовали коммерчески доступный флюс, который указан производителем для пайки деталей из нержавеющей стали, поскольку канюли для визуализации и инфузии изготовлены из нержавеющей стали. В случае других материалов, используемых для изготовления канюль, конечный пользователь должен выбрать флюс, который может сварить выбранный материал. - Расплавить паяльник и нанести его на место соединения, обработанное флюсом(рисунок 2).
ПРИМЕЧАНИЕ: Избегайте избытка паяльной олова, так как это потребует ненужной большой краниотомии во время операции.
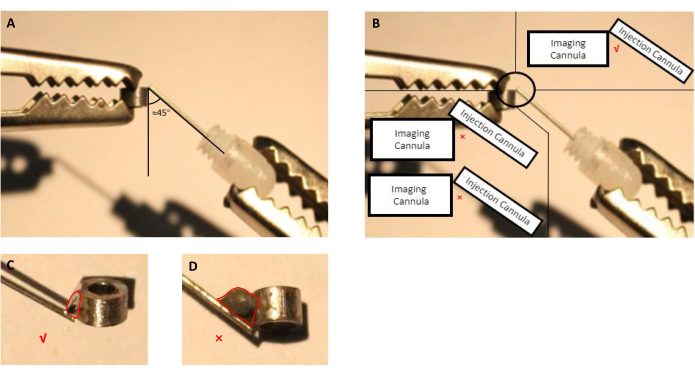
Рисунок 2:Схема сборки инъекционной канюли, состоящей из направляющей канюли с вставленным манекеном канюли, с визуализационной канюли. Уголмежду инъекционной канюлой и канюлой для визуализации должен составлять около 45 градусов. (B) Кончик инъекционной канюли должен быть прямо на краю канюли для визуализации. (C)Соответствующий размер сварочного олова, используемого для припаивания и инжекционного канюль (красная линия указывает на контур капли олова). (D)Неподходящий размер сварочной олова, которого следует избегать при подготовке имплантата (красная линия указывает на контур оловянной капли). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Подождите, пока паяльник остынет. Обычно это занимает несколько секунд.
- Убедитесь, что инъекционная канюля не заблокирована, вставив фиктивную канюлю с обеих сторон.
- Нанесите УФ-отверждающий оптический клей на нижнюю сторону канюли для визуализации с помощью зубочистки или иглы шприца 26 G.
- Используйте тонкий пинцет, чтобы аккуратно поместить покровный стакан соответствующего размера для визуализации канюли.
ПРИМЕЧАНИЕ: Позиционирование стекла должно быть выполнено точно на канюле для визуализации, не перемещая стекло слишком сильно после того, как оно коснулось оптического клея. В противном случае стекло пачкается, тем самым снижая качество изображения. - Отверждайте клей не менее часа при УФ-подсветке 350-400 нм от стандартной портативной УФ-лампы.
ПРИМЕЧАНИЕ: Используемый клей должен быть оптически прозрачным. В противном случае это снизит качество окна изображения.
ВНИМАНИЕ: Избегайте воздействия на кожу и глаза, нося УФ-защитные очки, перчатки и лабораторный халат. - Вымойте канюлю в 70% этаноле, высушите на воздухе и храните в стерильном контейнере до операции.
ПРИМЕЧАНИЕ: Очень важно, чтобы покровное стекло было как можно более чистым и нетронутым. Используемый оптический клей химически стабилен в 70% этаноле.
2. Имплантация окон
- Этапы подготовки перед операцией
- Стерилизуйте все хирургические инструменты в автоклаве.
- Приготовьте 1x PBS и 70% этанола в двух отдельных чашках Петри.
- Дополнительно: Продезинфицируйте область операции с помощью ультрафиолетового света в течение не менее 20 минут до начала хирургической процедуры.
ПРИМЕЧАНИЕ: Работа в максимально стерильных условиях приведет к успешному и долговечному (до 6 месяцев) застекленным черепным окнам. Загрязнение может привести к снижению прозрачности окна или сильному воспалению в большинстве случаев.
- Хирургическая процедура
- Стерилизуйте хирургическую область 70% этанолом непосредственно перед операцией.
- Взвесьте животное и ввести предоперационную дозу анальгетика подкожно в соответствии с одобренным IACUC протоколом для животных.
- Обезболить мышь изофлураном (4% для индукции, 1,5-2% для поддержания, 0,3-0,5 л/мин расход воздуха). Используйте технику защемления хвоста и нога, чтобы убедиться, что животное полностью утешено. Соблюдайте жизненно важные показатели животного, такие как дыхание, SpO2и частоту сердечных сокращений в течение всего периода процедуры.
- Используйте триммер или крем для депиляции, чтобы удалить мех с задней части шеи до глаз.
- Поместите мышь в стереотаксическую рамку над хирургической грелкой (при 37 °C). Закрепите голову ушными вкладышами. Слегка подтолкните голову во всех направлениях, чтобы убедиться, что голова надежно закреплена.
- Нанесите глазную мазь, чтобы предотвратить пересыхание глаз животного во время операции.
- Стерилизуйте хирургический участок бетадином, а затем 70% этанолом три раза, прежде чем сделать разрез.
- Снимите кожу над верхней частью черепа, начав с горизонтального разреза по всему основанию головы, затем два разреза в ростральном направлении, почти дойдя до век, затем два косых разреза, которые сходятся по средней линии.
- Двумя стерильными валопчатобумажными тампонами втягивают соединительную ткань, а также мускулатуру задней части шеи, к краям черепа.
ПРИМЕЧАНИЕ: Старайтесь избегать повреждения кровеносных сосудов (особенно тех, которые скрыты в мышцах) во время манипуляции. - Нанесите каплю раствора лидокаина (~0,1 мл) на поверхность надкостницы на 2 минуты, чтобы избежать чрезмерной боли. Опционально, чтобы уменьшить мозг от отека после удаления черепа, 0,1 мл 1% дексаметазона может быть введено подкожно.
- Аккуратно соскоблите всю открытую область черепа скальпелем, чтобы создать сухую и шероховатую поверхность, которая позволяет клею и зубной цементу лучше прилипать и, таким образом, приводит к хронической имплантации.
- Поместите кончик иглы, установленной на стереотаксической станции, на брегму, установите все три координаты (AP: Передний-Задний; МЛ: Медиал-Латеральный; Д.В.: Дорсально-Вентральный) как 0.
- Поместите кончик иглы на лямбду и посмотрите, является ли координата AP 0, чтобы подтвердить, что положение головы вертикально, а также если координата ML составляет 0, чтобы подтвердить, что голова расположена горизонтально. Если нет, отрегулируйте соответствующие ручки на стереотаксической станции, пока координаты AP и ML не будут в пределах 0,1 мм.
- Переместите кончик иглы, чтобы найти соответствующие точки для краниотомии и отметить их положения на черепе с помощью тонкого маркера. В случае имплантации гиппокампа имеется 4 точки со следующими координатами (AP: -0,68, ML: -2,0) (AP: -3,68, ML: -2,0) (AP: -2,18, ML: -0,5) и (AP: -2,18, ML: -3,5)11,а также (AP: -4,0, ML: -2,0) для самой каудальной точки инъекционной канюли.
ПРИМЕЧАНИЕ: Маркер, используемый на этом этапе, должен быть стерилизован с использованием ультрафиолетового освещения в течение не менее часа до операции. Координаты, показанные здесь, предназначены для 6-8-недельных мышей C57BL/6J. Координаты могут отличаться из-за разного возраста или штаммов мышей. - Нарисуйте круг на основе четырех отмеченных точек, а также контура области инъекционной канюли на каудальной стороне круга(рисунок 3).
- Используйте пневматическое сверло со скоростью 10 000 об/мин, чтобы аккуратно «нарисовать» вдоль контура, отмеченного на черепе.
- Просверлите череп до тех пор, пока не останется очень тонкий слой кости, который обычно начинает покачиваться при нежном прикосновении в центре.
- Нанесите каплю стерильного 1x PBS к центру краниотомии, поднимите костный лоскут с черепа очень тонкими щипцами или двумя иглами по 26 Г, приближающимися с противоположных сторон.
ПРИМЕЧАНИЕ: PBS поможет удалить кусок черепа и предотвратить возможное кровотечение твердой мозговой оболочки12. - Нанесите PBS с последующей мягкой аспиражей через тупую иглу 26G несколько раз, чтобы очистить поверхность твердой мозговой оболочки.
- Аккуратно удалите дурную оболочку либо аспирацией, либо офтальмологическими ножницами. Применяют мягкое всасывание (~-60 кПа) для абляции коры головного мозга, а также мозолистого тела над гиппокампом.
ПРИМЕЧАНИЕ: Кора часто более желтая, чем мозолистое тело, а мозолистое тело обычно белее, чем гиппокамп. Мозолистое тело обычно легко отличить по нейронным волокнам, идущим в вертикальном и горизонтальном направлениях при наблюдении сверху(рисунок 3).
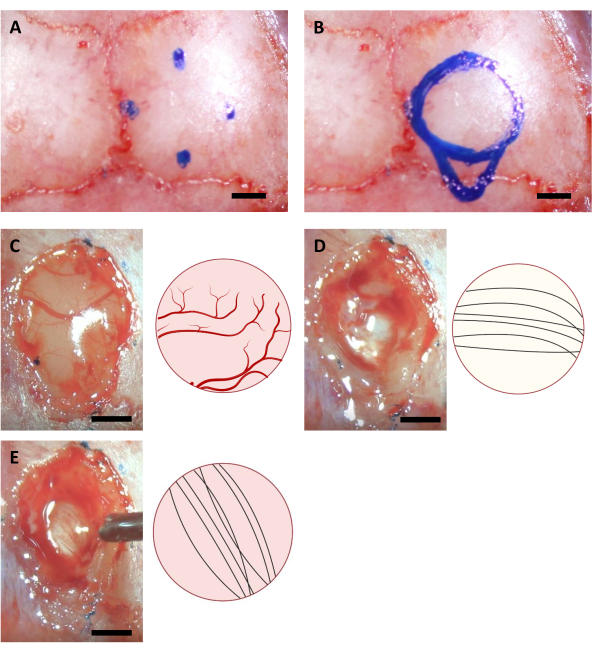
Рисунок 3:Стереотаксические координаты расположения гиппокампа и процесса абляции мозга. (A) Четыре координаты для краев области краниотомии. (B) Полная область краниотомии. (С-Е) Репрезентативные изображения, полученные во время операции (слева) и их принципиальная схема (справа), указывающие на различные цвета и направления нейронных волокон(A)коры(B)желтого тела и(C)гиппокампа, видимые при абляции коры. Шкала: 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Кровотечение в этот момент повлияет на видимость мозговой ткани в краниотомии. Применяют 1x PBS с последующим мягким всасыванием, при этом аспирируя кору, чтобы избавиться от крови.
ПРИМЕЧАНИЕ: Непрерывное кровотечение неизбежно во время этого этапа, и в некоторой степени непрерывное кровотечение является признаком нормального кровяного давления. В отличие от имплантации окна визуализации коры головного мозга, присутствие крови под оптическим окном является приемлемым, поскольку оно будет очищено через несколько дней после операции. Введение визуализующей канюли в созданную полость как можно скорее после абляции коры является оптимальным. - Если черепно-качелети больше на <0,5 мм, чем канюля для визуализации, в некоторой степени спасите установку канюли, используя дополнительное уплотнение Kwik Sil перед фиксацией имплантата с помощью SuperBond.
- Если трепанирование черепа меньше на <0,5 мм, чем визуализационная канюля, спасите хирургическую процедуру в некоторой степени, обрезав край трепаниотомии с помощью тонкого пинцета или пары офтальмологических ножниц, поскольку оставшаяся кость на краю трепанирования тоньше, чем сам череп в результате сверления.
ПРИМЕЧАНИЕ: Краниотомии, которые превышают диапазоны выше 0,5 мм, не могут быть спасены. Соответствующие действия в этих случаях должны следовать процедуре прекращения в соответствии с протоколом о животных.
- Аккуратно вставьте имплантат в краниотомию.
- Плотно надавить на верхнюю часть имплантата L-образной иглой, чтобы расположить оптическое окно имплантата как можно ближе к открытой поверхности гиппокампа. Многократно наносите PBS на череп вокруг имплантата с последующим всасыванием, чтобы удалить кровь как можно больше во время установки имплантата. Затем нанесите тонкий слой Kwik Sil между имплантатом и черепом, чтобы предотвратить проникновение зубного цемента под череп(рисунок 4).
- Убедитесь, что размещение оптического окна имплантата находится прямо против гиппокампа, чтобы избежать скопления крови или другой жидкости под ним.
ПРИМЕЧАНИЕ: Критическим моментом является обеспечение того, чтобы покровное стекло канюли для визуализации было размещено прямо против гиппокампа, что может потребовать мягкого давления на верхнюю часть канюли во время процесса установки и герметизации. Является ли верхняя сторона канюли визуализации параллельной черепу, не имеет решающего значение для окончательного оптического доступа, если оптическое окно размещено против гиппокампа. - В соответствии со средней толщиной коры над областью CA1, держите верхнюю поверхность канюли визуализации над поверхностью черепа на ~ 0,5 мм, чтобы облегчить прикрепление канюли к черепу(рисунок 4).
- Убедитесь, что размещение оптического окна имплантата находится прямо против гиппокампа, чтобы избежать скопления крови или другой жидкости под ним.
- После того, как Kwik Sil вылечится, что обычно занимает не более ~ 1 мин, равномерно нанесите Super-Bond C & B на поверхность черепа, поверхность Kwik-Sil и верхнюю поверхность имплантата.
- После того, как Super-Bond C & B вылечен, нанесите смолу основания протеза над Super-Bond C & B, а также на кожу вокруг разреза, сделанного в начале операции.
ПРИМЕЧАНИЕ: Альтернативные типы цемента доступны у нескольких поставщиков. Следуйте инструкциям соответствующего производителя. - После того, как смола основания протеза отверждена, поместите головную пластину на смолу вокруг имплантата и сделайте ее концентрической с помощью канюли визуализации. Нанесите больше смолы основания протеза вокруг и над головной пластиной, чтобы зафиксировать ее положение. Дайте ему затвердеть в течение нескольких минут.
- Избегайте наращивания толстого слоя цемента вокруг канюли, чтобы обеспечить лучший доступ к окну изображения с объективом(рисунок 4).
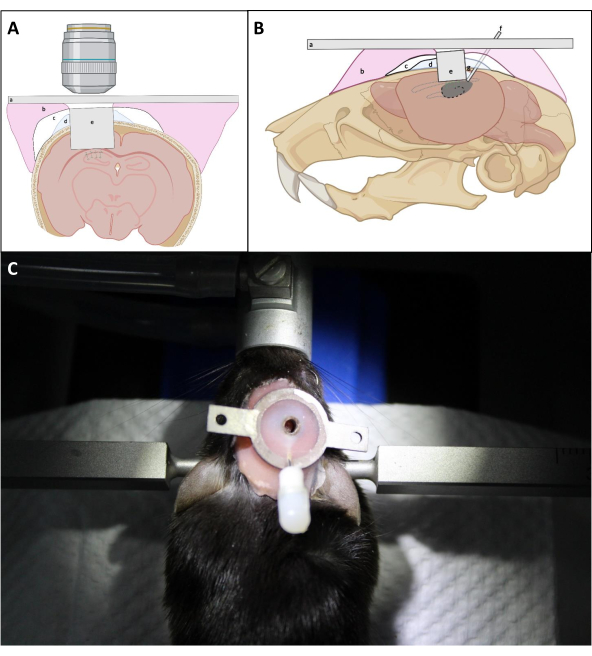
Рисунок 4:Принципиальная схема имплантации окна в (А) корональном и (В) сагиттальном виде. а)головная панель; b)смола основания зубного протеза; c)Суперконд; d)Квик-Сил; e)визуализация канюли; f)канюля для инъекций; (g)Паяльник. (C):Мышь с установленным имплантатом после операции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Разбавьте смолу основания протеза, чтобы уменьшить его вязкость, что позволит ему заполнить предостережения, которые труднодоступны с помощью аппликатора.
- Аккуратно поместите изолированную резиновую ленту над окном, чтобы защитить окно от возможного загрязнения от подстилки животных.
- Когда операция будет завершена, вводят противовоспалительный препарат подкожно, чтобы предотвратить воспалительную реакцию.
- Поместите животное в теплую клетку до тех пор, пока оно не оправится от анестезии.
- Проверьте состояние здоровья мыши в течение 72 ч после операции, наблюдая за общим поведением. Противовоспалительный препарат и анальгетик вводят подкожно в течение двух-трех дней после операции каждые 24 часа, чтобы снять боль и уменьшить воспалительную реакцию.
ПРИМЕЧАНИЕ: Альтернативные процедуры мониторинга, лекарства и дозировки возможны для послеоперационного ухода, обратитесь к одобренному IUCAC протоколу для животных для точной процедуры. - Проверьте окно через 5-7 дней после операции, чтобы наблюдать сосудистую азочку под окном. В случае прозрачного окна животное готово к инъекции вируса.
3. Инъекция вируса
ПРИМЕЧАНИЕ: Инъекция вируса обычно делается через 5-7 дней после операции. Перед инъекцией вируса необходимо подтвердить, что окно визуализации ясное, и можно наблюдать сосудистую азкулятуру мозга(рисунок 5). В некоторых случаях может потребоваться до 14-16 дней, чтобы очистить окно, что также приемлемо, если воспаление мозга не обнаружено.
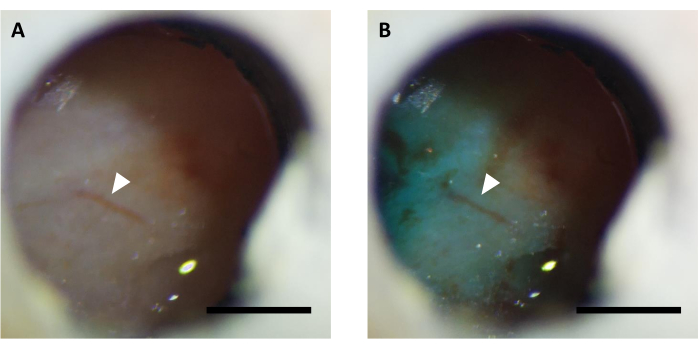
Рисунок 5:Репрезентативное изображение оптического окна (А) до и (В) после инъекции вируса, дополненное красителем FastGreen. Стрелка указывает на ту же структуру сосудов. Шкала: 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Добавить раствор красителя Fast-green в раствор вируса, разбавленный до нужного титра, в соотношении 1:9 в пробирке ПЦР.
ПРИМЕЧАНИЕ: Быстрый зеленый краситель добавляется для облегчения визуализации раствора вируса во время инъекции. - Соедините полиэтиленовую трубку со шприцем, затем засыпайте трубку минеральным маслом с помощью шприцевого насоса.
- Подключите внутреннюю канюлю к другому концу трубки, вливайте и вынимайте минеральное масло несколько раз, чтобы убедиться, что внутренняя канюля не засорена.
- Обезболить животное изофлураном (4% для индукции, 1,5-2% для поддержания, 0,3-0,5 л/мин расход воздуха), зафиксировать голову в стереотаксическом каркасе над грелкой (выдерживая 37 °С), нанести глазную мазь.
- Вывести 600 нл раствора вируса, удалить фиктивную канюлю и вставить внутреннюю канюлю, соединенную с инъекционным шприцем, в направляющую канюлю, наполнить вирус со скоростью 50 нл/мин в течение 10 минут в общей сложности.
ПРИМЕЧАНИЕ: Проверьте, виден ли краситель через окно, используя стереомикроскоп для подтверждения успешной инъекции вируса(рисунок 5). - После инъекции держите внутреннюю канюлю подключенной в течение 10 минут, чтобы вирус распространился под окном.
- Аккуратно снимите внутреннюю канюлю с направляющей канюли и повторите ее с помощью муляжной канюли.
- Поместите животное в теплую клетку, пока оно не оправится от анестезии.
ПРИМЕЧАНИЕ: Как правило, мыши готовы к визуализации через 10-20 дней после вирусной инъекции. Уровень экспрессии и время зависят от серотипа и промотора вируса, используемого для управления экспрессией генов.
4. Визуализация бодрствующих мышей под широкоугольным микроскопом.
ПРИМЕЧАНИЕ: Подготовленная головная пластина обеспечивает исключительную стабильность имплантата визуализации и, таким образом, позволяет проводить продольную визуализацию у бодрствующих и веющих себя мышей с минимальными артефактами движения.
- Индуцируйте мышь 4% изофлураном в течение нескольких минут, закрепите ее головную пластину на головной вилке, а затем закрепите головную вилку на беговой дорожке.
ПРИМЕЧАНИЕ: Головная вилка и беговая дорожка настроены для головной панели, используемой в этом исследовании, пожалуйста, см. Вспомогательные материалы для соответствующих файлов CAD. Индукция мыши перед фиксацией головы необязательна, так как можно приужить животное к этой процедуре. - Переместите беговую дорожку под ступень микроскопа и расположите оптическое окно под объективом.
- Используйте объектив с низким увеличением, чтобы найти лучшее поле зрения (FOV) для функциональной визуализации, а затем переключитесь на объектив с более высоким NA для записи активности нейронов с разрешением одной клетки.
ПРИМЕЧАНИЕ: Если инъекционная канюля по-прежнему является препятствием для достижения объективом рабочего расстояния, используйте проволочный клипер, чтобы отрезать канюлю для инъекций от головной пластины.
Результаты
Визуализация активности нейронов in vivo с использованием генетически закодированного показателя кальция. В среднем, визуализация in vivo начинается через 3-4 недели после имплантации, если достигнут достаточный уровень экспрессии трансгенов. К этому времени отек мозга и кровоизлияние обычно полностью разрешаются, а сосудистую азкуля мозга можно легко наблюдать через оптическое окно. Здесь мы использовали описанный препарат для выполнения повторных записей активности нейронов в области CA1 дорсального гиппокампа у мышей под флуоресцентным широкопольным микроскопом. Для записи активности нейронов мы использовали яркий генетически закодированный индикатор кальция, названный NCaMP713,который демонстрирует чувствительность к кальцию и временное разрешение, аналогичные чувствительности и временному разрешению GCaMP6s14. Чтобы выразить индикатор NCaMP7 в гиппокампе, мы ввели вирус rAAV / DJ-CAG-NCaMP7 с помощью инфузионной канюли и начали визуализацию долготы через 14 дней после инъекции. Для записи активности нейронов мы использовали объектив 10x NA 0.3 и камеру Hamamatsu OrcaFusion sCMOS, которая позволяла визуалировать при ~1,5x1,5 мм FOV на частоте до 100 Гц. Зеленая флуоресценция была вызвана коммерчески доступным светодиодом 470 нм с использованием стандартного набора фильтров GFP. Средняя глубина визуализации, достигаемая в зеленом канале, составляет около 50-120 мкм, что позволяет регистрировать активность нейронов преимущественно в толском ориенсе и пирамидальном слое. Глубина изображения в ближних инфракрасных каналах может составлять до 200 мкм, достигая более глубоких слоев гиппокампа8. Среднее время записи на FOV составляло 6-12 мин, хотя возможны гораздо более длительные сеансы визуализации, поскольку NCaMP7 характеризуется чрезвычайно высокой фотостабильностью и не наблюдалась обнаруживаемая фототоксичность(рисунок 6).
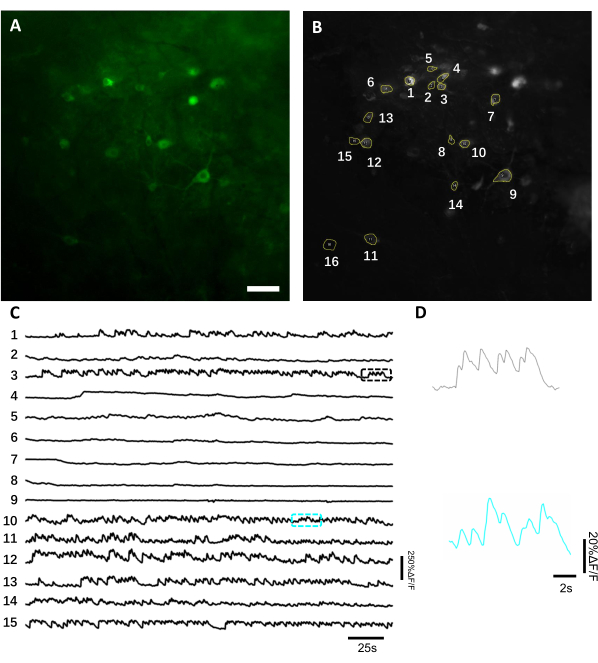
Рисунок 6:Регистрация активности нейронов в нейронах гиппокампа с использованием зеленого флуоресцентного генетически закодированного индикатора кальция. (A) Выбранный FOV, изображенный под широкоугольным флуоресцентным микроскопом в зеленом канале. (B) 15 ROI, соответствующих одиночным нейронам, показанным в A и выбранным с использованием проекции стандартного отклонения всей записи. (C) Репрезентативные флуоресцентные следы однократного испытания 15 выбранных нейронов в B. (D) Репрезентативный увеличенный вид 2 следов кальция показан в соответствующих цветовых полях, показанных в C. Шкала, 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Для получения флуоресцентных следов интересующих областей (ROI), соответствующих нейронным сомам, сегментировали вручную и анализировали программное обеспечение ImageJ. До коррекции движения анализа изображений общие процедуры пост-записи у бодрствующих животных не требовались, поскольку полученные наборы данных не демонстрировали артефакты движения из-за высокой стабильности имплантата визуализации. Репрезентативная оптическая запись активности нейронов из гиппокампа у бодрствующей мыши представлена на рисунке 6. 15 ROI, соответствующих нейронным сомам, были выбраны вручную из того же FOV, показанного на рисунке 6B,а следы флуоресценции в каждом исследовании показаны на рисунке 6C. На рисунке 6D показаны две репрезентативные части флуоресцентных следов от двух разных ROI. Мы выполнили 4 последовательных сеанса визуализации для одного и того же FOV с 3-дневными интервалами. Удалось идентифицировать и изобразить одни и те же нейроны в некоторых FOV в течение как минимум двух недель (более длительные сеансы визуализации не проводились для этого исследования, однако тот же препарат использовался для исследования визуализации продолжительностью до 6 месяцев на мышах,ранее 7; Рисунок 7). В этом исследовании мы использовали вектор AAV /DJ-CAG, который стимулировал сильную экспрессию интересуемого гена даже через 21 день после доставки вируса(дополнительный рисунок 1). Непрерывная экспрессия усложнила долгосрочную идентификацию одних и тех же нейронов из-за повышенного фона флуоресценции и появления новых нейронов, экспрессирующих кальциевый показатель. Поэтому выбор серотипа и промотора AAV для управления экспрессией генов-мишеней должен быть одним из важных соображений при экспериментальном проектировании, в частности, если требуется продольная визуализация одного и того же подмножества нейронов. Качество изображения позволило разрешить проксимальные дендриты, а также визуализировать кровеносные сосуды.
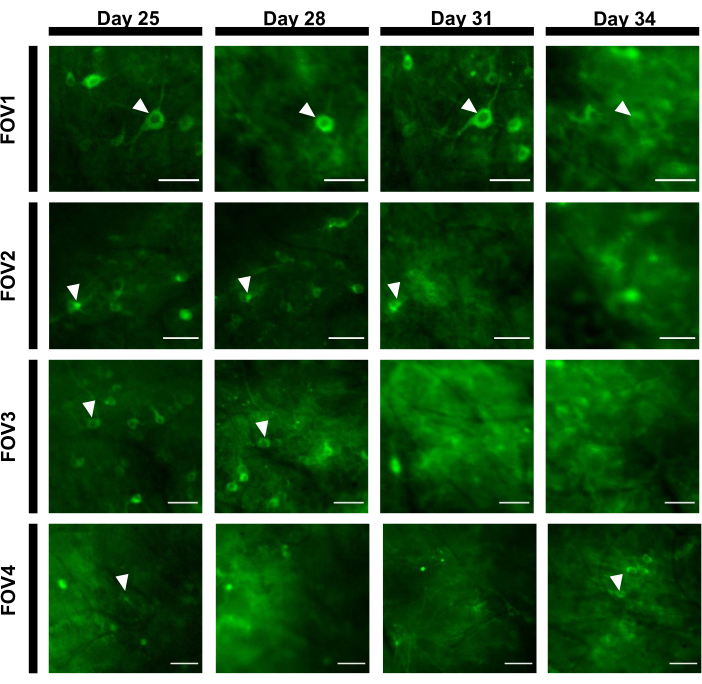
Рисунок 7:Последовательность изображений четырех различных FOV из области гиппокампа, отслеживаемая в течение 12 дней. Животному имплантировали окно на 0-й день и ввели вирус rAAV/DJ-CAG-NCaMP7 на 7-й день. Наконечники стрел указывают на нейрон, отслеживаемый в FOV. Шкала: 80 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Визуализация активности нейронов in vivo с использованием генетически закодированного датчика напряжения.
В этом исследовании мы также использовали новый генетически закодированный датчик напряжения, названный SomArchon7,который позволяет получать изображения напряжения с одноклеточным односкосковом разрешением у животных7,8. Чтобы экспрессировать SomArchon, мы ввели вирус rAAV / DJ-CAG-SomArchon с помощью инфузионной канюли и выполнили визуализацию напряжения у мыши с фиксированным поведением головы через несколько дней после инъекции. Для записи активности нейронов мы использовали объектив 40x NA 0,8 и камеру Hamamatsu OrcaFusion sCMOS, которая позволила нам визуалировать FOV 150x40 мкм со скоростью захвата до 830 Гц. Белок GFP, который является частью SomArchon, построенного для облегчения визуализации экспрессии в видимом диапазоне спектра, может быть легко визуализироваться в зеленом канале (возбуждение светодиода при 470/20 нм, излучение 525/50 нм) для обнаружения клеток, представляющих интерес для визуализации напряжения. Запись оптического напряжения проводилась в ближнем инфракрасном канале (лазерное возбуждение 637 нм при 3,4Вт/мм2,излучение 665 нм длинный проход) с биннингом 4 х 4 при частоте захвата 830 Гц. Мы записали спонтанную активность нейрона гиппокампа у бодрствующей мыши со средним SNR 7 на потенциал действия(рисунок 8).
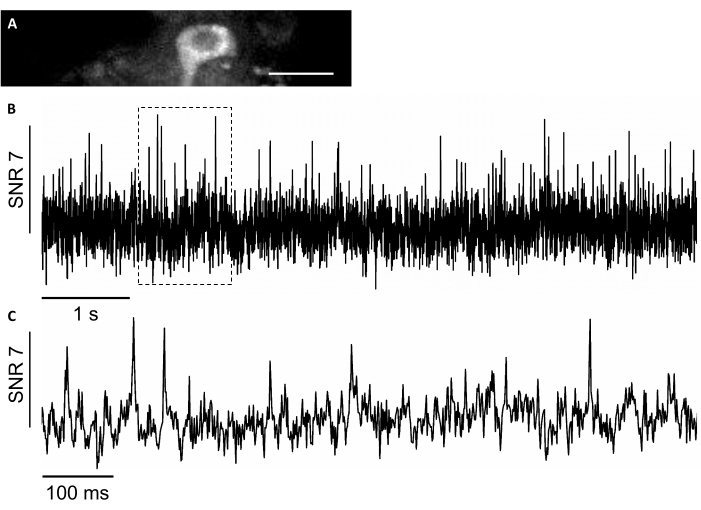
Рисунок 8:Регистрация активности нейронов в нейронах гиппокампа с помощью ближнего инфракрасного флуоресцентного генетически закодированного индикатора напряжения SomArchon. (A) Выбранный FOV, изображенный под широкоугольным флуоресцентным микроскопом в ближнем инфракрасном канале. (B) Однопроблюмный флуоресцентный след нейрона в A. (C) Репрезентативный увеличенный вид следа напряжения в соответствующем поле, показанном в B. Шкала: 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
гистология
После функционального визуализационного исследования посмертный анализ используется для подтверждения правильного размещения имплантата, области экспрессии вируса и локализации белка, интересующего в изображенных нейронах. Для гистологической верификации экспрессии вируса и размещения имплантата корональные участки фиксированного мозга PFA исследовали под флуоресцентным широкопольным микроскопом(рисунок 9A, C). Конфокальный микроскоп использовался для получения изображений высокого разрешения отдельных нейронов, экспрессирующих показатель кальция, а также индикатор напряжения(рис. 9B,D). Окрашивание DAPI использовалось для визуализации общей морфологии среза мозга. Кроме того, срезы мозга могут быть оценены с использованием иммуногистохимии для проверки астроглиоза или глиоза, вызванного имплантацией окна и вирусной экспрессией. Наши предыдущие исследования показали, что процедура не вызывает заметного глиоза7.
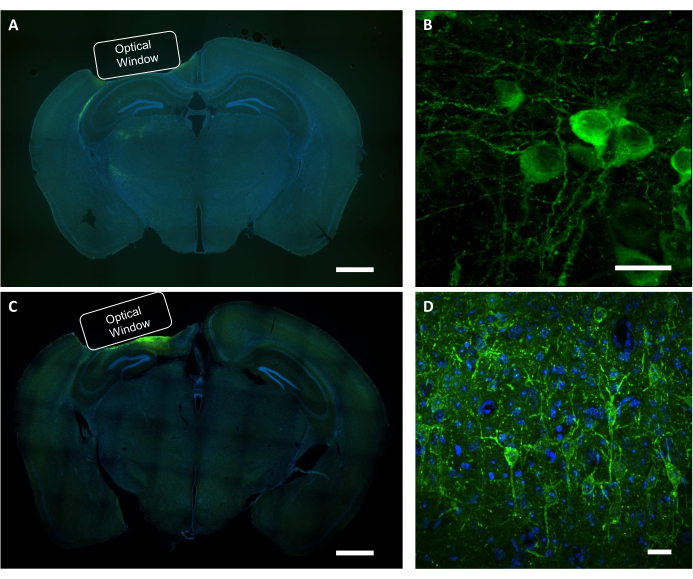
Рисунок 9:Гистологическая проверка положения оптического окна и экспрессии вируса. (A) Репрезентативное флуоресцентное изображение среза мозга коронального сечения, показывающее размещение оптического окна от NCaMP-экспрессивной мыши. Шкала: 1 мм. (B) Репрезентативное конфокальное изображение нейронов, выражающих показатели NCaMP7. Шкала: 25 мкм.(C)Репрезентативное флуоресцентное изображение среза мозга коронального отдела, показывающее размещение оптического окна от мыши, экспрессивной SomArchon. Шкала: 1 мм. (D) Репрезентативное конфокальное изображение нейронов, выражающих показатели SomArchon. Шкала: 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1:Количественный анализ относительной интенсивности флуоресценции наряду со временем экспрессии. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Здесь мы описываем метод долгосрочной визуализации области CA1 гиппокампа у поведения мышей. Метод основан на хронической имплантации специально изготовленного окна визуализации, которое также позволяет целенаправленно ввести вирусы или лекарства непосредственно в интересующие нейроны. Настоящий протокол состоит из четырех основных частей: i) сборка имплантата визуализации; ii) установка имплантата визуализации; iii) инъекция вируса через имплантат визуализации; iv) функциональная визуализация у мышей. Ниже мы опишем и обсудим критические шаги в протоколе, устранение неполадок, модификации и ограничения метода. Мы также обсуждаем значение метода и его потенциальные альтернативные применения.
В описанном протоколе есть несколько критических шагов, которые довольно важны для успешной операции: (i) подготовка высококачественного имплантата визуализации; ii) стерильные хирургические состояния; iii) аспирация коры головного мозга; (iv) точное размещение имплантата визуализации; v) вирусные инъекции. Как указывает шаг 1.6, избыток паяльника потребует большей краниотомии и, таким образом, увеличивает риск воспаления. Также очень важно использовать соответствующее количество клеевого оптического клея при фиксации покровного стекла к канюле визуализации, как указано в Шаге 1.11, так как недостаточное количество может привести к утечке спинномозговой жидкости в канюлю визуализации и сделать ее непрозрачной. С другой стороны, избыток оптического клея может привести к снижению прозрачности стеклянного окна. Возможное загрязнение имплантата визуализации может вызвать активное разрастание соединительной ткани под оптическим окном и/или сильное воспаление, что приведет к досрочному прекращению эксперимента. Поэтому сборка и подготовка имплантата перед операцией почти так же важна, как и сама хирургическая процедура.
Во время операции часть коры при краниотомии абляция мягкой аспирацией, что приводит к неизбежному кровотечению. Кровь в месте операции значительно снижает видимость мозговой ткани, которую необходимо удалить. Это усложняет точную оценку необходимой глубины абляции тканей. Тщательное промывание места операции PBS каждый раз перед применением отсасывания для удаления следующей части ткани обеспечивает лучший контроль глубины. Мозговая ткань всегда должна быть удалена небольшими порциями шаг за шагом, подтверждая глубину абляции ткани, прежде чем приступать к большему отсасывание. Более тонкий контроль всасывания также может быть достигнут с помощью более тонкой тупой иглы. Мы предлагаем использовать иглу 26 Г, однако диаметр меньше 26 Г более склонен к засорению. Кроме того, обычно требуется много практики, чтобы определить точную глубину аспирации, необходимую для каждого животного, так как цвет коры, мозолистого тела и гиппокампа может варьироваться от мыши к мыши(рисунок 3).
Установка и закрепление имплантата визуализации должны быть выполнены очень точно, чтобы обеспечить максимально возможное положение окна визуализации к дорсальной поверхности гиппокампа. Размер подготовленной краниотомии должен близко соответствовать имплантату и допускать его установку без значительного сопротивления. В то же время между черепом и имплантатом не должно быть видимого зазора, чтобы обеспечить надлежащую герметизацию и избежать воздействия мозговой ткани. Мягкое и стабильное давление должно быть приложено к верхней части имплантата во время его уплотнения к черепу. Почти неизбежно иметь кровь под окном визуализации во время установки имплантата. Если хирургическая процедура проведена правильно, окно должно очиститься через 3-7 дней, и сосудистая азкуль головного мозга станет хорошо видна. Также важно убедиться, что вирус правильно вводится под окно. В случае неудачной экспрессии вирус может быть повторно вставлен несколько раз.
Основным осложнением, с которым мы столкнулись в некоторых случаях, является снижение видимости окна визуализации. Существует несколько возможных причин плохого качества изображения: i) продолжающееся воспаление; ii) нарост соединительной ткани на стекле; iii) большой зазор между окном и гиппокампом. Воспаление обычно вызвано загрязнением во время операции или неправильно стерилизованным имплантатом визуализации. Мы предлагаем автоклавировать хирургические инструменты до и после каждой операции, дезинфицировать область операции непосредственно перед процедурой и носить чистые средства индивидуальной защиты во время операции. Имплантаты визуализации должны быть очищены после сборки, стерилизоваться и храниться в стерильных условиях. Нарастание соединительной ткани на стекле визуализа имплантата может быть обусловлено механическим загрязнением на поверхности стекла или чрезмерным травмированием мозговой ткани при абляции коры головного мозга. После сборки имплантата важно убедиться, что поверхность стекла чистая и гладкая. Кроме того, все кусочки поврежденной мозговой ткани должны быть тщательно удалены перед введением имплантата визуализации в краниотомию. В некоторых случаях зазор между стеклянным окном и гиппокампом приводит к накоплению спинномозговой жидкости, снижая качество визуализации. Поэтому во время установки имплантата крайне важно вставить его до укладки, чтобы обеспечить хороший контакт между гиппокампом и стеклянным окном. Иногда трудно определить точную причину непрозрачного окна изображения. Мы предлагаем провести патологоанатомический анализ, чтобы выявить условия под оптическим окном и соответственно скорректировать последующие операции.
Метод имеет несколько фундаментальных и технических ограничений, которые следует учитывать до и во время визуализации in vivo. Одним из основных ограничений является абляция коры головного мозга. Часть зрительной и сенсорной коры удаляется во время операции. Хотя трудно точно оценить влияние абляции коры головного мозга, поскольку удаленная ткань мозга не проецируется непосредственно на гиппокамп, несколько исследований не продемонстрировали заметного нарушения гиппокампа-зависимого обучения или других соответствующих функций гиппокампа15,16. Следует также учитывать оптические ограничения, особенно при использовании объективов с высоким NA. Например, в этом исследовании мы использовали канюлю длиной 1,75 мм с внутренним диаметром 1,9 мм. Геометрия этой канюли не сохранит полный NA воздушного объектива с NA более ~ 0,5 или водного объектива с NA более ~ 0,6, поскольку он будет обрезать часть света. Другим ограничением, общим для всех имплантатов визуализации мозга, является то, что часть мозга подвергается воздействию, что способствует потере тепла17,18. Тем не менее, физиологическая температура мозга может быть легко восстановлена во время визуализации путем перфузии теплого буфера.
Описанный способ может быть легко модифицирован или скорректирован для других применений. Например, препарат может быть адаптирован для визуализации полосатого тела7. Поскольку полосатое тело лежит немного глубже, чем гиппокамп, для сборки имплантата визуализации следует использовать более длинную канюлю визуализации. Мы предлагаем использовать канюлю с изображением 2,0 мм. Координаты краниотомии должны быть скорректированы соответствующим образом (AP: +0,8 мм, ML: −1,8 мм). Кроме того, инъекция вируса через инфузионную канюлю позволяет добиться экспрессии трансгена в тонком слое нейронов при использовании серотипа AAV с ограниченным распространением19,20. Это особенно полезно для однофотонной визуализации из-за уменьшения флуоресценции вне фокуса из более глубоких слоев и, как следствие, улучшенной визуализации с одноклеточным разрешением. Кроме того, инъекционная канюля также может быть использована во время функциональной визуализации для введения лекарств или других химических веществ непосредственно на нейроны в FOV(рисунок 5B). Общая инфузионная канюля добавляет полезные функции к имплантату визуализации, улучшая качество визуализации за счет целевой вирусной экспрессии и позволяя фармакологическую стимуляцию нейронов при FOV. Используемая головная пластина обеспечивает исключительную стабильность визуализационного имплантата, сводя к минимуму артефакты движения даже у активно движущихся животных на беговой дорожке. Головная пластина маленькая и легкая, причиняющая минимальный дискомфорт животным, и остается стабильной в течение нескольких месяцев после установки. Имплантат визуализации также совместим с многофотонной визуализацией15,16,21 и может быть объединен с микроэндоскопами22,23. Аналогичный имплантат визуализации также использовался для многофотонной визуализации более глубоких структур гиппокампа, включая слой радиатума, слой лакунозы и зубовидную извилину16,24,25,26,27. Однако нацеливание на более глубокие структуры гиппокампа с помощью AAV через инфузионную канюлю может потребовать дальнейшей оптимизации серотипа AAV и объема19.
Мы считаем, что описанный протокол облегчит исследования, направленные на изучение активности нейронов с высоким пространственно-временным разрешением в гиппокампе мышей с использованием простых и доступных однофотонных установок визуализации.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить всех членов Молекулярной биоинженерной группы в Университете Уэстлейк за помощь и полезную дискуссию. Мы также благодарим Джинзе Ли и Цзе-Мин Цзя из Университета Уэстлейка за помощь в съемках хирургической процедуры.
Эта работа была поддержана стартовым финансированием от Фонда Университета Уэстлейка, грантом BBRF Young Investigator 2020 года и грантом Национального фонда естественных наук Китая, 32050410298 все в K.D.P.
Материалы
| Name | Company | Catalog Number | Comments |
| Cover glass | Deckgläser | 72296-03 | |
| Denture Base Resin | ShangHai New Centery Dentel Material | N/A | Type I, self-solidifying |
| Dummy Cannula | RWD Life Science Co.,LTD | 62102 | OD 0.30mm |
| Guide Cannula | RWD Life Science Co.,LTD | 62003 | 26G |
| Head Fork | N/A | N/A | Custom made |
| Head Plate | N/A | N/A | Custom made |
| Imaging Cannula | N/A | N/A | Custom Made; OD 3mm, ID 2.7mm, Height 1.8mm, #108 stainless steel |
| Internal Cannula | RWD Life Science Co.,LTD | 62203 | 0.30*0.14 (OD*ID, mm) |
| Kwik Sil | World Precision Instruments | KWIK-SIL | |
| SuperBond C&B | SUN MEDICAL | N/A | SuperBond C&B kit |
| Treadmill Kit | N/A | N/A | Custom made |
| UV-cured Adhesive | NORLAND PRODUCTS | NOA 60 |
Ссылки
- Leutgeb, S., et al. Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science. 309 (5734), 619-623 (2005).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Polanco, J. C., et al. Amyloid-β and tau complexity - towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2018).
- Henneman, W. J. P., et al. Hippocampal atrophy rates in Alzheimer disease. Added value over whole brain volume measures. 72 (11), 999-1007 (2009).
- Camicioli, R., et al. Parkinson's disease is associated with hippocampal atrophy. Mov Disord. 18 (7), 784-790 (2003).
- Piatkevich, K. D., Murdock, M. H., Subach, F. V. Advances in Engineering and Application of Optogenetic Indicators for Neuroscience. Applied Sciences. 9 (3), 562 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Fan, L. Z., et al. All-Optical Electrophysiology Reveals the Role of Lateral Inhibition in Sensory Processing in Cortical Layer 1. Cell. 180 (3), 521-535 (2020).
- Shemesh, O. A., et al. Precision Calcium Imaging of Dense Neural Populations via a Cell-Body-Targeted Calcium Indicator. Neuron. 107 (3), 470-486 (2020).
- Villa, K. L., et al. Inhibitory Synapses Are Repeatedly Assembled and Removed at Persistent Sites In Vivo. Neuron. 89 (4), 756-769 (2016).
- Franklin, K. B. J., Paxinos, G. . Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , (2013).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Subach, O. M., et al. Novel Genetically Encoded Bright Positive Calcium Indicator NCaMP7 Based on the mNeonGreen Fluorescent Protein. International Journal of Molecular Sciences. 21 (5), 1644 (2020).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Kalmbach, A. S., Waters, J. Brain surface temperature under a craniotomy. Journal of neurophysiology. 108 (11), 3138-3146 (2012).
- Roche, M., et al. In vivo imaging with a water immersion objective affects brain temperature, blood flow and oxygenation. eLife. 8, 47324 (2019).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neuroscience Research. 93, 144-157 (2015).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H., Manfredssonn, F. P. . Gene Therapy for Neurological Disorders: Methods and Protocols. , 133-149 (2016).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), (2016).
- Yashiro, H., Nakahara, I., Funabiki, K., Riquimaroux, H. Micro-endoscopic system for functional assessment of neural circuits in deep brain regions: Simultaneous optical and electrical recordings of auditory responses in mouse's inferior colliculus. Neuroscience Research. 119, 61-69 (2017).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution In Vivo Imaging of Hippocampal Dendrites and Spines. The Journal of Neuroscience. 24 (13), 3147 (2004).
- Busche, M. A., et al. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proceedings of the National Academy of Sciences. 109 (22), 8740 (2012).
- Attardo, A., et al. Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Castello-Waldow, T. P., et al. Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. PLOS Biology. 18 (11), 3000928 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены