Method Article
マウスの振る舞いの海馬における神経活動を可視化するための頭蓋骨管制法
要約
この記事では、注入カニューレを補ったカスタムメイドのイメージングウィンドウの準備と、マウスの海馬のCA1領域への移植を示す。
要約
目覚めの行動動物における単細胞分解能におけるニューロン活動のイメージングは、システム神経科学における神経回路機能の研究にとって非常に強力なアプローチである。しかし、哺乳類組織における高い吸光度および散乱光は、主に脳内イメージングを表面的な脳領域に制限し、海馬などの深部脳領域は光学顕微鏡の手の届かないところに残っている。このビデオでは、ヘッド固定振る舞いマウスにおける眼海馬CA1領域の慢性in vivo イメージングを可能にするカスタムメイド画像ウィンドウの準備と移植を示す。カスタムメイドのウィンドウは、画像領域へのウイルスベクターおよび薬物の標的送達を可能にする注入カニューレで補われる。この調製物と広視野イメージングを組み合わせることで、数週間にわたってマウスを行動させるニューロンの大きなサブセットからの蛍光カルシウム指標を用いて、神経活動の長期的な記録を行った。また、この単一スパイク分解能による電圧イメージングの適用性も実証しました。ニューロン活性と科学的CMOSカメラの高性能遺伝的にコードされた指標は、高い時間分解能で単一ニューロンの細胞下形態学的詳細の繰り返し可視化を可能にした。また、説明した方法の利点と潜在的な制限、およびその他のイメージング技術との互換性についても説明します。
概要
海馬は、学習と記憶1だけでなく、空間ナビゲーション2を担当する重要な脳領域です。海馬萎縮は、記憶喪失と認知機能低下を伴う神経学的および精神障害に関連する3、4、5。マウスでは、海馬は、空間的、文脈的、および連想的学習および記憶形成を細胞レベル4,5で研究するための非常に確立されたモデルである。学習と記憶の機械学的研究では、マウスの動作における神経構造と機能の縦方向の尋問が必要です。遺伝子組み換えプローブ6と組み合わせた蛍光イメージングは、膜電圧ダイナミクス7、8、カルシウム過渡性9、および神経細胞の大きなサブセットに対する構造変化を極力重要な状態で記録する前例のない機能を提供する。しかし、マウスの海馬への光学的アクセスは皮質によって妨げられ、厚さは1mmを超える可能性がある。ここでは、マウスの動作中の裏海馬のCA1亜領域への長期的な光学アクセスのために、カスタムメイドの画像化装置とその慢性移植をマウスヘッドに組み立てる手順を説明した。画像インプラントに統合された注入カニューレは、視野のニューロンに直接ウイルスまたは薬物を投与することを可能にする。広視野顕微鏡と組み合わせて説明した調製は、長期間にわたってマウスを振る舞うニューロンの大きなサブセットの再的イメージングを可能にする。我々は、単一細胞分解能における神経活動記録のための組換えアデノ関連ウイルス(rAAV)の標的注入を介して海馬CA1領域のカルシウムおよび電圧遺伝的にコードされた指標を発現させるためにこの調製を利用した。また、行動する動物の高い時空間的分解能で、対応するニューロンサブセットの縦方向のカルシウムイメージングを行った。さらに、この調製物は多光子顕微鏡および顕微鏡検査と互換性があり、このように、マウスの行動中の細胞および細胞内レベルでニューロンネットワークを研究するためのイメージング技術のツールボックスをさらに拡大する。プロトコルの重要な手順とトラブルシューティングについて説明しました。また、この方法の落とし穴と限界についても説明しました。
プロトコル
ここに記載されているすべての方法は、ウェストレイク大学の施設動物のケアと使用委員会(IACUC)によって承認されています。
1. インプラント組み立て
注: イメージングインプラントの組み立ては技術的に簡単で、市販のアイテムのみを必要とします(図1、材料表も参照)。ヘッドプレートは、ステンレス製またはチタンプレートを使用して、地元の機械店で製造することができます。手術を開始する前に、完全に組み立てられたインプラントの在庫を準備することをお勧めします。インビボ実験が行われた後、インプラントを回収し、複数回再利用することができます。場合によっては、カバーガラスをはんだ付けまたは交換して注入カニューレを再装着するだけで済む場合があります。
- 6 つの主要なハードウェア コンポーネントすべてを準備して、イメージングインプラントの組み立てと設置を行います (図 1)。
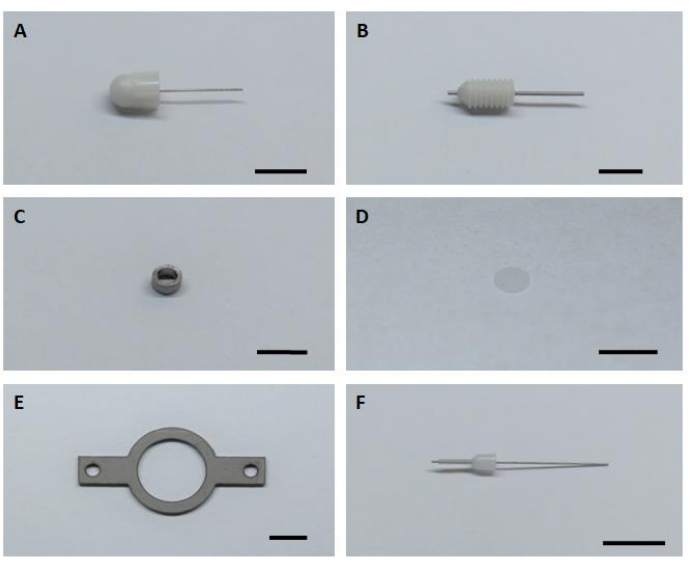
図1:イメージングインプラントの組み立てと設置のための6つの主要なハードウェアコンポーネント( A)ダミーカニューレ。(B)ガイドカニューレ。(C)イメージングカニューレ。(D) ガラスカバーガラス(E)ヘッドプレート。(F)内部カニューレ。スケールバー: 5 mm. この図の大きなバージョンを表示するには、ここをクリックしてください。
- 溶接機の電源を入れ、必要な温度まで加熱します。
メモ:温度は溶接スズによって異なります。 - 微細なサンドペーパーを使用して酸化層を除去し、より強いはんだ付けを容易にして、イメージングカニューレの側面を研磨します。
- 画像カニューレと射出カニューレ(挿入されたダミーカニューレ付きガイドカニューレ)の位置を、手を助けて調整します(図2A、B)。
- 注射器を針で使用し、少量の適切なフラックスを、画像化とカンヌラの間の接続スポットに5秒間塗布し、液滴を取り除きます。
注:この準備のために、我々は、イメージングと注入カニューラがステンレス鋼で作られているようにはんだ付けステンレス鋼部品のために、メーカーによって指定されている市販のフラックスを使用しました。カニューラの製造に使用する他の材料の場合、エンドユーザーは選択した材料を溶接できるフラックスを選択する必要があります。 - スズを溶融し、フラックスで処理された接続スポットに適用します(図2)。
注:手術中に不必要な大きな頭蓋切除術が必要になるため、余分なはんだ付けスズは避けてください。
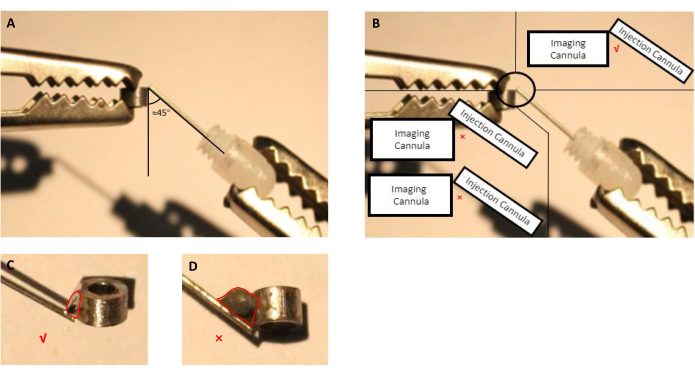
図2:射出カニューレを組み立てるの概略図は、挿入されたダミーカニューレを有するガイドカニューレと、イメージングカニューレを有する。(A)射出カニューレとイメージングカニューレの間の角度は、近位45度である必要があります。(B)射出カニューレの先端は、イメージングカニューレの端に正しく置く必要があります。(C)はんだ撮像および注入カニューレに使用される溶接スズの適切なサイズ(赤い線は、スズのドロップレットの輪郭を示す)。(D) インプラント調製中に避けるべき溶接スズの不適切なサイズ(赤い線はスズ液滴の輪郭を示す)。この図の大きなバージョンを表示するには、ここをクリックしてください。
- はんだ付けのスズが冷めるのを待ちます。通常、数秒かかります。
- ダミーカニューレを両方向に挿入して、射出カニューレがブロックされないことを確認します。
- 爪楊枝または26Gシリンジ針を使用して、撮像カニューレの底面にUV硬化光学接着剤を塗布します。
- ファイントゥイザーを使用して、画像カニューレに対応するサイズのカバーガラスを慎重に配置します。
注:ガラスの位置は、光学接着剤に触れた後、ガラスを動かさずにイメージングカニューレに正確に配置する必要があります。それ以外の場合、ガラスが汚れ、イメージングの品質が低下します。 - 標準的なハンドヘルドUVランプから350-400 nm UV照明によって少なくとも1時間接着剤を硬化させます。
注:使用する接着剤は、光学的に透明でなければなりません。それ以外の場合は、イメージングウィンドウの品質が低下します。
注意:UV保護メガネ、手袋、ラボコートを着用して、皮膚や目の露出を避けてください。 - カニューレを70%エタノールで洗浄し、空気乾燥し、手術まで滅菌容器に保管してください。
注:カバーガラスをできるだけ清潔でそのままにしておくことは非常に重要です。使用した光学接着剤は、70%エタノール中で化学的に安定である。
2. ウィンドウの埋め込み
- 手術前の準備ステップ
- オートクレーブ内のすべての手術器具を殺菌します。
- 1x PBSと70%エタノールを2つの別々のペトリ皿に入れ準備します。
- 必要に応じて:手術手術を開始する前に少なくとも20分間、UV光を使用して手術領域を消毒する。
注:可能な限り最も無菌状態で動作すると、ガラスで覆われた頭蓋窓が成功し、長持ち(6ヶ月)になります。汚染は、ほとんどの場合、窓の透明性を低下させるか、重度の炎症をもたらす可能性があります。
- 手術
- 手術の直前に70%エタノールで手術領域を殺菌します。
- IACUC承認動物プロトコルに従って、動物の重量を量り、鎮痛皮下投与前投与を行う。
- イオブルラン(誘導の場合は4%、維持する場合は1.5~2%、空気の流量は0.3~0.5 L/分)でマウスを麻酔します。動物が完全に鎮静されていることを確認するためにテールピンチとつま先ピンチ技術を使用してください。呼吸、SpO2、心拍数などの動物のバイタルサインを、処置の間観察する。
- トリマーまたは脱毛クリームを使用して、目まで首の後ろから毛皮を取り除きます。
- 手術用加熱パッドの上に立体的なフレームにマウスを置きます(37°Cを維持)。耳の棒で頭を固定します。頭を少し押して、頭がしっかりと固定されていることを確認します。
- 眼軟膏を塗布して、手術中に動物の目が乾燥するのを防ぎます。
- 子宮切開を行う前に、ベタジンとそれに続いて70%エタノールを3回投与して外科部位を殺菌する。
- 頭蓋骨の上部の皮膚を取り除き、頭の基部に沿って水平カットから始まり、続いて眼道方向に2つのカットを行い、まぶたにほぼ達し、次に正中線に収束する2つの斜めのカットを行います。
- 2つの無菌綿棒で、つなぎの組織だけでなく、首の後ろの筋肉を頭蓋骨の縁に引き込みます。
注:操作中に血管(特に筋肉に隠されたもの)に損傷を与えないようにしてください。 - 過度の痛みを避けるために、ペリオスの表面にリドカイン溶液(約0.1mL)を2分間塗布します。任意に頭蓋骨を除去した後に腫れから脳を減らすために、1%デキサメタゾンの0.1 mLを皮下注射することができる。
- スカルの露出した領域全体をメスで静かに削り取り、接着剤と歯科用セメントをより良く付着させ、慢性的な移植をもたらす乾燥した粗い表面を作成します。
- ステレオタキシックステーションに取り付けられた針の先端をブレグマに置き、3つの座標すべてを設定します(AP:前部後部;ML: 内側- 内側;DV: ドーサル-腹側) 0.
- 針の先端をラムダに置き、AP 座標が 0 であるかどうかを確認して、ヘッドの位置が垂直であることを確認し、また、ヘッドが水平に配置されていることを確認するために ML 座標が 0 であるかどうかを確認します。ない場合は、AP と ML 座標の両方が 0.1 mm 以内になるまで、ステレオタキシック ステーションの対応するノブを調整します。
- 針の先端を動かして頭蓋骨切り出し術の対応する点を見つけ、細かいマーカーを使用して頭蓋骨の位置をマークします。海馬の移植の場合、次の座標を持つ4点があります(AP:-0.68、 ML: -2.0) (AP: -3.68, ML: -2.0) (AP: -2.18, ML: -0.5) および (AP: -2.18, ML: -3.5)11, 同様に (AP: -4.0, ML: -2.0) 注射カニューラの最も大きいなポイント.
注:このステップで使用するマーカーは、手術前に少なくとも1時間、UV照明を使用して滅菌する必要があります。ここに示す座標は、6-8週齢のC57BL/6Jマウス用です。座標は、異なる年齢やマウスの株によって異なる場合があります。 - 4つのマークされた点に基づいて円を描き、円の尾側の射出カニューレ領域の輪郭を描く(図3)。
- 10,000 rpmの速度で空気圧ドリルを使用して、頭蓋骨にマークされた輪郭に沿って優しく「描画」します。
- 骨の非常に薄い層が残るまで頭蓋骨を掘削し、通常は中央の穏やかなタッチの下で揺れ始めます。
- 頭蓋骨切除術の中心に無菌1x PBSの滴を適用し、非常に薄い先端鉗子または反対側から接近する2つの26 G針で頭蓋骨から骨のフラップを持ち上げます。
注:PBSは頭蓋骨の部分を取り除き、dura12の出血の可能性を防ぐのに役立ちます。 - PBSを適用し、続いて26G鈍い針を通して穏やかな吸引を数回行い、硬膜の表面をきれいにする。
- 抱負または眼用はさみによって、硬膜をそっと取り除きます。穏やかな吸引(〜-60kPa)を適用して、海馬の上の体の梁と同様に皮質をアブラ化します。
注:皮質は、多くの場合、脳梁よりも黄色であり、脳梁は、通常、海馬よりも白いです。この脳梁は、通常、上から観察すると垂直および水平方向に行く神経線維によって区別が容易である(図3)。
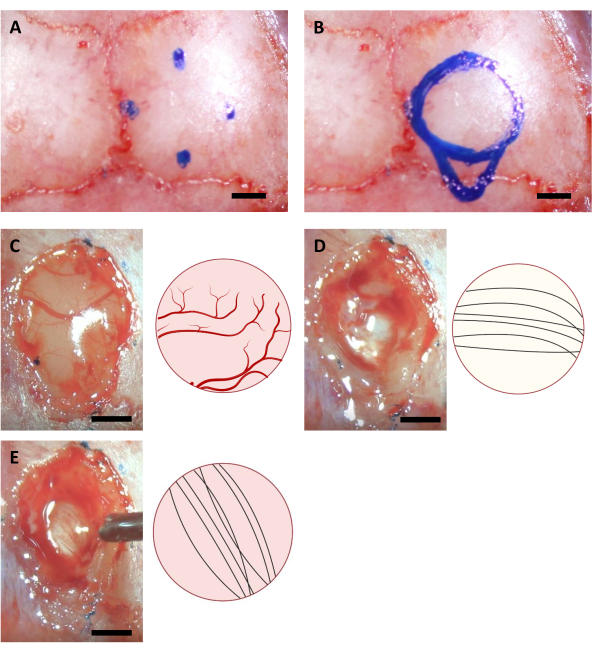
図3:海馬の位置と脳切れ過程の立体的座標(A)頭蓋切り出し領域の縁の4つの座標。(B) 完全な頭蓋間術領域。(C-E)手術中に取得した代表的な画像(左)とその模式図(右)は、(A)の神経線維の異なる色と方向を示す(A)コルテックス(B)コーパスカロサム、および(C)皮質アブレーション中に見える海馬。スケールバー: 1 mm.この図の大きなバージョンを表示するには、ここをクリックしてください。
- この時点での出血は、頭蓋切り出しにおける脳組織の視認性に影響を与える。血液を取り除くために皮質を吸引しながら、穏やかな吸引に続いて、1x PBSを適用します。
注:このステップの間に連続出血は避けられず、ある程度、連続出血は正常な血圧の徴候である。皮質イメージングウィンドウの移植とは異なり、光学窓の下に血液の存在は、手術の数日後にクリアされるため許容されます。皮質をアブレイトした後、できるだけ早く作成された空洞への画像カニューレの挿入が最適です。 - 頭蓋切除術が画像カニューレよりも<0.5mm大きい場合は、スーパーボンドでインプラントを固定する前に、余分なKwik Silシーリングを使用してカニューレの設置をある程度救ってください。
- 開頭術がイメージングカニューレよりも<0.5mm小さい場合は、開頭術の縁部の残りの骨が頭蓋骨自体よりも薄いため、細かいツイーザーまたは眼用ハサミを使用して開頭術の端をトリミングすることによって、ある程度外科的処置を救助する。
注:0.5ミリメートル以上の範囲を超えている頭蓋骨切除術は救助することはできません。これらの場合の対応するアクションは、動物のプロトコルに従って終了手順に従う必要があります。
- インプラントを静かに頭蓋骨の骨組に挿入します。
- L字針でインプラントの上にしっかりと押し付け、インプラントの光学窓を海馬の露出面にできるだけ近づけます。インプラントの挿入中に可能な限り血液を除去するために吸引を続けるインプラントの周りの頭蓋骨にPBSを繰り返し適用する。次に、インプラントと頭蓋骨の間にKwik Silの薄い層を適用して、歯科用セメントが頭蓋骨の下に浸透するのを防ぎます(図4)。
- 下の血液または他の液体の蓄積を避けるために、インプラントの光学窓の配置が海馬に対して正しいことを確認してください。
注:重要なポイントは、イメージングカニューレのカバーガラスが海馬に対して正しく配置されていることを確認することです。光学窓が海馬に対して配置されている限り、イメージングカニューレの上側が頭蓋骨に平行であるかどうかは、最終的な光学アクセスにとって重要ではない。 - CA1領域上の皮質の平均厚さに応じて、頭蓋骨へのカニューレの付着を容易にするために、画像カニューレの上面を頭蓋骨表面の上に~0.5mm保持する(図4)。
- 下の血液または他の液体の蓄積を避けるために、インプラントの光学窓の配置が海馬に対して正しいことを確認してください。
- 通常、約1分以下のKwik Silが治癒したら、頭蓋骨の表面、Kwik-Silの表面、およびインプラントの上面にスーパーボンドC&Bを均等に塗布します。
- スーパーボンドC&Bが硬化したら、スーパーボンドC&Bの上に入れ歯ベース樹脂を塗布し、手術開始時に行った切開部の周りの皮膚を塗布します。
注: セメントの代替タイプは、複数のベンダーから入手可能です。対応する製造元の指示に従います。 - 入れ歯ベース樹脂を硬化させた後、インプラントの周りの樹脂の上にヘッドプレートを置き、イメージングカニューレと同心円にします。ヘッドプレートの周りと上に入れ歯ベース樹脂を塗布して、その位置を固定します。数分間治しましょう。
- カニューレの周りに厚いセメント層を構築することは避けて、対物レンズを使用してイメージングウィンドウへのアクセスを改善します(図4)。
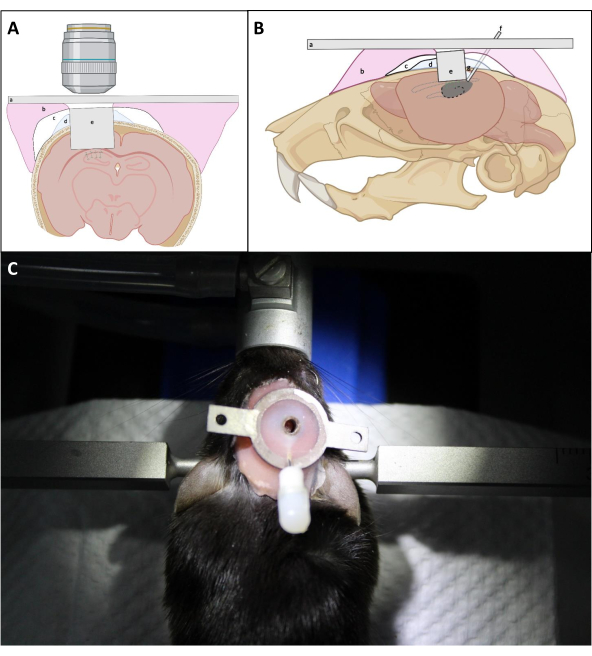
図4:(A)コロナルおよび(B)矢状図における窓埋め込みの概略図。() ヘッドプレート;(b) 入れ歯ベース樹脂;(c) スーパーボンド;(d) クウィックシル;(e) イメージングカニューレ;(f)注射カニューレ;(g) はんだ付けスズ。(C):手術後にインプラントを装着したマウス。この図の大きなバージョンを表示するには、ここをクリックしてください。
- 入れ歯ベース樹脂を希釈して粘度を下げ、アプリケーターで手が届きにくい警告を満たします。
- 断熱したゴムテープを窓の上にそっと置き、動物の寝具から汚染される可能性を防ぎます。
- 手術が終わったら、炎症反応を防ぐために皮下に抗炎症薬を注入する。
- 麻酔から回復するまで、動物を暖かいケージに入れます。
- 一般的な行動を観察して、手術後72時間のマウスの健康状態を確認します。抗炎症薬および鎮痛薬は、痛みを解放し、炎症反応を軽減するために、24時間ごとに2〜3日間の皮下注射される。
注:術後ケアのための代替監視手順、薬物および投与量は、正確な手順のためのIUCAC承認動物プロトコルを参照してください。 - 窓の下の血管系を観察するために、手術後5〜7日の窓をチェックしてください。透明なウィンドウの場合、動物はウイルス注射の準備ができています。
3. ウイルスの注入
注:ウイルス注射は通常、手術後5〜7日で行われます。ウイルス注射の前に、画像化窓がはっきりしていることを確認する必要があり、脳血管構造を観察することが可能である(図5)。場合によっては、ウィンドウをクリアするのに最大14〜16日かかる場合があり、脳の炎症が検出されない場合にも許容されます。
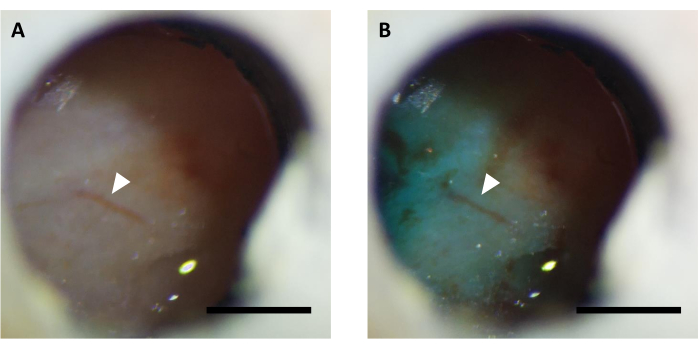
図5:高速グリーン色素を付加したウイルス注入後の光学窓(A)前及び(B)の代表的な画像。 矢印は同じ血管構造を示します。スケールバー: 1 mm. この図の大きなバージョンを表示するには、ここをクリックしてください。
- 高速緑色の染料ストック溶液をウイルス溶液に加え、PCRチューブ中の1:9の比で所望の抗度剤に希釈します。
注: 高速緑色の染料が追加され、注射中のウイルス溶液の可視化が容易になります。 - ポリエチレンチューブをシリンジと接続し、シリンジポンプを使用してミネラルオイルでチューブを埋め戻します。
- 内部カニューレをチューブの反対側に接続し、注入し、ミネラルオイルを数回引き出して、内部カニューレが詰まらないようにします。
- イソフルラン(誘導の場合は4%、維持用1.5~2%、空気の0.3-0.5 L/分流量)で動物を麻酔し、ヘッドを加熱パッド(37°Cを維持)上で立体化フレームに固定し、目の軟膏を塗布します。
- ウイルス溶液の600 nLを撤回し、ダミーカニューレを取り外し、注射器に接続された内部カニューレをガイドカニューレに挿入し、合計で10分間50 nL/minの速度でウイルスを注入する。
メモ:ステレオ顕微鏡を使用して窓から色素が見えるかどうかを確認し、ウイルスの注入が成功したことを確認します(図5)。 - 注射後、ウイルスが窓の下に広がるように、内部カニューレを10分間接続し続けます。
- ガイドカニューレから内側のカニューレをそっと取り出し、ダミーカニューレで再現します。
- 麻酔から回復するまで、動物を暖かいケージに入れます。
注:通常、マウスはウイルス注射後10〜20日でイメージングの準備ができています。発現量と時間は、遺伝子発現を促進するために使用されるウイルス血清型およびプロモーターに依存する。
4. 広視野顕微鏡下での目覚めのマウスのイメージング。
注:準備されたヘッドプレートは、画像性インプラントの異常な安定性を提供し、したがって、目覚めと最小限の動きアーティファクトでマウスを振る舞う縦方向のイメージングを可能にします。
- マウスを4%のイオブルランで数分間誘導し、ヘッドプレートをヘッドフォークに固定し、ヘッドフォークをトレッドミルに固定します。
注:ヘッドフォークとトレッドミルは、この研究で使用されるヘッドプレート用にカスタマイズされています、 対応するCADファイルについては、サポート材料を参照してください。頭部固定前のマウスの誘導は、この手順のために動物を慣らすることが可能であるため、任意である。 - トレッドミルを顕微鏡ステージの下に移動し、光学窓を対物レンズの下に置きます。
- 低倍率対物レンズを使用して機能イメージングに最適な視野(FOV)を見つけ、より高いNA対物レンズに切り替えて、単一細胞解像度でニューロンの活動を記録します。
注: 射出カニューレが、その作業距離を達成するために、対物レンズの障害物である場合は、ワイヤークリッパーを使用してヘッドプレートから注入カニューレを切り落とします。
結果
遺伝子でコード化されたカルシウムインジケーターを用いた神経活動のインビボイメージング平均して、十分なレベルの遺伝子導入発現が達成されれば、インビボイメージングは移植後3〜4週間開始する。この時までに、脳浮腫と出血は通常完全に解決され、脳血管構造は光学窓を通して容易に観察することができる。ここでは、蛍光広視野顕微鏡下でマウスを振る舞う後海馬CA1領域における神経活動の繰り返し記録を行う製剤を利用した。神経活動を記録するために、GCaMP6s14と同様のカルシウム感受性および時間分解能を示す明るい遺伝子でコード化されたカルシウム指標NCaMP713を用いた。海馬中のNCaMP7指標を発現させるために、注入カニューレを用いてrAAV/DJ-CAG-NCaMP7ウイルスを注入し、注射後14日で経度イメージングを開始した。ニューロン活動を記録するために、10x NA 0.3エア対物レンズと浜松オルカフュージョンsCMOSカメラを使用し、最大100Hz周波数で〜1.5x1.5mmのFOVでイメージングを可能にしました。緑色蛍光は、標準GFPフィルタセットを用いて市販の470nm LEDで励起された。緑色のチャネルで得られるイメージングの平均深さは約50〜120μmで、主に地層オリエンと角錐体での神経活動の記録が可能です。近赤外線チャネルのイメージング深さは、海馬8のより深い層に到達するために最大200 μmであることができます。1FOV当たりの平均記録時間は6〜12分であったが、NCaMP7が極めて高い光毒性を有し、検出可能な光毒性が認められなかったため、撮影セッションが非常に長く可能である(図6)。
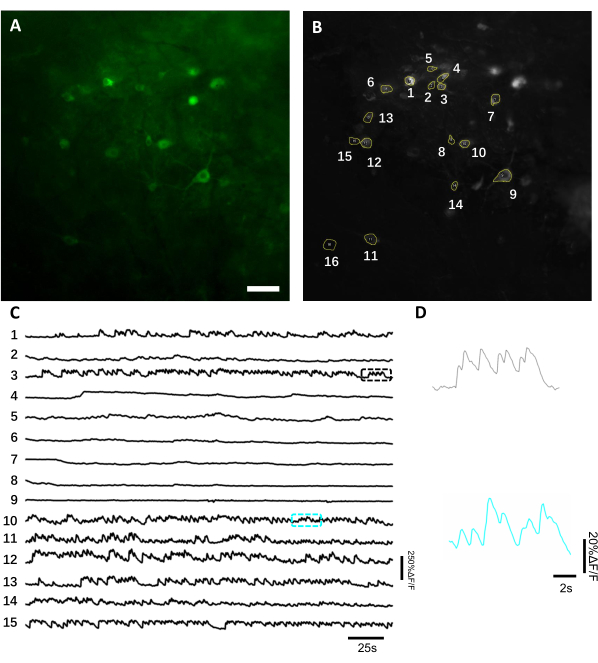
図6:緑色蛍光を用いた海馬ニューロンにおける神経活動の記録を、遺伝子組み換えカルシウム指標に遺伝子でコードした緑色蛍光を用いたものである。(B)Aに示された単一のニューロンに対応する15のROIを、記録全体の標準偏差投影を用いて選択した。(C)B. (D) C. スケールバーに示す対応するカラーボックスに示されている2つのカルシウムトレースの代表的なズームインビューである、この図のより大きなバージョンを表示するには、ここをクリックしてください。
蛍光痕を得るために、ニューロンソマに対応する対象領域(ROI)を手動でセグメント化し、ImageJソフトウェアによって分析した。画像解析のモーション補正の前に、取得したデータセットは画像移植の安定性が高いためモーションアーチファクトを示さなかったため、起床動物の一般的な記録後の手順は必要とされませんでした。目を覚ますマウスの海馬からの神経活動の代表的な単一試験光学記録を 図6に示す。神経細胞のソマに対応する15 ROIを 、図6Bに示す同じFOVから手動で選択し、各ROI内の単回蛍光トレースを 図6Cに示す。 図6D は、2つの異なるROIからの蛍光トレースの2つの代表的な部分を示しています。同じFOVに対して3日間間隔で4回連続イメージングセッションを実施しました。少なくとも2週間、特定のFOVで同じニューロンを同定して画像化することができました(この研究では長いイメージングセッションが行われなかったが、以前は7匹のマウスで最大6ヶ月間のイメージング研究に同じ製剤が使用されてきた。 図 7)。本研究では、ウイルス送達21日後でも対象遺伝子の強い発現を駆動していたAAV/DJ-CAGベクターを用いた(補足図1)。連続発現は、蛍光の背景の増加とカルシウム指標を発現する新しいニューロンの出現による同じニューロンの長期同定を複雑にした。したがって、同じニューロンのサブセットの縦方向イメージングが必要な場合、標的遺伝子発現を駆動するAAV血清型およびプロモーターの選択は、特に実験計画中の重要な考慮事項の1つであるべきである。画像の質は近位の樹状突起を解決し、血管を視覚化することを許した。
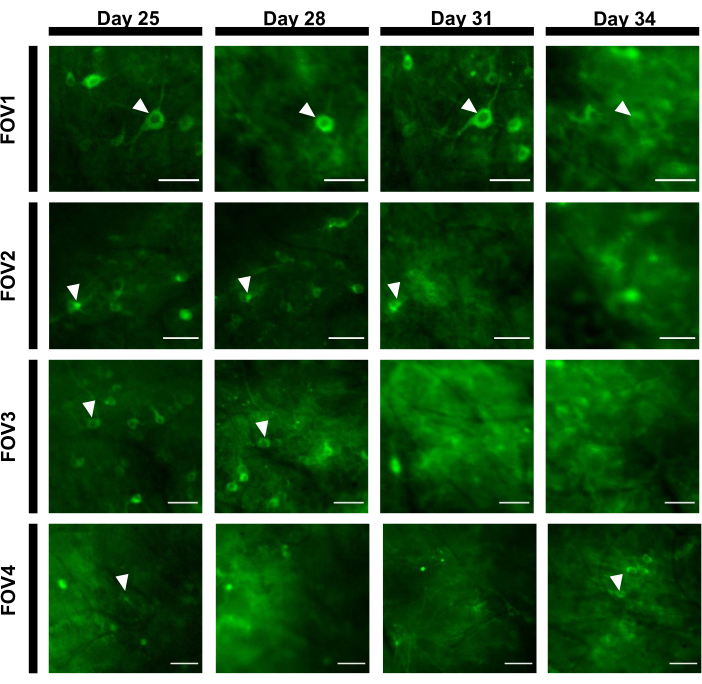
図7:海馬領域からの4つの異なるFOVの画像配列を12日間にわたって追跡した。 動物は0日目に窓を埋め込み、7日目にrAAV/DJ-CAG-NCaMP7ウイルスを注射された。矢印は、FOV内で追跡されたニューロンを示します。スケールバー:80 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
遺伝子組み換え電圧センサを用いた神経活動のインビボイメージング
本研究では、新しい遺伝的にコード化された電圧センサSomArchon7を用いて、7,8の挙動動物における単細胞単一スパイク分解能による電圧イメージングを可能にした。SomArchonを表現するために、注入カニューレを用いてrAAV/DJ-CAG-SomArchonウイルスを注入し、注射後数日後にヘッド固定動作マウスで電圧イメージングを行いました。ニューロン活動を記録するために、40x NA 0.8対物レンズと浜松オルカフュージョンsCMOSカメラを使用して、最大830Hzの取得速度で150x40 μmのFOVを画像化することができました。スペクトルの可視範囲で発現の可視化を容易にするためにSomArchonの一部が構築するGFPタンパク質は、緑色のチャネル(470/20 nmのLED励起、放出525/50nm)で容易に画像化され、電圧イメージングに関心のある細胞を見つけることができます。光学電圧記録は、830 Hz取得速度で4 x 4ビニングを用いて、近赤外チャネル(3.4 W/mm2で637nmのレーザー励起、発光665 nmロングパス)で行われました。1アクションポテンシャル7の平均SNRを有する目覚醒マウスにおける海馬ニューロンの自発的な活動を記録した(図8)。
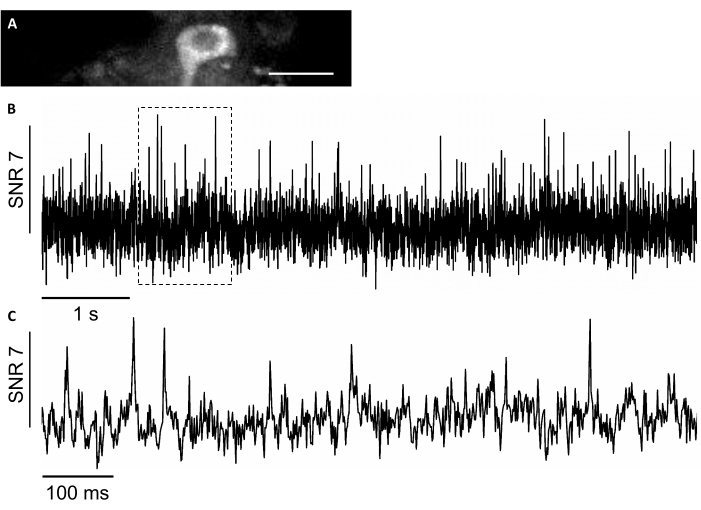
図8:近赤外蛍光を用いた海馬ニューロンにおける神経活動の記録を、遺伝子組み換え電圧指標SomArchonに近赤外蛍光を用いた。(A)近赤外線チャネルで広視野蛍光顕微鏡下で画像化された選択されたFOV。(B)A. ( C ) B. Scale バーに示す対応するボックス内の電圧トレースの代表的なズームインビューである A. (C)この図の大きなバージョンを表示するには、ここをクリックしてください。
組織学
機能的イメージング研究が行われた後、死後の分析を使用して、インプラントの正しい配置、ウイルス発現の領域、および画像化されたニューロンにおける関心のあるタンパク質の局在化を確認します。ウイルス発現および移植片の配置の組織学的検証のために、PFA固定脳のコロナ切片を蛍光広視野顕微鏡下で調べた(図9A、C)。 共焦点顕微鏡は、カルシウムインジケーターを発現する個々のニューロンの高解像度画像と電圧指標(図9B、D)を取得するために使用した。DAPI染色は、脳スライスの全体的な形態を可視化するために使用された。さらに、脳スライスは、免疫体系化学を用いて評価し、窓の移植およびウイルス発現によって引き起こされるアストログリオーシスまたは神経膠症を検証することができる。我々の以前の研究は、手順が顕著なgliosis7を誘導しなかったことを実証した。
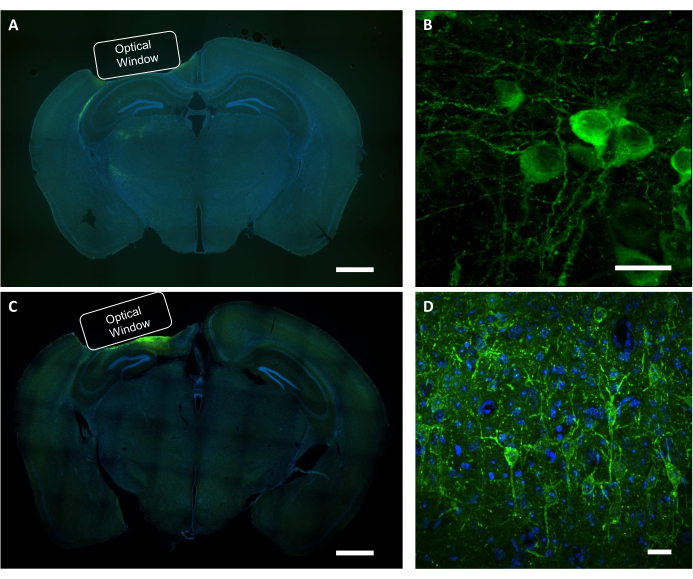
図9:光学窓位置およびウイルス発現の組織学的検証を行う。(A)NCaMP発現マウスからの光学窓の配置を示すコロナセクション脳スライスの代表的な蛍光画像である。スケールバー: 1 mm. (B) NCaMP7指標を発現するニューロンの代表的な共焦点画像。スケールバー:25μm(C)ソムアルコン発現マウスからの光学窓の配置を示すコロナセクション脳スライスの代表的な蛍光画像。スケールバー: 1 mm. (D) SomArchon 指標を発現するニューロンの代表的な共焦点画像。スケールバー:25 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
補足図1: 発現時間と共に相対的な蛍光強度の定量分析このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここでは、マウスの振る舞いにおける海馬CA1領域の長期イメージング方法について説明する。この方法は、カスタムメイドのイメージングウィンドウの慢性移植に基づいており、対象ニューロンに直接ウイルスまたは薬物の標的投与を可能にする。本プロトコルは、4つの主要な部分から構成されています: i) イメージングインプラントの組み立て;ii) イメージングインプラントのインストール;iii) 画像移植によるウイルス注入;iv) マウスの動作における機能的イメージング。以下では、プロトコル、トラブルシューティング、変更、およびメソッドの制限の重要な手順について説明し、説明します。また、メソッドの重要性と、その代替アプリケーションの可能性についても説明します。
説明されたプロトコルには、手術を成功させるためにかなり重要ないくつかの重要なステップがあります: (i) 高品質のイメージングインプラントの調製;(ii) 無菌手術条件;(iii) 皮質の吸引;(iv)イメージングインプラントの正確な配置。(v) ウイルス注射.ステップ1.6が示すように、過剰なはんだ付けスズはより大きな頭蓋切除術を必要とし、したがって炎症のリスクを高める。また、ステップ1.11に示すように、カバーガラスをイメージングカニューレに固定する際に適切な量の粘着剤を使用することも非常に重要であり、不十分な量がイメージングカニューレへの脳脊髄液の漏出をもたらし、不透明になる可能性があるためです。一方、過剰な光学接着剤は、ガラス窓の透明性を低下させることがある。イメージングインプラントの汚染の可能性は、光学窓の下での結合組織の活性増殖および/または重度の炎症を引き起こし、実験の早期終了につながる。したがって、手術前の画像移植体の組み立ておよび準備は、外科的処置自体とほぼ同じくらい重要である。
手術中、頭蓋骨の下皮質の部分は穏やかな吸引によって失われ、必然的な出血をもたらす。外科部位の血液は、除去しなければならない脳組織の視認性を有意に低下させる。これは、組織アブレーションの必要な深さの正確な評価を複雑にします。組織の次の部分を除去するために吸引を適用する前に毎回PBSで外科部位の慎重な洗い流しは、深さのより良い制御を提供します。脳組織は、より多くの吸引を進める前に、アブレートされた組織の深さを確認するステップバイステップで常に小さな部分で除去する必要があります。吸引のより細い制御はまたより薄い鈍い針と達成することができる。26G針を使用することをお勧めしますが、直径26Gより小さい方が詰まりやすくなります。さらに、皮質、脳梁、海馬の色がマウスによって異なる可能性があるため、通常、各動物に必要な正確な吸引深度を決定するには多くの練習が必要です(図3)。
画像インプラントの挿入および固定は、海馬の後部表面にイメージングウィンドウの最も近い位置を確保するために非常に正確に行われるべきである。準備された頭蓋骨の大きさはインプラントと密接に一致し、重大な抵抗なしに挿入を可能にするべきである。同時に、適切な密封を確実にし、脳組織暴露を避けるために、頭蓋骨とインプラントの間に目に見えるギャップがあってはならない。穏やかで安定した圧力は、頭蓋骨への密閉中にインプラントの上部に適用されるべきです。インプラントの取り付けの間に画像の窓の下に血を持つことはほとんど避けられません。外科手術が適切に行われると、窓は3〜7日でクリアされ、脳血管構造がはっきりと見えるようになります。また、ウイルスがウィンドウの下に適切に注入されるようにすることも重要です。式に失敗した場合、ウイルスを複数回再注入することができます。
場合によっては、イメージング ウィンドウの視認性が低下する可能性があります。イメージング品質が低い理由はいくつかあります: i) 継続的な炎症;ii)ガラス上の結合組織の成長;iii)窓と海馬の間の大きなギャップ。炎症は通常、手術中の汚染によって、または適切に殺菌された画像化インプラントによって引き起こされる。手術前後に手術器具をオートクレーブし、手術の直前に手術領域を消毒し、手術中に清潔な個人用保護具を着用することをお勧めします。イメージングインプラントは、組み立て後に洗浄し、滅菌し、滅菌状態で保管する必要があります。画像移植のガラス上の結合組織の成長は、ガラスの表面の機械的汚染または皮質アブレーション中の脳組織の過度の外傷に起因する可能性がある。インプラントを組み立てた後、ガラス表面がきれいで滑らかであることを確認することが重要です。また、損傷した脳組織のすべての部分は、頭蓋切除術にイメージングインプラントを挿入する前に慎重に除去する必要があります。場合によっては、ガラス窓と海馬の間の隙間が脳脊髄液の蓄積をもたらし、イメージングの質を低下させる。したがって、インプラントの設置中に、海馬とガラス窓の間の良好な接触を確保するために、すべての方法を挿入することが重要です。場合によっては、不透明な画像化ウィンドウの正確な理由を特定することが困難である。我々は、光学窓の下の状態を明らかにし、それに応じてその後の手術を調整するために事後分析を行うことを提案する。
この方法には、インビボイメージングの前および中に考慮すべきいくつかの基本的および技術的な制限があります。主な制限の1つは皮質アブレーションです。視覚および感覚皮質の一部は外科の間取除かれる。皮質切除の影響を正確に評価することは困難であるが、除去された脳組織が海馬に直接投影されないので、いくつかの研究は海馬依存性学習または他の関連する海馬機能15、16の顕著な障害を示さなかった。特に高NA対物レンズを使用する場合は、光学的制限も考慮する必要があります。例えば、この研究では、1.75mmの長いカニューレを1.9mm内径で使用しました。このカニューレの幾何学は、NA以上の空気目的の完全なNAを保持しません〜0.5以上またはNA以上の水の目的は、光の一部をクリップします。脳イメージングインプラントに共通するもう一つの制限は、脳の一部が露出し、したがって熱損失17、18を促進する。しかし、温かい緩衝液の灌流によって画像化の間に生理的な脳温度を容易に回復させることができる。
説明方法は、他のアプリケーションに対して容易に変更または調整することができる。例えば、この調製物は、線条体7の撮像に適応することができる。線条体は海馬よりもわずかに深く置かれるので、イメージング用インプラントを組み立てるのに長いイメージングカニューレを使用する必要があります。2.0 mmイメージングカニューレを使用することをお勧めします。頭蓋骨の座標は、対応して調整する必要があります(AP:+0.8 mm、ML:−1.8 mm)。また、注入カニューレによるウイルス注入は、AAV血清型を使用する場合にニューロンの薄層におけるトランスジーンの発現を達成することを可能にする19,20。これは、より深い層からの焦点外蛍光が減少し、その結果、単一細胞分解能イメージングの改善による1光子イメージングに特に有益です。さらに、注射カニューレは、FOV内のニューロンに直接薬物または他の化学物質を直接投与するための機能的なイメージング中に使用することもできる(図5B)。全体的な注入カニューレは、イメージングインプラントに有用な機能を追加し、標的ウイルス発現によるイメージング品質を向上させ、FOVにおけるニューロンの薬理学的刺激を可能にする。使用されるヘッドプレートは、トレッドミル上で動物を積極的に動かす場合でも、動きアーティファクトを最小限に抑える画像インプラントの異常な安定性を提供します。ヘッドプレートは小さくて軽く、動物に対する不快感を最小限に抑え、設置後数ヶ月間安定しています。イメージングインプラントは、マルチフォトンイメージング15、16、21と互換性があり、マイクロ内視鏡22、23と組み合わせることができます。同様のイメージングインプラントは、ラジウムラジウム、ラクノース層、およびデンテート回16、24、25、26、27を含む、より深い海馬構造の多光子イメージングにも使用された。しかし、注入カニューレを介してAAVでより深い海馬構造を標的にすることは、AAV血清型および容積19のさらなる最適化を必要とするかもしれない。
我々は、記載されたプロトコルは、単純で手頃な価格の1光子イメージングセットアップを使用して、マウスを振る舞う海馬の高い時空間分解能を持つ神経活動を調査することを目的とした研究を容易にすると考えている。
開示事項
著者らは開示するものは何もない。
謝辞
ウェストレイク大学の分子バイオエンジニアリンググループのメンバーの皆さんに、すべての助けと有益な議論に感謝したいと思います。また、ウェストレイク大学のジンゼ・リーとジエミン・ジアに対し、外科的処置の撮影に協力してくれたことに感謝します。
この研究は、ウェストレイク大学財団、2020年BBRFヤング・ポストラー・グラント、中国国立自然科学財団の助成金から、K.D.P 32050410298に資金を提供しました。
資料
| Name | Company | Catalog Number | Comments |
| Cover glass | Deckgläser | 72296-03 | |
| Denture Base Resin | ShangHai New Centery Dentel Material | N/A | Type I, self-solidifying |
| Dummy Cannula | RWD Life Science Co.,LTD | 62102 | OD 0.30mm |
| Guide Cannula | RWD Life Science Co.,LTD | 62003 | 26G |
| Head Fork | N/A | N/A | Custom made |
| Head Plate | N/A | N/A | Custom made |
| Imaging Cannula | N/A | N/A | Custom Made; OD 3mm, ID 2.7mm, Height 1.8mm, #108 stainless steel |
| Internal Cannula | RWD Life Science Co.,LTD | 62203 | 0.30*0.14 (OD*ID, mm) |
| Kwik Sil | World Precision Instruments | KWIK-SIL | |
| SuperBond C&B | SUN MEDICAL | N/A | SuperBond C&B kit |
| Treadmill Kit | N/A | N/A | Custom made |
| UV-cured Adhesive | NORLAND PRODUCTS | NOA 60 |
参考文献
- Leutgeb, S., et al. Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science. 309 (5734), 619-623 (2005).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Polanco, J. C., et al. Amyloid-β and tau complexity - towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2018).
- Henneman, W. J. P., et al. Hippocampal atrophy rates in Alzheimer disease. Added value over whole brain volume measures. 72 (11), 999-1007 (2009).
- Camicioli, R., et al. Parkinson's disease is associated with hippocampal atrophy. Mov Disord. 18 (7), 784-790 (2003).
- Piatkevich, K. D., Murdock, M. H., Subach, F. V. Advances in Engineering and Application of Optogenetic Indicators for Neuroscience. Applied Sciences. 9 (3), 562(2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Fan, L. Z., et al. All-Optical Electrophysiology Reveals the Role of Lateral Inhibition in Sensory Processing in Cortical Layer 1. Cell. 180 (3), 521-535 (2020).
- Shemesh, O. A., et al. Precision Calcium Imaging of Dense Neural Populations via a Cell-Body-Targeted Calcium Indicator. Neuron. 107 (3), 470-486 (2020).
- Villa, K. L., et al. Inhibitory Synapses Are Repeatedly Assembled and Removed at Persistent Sites In Vivo. Neuron. 89 (4), 756-769 (2016).
- Franklin, K. B. J., Paxinos, G. Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , (2013).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), e680(2008).
- Subach, O. M., et al. Novel Genetically Encoded Bright Positive Calcium Indicator NCaMP7 Based on the mNeonGreen Fluorescent Protein. International Journal of Molecular Sciences. 21 (5), 1644(2020).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Kalmbach, A. S., Waters, J. Brain surface temperature under a craniotomy. Journal of neurophysiology. 108 (11), 3138-3146 (2012).
- Roche, M., et al. In vivo imaging with a water immersion objective affects brain temperature, blood flow and oxygenation. eLife. 8, 47324(2019).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neuroscience Research. 93, 144-157 (2015).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Gene Therapy for Neurological Disorders: Methods and Protocols. Manfredssonn, F. P. , Springer. New York. 133-149 (2016).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), (2016).
- Yashiro, H., Nakahara, I., Funabiki, K., Riquimaroux, H. Micro-endoscopic system for functional assessment of neural circuits in deep brain regions: Simultaneous optical and electrical recordings of auditory responses in mouse's inferior colliculus. Neuroscience Research. 119, 61-69 (2017).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution In Vivo Imaging of Hippocampal Dendrites and Spines. The Journal of Neuroscience. 24 (13), 3147(2004).
- Busche, M. A., et al. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proceedings of the National Academy of Sciences. 109 (22), 8740(2012).
- Attardo, A., et al. Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Castello-Waldow, T. P., et al. Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. PLOS Biology. 18 (11), 3000928(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved