Method Article
Behaving Farelerinin Hipokampusunda Nöronal Aktiviteleri Görselleştirmek için Kraniyotomi Prosedürü
Bu Makalede
Özet
Bu makale, infüzyon kanülü ile desteklenmiş özel yapım bir görüntüleme penceresinin hazırlanmasını ve farelerde hipokampüsün CA1 bölgesine implantasyonunu göstermektedir.
Özet
Uyanık davranan hayvanlarda nöronal aktiviteleri tek hücreli çözünürlükte görüntülemek, sistem sinirbiliminde sinir devresi fonksiyonlarının araştırılması için çok güçlü bir yaklaşımdır. Bununla birlikte, memeli dokusundaki ışığın yüksek emiciliği ve saçılması, intravital görüntülemeyi çoğunlukla yüzeysel beyin bölgeleriyle sınırlar ve hipokampus gibi derin beyin bölgelerini optik mikroskopi için ulaşılamaz bırakır. Bu videoda, kafa sabiti davranan farelerde dorsal hipokampal CA1 bölgesinin kronik in vivo görüntülemesini sağlamak için özel yapım görüntüleme penceresinin hazırlanmasını ve implantasyonunu gösteriyoruz. Özel yapım pencere, viral vektörlerin ve ilaçların görüntüleme alanına hedefli olarak teslimine izin veren bir infüzyon kanülü ile desteklenmiştir. Bu hazırlığı geniş alan görüntüleme ile birleştirerek, birkaç hafta boyunca farelerin davranışlarında büyük nöron alt kümelerinden floresan kalsiyum göstergesi kullanarak nöronal aktivitenin uzun süreli bir kaydını gerçekleştirdik. Bu gerilim görüntüleme hazırlığının uygulanabilirliğini tek ani çözünürlükle de gösterdik. Nöronal aktivitenin ve bilimsel CMOS kameraların yüksek performanslı genetik olarak kodlanmış göstergeleri, tek nöronların hücre altı morfolojik ayrıntılarının yüksek zamansal çözünürlükte tekrarlayan görselleştirilmesine izin verdi. Ayrıca, açıklanan yöntemin avantajlarını ve potansiyel sınırlamalarını ve diğer görüntüleme teknikleriyle uyumluluğunu tartışıyoruz.
Giriş
Hipokampus, öğrenme ve hafıza1'in yanı sıra mekansal navigasyon2'densorumlu önemli bir beyin bölgesidir. Hipokampal atrofi, hafıza kaybı ve bilişsel düşüş içeren nörolojik ve psikiyatrik bozukluklarla ilişkilidir3,4,5. Farelerde, hipokampus hücresel ve ağ seviyelerinde mekansal, bağlamsal ve ilişkilendirilebilir öğrenme ve bellek oluşumunu incelemek için çok iyi kurulmuş bir modeldir4,5. Öğrenme ve hafızanın mekanistik çalışmaları, farelerin davranışlarında nöronal yapının ve işlevin uzunlamasına sorgulanarak sorgulanılmasını gerektirir. Genetik olarak kodlanmış problar6 ile birlikte floresangörüntüleme,membran voltaj dinamikleri7,8, kalsiyum geçicileri9ve yapısal değişiklikleri intravital olarak büyük nöron alt kümeleri üzerinde10 kaydetmek için eşi görülmemiş yetenekler sağlar. Bununla birlikte, farelerde hipokampusa optik erişim, kalınlığı 1 mm'nin üzerine ulaşabilen korteks tarafından engellenmiştir. Burada, farelerde sırt hipokampüsün CA1 alt bölgesine uzun süreli optik erişim için özel yapım bir görüntüleme cihazının ve kronik implantasyonunun fare kafasına monte edilmesi için bir prosedür tanımladık. Görüntüleme implantına entegre infüzyon kanülleri, virüslerin veya ilaçların doğrudan görüş alanındaki nöronlara verilmesine izin verir. Geniş alanlı mikroskopi ile birlikte tariflanan preparat, uzun süre farelerde davranan nöronların büyük alt kümelerinin tekrarlayan görüntülemesini sağlar. Bu hazırlığı hipokampal CA1 bölgesindeki kalsiyum ve voltaj genetik olarak kodlanmış göstergeleri tek hücreli çözünürlükte nöronal aktivite kayıtları için rekombinant adeno ilişkili virüsün (rAAV) hedefli enjeksiyonu ile ifade etmek için kullandık. Ayrıca, hayvanlara yapılan davranışlarda yüksek mekansal çözünürlükte ilgili nöronal alt kümelerin boyuna kalsiyum görüntülemesini gerçekleştirdik. Ek olarak, bu preparat multifotoğraf mikroskopisi ve miksoskopi ile uyumludur, böylece farelerde hücresel ve hücre altı seviyelerde nöronal ağları incelemek için görüntüleme tekniklerinin araç kutusunu daha da genişletir. Kritik adımları ve protokolün sorunlarını gidermeyi anlattık. Yöntemin olası tuzaklarını ve sınırlamalarını da tartıştık.
Protokol
Burada açıklanan tüm yöntemler Westlake Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır.
1. İmplant montajı
NOT: Görüntüleme implantının montajı teknik olarak basittir ve yalnızca piyasada bulunan öğeleri gerektirir (Şekil 1, ayrıcabkz. Kafa plakaları yerel makine atölyesinde paslanmaz çelik veya titanyum plakalar kullanılarak üretilebilir. Ameliyatlara başlamadan önce tam olarak monte edilmiş implant stoğu hazırlamanızı öneririz. In vivo deneyler yapıldıktan sonra implantlar birçok kez kurtarılabilir ve tekrar kullanılabilir. Bazı durumlarda, sadece kapak camını lehimleyerek veya değiştirerek infüzyon kanülünü yeniden takmayı gerektirebilir.
- Altı temel donanım bileşenini de montaj ve kurulum görüntüleme implantları için hazırlayın (Şekil 1).
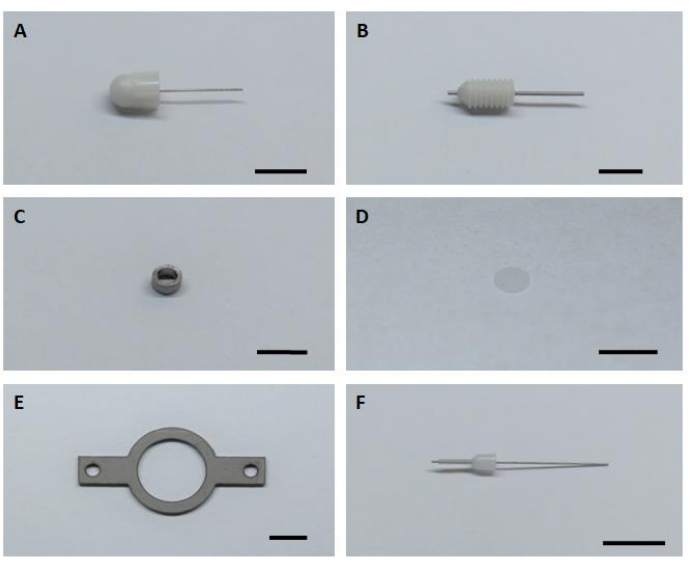
Şekil 1: Görüntüleme implantının montajı ve montajı için altı temel donanım bileşeni. (A) Kukla canül. (B) Kılavuz cannula. (C) Görüntüleme cannülü. (D) Cam kapak camı. (E) Başlık. (F) İç canül. Ölçek çubuğu: 5 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Kaynak makinesini açın ve gerekli sıcaklığa kadar ısıtın.
NOT: Sıcaklık kullanılan kaynak tenekeye bağlıdır. - Oksidasyon tabakasını çıkarmak ve böylece daha güçlü lehimleme yapmak için ince zımpara kağıdı kullanarak görüntüleme cannulasının yan yüzeyini parlatın.
- Yardım ellerini kullanarak görüntüleme kolayının ve enjeksiyon kolayının (yerleştirilen kuklalı kavun ile kılavuz canül) konumunu ayarlayın (Şekil 2A,B).
- İğneli bir şırınga kullanarak, görüntüleme ve enjekte kanülleri arasındaki bağlantı noktasına 5 saniye boyunca az miktarda uygun akı uygulayın ve ardından damlacığı çıkarın.
NOT: Bu hazırlık için, görüntüleme ve infüzyon kanülleri paslanmaz çelikten yapıldığı için, üretici tarafından paslanmaz çelik parçaları lehimleme için belirtilen ticari olarak mevcut bir akı kullandık. Ül üretmek için kullanılan diğer malzemeler söz konusu olduğunda, son kullanıcı seçilen malzemeyi kaynaklayabilecek akı seçmelidir. - Lehim tenekesini eritin ve akı ile muamele edilen bağlantı noktasına uygulayın (Şekil 2).
NOT: Ameliyat sırasında gereksiz yere daha büyük kraniyotomi gerektireceğinden aşırı lehim tenekesi kaçının.
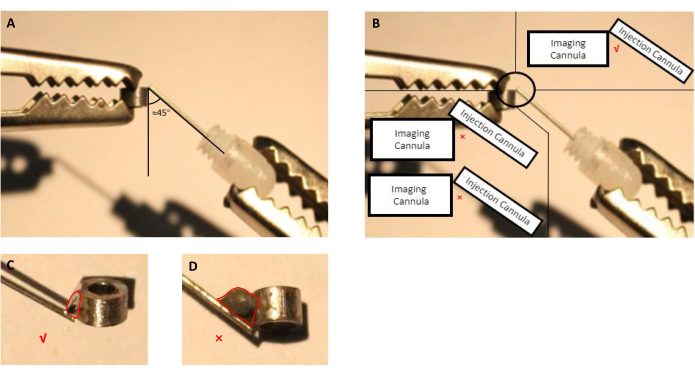
Şekil 2: Eklenen kuklalı canül ile kılavuz canülden oluşan enjeksiyon canülünü görüntüleme demleme şeması. (A) Enjeksiyon kolayı ile görüntüleme kasıt arasındaki açı yaklaşık 45 derece olmalıdır. (B) Enjeksiyon canülunun ucu görüntüleme henüllerinin tam kenarında olmalıdır. (C) Görüntüleme ve enjeksiyon kolaylarını lehimlemek için kullanılan kaynak tenekesinin uygun bir boyutu (kırmızı çizgi kalay damlacığın ana hatlarını gösterir). (D) İmplant hazırlığı sırasında kaçınılması gereken kaynak tenekesinin uygunsuz boyutu (kırmızı çizgi kalay damlacıklarının ana hatlarını gösterir). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Lehim tenekesinin soğumasını bekleyin. Genellikle birkaç saniye sürer.
- Her iki yönden de kukla canül takılarak enjeksiyon kolayın engellenmediğini onaylayın.
- Bir kürdan veya 26 G şırınga iğnesi kullanarak görüntüleme kanüllerinin alt tarafına UV kürleme optik yapıştırıcı uygulayın.
- Görüntüleme canülüne karşılık gelen boyutta bir kapak camını dikkatlice yerleştirmek için ince bir cımbız kullanın.
NOT: Camın konumlandırılması, optik yapıştırıcıya dokunduktan sonra camı çok fazla hareket ettirmeden görüntüleme canülüne tam olarak yapılmalıdır. Aksi takdirde, cam kirlenir, böylece görüntüleme kalitesini azaltır. - Yapıştırıcıyı standart bir el UV lambasından 350-400 nm UV aydınlatma ile en az bir saat boyunca iyileştirin.
NOT: Kullanılan yapıştırıcı optik olarak şeffaf olmalıdır. Aksi takdirde, görüntüleme penceresinin kalitesini düşürecektir.
DİkKAT: UV koruyucu gözlükler, eldivenler ve laboratuvar önlüğü giyerek cilde ve göze maruz kalmaktan kaçının. - Kanı% 70 etanolde yıkayın, hava kurulayın ve ameliyata kadar steril bir kapta saklayın.
NOT: Kapak camını mümkün olduğunca temiz ve sağlam tutmak çok önemlidir. Kullanılan optik yapıştırıcı % 70 etanolde kimyasal olarak stabildir.
2. Pencere implantasyonu
- Ameliyattan önce hazırlık adımları
- Tüm cerrahi aletleri bir otoklavda sterilize edin.
- İki ayrı Petri kabında 1x PBS ve %70 etanol hazırlayın.
- İsteğe bağlı olarak: Cerrahi prosedüre başlamadan önce ameliyat bölgesini UV ışığı kullanarak en az 20 dakika dezenfekte edin.
NOT: Mümkün olan en steril koşullar altında çalışma, başarılı ve uzun ömürlü (6 ay kadar) cam kaplı kranial pencerelere neden olacaktır. Kontaminasyon, çoğu durumda pencere şeffaflığının azalmasına veya ciddi iltihaplanmaya neden olabilir.
- Cerrahi prosedür
- Ameliyattan hemen önce cerrahi bölgeyi %70 etanol ile sterilize edin.
- Hayvanı tartın ve IACUC onaylı hayvan protokolüne göre cerrahi öncesi bir analjezik dozunu subkutan olarak uygular.
- Bir fareyi izofluran ile uyuşturun (indüksiyon için% 4, bakım için% 1.5-2, 0.3-0.5 L / dakika hava akış hızı). Hayvanın tamamen yatıştırılmasını sağlamak için bir kuyruk kıstırma ve parmak kıstırma tekniği kullanın. Hayvanın solunum, SpO2ve işlem süresince kalp atış hızı gibi hayati belirtilerini gözlemleyin.
- Kürkü boynun arkasından gözlere kadar çıkarmak için bir düzeltici veya depilatör krem kullanın.
- Fareyi bir ameliyat ısıtma yastığının üzerine stereotaksik bir çerçeveye yerleştirin (37 °C'nin bakımını yaparak). Başı kulak çubuklarıyla sabitleyin. Başın sıkıca sabit olduğundan emin olmak için başı her yöne hafifçe itin.
- Ameliyat sırasında hayvanın gözlerinin kurumasını önlemek için göz merhemi uygulayın.
- Kesi yapmadan önce cerrahi bölgeyi betadin ve ardından %70 etanol ile üç kez sterilize edin.
- Kafanın tabanı boyunca yatay bir kesikle başlayarak, kafatasının üstündeki deriyi çıkarın, ardından rostral yönde iki kesik, neredeyse göz kapaklarına ulaşır, ardından orta çizgide birleşen iki eğik kesik.
- İki steril pamuklu çubukla, bağ dokusunu ve boynun arkasının kaslarını kafatasının kenarlarına geri çek.
NOT: Manipülasyon sırasında kan damarlarına (özellikle kasta gizlenenlere) zarar vermekten kaçınmaya çalışın. - Aşırı ağrıyı önlemek için periosteumun yüzeyine 2 dakika boyunca bir damla lidokin çözeltisi (~0,1 mL) uygulayın. İsteğe bağlı olarak, kafatasını çıkardıktan sonra beynin şişmesini azaltmak için, % 1 deksametazon 0.1 mL deri altından enjekte edilebilir.
- Tutkalın ve diş çimentosunun daha iyi yapışmasını sağlayan ve böylece kronik implantasyona neden olan kuru ve pürüzlü bir yüzey oluşturmak için kafatasının tüm açık alanını bir neşterle hafifçe kazıyın.
- Stereotaksik istasyona monte edilen iğnenin ucunu bregma üzerine yerleştirin, üç koordinatı da ayarlayın (AP: Anterior-Posterior; ML: Medial-Yanal; DV: Dorsal-Ventral) 0 olarak.
- İğnenin ucunu lambda'nın üzerine yerleştirin ve kafa konumunun dikey olduğunu onaylamak için AP koordinatının 0 olup olmadığına ve başın yatay olarak konumlandırıldığı sonucuna varmak için ML koordinatının 0 olup olmadığına bakın. Değilse, AP ve ML koordinatları 0,1 mm içinde olana kadar stereotaksik istasyondaki ilgili düğmeleri ayarlayın.
- Kraniyotomi için karşılık gelen noktaları bulmak için iğnenin ucunu hareket ettinin ve ince bir işaretleyici kullanarak kafatası üzerindeki konumlarını işaretleyin. Hipokampus implantasyonu durumunda, aşağıdaki koordinatlara sahip 4 nokta vardır (AP: -0.68, ML: -2.0) (AP: -3.68, ML: -2.0) (AP: -2.18, ML: -0.5) ve (AP: -2.18, ML: -3.5)11, ayrıca enjeksiyon canüllerinin en kaudal noktası için (AP: -4.0, ML: -2.0).
NOT: Bu adımda kullanılan işaretleyici, ameliyattan önce en az bir saat UV aydınlatma kullanılarak sterilize edilmelidir. Burada gösterilen koordinatlar 6-8 haftalık C57BL/6J fareler içindir. Koordinatlar farklı yaşlar veya fare suşları nedeniyle farklılık gösterebilir. - Dört işaretli noktaya ve dairenin kaudal tarafındaki enjeksiyon cannula alanının ana hatlarına göre bir daire çizin (Şekil 3).
- Kafatasında işaretlenmiş anahat boyunca hafifçe "çizmek" için 10.000 rpm hızında bir pnömatik matkap kullanın.
- Kafatasını, genellikle merkezde hafif bir dokunuşla hareket etmeye başlayan çok ince bir kemik tabakası kalana kadar delin.
- Kraniyotomi merkezine bir damla steril 1x PBS uygulayın, kemik kapağını kafatasından çok ince uçlu önps veya karşı taraflardan yaklaşan iki 26 G iğne ile kaldırın.
NOT: PBS kafatası parçasının çıkarılmasına yardımcı olacak ve dura12'ninolası kanamasını önleyecektir. - Dura yüzeyini temizlemek için PBS'yi uygulayın, ardından 26G künt bir iğneden birkaç kez hafif aspirasyon uygulayın.
- Durayı aspirasyon veya oftalmik makasla hafifçe çıkarın. Korteksin yanı sıra hipokampüsün üzerindeki korpus callosum'u emmek için nazik emiş (~-60kPa) uygulayın.
NOT: Korteks genellikle korpus callosumdan daha sarıdır ve korpus callosum genellikle hipokampustan daha beyazdır. Korpus callosum genellikle yukarıdan gözlemlendiğinde dikey ve yatay yönlere giden nöronal liflerle ayırt etmek kolaydır (Şekil 3).
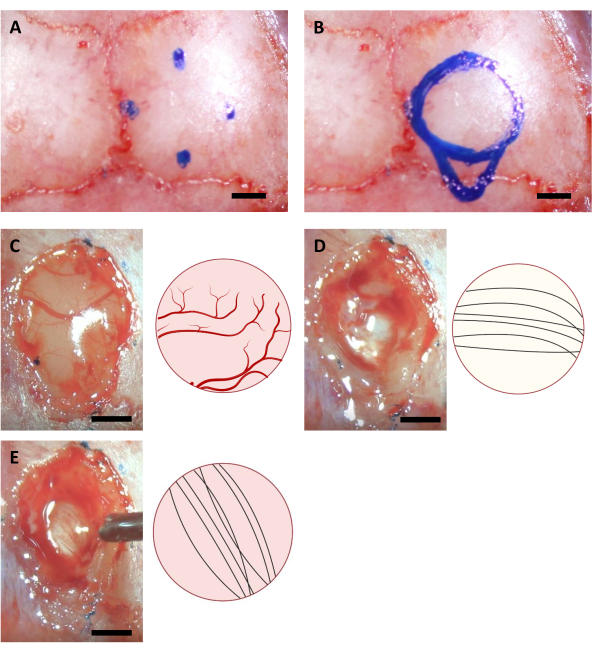
Şekil 3: Hipokampus yerinin stereotaksik koordinatları ve beyin ablasyon süreci. (A) Kraniyotomi bölgesinin kenarları için dört koordinat. (B) Komple kraniyotomi alanı. (C-E) Ameliyat sırasında elde edilen temsili görüntüler (solda) ve bunların şematik diyagramı (sağda),(A) Korteks (B) Corpus Callosum ve (C) Korteks ablasyonu sırasında görülebilen hipokampus sinir liflerinin farklı renk ve yönlerini gösterir. Ölçek çubuğu: 1 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Bu noktada kanama kraniyotomide beyin dokusunun görünürlüğünü etkileyecektir. Kandan kurtulmak için korteksi açarken 1x PBS uygulayın, ardından hafif emiş uygulayın.
NOT: Bu adım sırasında sürekli kanama kaçınılmazdır ve bir dereceye kadar sürekli kanama normal kan basıncının bir işaretidir. Korteks görüntüleme penceresi implantasyonunun aksine, optik pencerenin altında kan varlığı kabul edilebilir, çünkü ameliyattan birkaç gün sonra temizlenecektir. Görüntüleme kanüllerinin korteks ablatlamadan sonra en kısa sürede oluşturulan boşluğa yerleştirilmesi en uygunudur. - Kraniyotomi görüntüleme kolayından <0,5 mm daha büyükse, implantı SuperBond ile sabitlemeden önce ekstra Kwik Sil sızdırmazlık kullanarak kolayın kurulumunu bir dereceye kadar kurtarın.
- Kraniyotomi görüntüleme kanülüne göre <0,5 mm daha küçükse, kraniyotomi kenarındaki kalan kemik delme sonucunda kafatasının kendisinden daha ince olduğu için ince bir cımbız veya bir çift oftalmik makas kullanarak kraniyotomi kenarını kırparak cerrahi prosedürü bir dereceye kadar kurtarın.
NOT: 0,5 mm'nin üzerindeki aralıkları aşan kraniyotomiler kurtarılamaz. Bu durumlarda ilgili eylemler, hayvan protokolüne göre sonlandırma prosedürünü izlemelidir.
- İmplantı kraniyotomi içine hafifçe yerleştirin.
- İmplantın optik penceresini hipokampüsün maruz kalan yüzeyine mümkün olduğunca yakın konumlandırmak için L şeklindeki iğne ile implantın üzerine sıkıca bastırın. İmplant yerleştirme sırasında kanı mümkün olduğunca çıkarmak için implantın etrafındaki kafatasına tekrar tekrar PBS uygulayın ve ardından emme işlemi uygulayın. Daha sonra diş çimentosunun kafatasının altına nüfuz etmesini önlemek için implant ve kafatası arasına ince bir Kwik Sil tabakası uygulayın (Şekil 4).
- Altta kan veya başka bir sıvı birikmesini önlemek için implantın optik penceresinin hipokampusa karşı olduğundan emin olun.
NOT: Kritik nokta, görüntüleme canüllerinin kapak camının hipokampusa doğru yerleştirildiğından emin olmaktır, bu da kurulum ve sızdırmazlık işlemi sırasında kalısın üzerine hafifçe basınç gerektirebilir. Görüntüleme kolayının üst tarafının kafatasına paralel olup olmadığı, optik pencere hipokampusa karşı yerleştirdiği sürece son optik erişim için kritik değildir. - KORTEKsin CA1 alanının üzerindeki ortalama kalınlığına göre, kanülün kafatasına bağlanmasını kolaylaştırmak için görüntüleme kanüllerinin üst yüzeyini kafatası yüzeyinin üzerinde ~0,5 mm tutun (Şekil 4).
- Altta kan veya başka bir sıvı birikmesini önlemek için implantın optik penceresinin hipokampusa karşı olduğundan emin olun.
- Genellikle ~1 dakikadan fazla sürmeyen Kwik Sil iyileştikten sonra, kafatasının yüzeyine, Kwik-Sil yüzeyine ve implantın üst yüzeyine Super-Bond C&B'yi eşit şekilde uygulayın.
- Super-Bond C&B iyileştikten sonra, ameliyatın başında yapılan kesi etrafındaki cildin yanı sıra Super-Bond C&B'nin üzerine protez bazlı reçine uygulayın.
NOT: Alternatif çimento türleri birden fazla satıcıdan temin edilebilir. İlgili üreticinin yönergelerini izleyin. - Protez tabanı reçinesi iyileştikten sonra kafa plakasını implantın etrafındaki reçinenin üzerine yerleştirin ve görüntüleme kanı ile eşmerkezli hale getirin. Konumunu sabitlemek için kafa plakasının etrafına ve üstüne daha fazla protez taban reçinesi uygulayın. Birkaç dakika tedaviye bırakın.
- Objektif lens ile görüntüleme penceresine daha iyi erişim sağlamak için canül etrafında kalın bir çimento tabakası oluşturmaktan kaçının (Şekil 4).
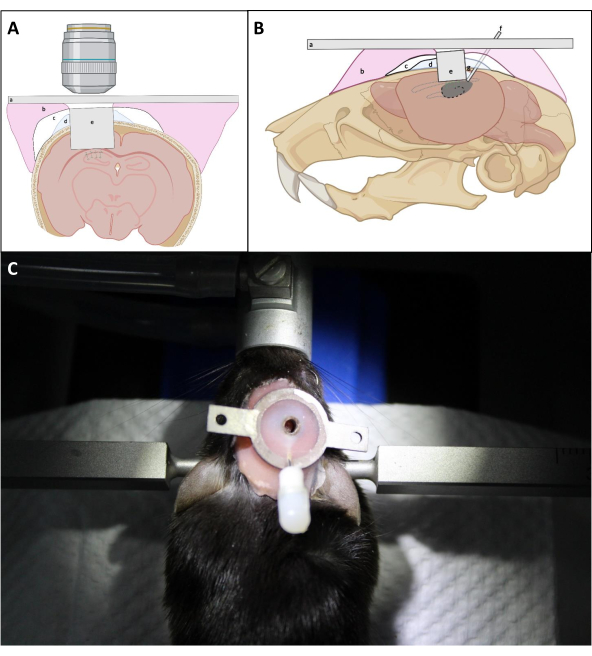
Şekil 4: (A) koronal ve (B) sagittal görünümde pencere implantasyonunun şematik diyagramı. (a) Başlık; (b) Protez taban reçinesi; (c) Superbond; (d) Kwik-Sil; (e) Görüntüleme cannülü; (f) Enjeksiyon kolayı; (g) Lehim tenekesi. (C): Ameliyattan sonra implant takılı fare. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Viskozitesini azaltmak için protez taban reçinesini seyreltin, böylece ulaşılması zor olan uyarılarını bir aplikatörle doldurmasına izin verin.
- Pencereyi hayvan yataklarından olası kirlenmeye karşı korumak için pencerenin üzerine yavaşça yalıtımlı bir kauçuk bant yerleştirin.
- Ameliyat bittiğinde, enflamatuar bir yanıtı önlemek için anti-enflamatuar ilacı deri altından enjekte edin.
- Hayvanı anesteziden kurtulana kadar ılık bir kafese yerleştirin.
- Genel davranışları gözlemleyerek ameliyat sonrası farenin sağlık durumunu 72 saat kontrol edin. Antienflamatuar ilaç ve analjezik, ağrıyı serbest bırakmak ve enflamatuar yanıtı azaltmak için her 24 saatte bir ameliyat sonrası iki-üç gün deri altı enjekte edilir.
NOT: Ameliyat sonrası bakım için alternatif izleme prosedürleri, ilaçlar ve dozajlar mümkündür, kesin prosedür için IUCAC onaylı hayvan protokolüne bakın. - Pencerenin altındaki vaskülatları gözlemlemek için ameliyattan 5-7 gün sonra pencereyi kontrol edin. Açık bir pencere durumunda, hayvan virüs enjeksiyonuna hazırdır.
3. Virüs Enjeksiyonu
NOT: Virüs enjeksiyonu genellikle ameliyattan 5-7 gün sonra yapılır. Virüs enjeksiyonundan önce, görüntüleme penceresinin açık olduğu ve beyin vaskülatını gözlemlemenin mümkün olduğu doğrulanmalı (Şekil 5). Bazı durumlarda, beyin iltihabı tespit edilirse de kabul edilebilir olan pencerenin temizlenmesi 14-16 güne kadar sürebilir.
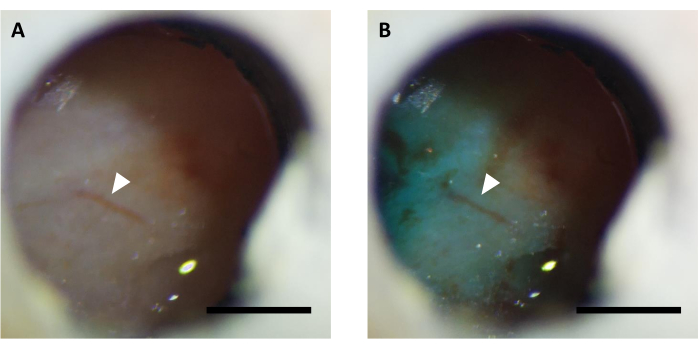
Şekil 5: FastGreen boyası ile desteklenmiş virüs enjeksiyonundan önce (A) ve (B) optik pencerenin temsili görüntüsü. Ok aynı vaskültür yapısını gösterir. Ölçek çubuğu: 1 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Bir PCR tüpünde 1:9 oranında, istenen titreye seyreltilmiş virüs çözeltisine hızlı-yeşil boya stok çözeltisi ekleyin.
NOT: Enjeksiyon sırasında virüs çözeltisinin görselleştirilmesini kolaylaştırmak için hızlı yeşil boya eklenir. - Polietilen boruyu şırınna ile bağlayın, ardından bir şırınna pompası kullanarak boruyu mineral yağ ile doldurun.
- İç canülleri borunun diğer ucuna bağlayın, iç canüllerin tıkanmamasını sağlamak için mineral yağı birkaç kez demleyin ve çekin.
- Hayvanı izofluran ile uyuşturun (indüksiyon için% 4, bakım için% 1.5-2, havanın 0.3-0.5 L / dakika akış hızı), başı bir ısıtma yastığının üzerinde stereotaksik bir çerçeveye sabitleyin (37 ° C'yi koruyarak), göz merhemi uygulayın.
- Virüs çözeltisinin 600 nL'sini çekin, kukla kolayı çıkarın ve enjeksiyon şırıncığına bağlı iç kanamayı kılavuz kanolaya yerleştirin, virüsü toplamda 10 dakika boyunca 50 nL / dak hızında aşılayın.
NOT: Başarılı virüs enjeksiyonu onaylamak için bir stereomikroskop kullanarak boyanın pencereden görüp görünmeyeceğini kontrol edin (Şekil 5). - Enjeksiyondan sonra, virüsün pencerenin altına yayılmasına izin vermek için iç kolayı 10 dakika bağlı tutun.
- İç canülleri kılavuz canülden hafifçe çıkarın ve sahte bir canül ile yeniden yakalayın.
- Hayvanı anesteziden kurtulana kadar ılık bir kafese yerleştirin.
NOT: Tipik olarak, fareler viral enjeksiyondan sonraki 10-20 gün içinde görüntülemeye hazırdır. İfade düzeyi ve zamanı, gen ekspresyonünü yönlendirmek için kullanılan virüs serotipine ve promotörüne bağlıdır.
4. Uyanık farelerin geniş alan mikroskobu altında görüntülenmesi.
NOT: Hazırlanan kafa plakası görüntüleme implantının olağanüstü stabilitesini sağlar ve böylece uyanık ve en az hareket objesi olan farelerde boyuna görüntülemeye izin verir.
- Fareyi birkaç dakika boyunca% 4 izofluran ile indükleyin, kafa plakasını kafa çatalına sabitleyin ve ardından kafa çatalını koşu bandına sabitleyin.
NOT: Baş çatalı ve koşu bandı bu çalışmada kullanılan kafa plakası için özelleştirilmiştir, lütfen ilgili cad dosyaları için Destekleyici Malzemeler'e bakın. Kafa sabitlemeden önce farenin indüksiyonu isteğe bağlıdır, çünkü bu prosedür için hayvanı alışkanlık haline getirmek mümkündür. - Koşu bandını mikroskop aşamasının altına taşıyın ve optik pencereyi objektif mercek altına yerleştirin.
- Fonksiyonel görüntüleme için en iyi görüş alanını (FOV) bulmak için düşük büyütme objektif lensi kullanın, ardından nöronal aktiviteleri tek hücreli çözünürlükte kaydetmek için daha yüksek bir NA objektif lense geçin.
NOT: Enjeksiyon kanı, objektif lensin çalışma mesafesine ulaşması için hala bir engelse, enjeksiyon kolayını kafa plakasından kesmek için bir tel kesme makinesi kullanın.
Sonuçlar
Genetik olarak kodlanmış bir kalsiyum göstergesi kullanılarak nöronal aktivitenin in vivo görüntülenmesi. Ortalama olarak, yeterli düzeyde transgene ekspresyon elde edilirse in vivo görüntüleme implantasyondan 3-4 hafta sonra başlar. Bu zamana kadar, serebral ödem ve kanama genellikle tamamen çözülür ve beyin damarı optik pencereden kolayca gözlemlenebilir. Burada, dorsal hipokampal CA1 bölgesindeki nöronal aktivitenin tekrarlanan kayıtlarını floresan geniş alan mikroskobu altında farelerin davranmasında gerçekleştirmek için açıklanan hazırlığı kullandık. Nöronal aktiviteyi kaydetmek için, GCaMP6s14ile benzer kalsiyum duyarlılığı ve zamansal çözünürlük gösteren NCaMP713adlı parlak bir genetik olarak kodlanmış kalsiyum göstergesi kullandık. Hipokampustaki NCaMP7 göstergesini ifade etmek için, bir infüzyon kanül kullanarak rAAV / DJ-CAG-NCaMP7 virüsünü enjekte ettik ve enjeksiyondan 14 gün sonra boylam görüntülemeyi başlattık. Nöronal aktiviteyi kaydetmek için 100 Hz frekansa kadar ~1.5x1.5 mm FOV'da görüntülemeye izin veren 10x NA 0.3 hava objektif lensi ve Hamamatsu OrcaFusion sCMOS kamera kullandık. Yeşil floresan, standart bir GFP filtre seti kullanılarak piyasada bulunan 470 nm LED ile heyecanlandı. Yeşil kanalda elde edilen ortalama görüntüleme derinliği yaklaşık 50-120 μm'dir, bu da esas olarak stratum oriens ve stratum piramitlerinde nöronal aktivitenin kaydedilmesini sağlar. Yakın kızılötesi kanallarda görüntüleme derinliği, hipokampüsün daha derin katmanlarına ulaşan 200 μm'ye kadar olabilir8. FOV başına ortalama kayıt süresi 6-12 dk idi, ancak NCaMP7 son derece yüksek fotoğraflanabilirlik ile karakterize olduğu ve tespit edilebilir fototoksioksisite gözlenmedi(Şekil 6).
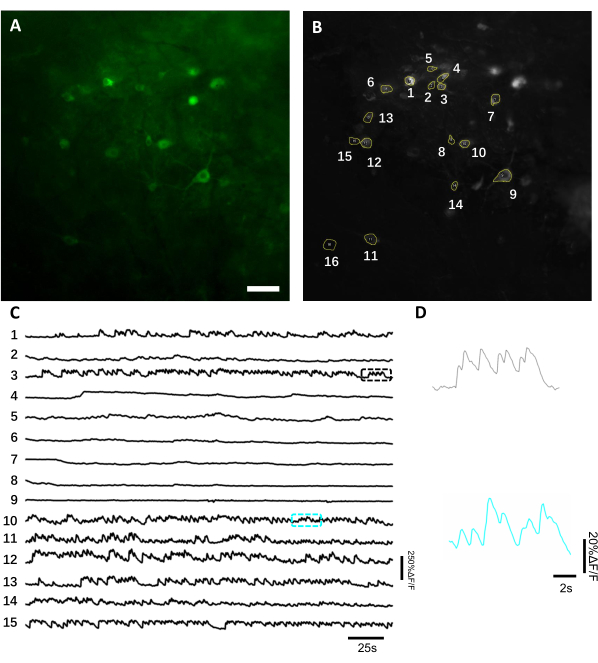
Şekil 6: Hipokampal nöronlardaki nöronal aktivitenin yeşil floresan genetik olarak kodlanmış kalsiyum göstergesi kullanılarak kaydedilmektedir. (A) Yeşil kanalda geniş alan floresan mikroskobu altında görüntülenen seçilmiş bir FOV. (B) A'da gösterilen ve tüm kaydın standart sapma projeksiyonu kullanılarak seçilen tek nöronlara karşılık gelen 15 ROI. (C) B'de seçilen 15 nöronun temsili floresan tek deneme izleri. (D) C. Scale barda gösterilen karşılık gelen renk kutularında gösterilen 2 kalsiyum izinin temsili yakınlaştırma görünümü, 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Floresan izleri elde etmek için, nöronal somalara karşılık gelen ilgi alanları (ROI' ler) manuel olarak segmentlere ayrılmıştır ve ImageJ yazılımı tarafından analiz edilmiştir. Görüntü analizi hareket düzeltmeden önce, elde edilen veri kümeleri görüntüleme implantının yüksek stabilitesi nedeniyle hareket eserleri sergilemediği için uyanık hayvanlarda yaygın kayıt sonrası prosedürler gerekli değildi. Hipokampustan gelen nöronal aktivitelerin uyanık bir farede temsili tek denemelik optik kaydı Şekil 6'da sunulmuştur. Nöronal somalara karşılık gelen 15 ROI, Şekil 6B'degösterilen aynı FOV'dan manuel olarak seçilmiştir ve her yatırım getirislerindeki tek denemelik floresan izleri Şekil 6C'degösterilmiştir. Şekil 6D, iki farklı ROI'den floresan izlerinin iki temsili parçasını göstermektedir. Aynı FOV için 3 gün aralıklarla ardışık 4 görüntüleme seansı gerçekleştirdik. Aynı nöronları belirli FOV'larda en az iki hafta boyunca tanımlamak ve görüntülemek mümkündü (bu çalışma için daha uzun görüntüleme seansları yapılmadı, ancak aynı hazırlık daha önce7farelerde 6 aya kadar görüntüleme çalışması için kullanıldı; Şekil 7). Bu çalışmada, virüs doğumundan 21 gün sonra bile ilgi geninin güçlü bir ifadesini yönlendiren AAV / DJ-CAG vektörünü kullandık (Ek Şekil 1). Sürekli ifade, artan floresan arka planı ve kalsiyum göstergesini ifade eden yeni nöronların görünümü nedeniyle aynı nöronların uzun süreli tanımlanmasını karmaşık hale getirdi. Bu nedenle, hedef gen ekspresyonunun yönlendirilmesi için AAV serotipinin ve promotörünün seçilmesi, özellikle aynı nöron alt kümesinin boyuna görüntülenmesi gerekiyorsa deneysel tasarım sırasında önemli hususlardan biri olmalıdır. Görüntüleme kalitesi proksimal dendritleri çözmenin yanı sıra kan damarlarını görselleştirmeye izin veriyordu.
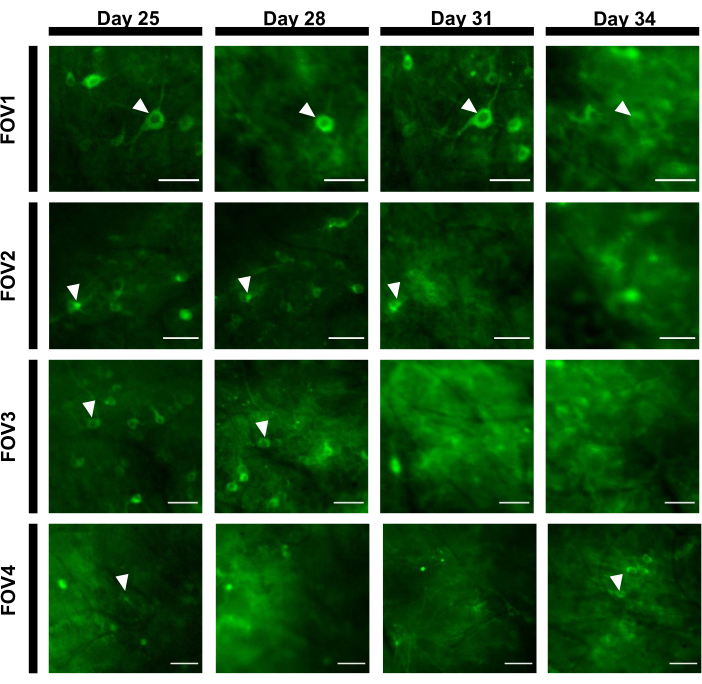
Şekil 7: Hipokampal alandan dört farklı FOV'un görüntü dizisi 12 gün boyunca izlendi. Hayvana 0. günde pencere takıldı ve 7. günde rAAV/DJ-CAG-NCaMP7 virüsü enjekte edildi. Ok uçları FOV içinde izlenen nöronu gösteriyor. Ölçek çubukları: 80 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Genetik olarak kodlanmış bir voltaj sensörü kullanılarak nöronal aktivitenin in vivo görüntülenmesi.
Bu çalışmada, somArchon7adlı genetik olarak kodlanmış bir yeni gerilim sensörü de kullandık, bu da hayvanlara davranışlarda tek hücreli tek ani çözünürlükte voltaj görüntülemeye izin verir7,8. SomArchon'u ifade etmek için, bir infüzyon kanülü kullanarak rAAV / DJ-CAG-SomArchon virüsünü enjekte ettik ve enjeksiyondan birkaç gün sonra kafa sabitli bir farede voltaj görüntülemesi yaptık. Nöronal aktiviteyi kaydetmek için, 150x40 μm FOV'u 830 Hz alım oranına kadar görüntülememizi sağlayan 40x NA 0.8 objektif lens ve Hamamatsu OrcaFusion sCMOS kamera kullandık. SomArchon'un bir parçasının spektrumun görünür aralığında ifadenin görselleştirilmesini kolaylaştırmak için inşa ettiği GFP proteini, voltaj görüntüleme için ilgi çekici hücreleri bulmak için yeşil kanalda (470/20 nm'de LED eksitasyon, emisyon 525/50 nm) kolayca görüntülenebilir. Optik gerilim kayıtları yakın kızılötesi kanalda (lazer ekscitasyon 637 nm at 3.4 W/mm2, emisyon 665 nm uzun pas) 830 Hz alım hızında 4 x 4 binning ile gerçekleştirildi. Hipokampal bir nöronun spontan aktivitesini, eylem potansiyeli başına ortalama 7 SNR ile uyanık bir farede kaydettik (Şekil 8).
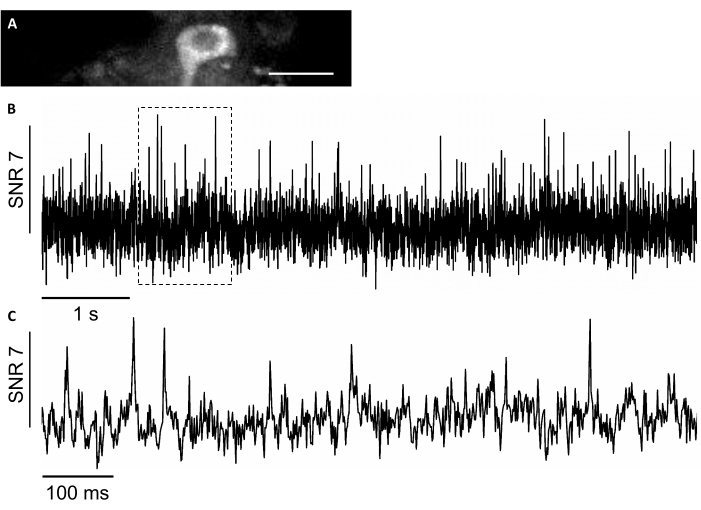
Şekil 8: Hipokampal nöronlardaki nöronal aktivitenin, genetik olarak kodlanmış voltaj göstergesi SomArchon'un kızılötesine yakın bir floresan kullanılarak kaydedilmesi. (A) Kızılötesine yakın kanalda geniş alan floresan mikroskobu altında görüntülenmiş seçilmiş bir FOV. (B) A. (C) B. Ölçek çubuğunda gösterilen ilgili kutudaki voltaj izinin temsili yakınlaştırma görünümü: 25 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
histoloji
Fonksiyonel görüntüleme çalışması yapıldıktan sonra, implantın doğru yerleşimini, virüs ekspresyon alanını ve görüntülenmiş nöronlarda ilgi çekici bir proteinin lokalizasyonunu doğrulamak için ölüm sonrası analiz kullanılır. Virüs ekspresyonunun histolojik olarak doğrulanması ve implantın yerleştirilmesi için PFA sabit beyninin koronal bölümleri floresan geniş alan mikroskobu altında incelenmiştir(Şekil 9A, C). Kalsiyum göstergesini ve voltaj göstergesini(Şekil 9B, D)ifade eden bireysel nöronların yüksek çözünürlüklü görüntülerini elde etmek için bir konfokal mikroskop kullanılmıştır. Beyin diliminin genel morfolojisini görselleştirmek için DAPI boyama kullanıldı. Ek olarak, beyin dilimleri, pencere implantasyonu ve viral ifadenin neden olduğu astrogliosis veya glizizi doğrulamak için immünhistokimya kullanılarak değerlendirilebilir. Önceki çalışmalarımız, prosedürün gözle görülür glioz7'yeneden olmadığını göstermiştir.
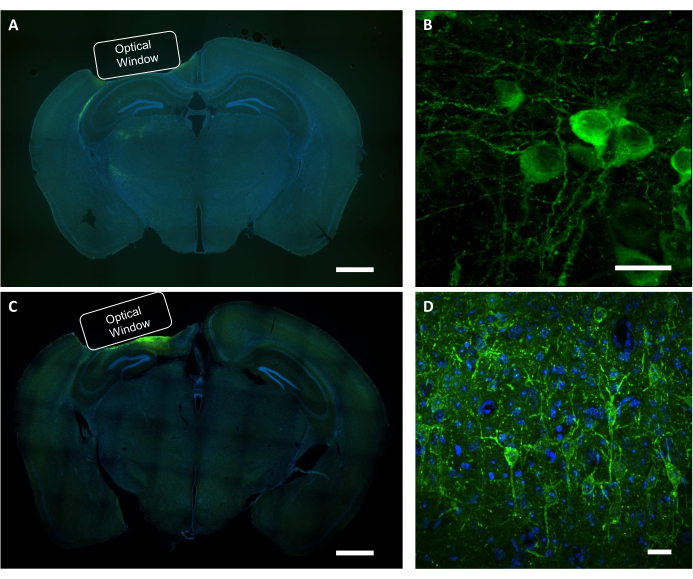
Şekil 9: Optik pencere konumunun ve virüs ifadesinin histolojik doğrulaması. (A) Optik pencerenin NCaMP ifade eden bir fareden yerleştirilmesini gösteren koronal bölüm beyin diliminin temsili floresan görüntüsü. Ölçek çubuğu: 1 mm. (B) NCaMP7 göstergelerini ifade eden nöronların temsili konfokal görüntüsü. Ölçek çubuğu: 25 μm. (C) Optik pencerenin SomArchon ifade eden bir fareden yerleştirilmesini gösteren koronal kesit beyin diliminin temsili floresan görüntüsü. Ölçek çubuğu: 1 mm. (D) SomArchon göstergelerini ifade eden nöronların temsili konfokal görüntüsü. Ölçek çubuğu: 25 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: İfade süresi ile birlikte bağıl floresan yoğunluğunun nicel analizi. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Burada, hipokampus CA1 bölgesinin farelerde uzun süreli görüntülenmesi için bir yöntem açıklıyoruz. Yöntem, virüslerin veya ilaçların doğrudan ilgi çekici nöronlara hedefli bir şekilde yönetilmesini sağlayan özel yapım bir görüntüleme penceresinin kronik implantasyonuna dayanmaktadır. Mevcut protokol dört ana bölümden oluşur: i) görüntüleme implantının montajı; ii) görüntüleme implantının montajı; iii) görüntüleme implantı ile virüs enjeksiyonu; iv) Farelerin davranışlarında fonksiyonel görüntüleme. Aşağıda, yöntemin protokolündeki kritik adımları, sorun gidermeyi, değişiklikleri ve sınırlamaları açıklar ve tartışırız. Ayrıca yöntemin önemini ve potansiyel alternatif uygulamalarını tartışıyoruz.
Açıklanan protokolde başarılı cerrahi için oldukça önemli olan birkaç kritik adım vardır: (i) yüksek kaliteli bir görüntüleme implantının hazırlanması; (ii) steril cerrahi durumlar; (iii) korteksin aspirasyonu; (iv) görüntüleme implantının hassas yerleştirilmesi; (v) viral enjeksiyon. Adım 1.6'nın gösterdiği gibi, aşırı lehim tenekesi daha büyük bir kraniyotomi gerektirir ve böylece iltihaplanma riskini arttırır. Kapak camını görüntüleme kanamasına sabitlerken uygun miktarda yapışkan optik tutkal kullanmak da çok önemlidir, adım 1.11'de belirtildiği gibi, yetersiz bir miktar serebrospinal sıvının görüntüleme akümülasına sızmasına ve opak hale getirilmesine neden olabilir. Öte yandan, aşırı optik yapıştırıcı cam pencerenin saydamlığının azalmasına neden olabilir. Görüntüleme implantının olası kirlenmesi, optik pencere altındaki bağ dokusunun aktif olarak çoğalmasına ve/veya şiddetli iltihaplanmaya neden olabilir ve bu da deneyin erken sonlandırılmasına neden olur. Bu nedenle ameliyat öncesi görüntüleme implantı montajı ve hazırlanması neredeyse cerrahi işlemin kendisi kadar önemlidir.
Ameliyat sırasında korteksin kraniyotomi altındaki kısmı hafif aspirasyon ile ablatlanır ve bu da kaçınılmaz kanama ile sonuçlanır. Cerrahi sahadaki kan, çıkarılması gereken beyin dokusunun görünürlüğünü önemli ölçüde azaltır. Bu, gerekli doku ablasyon derinliğinin kesin değerlendirmesini zorlaştırır. Dokunun bir sonraki kısmını çıkarmak için emme uygulamadan önce cerrahi bölgenin her seferinde PBS ile dikkatli bir şekilde yıkanması derinliğin daha iyi kontrol etmesini sağlar. Beyin dokusu, daha fazla emişle devam etmeden önce ablated dokunun derinliğini doğrulayan adım adım küçük porsiyonlarda her zaman çıkarılmalıdır. Daha ince bir künt iğne ile emmenin daha ince kontrolü de sağlanabilir. 26 G iğne kullanmanızı öneririz, ancak 26 G çapından daha küçük tıkanmaya daha yatkındır. Ayrıca, korteks, korpus callosum ve hipokampüsün rengi fareden fareye değişebileceğinden, her hayvan için gereken aspirasyon derinliğini belirlemek genellikle çok fazla pratik gerektirir (Şekil 3).
Görüntüleme penceresinin hipokampüsün dorsal yüzeyine mümkün olan en yakın konumunu sağlamak için görüntüleme implantının yerleştirilmesi ve sabitlemesi çok hassas bir şekilde yapılmalıdır. Hazırlanan kraniyotomi boyutu implantla yakından eşleşmeli ve önemli bir direnç olmadan yerleştirilmesine izin vermelidir. Aynı zamanda, uygun sızdırmazlık sağlamak ve beyin dokusuna maruz kalmayı önlemek için kafatası ve implant arasında görünür bir boşluk olmamalıdır. Kafatasına sızdırmazlığı sırasında implantın üstüne yumuşak ve kararlı basınç uygulanmalıdır. İmplant kurulumu sırasında görüntüleme penceresinin altında kan olması neredeyse kaçınılmazdır. Cerrahi işlem düzgün yapılırsa, pencere 3-7 gün içinde temizlenmeli ve beyin damarı açıkça görülebilir hale gelmelidir. Virüsün pencerenin altına düzgün bir şekilde enjekte edildiğine emin olmak da önemlidir. Başarısız ifade durumunda, virüs birden çok kez yeniden eklenebilir.
Bazı durumlarda karşılaştığımız en büyük komplikasyon görüntüleme penceresinin görünürlüğünün azalmasıdır. Düşük görüntüleme kalitesinin birkaç olası nedeni vardır: i) devam eden iltihaplanma; ii) cam üzerindeki bağ dokusunun büyümesi; iii) pencere ve hipokampus arasındaki büyük boşluk. İltihaplanma genellikle ameliyat sırasında kontaminasyondan veya uygun şekilde sterilize edilmiş görüntüleme implantı nedeniyle ortaya gelir. Her ameliyattan önce ve sonra cerrahi aletlerin otomatik olarak kapatılarak işlemden hemen önce ameliyat alanını dezenfekte etmeyi ve ameliyat sırasında temiz kişisel koruyucu ekipman giymenizi öneririz. Görüntüleme implantları monte edildikten sonra temizlenmeli, sterilize edilmeli ve steril koşullarda saklanmalıdır. Görüntüleme implantının camındaki bağ dokusunun büyümesi, camın yüzeyindeki mekanik kirlenmeye veya korteks ablasyonu sırasında beyin dokusunun aşırı travmasına bağlı olabilir. İmplantı monte ettikten sonra, cam yüzeyin temiz ve pürüzsüz olduğunu onaylamak önemlidir. Ayrıca, kraniyotomi içine görüntüleme implantı yerleştirilmeden önce tüm hasarlı beyin dokusu parçaları dikkatlice çıkarılmalıdır. Bazı durumlarda, cam pencere ile hipokampus arasındaki boşluk beyin omurilik sıvısının birikmesiyle sonuçlanır ve görüntüleme kalitesini azaltır. Bu nedenle, implant kurulumu sırasında, hipokampus ve cam pencere arasında iyi temas sağlamak için sonuna kadar takmak çok önemlidir. Bazen, opak görüntüleme penceresinin tam nedenini belirlemek zordur. Optik pencere altındaki koşulları ortaya çıkarmak ve buna bağlı olarak sonraki ameliyatları ayarlamak için ölüm sonrası analiz yapmanızı öneririz.
Yöntemin in vivo görüntülemeden önce ve in vivo görüntüleme sırasında dikkate alınması gereken birkaç temel ve teknik sınırlaması vardır. En önemli sınırlamalardan biri korteks ablasyondur. Ameliyat sırasında görsel ve duyusal korteksin bir kısmı çıkarılır. Korteks ablasyonunun etkisini hassas bir şekilde değerlendirmek zor olsa da, çıkarılan beyin dokusu doğrudan hipokampus üzerine yansıtılmadığı için, birkaç çalışma hipokampal bağımlı öğrenme veya diğer ilgili hipokampus fonksiyonlarında gözle görülür bir bozukluk olmadığını göstermiştir15,16. Optik sınırlamalar, özellikle yüksek NA objektif lensler kullanıldığında da göz önünde bulundurulmalıdır. Örneğin bu çalışmada 1,9 mm iç çaplı 1,75 mm uzunluğunda bir canül kullandık. Bu canül geometrisi, hava hedefinin tam NA'sını ~ 0.5'ten fazla NA veya NA ile su hedefini ~ 0.6'dan fazla korumaz, çünkü ışığın bir kısmını kesecektir. Tüm beyin görüntüleme implantları için yaygın olan bir başka sınırlama, beynin bir kısmının açığa çıkıyor olmasıdır, böylece ısı kaybını teşvik eder17,18. Bununla birlikte, fizyolojik beyin sıcaklığı görüntüleme sırasında sıcak bir tamponun perfüzyonu ile kolayca geri yüklenebilir.
Açıklanan yöntem, diğer uygulamalar için kolayca değiştirilebilir veya ayarlanabilir. Örneğin, hazırlık striatum7'ningörüntülenmesi için uyarlanabilir. Striatum hipokampustan biraz daha derine uzandıkça, görüntüleme implantını monte etmek için daha uzun görüntüleme cannula kullanılmalıdır. 2.0 mm görüntüleme canül kullanmanızı öneririz. Kraniyotomi koordinatları buna göre ayarlanmalıdır (AP: +0.8 mm, ML: −1.8 mm). Ek olarak, infüzyon kanül yoluyla virüs enjeksiyonu, sınırlı spread19,20ile AAV serotipini kullanırken ince bir nöron tabakasında bir transjenin ekspresyonunu elde etmeyi sağlar. Daha derin katmanlardan gelen odak dışı floresan azalması ve sonuç olarak geliştirilmiş tek hücreli çözünürlük görüntülemesi nedeniyle tek foton görüntüleme için özellikle faydalıdır. Ayrıca, enjeksiyon kanülleri, ilaçların veya diğer kimyasalların doğrudan FOV'daki nöronlara verilmesi için fonksiyonel görüntüleme sırasında da kullanılabilir (Şekil 5B). Genel infüzyon kanül, görüntüleme implantı için yararlı işlevler ekleyerek hedeflenen viral ekspresyon nedeniyle görüntüleme kalitesini artırır ve FOV'daki nöronların farmakolojik uyarılmasını sağlar. Kullanılan kafa plakası, koşu bandında aktif olarak hareket eden hayvanlarda bile hareket yapıtlarını en aza indiren görüntüleme implantının olağanüstü stabilitesini sağlar. Baş plakası küçük ve hafiftir, hayvanlara minimum rahatsızlık verebilir ve kurulumdan sonra birkaç ay boyunca sabit kalır. Görüntüleme implantı ayrıca multifotoğraf görüntüleme15,16,21 ile uyumludur ve mikro endoskoplar 22,23ile birleştirilebilir. Benzer bir görüntüleme implantı, stratum radiatum, stratum lacunoz ve dentat girus 16 , 24 ,25,26,27dahil olmak üzere daha derin hipokampus yapılarının çok sesli görüntülenmesi için de kullanılmıştır. Bununla birlikte, infüzyon kanül yoluyla AAV'lerle daha derin hipokampus yapılarının hedeflenmesi, AAV serotipinin ve hacim19'undaha fazla optimizasyonunu gerektirebilir.
Açıklanan protokolün, basit ve uygun fiyatlı tek foton görüntüleme kurulumları kullanarak farelerin hipokampusunda yüksek mekansal çözünürlüğe sahip nöronal aktiviteyi araştırmayı amaçlayan çalışmaları kolaylaştıracağına inanıyoruz.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Westlake Üniversitesi Moleküler Biyomühendislik Grubu'nun tüm üyelerine tüm yardım ve yararlı tartışmalar için teşekkür ederiz. Ayrıca Westlake Üniversitesi'nden Jinze Li ve Jie-Min Jia'ya cerrahi prosedürün filme alınmasına yardımcı olan için teşekkür ederiz.
Bu çalışma, Westlake Üniversitesi Vakfı, 2020 BBRF Genç Araştırmacı Hibesi ve Çin Ulusal Doğa Bilimleri Vakfı'nın K.D.P.'ye 32050410298 hibe vermesiyle desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cover glass | Deckgläser | 72296-03 | |
| Denture Base Resin | ShangHai New Centery Dentel Material | N/A | Type I, self-solidifying |
| Dummy Cannula | RWD Life Science Co.,LTD | 62102 | OD 0.30mm |
| Guide Cannula | RWD Life Science Co.,LTD | 62003 | 26G |
| Head Fork | N/A | N/A | Custom made |
| Head Plate | N/A | N/A | Custom made |
| Imaging Cannula | N/A | N/A | Custom Made; OD 3mm, ID 2.7mm, Height 1.8mm, #108 stainless steel |
| Internal Cannula | RWD Life Science Co.,LTD | 62203 | 0.30*0.14 (OD*ID, mm) |
| Kwik Sil | World Precision Instruments | KWIK-SIL | |
| SuperBond C&B | SUN MEDICAL | N/A | SuperBond C&B kit |
| Treadmill Kit | N/A | N/A | Custom made |
| UV-cured Adhesive | NORLAND PRODUCTS | NOA 60 |
Referanslar
- Leutgeb, S., et al. Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science. 309 (5734), 619-623 (2005).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Polanco, J. C., et al. Amyloid-β and tau complexity - towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2018).
- Henneman, W. J. P., et al. Hippocampal atrophy rates in Alzheimer disease. Added value over whole brain volume measures. 72 (11), 999-1007 (2009).
- Camicioli, R., et al. Parkinson's disease is associated with hippocampal atrophy. Mov Disord. 18 (7), 784-790 (2003).
- Piatkevich, K. D., Murdock, M. H., Subach, F. V. Advances in Engineering and Application of Optogenetic Indicators for Neuroscience. Applied Sciences. 9 (3), 562 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Fan, L. Z., et al. All-Optical Electrophysiology Reveals the Role of Lateral Inhibition in Sensory Processing in Cortical Layer 1. Cell. 180 (3), 521-535 (2020).
- Shemesh, O. A., et al. Precision Calcium Imaging of Dense Neural Populations via a Cell-Body-Targeted Calcium Indicator. Neuron. 107 (3), 470-486 (2020).
- Villa, K. L., et al. Inhibitory Synapses Are Repeatedly Assembled and Removed at Persistent Sites In Vivo. Neuron. 89 (4), 756-769 (2016).
- Franklin, K. B. J., Paxinos, G. . Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , (2013).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Subach, O. M., et al. Novel Genetically Encoded Bright Positive Calcium Indicator NCaMP7 Based on the mNeonGreen Fluorescent Protein. International Journal of Molecular Sciences. 21 (5), 1644 (2020).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Kalmbach, A. S., Waters, J. Brain surface temperature under a craniotomy. Journal of neurophysiology. 108 (11), 3138-3146 (2012).
- Roche, M., et al. In vivo imaging with a water immersion objective affects brain temperature, blood flow and oxygenation. eLife. 8, 47324 (2019).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neuroscience Research. 93, 144-157 (2015).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H., Manfredssonn, F. P. . Gene Therapy for Neurological Disorders: Methods and Protocols. , 133-149 (2016).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), (2016).
- Yashiro, H., Nakahara, I., Funabiki, K., Riquimaroux, H. Micro-endoscopic system for functional assessment of neural circuits in deep brain regions: Simultaneous optical and electrical recordings of auditory responses in mouse's inferior colliculus. Neuroscience Research. 119, 61-69 (2017).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution In Vivo Imaging of Hippocampal Dendrites and Spines. The Journal of Neuroscience. 24 (13), 3147 (2004).
- Busche, M. A., et al. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proceedings of the National Academy of Sciences. 109 (22), 8740 (2012).
- Attardo, A., et al. Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Castello-Waldow, T. P., et al. Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. PLOS Biology. 18 (11), 3000928 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır