Method Article
Kraniotomie-Verfahren zur Visualisierung neuronaler Aktivitäten im Hippocampus von sich benehmenden Mäusen
In diesem Artikel
Zusammenfassung
Dieser Artikel zeigt die Vorbereitung eines maßgeschneiderten Bildgebungsfensters, ergänzt mit Infusionskanüle und deren Implantation in die CA1-Region des Hippocampus bei Mäusen.
Zusammenfassung
Die Abbildung neuronaler Aktivitäten mit Einzelzellauflösung bei wachen Tieren ist ein sehr leistungsfähiger Ansatz für die Untersuchung neuronaler Schaltkreisfunktionen in den Systemneurowissenschaften. Eine hohe Absorption und Streuung von Licht im Gewebe von Säugetieren beschränkt die intravitale Bildgebung jedoch hauptsächlich auf oberflächliche Hirnregionen, so dass tiefe Hirnareale wie der Hippocampus für die optische Mikroskopie unerreichbar sind. In diesem Video zeigen wir die Vorbereitung und Implantation des maßgeschneiderten Bildgebungsfensters, um eine chronische In-vivo-Bildgebung der dorsalen Hippocampus-CA1-Region bei kopffixierten Mäusen zu ermöglichen. Das maßgeschneiderte Fenster wird durch eine Infusionskanüle ergänzt, die eine gezielte Abgabe von viralen Vektoren und Medikamenten in den Bildbereich ermöglicht. Durch die Kombination dieses Präparats mit der Weitfeldbildgebung führten wir eine Langzeitaufzeichnung der neuronalen Aktivität mit einem fluoreszierenden Kalziumindikator von großen Untergruppen von Neuronen in sich verhaltenden Mäusen über mehrere Wochen durch. Wir haben auch die Anwendbarkeit dieses Präparats für die Spannungsbildgebung mit Single-Spike-Auflösung demonstriert. Leistungsstarke genetisch kodierte Indikatoren neuronaler Aktivität und wissenschaftliche CMOS-Kameras ermöglichten die wiederkehrende Visualisierung subzellulärer morphologischer Details einzelner Neuronen mit hoher zeitlicher Auflösung. Wir diskutieren auch die Vorteile und möglichen Einschränkungen der beschriebenen Methode und ihre Kompatibilität mit anderen bildgebenden Verfahren.
Einleitung
Der Hippocampus ist eine schlüsselschwere Hirnregion, die für Lernen und Gedächtnis1 sowie für die räumliche Navigation 2 verantwortlichist. Hippocampus-Atrophie ist mit neurologischen und psychiatrischen Störungen verbunden, die Gedächtnisverlust und kognitiven Verfallbeinhalten 3,4,5. Bei Mäusen ist der Hippocampus ein sehr gut etabliertes Modell zur Untersuchung des räumlichen, kontextuellen und assoziativen Lernens und der Gedächtnisbildung auf der Zell- und Netzwerkebene4,5. Die mechanistischen Studien des Lernens und des Gedächtnisses erfordern eine longitudinale Befragung der neuronalen Struktur und Funktion bei sich verhaltenden Mäusen. Die Fluoreszenzbildgebung in Kombination mit genetisch kodierten Sonden6 bietet beispiellose Möglichkeiten, die Dynamik der Membranspannung7,8, Kalziumtransienten9und strukturelle Veränderungen10 über große Untergruppen von Neuronen intravital aufzuzeichnen. Der optische Zugang zum Hippocampus bei Mäusen wird jedoch durch den Kortex behindert, der eine Dicke von über 1 mm erreichen kann. Hier beschrieben wir ein Verfahren zum Zusammenbau eines maßgeschneiderten Bildgebungsgeräts und dessen chronische Implantation in den Mauskopf für den langfristigen optischen Zugang zur CA1-Subregion des dorsalen Hippocampus bei sich verhaltenden Mäusen. Die in das bildgebende Implantat integrierte Infusionskanüle ermöglicht die Verabreichung von Viren oder Medikamenten direkt auf die Neuronen im Sichtfeld. Das beschriebene Präparat in Kombination mit der Weitfeldmikroskopie ermöglicht die wiederkehrende Abbildung der großen Untergruppen von Neuronen in sich verhaltenden Mäusen über lange Zeiträume. Wir verwendeten dieses Präparat, um kalzium- und spannungsgenaue genetisch kodierte Indikatoren in der HIPPOCAMPUS-CA1-Region durch gezielte Injektion des rekombinanten Adeno-assoziierten Virus (rAAV) für neuronale Aktivitätsaufzeichnungen mit Einzelzellauflösung zu exprimieren. Wir führten auch eine longitudinale Kalziumbildgebung der entsprechenden neuronalen Untergruppen mit hoher räumlich-zeitlicher Auflösung bei sich verhaltenden Tieren durch. Darüber hinaus ist dieses Präparat mit der Multiphotonenmikroskopie und Mikroendoskopie kompatibel und erweitert so die Toolbox der bildgebenden Verfahren zur Untersuchung neuronaler Netzwerke auf zellulärer und subzellulärer Ebene in sich verhaltenden Mäusen. Wir haben kritische Schritte und die Fehlerbehebung des Protokolls beschrieben. Wir diskutierten auch die möglichen Fallstricke und Grenzen der Methode.
Protokoll
Alle hier beschriebenen Methoden wurden vom Institutional Animal Care and Use Committee (IACUC) der Westlake University genehmigt.
1. Implantatmontage
HINWEIS: Die Montage des bildgebenden Implantats ist technisch einfach und erfordert nur handelsübliche Artikel (Abbildung 1, siehe auch Materialtabelle). Die Kopfplatten können in der örtlichen Maschinenhalle mit Edelstahl- oder Titanplatten hergestellt werden. Wir empfehlen, vor Beginn der Operationen einen Vorrat an vollständig montierten Implantaten vorzubereiten. Nach In-vivo-Experimenten können die Implantate geborgen und mehrfach wiederverwendet werden. In einigen Fällen kann es nur erforderlich sein, die Infusionskanüle durch Löten oder Ersetzen des Deckglases wieder zulegen.
- Bereiten Sie alle sechs wichtigen Hardwarekomponenten für die Montage und Installation bildgebender Implantate vor (Abbildung 1).
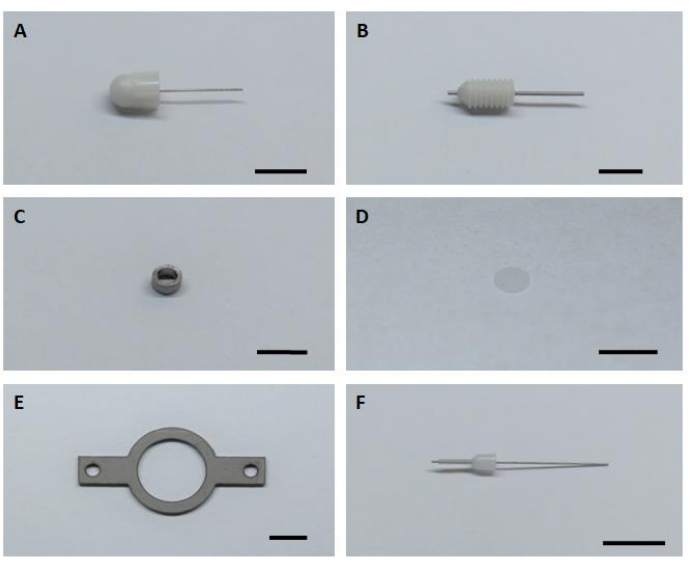
Abbildung 1: Sechs wichtige Hardwarekomponenten für die Montage und Installation des bildgebenden Implantats. (A) Dummy-Kanüle. (B) Leitkanüle. (C) Bildgebende Kanüle. (D) Glasdeckglas. (E) Kopfplatte. (F) Innere Kanüle. Maßstabsleiste: 5 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Schalten Sie das Schweißgerät ein und erhitzen Sie es auf die erforderliche Temperatur.
HINWEIS: Die Temperatur hängt vom verwendeten Schweißzinn ab. - Polieren Sie die Seitenfläche der bildgebenden Kanüle mit feinem Schleifpapier, um die Oxidationsschicht zu entfernen und so ein stärkeres Löten zu ermöglichen.
- Passen Sie die Position der Bildkanüle und der Injektionskanüle (Führungskanüle mit eingeführter Dummy-Kanüle) mit hilfenden Händen an (Abbildung 2A, B).
- Tragen Sie mit einer Spritze mit einer Nadel 5 Sekunden lang eine kleine Menge geeigneter Art von Flussmittel auf die Verbindungsstelle zwischen Bildgebung und Injektionskanülen auf und entfernen Sie dann den Tropfen.
HINWEIS: Für diese Zubereitung haben wir ein handelsübliches Flussmittel verwendet, das vom Hersteller zum Löten von Edelstahlteilen angegeben ist, da Bildgebungs- und Infusionskanülen aus Edelstahl bestehen. Bei anderen Materialien, die zur Herstellung von Kanülen verwendet werden, sollte der Endbenutzer ein Flussmittel auswählen, das das ausgewählte Material schweißen kann. - Lötzinn schmelzen und auf die mit Flussmittel behandelte Verbindungsstelle auftragen (Abbildung 2).
HINWEIS: Vermeiden Sie überschüssiges Lötzinn, da es während der Operation eine unnötige größere Kraniotomie erfordert.
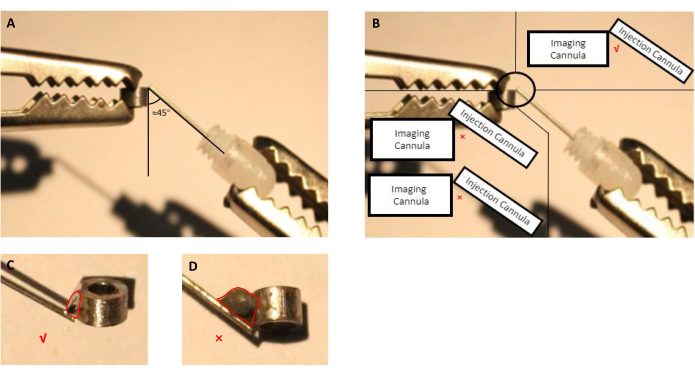
Abbildung 2: Schematische Darstellung der Montage der Injektionskanüle, bestehend aus Führungskanüle mit eingelegter Dummykanüle, mit der bildgebenden Kanüle. (A) Der Winkel zwischen der Injektionskanüle und der bildgebenden Kanüle sollte nahe 45 Grad betragen. (B) Die Spitze der Injektionskanüle sollte sich direkt am Rand der Bildkanüle befinden. (C) Eine angemessene Größe des Schweißzinnses, das zum Löten von Bildgebungs- und Injektionskanülen verwendet wird (rote Linie zeigt den Umriss des Zinntropfens an). (D) Unangemessene Größe der Schweißzinne, die während der Implantatvorbereitung vermieden werden sollte (rote Linie zeigt den Umriss des Zinntropfens an). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Warten Sie, bis die Lötdose abgekühlt ist. Normalerweise dauert es mehrere Sekunden.
- Vergewissern Sie sich, dass die Injektionskanüle nicht blockiert ist, indem Sie die Dummy-Kanüle aus beiden Richtungen einführen.
- Tragen Sie uv-härtenden optischen Klebstoff mit einem Zahnstocher oder einer 26 G Spritzennadel auf die Unterseite der Bildkanüle auf.
- Verwenden Sie eine feine Pinzette, um vorsichtig ein Deckglas der entsprechenden Größe auf die Bildkanüle zu legen.
HINWEIS: Die Positionierung des Glases muss präzise auf der Bildkanüle erfolgen, ohne das Glas zu sehr zu bewegen, sobald es den optischen Klebstoff berührt hat. Andernfalls wird das Glas verschmutzt, wodurch die Qualität der Bildgebung verringert wird. - Härten Sie den Klebstoff für eine Stunde durch 350-400 nm UV-Beleuchtung von einer Standard-Handheld-UV-Lampe aus.
HINWEIS: Der verwendete Klebstoff muss optisch transparent sein. Andernfalls wird die Qualität des Imaging-Fensters verringert.
VORSICHT: Vermeiden Sie Haut- und Augenexposition, indem Sie eine UV-schutzende Brille, Handschuhe und einen Laborkittel tragen. - Waschen Sie die Kanüle in 70% Ethanol, trocknen Sie sie an der Luft und lagern Sie sie bis zur Operation in einem sterilen Behälter.
HINWEIS: Es ist sehr wichtig, das Deckglas so sauber und intakt wie möglich zu halten. Der verwendete optische Klebstoff ist chemisch stabil in 70% Ethanol.
2. Fensterimplantation
- Vorbereitungsschritte vor der Operation
- Sterilisieren Sie alle chirurgischen Instrumente in einem Autoklaven.
- Bereiten Sie 1x PBS und 70% Ethanol in zwei separaten Petrischalen zu.
- Optional: Desinfizieren Sie den Operationsbereich mindestens 20 Minuten vor Beginn des chirurgischen Eingriffs mit UV-Licht.
HINWEIS: Der Betrieb unter möglichst sterilen Bedingungen führt zu erfolgreichen und langlebigen (bis zu 6 Monaten) glasbedeckten Schädelfenstern. Eine Kontamination kann in den meisten Fällen zu einer verminderten Fenstertransparenz oder schweren Entzündungen führen.
- Chirurgischer Eingriff
- Sterilisieren Sie den Operationsbereich mit 70% Ethanol direkt vor der Operation.
- Wiegen Sie das Tier und verabreichen Sie eine präoperative Dosis Analgetikum subkutan gemäß dem von der IACUC zugelassenen Tierprotokoll.
- Betäubung einer Maus mit Isofluran (4% für die Induktion, 1,5-2% für die Aufrechterhaltung, 0,3-0,5 l / min Luftdurchfluss). Verwenden Sie eine Schwanz- und Zehenklemmetechnik, um sicherzustellen, dass das Tier vollständig sediert ist. Beobachten Sie die Vitalparameter des Tieres wie Atmung, SpO2und Herzfrequenz für die Dauer des Eingriffs.
- Verwenden Sie einen Trimmer oder eine Enthaarungscreme, um das Fell vom Nacken bis zu den Augen zu entfernen.
- Legen Sie die Maus in einen stereotaxischen Rahmen über ein Operationsheizkissen (bei 37 °C). Befestmen Sie den Kopf mit Ohrbügeln. Drücken Sie den Kopf leicht in alle Richtungen, um sicherzustellen, dass der Kopf fest gesichert ist.
- Tragen Sie Augensalbe auf, um zu verhindern, dass die Augen des Tieres während der Operation austrocknen.
- Sterilisieren Sie die Operationsstelle dreimal mit Betadin gefolgt von 70% Ethanol, bevor Sie einen Schnitt machen.
- Entfernen Sie die Haut über der Oberseite des Schädels, beginnend mit einem horizontalen Schnitt entlang der Basis des Kopfes, gefolgt von zwei Schnitten in Rostralrichtung, die fast die Augenlider erreichen, dann zwei schräge Schnitte, die an der Mittellinie zusammenlaufen.
- Ziehen Sie mit zwei sterilen Wattestäbchen das Verbindungsgewebe sowie die Muskulatur des Nackens an die Schädelränder zurück.
HINWEIS: Versuchen Sie, schädliche Blutgefäße (insbesondere solche, die im Muskel versteckt sind) während der Manipulation zu vermeiden. - Tragen Sie einen Tropfen Lidocainlösung (~ 0,1 ml) für 2 Minuten auf die Oberfläche des Periosts auf, um übermäßige Schmerzen zu vermeiden. Optional, um das Gehirn vor Schwellungen nach der Entfernung des Schädels zu reduzieren, können 0,1 ml 1% Dexamethason subkutan injiziert werden.
- Kratzen Sie vorsichtig den gesamten exponierten Bereich des Schädels mit einem Skalpell ab, um eine trockene und raue Oberfläche zu schaffen, die es dem Klebstoff und dem Zahnzement ermöglicht, besser zu haften und so zu einer chronischen Implantation zu führen.
- Legen Sie die Spitze der nadelgelagerten Nadel auf die Bregma, setzen Sie alle drei Koordinaten (AP: Anterior-Posterior; ML: Medial-Lateral; DV: Dorsal-Ventral) als 0.
- Legen Sie die Nadelspitze auf das Lambda und prüfen Sie, ob die AP-Koordinate 0 ist, um zu bestätigen, dass die Kopfposition vertikal ist, sowie ob die ML-Koordinate 0 ist, um zu bestätigen, dass der Kopf horizontal positioniert ist. Wenn nicht, stellen Sie die entsprechenden Knöpfe an der stereotaxischen Station ein, bis die AP- und ML-Koordinaten beide innerhalb von 0,1 mm liegen.
- Bewegen Sie die Spitze der Nadel, um die entsprechenden Punkte für die Kraniotomie zu finden, und markieren Sie ihre Positionen auf dem Schädel mit einem feinen Marker. Bei der Implantation für hippocampus gibt es 4 Punkte mit folgenden Koordinaten (AP: -0,68, ML: -2,0) (AP: -3,68, ML: -2,0) (AP: -2,18, ML: -0,5) und (AP: -2,18, ML: -3,5)11sowie (AP: -4,0, ML: -2,0) für den kaudalesten Punkt der Injektionskanüle.
HINWEIS: Der in diesem Schritt verwendete Marker muss mindestens eine Stunde vor der Operation mit UV-Beleuchtung sterilisiert werden. Die hier gezeigten Koordinaten beziehen sich auf 6-8 Wochen alte C57BL/6J-Mäuse. Die Koordinaten können sich aufgrund unterschiedlichen Alters oder Stämmen von Mäusen unterscheiden. - Zeichnen Sie einen Kreis basierend auf vier markierten Punkten sowie den Umriss des Injektionskanülenbereichs auf der Schwanzseite des Kreises (Abbildung 3).
- Verwenden Sie einen pneumatischen Bohrer mit einer Geschwindigkeit von 10.000 U / min, um sanft entlang des auf dem Schädel markierten Umrisses zu "zeichnen".
- Bohren Sie den Schädel, bis eine sehr dünne Knochenschicht übrig ist, die normalerweise unter sanfter Berührung in der Mitte zu wackeln beginnt.
- Tragen Sie einen Tropfen steriles 1x PBS auf die Mitte der Kraniotomie auf, heben Sie den Knochenlappen mit einer sehr dünnen Spitzenzette oder zwei 26 G-Nadeln, die sich von gegenüberliegenden Seiten nähern, vom Schädel.
HINWEIS: Das PBS hilft, das Schädelstück zu entfernen und mögliche Blutungen der Dura12zu verhindern. - Tragen Sie PBS auf, gefolgt von einer sanften Aspiration durch eine stumpfe 26G-Nadel mehrmals, um die Oberfläche der Dura zu reinigen.
- Entfernen Sie die Dura vorsichtig, entweder durch Aspiration oder mit einer Augenschere. Wenden Sie eine sanfte Absaugung (~ -60kPa) an, um den Kortex sowie den Corpus callosum über dem Hippocampus abzutragen.
HINWEIS: Der Kortex ist oft gelber als der Corpus callosum, und der Corpus callosum ist normalerweise weißer als der Hippocampus. Der Corpus callosum ist in der Regel leicht durch neuronale Fasern zu unterscheiden, die in vertikaler und horizontaler Richtung gehen, wenn sie von oben beobachtet werden (Abbildung 3).
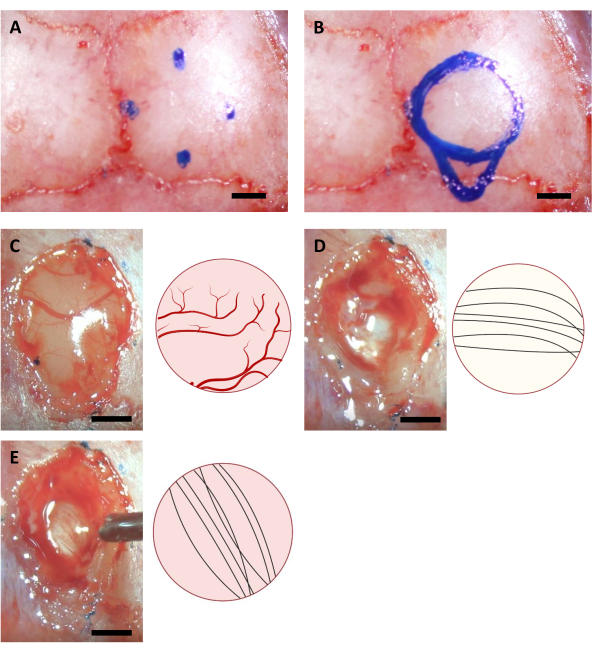
Abbildung 3: Stereotaxische Koordinaten der Hippocampus-Lage und des Hirnablationsprozesses. (A) Vier Koordinaten für die Ränder des Kraniotomiebereichs. (B) Vollständiger Kraniotomiebereich. (C-E) Repräsentative Bilder, die während der Operation aufgenommen wurden (links) und ihr schematisches Diagramm (rechts), das die verschiedenen Farben und Richtungen der neuronalen Fasern von (A) Cortex (B) Corpus Callosum und (C) Hippocampus anzeigt, die während der Kortexablation sichtbar sind. Maßstabsleiste: 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Blutungen an diesem Punkt beeinflussen die Sichtbarkeit des Hirngewebes in der Kraniotomie. Tragen Sie 1x PBS auf, gefolgt von einem sanften Absaugen, während Sie den Kortex ansaugen, um das Blut loszuwerden.
HINWEIS: Kontinuierliche Blutungen sind während dieses Schritts unvermeidlich, und bis zu einem gewissen Grad ist eine kontinuierliche Blutung ein Zeichen für normalen Blutdruck. Im Gegensatz zur Cortex-Imaging-Fensterimplantation ist das Vorhandensein von Blut unter dem optischen Fenster akzeptabel, da es einige Tage nach der Operation gereinigt wird. Das Einsetzen der bildgebenden Kanüle in die erzeugte Höhle so schnell wie möglich nach dem Abtladieren des Kortex ist optimal. - Wenn die Kraniotomie um <0,5 mm größer ist als die bildgebende Kanüle, retten Sie die Installation der Kanüle bis zu einem gewissen Grad, indem Sie eine zusätzliche Kwik Sil-Versiegelung verwenden, bevor Sie das Implantat mit SuperBond fixieren.
- Wenn die Kraniotomie um <0,5 mm kleiner ist als die bildgebende Kanüle, retten Sie den chirurgischen Eingriff bis zu einem gewissen Grad, indem Sie den Rand der Kraniotomie mit einer feinen Pinzette oder einer Augenschere trimmen, da der verbleibende Knochen am Rand der Kraniotomie durch das Bohren dünner ist als der Schädel selbst.
HINWEIS: Kraniotomien, die die Bereiche über 0,5 mm überschreiten, können nicht gerettet werden. Die entsprechenden Maßnahmen in diesen Fällen sollten dem Kündigungsverfahren gemäß dem Tierprotokoll folgen.
- Setzen Sie das Implantat vorsichtig in die Kraniotomie ein.
- Drücken Sie mit der L-förmigen Nadel fest auf das Implantat, um das optische Fenster des Implantats so nah wie möglich an der freiliegenden Oberfläche des Hippocampus zu positionieren. Tragen Sie PBS wiederholt auf den Schädel um das Implantat herum auf, gefolgt von einer Absaugung, um während des Einsetzens des Implantats so weit wie möglich Blut zu entfernen. Tragen Sie dann eine dünne Schicht Kwik Sil zwischen Implantat und Schädel auf, um zu verhindern, dass Zahnzement unter den Schädel eindringt (Abbildung 4).
- Stellen Sie sicher, dass das optische Fenster des Implantats direkt vor dem Hippocampus liegt, um Eineblut- oder andere Flüssigkeitsansammlung darunter zu vermeiden.
HINWEIS: Der kritische Punkt besteht darin, sicherzustellen, dass das Deckglas der Bildkanüle direkt gegen den Hippocampus platziert wird, was während des Installations- und Versiegelungsprozesses einen sanften Druck auf die Kanüle erfordern kann. Ob die Oberseite der bildgebenden Kanüle parallel zum Schädel verläuft, ist für den endgültigen optischen Zugang nicht entscheidend, solange das optische Fenster gegen den Hippocampus platziert wird. - Entsprechend der durchschnittlichen Dicke des Kortex über dem CA1-Bereich halten Sie die obere Oberfläche der bildgebenden Kanüle um ~ 0,5 mm über der Schädeloberfläche, um die Befestigung der Kanüle am Schädel zu erleichtern (Abbildung 4).
- Stellen Sie sicher, dass das optische Fenster des Implantats direkt vor dem Hippocampus liegt, um Eineblut- oder andere Flüssigkeitsansammlung darunter zu vermeiden.
- Sobald das Kwik Sil ausgehärtet ist, was normalerweise nicht mehr als ~ 1 minute dauert, tragen Sie Super-Bond C & B gleichmäßig auf die Oberfläche des Schädels, die Oberfläche von Kwik-Sil und die Oberseite des Implantats auf.
- Sobald der Super-Bond C & B ausgehärtet ist, tragen Sie Prothesenbasisharz über dem Super-Bond C & B sowie die Haut um den Schnitt zu Beginn der Operation auf.
HINWEIS: Alternative Zementsorten sind von mehreren Anbietern erhältlich. Befolgen Sie die entsprechenden Herstelleranweisungen. - Nachdem das Prothesenbasisharz ausgehärtet ist, legen Sie die Kopfplatte auf das Harz um das Implantat herum und machen Sie es mit der bildgebenden Kanüle konzentrisch. Tragen Sie mehr Prothesenharz um und über der Kopfplatte auf, um ihre Position zu fixieren. Lassen Sie es für einige Minuten aushärten.
- Vermeiden Sie es, eine dicke Zementschicht um die Kanüle herum aufzubauen, um einen besseren Zugang zum Bildfenster mit der Objektivlinse zu gewährleisten (Abbildung 4).
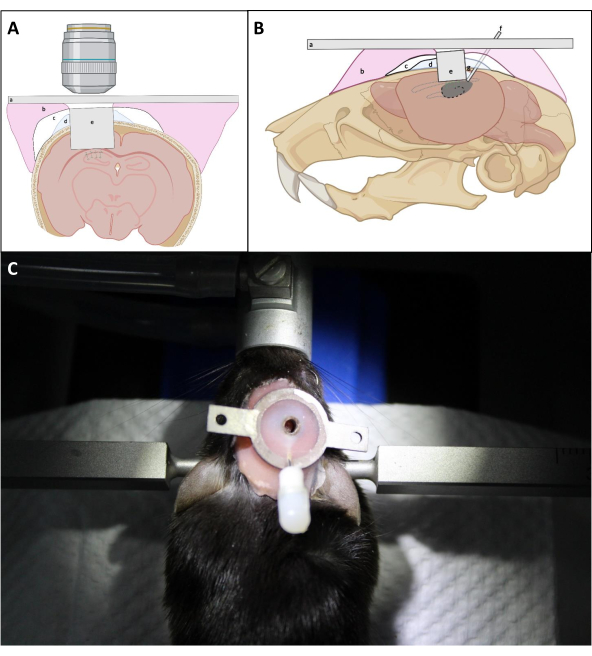
Abbildung 4: Schematische Darstellung der Fensterimplantation in (A) koronaler und (B) sagittaler Ansicht. a)Kopfplatte; b)Prothesenbasisharz; c)Superbond; d)Kwik-Sil; e)Bildgebende Kanüle; f) Injektionskanüle; g)Lötzinn. (C): Maus mit dem installierten Implantat nach der Operation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Verdünnen Sie das Prothesenbasisharz, um seine Viskosität zu verringern, so dass es die Vorbehalte füllen kann, die mit einem Applikator schwer zu erreichen sind.
- Legen Sie vorsichtig ein isoliertes Gummiband über das Fenster, um das Fenster vor möglichen Verunreinigungen durch Tiereinstreu zu schützen.
- Wenn die Operation abgeschlossen ist, injizieren Sie entzündungshemmende Medikamente subkutan, um eine Entzündungsreaktion zu verhindern.
- Legen Sie das Tier in einen warmen Käfig, bis es sich von der Anästhesie erholt hat.
- Überprüfen Sie den Gesundheitszustand der Maus für 72 Stunden nach der Operation, indem Sie das allgemeine Verhalten beobachten. Entzündungshemmende Medikamente und Analgetika werden alle 24 Stunden zwei bis drei Tage nach der Operation subkutan injiziert, um Schmerzen zu lindern und die Entzündungsreaktion zu reduzieren.
HINWEIS: Alternative Überwachungsverfahren, Medikamente und Dosierungen sind für die postoperative Versorgung möglich, siehe das von der IUCAC zugelassene Tierprotokoll für das genaue Verfahren. - Überprüfen Sie das Fenster 5-7 Tage nach der Operation, um Vaskulatur unter dem Fenster zu beobachten. Im Falle eines klaren Fensters ist das Tier bereit für die Virusinjektion.
3. Virus-Injektion
HINWEIS: Die Virusinjektion erfolgt in der Regel 5-7 Tage nach der Operation. Vor der Virusinjektion muss bestätigt werden, dass das Bildgebungsfenster klar ist und es möglich ist, Gehirngefäße zu beobachten (Abbildung 5). In einigen Fällen kann es bis zu 14-16 Tage dauern, bis das Fenster geräumt ist, was auch akzeptabel ist, wenn keine Gehirnentzündung festgestellt wird.
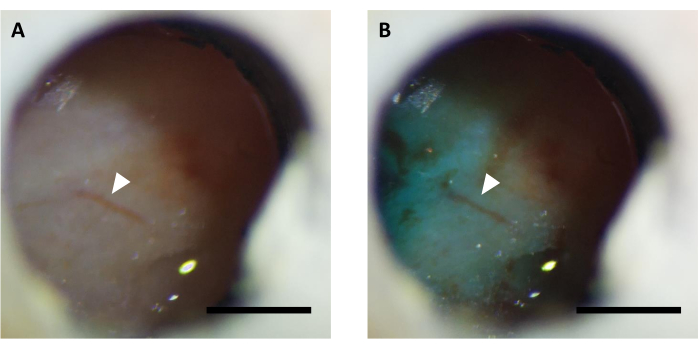
Abbildung 5: Repräsentatives Bild des optischen Fensters (A) vor und (B) nach Virusinjektion, ergänzt mit FastGreen-Farbstoff. Pfeil zeigt die gleiche Gefäßstruktur an. Maßstabsleiste: 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Fügen Sie der Viruslösung, verdünnt auf den gewünschten Titer, im Verhältnis 1:9 in einer PCR-Tube eine Fast-Green-Farbstoff-Stammlösung hinzu.
HINWEIS: Schneller grüner Farbstoff wird hinzugefügt, um die Visualisierung der Viruslösung während der Injektion zu erleichtern. - Verbinden Sie den Polyethylenschlauch mit der Spritze und füllen Sie den Schlauch dann mit einer Spritzenpumpe mit Mineralöl auf.
- Verbinden Sie die innere Kanüle mit dem anderen Ende des Schlauches, ziehen Sie das Mineralöl ein und ziehen Sie es einige Male zurück, um sicherzustellen, dass die innere Kanüle nicht verstopft ist.
- Betäuben Sie das Tier mit Isofluran (4% für die Induktion, 1,5-2% für die Aufrechterhaltung, 0,3-0,5 l / min Luftdurchfluss), befestigen Sie den Kopf in einem stereotaxischen Rahmen über einem Heizkissen (37 ° C beibehalten), tragen Sie Augensalbe auf.
- Ziehen Sie 600 nL der Viruslösung, entfernen Sie die Dummy-Kanüle und führen Sie die interne Kanüle, die mit der Injektionsspritze verbunden ist, in die Führungskanüle ein, infundieren Sie das Virus mit einer Geschwindigkeit von 50 nL / min für insgesamt 10 Minuten.
HINWEIS: Überprüfen Sie mit einem Stereomikroskop, ob der Farbstoff durch das Fenster sichtbar ist, um die erfolgreiche Virusinjektion zu bestätigen (Abbildung 5). - Halten Sie die innere Kanüle nach der Injektion 10 Minuten lang angeschlossen, damit sich das Virus unter dem Fenster ausbreiten kann.
- Entfernen Sie vorsichtig die innere Kanüle von der Führungskanüle und rekapitulieren Sie sie mit einer Dummy-Kanüle.
- Legen Sie das Tier in einen warmen Käfig, bis es sich von der Anästhesie erholt hat.
HINWEIS: In der Regel sind Mäuse in 10-20 Tagen nach der Virusinjektion für die Bildgebung bereit. Expressionsniveau und -zeit hängen vom Virusserotyp und -promotor ab, der zur Triebtriebgenexpression verwendet wird.
4. Bildgebung von wachen Mäusen unter dem Weitfeldmikroskop.
HINWEIS: Die vorbereitete Kopfplatte bietet eine außergewöhnliche Stabilität des bildgebenden Implantats und ermöglicht so eine Längsbildgebung bei wachen und sich verhaltenden Mäusen mit minimalen Bewegungsartefakten.
- Induzieren Sie die Maus mit 4% Isofluran für ein paar Minuten, befestigen Sie ihre Kopfplatte an der Kopfgabel und befestigen Sie dann die Kopfgabel am Laufband.
HINWEIS: Die Kopf gabel und das Laufband sind für die in dieser Studie verwendete Kopfplatte angepasst, siehe Unterstützende Materialien für die entsprechenden CAD-Dateien. Die Induktion der Maus vor der Kopffixierung ist optional, da es möglich ist, das Tier für dieses Verfahren zu gewöhnen. - Bewegen Sie das Laufband unter den Mikroskopstand und positionieren Sie das optische Fenster unter der Objektivlinse.
- Verwenden Sie ein Objektiv mit geringer Vergrößerung, um das beste Sichtfeld (FOV) für die funktionelle Bildgebung zu finden, und wechseln Sie dann zu einem objektiven mit höherer NA, um die neuronalen Aktivitäten mit Einzelzellauflösung aufzuzeichnen.
HINWEIS: Wenn die Injektionskanüle immer noch ein Hindernis für die Objektivlinse ist, um ihren Arbeitsabstand zu erreichen, verwenden Sie einen Drahtschneider, um die Injektionskanüle von der Kopfplatte abzuschneiden.
Ergebnisse
In-vivo-Bildgebung der neuronalen Aktivität mit einem genetisch kodierten Kalziumindikator. Im Durchschnitt beginnt die In-vivo-Bildgebung 3-4 Wochen nach der Implantation, wenn eine ausreichende Transgenexpression erreicht wird. Zu diesem Zeitpunkt sind Hirnödeme und Blutungen in der Regel vollständig aufgelöst, und Gehirngefäße können leicht durch das optische Fenster beobachtet werden. Hier nutzten wir das beschriebene Präparat, um die wiederholten Aufzeichnungen der neuronalen Aktivität in der dorsalen Hippocampus-CA1-Region bei sich verhaltenden Mäusen unter dem Fluoreszenz-Weitfeldmikroskop durchzuführen. Um die neuronale Aktivität aufzuzeichnen, verwendeten wir einen hellen genetisch kodierten Kalziumindikator namens NCaMP713, der eine ähnliche Kalziumempfindlichkeit und zeitliche Auflösung wie GCaMP6s14aufweist. Um den NCaMP7-Indikator im Hippocampus zu exprimierenden, injizierten wir das rAAV/DJ-CAG-NCaMP7-Virus mit einer Infusionskanüle und leiteten 14 Tage nach der Injektion eine Längengradbildgebung ein. Um die neuronale Aktivität aufzuzeichnen, verwendeten wir ein 10-faches NA 0,3-Luftobjektiv und eine Hamamatsu OrcaFusion sCMOS-Kamera, die eine Bildgebung bei ~ 1,5 x 1,5 mm FOV bei bis zu 100 Hz Frequenz ermöglichte. Die grüne Fluoreszenz wurde durch eine kommerziell erhältliche 470-nm-LED mit einem Standard-GFP-Filterset angeregt. Die durchschnittliche Tiefe der Bildgebung im grünen Kanal beträgt etwa 50-120 μm, was die Aufzeichnung der neuronalen Aktivität hauptsächlich in Stratum Oriens und Stratum Pyramidale ermöglicht. Die Bildtiefe in Nahinfrarotkanälen kann bis zu 200 μm bis zu den tieferen Schichten des Hippocampus8 erreichen. Die durchschnittliche Aufnahmezeit pro Sichtfeld betrug 6-12 min, obwohl viel längere Bildgebungssitzungen möglich sind, da NCaMP7 durch eine extrem hohe Photostabilität gekennzeichnet ist und keine nachweisbare Phototoxizität beobachtet wurde (Abbildung 6).
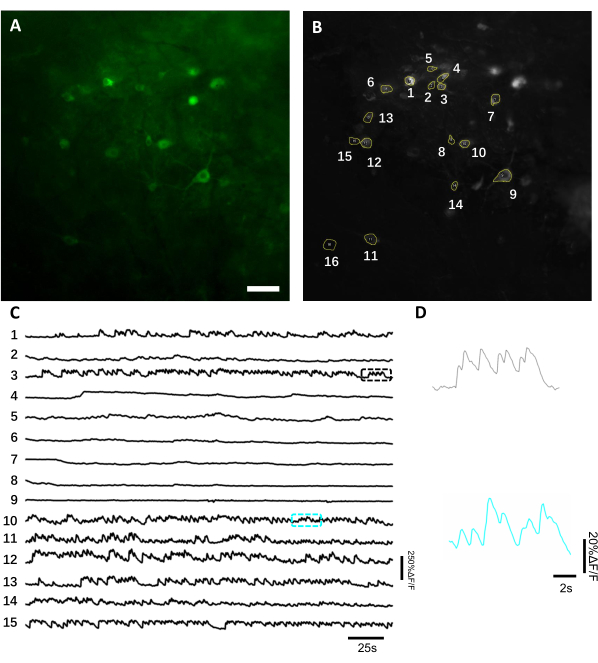
Abbildung 6: Aufzeichnung der neuronalen Aktivität in den Neuronen des Hippocampus unter Verwendung eines genetisch kodierten Calciumindikators für grüne Fluoreszenz. (A) Ein ausgewähltes Sichtfeld, das unter einem Weitfeldfluoreszenzmikroskop im grünen Kanal abgebildet wurde. (B) Die 15 ROIs, die den einzelnen Neuronen entsprechen, die in A dargestellt und unter Verwendung der Standardabweichungsprojektion der gesamten Aufzeichnung ausgewählt wurden. (C) Repräsentative Fluoreszenz-Einzelversuchsspuren der 15 ausgewählten Neuronen in B. (D) Eine repräsentative Zoom-in-Ansicht von 2 Kalziumspuren in entsprechenden Farbfeldern in C. Scale bar, 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um Fluoreszenzspuren zu erhalten, wurden die Regionen von Interesse (ROIs), die neuronalen Somen entsprechen, manuell segmentiert und von der ImageJ-Software analysiert. Vor der Bewegungskorrektur der Bildanalyse waren gängige Post-Recording-Verfahren bei wachen Tieren nicht erforderlich, da die erfassten Datensätze aufgrund der hohen Stabilität des bildgebenden Implantats keine Bewegungsartefakte aufwiesen. Eine repräsentative optische Einzelstudie zur Aufzeichnung neuronaler Aktivitäten aus dem Hippocampus in einer sich wach verhaltenden Maus ist in Abbildung 6 dargestellt. 15 ROIs, die neuronalen Somen entsprechen, wurden manuell aus demselben FOV ausgewählt, das in Abbildung 6Bgezeigt ist, und die Fluoreszenzspuren innerhalb jedes ROI in Einzelversuchen sind in Abbildung 6Cdargestellt. Abbildung 6D zeigt zwei repräsentative Teile von Fluoreszenzspuren aus zwei verschiedenen ROIs. Wir führten 4 aufeinanderfolgende Bildgebungssitzungen für dasselbe FOV mit 3-Tage-Intervallen durch. Es war möglich, die gleichen Neuronen in bestimmten FOVs für mindestens zwei Wochen zu identifizieren und abbilden (die längeren Bildgebungssitzungen wurden für diese Studie nicht durchgeführt, jedoch wurde das gleiche Präparat für bis zu 6-monatige Bildgebungsstudien an Mäusen zuvorverwendet 7; Abbildung 7). In dieser Studie verwendeten wir den AAV/DJ-CAG-Vektor, der auch 21 Tage nach der Virusabgabe eine starke Expression des interessierenden Gens antreibt (Ergänzende Abbildung 1). Die kontinuierliche Expression erschwerte die langfristige Identifizierung der gleichen Neuronen aufgrund des erhöhten Fluoreszenzhintergrunds und des Auftretens neuer Neuronen, die den Kalziumindikator exprimieren. Daher sollte die Auswahl des AAV-Serotyps und des Promotors zur Förderung der Zielgenexpression eine der wichtigen Überlegungen während des experimentellen Designs sein, insbesondere wenn eine longitudinale Bildgebung derselben Untergruppe von Neuronen erforderlich ist. Die Bildqualität ermöglichte es, proximale Dendriten aufzulösen und Blutgefäße zu visualisieren.
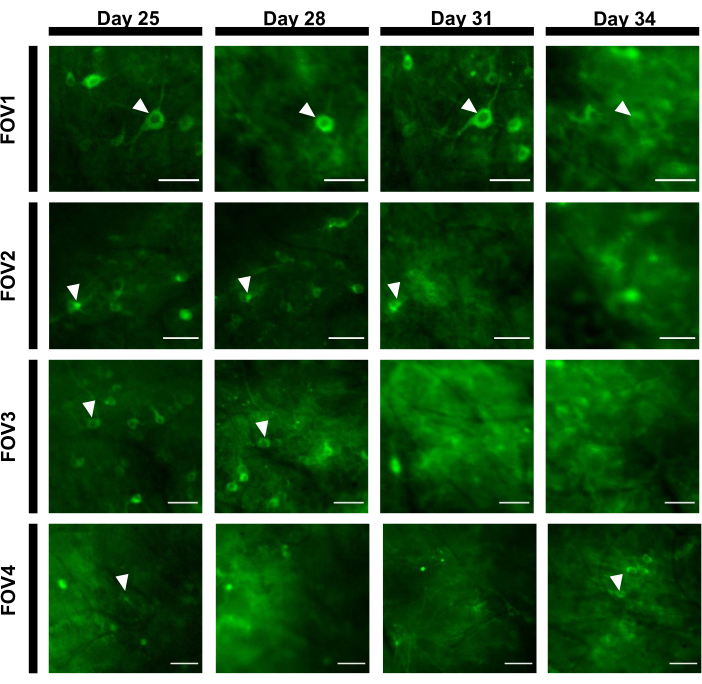
Abbildung 7: Bildsequenz von vier verschiedenen FOVs aus dem Hippocampus-Bereich, die über 12 Tage verfolgt wurden. Dem Tier wurde an Tag 0 das Fenster implantiert und an Tag 7 das rAAV/DJ-CAG-NCaMP7-Virus injiziert. Pfeilspitzen zeigen das Neuron an, das im FOV verfolgt wird. Maßstabsbalken: 80 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
In-vivo-Bildgebung der neuronalen Aktivität mit einem genetisch kodierten Spannungssensor.
In dieser Studie haben wir auch einen neuartigen genetisch kodierten Spannungssensor namens SomArchon7verwendet, der eine Spannungsbildgebung mit Einzelzell-Single-Spike-Auflösung bei sich verhaltenden Tieren ermöglicht7,8. Um SomArchon auszudrücken, injizierten wir das rAAV/DJ-CAG-SomArchon-Virus mit einer Infusionskanüle und führten mehrere Tage nach der Injektion eine Spannungsbildgebung in einer kopffixierten Maus durch. Um die neuronale Aktivität aufzuzeichnen, verwendeten wir ein 40-faches NA 0,8-Objektiv und eine Hamamatsu OrcaFusion sCMOS-Kamera, mit der wir 150x40 μm FOV mit einer Erfassungsrate von bis zu 830 Hz abbilden konnten. Das GFP-Protein, das ein Teil von SomArchon konstruiert, um die Visualisierung der Expression im sichtbaren Bereich des Spektrums zu erleichtern, kann leicht im grünen Kanal abgebildet werden (LED-Anregung bei 470/20 nm, Emission 525/50 nm), um Zellen zu lokalisieren, die für die Spannungsbildgebung von Interesse sind. Optische Spannungsaufzeichnungen wurden im Nahinfrarotkanal (Laseranregung 637 nm bei 3,4 W/mm2,Emission 665 nm Long Pass) mit 4 x 4 Binning bei 830 Hz Erfassungsrate durchgeführt. Wir haben die spontane Aktivität eines Hippocampus-Neurons in einer wachen Maus mit durchschnittlichem SNR von 7 pro Aktionspotential aufgezeichnet (Abbildung 8).
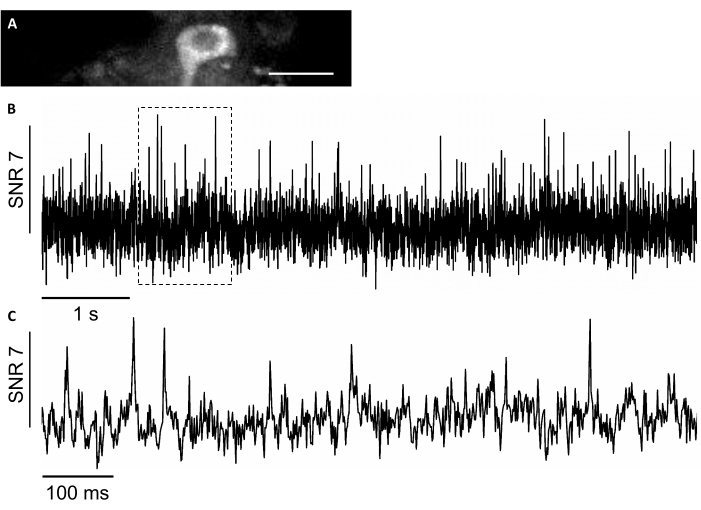
Abbildung 8: Aufzeichnung der neuronalen Aktivität in den Neuronen des Hippocampus mit einem genetisch kodierten Nahinfrarot-Fluoreszenzindikator SomArchon. (A) Ein ausgewähltes Sichtfeld, das unter einem Weitfeld-Fluoreszenzmikroskop im Nahinfrarotkanal abgebildet wurde. (B) Einzelversuchs-Fluoreszenzspur des Neurons in A. (C) Eine repräsentative Zoom-in-Ansicht der Spannungsspur in der entsprechenden Box in B. Maßstabsbalken: 25 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Histologie
Nach der funktionellen Bildgebungsstudie wird die Post-mortem-Analyse verwendet, um die korrekte Platzierung des Implantats, den Bereich der Virusexpression und die Lokalisation eines Proteins von Interesse in abgebildeten Neuronen zu bestätigen. Zur histologischen Überprüfung der Virusexpression und Platzierung des Implantats wurden koronale Abschnitte des PFA-fixierten Gehirns unter einem Fluoreszenz-Weitfeldmikroskop untersucht (Abbildung 9A, C). Ein konfokales Mikroskop wurde verwendet, um hochauflösende Bilder von einzelnen Neuronen zu erfassen, die den Kalziumindikator sowie den Spannungsindikator exprimieren (Abbildung 9B, D). DaPI-Färbung wurde verwendet, um die Gesamtmorphologie der Gehirnscheibe zu visualisieren. Darüber hinaus können die Hirnschnitte mittels Immunhistochemie beurteilt werden, um Astrogliose oder Gliose durch Fensterimplantation und virale Expression zu überprüfen. Unsere früheren Studien zeigten, dass das Verfahren keine merkliche Glioseinduzierte 7.
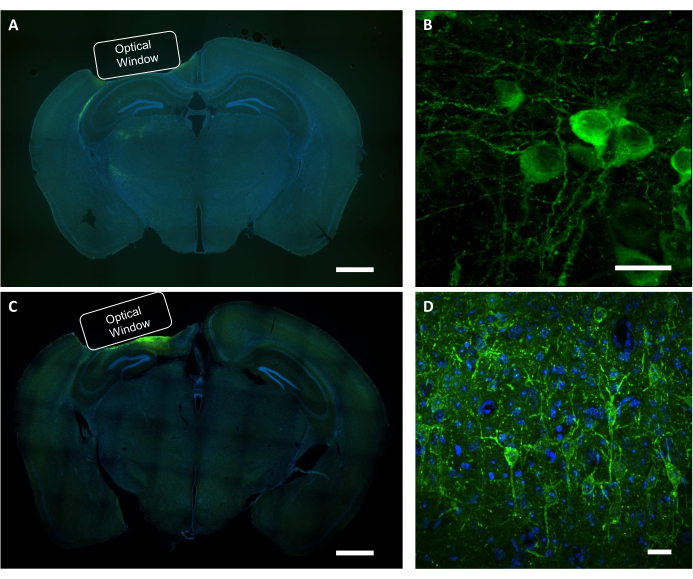
Abbildung 9: Histologische Überprüfung der optischen Fensterposition und der Virusexpression. (A) Ein repräsentatives fluoreszierendes Bild des koronalen Abschnitts des Gehirnschnitts, das die Platzierung des optischen Fensters von einer NCaMP-exprimierenden Maus zeigt. Maßstabsbalken: 1 mm. (B) Ein repräsentatives konfokales Bild von Neuronen, die die NCaMP7-Indikatoren exprimieren. Maßstabsleiste: 25 μm. (C) Ein repräsentatives Fluoreszenzbild des koronalen Abschnitts Gehirnschnitts, das die Platzierung des optischen Fensters einer SomArchon-exprimierenden Maus zeigt. Maßstabsbalken: 1 mm. (D) Ein repräsentatives konfokales Bild von Neuronen, die die SomArchon-Indikatoren exprimieren. Maßstabsleiste: 25 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Quantitative Analyse der relativen Fluoreszenzintensität zusammen mit der Expressionszeit. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Hier beschreiben wir eine Methode zur Langzeitbildgebung der Hippocampus CA1-Region bei sich verhaltenden Mäusen. Die Methode basiert auf der chronischen Implantation eines maßgeschneiderten Bildgebungsfensters, das auch die gezielte Verabreichung von Viren oder Medikamenten direkt an die interessierenden Neuronen ermöglicht. Das vorliegende Protokoll besteht aus vier Hauptteilen: i) Montage des bildgebenden Implantats; ii) Installation eines bildgebenden Implantats; iii) Virusinjektion über bildgebendes Implantat; iv) funktionelle Bildgebung bei sich verhaltenden Mäusen. Im Folgenden beschreiben und diskutieren wir kritische Schritte im Protokoll, die Fehlerbehebung, Änderungen und Einschränkungen der Methode. Wir diskutieren auch die Bedeutung der Methode und ihre möglichen alternativen Anwendungen.
Es gibt mehrere kritische Schritte im beschriebenen Protokoll, die für eine erfolgreiche Operation ziemlich wichtig sind: (i) Vorbereitung eines hochwertigen bildgebenden Implantats; ii) sterile chirurgische Bedingungen; iii) Aspiration des Kortex; iv) genaue Platzierung des bildgebenden Implantats; v) Virusinjektion. Wie Schritt 1.6 zeigt, würde überschüssiges Lötzinn eine größere Kraniotomie erfordern und somit das Entzündungsrisiko erhöhen. Es ist auch sehr wichtig, eine angemessene Menge des adhäsiven optischen Klebstoffs zu verwenden, wenn das Deckglas an der bildgebenden Kanüle befestigt wird, wie in Schritt 1.11 angegeben, da eine unzureichende Menge dazu führen kann, dass Zerebrospinalflüssigkeit in die bildgebende Kanüle austritt und diese undurchsichtig macht. Auf der anderen Seite kann überschüssiger optischer Klebstoff zu einer verminderten Transparenz des Glasfensters führen. Eine mögliche Kontamination des bildgebenden Implantats kann zu einer aktiven Proliferation von Bindegewebe unter dem optischen Fenster und/oder zu schweren Entzündungen führen, die zu einem vorzeitigen Abbruch des Experiments führen. Daher ist die bildgebende Implantation und Vorbereitung vor der Operation fast so wichtig wie der chirurgische Eingriff selbst.
Während der Operation wird der Teil des Kortex unter Kraniotomie durch sanfte Aspiration abgetragen, was zu unvermeidlichen Blutungen führt. Blut an der Operationsstelle reduziert signifikant die Sichtbarkeit des Hirngewebes, das entfernt werden muss. Dies erschwert die genaue Beurteilung der erforderlichen Gewebeablationstiefe. Eine sorgfältige Spülung der Operationsstelle mit PBS jedes Mal vor dem Absaugen, um den nächsten Teil des Gewebes zu entfernen, sorgt für eine bessere Kontrolle der Tiefe. Das Hirngewebe sollte immer in kleinen Portionen Schritt für Schritt entfernt werden, um die Tiefe des abgetragenen Gewebes zu bestätigen, bevor mit mehr Absaugung fortgefahren wird. Eine feinere Kontrolle der Absaugung kann auch mit einer dünneren stumpfen Nadel erreicht werden. Wir empfehlen die Verwendung einer 26-G-Nadel, jedoch ist ein Durchmesser von weniger als 26 G anfälliger für Verstopfungen. Darüber hinaus erfordert es in der Regel viel Übung, um die genaue Tiefe der Aspiration zu bestimmen, die für jedes Tier erforderlich ist, da die Farbe des Kortex, des Corpus callosum und des Hippocampus von Maus zu Maus variieren kann (Abbildung 3).
Das Einsetzen und Sichern des bildgebenden Implantats sollte sehr präzise erfolgen, um eine möglichst nahe Position des Bildgebungsfensters zur dorsalen Oberfläche des Hippocampus zu gewährleisten. Die Größe der vorbereiteten Kraniotomie sollte eng mit dem Implantat übereinstimmen und sein Einsetzen ohne nennenswerten Widerstand ermöglichen. Gleichzeitig sollte es keine sichtbare Lücke zwischen dem Schädel und dem Implantat geben, um eine ordnungsgemäße Abdichtung zu gewährleisten und eine Exposition des Gehirngewebes zu vermeiden. Während der Versiegelung des Schädels sollte ein sanfter und stabiler Druck auf die Oberseite des Implantats ausgeübt werden. Es ist fast unvermeidbar, während der Implantatinstallation Blut unter dem Bildgebungsfenster zu haben. Wenn der chirurgische Eingriff richtig durchgeführt wird, sollte sich das Fenster in 3-7 Tagen aufräumen und das Gefäßsystem des Gehirns wird deutlich sichtbar. Es ist auch wichtig sicherzustellen, dass der Virus ordnungsgemäß unter das Fenster injiziert wird. Im Falle eines fehlgeschlagenen Ausdrucks kann der Virus mehrmals neu ausgelöst werden.
Die Hauptkomplikation, auf die wir in einigen Fällen gestoßen sind, ist die eingeschränkte Sichtbarkeit des Bildgebungsfensters. Es gibt mehrere mögliche Gründe für eine schlechte Bildqualität: i) anhaltende Entzündung; ii) Auswachsen von Bindegewebe auf dem Glas; iii) große Lücke zwischen Fenster und Hippocampus. Entzündungen werden in der Regel durch Kontamination während der Operation oder durch nicht ordnungsgemäß sterilisierte bildgebende Implantate verursacht. Wir empfehlen, die chirurgischen Instrumente vor und nach jeder Operation zu autoklavieren, den Operationsbereich direkt vor dem Eingriff zu desinfizieren und während der Operation eine saubere persönliche Schutzausrüstung zu tragen. Bildgebende Implantate sollten nach der Montage gereinigt, sterilisiert und unter sterilen Bedingungen gelagert werden. Das Auswachsen von Bindegewebe auf dem Glas des bildgebenden Implantats kann auf eine mechanische Kontamination auf der Oberfläche des Glases oder ein übermäßiges Trauma des Hirngewebes während der Kortexablation zurückzuführen sein. Nach der Montage des Implantats ist es wichtig zu bestätigen, dass die Glasoberfläche sauber und glatt ist. Außerdem müssen alle Teile des beschädigten Hirngewebes sorgfältig entfernt werden, bevor das bildgebende Implantat in die Kraniotomie eingesetzt wird. In bestimmten Fällen führt die Lücke zwischen dem Glasfenster und dem Hippocampus zur Ansammlung von Zerebrospinalflüssigkeit, was die Qualität der Bildgebung verringert. Daher ist es bei der Implantation wichtig, es ganz einzusetzen, um einen guten Kontakt zwischen Hippocampus und Glasfenster zu gewährleisten. Manchmal ist es schwierig, den genauen Grund für das undurchsichtige Imaging-Fenster zu identifizieren. Wir empfehlen, eine Post-Mortem-Analyse durchzuführen, um die Bedingungen unter dem optischen Fenster aufzudecken und nachfolgende Operationen entsprechend anzupassen.
Die Methode weist mehrere grundlegende und technische Einschränkungen auf, die vor und während der In-vivo-Bildgebung berücksichtigt werden sollten. Eine der Haupteinschränkungen ist die Kortexablation. Ein Teil des visuellen und sensorischen Kortex wird während der Operation entfernt. Während es schwierig ist, die Auswirkungen der Kortexablation genau zu bewerten, da entferntes Hirngewebe nicht direkt auf den Hippocampus projiziert wird, zeigten mehrere Studien keine merkliche Beeinträchtigung des hippocampusabhängigen Lernens oder anderer relevanter Hippocampus-Funktionen15,16. Die optischen Einschränkungen sollten ebenfalls berücksichtigt werden, insbesondere wenn Objektive mit hohem NA-Objektiv verwendet werden. Zum Beispiel haben wir in dieser Studie eine 1,75 mm lange Kanüle mit einem Innendurchmesser von 1,9 mm verwendet. Die Geometrie dieser Kanüle bewahrt nicht den vollen NA des Luftobjektivs mit NA mehr als ~ 0,5 oder das Wasserobjektiv mit NA mehr als ~ 0,6, da es etwas Licht abschneiden wird. Eine weitere Einschränkung, die für alle bildgebenden Implantate des Gehirns üblich ist, ist, dass ein Teil des Gehirns exponiert wird, wodurch der Wärmeverlust gefördert wird17,18. Die physiologische Gehirntemperatur kann jedoch während der Bildgebung durch Durchblutung eines warmen Puffers leicht wiederhergestellt werden.
Das beschriebene Verfahren kann leicht modifiziert oder für andere Anwendungen angepasst werden. Beispielsweise kann das Präparat für die Bildgebung von Striatum7angepasst werden. Da das Striatum etwas tiefer liegt als der Hippocampus, sollte die längere bildgebende Kanüle für die Montage des bildgebenden Implantats verwendet werden. Wir empfehlen die Verwendung von 2,0 mm Bildkanüle. Die Koordinaten der Kraniotomie sollten entsprechend angepasst werden (AP: +0,8 mm, ML: −1,8 mm). Darüber hinaus ermöglicht die Virusinjektion über Infusionskanüle die Expression eines Transgens in einer dünnen Schicht von Neuronen bei Verwendung des AAV-Serotyps mit eingeschränkter Ausbreitung19,20. Es ist besonders vorteilhaft für die Ein-Photonen-Bildgebung aufgrund der reduzierten unsauzenten Fluoreszenz aus tieferen Schichten und infolgedessen einer verbesserten Einzelzellauflösung. Darüber hinaus kann die Injektionskanüle auch während der funktionellen Bildgebung zur Verabreichung von Medikamenten oder anderen Chemikalien direkt auf die Neuronen im FOV verwendet werden (Abbildung 5B). Die gesamte Infusionskanüle fügt dem bildgebenden Implantat nützliche Funktionalitäten hinzu, verbessert die Bildgebungsqualität aufgrund der gezielten Virusexpression und ermöglicht die pharmakologische Stimulation von Neuronen im FOV. Die verwendete Kopfplatte bietet eine außergewöhnliche Stabilität des bildgebenden Implantats und minimiert Bewegungsartefakte auch bei sich aktiv bewegenden Tieren auf einem Laufband. Die Kopfplatte ist klein und leicht, verursacht minimale Beschwerden für Tiere und bleibt nach der Installation mehrere Monate lang stabil. Das bildgebende Implantat ist auch kompatibel mit multiphotonenbildenden Bildgebung15,16,21 und kann mit Mikroendoskopen22,23kombiniert werden. Ein ähnliches bildgebendes Implantat wurde auch für die Multiphotonenbildgebung der tieferen Hippocampusstrukturen verwendet, einschließlich Stratum radiatum, Stratum lacunose und Gyrus dentatus16,24,25,26,27. Das Targeting der tieferen Hippocampus-Strukturen mit AAVs über Infusionskanülen kann jedoch eine weitere Optimierung des AAV-Serotyps und des Volumens19erfordern.
Wir glauben, dass das beschriebene Protokoll Studien erleichtern wird, die darauf abzielen, die neuronale Aktivität mit hoher räumlich-zeitlicher Auflösung im Hippocampus von sich verhaltenden Mäusen mit einfachen und erschwinglichen Ein-Photonen-Bildgebungsaufbauten zu untersuchen.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken allen Mitgliedern der Molecular BioEngineering Group an der Westlake University für die Hilfe und die nützliche Diskussion. Wir danken auch Jinze Li und Jie-Min Jia von der Westlake University für die Hilfe beim Filmen des chirurgischen Eingriffs.
Diese Arbeit wurde durch Eine Anschubfinanzierung der Foundation of Westlake University, den BBRF Young Investigator Grant 2020 und den Zuschuss der National Natural Science Foundation of China 32050410298 alle an K.D.P.
Materialien
| Name | Company | Catalog Number | Comments |
| Cover glass | Deckgläser | 72296-03 | |
| Denture Base Resin | ShangHai New Centery Dentel Material | N/A | Type I, self-solidifying |
| Dummy Cannula | RWD Life Science Co.,LTD | 62102 | OD 0.30mm |
| Guide Cannula | RWD Life Science Co.,LTD | 62003 | 26G |
| Head Fork | N/A | N/A | Custom made |
| Head Plate | N/A | N/A | Custom made |
| Imaging Cannula | N/A | N/A | Custom Made; OD 3mm, ID 2.7mm, Height 1.8mm, #108 stainless steel |
| Internal Cannula | RWD Life Science Co.,LTD | 62203 | 0.30*0.14 (OD*ID, mm) |
| Kwik Sil | World Precision Instruments | KWIK-SIL | |
| SuperBond C&B | SUN MEDICAL | N/A | SuperBond C&B kit |
| Treadmill Kit | N/A | N/A | Custom made |
| UV-cured Adhesive | NORLAND PRODUCTS | NOA 60 |
Referenzen
- Leutgeb, S., et al. Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science. 309 (5734), 619-623 (2005).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Polanco, J. C., et al. Amyloid-β and tau complexity - towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2018).
- Henneman, W. J. P., et al. Hippocampal atrophy rates in Alzheimer disease. Added value over whole brain volume measures. 72 (11), 999-1007 (2009).
- Camicioli, R., et al. Parkinson's disease is associated with hippocampal atrophy. Mov Disord. 18 (7), 784-790 (2003).
- Piatkevich, K. D., Murdock, M. H., Subach, F. V. Advances in Engineering and Application of Optogenetic Indicators for Neuroscience. Applied Sciences. 9 (3), 562 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Fan, L. Z., et al. All-Optical Electrophysiology Reveals the Role of Lateral Inhibition in Sensory Processing in Cortical Layer 1. Cell. 180 (3), 521-535 (2020).
- Shemesh, O. A., et al. Precision Calcium Imaging of Dense Neural Populations via a Cell-Body-Targeted Calcium Indicator. Neuron. 107 (3), 470-486 (2020).
- Villa, K. L., et al. Inhibitory Synapses Are Repeatedly Assembled and Removed at Persistent Sites In Vivo. Neuron. 89 (4), 756-769 (2016).
- Franklin, K. B. J., Paxinos, G. . Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , (2013).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Subach, O. M., et al. Novel Genetically Encoded Bright Positive Calcium Indicator NCaMP7 Based on the mNeonGreen Fluorescent Protein. International Journal of Molecular Sciences. 21 (5), 1644 (2020).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Kalmbach, A. S., Waters, J. Brain surface temperature under a craniotomy. Journal of neurophysiology. 108 (11), 3138-3146 (2012).
- Roche, M., et al. In vivo imaging with a water immersion objective affects brain temperature, blood flow and oxygenation. eLife. 8, 47324 (2019).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neuroscience Research. 93, 144-157 (2015).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H., Manfredssonn, F. P. . Gene Therapy for Neurological Disorders: Methods and Protocols. , 133-149 (2016).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), (2016).
- Yashiro, H., Nakahara, I., Funabiki, K., Riquimaroux, H. Micro-endoscopic system for functional assessment of neural circuits in deep brain regions: Simultaneous optical and electrical recordings of auditory responses in mouse's inferior colliculus. Neuroscience Research. 119, 61-69 (2017).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution In Vivo Imaging of Hippocampal Dendrites and Spines. The Journal of Neuroscience. 24 (13), 3147 (2004).
- Busche, M. A., et al. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proceedings of the National Academy of Sciences. 109 (22), 8740 (2012).
- Attardo, A., et al. Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Castello-Waldow, T. P., et al. Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. PLOS Biology. 18 (11), 3000928 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten