Method Article
마우스를 면도하는 해마에서 신경 활동을 시각화하기위한 두개골 절제술 절차
요약
이 문서는 주입 캐뉼라와 마우스의 해마의 CA1 영역에 이식으로 보충 된 맞춤형 이미징 창의 준비를 보여줍니다.
초록
깨어 있는 행동 동물에 있는 단세포 해상도에 있는 신경 활동을 화상 진찰하는 것은 시스템 신경 과학에 있는 신경 회로 기능의 조사를 위한 아주 강력한 접근입니다. 그러나, 포유류 조직에 있는 높은 흡광도 및 산란은 주로 피상적인 두뇌 지구에 생명 화상 진찰을 제한하고, 해마와 같은 깊은 두뇌 영역을 떠나, 광학 현미경 검사법에 대한 손이 닿지 않는 곳에 둡니까. 이 비디오에서는, 헤드 고정 행동 마우스에서 등쪽 해마 CA1 영역의 만성 생체 내 이미징을 가능하게 하기 위해 맞춤형 이미징 창의 준비 및 이식을 보여줍니다. 맞춤형 창은 이미징 영역에 바이러스 벡터와 약물의 표적 전달을 허용하는 주입 캐뉼라로 보완됩니다. 이 준비를 와이드 필드 이미징과 결합함으로써, 우리는 몇 주 동안 마우스를 행동하는 뉴런의 큰 하위 세트에서 형광 칼슘 지표를 사용하여 신경 활동의 장기 기록을 수행했습니다. 또한 단일 스파이크 해상도를 갖춘 전압 이미징을 위한 이 준비의 적용 가능성을 입증했습니다. 신경 활동과 과학 CMOS 카메라의 고성능 유전적으로 인코딩된 지표는 높은 시간적 해상도에서 단일 뉴런의 세포 전형 학적 세부 사항의 재발적인 시각화를 허용했습니다. 우리는 또한 기술된 방법의 장점 및 잠재적인 한계 및 그밖 화상 진찰 기술과의 호환성에 대해 토론합니다.
서문
해마는 학습및 기억1뿐만 아니라 공간 탐색2를담당하는 주요 뇌 영역입니다. 해마 위축은 기억 상실 및 인지기능저하3,4,5와 관련된 신경 학적 및 정신 질환과 관련이있습니다. 마우스에서, 해마는 세포 및 네트워크 수준4,5에공간, 문맥, 및 연관 학습 및 메모리 형성을 연구하는 아주 잘 확립된 모델이다. 학습과 메모리의 기계적인 연구는 신경 구조와 쥐를 행동하는 기능의 세로 심문이 필요합니다. 유전적으로 인코딩된 프로브6과 결합된 형광 이미징 은 막 전압 역학7,8,칼슘 과도9,뉴런의 대형 하위 집합에 대한 구조적 변화10을 유전적으로 기록할 수 있는 전례 없는 기능을 제공합니다. 그러나, 마우스에 있는 해마에 광학 접근은 두께에 있는 1 mm 이상에 도달할 수 있는 피질에 의해 방해됩니다. 여기서, 우리는 마우스를 행동하는 등쪽 해마의 CA1 하위 영역에 장기 광학 접근을 위해 맞춤형 이미징 장치와 만성 이식을 마우스 헤드로 조립하는 절차를 설명했습니다. 이미징 임플란트에 통합된 주입 캐뉼라를 사용하면 시야의 뉴런에 직접 바이러스 또는 약물을 투여할 수 있습니다. 넓은 필드 현미경 검사법과 함께 설명된 준비는 오랜 기간 동안 마우스를 행동하는 뉴런의 큰 하위 집합의 재발성 이미징을 가능하게 합니다. 우리는 단일 세포 해상도에서 신경 활동 기록을 위한 재조합 아데노 관련 바이러스 (rAAV)의 표적 주입을 통해 해마 CA1 지역에서 칼슘 및 전압 유전으로 인코딩된 지표를 표현하기 위해 이 준비를 활용했습니다. 우리는 또한 동물을 행동하는 높은 현면 적 해상도에서 해당 신경 하위 집합의 세로 칼슘 이미징을 수행했습니다. 또한, 이러한 제제는 다광석 현미경 검사법과 미세내시경과 호환되므로, 마우스를 행동하는 세포 및 세포외 수준에서 신경망을 연구하기 위해 이미징 기술의 툴박스를 더욱 확장한다. 우리는 프로토콜의 중요한 단계와 문제 해결을 설명했습니다. 우리는 또한 방법의 가능한 함정과 한계에 대해 논의했다.
프로토콜
여기에 설명 된 모든 방법은 웨스트 레이크 대학의 기관 동물 관리 및 사용위원회 (IACUC)에 의해 승인되었습니다.
1. 임플란트 조립
참고: 이미징 임플란트의 조립은 기술적으로 간단하며 시판되는 항목만필요합니다(그림 1, 재료 표참조). 헤드 플레이트는 스테인레스 스틸 또는 티타늄 플레이트를 사용하여 현지 기계 가게에서 제조 할 수 있습니다. 수술을 시작하기 전에 완전히 조립된 임플란트의 재고를 준비하는 것이 좋습니다. 생체 내 실험이 끝나면 임플란트를 여러 번 회수하고 재사용할 수 있습니다. 경우에 따라 커버 글래스를 납땜하거나 교체하여 주입 캐뉼라를 다시 부착해야 할 수도 있습니다.
- 조립 및 설치 이미징 임플란트를 위한 6가지 핵심 하드웨어 구성 요소를 모두 준비합니다(그림1).
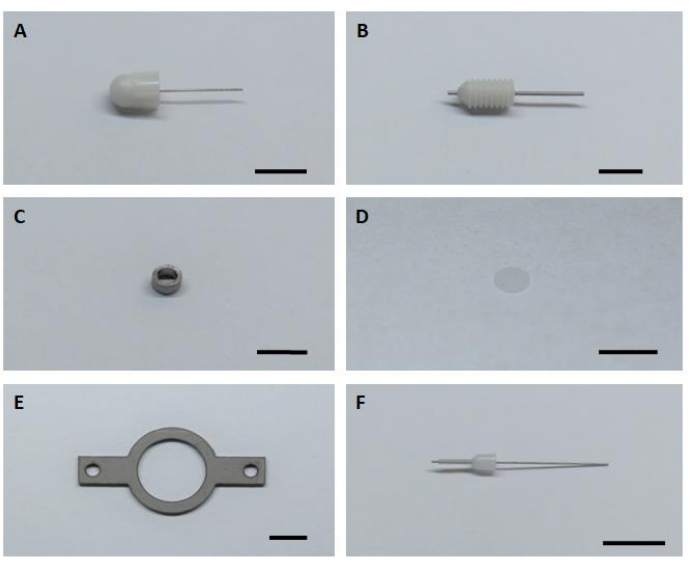
그림 1: 이미징 임플란트의 조립 및 설치를 위한 6가지 핵심 하드웨어 구성 요소. (A)더미 캐뉼라. (B)가이드 캐뉼라. (C)이미징 캐뉼라. (D)유리 커버 유리. (E)헤드 플레이트. (F)내부 캐뉼라. 규모 표시줄: 5mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 용접 기를 켜고 필요한 온도까지 가열합니다.
참고: 온도는 사용되는 용접 주석에 따라 다릅니다. - 미세 사포를 사용하여 이미징 캐뉼라의 측면 표면을 연마하여 산화 층을 제거하고 따라서 더 강한 납땜을 용이하게합니다.
- 화상 진찰 캐뉼라 및 주입 캐뉼라의 위치를 조정합니다 (삽입 된 더미 캐뉼라를 사용한 가이드 캐뉼라)는 도움의 손길(그림 2A,B)을사용하여.
- 바늘을 가진 주사기를 사용하여, 화상 진찰과 주입 칸누라 사이 연결 자리에 적당한 유형의 플럭스를 5 초 동안 적용한 다음 물방울을 제거하십시오.
참고: 이 준비를 위해, 우리는 스테인레스 스틸로 만들어진 화상 진찰 및 주입 캐뉼라로 납땜 스테인레스 스틸 부품을 납땜하기 위해 제조 업체에 의해 지정된 상업적으로 이용 가능한 플럭스를 사용했다. 캐뉼라를 제조하는 데 사용되는 다른 재료의 경우 최종 사용자는 선택한 재료를 용접 할 수있는 플럭스를 선택해야합니다. - 납땜 주석을 녹여 플럭스로 처리된 연결 부위에 적용합니다(도2).
참고: 수술 중 불필요한 더 큰 두개골 절제술이 필요하기 때문에 과도한 납땜 주석을 피하십시오.
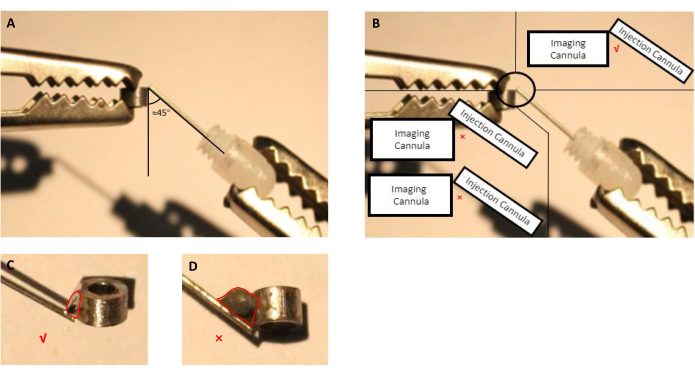
그림 2: 삽입 더미 캐뉼라가이드 캐뉼러로 구성된 분사 캐뉼러를 조립하는 회로도, 이미징 캐뉼라. (A)주사 캐뉼라와 이미징 캐뉼라 사이의 각도는 근접45도여야 한다. (B)주사 캐뉼라의 끝은 이미징 캐뉼라의 가장자리에 있어야 한다. (C)살구 화상 진찰 및 주입 칸누라에 사용되는 용접 주석의 적절한 크기 (빨간색 선은 주석 물방울의 윤곽을 나타냅니다). (D)임플란트 준비 중에 피해야 하는 용접 주석의 부적절한 크기(빨간 선은 주석 물방울의 윤곽을 나타낸다). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 납땜 주석이 식을 때까지 기다립니다. 일반적으로 몇 초가 걸립니다.
- 사출 캐뉼러가 양방향에서 더미 캐뉼라를 삽입하여 차단되지 않는지 확인합니다.
- 이쑤시개 또는 26 G 주사기 바늘을 사용하여 이미징 캐뉼라의 하단에 UV 경화 광학 접착제를 적용하십시오.
- 미세 트위저를 사용하여 해당 크기의 커버 유리를 이미징 캐뉼라에 조심스럽게 배치합니다.
참고: 유리의 위치는 광학 접착제에 닿으면 유리를 너무 많이 움직이지 않고 이미징 캐뉼라에 정확하게 수행해야 합니다. 그렇지 않으면 유리가 더러워져 이미징의 품질이 줄어듭니다. - 표준 핸드헬드 UV 램프에서 350-400 nm UV 조명으로 최소 한 시간 동안 접착제를 치료합니다.
참고: 사용된 접착제는 광학적으로 투명해야 합니다. 그렇지 않으면 이미징 창의 품질이 저하됩니다.
주의: 자외선 차단 안경, 장갑 및 실험실 코트를 착용하여 피부와 눈 노출을 방지하십시오. - 캐뉼라를 70% 에탄올로 씻고, 공기 건조하고, 수술전까지 멸균 용기에 보관하십시오.
참고: 커버 글래스를 가능한 한 깨끗하고 그대로 유지하는 것이 매우 중요합니다. 사용된 광학 접착제는 70% 에탄올에서 화학적으로 안정적입니다.
2. 창 이식
- 수술 전 준비 단계
- 자동 클ave에 있는 모든 수술 기구를 살균합니다.
- 2개의 별도 페트리 요리로 PBS 1배, 에탄올 70%를 준비하세요.
- 선택사항: 수술 시술을 시작하기 전에 최소 20분 동안 UV 광을 사용하여 수술 부위를 소독합니다.
참고: 가능한 가장 멸균 조건에서 작동하면 유리로 덮인 두개골 창이 성공적이고 오래 지속됩니다( 6개월 동안). 오염은 대부분의 경우에 감소 된 창 투명도 또는 심한 염증을 초래할 수 있습니다.
- 수술
- 수술 직전에 70%의 에탄올로 수술 부위를 살균합니다.
- 동물의 무게를 측정하고 IACUC 승인 된 동물 프로토콜에 따라 피하 진통제의 사전 수술 용량을 투여.
- 이소플루란으로 마우스를 마취한다(유도용 4%, 유지 보수시 1.5~2%, 공기의 0.3-0.5 L/min 유량). 꼬리 꼬집기 와 발가락 핀치 기술을 사용하여 동물이 완전히 진정되도록하십시오. 호흡, SpO2및 심박수와 같은 동물의 활력 징후를 관찰하여 시술 기간 동안 관찰하십시오.
- 트리머 또는 탈필 크림을 사용하여 목 뒤쪽에서 눈까지 털을 제거합니다.
- 수술 가열 패드 (37 °C 유지)에 스테레오 탁스 프레임에 마우스를 배치합니다. 이어 바으로 머리를 고정하십시오. 머리를 사방으로 살짝 밀어 머리를 단단히 고정시합니다.
- 수술 중 동물의 눈이 건조되는 것을 방지하기 위해 눈 연고를 적용하십시오.
- 베타딘으로 수술 부위를 살균한 후 에탄올이 3회 인절을 합니다.
- 두개골 의 상단에 피부를 제거, 머리의 베이스를 따라 모든 수평 컷으로 시작, 거의 눈꺼풀에 도달, 다음 중간라인에 수렴 두 경사 컷, 장밋 방향으로 두 컷다음.
- 두 개의 멸균 면봉으로, 연결 조직뿐만 아니라 목 뒤쪽의 근육, 두개골의 가장자리에 철회.
참고: 조작 하는 동안 혈관 (특히 근육에 숨겨진 것) 손상 방지 하려고. - 과도한 통증을 피하기 위해 2 분 동안 음막 표면에 리도카인 용액 (~0.1 mL)을 적용하십시오. 선택적으로 두개골을 제거 한 후 붓기에서 뇌를 줄이기 위해, 0.1 mL의 1% 덱사메타손피카테타손은 피하 주입 될 수있다.
- 두개골의 노출된 부위 전체를 메스로 부드럽게 긁어 내어 접착제와 치과 시멘트가 더 잘 부착되어 만성 이식을 가능하게 하는 건조하고 거친 표면을 만듭니다.
- 스테레오탁스 스테이션에 장착된 바늘 끝을 브레그마에 놓고 세 가지 좌표(AP: 전방 후방) 모두 설정합니다. ML: 중내 측측; DV: 도르살-벤탈) 0.
- 바늘끝을 람다에 놓고 AP 좌표가 0인지 확인하여 헤드 위치가 수직인지 확인하고 ML 좌표가 0인 경우 헤드가 수평으로 위치하는지 확인한다. 그렇지 않은 경우 AP 및 ML 좌표가 모두 0.1mm 이내일 때까지 스테레오탁스 스테이션에서 해당 노브를 조정합니다.
- 바늘 끝을 이동하여 두개골 절제술에 대한 해당 지점을 찾고 미세 마커를 사용하여 두개골에 자신의 위치를 표시합니다. 해마에 이식의 경우, 다음 좌표와 4 점이 있습니다 (AP: -0.68, ML: -2.0) (AP: -3.68, ML: -2.0) (AP: -2.18, ML: -0.5) 및 (AP: -2.18, ML: -3.5)11,뿐만 아니라 (AP: -4.0, ML: -2.0) 주사의 가장 카우달 포인트에 대한.
참고: 이 단계에서 사용되는 마커는 수술 전 최소 한 시간 동안 UV 조명을 사용하여 멸균되어야 합니다. 여기에 표시된 좌표는 6-8주 된 C57BL/6J 마우스용입니다. 좌표는 마우스의 다른 나이 또는 긴장 때문에 다를 수 있습니다. - 4개의 표시된 점을 기반으로 원을 그리며, 원의 소달 측에 주사 캐뉼라 영역의 윤곽선을그립니다(도 3).
- 10,000 rpm의 속도로 공압 드릴을 사용하여 두개골에 표시된 윤곽선을 따라 부드럽게 "그리기"하십시오.
- 두개골을 매우 얇은 뼈 층이 남을 때까지 드릴링하면 일반적으로 중앙에서 부드러운 터치로 흔들리기 시작합니다.
- 두개술의 중심에 멸균 1x PBS 를 넣고, 매우 얇은 팁 집게 또는 반대쪽에서 접근하는 2개의 26G 바늘로 두개골에서 뼈 플랩을 들어 올립니다.
참고 : PBS는 두개골 조각을 제거하고 두라12의가능한 출혈을 방지하는 데 도움이됩니다. - PBS를 적용한 다음 26G 무딘 바늘을 통해 부드러운 포부를 여러 번 사용하여 두라표면을 청소합니다.
- 포부 또는 안과 가위로 두라를 부드럽게 제거합니다. 피질을 제거하려면 부드러운 흡입(~-60kPa)과 해마 위의 코퍼스 캘로섬을 적용하십시오.
참고: 피질은 종종 코퍼스 캘로섬보다 더 황색이며, 코퍼스 캘로섬은 일반적으로 해마보다 희미합니다. 코퍼스 캘로섬은 일반적으로 상부에서 관찰할 때 수직 및 수평 방향으로 가는 신경 섬유에 의해 구별하기쉽다(도 3).
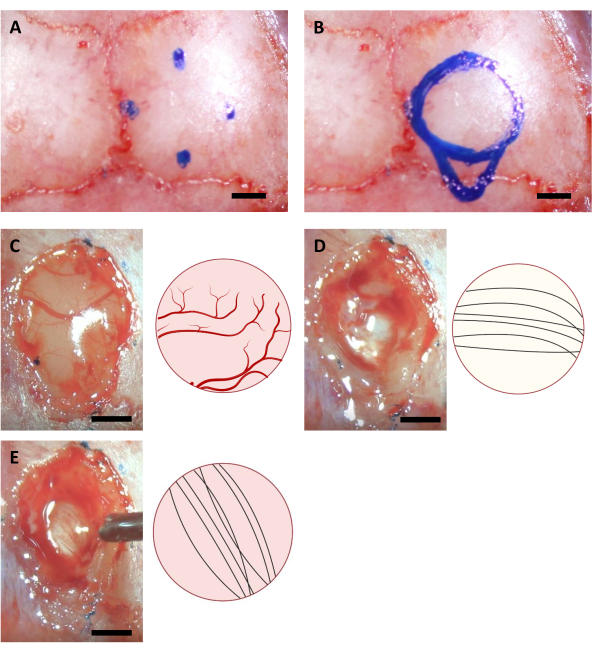
그림 3: 해마 위치 및 뇌 절제 과정의 스테레오 탁스 좌표. (A)두개골 절제술 영역의 가장자리에 대한 네 개의 좌표. (B)완전한 두개골 절제술 영역. (C-E) 수술 중 획득한 대표적인 이미지(왼쪽)와 그들의 회로도(오른쪽)는(A)피질(B)코퍼스 캘로섬,(C)피질 절제 시 보이는 해마의 다양한 색상과 방향을 나타낸다. 규모 표시줄: 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 이 시점에서 출혈은 두개 내의 뇌 조직의 가시성에 영향을 미칩니다. 1x PBS를 적용한 다음 부드러운 흡입을 하고 피질을 흡입하여 혈액을 제거합니다.
참고 : 지속적인 출혈은이 단계에서 피할 수 없으며, 어느 정도, 지속적인 출혈은 정상 혈압의 표시입니다. 피질 화상 진찰 창 이식과는 달리, 광학 창 의 밑에 혈액의 존재는 수술 후에 며칠 후에 삭제될 것이기 때문에 허용됩니다. 피질을 아블라스팅한 후 가능한 한 빨리 생성된 캐뉼라에 이미징 캐뉼라를 삽입하는 것이 최적입니다. - 두개골 절제술이 이미징 캐뉼라보다 <0.5mm 더 큰 경우 SuperBond로 임플란트를 고정하기 전에 Kwik Sil 밀봉을 추가하여 캐뉼러의 설치를 어느 정도 구출하십시오.
- 두개골 절제술이 이미징 캐뉼라보다 <0.5mm 더 작으면 두개골 의 가장자리에 남아있는 뼈가 두개골 자체보다 얇기 때문에 미세 트위저 또는 한 쌍의 안과 가위를 사용하여 두개골의 가장자리를 다듬어 외과 적 시술을 어느 정도 구출하십시오.
참고: 0.5mm 이상의 범위를 초과하는 두개골 절제술은 구조될 수 없습니다. 이러한 경우 해당 작업은 동물 프로토콜에 따라 종료 절차를 따라야 합니다.
- 임플란트를 두개골 절제술에 부드럽게 삽입합니다.
- 임플란트의 표면을 해마의 노출 표면에 최대한 가깝게 배치하기 위해 L자 형 바늘로 임플란트 위에 단단히 누릅니다. 임플란트 주변의 두개골에 PBS를 반복적으로 적용한 다음 임플란트 삽입 중에 가능한 한 혈액을 제거하는 흡입을 합니다. 그런 다음 임플란트와 두개골 사이에 곽실의 얇은 층을 적용하여 두개골 아래에 치과 시멘트가 침투하는 것을 방지합니다(그림4).
- 임플란트의 광학 창의 배치가 혈액 이나 그 아래에 다른 액체 축적을 피하기 위해 해마에 맞도록 하십시오.
참고: 중요한 점은 이미징 캐뉼라의 커버 유리가 해마에 맞서 올바르게 배치되어 있는지 확인하는 것이며, 이는 설치 및 밀봉 과정에서 캐뉼라 위에 부드러운 압력을 가할 수 있습니다. 이미징 캐뉼라의 위쪽이 두개골과 평행한지 여부는 광학 창이 해마에 대해 배치되는 한 최종 광학 액세스에 중요하지 않습니다. - CA1 영역 위의 피질의 평균 두께에 따라, 두개골 표면에 대한 이미징 캐뉼라의 상부 표면을 ~0.5mm로 유지하여 두개골에 캐뉼라의 부착을 용이하게한다(도 4).
- 임플란트의 광학 창의 배치가 혈액 이나 그 아래에 다른 액체 축적을 피하기 위해 해마에 맞도록 하십시오.
- 보통 ~1분 이하의 Kwik Sil이 경화되면 두개골 표면, Kwik-Sil 표면 및 임플란트의 상부 표면에 슈퍼 본드 C&B를 고르게 적용합니다.
- 슈퍼 본드 C&B가 경화되면, 슈퍼 본드 C&B 위에 의치 베이스 수지뿐만 아니라 수술 초기에 만들어진 절개 주위에 피부를 적용하십시오.
참고: 여러 공급업체에서 대체 유형의 시멘트를 사용할 수 있습니다. 해당 제조업체의 지침을 따릅니다. - 의치 베이스 수지가 경화 된 후, 임플란트 주위에 수지에 헤드 플레이트를 놓고 이미징 캐뉼라와 동심합니다. 헤드 플레이트 주변에 더 많은 틀니 베이스 수지를 적용하여 위치를 수정합니다. 몇 분 동안 치료하자.
- 객관적인렌즈(그림 4)를사용하여 이미징 창에 더 잘 접근할 수 있도록 캐뉼라 주변에 두꺼운 시멘트 층을 쌓지 마십시오.
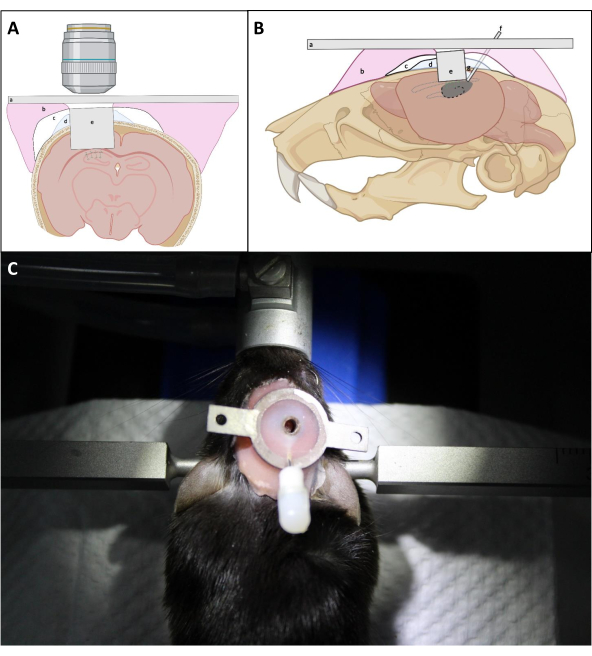
그림 4: (A) 관상 및 (B) 식경에서 창 이식의 회로도. (a)헤드 플레이트; (b)틀니 베이스 수지; (c)슈퍼본드; (d)곽실; (e)이미징 캐뉼라; (f)주사 캐뉼라; (g)납땜 주석. (C):수술 후 설치된 임플란트가 있는 마우스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 틀니 베이스 수지를 희석시켜 점도를 감소시켜 어플리케이터로 도달하기 어려운 주의 사항을 채울 수 있습니다.
- 동물 침구로 인한 오염으로부터 창문을 보호하기 위해 창문 위에 절연 고무 테이프를 부드럽게 놓습니다.
- 수술이 끝나면 염증 반응을 방지하기 위해 항염증약물을 피하로 주입한다.
- 동물을 마취에서 회복할 때까지 따뜻한 케이지에 놓습니다.
- 일반적인 행동을 관찰하여 수술 후 72 h에 대한 마우스의 상태 확인. 항염증제 와 진통제는 통증을 방출하고 염증 반응을 줄이기 위해 24 시간마다 수술 후 2-3 일 동안 피하주사됩니다.
참고: 대체 모니터링 절차, 약물 및 투여량은 수술 후 치료에 가능하며 정확한 절차에 대한 IUCAC 승인 된 동물 프로토콜을 참조하십시오. - 창 아래 혈관을 관찰하기 위해 수술 후 5-7 일 창을 확인합니다. 명확한 창의 경우, 동물은 바이러스 주입에 대한 준비가되어 있습니다.
3. 바이러스 주입
참고: 바이러스 주사는 일반적으로 수술 후 5-7 일 이내에 수행됩니다. 바이러스 주입 전에 이미징 창이 명확하고 뇌 혈관을 관찰할 수 있음을 확인해야합니다(도5). 어떤 경우에는 창을 지우는 데 최대 14-16 일이 걸릴 수 있으며 뇌 염증이 감지되지 않으면 허용됩니다.
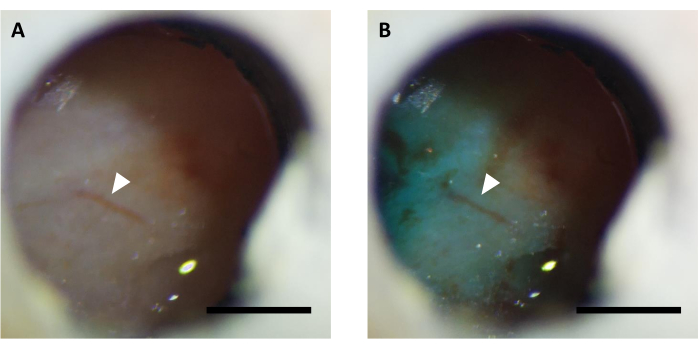
그림 5: 패스트그린 염료로 보충된 바이러스 주입 전후 광학 창(A)의 대표적인 영상. 화살표는 동일한 혈관 구조를 나타냅니다. 규모 표시줄: 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- PCR 튜브에서 1:9의 비율로 원하는 티터에 희석된 바이러스 용액에 빠른 녹색 염료 스톡 솔루션을 추가합니다.
참고: 빠른 녹색 염료가 첨가되어 주입 중에 바이러스 용액의 시각화를 용이하게 합니다. - 폴리에틸렌 튜빙과 주사기를 연결한 다음 주사기 펌프를 사용하여 미네랄 오일로 튜브를 다시 채웁니다.
- 내부 캐뉼라를 튜브의 다른 쪽 끝에 연결하고, 미네랄 오일을 몇 번 인출하여 내부 캐뉼라가 막히지 않도록 하십시오.
- 이소플루란으로 동물을 마취(유도용 4%, 유지 보수1.5~2%, 공기의 0.3-0.5 L/min 유량), 가열 패드(37°C 유지)를 통해 스테레오탁스 프레임에 머리를 고정하여 눈 연고를 적용한다.
- 바이러스 용액의 600nL을 철회하고, 더미 캐뉼라를 제거하고, 유도칸룰라에 주사 주사기에 연결된 내부 캐뉼라를 삽입하고, 총 10분 동안 50nL/min의 속도로 바이러스를 주입한다.
참고: 염료가 성공적인 바이러스 주입을 확인하기 위해 스테레오 현미경을 사용하여 창을 통해 보이는지 확인합니다(도5). - 주입 후, 내부 캐뉼라를 10분 동안 연결하여 바이러스가 창 아래에 퍼질 수 있도록 하십시오.
- 가이드 캐뉼라에서 내부 캐뉼라를 부드럽게 제거하고 더미 캐뉼라로 다시 보냅니다.
- 동물을 마취에서 회복할 때까지 따뜻한 케이지에 놓습니다.
참고: 일반적으로, 마우스는 바이러스 주사 후에 10-20 일에 화상 진찰을 위한 준비됩니다. 발현 수준과 시간은 유전자 발현을 구동하는 데 사용되는 바이러스 혈청형 및 프로모터에 의존한다.
4. 넓은 필드 현미경에서 깨어있는 마우스의 이미징.
참고: 준비된 헤드 플레이트는 이미징 임플란트의 탁월한 안정성을 제공하므로 최소한의 모션 아티팩트로 마우스를 깨우고 행동하는 세로 이미징을 허용합니다.
- 마우스를 4% 이소플루란으로 몇 분 동안 유도하고 헤드 플레이트를 헤드 포크에 고정한 다음 머리 포크를 러닝머신에 고정시하십시오.
참고 : 헤드 포크와 러닝 머신은이 연구에 사용되는 헤드 플레이트에 맞게 사용자 정의되어 있으며 해당 CAD 파일에 대한 지원 자료를 참조하십시오. 이 절차에 대 한 동물을 습관화 할 수 있기 때문에 머리 고정 하기 전에 마우스의 유도 는 선택 사항입니다. - 현미경 단계에서 러닝머신을 이동하고 광학 창을 객관적인 렌즈 아래에 배치합니다.
- 낮은 배율 목표 렌즈를 사용하여 기능성 이미징을 위한 최상의 시야(FOV)를 찾은 다음 더 높은 NA 객관적 렌즈로 전환하여 단일 세포 해상도에서 신경 활동을 기록합니다.
참고: 사출 캐뉼라가 여전히 작업 거리를 달성하기 위한 목표 렌즈의 장애물인 경우 와이어 클리퍼를 사용하여 헤드 플레이트에서 주입 캐뉼라를 차단합니다.
결과
유전적으로 인코딩된 칼슘 표시기를 사용하여 신경 활동의 생체 내 이미징. 평균적으로 생체 내 이미징은 충분한 수준의 트랜스진 발현이 달성되면 이식 후 3-4주 후에 시작됩니다. 이 때까지, 뇌 부종과 출혈은 일반적으로 완전히 해결되고, 뇌 혈관은 광학 창을 통해 쉽게 관찰 될 수있다. 여기서는 형광 광역 현미경하에서 마우스를 행동하는 등쪽 해마 CA1 영역에서 신경 활성의 반복된 기록을 수행하기 위해 기술된 제제를 활용하였다. 신경 활동을 기록하기 위해, 우리는 GCaMP6s14의것과 유사한 칼슘 감도 및 측두해상도를 나타내는 NCaMP713이라는밝은 유전적으로 인코딩된 칼슘 표시기를 사용했습니다. 해마에서 NCaMP7 지표를 표현하기 위해, 우리는 주입 캐뉼라를 사용하여 rAAV / DJ-CAG-NCaMP7 바이러스를 주입하고 14 일 후 주사에 경도 영상을 시작했습니다. 신경 활성을 기록하기 위해 10x NA 0.3 공기 목표 렌즈와 하마마츠 오르카퓨전 sCMOS 카메라를 사용하여 최대 100Hz 주파수에서 ~1.5x1.5mm FOV의 이미징을 허용했습니다. 녹색 형광은 표준 GFP 필터 세트를 사용하여 시판되는 470 nm LED에 의해 흥분되었다. 녹색 채널에서 달성된 화상 진찰의 평균 깊이는 대략 50-120 μm입니다, 지층 오리엔스와 지층 피라미드에 주로 신경 활동의 기록을 허용합니다. 근적외선 채널의 이미징 깊이는 해마8의더 깊은 층에 도달하는 최대 200 μm일 수 있습니다. FOV당 평균 기록 시간은 6-12분이었지만, NCaMP7은 매우 높은 광안정성을 특징으로 하고 검출 가능한 광독성이 관찰되지 않은 만큼 훨씬 더 긴 이미징 세션이 가능하지만(도6).
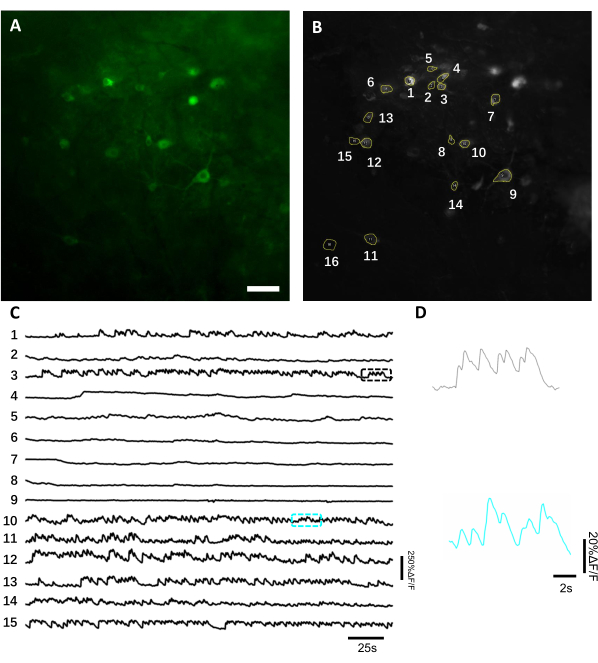
도 6: 녹색 형광유전자를 사용하여 해마 뉴런에서 뉴런 활성을 기록하여 유전적으로 인코딩된 칼슘 표시기. (A)녹색 채널에서 광장 형광 현미경으로 촬영된 선택된 FOV. (B)A에 도시된 단일 뉴런에 대응하는 15개의 ROI는 전체 레코딩의 표준 편차 투영을 이용하여 선택되었다. (C)B.(D)C. 스케일 바, 100 μm에 표시된 해당 컬러 박스에 표시된 2개의 칼슘 흔적의 대표적인 줌인 뷰(100 μm)의 대표적인 형광 단일 시험 흔적은 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
형광 흔적을 얻기 위해, 신경 소마에 대응하는 관심 영역 (ROI)은 ImageJ 소프트웨어에 의해 수동으로 분할및 분석되었다. 영상 분석 모션 보정 이전에는 획득한 데이터 세트가 이미징 임플란트의 높은 안정성으로 인해 모션 아티팩트를 나타내지 않았기 때문에 깨어 있는 동물의 일반적인 사후 기록 절차가 필요하지 않았습니다. 깨어 있는 행동 마우스에서 해마에서 뉴런 활동의 대표적인 단일 시험 광학 기록은 도 6에제시된다. 신경소마에 대응하는 15개의 ROI는 도 6B에도시된 동일한 FOV로부터 수동으로 선택되었으며, 각 ROI 내의 단일 임상시험 형광 추적은 도 6C에도시된다. 도 6D는 두 개의 서로 다른 ROI에서 형광 흔적의 두 가지 대표적인 부분을 나타낸다. 우리는 3 일 간격으로 동일한 FOV에 대한 4 연속 이미징 세션을 수행했습니다. 적어도 2 주 동안 특정 FOV에서 동일한 뉴런을 식별하고 이미지화 할 수 있었다 (더 긴 이미징 세션은이 연구를 위해 수행되지 않았다, 그러나, 동일한 준비는 마우스에서 최대 6 개월 긴 이미징 연구를 위해 사용되었습니다이전 7; 그림 7). 본 연구에서는 AAV/DJ-CAG 벡터를 사용했는데, 이는 바이러스 전달 후 21일 후에도 관심 유전자의 강한 발현을유도하였다(보충도 도 1). 지속적인 발현은 칼슘 표시기를 표현하는 새로운 뉴런의 증가형 배경과 외관으로 인해 동일한 뉴런의 장기 적인 식별을 복잡하게 합니다. 따라서, 표적 유전자 발현을 구동하기 위한 AAV 혈청형 및 프로모터의 선택은 특히 뉴런의 동일한 하위 집합의 세로 이미징이 필요한 경우 실험 설계 중에 중요한 고려 사항 중 하나가 되어야 한다. 이미징 품질은 근위 점막을 해결하고 혈관을 시각화 할 수있었습니다.
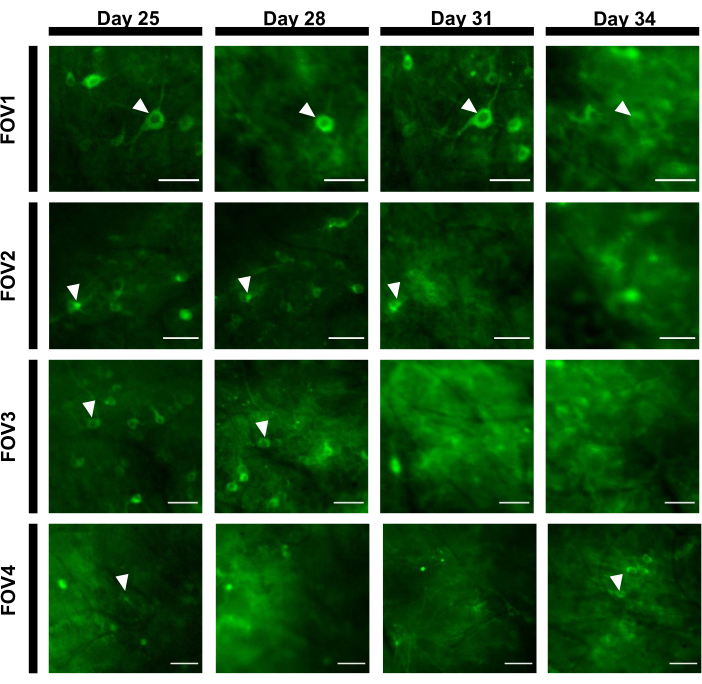
그림 7: 12일 동안 추적된 해마 영역에서 4개의 다른 FOV의 이미지 서열. 동물은 0 일에 창으로 이식되었고 7 일째에 rAAV / DJ-CAG-NCaMP7 바이러스를 주입했습니다. 애로우헤드는 FOV 내에서 추적된 뉴런을 나타냅니다. 스케일 바: 80 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
유전적으로 인코딩된 전압 센서를 사용하여 뉴런 활동의 생체 내 이미징.
이 연구에서는, 우리는 또한 동물7,8을행동하는 단세포 단면도 해상도로 전압 화상 진찰을 허용하는 SomArchon7이라는새로운 유전자 로 코딩된 전압센서를사용했습니다. SomArchon을 표현하기 위해, 우리는 주입 캐뉼라를 사용하여 rAAV / DJ-CAG-SomArchon 바이러스를 주입하고 헤드 고정 행동 마우스에 전압 이미징을 수행 며칠 후 주입. 뉴런 활성을 기록하기 위해 40x NA 0.8 객관적렌즈와 하마마츠 오르카퓨전 sCMOS 카메라를 사용하여 최대 830Hz 의 획득 속도로 150x40 μm FOV를 이미지화할 수 있었습니다. 스펙트럼의 가시 범위에서 발현의 시각화를 용이하게 하기 위해 SomArchon 구조의 일부인 GFP 단백질은 녹색 채널(470/20 nm에서 LED 여기, 방출 525/50 nm)에서 쉽게 배분하여 전압 이미징에 대한 관심 있는 세포를 찾을 수 있다. 광학 전압 레코딩은 근적외선 채널(레이저 여기 637 nm at 3.4 W/mm2,방출 665 nm 롱 패스)에서 수행되었으며 830Hz 획득 율로 4 x 4 비닝을 수행하였다. 우리는 행동 잠재력당 평균 SNR 7의 평균 SNR을 가진 깨어있는 마우스에서 해마 뉴런의 자발적인 활성을 기록하였다(그림8).
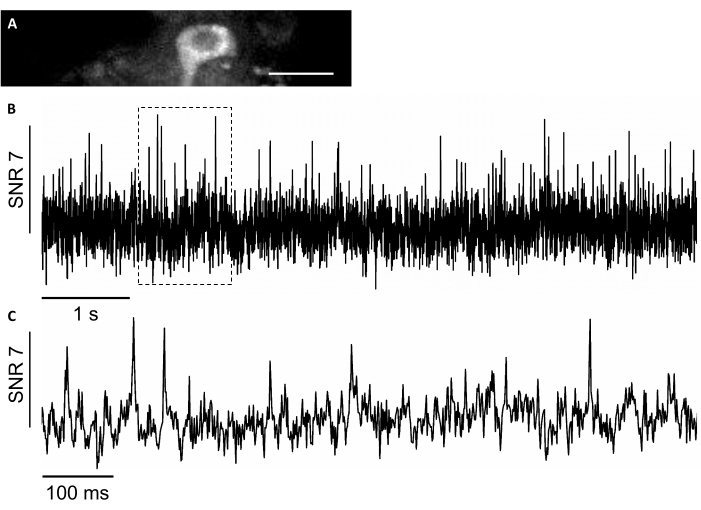
그림 8: 근적외선 형광을 유전적으로 인코딩된 전압 지표솜아콘을 사용하여 해마 뉴런내의 뉴런 활성을 기록한다. (A)근적외선 채널에서 광시야 형광 현미경하에서 이미지된 선택된 FOV. (B)A.(C)B. 스케일 바에 표시된 해당 상자에 전압 추적의 대표적인 줌인 뷰: 25 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
조직학
기능적 이미징 연구가 수행된 후, 사후 분석은 임플란트의 올바른 배치, 바이러스 발현 영역 및 이미지 뉴런에 대한 관심 있는 단백질의 국소화를 확인하는 데 사용됩니다. 바이러스 발현 및 임플란트의 배치에 대한 조직학적 검증을 위해 PFA 고정 뇌의 관상 적 부분은 형광 광시야현미경(도 9A, C)으로검사하였다. 공초점 현미경은 칼슘 표시기를 표현하는 개별 뉴런의 고해상도 이미지를 획득하는 데 사용되었으며, 전압 표시기(도9B,D). DAPI 염색은 뇌 슬라이스의 전반적인 형태를 시각화하는 데 사용되었습니다. 또한, 뇌 슬라이스는 면역히스토케를 사용하여 창 이식 및 바이러스 성 발현으로 인한 천체 글리오오스증 또는 글리오사이스를 확인할 수 있다. 우리의 이전 연구는 절차가 눈에 띄는 글리오증을 유발하지 않았다는 것을 보여 주었다7.
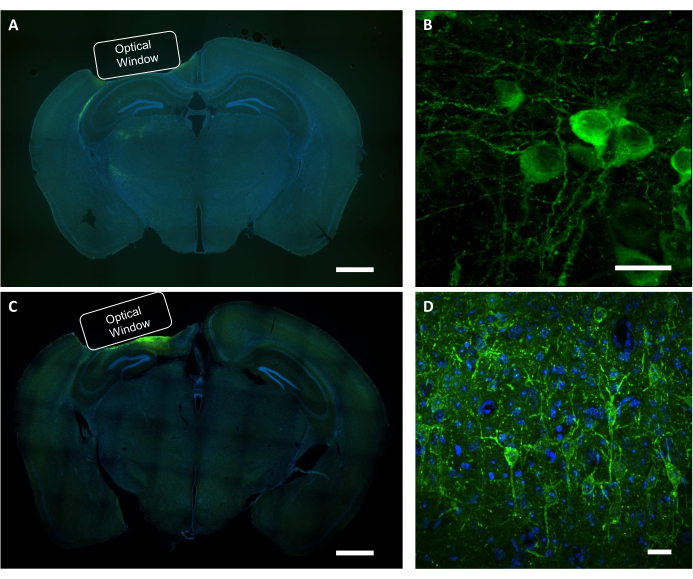
도 9: 광학 창 위치 및 바이러스 발현의 조직학적 검증. (A)NCaMP 표현 마우스로부터 광학 창의 배치를 보여주는 관상 부속절 뇌 슬라이스의 대표적인 형광 이미지. 스케일 바: 1mm.(B)NCaMP7 지표를 표현하는 뉴런의 대표적인 공초점 이미지. 스케일 바: 25 μm.(C)SomArchon 표현 마우스에서 광학 창의 배치를 보여주는 관상 단면 뇌 슬라이스의 대표적인 형광 이미지. 규모 막대: 1mm.(D)SomArchon 표시기를 표현하는 뉴런의 대표적인 공초점 이미지. 스케일 바: 25 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충도 도 1: 표현 시간과 함께 상대형광 강도의 양분석. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기서 우리는 행동 마우스에서 해마 CA1 영역의 장기 화상 진찰을 위한 방법을 기술합니다. 이 방법은 맞춤형 이미징 창의 만성 이식에 기초하여, 이는 또한 관심의 뉴런에 직접 바이러스 또는 약물의 표적 투여를 가능하게. 본 프로토콜은 네 가지 주요 부분으로 구성됩니다: i) 이미징 임플란트의 조립; ii) 이미징 임플란트 설치; iii) 이미징 임플란트를 통한 바이러스 주입; iv) 면도 마우스에서 기능성 이미징. 아래에서 는 프로토콜의 중요한 단계, 문제 해결, 수정 및 메서드의 제한 사항을 설명하고 설명합니다. 우리는 또한 방법과 잠재적 인 대체 응용 프로그램의 중요성에 대해 논의합니다.
성공적인 수술을 위해 오히려 중요한 기술된 프로토콜에 있는 몇몇 중요한 단계가 있습니다: (i) 고품질 화상 진찰 임플란트의 준비; (ii) 멸균 수술 조건; (iii) 피질의 포부; (iv) 이미징 임플란트의 정확한 배치; (v) 바이러스 주사. 1.6 단계에서 말했듯이, 과도한 납땜 주석은 더 큰 두개 통 절제술을 필요로하므로 염증의 위험을 증가시킵니다. 또한 1.11단계에서 나타난 바와 같이, 이미징 캐뉼라에 커버 글래스를 고정할 때 적정량의 접착 광학 접착제를 사용하는 것이 매우 중요하며, 불충분한 양은 뇌척수액을 이미징 캐뉼라로 누출시키고 불투명하게 만들 수 있기 때문에 매우 중요합니다. 한편, 과도한 광학 접착제는 유리 창의 투명도가 저하될 수 있다. 이미징 임플란트의 가능한 오염은 광학 창 및/또는 심한 염증 하에서 결합 조직의 활성 증식을 일으킬 수 있으며, 이는 실험의 조기 종료로 이어질 것입니다. 따라서 수술 전에 임플란트 조립 및 준비를 이미징하는 것은 수술 자체만큼이나 중요합니다.
수술 도중, 두개골 절제술의 밑에 피질의 부분은 피할 수 없는 출혈을 초래하는 온화한 포부에 의해 abD됩니다. 수술 부위의 혈액은 제거해야 하는 뇌 조직의 가시성을 크게 감소시킵니다. 이것은 조직 절제의 요구되는 깊이의 정확한 평가를 복잡하게 합니다. 조직의 다음 부분을 제거하기 위해 흡입을 적용하기 전에 매번 PBS와 수술 부위의 주의 깊은 홍조는 깊이의 더 나은 제어를 제공합니다. 뇌 조직은 항상 더 많은 흡입을 진행하기 전에 ablated 조직의 깊이를 확인하는 단계별로 작은 부분에서 제거해야합니다. 흡입의 미세한 제어는 또한 얇은 무딘 바늘로 달성 될 수있다. 우리는 26 G 바늘을 사용하는 것이 좋습니다, 그러나, 26 G 직경보다 작은 막히는 경향이있다. 더욱이, 피질, 코퍼스 캘로섬 및 해마의 색이 마우스에서 마우스로 다를 수 있기 때문에, 각 동물에게 필요한 포부의 정확한 깊이를 결정하기 위해 많은 연습이필요하다(그림 3).
이미징 임플란트의 삽입 및 고정은 해마의 등대 표면에 이미징 창의 가장 가까운 위치를 보장하기 위해 매우 정확하게 수행해야합니다. 준비된 두개골 절제술의 크기는 임플란트와 밀접하게 일치하고 상당한 저항없이 삽입을 허용해야합니다. 동시에, 적절한 밀봉을 보장하고 뇌 조직 노출을 피하기 위해 두개골과 임플란트 사이에 눈에 보이는 간격이 없어야합니다. 부드럽고 안정적인 압력은 두개골에 밀봉하는 동안 임플란트의 상단에 적용해야합니다. 임플란트 설치 중 이미징 창 아래에 혈액이 있는 것은 거의 피할 수 없습니다. 외과 적 수술이 제대로 완료되면 창은 3-7 일 후에 꺼져야하며 뇌 혈관이 명확하게 보입니다. 바이러스가 창 아래에 제대로 주입되도록하는 것도 중요합니다. 발현이 실패하면 바이러스를 여러 번 재주입할 수 있다.
어떤 경우에는 우리가 만난 주요 합병증은 이미징 창의 가시성을 감소시면 됩니다. 가난한 이미징 품질에 대 한 몇 가지 가능한 이유가 있다: i) 지속적인 염증; ii) 유리에 결합 조직의 파생; iii) 창과 해마 사이의 큰 간격. 염증은 일반적으로 수술 중 또는 제대로 살균되지 않은 이미징 임플란트에 의해 오염에 의해 발생합니다. 우리는 각 수술 전후 수술 기구를 자동화하고, 수술 직전에 수술 부위를 소독하고, 수술 중에 깨끗한 개인 보호 장비를 착용하는 것이 좋습니다. 이미징 임플란트는 조립, 살균 및 멸균 상태로 저장한 후 세척해야 합니다. 화상 진찰 임플란트의 유리에 결합 조직의 파생은 피질 절제 도중 유리의 표면에 기계적 오염 또는 과도한 외상 때문일 수 있습니다. 임플란트를 조립한 후 유리 표면이 깨끗하고 매끄럽게 유지되도록 하는 것이 중요합니다. 또한, 손상된 뇌 조직의 모든 조각은 두개골 절제술에 이미징 임플란트를 삽입하기 전에 주의 깊게 제거해야합니다. 경우에 따라 유리 창과 해마 사이의 간격으로 뇌척수액이 축적되어 이미징의 품질이 저하됩니다. 따라서 임플란트 설치 시 해마와 유리 창 사이의 좋은 접촉을 보장하는 데 모든 방법을 삽입하는 것이 중요합니다. 때로는 불투명한 이미징 창의 정확한 이유를 식별하기가 어렵습니다. 우리는 광학 창에서 조건을 드러내고 그에 상응하는 후속 수술을 조정하기 위하여 사후 분석을 능력을 발휘하는 것이 좋습니다.
이 방법은 생체 내 이미징 전과 도중 고려해야 할 몇 가지 기본 및 기술적 한계가 있습니다. 주요 한계 중 하나는 피질 절제입니다. 시각 및 감각 피질의 일부가 수술 중에 제거됩니다. 피질 절제의 영향을 정확하게 평가하기는 어렵지만, 제거된 뇌 조직이 해마에 직접 투사하지 않기 때문에, 여러 연구는 해마 의존학습 또는 기타 관련 해마기능(15,16)의눈에 띄는 손상을 입증하지 못했다. 특히 높은 NA 객관적렌즈를 사용할 때광학적 한계도 고려해야 합니다. 예를 들어, 이 연구에서는 1.9mm 의 내경을 가진 1.75mm 길이의 캐뉼라를 사용했습니다. 이 캐뉼라의 지오메트리는 NA ~0.5 이상의 공기 목표 또는 NA가 ~0.6 이상의 빛으로 표시되기 때문에 물 목표의 전체 NA를 보존하지 않습니다. 모든 뇌 이미징 임플란트에 대한 일반적인 또 다른 제한은 뇌의 일부가 노출되어 열 손실17,18을촉진한다는 것입니다. 그러나, 생리적 뇌 온도는 따뜻한 완충제의 관류에 의해 이미징 중에 쉽게 복원 될 수있다.
설명된 방법은 다른 응용 프로그램에 대해 쉽게 수정하거나 조정할 수 있습니다. 예를 들어, 준비는 striatum7의이미징을 위해 적응될 수 있다. 줄무늬가 해마보다 약간 더 깊어짐에 따라, 더 긴 이미징 캐뉼라를 이미징 임플란트 조립에 사용해야 합니다. 우리는 2.0 mm 화상 진찰 캐뉼라를 사용하는 것이 좋습니다. 두개골 절제술의 좌표는 그에 따라 조정되어야합니다 (AP : +0.8 mm, ML : -1.8 mm). 또한, 주입 캐뉼라를 통한 바이러스 주사는 제한된확산을가진 AAV 혈청형을 사용할 때 뉴런의 얇은 층에서 트랜스진의 발현을 달성할 수 있게 한다19,20. 그것은 더 깊은 층에서 초점 불소 감소 때문에 1 광자 화상 진찰에 특히 유익하고, 그 결과로, 향상한 단세포 해상도 화상 진찰. 더욱이, 주사 캐뉼라는 또한 FOV(도5B)의뉴런에 직접 약물 또는 기타 화학 물질의 투여를 위한 기능적 이미징 중에 사용될 수 있다. 전반적인 주입 캐뉼라는 이미징 임플란트에 유용한 기능을 추가하여 표적 바이러스 발현으로 인한 이미징 품질을 개선하고 FOV에서 뉴런의 약리자극을 가능하게 합니다. 사용된 헤드 플레이트는 러닝머신에서 동물을 활발하게 움직이는 경우에도 모션 아티팩트를 최소화하는 이미징 임플란트의 탁월한 안정성을 제공합니다. 헤드 플레이트는 작고 가볍기 때문에 동물에게 최소한의 불편함을 주며 설치 후 몇 달 동안 안정적으로 유지됩니다. 이미징 임플란트는 또한 다광화상영상(15,16,21)과 호환되며, 마이크로내시경(22,23)과결합될 수 있다. 유사한 이미징 임플란트는 또한 층 라디툼, 층 라쿠노스 및 덴테이트 자이러스16,24, 25,26,27을포함하여 깊은 해마 구조의 다광 화상 진찰에 사용되었다. 그러나, 주입 캐뉼라를 통해 AAV를 가진 더 깊은 해마 구조물을 표적으로 하는 것은 AAV 혈청형 및 부피19의추가 최적화를 요구할 수 있다.
우리는 기술된 프로토콜이 간단하고 적당한 1광화상 화상 진찰 설정을 사용하여 마우스를 행동하는 마우스의 해마에 있는 높은 현면 적 해상도를 가진 신경 활동을 조사하는 것을 목표로 하는 연구를 촉진할 것이라는 점을 믿습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
웨스트레이크 대학의 분자 생물 공학 그룹의 모든 구성원에게 모든 도움과 유용한 토론을 감사드립니다. 웨스트레이크대학의 리진제와 지민지아에게도 수술 촬영에 도움을 주신 것에 대해 감사드립니다.
이 작품은 웨스트 레이크 대학, 2020 BBRF 젊은 조사관 그랜트, 중국 국립 자연 과학 재단이 K.D.P.에 모든 32050410298 보조금의 기초 기금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Cover glass | Deckgläser | 72296-03 | |
| Denture Base Resin | ShangHai New Centery Dentel Material | N/A | Type I, self-solidifying |
| Dummy Cannula | RWD Life Science Co.,LTD | 62102 | OD 0.30mm |
| Guide Cannula | RWD Life Science Co.,LTD | 62003 | 26G |
| Head Fork | N/A | N/A | Custom made |
| Head Plate | N/A | N/A | Custom made |
| Imaging Cannula | N/A | N/A | Custom Made; OD 3mm, ID 2.7mm, Height 1.8mm, #108 stainless steel |
| Internal Cannula | RWD Life Science Co.,LTD | 62203 | 0.30*0.14 (OD*ID, mm) |
| Kwik Sil | World Precision Instruments | KWIK-SIL | |
| SuperBond C&B | SUN MEDICAL | N/A | SuperBond C&B kit |
| Treadmill Kit | N/A | N/A | Custom made |
| UV-cured Adhesive | NORLAND PRODUCTS | NOA 60 |
참고문헌
- Leutgeb, S., et al. Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science. 309 (5734), 619-623 (2005).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Polanco, J. C., et al. Amyloid-β and tau complexity - towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2018).
- Henneman, W. J. P., et al. Hippocampal atrophy rates in Alzheimer disease. Added value over whole brain volume measures. 72 (11), 999-1007 (2009).
- Camicioli, R., et al. Parkinson's disease is associated with hippocampal atrophy. Mov Disord. 18 (7), 784-790 (2003).
- Piatkevich, K. D., Murdock, M. H., Subach, F. V. Advances in Engineering and Application of Optogenetic Indicators for Neuroscience. Applied Sciences. 9 (3), 562 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Fan, L. Z., et al. All-Optical Electrophysiology Reveals the Role of Lateral Inhibition in Sensory Processing in Cortical Layer 1. Cell. 180 (3), 521-535 (2020).
- Shemesh, O. A., et al. Precision Calcium Imaging of Dense Neural Populations via a Cell-Body-Targeted Calcium Indicator. Neuron. 107 (3), 470-486 (2020).
- Villa, K. L., et al. Inhibitory Synapses Are Repeatedly Assembled and Removed at Persistent Sites In Vivo. Neuron. 89 (4), 756-769 (2016).
- Franklin, K. B. J., Paxinos, G. . Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , (2013).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Subach, O. M., et al. Novel Genetically Encoded Bright Positive Calcium Indicator NCaMP7 Based on the mNeonGreen Fluorescent Protein. International Journal of Molecular Sciences. 21 (5), 1644 (2020).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Kalmbach, A. S., Waters, J. Brain surface temperature under a craniotomy. Journal of neurophysiology. 108 (11), 3138-3146 (2012).
- Roche, M., et al. In vivo imaging with a water immersion objective affects brain temperature, blood flow and oxygenation. eLife. 8, 47324 (2019).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neuroscience Research. 93, 144-157 (2015).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H., Manfredssonn, F. P. . Gene Therapy for Neurological Disorders: Methods and Protocols. , 133-149 (2016).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), (2016).
- Yashiro, H., Nakahara, I., Funabiki, K., Riquimaroux, H. Micro-endoscopic system for functional assessment of neural circuits in deep brain regions: Simultaneous optical and electrical recordings of auditory responses in mouse's inferior colliculus. Neuroscience Research. 119, 61-69 (2017).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution In Vivo Imaging of Hippocampal Dendrites and Spines. The Journal of Neuroscience. 24 (13), 3147 (2004).
- Busche, M. A., et al. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proceedings of the National Academy of Sciences. 109 (22), 8740 (2012).
- Attardo, A., et al. Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Castello-Waldow, T. P., et al. Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. PLOS Biology. 18 (11), 3000928 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유