Method Article
Procedura craniotomia per la visualizzazione delle attività neuronali nell'ippocampo dei topi che si comportano
In questo articolo
Riepilogo
Questo articolo dimostra la preparazione di una finestra di imaging su misura integrata con cannula per infusione e il suo impianto sulla regione CA1 dell'ippocampo nei topi.
Abstract
L'imaging delle attività neuronali a risoluzione a singola cellula negli animali che si comportano svegli è un approccio molto potente per lo studio delle funzioni del circuito neurale nelle neuroscienze dei sistemi. Tuttavia, l'elevata assorbanza e dispersione della luce nei tessuti dei mammiferi limita l'imaging intravitale principalmente alle regioni cerebrali superficiali, lasciando le aree cerebrali profonde, come l'ippocampo, fuori dalla portata della microscopia ottica. In questo video, mostriamo la preparazione e l'impianto della finestra di imaging su misura per consentire l'imaging cronico in vivo della regione CA1 ippocampale dorsale nei topi che si comportano a testa fissa. La finestra su misura è integrata da una cannula per infusione che consente la consegna mirata di vettori virali e farmaci all'area di imaging. Combinando questa preparazione con l'imaging a campo largo, abbiamo eseguito una registrazione a lungo termine dell'attività neuronale utilizzando un indicatore di calcio fluorescente da grandi sottoinsiemi di neuroni nel comportarsi con topi per diverse settimane. Abbiamo anche dimostrato l'applicabilità di questa preparazione per l'imaging a tensione con risoluzione a picco singolo. Gli indicatori geneticamente codificati ad alte prestazioni dell'attività neuronale e le telecamere CMOS scientifiche hanno permesso la visualizzazione ricorrente dei dettagli morfologici subcellulari dei singoli neuroni ad alta risoluzione temporale. Discutiamo anche dei vantaggi e delle potenziali limitazioni del metodo descritto e della sua compatibilità con altre tecniche di imaging.
Introduzione
L'ippocampo è una regione cerebrale chiave responsabile dell'apprendimento edella memoria 1, nonché della navigazionespaziale 2. L'atrofia ippocampale è associata a disturbi neurologici e psichiatrici che coinvolgono la perdita di memoria e ildeclino cognitivo 3,4,5. Nei topi, l'ippocampo è un modello molto consolidato per studiare l'apprendimento spaziale, contestuale e associativo e la formazione della memoria sui livelli cellulare edi rete 4,5. Gli studi meccanicistici sull'apprendimento e la memoria richiedono l'interrogatorio longitudinale della struttura neuronale e della funzione nel comportarsi con i topi. L'imaging a fluorescenza in combinazione con sondegeneticamente codificate 6 fornisce capacità senza precedenti per registrare la dinamica della tensione della membrana7,8, transitori di calcio9e cambiamenti strutturali10 su grandi sottoinsiemi di neuroni intravitally. Tuttavia, l'accesso ottico all'ippocampo nei topi è ostruito dalla corteccia, che può raggiungere oltre 1 mm di spessore. Qui, abbiamo descritto una procedura per assemblare un dispositivo di imaging su misura e il suo impianto cronico nella testa del topo per l'accesso ottico a lungo termine alla sottoregione CA1 dell'ippocampo dorsale nei topi che si comportano. La cannula per infusione integrata nell'impianto di imaging consente la somministrazione di virus o farmaci direttamente sui neuroni nel campo visivo. La preparazione descritta in combinazione con la microscopia a campo largo consente l'imaging ricorrente dei grandi sottoinsiemi di neuroni nel comportarsi con i topi per lunghi periodi di tempo. Abbiamo utilizzato questa preparazione per esprimere indicatori geneticamente codificati di calcio e tensione nella regione ippocampale CA1 attraverso l'iniezione mirata di virus adeno-associato ricombinante (rAAV) per registrazioni di attività neuronali a risoluzione a singola cellula. Abbiamo anche eseguito l'imaging longitudinale del calcio dei corrispondenti sottoinsiemi neuronali ad alta risoluzione spaziotemporale nel comportamento degli animali. Inoltre, questa preparazione è compatibile con la microscopia multifotonica e la microscopia, espandendo così ulteriormente la cassetta degli attrezzi delle tecniche di imaging per studiare le reti neuronali a livello cellulare e subcellulare nel comportamento dei topi. Sono stati descritti i passaggi critici e la risoluzione dei problemi del protocollo. Abbiamo anche discusso delle possibili insidie e limitazioni del metodo.
Protocollo
Tutti i metodi qui descritti sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) della Westlake University.
1. Assemblaggio implantare
NOTA: L'assemblaggio dell'impianto di imaging è tecnicamente semplice e richiede solo articoli disponibili in commercio(Figura 1, vedi anche Tabella dei materiali). Le piastre di testa possono essere prodotte presso l'officina locale utilizzando piastre in acciaio inossidabile o titanio. Si consiglia di preparare uno stock di impianti completamente assemblati prima di iniziare gli interventi chirurgici. Dopo aver fatto esperimenti in vivo, gli impianti possono essere recuperati e riutilizzati più volte. In alcuni casi, può richiedere solo il riasscritto della cannula per infusione saldando o sostituendo il vetro di copertura.
- Preparare tutti e sei i componenti hardware chiave per l'assemblaggio e l'installazione di impianti di imaging (Figura 1).
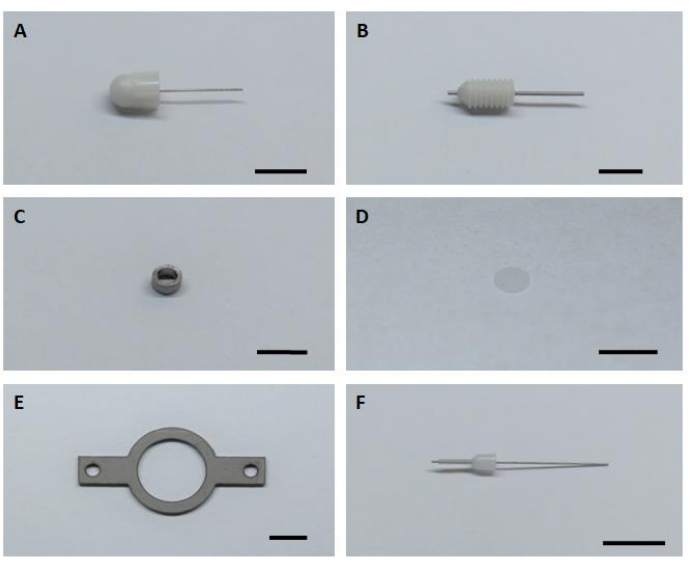
Figura 1: Sei componenti hardware chiave per l'assemblaggio e l'installazione dell'impianto di imaging. (A) Cannula fittizia. (B)Guida cannula. (C) Cannula di imaging. (D)Vetro di copertura in vetro. (E)Piastra frontale. (F) Cannula interna. Barra di scala: 5 mm. Clicca qui per visualizzare una versione più grande di questa figura.
- Accendere la saldatrice e riscaldarla fino alla temperatura richiesta.
NOTA: La temperatura dipende dallo stagno di saldatura utilizzato. - Lucidare la superficie laterale della cannula di imaging utilizzando carta vetrata fine per rimuovere lo strato di ossidazione e quindi facilitare una saldatura più forte.
- Regolare la posizione della cannula di imaging e della cannula di iniezione (cannula guida con cannula fittizia inserita) utilizzando le mani d'aiuto(Figura 2A,B).
- Utilizzando una siringa con un ago, applicare una piccola quantità di flusso appropriato sul punto di connessione tra l'imaging e l'iniezione di cannule per 5 secondi, quindi rimuovere la goccia.
NOTA: Per questa preparazione, abbiamo utilizzato un flusso disponibile in commercio che è specificato dal produttore per essere per la saldatura di parti in acciaio inossidabile in quanto le cannule per immagini e infusione sono fatte di acciaio inossidabile. Nel caso di altri materiali utilizzati per la produzione di cannule, l'utente finale deve selezionare il flusso in grado di saldare il materiale selezionato. - Sciogliere lo stagno di saldatura e applicarlo al punto di connessione trattato con flusso(figura 2).
NOTA: Evitare l'eccesso di stagno di saldatura, in quanto richiederà craniotomia più grande non necessaria durante l'intervento chirurgico.
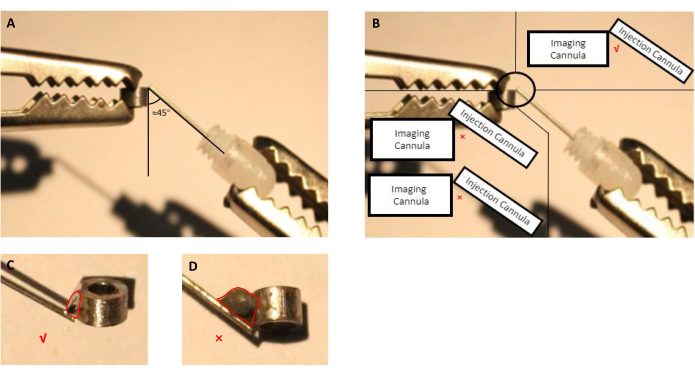
Figura 2: Schema di assemblaggio della cannula di iniezione, costituita da cannula guida con cannula fittizia inserita, con la cannula di imaging. (A) L'angolo tra la cannula di iniezione e la cannula di imaging deve essere prossimamente di 45 gradi. (B) La punta della cannula di iniezione deve essere proprio sul bordo della cannula di imaging. (C) Una dimensione appropriata dello stagno di saldatura utilizzato per saldare le cannule di imaging e iniezione (la linea rossa indica il contorno della goccia di stagno). (D) Dimensioni inadeguate della latta di saldatura che devono essere evitate durante la preparazione dell'impianto (la linea rossa indica il contorno della goccia di stagno). Clicca qui per visualizzare una versione più grande di questa figura.
- Aspetta che la lattina di saldatura si raffredda. Di solito, ci vogliono diversi secondi.
- Verificare che la cannula di iniezione non sia bloccata inserendo la cannula fittizia da entrambe le direzioni.
- Applicare adesivo ottico polimerizzazione UV sul lato inferiore della cannula di imaging utilizzando uno stuzzicadenti o un ago da siringa da 26 G.
- Utilizzare una pinzetta fine per posizionare con cura un vetro di copertura della dimensione corrispondente alla cannula di imaging.
NOTA: Il posizionamento del vetro deve essere effettuato con precisione sulla cannula di imaging senza spostare troppo il vetro una volta toccato l'adesivo ottico. Altrimenti, il vetro si sporca, riducendo così la qualità dell'imaging. - Polimerizzare l'adesivo per almeno un'ora con un'illuminazione UV a 350-400 nm da una lampada UV portatile standard.
NOTA: L'adesivo usato deve essere otticamente trasparente. In caso contrario, diminuirà la qualità della finestra di imaging.
ATTENZIONE: Evitare l'esposizione della pelle e degli occhi indossando occhiali, guanti e un camice da laboratorio che proteggono i raggi UV. - Lavare la cannula in etanolo al 70%, asciugare all'aria e conservare in un contenitore sterile fino all'intervento chirurgico.
NOTA: È molto importante mantenere il vetro di copertura il più pulito e intatto possibile. L'adesivo ottico usato è chimicamente stabile nel 70% di etanolo.
2. Impianto di finestre
- Fasi di preparazione prima dell'intervento chirurgico
- Sterilizzare tutti gli strumenti chirurgici in autoclave.
- Preparare 1x PBS e 70% di etanolo in due piastre di Petri separate.
- Facoltativamente: disinfettare l'area chirurgica utilizzando la luce UV per almeno 20 minuti prima di iniziare la procedura chirurgica.
NOTA: Operare nelle condizioni più sterili possibili si tradurrà in finestre cranici coperte di vetro di successo e di lunga durata (fino a 6 mesi). La contaminazione può comportare una ridotta trasparenza delle finestre o una grave infiammazione nella maggior parte dei casi.
- Procedura chirurgica
- Sterilizzare l'area chirurgica con il 70% di etanolo subito prima dell'intervento chirurgico.
- Pesare l'animale e somministrare una dose pre-chirurgica di analgesico per via sottocutanea secondo il protocollo animale approvato dalla IACUC.
- Anestetizzare un topo con isoflurane (4% per l'induzione, 1,5-2% per la manutenzione, 0,3-0,5 L/min di portata dell'aria). Utilizzare una tecnica di avvicinamento delle dita dei clic e delle dita dei dita dei dita per garantire che l'animale sia completamente sedato. Osservare i segni vitali dell'animale, come la respirazione, spo2e la frequenza cardiaca per tutta la durata della procedura.
- Utilizzare un trimmer o una crema depilatoria per rimuovere la pelliccia dalla parte posteriore del collo fino agli occhi.
- Posizionare il mouse in un telaio stereotassico sopra un tappetino riscaldante chirurgico (mantenendo 37 °C). Fissare la testa con le barre auricolari. Spingere leggermente la testa in tutte le direzioni per assicurarsi che la testa sia fissata saldamente.
- Applicare unguento per gli occhi per evitare che gli occhi dell'animale si asciughino durante l'intervento chirurgico.
- Sterilizzare il sito chirurgico con betadina seguita dal 70% di etanolo tre volte prima di fare un'incisione.
- Rimuovere la pelle sopra la parte superiore del cranio, iniziando con un taglio orizzontale lungo tutta la base della testa, seguito da due tagli in direzione rostrale, quasi raggiungendo le palpebre, quindi due tagli obliqui che convergono alla linea mediana.
- Con due tamponi di cotone sterili, ritrarre il tessuto di collegamento, così come la muscolatura della parte posteriore del collo, ai bordi del cranio.
NOTA: Cerca di evitare di danneggiare i vasi sanguigni (specialmente quelli nascosti nel muscolo) durante la manipolazione. - Applicare una goccia di soluzione di lidocaina (~0,1 mL) sulla superficie del periostio per 2 minuti per evitare dolori eccessivi. Opzionalmente per ridurre il cervello dal gonfiore dopo aver rimosso il cranio, 0,1 mL di 1% di desametasone possono essere iniettati per via sottocutanea.
- Raschiare delicatamente l'intera area esposta del cranio con un bisturi per creare una superficie asciutta e ruvida che consenta alla colla e al cemento dentale di aderire meglio e quindi con conseguente impianto cronico.
- Posizionare la punta dell'ago montato sulla stazione stereotassica sul bregma, impostare tutte e tre le coordinate (AP: Anteriore-Posteriore; ML: Mediale-Laterale; DV: Dorsal-Ventrale) come 0.
- Posizionare la punta dell'ago sulla lambda e vedere se la coordinata AP è 0 per confermare che la posizione della testa è verticale, così come se la coordinata ML è 0 per confermare che la testa è posizionata orizzontalmente. In caso meno, regolare le manopole corrispondenti sulla stazione stereotassica, fino a quando le coordinate AP e ML sono entrambe entro 0,1 mm.
- Spostare la punta dell'ago per trovare i punti corrispondenti per la craniotomia e contrassegnare le loro posizioni sul cranio usando un pennarello fine. Nel caso dell'impianto per ippocampo, ci sono 4 punti con le seguenti coordinate (AP: -0,68, ML: -2,0) (AP: -3,68, ML: -2.0) (AP: -2.18, ML: -0.5) e (AP: -2.18, ML: -3.5)11, così come (AP: -4.0, ML: -2.0) per il punto più caudale della cannula di iniezione.
NOTA: Il marcatore utilizzato in questo passaggio deve essere sterilizzato utilizzando l'illuminazione UV per almeno un'ora prima dell'intervento chirurgico. Le coordinate mostrate qui sono per topi C57BL /6J di 6-8 settimane. Le coordinate possono differire a causa di diverse età o ceppi di topi. - Disegnare un cerchio basato su quattro punti contrassegnati, nonché il contorno dell'area della cannula di iniezione sul lato caudale del cerchio (Figura 3).
- Utilizzare un trapano pneumatico alla velocità di 10.000 giri/min per "disegnare" delicatamente lungo il contorno segnato sul cranio.
- Perforare il cranio fino a quando non viene lasciato uno strato molto sottile di osso, che di solito inizia a muoversi sotto un tocco delicato al centro.
- Applicare una goccia di PBS sterile 1x al centro della craniotomia, sollevare il lembo osseo dal cranio con pinza di punta molto sottile o due aghi da 26 G che si avvicinano da lati opposti.
NOTA: Il PBS aiuterà a rimuovere il pezzo di cranio e prevenire possibili sanguinamenti della dura12. - Applicare PBS, seguito da una delicata aspirazione attraverso un ago smussato 26G più volte per pulire la superficie della dura.
- Rimuovere delicatamente la dura, per aspirazione o per forbici oftalmiche. Applicare un'aspirazione delicata (~-60kPa) per ablato la corteccia, così come il corpo calloso sopra l'ippocampo.
NOTA: La corteccia è spesso più gialla del corpo calloso, e il corpo calloso è solitamente più bianco dell'ippocampo. Il corpo calloso è solitamente facile da distinguere per le fibre neuronali che vanno in direzione verticale e orizzontale quando osservate dall'alto (Figura 3).
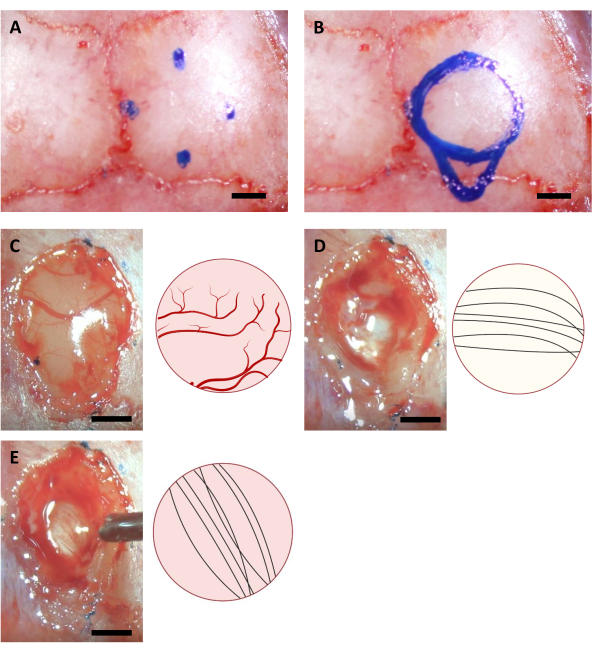
Figura 3: Coordinate stereotassiche della posizione dell'ippocampo e processo di ablazione cerebrale. (A) Quattro coordinate per i bordi dell'area della craniotomia. (B)Superficie craniotomica completa. (C-E) Immagini rappresentative acquisite durante l'intervento chirurgico (a sinistra) e il loro diagramma schematico(adestra) che indica i diversi colori e direzioni delle fibre neurali di ( A ) Cortex (B) Corpus Callosum e (C) Hippocampus visibili durante l'ablazione della corteccia. Barra di scala: 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
- Il sanguinamento a questo punto influenzerà la visibilità del tessuto cerebrale nella craniotomia. Applicare 1x PBS, seguito da una leggera aspirazione, aspirando la corteccia per sbarazzarsi del sangue.
NOTA: Il sanguinamento continuo è inevitabile durante questa fase e, in una certa misura, il sanguinamento continuo è un segno di normale pressione sanguigna. A differenza dell'impianto della finestra di imaging della corteccia, la presenza di sangue sotto la finestra ottica è accettabile poiché verrà cancellata diversi giorni dopo l'intervento chirurgico. L'inserimento della cannula di imaging nella cavità creata il prima possibile dopo aver blato la corteccia è ottimale. - Se la craniotomia è più grande di <0,5 mm rispetto alla cannula di imaging, salvare l'installazione della cannula in una certa misura utilizzando la sigillatura extra Kwik Sil prima di fissare l'impianto con SuperBond.
- Se la craniotomia è più piccola di <0,5 mm rispetto alla cannula di imaging, salvare la procedura chirurgica in una certa misura tagliando il bordo della craniotomia usando una pinzetta fine o un paio di forbici oftalmiche poiché l'osso rimanente sul bordo della craniotomia è più sottile del cranio stesso a seguito della perforazione.
NOTA: Le craniotomie che superano le gamme superiori a 0,5 mm non possono essere salvate. Le azioni corrispondenti in tali casi dovrebbero seguire la procedura di terminazione secondo il protocollo sugli animali.
- Inserire delicatamente l'impianto nella craniotomia.
- Premere saldamente sopra l'impianto con l'ago a forma di L per posizionare la finestra ottica dell'impianto il più vicino possibile alla superficie esposta dell'ippocampo. Applicare ripetutamente PBS sul cranio intorno all'impianto seguito da aspirazione per rimuovere il sangue il più possibile durante l'inserimento dell'impianto. Quindi applicare un sottile strato di Kwik Sil tra l'impianto e il cranio per evitare che il cemento dentale penei sotto il cranio (Figura 4).
- Assicurarsi che il posizionamento della finestra ottica dell'impianto sia proprio contro l'ippocampo per evitare l'accumulo di sangue o altri liquidi sotto.
NOTA: Il punto critico è assicurarsi che il vetro di copertura della cannula di imaging sia posizionato proprio contro l'ippocampo, che potrebbe richiedere una leggera pressione sulla parte superiore della cannula durante il processo di installazione e sigillatura. Se il lato superiore della cannula di imaging è parallelo al cranio non è fondamentale per l'accesso ottico finale purché la finestra ottica sia posizionata contro l'ippocampo. - In base allo spessore medio della corteccia sopra l'area CA1, mantenere la superficie superiore della cannula di imaging sopra la superficie del cranio di ~ 0,5 mm per facilitare l'attacco della cannula al cranio (Figura 4).
- Assicurarsi che il posizionamento della finestra ottica dell'impianto sia proprio contro l'ippocampo per evitare l'accumulo di sangue o altri liquidi sotto.
- Una volta che il Kwik Sil è guarito, che di solito impiega non più di ~ 1 minuto, applicare Super-Bond C&B uniformemente sulla superficie del cranio, sulla superficie di Kwik-Sil e sulla superficie superiore dell'impianto.
- Una volta stagionato il C&B Super-Bond, applicare la resina di base della protesi sopra il C&B Super-Bond, così come la pelle intorno all'incisione effettuata all'inizio dell'intervento chirurgico.
NOTA: Tipi alternativi di cemento sono disponibili da più fornitori. Seguire le istruzioni del produttore corrispondente. - Dopo aver polimerizzata la resina di base della protesi, posizionare la piastra della testa sulla resina intorno all'impianto e renderla concentrica con la cannula di imaging. Applicare più resina di base della protesi intorno e sopra la piastra della testa per fissarne la posizione. Lascialo curare per diversi minuti.
- Evitare di costruire uno spesso strato di cemento intorno alla cannula per garantire un migliore accesso alla finestra di imaging con l'obiettivo (Figura 4).
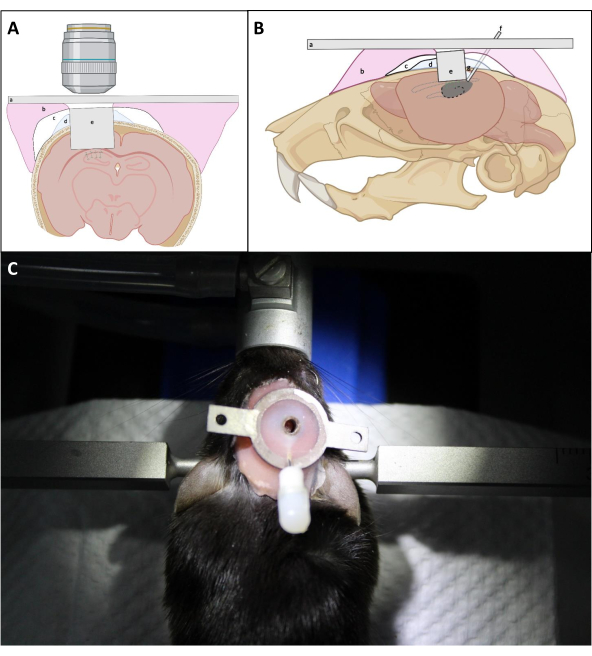
Figura 4: Diagramma schematico dell'impianto di finestre in vista coronale (A) e (B) sagittale. (a) Piastra frontale; bresinadi base per protesi; e)Superbond; (d)Kwik-Sil; (e) Cannula per immagini; fcannula per iniezione; gstagnodi saldatura. (C): Topo con l'impianto installato dopo l'intervento chirurgico. Clicca qui per visualizzare una versione più grande di questa figura.
- Diluire la resina di base della protesi per diminuirne la viscosità, permettendogli così di riempire gli avvertimenti difficili da raggiungere con un applicatore.
- Posizionare delicatamente un nastro di gomma isolato sopra la finestra per proteggere la finestra da possibili contaminazioni dalla biancheria da letto degli animali.
- Al termine dell'intervento chirurgico, iniettare sottocutaneamente un farmaco antinfiammatorio per prevenire una risposta infiammatoria.
- Mettere l'animale in una gabbia calda fino a quando non si riprende dall'anestesia.
- Controllare lo stato di salute del mouse per 72 ore dopo l'intervento chirurgico osservando il comportamento generale. Il farmaco antinfiammatorio e l'analgesico vengono iniettati per via sottocutanea per due-tre giorni dopo l'intervento chirurgico ogni 24 ore per rilasciare dolore e ridurre la risposta infiammatoria.
NOTA: Sono possibili procedure di monitoraggio alternative, farmaci e dosaggi per la cura postoperatoria, fare riferimento al protocollo animale approvato dall'IUCAC per la procedura esatta. - Controllare la finestra 5-7 giorni dopo l'intervento chirurgico per osservare la vascucolatura sotto la finestra. Nel caso di una finestra chiara, l'animale è pronto per l'iniezione di virus.
3. Iniezione di virus
NOTA: L'iniezione di virus viene solitamente eseguita in 5-7 giorni dopo l'intervento chirurgico. Prima dell'iniezione di virus, va confermato che la finestra di imaging è chiara ed è possibile osservare la vascucolatura cerebrale (Figura 5). In alcuni casi, potrebbero essere necessario fino a 14-16 giorni per liberare la finestra, il che è accettabile anche se non viene rilevata alcuna infiammazione cerebrale.
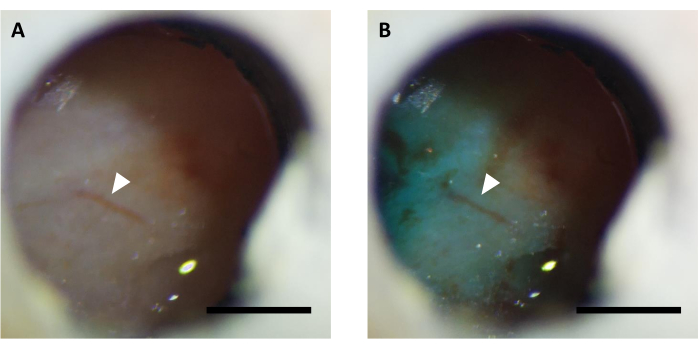
Figura 5: Immagine rappresentativa della finestra ottica (A) prima e (B) dopo iniezione di virus integrata con colorante FastGreen. Freccia indica la stessa struttura vascucolare. Barra di scala: 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
- Aggiungere la soluzione di materiale colorante verde veloce alla soluzione virale, diluita nel titolo desiderato, nel rapporto di 1:9 in un tubo PCR.
NOTA: Viene aggiunto colorante verde veloce per facilitare la visualizzazione della soluzione virale durante l'iniezione. - Collegare il tubo di polietilene con la siringa, quindi riempire il tubo con olio minerale utilizzando una pompa per siringhe.
- Collegare la cannula interna all'altra estremità del tubo, infondere e ritirare l'olio minerale alcune volte per assicurarsi che la cannula interna non sia ostruta.
- Anestetizzare l'animale con isoflurane (4% per l'induzione, 1,5-2% per la manutenzione, 0,3-0,5 L/min di portata dell'aria), fissare la testa in un telaio stereotassico su un pad riscaldante (mantenendo 37 °C), applicare un unguento per gli occhi.
- Prelevare 600 nL della soluzione virale, rimuovere la cannula fittizia e inserire la cannula interna collegata alla siringa di iniezione nella cannula guida, infondere il virus alla velocità di 50 nL / min per 10 minuti in totale.
NOTA: Verificare se il colorante è visibile attraverso la finestra utilizzando uno stereomicroscopio per confermare l'iniezione di virus riuscita (Figura 5). - Dopo l'iniezione, mantenere la cannula interna collegata per 10 minuti per consentire al virus di diffondersi sotto la finestra.
- Rimuovere delicatamente la cannula interna dalla cannula guida e riacquisirla con una cannula fittizia.
- Mettere l'animale in una gabbia calda fino a quando non si riprende dall'anestesia.
NOTA: In genere, i topi sono pronti per l'imaging in 10-20 giorni dopo l'iniezione virale. Il livello di espressione e il tempo dipendono dal sierotipo del virus e dal promotore utilizzato per guidare l'espressione genica.
4. Imaging di topi svegli al microscopio a campo largo.
NOTA: La piastra della testa preparata fornisce una straordinaria stabilità dell'impianto di imaging e consente quindi l'imaging longitudinale in topi svegli e che si comportano con artefatti di movimento minimi.
- Indurre il mouse con isoflurane al 4% per alcuni minuti, fissare la piastra della testa alla forcella della testa e quindi fissare la forcella della testa al tapis roulant.
NOTA: La forcella della testa e il tapis roulant sono personalizzati per la piastra frontale utilizzata in questo studio, si prega di vedere Materiali di supporto per i file cad corrispondenti. L'induzione del topo prima della fissazione della testa è facoltativa in quanto è possibile abituare l'animale per questa procedura. - Spostare il tapis roulant al microscopio e posizionare la finestra ottica sotto l'obiettivo.
- Utilizzare una lente obiettiva a basso ingrandimento per trovare il miglior campo visivo (FOV) per l'imaging funzionale, quindi passare a una lente obiettivo NA più alta per registrare le attività neuronali a risoluzione a singola cella.
NOTA: Se la cannula di iniezione è ancora un ostacolo per l'obiettivo di raggiungere la sua distanza di lavoro, utilizzare un clipper di filo per tagliare la cannula di iniezione dalla piastra della testa.
Risultati
Imaging in vivo dell'attività neuronale utilizzando un indicatore di calcio geneticamente codificato. In media, l'imaging in vivo inizia 3-4 settimane dopo l'impianto se si ottiene un livello sufficiente di espressione transgena. A questo punto, l'edema cerebrale e l'emorragia sono solitamente completamente risolti e la vascucolatura cerebrale può essere facilmente osservata attraverso la finestra ottica. Qui abbiamo utilizzato la preparazione descritta per eseguire le registrazioni ripetute dell'attività neuronale nella regione dorsale ipcampale CA1 nel comportarsi con topi al microscopio a campo largo a fluorescenza. Per registrare l'attività neuronale, abbiamo usato un indicatore di calcio geneticamente codificato luminoso, chiamato NCaMP713, che mostra una sensibilità al calcio e una risoluzione temporale simili a quella di GCaMP6s14. Per esprimere l'indicatore NCaMP7 nell'ippocampo, abbiamo iniettato il virus rAAV/DJ-CAG-NCaMP7 utilizzando una cannula per infusione e iniziato l'imaging a longitudine a 14 giorni dopo l'iniezione. Per registrare l'attività neuronale, abbiamo usato un obiettivo d'aria NA 0.3 10x e una fotocamera sCMOS Hamamatsu OrcaFusion che ha permesso l'imaging a ~ 1,5x1,5 mm FOV a una frequenza fino a 100 Hz. La fluorescenza verde era eccitata da un LED a 470 nm disponibile in commercio utilizzando un set di filtri GFP standard. La profondità media dell'imaging raggiunta nel canale verde è di circa 50-120 μm, che consente la registrazione dell'attività neuronale principalmente negli oriens dello strato e nello strato pyramidale. La profondità di imaging nei canali del vicino infrarosso può arrivare fino a 200 μm raggiungendo gli strati più profondi dell'ippocampo8. Il tempo medio di registrazione per FOV è stato di 6-12 minuti, anche se sono possibili sessioni di imaging molto più lunghe in quanto NCaMP7 è caratterizzato da una fototabilità estremamente elevata e non è stata osservata alcuna fototossicità rilevabile(Figura 6).
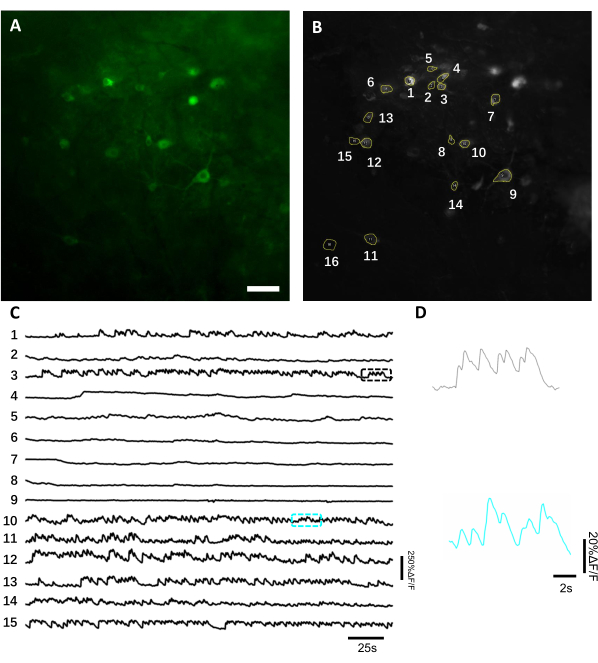
Figura 6: Registrazione dell'attività neuronale nei neuroni ippocampali utilizzando un indicatore di calcio geneticamente codificato a fluorescenza verde. (A) Un FOV selezionato registrato sotto un microscopio a fluorescenza a campo largo in canale verde. (B) I 15 ROM corrispondenti ai singoli neuroni mostrati in A e selezionati utilizzando la proiezione di deviazione standard dell'intera registrazione. (C) Tracce rappresentative a prova singola a fluorescenza dei 15 neuroni selezionati in B. (D) Una vista di zoom rappresentativa di 2 tracce di calcio mostrate nelle corrispondenti caselle di colore mostrate nella barra di scala C. , 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Per ottenere tracce di fluorescenza, le regioni di interesse (ROM) corrispondenti ai somi neuronali sono state segmentate manualmente e analizzate dal software ImageJ. Prima della correzione del movimento dell'analisi delle immagini, non erano necessarie procedure comuni di post-registrazione negli animali svegli in quanto i set di dati acquisiti non mostravano artefatti di movimento a causa dell'elevata stabilità dell'impianto di imaging. Una registrazione ottica rappresentativa a prova singola delle attività neuronali dall'ippocampo in un topo che si comporta sveglio è presentata nella figura 6. 15 ROI corrispondenti ai somi neuronali sono stati selezionati manualmente dallo stesso FOV mostrato nella figura 6Be le tracce di fluorescenza a prova singola all'interno di ciascun ROI sono mostrate nella figura 6C. La figura 6D mostra due parti rappresentative di tracce di fluorescenza di due diverse ROM. Abbiamo eseguito 4 sessioni di imaging consecutive per lo stesso FOV con intervalli di 3 giorni. È stato possibile identificare e identificare gli stessi neuroni in alcuni DOM per almeno due settimane (le sessioni di imaging più lunghe non sono state eseguite per questo studio, tuttavia, la stessa preparazione è stata utilizzata per uno studio di imaging fino a 6 mesi su topiprecedentemente 7; Figura 7). In questo studio, abbiamo utilizzato il vettore AAV / DJ-CAG, che stava guidando una forte espressione del gene di interesse anche 21 giorni dopo la consegna del virus (Figura complementare 1). L'espressione continua complicava l'identificazione a lungo termine degli stessi neuroni a causa dell'aumento dello sfondo di fluorescenza e della comparsa di nuovi neuroni che esprimevano l'indicatore del calcio. Pertanto, la selezione del sierotipo AAV e del promotore per guidare l'espressione genica bersaglio dovrebbe essere una delle considerazioni importanti durante la progettazione sperimentale, in particolare se è richiesta l'imaging longitudinale dello stesso sottoinsieme di neuroni. La qualità dell'imaging ha permesso di risolvere i dendriti prossimali e di visualizzare i vasi sanguigni.
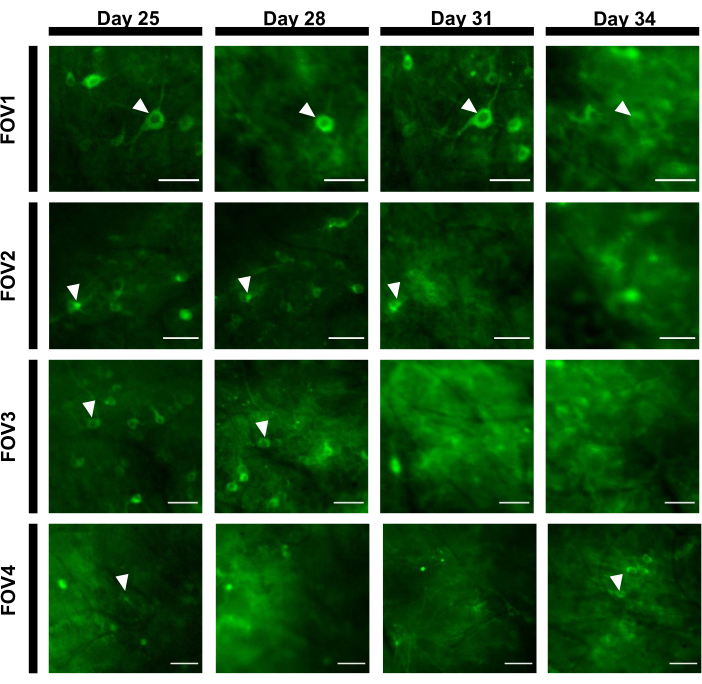
Figura 7: Sequenza di immagini di quattro diversi PV dell'area ippocampale tracciati nell'area di 12 giorni. L'animale è stato impiantato con la finestra il giorno 0 ed è stato iniettato con il virus rAAV / DJ-CAG-NCaMP7 il giorno 7. Le punte delle frecce indicano il neurone tracciato all'interno del FOV. Barre di scala: 80 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Imaging in vivo dell'attività neuronale utilizzando un sensore di tensione geneticamente codificato.
In questo studio, abbiamo anche utilizzato un nuovo sensore di tensione geneticamente codificato, chiamato SomArchon7, che consente l'imaging di tensione con risoluzione a un solo picco a singola cella negli animali dacomportamento 7,8. Per esprimere SomArchon, abbiamo iniettato il virus rAAV/DJ-CAG-SomArchon utilizzando una cannula per infusione ed eseguito l'imaging di tensione in un topo comportamentale fissato dalla testa diversi giorni dopo l'iniezione. Per registrare l'attività neuronale, abbiamo utilizzato un obiettivo NA 0.8 40x e una fotocamera sCMOS Hamamatsu OrcaFusion che ci ha permesso di immaginare FOV 150x40 μm a una velocità di acquisizione fino a 830 Hz. La proteina GFP, che una parte del costrutto SomArchon costruisce per facilitare la visualizzazione dell'espressione nella gamma visibile dello spettro, può essere facilmente immaginata nel canale verde (eccitazione LED a 470/20 nm, emissione 525/50 nm) per localizzare le cellule di interesse per l'imaging di tensione. Le registrazioni di tensione ottica sono state eseguite nel canale del vicino infrarosso (eccitazione laser 637 nm a 3,4 W/mm2,emissione 665 nm di passaggio lungo) con 4 x 4 binning a velocità di acquisizione di 830 Hz. Abbiamo registrato l'attività spontanea di un neurone ippocampale in un topo sveglio con SNR medio di 7 per potenziale d'azione(Figura 8).
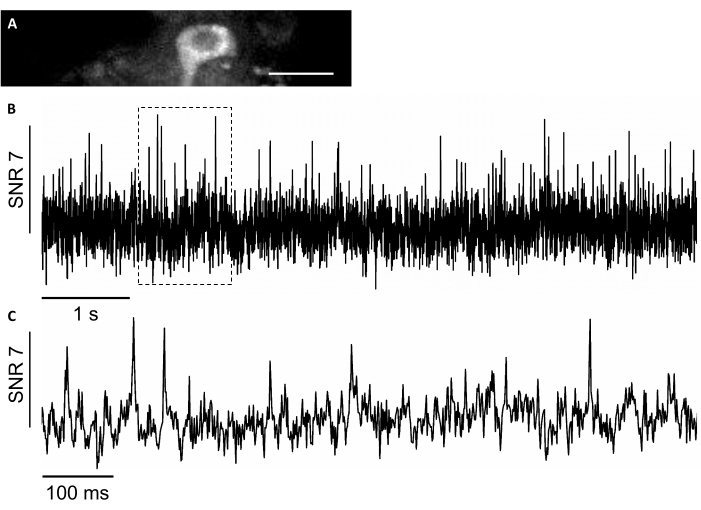
Figura 8: Registrazione dell'attività neuronale nei neuroni ippocampali utilizzando un indicatore di tensione geneticamente codificato a fluorescenza nel vicino infrarosso SomArchon. (A) Un FOV selezionato è stato immaginato al microscopio a fluorescenza a campo largo nel canale del vicino infrarosso. (B) Traccia a fluorescenza a prova singola del neurone in A. (C) Una vista di zoom rappresentativa della traccia di tensione nella casella corrispondente mostrata in B. Barra di scala: 25 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
istologia
Dopo aver effettuato lo studio di imaging funzionale, l'analisi post mortem viene utilizzata per confermare il corretto posizionamento dell'impianto, l'area di espressione del virus e la localizzazione di una proteina di interesse nei neuroni immagine. Per la verifica istologica dell'espressione del virus e del posizionamento dell'impianto, le sezioni coronali del cervello fisso della PFA sono state esaminate al microscopio a campo largo a fluorescenza(Figura 9A, C). Un microscopio confocale è stato utilizzato per acquisire immagini ad alta risoluzione di singoli neuroni che esprimono l'indicatore di calcio, così come l'indicatore di tensione (Figura 9B, D). La colorazione DAPI è stata utilizzata per visualizzare la morfologia complessiva della fetta cerebrale. Inoltre, le fette cerebrali possono essere valutate utilizzando l'immunoistochimica per verificare l'astrogliosi o la gliosi causata dall'impianto della finestra e dall'espressione virale. I nostri studi precedenti hanno dimostrato che la procedura non ha indotto una notevolegliosi 7.
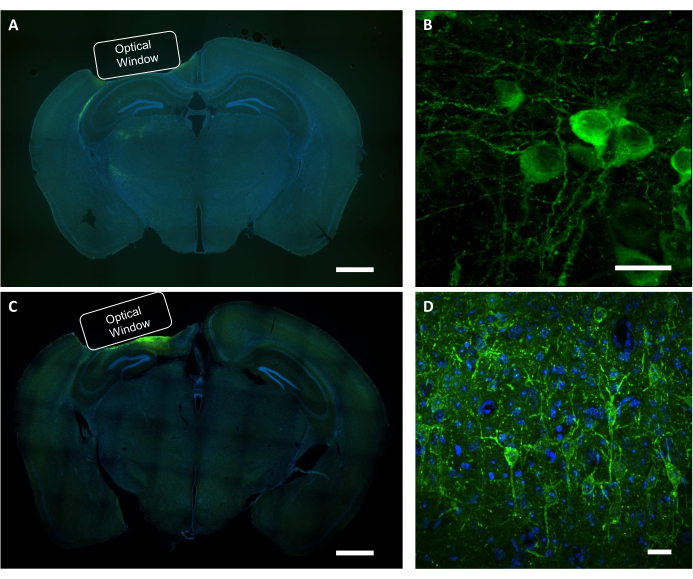
Figura 9: Verifica istologica della posizione ottico della finestra e dell'espressione del virus. (A) Immagine fluorescente rappresentativa della fetta cerebrale della sezione coronale che mostra il posizionamento della finestra ottica da un mouse che esprime NCaMP. Barra di scala: 1 mm. (B) Un'immagine confocale rappresentativa dei neuroni che esprimono gli indicatori NCaMP7. Barra di scala: 25 μm. (C) Un'immagine rappresentativa di fluorescenza della fetta cerebrale della sezione coronale che mostra il posizionamento della finestra ottica da un mouse che esprime SomArchon. Barra di scala: 1 mm. (D) Un'immagine confocale rappresentativa dei neuroni che esprimono gli indicatori somarchon. Barra di scala: 25 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura complementare 1: Analisi quantitativa dell'intensità relativa della fluorescenza insieme al tempo di espressione. Clicca qui per scaricare questo file.
Discussione
Qui descriviamo un metodo per l'imaging a lungo termine della regione dell'ippocampo CA1 nel comportarsi con i topi. Il metodo si basa sull'impianto cronico di una finestra di imaging su misura, che consente anche la somministrazione mirata di virus o farmaci direttamente ai neuroni di interesse. Il presente protocollo si compone di quattro parti principali: i) assemblaggio di impianti di imaging; ii) installazione di impianti di imaging; iii) iniezione di virus tramite impianto di imaging; iv) imaging funzionale nei topi che si comportano. Di seguito vengono descritti e descritti i passaggi critici del protocollo, la risoluzione dei problemi, le modifiche e le limitazioni del metodo. Discutiamo anche dell'importanza del metodo e delle sue potenziali applicazioni alternative.
Ci sono diversi passaggi critici nel protocollo descritto che sono piuttosto importanti per un intervento chirurgico di successo: (i) preparazione di un impianto di imaging di alta qualità; — condizioni chirurgiche sterili; — aspirazione della corteccia; — posizionamento preciso dell'impianto di imaging; — iniezione virale. Come indica il passaggio 1.6, l'eccesso di stagno di saldatura richiederebbe una craniotomia più grande e quindi aumenta il rischio di infiammazione. È anche molto importante utilizzare una quantità appropriata della colla ottica adesiva quando si fissa il vetro di copertura alla cannula di imaging, come indicato nel passaggio 1.11, poiché una quantità insufficiente può causare perdite di liquido cerebrospinale nella cannula di imaging e renderla opaca. D'altra parte, l'eccesso di adesivo ottico può comportare la ridotta trasparenza della finestra di vetro. La possibile contaminazione dell'impianto di imaging può causare una proliferazione attiva del tessuto connettivo sotto la finestra ottica e / o grave infiammazione, che porterà alla fine anticipata dell'esperimento. Pertanto, l'assemblaggio e la preparazione dell'impianto di imaging prima dell'intervento chirurgico è quasi altrettanto importante della procedura chirurgica stessa.
Durante l'intervento chirurgico, la parte della corteccia sotto craniotomia è ablata da una delicata aspirazione, che si traduce in un inevitabile sanguinamento. Il sangue nel sito chirurgico riduce significativamente la visibilità del tessuto cerebrale che deve essere rimosso. Ciò complica la valutazione precisa della profondità richiesta di ablazione tissutale. Un attento lavaggio del sito chirurgico con PBS ogni volta prima di applicare l'aspirazione per rimuovere la porzione successiva di tessuto fornisce un migliore controllo della profondità. Il tessuto cerebrale deve sempre essere rimosso in piccole porzioni passo dopo passo confermando la profondità del tessuto alalato prima di procedere con più aspirazione. Un controllo più fine dell'aspirazione può essere ottenuto anche con un ago smussato più sottile. Si consiglia di utilizzare un ago da 26 G, tuttavia, un diametro inferiore a 26 G è più incline all'intasamento. Inoltre, di solito ci vuole molta pratica per determinare la profondità precisa di aspirazione richiesta per ogni animale, poiché il colore della corteccia, del corpo calloso e dell'ippocampo può variare da topo a topo(Figura 3).
L'inserimento e la messa in sicurezza dell'impianto di imaging devono essere eseguiti in modo molto preciso per garantire la posizione più vicina possibile della finestra di imaging alla superficie dorsale dell'ippocampo. La dimensione della craniotomia preparata dovrebbe corrispondere strettamente all'impianto e consentirne l'inserimento senza una resistenza significativa. Allo stesso tempo, non dovrebbe esserci spazio visibile tra il cranio e l'impianto per garantire una corretta sigillatura ed evitare l'esposizione del tessuto cerebrale. Pressione delicata e stabile deve essere applicata sulla parte superiore dell'impianto durante la sua sigillatura al cranio. È quasi inevitabile avere sangue sotto la finestra di imaging durante l'installazione dell'impianto. Se la procedura chirurgica viene eseguita correttamente, la finestra dovrebbe essere liberata in 3-7 giorni e la vascucolatura cerebrale diventa chiaramente visibile. È anche importante assicurarsi che il virus sia correttamente iniettato sotto la finestra. In caso di espressione non riuscita, il virus può essere reiniettato più volte.
La maggiore complicazione che abbiamo riscontrato in alcuni casi è la ridotta visibilità della finestra di imaging. Ci sono diverse possibili ragioni per una scarsa qualità dell'imaging: i) infiammazione in corso; ii) crescita del tessuto connettivo sul vetro; iii) grande divario tra la finestra e l'ippocampo. L'infiammazione è solitamente causata da contaminazione durante l'intervento chirurgico o da impianto di imaging non adeguatamente sterilizzato. Suggeriamo di autoclavare gli strumenti chirurgici prima e dopo ogni intervento chirurgico, disinfettare l'area dell'intervento chirurgico subito prima della procedura e indossare dispositivi di protezione individuale puliti durante l'intervento chirurgico. Gli impianti di imaging devono essere puliti dopo l'assemblaggio, sterilizzati e conservati in condizioni sterili. La crescita del tessuto connettivo sul vetro dell'impianto di imaging può essere dovuta a contaminazione meccanica sulla superficie del vetro o a un trauma eccessivo del tessuto cerebrale durante l'ablazione della corteccia. Dopo aver assemblato l'impianto, è importante confermare che la superficie del vetro è pulita e liscia. Inoltre, tutti i pezzi di tessuto cerebrale danneggiato devono essere accuratamente rimossi prima di inserire l'impianto di imaging nella craniotomia. In alcuni casi, lo spazio tra la finestra di vetro e l'ippocampo si traduce nell'accumulo di liquido cerebrospinale, riducendo la qualità dell'imaging. Pertanto, durante l'installazione dell'impianto, è fondamentale inserirlo fino in fondo per garantire un buon contatto tra ippocampo e finestra di vetro. A volte, è difficile identificare il motivo esatto della finestra di imaging opaca. Si consiglia di eseguire analisi post mortem per rivelare le condizioni sotto la finestra ottica e di conseguenza regolare gli interventi chirurgici successivi.
Il metodo presenta diverse limitazioni fondamentali e tecniche che dovrebbero essere prese in considerazione prima e durante l'imaging in vivo. Uno dei principali limiti è l'ablazione della corteccia. Parte della corteccia visiva e sensoriale viene rimossa durante l'intervento chirurgico. Mentre è difficile valutare con precisione l'impatto dell'ablazione della corteccia, poiché il tessuto cerebrale rimosso non si proietta direttamente sull'ippocampo, diversi studi non hanno dimostrato alcuna compromissione evidente dell'apprendimento dipendente dall'ippocampo o di altre funzioni ippocampopertinenti 15,16. Dovrebbero essere prese in considerazione anche le limitazioni ottiche, specialmente quando vengono utilizzate lenti oggettive NA elevate. Ad esempio, in questo studio, abbiamo usato una cannula lunga 1,75 mm con un diametro interno di 1,9 mm. La geometria di questa cannula non conserverà l'obiettivo NA completo dell'aria con NA più di ~0,5 o obiettivo acqua con NA più di ~0,6 in quanto ritaglierà un po 'di luce. Un'altra limitazione, comune per tutti gli impianti di imaging cerebrale, è che parte del cervello viene esposta, promuovendo così la perditadi calore 17,18. Tuttavia, la temperatura fisiologica del cervello può essere facilmente ripristinata durante l'imaging per perfusione di un tampone caldo.
Il metodo descritto può essere facilmente modificato o regolato per altre applicazioni. Ad esempio, la preparazione può essere adattata per l'imaging dello striato7. Poiché lo striato si trova leggermente più in profondità dell'ippocampo, la cannula di imaging più lunga dovrebbe essere utilizzata per assemblare l'impianto di imaging. Si consiglia di utilizzare cannula di imaging da 2,0 mm. Le coordinate della craniotomia devono essere regolate di conseguenza (AP: +0,8 mm, ML: −1,8 mm). Inoltre, l'iniezione di virus tramite cannula per infusione consente di ottenere l'espressione di un transgene in un sottile strato di neuroni quando si utilizza sierotipo AAV con diffusionelimitata 19,20. È particolarmente utile per l'imaging con un fotone a causa della ridotta fluorescenza fuori fuoco da strati più profondi e, di conseguenza, di una migliore imaging a risoluzione a singola cellula. Inoltre, la cannula a iniezione può essere utilizzata anche durante l'imaging funzionale per la somministrazione di farmaci o altre sostanze chimiche direttamente sui neuroni in FOV (Figura 5B). La cannula per infusione complessiva aggiunge funzionalità utili all'impianto di imaging, migliorando la qualità dell'imaging grazie all'espressione virale mirata e consentendo la stimolazione farmacologica dei neuroni nei FOV. La piastra della testa utilizzata fornisce una straordinaria stabilità dell'impianto di imaging riducendo al minimo gli artefatti del movimento anche negli animali in movimento attivo su un tapis roulant. La piastra della testa è piccola e leggera, causando un minimo disagio agli animali, e rimane stabile per diversi mesi dopo l'installazione. L'impianto di imaging è anche compatibile con l'imaging multifotono15,16,21 e può essere combinato con micro-endoscopi22,23. Un impianto di imaging simile è stato utilizzato anche per l'imaging multifotonica delle strutture dell'ippocampo più profonde, tra cui strato radio, lacunosi dello strato e giro dentato16,24,25,26,27. Tuttavia, il targeting delle strutture di ippocampo più profonde con AAV tramite cannula per infusione può richiedere un'ulteriore ottimizzazione del sierotipo AAV e del volume19.
Crediamo che il protocollo descritto faciliterà gli studi che mirano a indagare l'attività neuronale con alta risoluzione spaziotemporale nell'ippocampo di comportarsi con topi utilizzando configurazioni di imaging un-fotone semplici e convenienti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo tutti i membri del Molecular BioEngineering Group della Westlake University per tutto l'aiuto e l'utile discussione. Ringraziamo anche Jinze Li e Jie-Min Jia della Westlake University per l'aiuto con le riprese della procedura chirurgica.
Questo lavoro è stato supportato da finanziamenti per le start-up della Foundation of Westlake University, bbrf Young Investigator Grant 2020 e national natural science foundation of China grant 32050410298 all'K.D.P.
Materiali
| Name | Company | Catalog Number | Comments |
| Cover glass | Deckgläser | 72296-03 | |
| Denture Base Resin | ShangHai New Centery Dentel Material | N/A | Type I, self-solidifying |
| Dummy Cannula | RWD Life Science Co.,LTD | 62102 | OD 0.30mm |
| Guide Cannula | RWD Life Science Co.,LTD | 62003 | 26G |
| Head Fork | N/A | N/A | Custom made |
| Head Plate | N/A | N/A | Custom made |
| Imaging Cannula | N/A | N/A | Custom Made; OD 3mm, ID 2.7mm, Height 1.8mm, #108 stainless steel |
| Internal Cannula | RWD Life Science Co.,LTD | 62203 | 0.30*0.14 (OD*ID, mm) |
| Kwik Sil | World Precision Instruments | KWIK-SIL | |
| SuperBond C&B | SUN MEDICAL | N/A | SuperBond C&B kit |
| Treadmill Kit | N/A | N/A | Custom made |
| UV-cured Adhesive | NORLAND PRODUCTS | NOA 60 |
Riferimenti
- Leutgeb, S., et al. Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science. 309 (5734), 619-623 (2005).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Polanco, J. C., et al. Amyloid-β and tau complexity - towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2018).
- Henneman, W. J. P., et al. Hippocampal atrophy rates in Alzheimer disease. Added value over whole brain volume measures. 72 (11), 999-1007 (2009).
- Camicioli, R., et al. Parkinson's disease is associated with hippocampal atrophy. Mov Disord. 18 (7), 784-790 (2003).
- Piatkevich, K. D., Murdock, M. H., Subach, F. V. Advances in Engineering and Application of Optogenetic Indicators for Neuroscience. Applied Sciences. 9 (3), 562(2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Fan, L. Z., et al. All-Optical Electrophysiology Reveals the Role of Lateral Inhibition in Sensory Processing in Cortical Layer 1. Cell. 180 (3), 521-535 (2020).
- Shemesh, O. A., et al. Precision Calcium Imaging of Dense Neural Populations via a Cell-Body-Targeted Calcium Indicator. Neuron. 107 (3), 470-486 (2020).
- Villa, K. L., et al. Inhibitory Synapses Are Repeatedly Assembled and Removed at Persistent Sites In Vivo. Neuron. 89 (4), 756-769 (2016).
- Franklin, K. B. J., Paxinos, G. Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , (2013).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), e680(2008).
- Subach, O. M., et al. Novel Genetically Encoded Bright Positive Calcium Indicator NCaMP7 Based on the mNeonGreen Fluorescent Protein. International Journal of Molecular Sciences. 21 (5), 1644(2020).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Kalmbach, A. S., Waters, J. Brain surface temperature under a craniotomy. Journal of neurophysiology. 108 (11), 3138-3146 (2012).
- Roche, M., et al. In vivo imaging with a water immersion objective affects brain temperature, blood flow and oxygenation. eLife. 8, 47324(2019).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neuroscience Research. 93, 144-157 (2015).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Gene Therapy for Neurological Disorders: Methods and Protocols. Manfredssonn, F. P. , Springer. New York. 133-149 (2016).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), (2016).
- Yashiro, H., Nakahara, I., Funabiki, K., Riquimaroux, H. Micro-endoscopic system for functional assessment of neural circuits in deep brain regions: Simultaneous optical and electrical recordings of auditory responses in mouse's inferior colliculus. Neuroscience Research. 119, 61-69 (2017).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution In Vivo Imaging of Hippocampal Dendrites and Spines. The Journal of Neuroscience. 24 (13), 3147(2004).
- Busche, M. A., et al. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proceedings of the National Academy of Sciences. 109 (22), 8740(2012).
- Attardo, A., et al. Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Castello-Waldow, T. P., et al. Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. PLOS Biology. 18 (11), 3000928(2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon