Method Article
Procedimiento De Craneotomía Para La Visualización De Las Actividades Neuronales En El Hipocampo De Comportarse Ratones
En este artículo
Resumen
Este artículo demuestra la preparación de una ventana de encargo de la proyección de imagen complementada con la cánula de la infusión y su implantación sobre la región CA1 del hipocampo en ratones.
Resumen
Las actividades neuronales de la proyección de imagen en la resolución unicelular en animales despiertos que se comportan es un acercamiento muy de gran alcance para la investigación de las funciones del circuito de los nervios en neurociencia de los sistemas. Sin embargo, la alta absorbancia y la dispersión de la luz en el tejido de mamíferos limitan las imágenes intravitales principalmente a las regiones cerebrales superficiales, dejando las áreas cerebrales profundas, como el hipocampo, fuera del alcance de la microscopía óptica. En este video, mostramos la preparación e implantación de la ventana de imágenes a medida para permitir la obtención de imágenes crónicas in vivo de la región del hipocampo dorsal CA1 en ratones que se comportan con la cabeza fija. La ventana hecha a medida se complementa con una cánula de infusión que permite la entrega dirigida de vectores virales y fármacos al área de imágenes. Combinando esta preparación con proyección de imagen de campo amplio, realizamos una grabación a largo plazo de la actividad neuronal usando un indicador fluorescente del calcio de subconjuntos grandes de neuronas en ratones que comportan durante varias semanas. También demostramos la aplicabilidad de esta preparación para la proyección de imagen del voltaje con la resolución del solo-punto. Los indicadores genéticamente codificados de alto rendimiento de la actividad neuronal y las cámaras CMOS científicas permitieron la visualización recurrente de detalles morfológicos subcelulares de neuronas individuales a alta resolución temporal. También discutimos las ventajas y las limitaciones potenciales del método descrito y de su compatibilidad con otras técnicas de proyección de imagen.
Introducción
El hipocampo es una región clave del cerebro responsable del aprendizaje y la memoria1, así como de la navegación espacial2. La atrofia del hipocampo se asocia con trastornos neurológicos y psiquiátricos que implican pérdida de memoria y deterioro cognitivo3,4,5. En ratones, el hipocampo es un modelo muy bien establecido para estudiar el aprendizaje espacial, contextual y asociativo y la formación de la memoria en los niveles celular y de red4,5. Los estudios mecanicistas del aprendizaje y la memoria requieren la interrogación longitudinal de la estructura neuronal y la función en ratones que se comportan. Las imágenes de fluorescencia en combinación con sondas codificadas genéticamente6 proporcionan capacidades sin precedentes para registrar la dinámica de voltaje de membrana7,8,transitorios de calcio9,y cambios estructurales10 sobre grandes subconjuntos de neuronas por vía intravírica. Sin embargo, el acceso óptico al hipocampo en ratones está obstruido por la corteza, que puede alcanzar más de 1 mm de espesor. Aquí, se describe un procedimiento para el montaje de un dispositivo de imagen a medida y su implantación crónica en la cabeza del ratón para el acceso óptico a largo plazo a la subregión CA1 del hipocampo dorsal en ratones que se comportan. La cánula de infusión integrada en el implante de imagen permite la administración de virus o fármacos directamente sobre las neuronas en el campo de visión. La preparación descrita en combinación con microscopía de campo amplio permite la obtención de imágenes recurrentes de los grandes subconjuntos de neuronas en ratones que se comportan durante largos períodos de tiempo. Utilizamos esta preparación para expresar el calcio y el voltaje genético codificados indicadores en la región hippocampal CA1 vía la inyección apuntada del virus adeno-asociado recombinante (rAAV) para las grabaciones neuronales de la actividad en la resolución unicelular. También realizamos proyección de imagen longitudinal del calcio de los subconjuntos neuronales correspondientes en la alta resolución espaciotemporal en animales que se comportaban. Además, esta preparación es compatible con microscopía multifotónica y microendoscopia, ampliando así aún más la caja de herramientas de técnicas de imagen para estudiar las redes neuronales a nivel celular y subcelular en ratones que se comportan. Describimos los pasos críticos y el Troubleshooting del protocolo. También discutimos las posibles trampas y limitaciones del método.
Protocolo
Todos los métodos descritos aquí han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Westlake.
1. Montaje de implantes
NOTA: El montaje del implante de imágenes es técnicamente simple y requiere sólo elementos disponibles comercialmente (Figura 1, ver también Tabla de Materiales). Las placas de cabezal se pueden fabricar en el taller de máquinas local utilizando placas de acero inoxidable o titanio. Sugerimos preparar un stock de implantes completamente ensamblados antes de comenzar las cirugías. Después de realizar experimentos in vivo, los implantes se pueden recuperar y reutilizar varias veces. En algunos casos, sólo puede requerir volver a colocar la cánula de infusión mediante la soldadura o el reemplazo del vidrio de la cubierta.
- Prepare los seis componentes de hardware clave para el montaje y la instalación de implantes de imágenes (Figura 1).
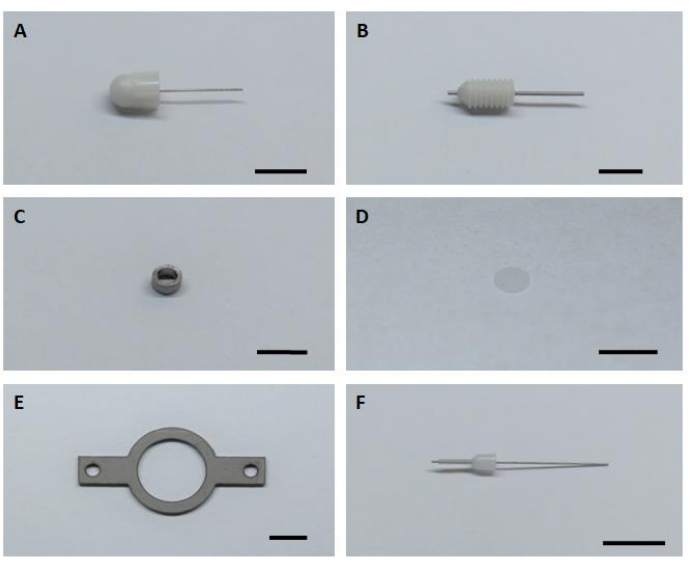
Figura 1:Seis componentes clave de hardware para el montaje e instalación del implante de imagen. (A)Cánula ficticia. (B) Cánula guía. (C) C ) Cánula de la proyección de imagen. (D) Vidrio de la cubierta de vidrio. (E) Placa de cabeza. (F) Cánula interna. Barra de escala: 5 mm. Haga clic aquí para ver una versión más grande de esta figura.
- Encienda la máquina de soldadura y címela hasta la temperatura requerida.
NOTA: La temperatura depende de la lata de soldadura utilizada. - Pula la superficie lateral de la cánula de imagen usando papel de lija fina para eliminar la capa de oxidación y así facilitar una soldadura más fuerte.
- Ajuste la posición de la cánula de imagen y la cánula de inyección (cánula guía con cánula ficticia insertada) usando las manos de ayuda (Figura 2A,B).
- Usando una jeringa con una aguja, aplique una pequeña cantidad de tipo apropiado de fundente en el punto de conexión entre la imagen y la inyección de cánulas durante 5 segundos, y luego retire la gotita.
NOTA: Para esta preparación, utilizamos un fundente disponible comercialmente que el fabricante especifica que es para soldar piezas de acero inoxidable, ya que las cánulas de imágenes e infusión están hechas de acero inoxidable. En el caso de otros materiales utilizados para fabricar cánulas, el usuario final debe seleccionar fundente que pueda soldar el material seleccionado. - Fundir lata de soldadura y aplicarla al punto de conexión tratado con fundente (Figura 2).
NOTA: Evite el exceso de soldadura de estaño, ya que requerirá una craneotomía innecesariamente más grande durante la cirugía.
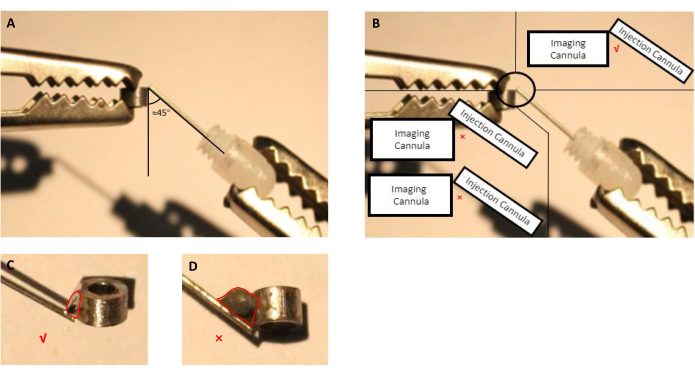
Figura 2: Esquema de montaje de la cánula de inyección, que consiste en cánula guía con cánula ficticia insertada, con la cánula de imagen. (A)El ángulo entre la cánula de inyección y la cánula de imagen debe ser próximo 45 grados. (B)La punta de la cánula de inyección debe estar justo en el borde de la cánula de imágenes. (C)Un tamaño apropiado de la lata de soldadura utilizada para soldar cánulas de imagen e inyección (la línea roja indica el contorno de la gota de estaño). (D)Tamaño inadecuado de la lata de soldadura que debe evitarse durante la preparación del implante (la línea roja indica el contorno de la gota de estaño). Haga clic aquí para ver una versión más amplia de esta figura.
- Espere a que la lata de soldadura se enfríe. Por lo general, tarda varios segundos.
- Confirme que la cánula de inyección no está bloqueada insertando la cánula ficticia desde ambas direcciones.
- Aplique adhesivo óptico de curado UV en la parte inferior de la cánula de imágenes con un palillo de dientes o una aguja de jeringa de 26 G.
- Use una pinza fina para colocar cuidadosamente un vaso de cubierta del tamaño correspondiente a la cánula de imágenes.
NOTA: El posicionamiento del vidrio debe hacerse con precisión sobre la cánula de imagen sin mover demasiado el vidrio una vez que ha tocado el adhesivo óptico. De lo contrario, el vidrio se ensucia, lo que reduce la calidad de las imágenes. - Cure el adhesivo durante al menos una hora por iluminación UV de 350-400 nm de una lámpara UV de mano estándar.
NOTA: El adhesivo utilizado debe ser ópticamente transparente. De lo contrario, disminuirá la calidad de la ventana de imágenes.
PRECAUCIÓN: Evite la exposición de la piel y los ojos usando gafas, guantes y bata de laboratorio que protejan los rayos UV. - Lave la cánula en etanol al 70%, seque al aire y guárdela en un recipiente estéril hasta la cirugía.
NOTA: Es muy importante mantener el vidrio de la cubierta lo más limpio e intacto posible. El adhesivo óptico utilizado es químicamente estable en etanol al 70%.
2. Implantación de ventanas
- Pasos de preparación antes de la cirugía
- Esterilizar todos los instrumentos quirúrgicos en un autoclave.
- Prepare 1x PBS y etanol al 70% en dos placas de Petri separadas.
- Opcionalmente: Desinfecte el área de la cirugía usando luz UV durante al menos 20 minutos antes de iniciar el procedimiento quirúrgico.
NOTA: Operar en las condiciones más estériles posibles resultará en ventanas craneales cubiertas de vidrio exitosas y duraderas (hasta 6 meses). La contaminación puede resultar en una reducción de la transparencia de las ventanas o una inflamación grave en la mayoría de los casos.
- Procedimiento quirúrgico
- Esterilizar el área quirúrgica con etanol al 70% justo antes de la cirugía.
- Pesar al animal y administrar una dosis prequirúrgica de analgésico por vía subcutánea según el protocolo animal aprobado por el IACUC.
- Anestesiar un ratón con isoflurano (4% para la inducción, 1.5-2% para el mantenimiento, 0.3-0.5 L/min caudal de aire). Utilice una técnica de pellizco en la cola y dedo del otro para asegurarse de que el animal esté completamente sedado. Observe los signos vitales del animal, como la respiración, la SpO2y la frecuencia cardíaca durante la duración del procedimiento.
- Use una recortadora o crema depilatoria para eliminar el pelaje desde la parte posterior del cuello hasta los ojos.
- Coloque el ratón en un marco estereotáxico sobre una almohadilla de calentamiento de cirugía (manteniendo 37 °C). Asegure la cabeza con barras para los oídos. Empuje ligeramente la cabeza en todas las direcciones para asegurarse de que la cabeza esté firmemente asegurada.
- Aplique ungüento para los ojos para evitar que los ojos del animal se sequen durante la cirugía.
- Esterilice el sitio quirúrgico con betadina seguida de etanol al 70% tres veces antes de hacer una incisión.
- Retire la piel sobre la parte superior del cráneo, comenzando con un corte horizontal a lo largo de toda la base de la cabeza, seguido de dos cortes en la dirección rostral, casi llegando a los párpados, luego dos cortes oblicuos que convergen en la línea media.
- Con dos hisopos de algodón estériles, retraer el tejido de conexión, así como la musculatura de la parte posterior del cuello, a los bordes del cráneo.
NOTA: Trate de evitar dañar los vasos sanguíneos (especialmente los ocultos en el músculo) durante la manipulación. - Aplique una gota de solución de lidocaína (~0,1 mL) en la superficie del periostio durante 2 minutos para evitar un dolor excesivo. Opcionalmente para reducir el cerebro de la hinchazón después de extraer el cráneo, 0.1 mL de dexametasona al 1% se puede inyectar por vía subcutánea.
- Raspe suavemente toda el área expuesta del cráneo con un bisturí para crear una superficie seca y rugosa que permita que el pegamento y el cemento dental se adhieran mejor y, por lo tanto, resulte en una implantación crónica.
- Coloque la punta de la aguja montada en la estación estereotáxica sobre el bregma, establezca las tres coordenadas (AP: Anterior-Posterior; ML: Medial-Lateral; DV: Dorsal-Ventral) como 0.
- Coloque la punta de la aguja en la lambda y vea si la coordenada AP es 0 para confirmar que la posición de la cabeza es vertical, así como si la coordenada ML es 0 para confirmar que la cabeza está posicionada horizontalmente. Si no es así, ajuste las perillas correspondientes en la estación estereotáxica, hasta que las coordenadas AP y ML estén dentro de 0,1 mm.
- Mueva la punta de la aguja para encontrar los puntos correspondientes para la craneotomía y marque sus posiciones en el cráneo usando un marcador fino. En el caso de la implantación para hipocampo, hay 4 puntos con las siguientes coordenadas (AP: -0.68, ML: -2.0) (AP: -3.68, ML: -2.0) (AP: -2.18, ML: -0.5) y (AP: -2.18, ML: -3.5)11,así como (AP: -4.0, ML: -2.0) para el punto más caudal de la cánula de inyección.
NOTA: El marcador utilizado en este paso debe esterilizarse utilizando iluminación UV durante al menos una hora antes de la cirugía. Las coordenadas que se muestran aquí son para ratones C57BL/6J de 6-8 semanas de edad. Las coordenadas pueden diferir debido a diferentes edades o cepas de ratones. - Dibuje un círculo basado en cuatro puntos marcados, así como el contorno del área de la cánula de inyección en el lado caudal del círculo (Figura 3).
- Utilice un taladro neumático a la velocidad de 10.000 rpm para "dibujar" suavemente a lo largo del contorno marcado en el cráneo.
- Perfore el cráneo hasta que quede una capa muy delgada de hueso, que generalmente comienza a moverse bajo un toque suave en el centro.
- Aplique una gota de PBS estéril 1x al centro de la craneotomía, levante el colgajo óseo del cráneo con pinzas de punta muy delgadas o dos agujas de 26 G que se acerquen desde lados opuestos.
NOTA: El PBS ayudará a retirar el trozo de cráneo y prevenirá un posible sangrado de la duramadre12. - Aplique PBS, seguido de una aspiración suave a través de una aguja roma 26G varias veces para limpiar la superficie de la duramadre.
- Retire suavemente la duramadre, ya sea por aspiración o por tijeras oftálmicas. Aplique una succión suave (~-60kPa) para ablacionar la corteza, así como el cuerpo calloso por encima del hipocampo.
NOTA: La corteza es a menudo más amarilla que el cuerpo calloso, y el cuerpo calloso es generalmente más blanco que el hipocampo. El cuerpo calloso suele ser fácil de distinguir por las fibras neuronales que van en las direcciones vertical y horizontal cuando se observa desde la parte superior (Figura 3).
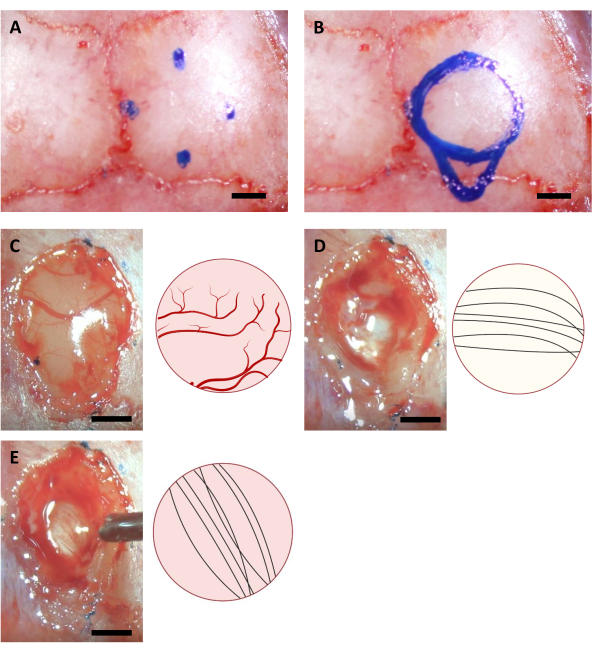
Figura 3:Coordenadas estereotáxicas de la localización del hipocampo y el proceso de ablación cerebral. (A)Cuatro coordenadas para los bordes del área de craneotomía. (B)Área completa de craneotomía. (C-E) Imágenes representativas adquiridas durante la cirugía (izquierda) y su diagrama esquemático (derecha) indicando los diferentes colores y direcciones de las fibras neurales de(A)corteza(B)cuerpo calloso, y(C)hipocampo visible durante la ablación de la corteza. Barra de escala: 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
- El sangrado en este punto afectará la visibilidad del tejido cerebral en la craneotomía. Aplique 1x PBS, seguido de una succión suave, mientras aspira la corteza para deshacerse de la sangre.
NOTA: El sangrado continuo es inevitable durante este paso, y hasta cierto punto, el sangrado continuo es un signo de presión arterial normal. A diferencia de la implantación de la ventana de la proyección de imagen de la corteza, la presencia de sangre debajo de la ventana óptica es aceptable puesto que será despejada varios días después de la cirugía. La inserción de la cánula de la proyección de imagen a la cavidad creada cuanto antes después de ablación de la corteza es óptima. - Si la craneotomía es más grande en <0.5 mm que la cánula de imágenes, rescate la instalación de la cánula hasta cierto punto mediante el uso de sellado Kwik Sil adicional antes de fijar el implante con SuperBond.
- Si la craneotomía es más pequeña en <0,5 mm que la cánula por imágenes, rescate el procedimiento quirúrgico hasta cierto punto recortando el borde de la craneotomía usando una pinza fina o un par de tijeras oftálmicas, ya que el hueso restante en el borde de la craneotomía es más delgado que el cráneo en sí como resultado de la perforación.
NOTA: Las craneotomías que exceden los rangos superiores a 0,5 mm no pueden ser rescatadas. Las acciones correspondientes en esos casos deben seguir el procedimiento de terminación de acuerdo con el protocolo animal.
- Inserte suavemente el implante en la craneotomía.
- Presione firmemente la parte superior del implante con la aguja en forma de L para colocar la ventana óptica del implante lo más cerca posible de la superficie expuesta del hipocampo. Aplique repetidamente PBS en el cráneo alrededor del implante seguido de succión para extraer la sangre tanto como sea posible durante la inserción del implante. A continuación, aplique una capa delgada de Kwik Sil entre el implante y el cráneo para evitar que el cemento dental penetre debajo del cráneo (Figura 4).
- Asegúrese de que la colocación de la ventana óptica del implante es correcta contra el hipocampo para evitar la acumulación de sangre u otro líquido debajo.
NOTA: El punto crítico es asegurarse de que el vidrio de la cubierta de la cánula de imágenes se coloca justo contra el hipocampo, que puede requerir una presión suave en la parte superior de la cánula durante el proceso de instalación y sellado. Si el lado superior de la cánula de imágenes es paralelo al cráneo no es crítico para el acceso óptico final, siempre y cuando la ventana óptica se coloque contra el hipocampo. - De acuerdo con el espesor promedio de la corteza por encima del área CA1, mantenga la superficie superior de la cánula de imagen por encima de la superficie del cráneo en ~ 0,5 mm para facilitar la unión de la cánula al cráneo (Figura 4).
- Asegúrese de que la colocación de la ventana óptica del implante es correcta contra el hipocampo para evitar la acumulación de sangre u otro líquido debajo.
- Una vez que el Kwik Sil se cura, que generalmente no toma más de ~ 1 minuto, aplique Super-Bond C &B uniformemente en la superficie del cráneo, la superficie de Kwik-Sil y la superficie superior del implante.
- Una vez curado el Super-Bond C&B, aplique la resina de base de dentadura postiza por encima del Super-Bond C&B, así como la piel alrededor de la incisión realizada al comienzo de la cirugía.
NOTA: Los tipos alternativos de cemento están disponibles de varios proveedores. Siga las instrucciones del fabricante correspondiente. - Después de que la resina de la base de la dentadura se cure, coloque la placa de la cabeza en la resina alrededor del implante y concéntrela con la cánula de la proyección de imagen. Aplique más resina de base de dentadura alrededor y por encima de la placa de la cabeza para fijar su posición. Deja que se cure durante varios minutos.
- Evite construir una gruesa capa de cemento alrededor de la cánula para garantizar un mejor acceso a la ventana de imágenes con la lente objetivo (Figura 4).
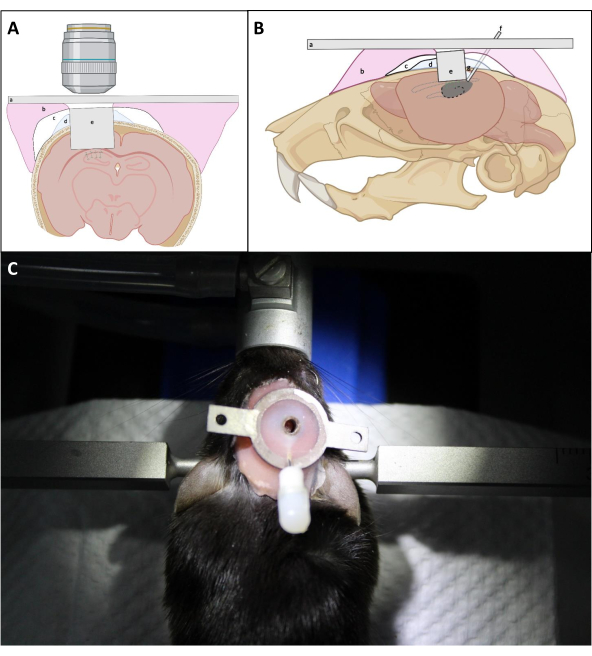
Figura 4: Diagrama esquemático de la implantación de ventanas en (A) vista coronal y (B) sagital. a) placa de cabecera; b) resina de base de dentadura postiza; c)Superbond; d) Kwik-Sil; e)cánula de diagnóstico por imágenes; f) cánula inyectable; g) Estaño de soldadura. (C): Ratón con el implante instalado después de la cirugía. Haga clic aquí para ver una versión más amplia de esta figura.
- Diluya la resina de base de la dentadura para disminuir su viscosidad, lo que le permite llenar las advertencias que son difíciles de alcanzar con un aplicador.
- Coloque suavemente una cinta de goma aislada sobre la ventana para proteger la ventana de una posible contaminación de la ropa de cama de los animales.
- Cuando termine la cirugía, inyecte el fármaco antiinflamatorio por vía subcutánea para prevenir una respuesta inflamatoria.
- Coloque al animal en una jaula caliente hasta que se recupere de la anestesia.
- Compruebe el estado de salud del ratón durante 72 h después de la cirugía observando el comportamiento general. El fármaco antiinflamatorio y el analgésico se inyectan por vía subcutánea durante dos o tres días después de la cirugía cada 24 horas para liberar el dolor y reducir la respuesta inflamatoria.
NOTA: Los procedimientos de monitoreo alternativos, los medicamentos y las dosis son posibles para el cuidado postoperatorio, consulte el protocolo animal aprobado por la IUCAC para el procedimiento exacto. - Revise la ventana 5-7 días después de la cirugía para observar la vasculatura debajo de la ventana. En el caso de una ventana clara, el animal está listo para la inyección del virus.
3. Inyección de virus
NOTA: La inyección de virus generalmente se realiza en 5-7 días después de la cirugía. Antes de la inyección del virus, hay que confirmar que la ventana de imagen está clara, y es posible observar la vasculatura cerebral (Figura 5). En algunos casos, puede tomar hasta 14-16 días para despejar la ventana, que también es aceptable si no se detecta ninguna inflamación cerebral.
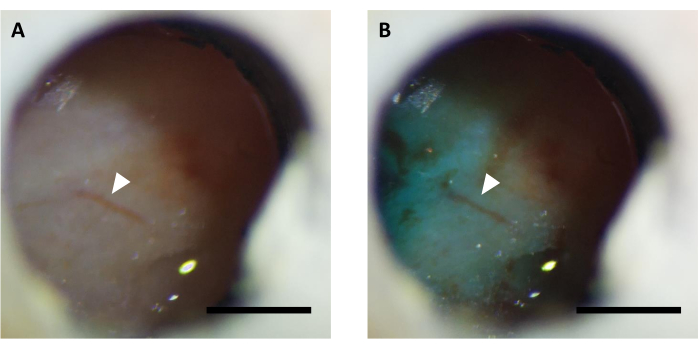
Figura 5:Imagen representativa de la ventana óptica (A) antes y (B) después de la inyección de virus complementada con tinte FastGreen. Arrow indica la misma estructura de vasculatura. Barra de escala: 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
- Agregue la solución de culata de colorante verde rápido a la solución de virus, diluida al título deseado, en la proporción de 1:9 en un tubo de PCR.
NOTA: Se agrega un tinte verde rápido para facilitar la visualización de la solución de virus durante la inyección. - Conecte el tubo de polietileno con la jeringa, luego vuelva a llenar el tubo con aceite mineral usando una bomba de jeringa.
- Conecte la cánula interna al otro extremo de la tubería, infunda y retire el aceite mineral unas cuantas veces para asegurarse de que la cánula interna no esté obstruida.
- Anestesiar al animal con isoflurano (4% para la inducción, 1.5-2% para el mantenimiento, 0.3-0.5 L/min caudal de aire), fijar la cabeza en un marco estereotáxico sobre una almohadilla térmica (manteniendo 37 °C), aplicar ungüento para los ojos.
- Retire 600 nL de la solución del virus, retire la cánula ficticia e inserte la cánula interna conectada a la jeringa de inyección en la cánula guía, infunda el virus a la velocidad de 50 nL /min durante 10 minutos en total.
NOTA: Compruebe si el tinte es visible a través de la ventana utilizando un estereomicroscopio para confirmar el éxito de la inyección de virus (Figura 5). - Después de la inyección, mantenga la cánula interna conectada durante 10 minutos para permitir que el virus se propague debajo de la ventana.
- Retire suavemente la cánula interna de la cánula guía y recapitularla con una cánula ficticia.
- Coloque al animal en una jaula caliente hasta que se recupere de la anestesia.
NOTA: Por lo general, los ratones están listos para la toma de imágenes en 10-20 días después de la inyección viral. El nivel de expresión y el tiempo dependen del serotipo y promotor del virus utilizado para impulsar la expresión génica.
4. Proyección de imagen de ratones despiertos bajo microscopio de campo ancho.
NOTA: La placa de cabeza preparada proporciona una estabilidad extraordinaria del implante de imágenes y, por lo tanto, permite la obtención de imágenes longitudinales en ratones despiertos y que se comportan con artefactos de movimiento mínimos.
- Induzca el ratón con isoflurano al 4% durante unos minutos, fije su placa de cabeza a la horquilla de la cabeza y, a continuación, fije la horquilla de la cabeza a la cinta de correr.
NOTA: La horquilla de la cabeza y la cinta de correr se personalizan para la placa de cabecera utilizada en este estudio, consulte los materiales de apoyo para los archivos cad correspondientes. La inducción del ratón antes de la fijación de la cabeza es opcional, ya que es posible habituar el animal para este procedimiento. - Mueva la cinta de correr bajo la etapa del microscopio y coloque la ventana óptica debajo de la lente objetivo.
- Utilice una lente de objetivo de bajo aumento para encontrar el mejor campo de visión (FOV) para imágenes funcionales, luego cambie a una lente objetivo de NA más alta para registrar las actividades neuronales a resolución unicelular.
NOTA: Si la cánula de inyección sigue siendo un obstáculo para que la lente objetivo alcance su distancia de trabajo, utilice un cortador de alambre para cortar la cánula de inyección de la placa de la cabeza.
Resultados
Proyección de imagen in vivo de la actividad neuronal usando un indicador genético codificado del calcio. En promedio, la proyección de imagen in vivo comienza 3-4 semanas después de la implantación si se alcanza un nivel suficiente de expresión del transgene. En este momento, el edema cerebral y la hemorragia generalmente se resuelven completamente, y la vasculatura cerebral se puede observar fácilmente a través de la ventana óptica. Aquí se utilizó la preparación descrita para realizar las grabaciones repetidas de la actividad neuronal en la región del hipocampo dorsal CA1 en ratones que se comportan bajo microscopio de fluorescencia de campo amplio. Para registrar la actividad neuronal, utilizamos un indicador de calcio brillante codificado genéticamente, llamado NCaMP713,que exhibe una sensibilidad al calcio y una resolución temporal similares a la de GCaMP6s14. Para expresar el indicador NCaMP7 en el hipocampo, inyectamos el virus rAAV/DJ-CAG-NCaMP7 usando una cánula de infusión e iniciamos la proyección de imagen de la longitud en 14 días después de la inyección. Para registrar la actividad neuronal, utilizamos una lente de objetivo de aire 10x NA 0.3 y una cámara Hamamatsu OrcaFusion sCMOS que permitió obtener imágenes a ~ 1.5x1.5 mm FOV a una frecuencia de hasta 100 Hz. La fluorescencia verde fue excitada por un LED de 470 nm disponible en el comercio utilizando un conjunto de filtros GFP estándar. La profundidad media de imagen alcanzada en el canal verde es de unos 50-120 μm, lo que permite registrar la actividad neuronal principalmente en el estrato oriens y el estrato piramidal. La profundidad de imagen en los canales del infrarrojo cercano puede ser de hasta 200 μm alcanzando las capas más profundas del hipocampo8. El tiempo medio de grabación por VO fue de 6-12 min, aunque es posible realizar sesiones de imagen mucho más largas ya que el NCaMP7 se caracteriza por una fotoestabilidad extremadamente alta y no se observó fototoxicidad detectable(Figura 6).
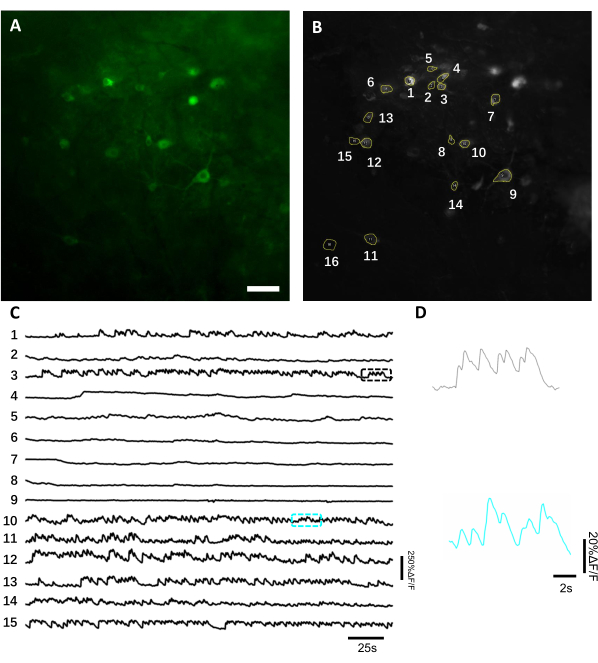
Figura 6: Registro de la actividad neuronal en las neuronas del hipocampo utilizando un indicador de calcio codificado genéticamente por fluorescencia verde. (A) Un campo de estudios seleccionado fotograbado bajo un microscopio de fluorescencia de campo ancho en el canal verde. (B) Los 15 ROIs correspondientes a las neuronas individuales mostradas en A y seleccionadas utilizando la proyección de desviación estándar de todo el registro. (C) Rastros representativos de fluorescencia de un solo ensayo de las 15 neuronas seleccionadas en B. (D) Una vista representativa de zoom de 2 rastros de calcio que se muestran en los cuadros de color correspondientes que se muestran en la barra de C. Scale, 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Para obtener trazas de fluorescencia, las regiones de interés (ROIs) correspondientes a los somas neuronales se segmentaron manualmente y se analizaron mediante el software ImageJ. Antes de la corrección del movimiento del análisis de imagen, los procedimientos comunes de la poste-grabación en animales despiertos no eran requeridos pues los conjuntos de datos adquiridos no exhibieron los artefactos del movimiento debido a la alta estabilidad del implante de la proyección de imagen. En la Figura 6se presenta un registro óptico representativo de un solo ensayo de las actividades neuronales del hipocampo en un ratón que se comporta despierto. Se seleccionaron manualmente 15 ROI correspondientes a somas neuronales a partir del mismo campo de trabajo que se muestra en la Figura 6B,y las trazas de fluorescencia de un solo ensayo dentro de cada ROI se muestran en la Figura 6C. La Figura 6D muestra dos partes representativas de trazas de fluorescencia de dos ROIs diferentes. Realizamos 4 sesiones consecutivas de la proyección de imagen para el mismo FOV con intervalos de 3 días. Fue posible identificar e imagen de las mismas neuronas en ciertos FOVs durante al menos dos semanas (las sesiones de imágenes más largas no se realizaron para este estudio, sin embargo, la misma preparación se ha utilizado para hasta 6 meses de estudio por imágenes en ratonespreviamente 7; Figura 7). En este estudio, se utilizó el vector AAV/DJ-CAG, que fue impulsando una fuerte expresión del gen de interés incluso 21 días después de la entrega del virus(Figura Suplementaria 1). La expresión continua complicó la identificación a largo plazo de las mismas neuronas debido al aumento del fondo de fluorescencia y la aparición de nuevas neuronas que expresan el indicador de calcio. Por lo tanto, la selección del serotipo y del promotor de AAV para conducir la expresión génica de la blanco debe ser una de las consideraciones importantes durante diseño experimental particularmente si la proyección de imagen longitudinal del mismo subconjunto de neuronas se requiere. La calidad de la proyección de imagen permitió resolver dendritas próximas así como visualizar los vasos sanguíneos.
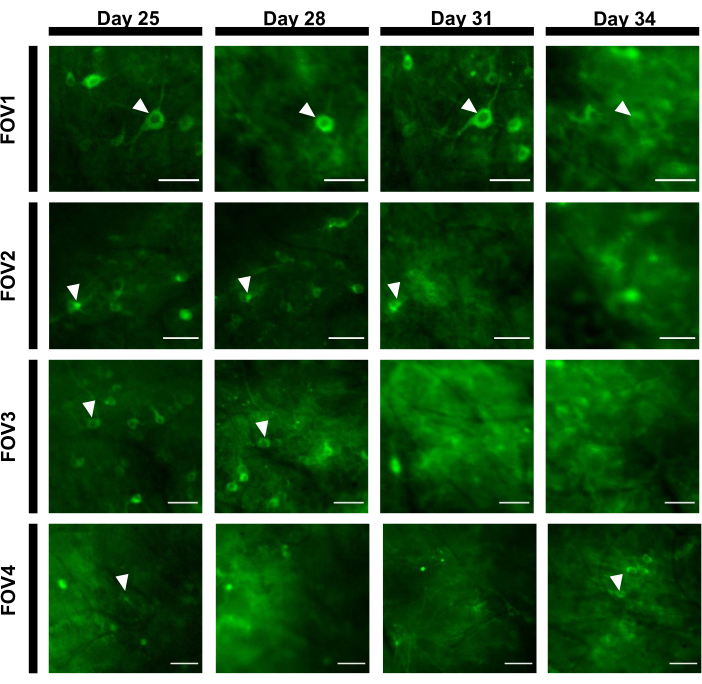
Figura 7:Secuencia de imágenes de cuatro FOVs diferentes del área del hipocampo rastreados durante 12 días. El animal fue implantado con la ventana el día 0 y fue inyectado con el virus rAAV/DJ-CAG-NCaMP7 el día 7. Las puntas de flecha indican la neurona rastreada dentro del fov. Barras de escala: 80 μm. Haga clic aquí para ver una versión más grande de esta figura.
Proyección de imagen in vivo de la actividad neuronal usando un sensor genético codificado del voltaje.
En este estudio, también utilizamos un nuevo sensor de voltaje codificado genéticamente, llamado SomArchon7,que permite obtener imágenes de voltaje con resolución de pico único unicelular en animales que se comportan7,8. Para expresar SomArchon, inyectamos el virus de rAAV/DJ-CAG-SomArchon usando una cánula de la infusión y realizamos proyección de imagen del voltaje en un ratón de comportamiento cabeza-fijo varios días después de la inyección. Para registrar la actividad neuronal, utilizamos una lente objetivo 40x NA 0.8 y una cámara Hamamatsu OrcaFusion sCMOS que nos permitió obtener imágenes de FOV de 150x40 μm a una velocidad de adquisición de hasta 830 Hz. La proteína GFP, que una parte de la construcción de SomArchon para facilitar la visualización de la expresión en el rango visible del espectro, se puede visualizar fácilmente en el canal verde (excitación LED a 470/20 nm, emisión 525/50 nm) para localizar células de interés para la obtención de imágenes de voltaje. Las grabaciones ópticas de voltaje se realizaron en el canal de infrarrojo cercano (excitación láser 637 nm a 3,4 W/mm2,emisión 665 nm de paso largo) con 4 x 4 binning a una velocidad de adquisición de 830 Hz. Se registró la actividad espontánea de una neurona del hipocampo en un ratón despierto con una SNR media de 7 por potencial de acción(Figura 8).
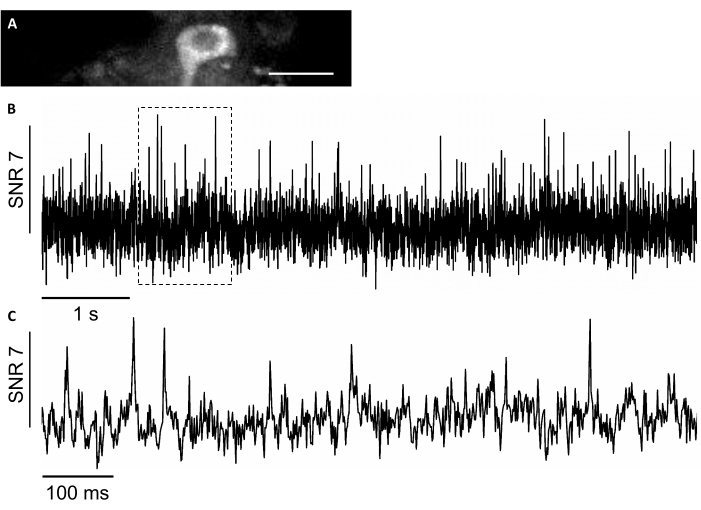
Figura 8: Registro de la actividad neuronal en las neuronas del hipocampo utilizando un indicador de voltaje codificado genéticamente por fluorescencia de infrarrojo cercano SomArchon. (A) Un campo de estudios seleccionado foto fotomente fotoda bajo microscopio de fluorescencia de campo amplio en el canal infrarrojo cercano. (B) Traza de fluorescencia de prueba única de la neurona en A. (C) Una vista representativa de zoom de la traza de voltaje en la caja correspondiente que se muestra en B. Barra de escala: 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
histología
Después de que se realiza el estudio de imágenes funcionales, el análisis post mortem se utiliza para confirmar la colocación correcta del implante, el área de expresión del virus y la localización de una proteína de interés en las neuronas con imágenes. Para la verificación histológica de la expresión del virus y la colocación del implante, se examinaron las secciones coronales del cerebro fijo de PFA bajo un microscopio de fluorescencia de campo amplio(Figura 9A, C). Se utilizó un microscopio confocal para adquirir imágenes de alta resolución de neuronas individuales que expresan el indicador de calcio, así como el indicador de voltaje(Figura 9B,D). La coloración de DAPI fue utilizada para visualizar la morfología total de la rebanada del cerebro. Además, las rebanadas cerebrales se pueden evaluar mediante inmunohistoquímica para verificar la astrogliosis o gliosis causada por la implantación de ventanas y la expresión viral. Nuestros estudios previos demostraron que el procedimiento no inducía gliosis notable7.
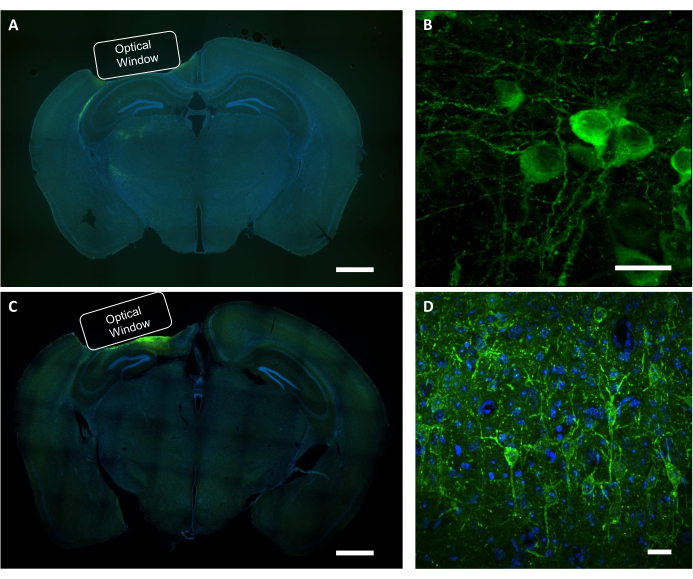
Figura 9: Verificaciónhistológica de la posición de la ventana óptica y la expresión del virus. (A) Una imagen fluorescente representativa de la rebanada cerebral de la sección coronal que muestra la colocación de la ventana óptica desde un ratón que expresa NCaMP. Barra de escala: 1 mm.(B)Imagen confocal representativa de neuronas que expresan los indicadores NCaMP7. Barra de escala: 25 μm.(C)Una imagen representativa de fluorescencia de la rebanada cerebral de la sección coronal que muestra la colocación de la ventana óptica de un ratón que expresa SomArchon. Barra de escala: 1 mm.(D)Imagen confocal representativa de neuronas que expresan los indicadores de SomArchon. Barra de escala: 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1:Análisis cuantitativo de la intensidad relativa de fluorescencia junto con el tiempo de expresión. Por favor, haga clic aquí para descargar este archivo.
Discusión
Aquí se describe un método para la proyección de imagen a largo plazo de la región del hipocampo CA1 en ratones que se comportan. El método se basa en la implantación crónica de una ventana de imagen a medida, que también permite la administración dirigida de virus o fármacos directamente a las neuronas de interés. El actual protocolo consiste en cuatro porciones principales: i) ensamblar del implante de la proyección de imagen; ii) instalación de implantes de imágenes; iii) inyección de virus a través de implantes de imágenes; iv) imágenes funcionales en ratones que se comportan. A continuación describimos y analizamos los pasos críticos en el protocolo, la solución de problemas, las modificaciones y las limitaciones del método. También discutimos la importancia del método y sus posibles aplicaciones alternativas.
Hay varios pasos críticos en el protocolo descrito que son bastante importantes para la cirugía exitosa: (i) preparación de un implante de imágenes de alta calidad; (ii) condiciones quirúrgicas estériles; (iii) aspiración de la corteza; (iv) colocación precisa del implante de imagen; (v) inyección viral. Como indica el paso 1.6, el exceso de soldadura de estaño requeriría una craneotomía más grande y, por lo tanto, aumenta el riesgo de inflamación. También es muy importante utilizar una cantidad adecuada del pegamento óptico adhesivo al fijar el vidrio de la cubierta a la cánula de imagen, como se indica en el paso 1.11, ya que una cantidad insuficiente puede resultar en fugas de líquido cefalorraquídeo en la cánula de imagen y hacerla opaca. Por otro lado, el exceso de adhesivo óptico puede resultar en la disminución de la transparencia de la ventana de vidrio. La posible contaminación del implante de imágenes puede causar una proliferación activa del tejido conectivo debajo de la ventana óptica y/o inflamación grave, lo que llevará a la terminación temprana del experimento. Por lo tanto, el montaje y la preparación del implante de imágenes antes de la cirugía es casi tan importante como el procedimiento quirúrgico en sí.
Durante la cirugía, la parte de la corteza bajo craneotomía es ablada por la aspiración suave, que da lugar a la sangría inevitable. La sangre en el sitio quirúrgico reduce significativamente la visibilidad del tejido cerebral que debe extirparse. Esto complica la evaluación precisa de la profundidad requerida de la ablación tisular. El enrojecimiento cuidadoso del sitio quirúrgico con PBS cada vez antes de aplicar la succión para quitar la porción siguiente de tejido proporciona un mejor control de la profundidad. El tejido cerebral siempre debe extirparse en pequeñas porciones paso a paso confirmando la profundidad del tejido ablacional antes de proceder con más succión. Un control más fino de la succión también se puede lograr con una aguja roma más delgada. Sugerimos usar una aguja de 26 G, sin embargo, más pequeño de 26 G de diámetro es más propenso a la obstrucción. Además, por lo general se necesita mucha práctica para determinar la profundidad precisa de aspiración requerida para cada animal, ya que el color de la corteza, el cuerpo calloso y el hipocampo pueden variar de un ratón a otro(Figura 3).
La inserción y la fijación del implante de la proyección de imagen se deben hacer muy exacto para asegurar la posición más cercana posible de la ventana de la proyección de imagen a la superficie dorsal del hipocampo. El tamaño de la craneotomía preparada debe coincidir estrechamente con el implante y permitir su inserción sin resistencia significativa. Al mismo tiempo, no debe haber ninguna brecha visible entre el cráneo y el implante para garantizar el sellado adecuado y evitar la exposición al tejido cerebral. Se debe aplicar una presión suave y estable en la parte superior del implante durante su sellado al cráneo. Es casi inevitable tener sangre debajo de la ventana de imágenes durante la instalación del implante. Si el procedimiento quirúrgico se realiza correctamente, la ventana debe despejarse en 3-7 días, y la vasculatura cerebral se vuelve claramente visible. También es importante asegurarse de que el virus se inyecta correctamente debajo de la ventana. En el caso de una expresión fallida, el virus se puede reinyectar varias veces.
La complicación principal que encontramos en algunos casos es visibilidad reducida de la ventana de la proyección de imagen. Hay varias razones posibles de la calidad pobre de la proyección de imagen: i) inflamación en curso; ii) excrecencia del tejido conectivo en el vidrio; iii) gran espacio entre la ventana y el hipocampo. La inflamación es causada generalmente por la contaminación durante cirugía o por el implante no correctamente esterilizado de la proyección de imagen. Sugerimos autoclavar los instrumentos quirúrgicos antes y después de cada cirugía, desinfectar el área de la cirugía justo antes del procedimiento, y usar el equipo de protección personal limpio durante la cirugía. Los implantes por imágenes deben limpiarse después de ensamblarse, esterilizarse y almacenarse en condiciones estériles. La consecuencia del tejido conectivo en el vidrio del implante de la proyección de imagen puede ser debido a la contaminación mecánica en la superficie del cristal o al trauma excesivo del tejido cerebral durante la ablación de la corteza. Después de montar el implante, es importante confirmar que la superficie del vidrio está limpia y lisa. Además, todas las piezas de tejido cerebral dañado deben eliminarse cuidadosamente antes de insertar el implante de imágenes en la craneotomía. En ciertos casos, la brecha entre la ventana de vidrio y el hipocampo resulta en la acumulación de líquido cefalorraquídeo, lo que reduce la calidad de las imágenes. Por lo tanto, durante la instalación del implante, es crucial insertarlo todo el camino para garantizar un buen contacto entre el hipocampo y la ventana de vidrio. A veces, es difícil identificar la razón exacta de la ventana de imágenes opacas. Sugerimos realizar análisis post mortem para revelar condiciones debajo de la ventana óptica y ajustar correspondientemente cirugías subsecuentes.
El método tiene varias limitaciones fundamentales y técnicas que se deben tener en cuenta antes y durante la proyección de imagen in vivo. Una de las principales limitaciones es la ablación de la corteza. Parte de la corteza visual y sensorial se extirpa durante la cirugía. Si bien es difícil evaluar con precisión el impacto de la ablación de la corteza, ya que el tejido cerebral extirpado no se proyecta directamente sobre el hipocampo, varios estudios no demostraron un deterioro notable del aprendizaje dependiente del hipocampo u otras funciones relevantes del hipocampo15,16. Las limitaciones ópticas también deben ser consideradas, especialmente cuando se utilizan las altas lentes objetivas del NA. Por ejemplo, en este estudio, utilizamos una cánula de 1,75 mm de largo con un diámetro interior de 1,9 mm. La geometría de esta cánula no preservará el NA completo del objetivo de aire con NA más de ~ 0.5 o el objetivo de agua con NA más de ~ 0.6, ya que recortará algo de luz. Otra limitación, común para todos los implantes de imágenes cerebrales, es que parte del cerebro se está exponiendo, promoviendo así la pérdida de calor17,18. Sin embargo, la temperatura fisiológica del cerebro se puede restaurar fácilmente durante proyección de imagen por la perfusión de un almacenador intermediario caliente.
El método descrito se puede modificar o ajustar fácilmente para otras aplicaciones. Por ejemplo, la preparación se puede adaptar para la proyección de imagen del striatum7. Como el estriado se encuentra un poco más profundo que el hipocampo, la cánula de imágenes más larga se debe utilizar para ensamblar el implante de imágenes. Sugerimos usar la cánula de la proyección de imagen de 2.0 milímetros. Las coordenadas de la craneotomía deben ajustarse en consecuencia (AP: +0,8 mm, ML: −1,8 mm). Además, la inyección de virus a través de cánula de infusión permite lograr la expresión de un transgén en una capa delgada de neuronas cuando se utiliza el serotipo AAV con diseminación restringida19,20. Es particularmente beneficioso para las imágenes de un fotón debido a la reducción de la fluorescencia fuera de foco de capas más profundas y, como resultado, la mejora de las imágenes de resolución unicelular. Además, la cánula de inyección también se puede utilizar durante la toma de imágenes funcionales para la administración de fármacos u otros productos químicos directamente sobre las neuronas en el fov(Figura 5B). En general, la cánula de infusión agrega funcionalidades útiles al implante de imágenes, mejorando la calidad de las imágenes debido a la expresión viral dirigida y permitiendo la estimulación farmacológica de las neuronas en el campo de visión. La placa de cabeza utilizada proporciona una estabilidad extraordinaria de los implantes de imágenes que minimizan los artefactos de movimiento, incluso en animales en movimiento activo en una cinta de correr. La placa de la cabeza es pequeña y ligera, causando molestias mínimas a los animales, y permanece estable durante varios meses después de la instalación. El implante de imagen también es compatible con imágenes multifotónicas15,16,21 y se puede combinar con micro-endoscopios22,23. Un implante similar de la proyección de imagen también fue utilizado para la proyección de imagen del multiphoton de las estructuras más profundas del hipocampo, incluyendo el radiatum del estrato, la laguna del estrato, y la convolución del cerebro dentada16,24,25,26,27. Sin embargo, dirigirse a las estructuras más profundas del hipocampo con AAV a través de la cánula de infusión puede requerir una mayor optimización del serotipo de AAV y el volumen19.
Creemos que el protocolo descrito facilitará los estudios que tienen como objetivo investigar la actividad neuronal con alta resolución espaciotemporal en el hipocampo de ratones que se comportan utilizando configuraciones de imagen de un fotón simples y asequibles.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a todos los miembros del Grupo de Bioingeniería Molecular de la Universidad de Westlake por toda la ayuda y la discusión útil. También agradecemos a Jinze Li y Jie-Min Jia de la Universidad de Westlake por la ayuda con la filmación del procedimiento quirúrgico.
Este trabajo fue apoyado por fondos adicionales de la Fundación de la Universidad de Westlake, la Beca de Joven Investigador BBRF 2020 y la subvención de la Fundación Nacional de Ciencias Naturales de China 32050410298 todo a K.D.P.
Materiales
| Name | Company | Catalog Number | Comments |
| Cover glass | Deckgläser | 72296-03 | |
| Denture Base Resin | ShangHai New Centery Dentel Material | N/A | Type I, self-solidifying |
| Dummy Cannula | RWD Life Science Co.,LTD | 62102 | OD 0.30mm |
| Guide Cannula | RWD Life Science Co.,LTD | 62003 | 26G |
| Head Fork | N/A | N/A | Custom made |
| Head Plate | N/A | N/A | Custom made |
| Imaging Cannula | N/A | N/A | Custom Made; OD 3mm, ID 2.7mm, Height 1.8mm, #108 stainless steel |
| Internal Cannula | RWD Life Science Co.,LTD | 62203 | 0.30*0.14 (OD*ID, mm) |
| Kwik Sil | World Precision Instruments | KWIK-SIL | |
| SuperBond C&B | SUN MEDICAL | N/A | SuperBond C&B kit |
| Treadmill Kit | N/A | N/A | Custom made |
| UV-cured Adhesive | NORLAND PRODUCTS | NOA 60 |
Referencias
- Leutgeb, S., et al. Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science. 309 (5734), 619-623 (2005).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Polanco, J. C., et al. Amyloid-β and tau complexity - towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2018).
- Henneman, W. J. P., et al. Hippocampal atrophy rates in Alzheimer disease. Added value over whole brain volume measures. 72 (11), 999-1007 (2009).
- Camicioli, R., et al. Parkinson's disease is associated with hippocampal atrophy. Mov Disord. 18 (7), 784-790 (2003).
- Piatkevich, K. D., Murdock, M. H., Subach, F. V. Advances in Engineering and Application of Optogenetic Indicators for Neuroscience. Applied Sciences. 9 (3), 562 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Fan, L. Z., et al. All-Optical Electrophysiology Reveals the Role of Lateral Inhibition in Sensory Processing in Cortical Layer 1. Cell. 180 (3), 521-535 (2020).
- Shemesh, O. A., et al. Precision Calcium Imaging of Dense Neural Populations via a Cell-Body-Targeted Calcium Indicator. Neuron. 107 (3), 470-486 (2020).
- Villa, K. L., et al. Inhibitory Synapses Are Repeatedly Assembled and Removed at Persistent Sites In Vivo. Neuron. 89 (4), 756-769 (2016).
- Franklin, K. B. J., Paxinos, G. . Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , (2013).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Subach, O. M., et al. Novel Genetically Encoded Bright Positive Calcium Indicator NCaMP7 Based on the mNeonGreen Fluorescent Protein. International Journal of Molecular Sciences. 21 (5), 1644 (2020).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Kalmbach, A. S., Waters, J. Brain surface temperature under a craniotomy. Journal of neurophysiology. 108 (11), 3138-3146 (2012).
- Roche, M., et al. In vivo imaging with a water immersion objective affects brain temperature, blood flow and oxygenation. eLife. 8, 47324 (2019).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neuroscience Research. 93, 144-157 (2015).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H., Manfredssonn, F. P. . Gene Therapy for Neurological Disorders: Methods and Protocols. , 133-149 (2016).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), (2016).
- Yashiro, H., Nakahara, I., Funabiki, K., Riquimaroux, H. Micro-endoscopic system for functional assessment of neural circuits in deep brain regions: Simultaneous optical and electrical recordings of auditory responses in mouse's inferior colliculus. Neuroscience Research. 119, 61-69 (2017).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution In Vivo Imaging of Hippocampal Dendrites and Spines. The Journal of Neuroscience. 24 (13), 3147 (2004).
- Busche, M. A., et al. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proceedings of the National Academy of Sciences. 109 (22), 8740 (2012).
- Attardo, A., et al. Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Castello-Waldow, T. P., et al. Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. PLOS Biology. 18 (11), 3000928 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados