Method Article
行为小鼠希波坎帕的神经元活动可视化的颅骨切除术
摘要
本文演示了定制成像窗口的制备,并辅以输液管,并将其植入小鼠海马的CA1区域。
摘要
在清醒动物中以单细胞分辨率成像神经元活动是研究系统神经科学神经回路功能的一种非常有力的方法。然而,哺乳动物组织中高吸收和光散射将内视成像主要限制在表面大脑区域,使深脑区域(如海马)无法进行光学显微镜检查。在这段视频中,我们展示了定制成像窗口的准备和植入,以便对头部固定行为小鼠的背部海马 CA1 区域进行慢性 体内 成像。定制窗口辅以输液管,允许有针对性地将病毒载体和药物输送到成像区域。通过将这种制备与广域成像相结合,我们使用来自大块神经元组的荧光钙指示器对神经元活动进行了长期记录。我们还演示了这种具有单尖峰分辨率的电压成像制备的适用性。高性能的神经元活动基因编码指标和科学的CMOS摄像机允许以高时间分辨率反复可视化单个神经元的亚细胞形态细节。我们还讨论了上述方法的优势和潜在局限性,以及它与其他成像技术的兼容性。
引言
海马是一个关键的大脑区域,负责学习和记忆1以及空间导航2。河马萎缩与神经和精神疾病有关,包括记忆丧失和认知衰退3,4,5。在小鼠中,海马体是研究细胞和网络4级、5级空间、上下文和关联学习和记忆形成的非常成熟的模型。学习和记忆的机械学研究需要对行为小鼠的神经元结构和功能进行纵向询问。荧光成像与基因编码探针6相结合,提供了前所未有的能力,记录膜电压动力学7,8,钙瞬态9,和结构变化10在神经元内大子集。然而,小鼠进入海马的光学通道受到皮层的阻塞,皮层的厚度可能超过1毫米。在这里,我们描述了一个程序,组装一个定制的成像设备,并将其长期植入小鼠头,以便长期光学访问在行为小鼠的背部海马的CA1亚区域。注入纳入成像植入物的输液管允许将病毒或药物直接传到视场的神经元上。所述制备与广场显微镜相结合,能够长时间对行为小鼠中大型神经元子集进行反复成像。我们利用这种制剂,通过有针对性地注入重组腺相关病毒(rAAV),以单细胞分辨率进行神经元活动记录,来表达海马CA1区域的钙和电压基因编码指标。我们还对相应的神经元子集进行了纵向钙成像,其空间分辨率很高。此外,这种制备与多光显微镜和显微镜相容,从而进一步扩大成像技术的工具箱,以研究小鼠细胞和细胞亚细胞水平的神经元网络。我们描述了协议的关键步骤和故障排除。我们还讨论了该方法可能的缺陷和局限性。
研究方案
此处描述的所有方法均已获得西湖大学机构动物护理和使用委员会 (IACUC) 的批准。
1. 植入物组装
注:成像植入物的组装在技术上很简单,只需要市售物品(图1,另见 材料表)。头板可以在当地机器车间使用不锈钢或钛板制造。我们建议在开始手术之前准备一批完全组装的植入物。 在体内 实验完成后,植入物可以恢复并多次重复使用。在某些情况下,它可能只需要通过焊接或更换盖玻璃重新连接输液管。
- 准备所有六个关键硬件组件组装和安装成像植入物 (图 1)。
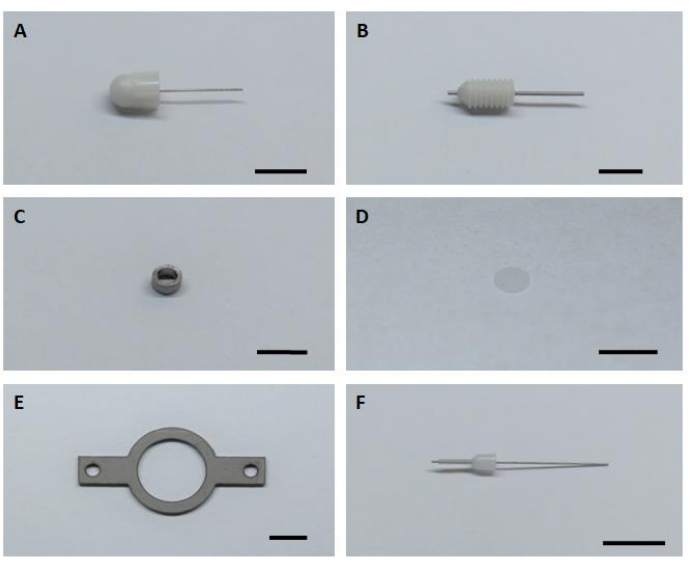
图1:用于组装和安装成像植入物的六个关键硬件组件。(B) 指南坎努拉.(C) 成像管。(D) 玻璃盖玻璃。(E) 车头板。(F) 内部坎努拉.比例栏:5毫米。请单击此处查看此图的较大版本。
- 打开焊接机,加热到所需的温度。
注:温度取决于使用的焊接锡。 - 使用细砂纸去除氧化层,从而促进更坚固的焊接,从而对成像罐头的侧面进行抛光。
- 使用帮助手调整成像管和注射管的位置(带插入假管的导管)(图2A,B)。
- 使用带针头的注射器,在成像和注射罐之间的连接点上涂抹少量适当的通量5秒钟,然后取出液滴。
注意:对于此制备,我们使用制造商指定的市售通量,用于焊接不锈钢部件,因为成像和输液罐由不锈钢制成。在用于制造罐头的其他材料中,最终用户应选择可以焊接所选材料的通量。 - 熔化焊接锡,并将其应用到用通量处理的连接点(图2)。
注意:避免过量焊接锡,因为它将需要不必要的更大的颅骨切除术在手术期间。
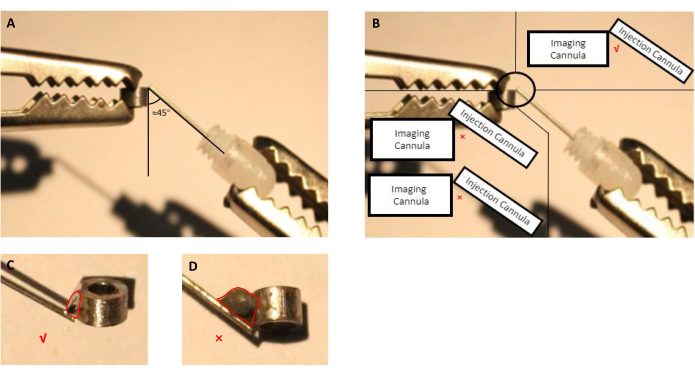
图2:组装注射管的原理图,由带插入假管的导管和成像罐头组成。 (A) 注射管和成像管之间的角度应接近45度。(B) 注射管的尖端应就在成像管的边缘。(C) 用于焊接成像和注射罐的焊接锡的适当尺寸(红线表示锡液滴的轮廓)。(D) 在植入准备过程中应避免的焊接锡尺寸不当(红线表示锡液滴的轮廓)。 请单击此处查看此图的较大版本。
- 等待焊接锡冷却。通常,它需要几秒钟。
- 确认注射管不会通过从两个方向插入假管来阻止。
- 使用牙签或 26 G 注射器针在成像管底部涂抹紫外线固化光学胶粘剂。
- 使用细钳小心放置与成像管相当大小的盖玻璃。
注意:玻璃的定位必须精确到成像管上,一旦触及光学胶粘剂,就不要移动玻璃太多。否则,玻璃会变脏,从而降低成像质量。 - 通过标准手持式紫外线灯的 350-400 nm UV 照明,将胶粘剂固化至少一小时。
注意:所用的粘合剂必须是光学透明的。否则,它会降低成像窗口的质量。
注意:戴防紫外线眼镜、手套和实验室外套,避免皮肤和眼睛暴露。 - 将管子清洗在70%的乙醇中,空气干燥,并储存在无菌容器中,直到手术。
注意:保持盖玻璃尽可能清洁和完好无损是非常重要的。使用的光学胶粘剂在70%乙醇中具有化学稳定性。
2. 窗口植入
- 手术前的准备步骤
- 在高压灭菌器械中消毒。
- 在两个独立的培养皿中准备1倍PBS和70%乙醇。
- 可选:在开始手术前,使用紫外线对手术区域进行至少 20 分钟的消毒。
注:在最无菌条件下操作将导致成功和持久(长达6个月)玻璃覆盖的颅窗。污染可能导致窗口透明度降低或严重炎症在大多数情况下。
- 手术
- 手术前用70%的乙醇消毒手术区。
- 根据 IACUC 批准的动物协议,称重动物并按皮下管理手术前镇痛剂剂量。
- 用异氟兰麻醉小鼠(感应4%,维护1.5-2%,空气流量0.3-0.5L/分钟)。使用尾部捏捏和脚趾捏技术,以确保动物完全镇静。观察动物的生命体征,如呼吸、SPO2和心率。
- 使用修剪器或脱脂霜将毛皮从颈部后部移到眼睛。
- 将鼠标置于立体氧化框架中,置于手术加热垫上(保持 37 °C)。用耳栏固定头部。稍微将头部向四面八方推,以确保头部牢固固定。
- 应用眼药膏,以防止动物的眼睛在手术过程中干涸。
- 在切口之前,用β丁对手术部位进行消毒,然后用70%的乙醇消毒三次。
- 取出头骨顶部的皮肤,从头部底部的水平切口开始,然后沿轮盘方向进行两次切口,几乎到达眼睑,然后两个斜切在中线收敛。
- 用两个无菌棉签,缩回连接组织,以及颈部后部的肌肉,到头骨的边缘。
注意:在操作过程中尽量避免损坏血管(尤其是隐藏在肌肉中的血管)。 - 将一滴利多卡因溶液(约0.1 mL)涂抹在围产层表面2分钟,以避免过度疼痛。可选地减少大脑在切除头骨后肿胀,0.1 mL的1%脱氧酮可以注射皮下。
- 用手术刀轻轻刮伤头骨的整个暴露区域,形成干燥粗糙的表面,使胶水和牙水泥粘附得更好,从而导致慢性植入。
- 将安装在立体塔上的针尖放在树皮上,设置所有三个坐标(美联社:前后:ML: 中间-拉塔尔:DV: 多尔萨尔-文特尔) 为 0。
- 将针尖放在lamda上,看看AP坐标是否为0,以确认头部位置是垂直的,以及ML坐标是否为0,以确认头部水平定位。如果没有,调整立体声站上的相应旋钮,直到 AP 和 ML 坐标都在 0.1 mm 以内。
- 移动针尖,找到颅骨切除术的相应点,并用精细的标记标记它们在头骨上的位置。在海马体植入的情况下,有4点与以下坐标(AP:-0.68,ML:-2.0)(AP:-3.68, ML: -2.0) (AP: -2.18, ML: -0.5) 和 (AP: -2.18, ML: -3.5)11,以及 (AP: -4.0, ML: -2.0) 注射罐最牛角.
注意:此步骤中使用的标记必须在手术前至少一小时使用紫外线照明进行消毒。此处显示的坐标为 6-8 周大的 C57BL/6J 小鼠。坐标可能因小鼠的年龄或菌株而不同。 - 根据四个标记点绘制一个圆,以及圆的考达尔侧注射管区域的轮廓(图 3)。
- 以 10,000 rpm 的速度使用气动钻头,沿着头骨上标记的轮廓轻轻"绘制"。
- 钻头骨,直到留下一层非常薄的骨头,通常开始在中心温柔的触摸下摆动。
- 将一滴无菌 1x PBS 涂抹到颅骨切除术中心,用非常薄的尖钳或两根从对面接近的 26 G 针从头骨中抬起骨瓣。
注:PBS将帮助取出头骨,防止杜拉12号可能出血。 - 应用 PBS,然后通过 26G 钝针多次轻轻吸气,以清洁杜拉表面。
- 通过吸气或眼切刀轻轻取出杜拉。应用温和的吸力(~-60kPa)来消融皮层,以及海马上方的语料库。
注:皮层通常比语料库更黄,皮层通常比海马更白。当从顶部观察到神经元纤维时,语料库通常很容易被垂直和水平方向的神经元纤维区分开来(图3)。
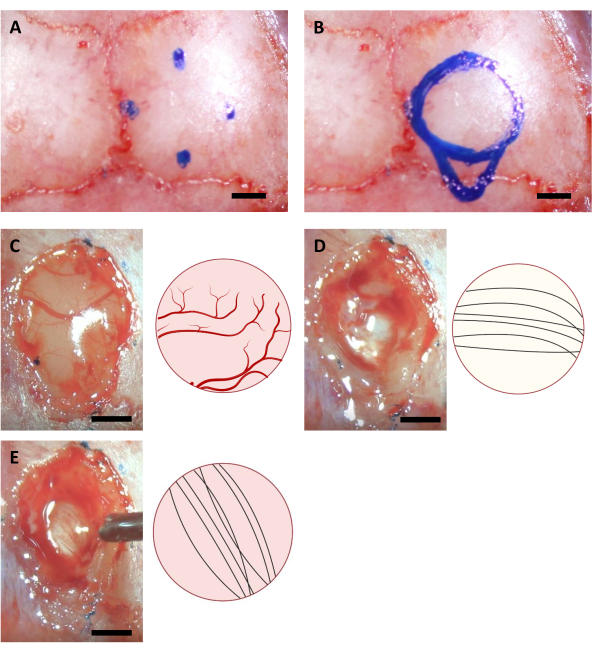
图3:海马位置和脑消融过程的立体毒性坐标。 ( A ) 颅骨切除术区域边缘的四个坐标。(B) 完整的颅骨切除区。(C-E)手术期间获得的代表性图像(左)及其示意图图(右),指示皮层消融期间可见的(A) 皮层(B)科珀斯卡洛苏姆和(C)希波坎巴斯神经纤维的不同颜色和方向。比例栏:1毫米。 请单击此处查看此图的较大版本。
- 此时出血会影响颅骨切除术中脑组织的可见性。应用1x PBS,然后轻轻吸气,同时吸气皮层以去除血液。
注意:在这一步中持续出血是不可避免的,在某种程度上,连续出血是血压正常的表现。与皮层成像窗口植入不同,光学窗口下的血液是可以接受的,因为手术后几天就会清除。在使皮层消融后,尽快将成像管插入创建的腔中是最佳的。 - 如果颅骨切除术比成像管大<0.5毫米,则在用SutraBond固定植入物之前,使用额外的Kwik Sil密封技术,在一定程度上挽救了坎努拉的安装。
- 如果颅骨切除术比成像管小<0.5毫米,则使用细钳或一对眼切刀修剪颅骨切除术边缘,在一定程度上挽救手术过程,因为颅骨切除术边缘的剩余骨骼因钻探而比头骨本身更薄。
注:超过0.5毫米范围的颅骨切除术无法挽救。在这些情况下,相应的行动应遵循动物协议的终止程序。
- 轻轻地将植入物插入颅骨切除术。
- 用 L 形针牢牢地按压植入物顶部,以尽可能靠近海马体的外露表面,使植入物的光学窗口位置尽可能接近。在植入物周围的头骨上反复涂抹 PBS,然后吸吸,在植入过程中尽可能多地去除血液。然后在植入物和头骨之间涂抹一层薄薄的Kwik Sil,以防止牙齿水泥穿透头骨下部(图4)。
- 确保植入物的光学窗口的位置与海马体对比,以避免下面积聚血液或其他液体。
注意:关键是确保成像管的盖玻璃直接放置在海马体上,在安装和密封过程中,海马可能需要对管顶部施加温和的压力。只要将光学窗口置于海马体上,成像管的上侧是否与头骨平行对于最终的光学访问就不至关重要。 - 根据 CA1 区域上方皮层的平均厚度,将头骨表面上方成像管的上表面保持约 0.5 毫米,以便于将骨管附着到头骨上(图 4)。
- 确保植入物的光学窗口的位置与海马体对比,以避免下面积聚血液或其他液体。
- 一旦 Kwik Sil 治愈,通常不超过 +1 分钟,在头骨表面、Kwik-Sil 表面和植入物的上表面均匀地应用超级债券 C&B。
- 一旦超级债券C&B被治愈,应用假牙基树脂以上的超级债券C&B,以及皮肤周围的切口在手术开始。
注:多种供应商提供其他类型的水泥。按照相应的制造商的说明操作。 - 假牙碱脂固化后,将头板放在植入物周围的树脂上,使其与成像管心同心。在头板周围和上方涂抹更多的假牙基树脂,以固定其位置。让它治愈几分钟。
- 避免在管子周围积筑一层厚厚的水泥,以确保使用目标镜头更好地进入成像窗口(图4)。
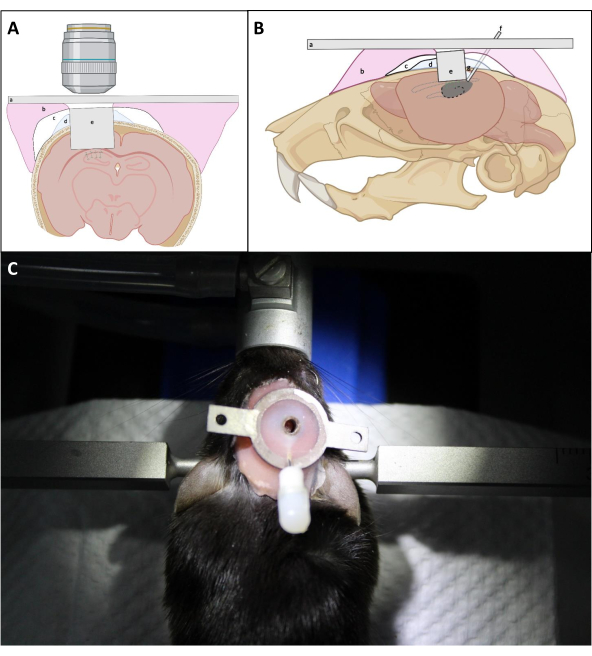
图4:在(A)日冕和(B)下垂视图中植入窗口的示意图图。 (a) 头板:(b) 假牙基树脂:(c) 超棒:(d) 奎克-西尔:(e) 成像管:(f) 注射罐:(g) 焊接锡。(C): 手术后安装植入物的鼠标。 请单击此处查看此图的较大版本。
- 稀释假牙基树脂以降低其粘度,从而使其能够填充与施用器难以触及的警告。
- 轻轻地将绝缘橡胶胶带放在窗户上方,以保护窗户免受动物床上用品可能造成的污染。
- 手术结束后,皮下注射抗炎药物,以防止炎症反应。
- 将动物放在一个温暖的笼子里,直到它从麻醉中恢复过来。
- 通过观察一般行为,检查小鼠手术后72小时的健康状况。抗炎药物和镇痛剂每24小时注射两三天皮下,以释放疼痛和减少炎症反应。
注:术后护理可以进行替代监测程序、药物和剂量,请参阅 IUCAC 批准的动物协议,了解确切程序。 - 手术后5-7天检查窗口,观察窗口下的血管。在一个清晰的窗口的情况下,动物准备注射病毒。
3. 病毒注射
注:病毒注射通常在手术后5-7天内进行。在注射病毒之前,必须确认成像窗口是清晰的,并且可以观察脑血管(图5)。在某些情况下,可能需要长达 14-16 天才能清除窗口,如果没有检测到脑部炎症,这也是可以接受的。
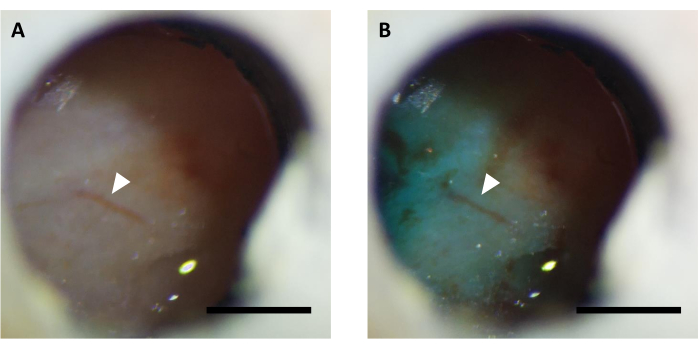
图5: 病毒注射前和(B)后光学窗口(A)的代表图像,辅以快速绿色染料。 箭表示相同的血管结构。比例栏:1毫米。 请单击此处查看此图的较大版本。
- 在 PCR 管中以 1:9 的比例将快速绿色染料库存溶液添加到病毒溶液中,稀释到所需的滴定器中。
注意:添加快速绿色染料,便于注射期间病毒溶液的可视化。 - 将聚乙烯管与注射器连接起来,然后使用注射器泵将管子与矿物油回填。
- 将内部管子连接到管子的另一端,多次注入和提取矿物油,以确保内部管子不会堵塞。
- 用异氟兰麻醉动物(感应4%,维护1.5-2%,空气流量0.3-0.5L/分钟),将头部固定在加热垫上的立体氧化框架中(保持37°C),涂抹眼药膏。
- 提取病毒溶液的 600 nL,取出假管,并将连接到注射注射器的内部管插入导管中,以 50 nL/min 的速度注入病毒,总共 10 分钟。
注:使用立体显微镜检查染料是否通过窗口可见,以确认病毒注射成功(图5)。 - 注射后,保持内部管连接10分钟,使病毒在窗口下传播。
- 轻轻地从导管中取出内部管子,用假管重新回顾它。
- 将动物放在一个温暖的笼子里,直到它从麻醉中恢复过来。
注:通常,小鼠在病毒注射后10-20天内即可成像。表达水平和时间取决于用于驱动基因表达的病毒血清型和促进器。
4. 在广域显微镜下对清醒小鼠进行成像。
注:准备好的头板提供成像植入物的非凡稳定性,从而允许在清醒和行为小鼠的纵向成像与最小的运动神器。
- 用4%异氟兰诱导鼠标几分钟,将头板固定在头部叉上,然后将头叉固定在跑步机上。
注:头叉和跑步机是针对本研究中使用的车头板定制的,请参阅相应的 cad 文件的支撑材料。在头部固定之前诱导小鼠是可选的,因为可以为此程序习惯动物。 - 将跑步机移到显微镜台下,将光学窗口定位在客观镜头下。
- 使用低倍率目标透镜找到功能成像的最佳视场 (FOV),然后切换到更高的 NA 客观镜头,以单细胞分辨率记录神经元活动。
注意:如果注射管仍然是目标透镜实现工作距离的障碍,请使用钢丝剪刀切断头部板上的注射管。
结果
在神经元活动体内成像使用基因编码的钙指示器。平均而言, 如果 实现足够的转基因表达水平,体内成像在植入后 3-4 周开始。此时,脑水肿和出血通常完全解决,大脑血管可以通过光学窗口轻松观察。在这里,我们利用所述的准备,在荧光广域显微镜下对行为小鼠的后部海马CA1区域的神经元活动进行反复记录。为了记录神经元活动,我们使用了一个明亮的基因编码钙指示器,名为NCaMP713,它表现出与GCaMP6s14类似的钙敏感性和时间分辨率。为了表达海马中的NCaMP7指示器,我们使用输液管注射了rAAV/DJ-CAG-NCaMP7病毒,并在注射后14天启动经度成像。为了记录神经元活动,我们使用了 10 倍 NA 0.3 空气目标镜头和 Hamamatsu OrcaFusion sCMOS 相机,允许在高达 100 Hz 频率下以 +1.5x1.5 mm FOV 进行成像。绿色荧光被一个商用的470纳米LED使用标准的GFP过滤器集兴奋。在绿色通道中实现的成像平均深度约为 50-120 μm,这允许主要记录地层或地层金字塔中的神经元活动。近红外通道的成像深度可达200 μm,到达海马8的深层。每个 FOV 的平均记录时间为 6-12 分钟,尽管由于 NCaMP7 具有极高的光敏度,且未观察到可检测的光毒性(图6),因此可以进行更长的成像会话。
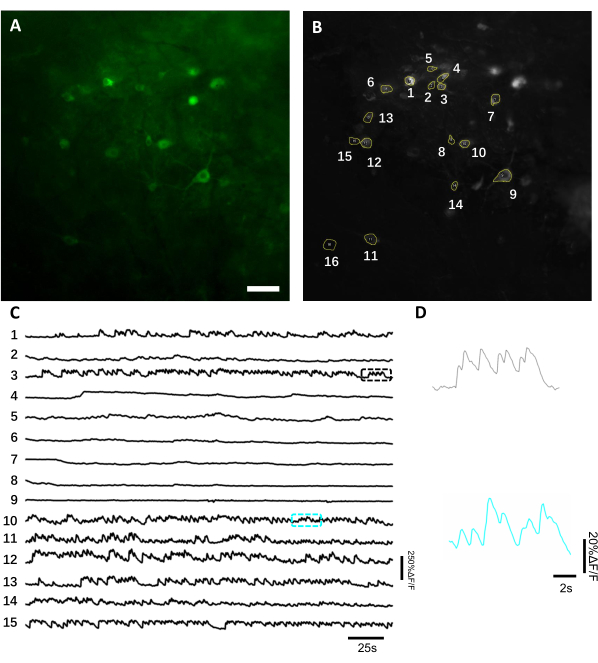
图6:使用绿色荧光基因编码钙指标记录海马神经元的神经元活动。 (B) 与 A 中显示的单个神经元相对应的 15 个 15 个 15 个 15 个 1000 个 15 个 15 个 15 个 1ROI,使用整个记录的标准偏差投影进行选择。(C) B.D 中 15 个选定的神经元的代表性荧光单试验痕迹 具有代表性的 放大视图 C. Scale 栏中显示的相应颜色框中显示的 2 个钙痕迹, 100 μm.请单击此处查看此图的更大版本。
为了获得荧光痕迹,对应于神经元索玛斯的兴趣区域(ROIs)进行了手动分割,并通过 ImageJ 软件进行分析。在图像分析运动校正之前,不需要在清醒动物身上进行常见的记录后程序,因为由于成像植入物的高稳定性,获得的数据集没有显示运动文物。 图6中介绍了一只醒着行为小鼠中海马的神经元活动具有代表性的单试验光学记录。15 个与神经元 somas 相对应的投资回报率是从 图 6B中显示的同一 FOV 中手动选择的,每个投资回报率内的单次试用荧光痕迹显示在 图 6C中。 图6D 显示了来自两个不同投资回报率的荧光痕迹的两个具有代表性的部分。我们为同一 FOV 连续执行了 4 次成像会话,间隔 3 天。在某些 FOV 中识别和成像相同的神经元至少两周是可能的(此研究没有进行更长的成像过程,但是,在以前 7 只小鼠中,同样的制图工作已用于长达6个月的成像研究: 图7)。在这项研究中,我们使用了AV/DJ-CAG载体,即使在病毒传播21天后(补充图1),它就强烈地表达了对兴趣基因的兴趣。由于荧光背景的增加和表达钙指示器的新神经元的出现,连续表达使同一神经元的长期识别变得复杂。因此,选择AAV血清型和促进器来驱动目标基因表达应该是实验设计中的重要考虑因素之一,特别是如果需要对同一部分神经元的纵向成像。成像质量允许解决近邻树突,以及可视化血管。
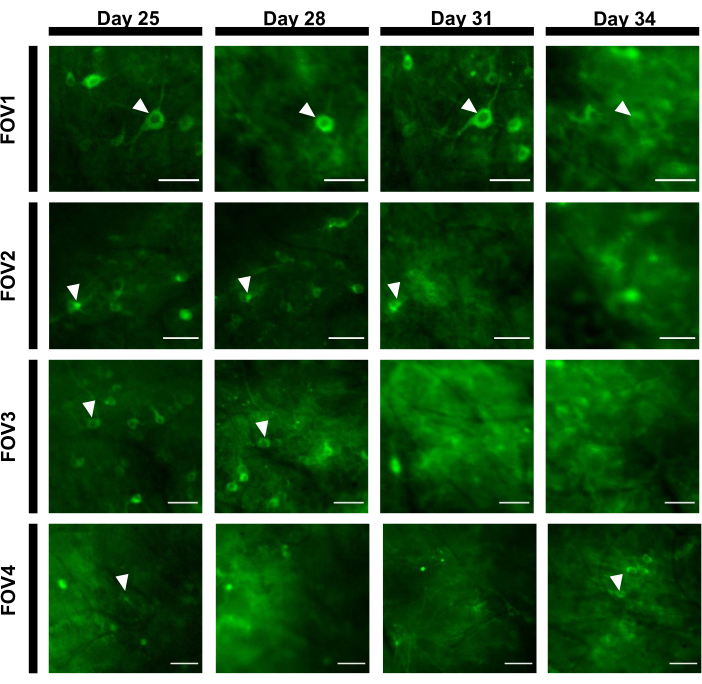
图7:海马区四个不同的FOV的图像序列跟踪超过12天。 动物在第0天被植入窗户,第7天注射了rAAV/DJ-CAG-NCamp7病毒。箭头指示在 FOV 内跟踪的神经元。比例栏: 80μm. 请单击此处查看此图的更大版本。
使用基因编码的电压传感器对神经元活动进行体内成像。
在这项研究中,我们还使用了一种名为SomArchon7的新型基因编码电压传感器,它允许在行为动物7、8时采用单细胞单尖峰分辨率的电压成像。为了表达SonArchon,我们使用输液管注射了rAAV/DJ-CAG-索马琼病毒,并在注射后几天在头部固定的老鼠身上进行了电压成像。为了记录神经元活动,我们使用了 40 倍 NA 0.8 目标镜头和 Hamamatsu OrcaFusion sCMOS 相机,使我们能够以高达 830 Hz 的采集速率对 150x40μm FOV 进行成像。GFP 蛋白是 SomArchon 构建的一部分,用于促进光谱可见范围内表达的可视化,可在绿色通道(LED 激发度为 470/20 nm,发射 525/50 nm)中轻松成像,以定位电压成像感兴趣的单元。在近红外信道(激光激发637纳米3.4 W/mm2,发射665 nm长通)进行光电压记录,4×4以830 Hz采集速率进行装箱。我们记录了一只清醒小鼠的海马神经元的自发活动,每个动作电位平均SNR为7(图8)。
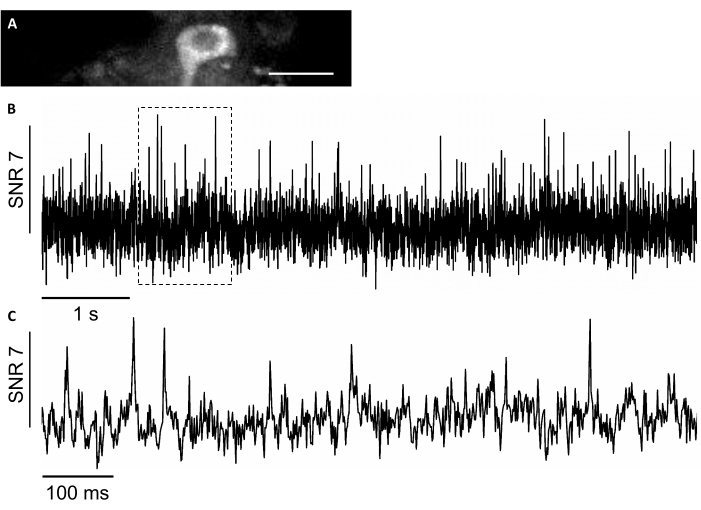
图8:使用近红外荧光基因编码电压指示器SohmArchon记录海马神经元的神经元活动。 (A) 在近红外通道的广域荧光显微镜下拍摄的选定 FOV。(B) A. (C) 中神经元的单试荧光痕迹,B. 比例栏中显示的相应框中的电压痕迹的代表性放大视图:25 μm。 请单击此处查看此图的较大版本。
组织学
功能成像研究完成后,使用验尸分析来确认植入物的正确位置、病毒表达区域以及图像神经元中感兴趣的蛋白质的本地化。为了组织验证病毒的表达和植入物的放置,在荧光广场显微镜(图9A,C)下检查了PFA固定大脑的冠状部分。 共焦显微镜用于获取表达钙指示器的单个神经元的高分辨率图像,以及电压指示器(图9B,D)。DAPI染色用于可视化大脑切片的整体形态。此外,脑片可以使用免疫造血术进行评估,以验证窗口植入和病毒表达引起的天文胶质疏松症或滑翔。我们先前的研究表明,这个程序并没有引起明显的胶质疏松症。
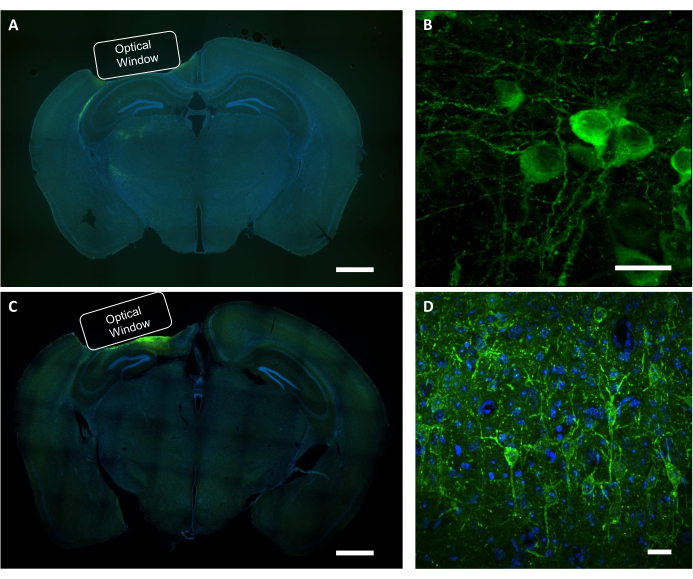
图9:对光学窗口位置和病毒表达的组织学验证。 (A) 日冕部分大脑切片的代表性荧光图像,显示来自NCaMP表达鼠标的光学窗口的位置。比例杆:1毫米(B)神经元代表的对焦图像,表示NCaMP7指标。比例杆:25μm. (C) 日冕部分大脑切片的代表性荧光图像,显示来自 SomArchon 表达鼠标的光学窗口的位置。比例杆:1毫米(D)神经元代表的共聚焦图像,表达索马肯指标。比例栏: 25μm. 请单击此处查看此图的更大版本。
补充图1:对相对荧光强度以及表达时间的量化分析。请单击此处下载此文件。
讨论
在这里,我们描述了一种长期成像海马CA1区域的方法。该方法基于定制成像窗口的慢性植入,这也使病毒或药物的靶向管理直接到感兴趣的神经元。本协议由四个主要部分组成:一) 成像植入物的组装:(二) 安装成像植入物:iii) 通过成像植入注射病毒:iv) 行为小鼠的功能成像。下面我们描述和讨论协议中的关键步骤、故障排除、修改和方法的局限性。我们还讨论了该方法的重要性及其潜在的替代应用。
在所述协议中有几个关键步骤对于成功的手术非常重要:(一) 准备高质量的成像植入物:(二) 无菌手术条件:(三) 皮层的渴望;(四) 成像植入物的精确放置:(v) 病毒注射。正如步骤 1.6 所示,过量焊接锡需要更大的颅骨切除术,从而增加炎症的风险。正如步骤 1.11 所示,在将盖玻璃固定到成像罐中时,使用适量的胶粘剂光学胶水也非常重要,因为量不足可能导致脑脊液泄漏到成像管中,使其不透明。另一方面,过量的光学胶粘剂会导致玻璃窗透明度降低。成像植入物可能受到污染,可能导致光学窗口下结缔组织活跃增殖和/或严重炎症,这将导致实验提前终止。因此,手术前的成像植入物组装和准备几乎与外科手术本身一样重要。
在手术过程中,颅骨切除术下皮层的一部分被温柔的渴望所消融,导致不可避免的出血。手术部位的血液显著降低了必须切除的脑组织的可见性。这使组织消融所需深度的精确评估复杂化。在应用吸力去除组织下一部分之前,每次都要用 PBS 小心地冲洗手术部位,从而更好地控制深度。脑组织应始终以小份分步切除,以确认消融组织的深度,然后再进行更多的吸力。更精细的吸力控制也可以用更薄的钝针实现。我们建议使用26G针,但是,小于26G直径更容易堵塞。此外,通常需要大量的实践来确定每种动物所需的精确渴望深度,因为皮层、体质和海马的颜色可能因小鼠而异(图3)。
应非常精确地插入和固定成像植入物,以确保成像窗口尽可能接近海马体的后部表面。准备的颅骨切除术的大小应与植入物紧密匹配,并允许其插入,没有明显的阻力。同时,头骨和植入物之间不应有明显的间隙,以确保适当的密封和避免脑组织暴露。在植入物密封到头骨时,应向植入物顶部施加温和而稳定的压力。在植入装置期间,几乎不可避免的是成像窗口下有血液。如果手术做对了,窗户应该在3-7天内清理干净,脑血管变得清晰可见。确保病毒在窗口下正确注射也很重要。在表达失败的情况下,病毒可以多次重新弹出。
在某些情况下,我们遇到的主要并发症是成像窗口的可见性降低。成像质量差有几个可能的原因:一) 持续炎症:ii) 玻璃上结缔组织生长:iii) 窗户和海马之间的巨大差距。炎症通常是由手术过程中的污染或未正确消毒的成像植入物引起的。我们建议在每次手术前后自动切割手术器械,手术前立即对手术区进行消毒,并在手术过程中佩戴干净的个人防护设备。成像植入物应在组装、消毒和储存在无菌条件下后进行清洁。成像植入物玻璃上的结缔组织生长可能是由于玻璃表面的机械污染或皮层消融期间脑组织的过度创伤。组装植入物后,确认玻璃表面清洁光滑非常重要。此外,所有受损的脑组织在将成像植入到颅骨切除术中之前都必须小心切除。在某些情况下,玻璃窗和海马之间的间隙会导致脑脊液的积累,降低成像质量。因此,在植入安装过程中,必须一直插入它,以确保海马体和玻璃窗之间的良好接触。有时,很难确定不透明成像窗口的确切原因。我们建议进行验尸分析,以揭示光学窗口下的情况,并相应地调整后续手术。
该方法有几个基本和技术限制,应考虑在体内成像之前和期间。其中一个主要限制是皮层消融。手术期间切除部分视觉和感觉皮层。虽然很难精确评估皮层消融的影响,因为被切除的脑组织不会直接投射到海马体上,但一些研究表明,海马依赖性学习或其他相关的海马功能没有明显受损。还应考虑光学限制,特别是当使用高 NA 客观透镜时。例如,在这项研究中,我们使用了1.75毫米长的内径为1.9毫米的管子。此管的几何形状不会保留完整的 NA 空气目标与 NA 超过 0.5 或水目标与 NA 超过约 0.6,因为它将夹住一些光。另一个限制,常见的所有脑成像植入物,是大脑的一部分被暴露,从而促进热量损失17,18。然而,通过灌注温暖的缓冲液,在成像过程中可以轻松恢复生理脑温。
所述方法可以很容易地修改或调整其他应用程序。例如,该制剂可以适应纹状体7的成像。由于纹状体比海马体稍深,成像管应用于组装成像植入物的时间越长。我们建议使用2.0毫米成像管。颅骨切除术的坐标应相应调整(AP: +0.8 mm,ML: −1.8 毫米)。此外,通过输液管注射病毒,允许在使用AAV血清型时,在细薄的神经元层中实现转基因的表达,并限制传播19,20。由于更深层的聚焦外荧光减少,因此改善了单细胞分辨率成像,因此对单光子成像特别有益。此外,注射管也可以用于功能成像,直接在FOV(图5B)的神经元上施用药物或其他化学物质。整体输液管为成像植入物增添了有用的功能,由于有针对性的病毒表达,提高了成像质量,并使 FOV 中的神经元能够进行药理刺激。使用过的头板提供显像植入物的非凡稳定性,即使在跑步机上主动移动的动物中,也可最大限度地减少运动物件。头板小而轻,对动物的不适程度极小,安装后几个月保持稳定。成像植入物还与多光成像15、16、21兼容,可与显微内窥镜22、23结合。类似的成像植入物也用于多光子成像的更深的海马结构,包括地层半径,地层拉库诺塞,和凹陷陀螺16,24,25,26,27。然而,通过输液管瞄准AAV的更深海马结构可能需要进一步优化AAV血清型和体积19。
我们相信,上述协议将促进研究,旨在利用简单且经济实惠的单光子成像设置,调查行为小鼠海马体内具有高空间空间分辨率的神经元活动。
披露声明
作者没有什么可透露的。
致谢
我们要感谢西湖大学分子生物工程组全体成员的帮助和有益的讨论。我们也感谢来自西湖大学的李金泽和贾杰敏在拍摄外科手术方面所提供帮助。
这项工作得到了西湖大学基金会的启动资金、2020年BRF青年研究员资助和中国国家自然科学基金的启动资助,32050410298全部捐赠给K.D.P.
材料
| Name | Company | Catalog Number | Comments |
| Cover glass | Deckgläser | 72296-03 | |
| Denture Base Resin | ShangHai New Centery Dentel Material | N/A | Type I, self-solidifying |
| Dummy Cannula | RWD Life Science Co.,LTD | 62102 | OD 0.30mm |
| Guide Cannula | RWD Life Science Co.,LTD | 62003 | 26G |
| Head Fork | N/A | N/A | Custom made |
| Head Plate | N/A | N/A | Custom made |
| Imaging Cannula | N/A | N/A | Custom Made; OD 3mm, ID 2.7mm, Height 1.8mm, #108 stainless steel |
| Internal Cannula | RWD Life Science Co.,LTD | 62203 | 0.30*0.14 (OD*ID, mm) |
| Kwik Sil | World Precision Instruments | KWIK-SIL | |
| SuperBond C&B | SUN MEDICAL | N/A | SuperBond C&B kit |
| Treadmill Kit | N/A | N/A | Custom made |
| UV-cured Adhesive | NORLAND PRODUCTS | NOA 60 |
参考文献
- Leutgeb, S., et al. Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science. 309 (5734), 619-623 (2005).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Polanco, J. C., et al. Amyloid-β and tau complexity - towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2018).
- Henneman, W. J. P., et al. Hippocampal atrophy rates in Alzheimer disease. Added value over whole brain volume measures. 72 (11), 999-1007 (2009).
- Camicioli, R., et al. Parkinson's disease is associated with hippocampal atrophy. Mov Disord. 18 (7), 784-790 (2003).
- Piatkevich, K. D., Murdock, M. H., Subach, F. V. Advances in Engineering and Application of Optogenetic Indicators for Neuroscience. Applied Sciences. 9 (3), 562 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Fan, L. Z., et al. All-Optical Electrophysiology Reveals the Role of Lateral Inhibition in Sensory Processing in Cortical Layer 1. Cell. 180 (3), 521-535 (2020).
- Shemesh, O. A., et al. Precision Calcium Imaging of Dense Neural Populations via a Cell-Body-Targeted Calcium Indicator. Neuron. 107 (3), 470-486 (2020).
- Villa, K. L., et al. Inhibitory Synapses Are Repeatedly Assembled and Removed at Persistent Sites In Vivo. Neuron. 89 (4), 756-769 (2016).
- Franklin, K. B. J., Paxinos, G. . Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , (2013).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Subach, O. M., et al. Novel Genetically Encoded Bright Positive Calcium Indicator NCaMP7 Based on the mNeonGreen Fluorescent Protein. International Journal of Molecular Sciences. 21 (5), 1644 (2020).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Kalmbach, A. S., Waters, J. Brain surface temperature under a craniotomy. Journal of neurophysiology. 108 (11), 3138-3146 (2012).
- Roche, M., et al. In vivo imaging with a water immersion objective affects brain temperature, blood flow and oxygenation. eLife. 8, 47324 (2019).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neuroscience Research. 93, 144-157 (2015).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H., Manfredssonn, F. P. . Gene Therapy for Neurological Disorders: Methods and Protocols. , 133-149 (2016).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), (2016).
- Yashiro, H., Nakahara, I., Funabiki, K., Riquimaroux, H. Micro-endoscopic system for functional assessment of neural circuits in deep brain regions: Simultaneous optical and electrical recordings of auditory responses in mouse's inferior colliculus. Neuroscience Research. 119, 61-69 (2017).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution In Vivo Imaging of Hippocampal Dendrites and Spines. The Journal of Neuroscience. 24 (13), 3147 (2004).
- Busche, M. A., et al. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proceedings of the National Academy of Sciences. 109 (22), 8740 (2012).
- Attardo, A., et al. Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Castello-Waldow, T. P., et al. Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. PLOS Biology. 18 (11), 3000928 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。