Method Article
הליך גולגולתי להדמיית פעילויות עצביות בהיפוקמפוס של עכברים מתנהגים
In This Article
Summary
מאמר זה מדגים את הכנת חלון הדמיה בהתאמה אישית בתוספת קנולה עירוי והשתלתו על אזור CA1 של ההיפוקמפוס בעכברים.
Abstract
הדמיית פעילויות עצביות ברזולוציה של תא יחיד בבעלי חיים מתנהגים ערים היא גישה חזקה מאוד לחקירת פונקציות מעגל עצבי במערכות מדעי המוח. עם זאת, ספיגה גבוהה ופיזור של אור ברקמת יונקים מגבילים את ההדמיה התוך-וורידית בעיקר לאזורי מוח שטחיים, ומשאירים אזורים במוח עמוק, כגון ההיפוקמפוס, מחוץ להישג ידם של מיקרוסקופיה אופטית. בסרטון זה, אנו מראים את ההכנה וההשתלה של חלון ההדמיה המותאם אישית כדי לאפשר הדמיה כרונית ב- vivo של אזור CA1 ההיפוקמפוס הגבי בעכברים מתנהגים עם ראש קבוע. החלון בהתאמה אישית מתווסף קנולה עירוי המאפשר משלוח ממוקד של וקטורים ויראליים וסמים לאזור ההדמיה. על ידי שילוב הכנה זו עם הדמיה שדה רחב, ביצענו הקלטה ארוכת טווח של פעילות עצבית באמצעות מחוון סידן פלואורסצנטי מתת-קבוצות גדולות של נוירונים בעכברים מתנהגים במשך מספר שבועות. הדגמנו גם את הישימות של הכנה זו להדמיית מתח ברזולוציה חד-פעמית. אינדיקטורים מקודדים גנטית בעלי ביצועים גבוהים של פעילות עצבית ומצלמות CMOS מדעיות אפשרו הדמיה חוזרת ונשנית של פרטים מורפולוגיים תת-תאיים של נוירונים בודדים ברזולוציה זמנית גבוהה. כמו כן, אנו דנים ביתרונות ובמגבלות הפוטנציאליות של השיטה המתוארת ובתאימותה לטכניקות הדמיה אחרות.
Introduction
ההיפוקמפוס הוא אזור מוח מרכזי האחראי על למידה וזיכרון1, כמו גם לניווט מרחבי2. ניוון היפוקמפוס קשורה להפרעות נוירולוגיות ופסיכיאטריות הכרוכות באובדן זיכרון וירידה קוגניטיבית3,4,5. בעכברים, ההיפוקמפוס הוא מודל מבוסס מאוד ללמוד היווצרות למידה מרחבית, הקשרית ואסוציאטיבית וזיכרון ברמות התא והרשת4,5. המחקרים המכניסטיים של למידה וזיכרון דורשים חקירה אורך של מבנה עצבי ותפקוד בעכברים מתנהגים. הדמיית פלואורסצנטיות בשילוב עם בדיקות מקודדותגנטית 6 מספקת יכולות חסרות תקדים לתיעוד דינמיקת מתח ממברנה7,8, סידן חולף9, ושינויים מבניים10 על תת קבוצות גדולות של נוירונים תוך ורידי. עם זאת, גישה אופטית להיפוקמפוס בעכברים נחסמת על ידי קליפת המוח, אשר יכול להגיע מעל 1 מ"מ עובי. כאן, תיארנו הליך להרכבת מכשיר הדמיה בהתאמה אישית וההשתלה הכרונית שלו בראש העכבר לגישה אופטית ארוכת טווח לתיבת המשנה CA1 של ההיפוקמפוס הגבי בעכברים מתנהגים. קנולה עירוי משולב שתל הדמיה מאפשר ניהול של וירוסים או תרופות ישירות על הנוירונים בתחום הראייה. ההכנה המתוארת בשילוב עם מיקרוסקופיה רחבת שדה מאפשרת הדמיה חוזרת ונשנית של תת-קבוצות גדולות של נוירונים בהתנהגות עכברים לאורך תקופות זמן ארוכות. השתמשנו בהכנה זו כדי לבטא אינדיקטורים מקודדים גנטית סידן ומתח באזור CA1 ההיפוקמפוס באמצעות הזרקה ממוקדת של וירוס הקשורים אדנו רקומביננטי (rAAV) עבור הקלטות פעילות עצבית ברזולוציה של תא יחיד. ביצענו גם הדמיית סידן אורך של תת-קבוצות העצבים המתאימות ברזולוציה גבוהה של מרחבי ספטיו-טמפורל בבעלי חיים מתנהגים. בנוסף, הכנה זו תואמת מיקרוסקופיה מולטי פוטון ומיקרואנדוסקופיה, ובכך להרחיב עוד יותר את ארגז הכלים של טכניקות הדמיה ללמוד רשתות עצביות ברמות הסלולר והתת-תאיות בעכברים מתנהגים. תיארנו שלבים קריטיים ופתרון בעיות בפרוטוקול. כמו כן דנו בחסרונות ובמגבלות האפשריות של השיטה.
Protocol
כל השיטות המתוארות כאן אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של אוניברסיטת ווסטלייק.
1. הרכבת שתלים
הערה: הרכבת שתל ההדמיה היא פשוטה מבחינה טכנית ודורשת רק פריטים זמינים מסחרית (איור 1, ראה גם טבלת חומרים). ניתן לייצר את לוחות הראש בחנות המכונות המקומית באמצעות לוחות נירוסטה או טיטניום. אנו ממליצים להכין מלאי של שתלים שהורכבו במלואם לפני תחילת הניתוחים. לאחר ניסויים in vivo נעשים, השתלים ניתן לשחזר לעשות שימוש חוזר מספר פעמים. במקרים מסוימים, זה עשוי רק לדרוש חיבור מחדש של הצינורית על ידי הלחמה או החלפת זכוכית הכיסוי.
- הכינו את כל ששת רכיבי החומרה העיקריים להרכבה והתקנה של שתלי הדמיה (איור 1).
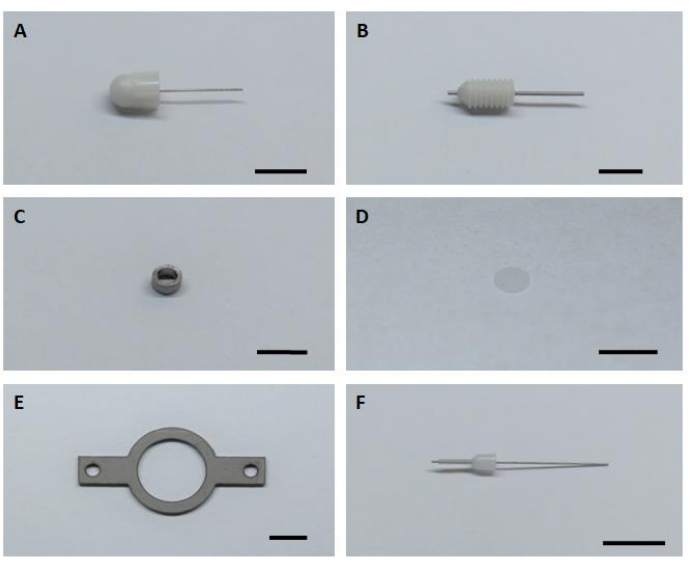
איור 1: שישה רכיבי חומרה מרכזיים להרכבה והתקנה של שתל ההדמיה. (B)מדריך קנולה. (C) קנולה הדמיה. (ד)זכוכית כיסוי זכוכית. (ה)לוחית ראש. (ו)קנולה פנימית. סרגל קנה מידה: 5 מ"מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הפעל את מכונת הריתוך וחמם אותה לטמפרטורה הנדרשת.
הערה: הטמפרטורה תלויה בפח הריתוך המשמש. - ללטש את פני השטח הצדדיים של הצינור הדמיה באמצעות נייר זכוכית דק כדי להסיר את שכבת החמצון ובכך להקל על הלחמה חזקה יותר.
- התאימו את מיקום הצינורית ההדמיה ואת הצינורית (קנולה מנחה עם קנולה דמה שהוכנסה) בעזרת ידיים עוזרות(איור 2A, B).
- באמצעות מזרק עם מחט, להחיל כמות קטנה של סוג מתאים של שטף על נקודת החיבור בין הדמיה הזרקת קנולס במשך 5 שניות, ולאחר מכן להסיר את הטיפה.
הערה: להכנה זו, השתמשנו שטף זמין מסחרית שצוין על ידי היצרן להיות עבור הלחמת חלקי נירוסטה כמו קנולות הדמיה ועירוי עשויים נירוסטה. במקרה של חומרים אחרים המשמשים לייצור קנולאס, משתמש הקצה צריך לבחור שטף שיכול לרתך את החומר שנבחר. - ממיסים את פח ההלחמה ומחילים אותו על נקודת החיבור המטופלת בשטף (איור 2).
הערה: הימנע פח הלחמה עודף, כפי שהוא ידרוש גולגולת גדולה מיותרת במהלך הניתוח.
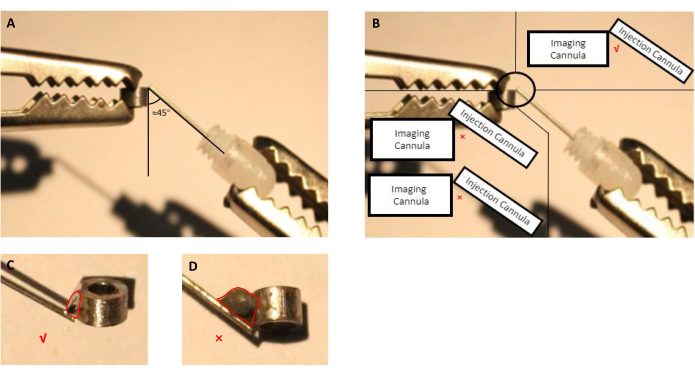
איור 2: סכמטי של הרכבת קנולה הזרקה, המורכבת מקנולה מדריך עם קנולה דמה מוכנס, עם הצינורית הדמיה. (A) הזווית בין הצינורית ההזרקה לבין הצינורית הדמיה צריך להיות קרוב 45 מעלות. (B) קצה הצינורית של ההזרקה צריך להיות ממש על קצה הצינורית הדמיה. (C) גודל מתאים של פח הריתוך המשמש להדמיית הלחמה וקאנולס הזרקה (קו אדום מציין את קווי המתאר של טיפת הפח). (ד)גודל לא הולם של פח הריתוך שיש להימנע ממנו במהלך הכנת השתל (הקו האדום מציין את קווי המתאר של טיפת הפח). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- חכה שקופסת ההלחמה תתקרר. בדרך כלל, זה לוקח כמה שניות.
- ודא כי הצינורית ההזרקה אינה חסומה על ידי החדרת הצינורית דמה משני הכיוונים.
- החל דבק אופטי ריפוי UV בצד התחתון של הצינורית הדמיה באמצעות קיסם או מחט מזרק 26 G.
- השתמש פינצטה בסדר בזהירות למקם כיסוי בגודל המתאים קנולה הדמיה.
הערה: מיקום הזכוכית חייב להיעשות בדיוק על קנולה הדמיה מבלי להזיז את הזכוכית יותר מדי ברגע שהוא נגע דבק אופטי. אחרת, הזכוכית מתלכלכת, ובכך מפחיתה את איכות ההדמיה. - לרפא את הדבק לפחות שעה על ידי 350-400 ננומטר תאורת UV ממנורה UV כף יד סטנדרטית.
הערה: הדבק המשומש חייב להיות שקוף אופטית. אחרת, זה יקטין את האיכות של חלון ההדמיה.
התראה: יש להימנע מחשיפה לעור ולעין על-ידי הרכבת משקפיים, כפפות וחלוק מעבדה להגנה מפני קרינת UV. - לשטוף את הצינורית ב 70% אתנול, אוויר יבש, ולאחסן במיכל סטרילי עד הניתוח.
הערה: חשוב מאוד לשמור על זכוכית הכיסוי נקייה ושלם ככל האפשר. הדבק האופטי המשומש יציב מבחינה כימית ב-70% אתנול.
2. השתלת חלון
- שלבי הכנה לפני הניתוח
- לעקר את כל המכשירים הכירורגיים במובלעת אוטומטית.
- מכינים 1x PBS ו 70% אתנול בשתי מנות פטרי נפרדות.
- אופציונלית: לחטא את אזור הניתוח באמצעות אור UV לפחות 20 דקות לפני תחילת ההליך הכירורגי.
הערה: הפעלה בתנאים הסטריליים ביותר האפשריים תגרום לחלונות גולגולת מוצלחים וארוכי טווח (עד 6 חודשים). זיהום עלול לגרום לשקיפות חלון מופחתת או דלקת חמורה ברוב המקרים.
- הליך כירורגי
- לעקר את האזור הכירורגי עם 70% אתנול ממש לפני הניתוח.
- לשקול את החיה ולנהל מנה טרום ניתוחית של משכך כאבים תת עורית על פי פרוטוקול בעלי חיים שאושרו IACUC.
- הרדים עכבר עם isoflurane (4% עבור אינדוקציה, 1.5-2% לשמירה, 0.3-0.5 L /min קצב זרימה של אוויר). השתמש בטכניקת צביטה של זנב וקמצוץ בוהן כדי להבטיח שהחיה מסוממת לחלוטין. שים לב סימנים חיוניים של החיה, כגון נשימה, SpO2, וקצב הלב למשך ההליך.
- השתמש גוזם או קרם depilatory כדי להסיר את הפרווה מהחלק האחורי של הצוואר עד העיניים.
- מניחים את העכבר במסגרת סטראוטקסית מעל כרית חימום לניתוח (שמירה על 37 °C (60 °F). אבטחו את הראש עם מוטות אוזניים. מעט לדחוף את הראש לכל הכיוונים כדי לוודא את הראש מאובטח בחוזקה.
- יש למרוח משחת עיניים כדי למנוע מעיני החיה להתייבש במהלך הניתוח.
- לעקר את האתר הכירורגי עם betadine ואחריו 70% אתנול שלוש פעמים לפני ביצוע חתך.
- הסר את העור מעל החלק העליון של הגולגולת, החל חתך אופקי לאורך כל בסיס הראש, ואחריו שני חתכים בכיוון rostral, כמעט להגיע העפעפיים, אז שני חתכים אלכסוניים המתכנסים בקו האמצע.
- עם שתי ספוגיות כותנה סטריליות, לסגת הרקמה המחברת, כמו גם את השרירים של החלק האחורי של הצוואר, אל קצות הגולגולת.
הערה: נסה להימנע מפגיעה בכלי הדם (במיוחד אלה החבויים בשריר) במהלך מניפולציה. - החל טיפה של פתרון לידוקאין (~ 0.1 מ"ל) על פני השטח של periosteum במשך 2 דקות, כדי למנוע כאב מוגזם. אופציונלי כדי להפחית את המוח מנפיחות לאחר הסרת הגולגולת, 0.1 מ"ל של 1% dexamethasone ניתן להזריק תת עורית.
- בעדינות לגרד את כל האזור החשוף של הגולגולת עם אזמל כדי ליצור משטח יבש ומחוספס המאפשר דבק מלט שיניים לדבוק טוב יותר ובכך וכתוצאה מכך השתלה כרונית.
- מניחים את קצה המחט רכוב על התחנה הסטראוטקסית על bregma, להגדיר את כל שלושת הקואורדינטות (AP: Anterior-אחורי; ML: מדיאלי-לרוחב; DV: גב-גחוני) כמו 0.
- מניחים קצה של המחט על lambda ולראות אם קואורדינטת AP הוא 0 כדי לאשר כי מיקום הראש הוא אנכי, כמו גם אם קואורדינטת ML הוא 0 כדי לאשר את הראש ממוקם אופקית. אם לא, כוונן את הידיות המתאימות בתחנה הסטראוטקסית, עד שנקודות הציון AP ו- ML נמצאות שתיהן בטווח של 0.1 מ"מ.
- להזיז את קצה המחט כדי למצוא את הנקודות המתאימות עבור craniotomy ולסמן את מיקומם על הגולגולת באמצעות סמן עדין. במקרה של השתלה עבור ההיפוקמפוס, יש 4 נקודות עם הקואורדינטות הבאות (AP: -0.68, ML: -2.0) (AP: -3.68, ML: -2.0) (AP: -2.18, ML: -0.5) ו -AP: -2.18, ML: -3.5)11, כמו גם (AP: -4.0, ML: -2.0) עבור הנקודה הקאודלית ביותר של הצינורית ההזרקה.
הערה: הסמן המשמש בשלב זה חייב להיות מעוקר באמצעות תאורת UV לפחות שעה לפני הניתוח. הקואורדינטות המוצגות כאן מיועדות לעכברי C57BL/6J בני 6-8 שבועות. הקואורדינטות עשויות להיות שונות בשל גילאים שונים או זנים של עכברים. - ציירו עיגול המבוסס על ארבע נקודות מסומנות, כמו גם על קווי המתאר של אזור הצינורית בהזרקה בצד הקאודלי של העיגול (איור 3).
- השתמש במקדח פנאומטי במהירות של 10,000 סל"ד כדי "לצייר" בעדינות לאורך קווי המתאר המסומנים על הגולגולת.
- לקדוח את הגולגולת עד שכבה דקה מאוד של העצם נשאר, אשר בדרך כלל מתחיל להתנועע תחת מגע עדין במרכז.
- החל טיפה של PBS סטרילי 1x למרכז הגולגולת, להרים את דש העצם מן הגולגולת עם מלקחיים קצה דק מאוד או שני מחטים 26 G מתקרבים משני הצדדים.
הערה: PBS יעזור להסיר את חתיכת הגולגולת ולמנוע דימום אפשרי של הדורה12. - החל PBS, ואחריו שאיפה עדינה באמצעות מחט קהה 26G מספר פעמים כדי לנקות את פני השטח של הדורה.
- הסר בעדינות את הדורה, בין אם על ידי שאיפה או על ידי מספריים עיניים. יש למרוח יניקה עדינה (~-60kPa) כדי לבלום את קליפת המוח, כמו גם את כפיס המוח מעל ההיפוקמפוס.
הערה: קליפת המוח היא לעתים קרובות צהוב יותר מאשר כפיס המוח קורפוס, ואת כפיס המוח הוא בדרך כלל לבן יותר מאשר ההיפוקמפוס. בדרך כלל קל להבחין בין כפיס המוח באמצעות סיבים עצביים הנחמדים בכיוונים האנכיים והאופקיים כאשר הם נצפים מלמעלה (איור 3).
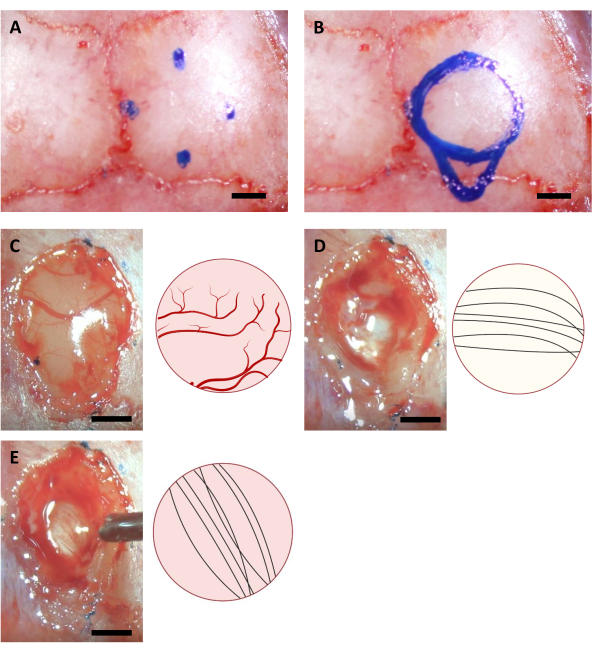
איור 3: קואורדינטות סטראוטקסיות של מיקום ההיפוקמפוס ותהליך אבלציה במוח. (B)אזור גולגולתי מלא. (C-E) תמונות מייצגות שנרכשו במהלך הניתוח (משמאל) והדיאגרמה הסכימטית שלהם (מימין) המצביעות על הצבעים וה הכיוונים השונים של סיבים עצביים של (A) Cortex (B) קורפוס קלוסום, ו -( C) היפוקמפוס גלוי במהלך אבלציה קליפת המוח. סרגל קנה מידה: 1 מ"מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- דימום בשלב זה ישפיע על הראות של רקמת המוח בגולגולת. החל 1x PBS, ואחריו יניקה עדינה, תוך שאיפה קליפת המוח כדי להיפטר מהדם.
הערה: דימום מתמשך הוא בלתי נמנע במהלך שלב זה, ובמידה מסוימת, דימום מתמשך הוא סימן ללחץ דם תקין. שלא כמו השתלת חלון הדמיית קליפת המוח, נוכחות הדם מתחת לחלון האופטי מקובלת שכן היא תטוהר מספר ימים לאחר הניתוח. החדרת הצינורית הדמיה לחלל שנוצר בהקדם האפשרי לאחר ablating קליפת המוח היא אופטימלית. - אם הגולגולת גדולה יותר על ידי <0.5 מ"מ מאשר קנולה הדמיה, להציל את ההתקנה של הצינורית במידה מסוימת באמצעות איטום נוסף Kwik Sil לפני תיקון השתל עם SuperBond.
- אם הגולגולת קטנה יותר על ידי <0.5 מ"מ מאשר קנולה הדמיה, להציל את ההליך הכירורגי במידה מסוימת על ידי גיזום קצה הגולגולת באמצעות פינצטה בסדר או זוג מספריים עיניים מאז העצם הנותרת בקצה craniotomy הוא דק יותר מאשר הגולגולת עצמה כתוצאה של קידוח.
הערה: לא ניתן להציל קרניוטומיות החורגות מהטווחים מעל 0.5 מ"מ. הפעולות המתאימות במקרים אלה צריכות לעקוב אחר הליך הסיום על פי פרוטוקול בעלי החיים.
- הכנס בעדינות את השתל לתוך הגולגולת.
- לחץ בחוזקה על גבי השתל עם המחט בצורת L כדי למקם את החלון האופטי של השתל קרוב ככל האפשר לפני השטח החשופים של ההיפוקמפוס. שוב ושוב להחיל PBS על הגולגולת סביב השתל ואחריו יניקה כדי להסיר דם ככל האפשר במהלך החדרת השתל. לאחר מכן יש למרוח שכבה דקה של קוויק סיל בין השתל לגולגולת כדי למנוע חדירה של מלט דנטלי מתחת לגולגולת(איור 4).
- ודא את המיקום של החלון האופטי של השתל הוא ממש נגד ההיפוקמפוס, כדי למנוע הצטברות דם או נוזלים אחרים מתחת.
הערה: הנקודה הקריטית היא לוודא כי הכיסוי של הצינור הדמיה ממוקם ממש נגד ההיפוקמפוס, אשר עשוי לדרוש לחץ עדין על גבי הצינורית במהלך ההתקנה ואת תהליך האיטום. אם הצד העליון של הצינורית ההדמיה מקביל לגולגולת אינו קריטי עבור הגישה האופטית הסופית כל עוד החלון האופטי ממוקם נגד ההיפוקמפוס. - על פי העובי הממוצע של קליפת המוח מעל אזור CA1, לשמור על המשטח העליון של הצינורית הדמיה מעל פני השטח של הגולגולת על ידי ~ 0.5 מ"מ כדי להקל על החיבור של הצינורית לגולגולת (איור 4).
- ודא את המיקום של החלון האופטי של השתל הוא ממש נגד ההיפוקמפוס, כדי למנוע הצטברות דם או נוזלים אחרים מתחת.
- לאחר סיל Kwik נרפא, אשר בדרך כלל לוקח לא יותר מ ~ 1 דקות, להחיל סופר בונד C&B באופן שווה על פני השטח של הגולגולת, את פני השטח של Kwik-Sil, ואת המשטח העליון של השתל.
- לאחר C&B סופר בונד נרפא, להחיל שרסן בסיס תותבת מעל C&B סופר בונד, כמו גם את העור סביב החתך שנעשה בתחילת הניתוח.
הערה: סוגים חלופיים של מלט זמינים מספקים מרובים. בצע את הוראות היצרן המתאימות. - לאחר שצורף בסיס התותבת נרפא, מניחים את צלחת הראש על השורף סביב השתל ולהפוך אותו קונצנטרי עם הצינורית הדמיה. החל יותר משרף בסיס תותבת סביב ומעל צלחת הראש כדי לתקן את מיקומו. תן לזה תרופה לכמה דקות.
- הימנעו מבניית שכבה עבה של מלט סביב הצינורית כדי להבטיח גישה טובה יותר לחלון ההדמיה עם העדשה האובייקטיבית (איור 4).
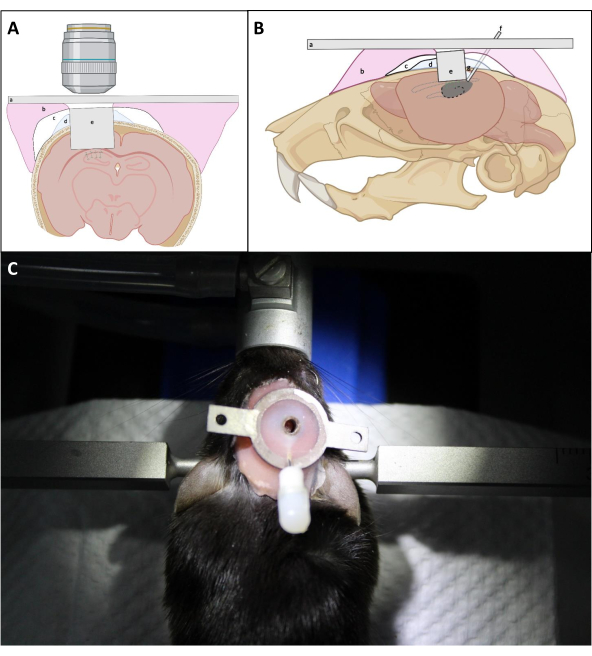
איור 4: דיאגרמה סכמטית של השתלת חלונות בתצוגה (A) coronal ו- (B) קשתית. (א)לוחית ראש; (ב)שף בסיס תותבת; (ג)סופרבונד; (ד)קוויק-סיל; (ה)קונולה הדמיה; (ו)הזרקת קנולה; (ז)פח הלחמה. (ג):עכבר עם השתל המותקן לאחר הניתוח. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- לדלל את שרף בסיס התותבת כדי להקטין את צמיגותו, ובכך לאפשר לו למלא את האזהרות אשר קשה להגיע עם אפליקטור.
- מניחים בעדינות סרט גומי מבודד מעל החלון כדי להגן על החלון מפני זיהום אפשרי מפני מצעים של בעלי חיים.
- כאשר הניתוח מסתיים, להזריק תרופה אנטי דלקתית תת עורית כדי למנוע תגובה דלקתית.
- מניחים את החיה בכלוב חם עד שהיא מתאוששת מהרדמה.
- בדוק את מצב התקינות של העכבר עבור 72 שעות לאחר הניתוח על ידי התבוננות בהתנהגות כללית. תרופות אנטי דלקתיות ומשככי כאבים מוזרקים תת עורית במשך יומיים-שלושה לאחר הניתוח כל 24 שעות כדי לשחרר כאב ולהפחית את התגובה הדלקתית.
הערה: נהלי ניטור חלופיים, תרופות, במינונים אפשריים לטיפול לאחר הניתוח, עיין בפרוטוקול בעלי חיים שאושר על ידי IUCAC להליך המדויק. - בדוק את החלון 5-7 ימים לאחר הניתוח כדי לצפות בכלי הדם מתחת לחלון. במקרה של חלון ברור, החיה מוכנה להזרקת וירוסים.
3. הזרקת וירוסים
הערה: הזרקת וירוסים נעשית בדרך כלל 5-7 ימים לאחר הניתוח. לפני הזרקת הנגיף, יש לאשר שחלון ההדמיה נקי, וניתן להתבונן בכלי הדם במוח (איור 5). במקרים מסוימים, זה עלול לקחת עד 14-16 ימים כדי לנקות את החלון, וזה מקובל גם אם לא זוהתה דלקת במוח.
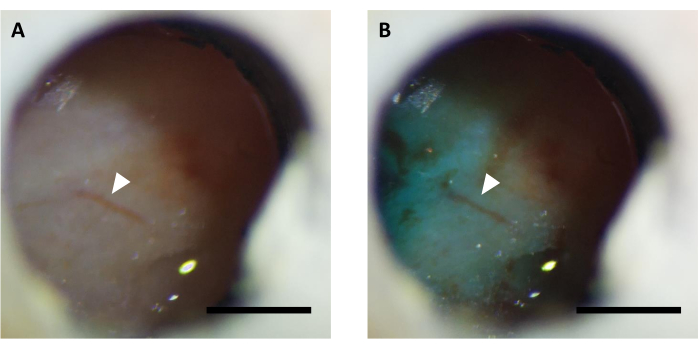
איור 5: תמונה מייצגת של חלון אופטי (A) לפני ו-(B) לאחר הזרקת וירוס בתוספת צבע FastGreen. חץ מציין את אותו מבנה כלי דם. סרגל קנה מידה: 1 מ"מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הוסף פתרון מלאי צבע ירוק מהיר לפתרון וירוס, מדולל טיטר הרצוי, ביחס של 1:9 בצינור PCR.
הערה: צבע ירוק מהיר מתווסף כדי להקל על הדמיה של פתרון וירוס במהלך ההזרקה. - חבר את צינורות פוליאתילן עם המזרק, ולאחר מכן למלא את הצינור עם שמן מינרלי באמצעות משאבת מזרק.
- חבר את הצינור הפנימי לקצה השני של הצינור, להחדיר ולמשוך את השמן המינרלי כמה פעמים כדי לוודא כי הצינור הפנימי אינו סתום.
- הרדמה את החיה עם isoflurane (4% עבור אינדוקציה, 1.5-2% לשמירה, 0.3-0.5 L /min קצב זרימה של אוויר), לתקן את הראש במסגרת סטראוטקסית על כרית חימום (שמירה על 37 °C (37 °F), להחיל משחת עיניים.
- למשוך 600 nL של פתרון הנגיף, להסיר את הצינורית דמה ולהכניס את הצינורית הפנימית מחובר מזרק הזרקה לתוך הצינור מדריך, להחדיר את הנגיף במהירות של 50 nL / min במשך 10 דקות בסך הכל.
הערה: בדוק אם הצבע גלוי דרך החלון באמצעות סטריאומיקרוסקופ כדי לאשר הזרקת וירוסים מוצלחת (איור 5). - לאחר ההזרקה, לשמור על הצינורית הפנימית מחובר במשך 10 דקות כדי לאפשר לנגיף להתפשט מתחת לחלון.
- הסר בעדינות את הצינורית הפנימית מהקנולה המנחה וסכם אותה מחדש עם קנולה דמה.
- מניחים את החיה בכלוב חם עד שהיא מתאוששת מההרדמה.
הערה: בדרך כלל, עכברים מוכנים להדמיה ב 10-20 ימים לאחר הזרקה ויראלית. רמת הביטוי והזמן תלויים בסרוטיגת הווירוסים ובמקדם המשמשים להנעת ביטוי גנים.
4. הדמיה של עכברים ערים תחת מיקרוסקופ שדה רחב.
הערה: צלחת הראש המוכנה מספקת יציבות יוצאת דופן של שתל הדמיה ובכך מאפשרת הדמיה אורך בעכברים ערים ומתנהגים עם חפצי תנועה מינימליים.
- לגרום לעכבר עם 4% isoflurane במשך כמה דקות, לתקן את צלחת הראש שלה למזלג הראש, ולאחר מכן לתקן את המזלג הראש להליכון.
הערה: מזלג הראש וההליכון מותאמים אישית עבור לוחית הראש המשמשת במחקר זה, ראה חומרים תומכים עבור קבצי cad המתאימים. אינדוקציה של העכבר לפני קיבעון הראש היא אופציונלית כפי שניתן להתרגל בעלי חיים עבור הליך זה. - הזז את ההליכון מתחת לשלב המיקרוסקופ ומקם את החלון האופטי מתחת לעדשה אובייקטיבית.
- השתמש בעדשת יעד הגדלה נמוכה כדי למצוא את שדה הראייה הטוב ביותר (FOV) להדמיה תפקודית, ולאחר מכן עבור לעדשה אובייקטיבית NA גבוהה יותר כדי לתעד את הפעילויות העצביות ברזולוציה של תא יחיד.
הערה: אם הצינורית ההזרקה היא עדיין מכשול עבור העדשה המטרה כדי להשיג את מרחק העבודה שלה, להשתמש קוצץ תיל כדי לחתוך את הצינורית ההזרקה מלוחית הראש.
תוצאות
בהדמיה vivo של פעילות עצבית באמצעות מחוון סידן מקודד גנטית. בממוצע, הדמיה vivo מתחיל 3-4 שבועות לאחר ההשתלה אם רמה מספקת של ביטוי transgene מושגת. בשלב זה, בצקת מוחית ודימום נפתרים בדרך כלל לחלוטין, ואת כלי הדם במוח ניתן לראות בקלות דרך החלון האופטי. כאן ניצלנו את ההכנה המתוארת כדי לבצע את ההקלטות החוזרות ונשנות של פעילות עצבית באזור CA1 ההיפוקמפוס הגבי בהתנהגות עכברים תחת מיקרוסקופ שדה רחב פלואורסצנטי. כדי לתעד פעילות עצבית, השתמשנו מחוון סידן מקודד גנטית בהיר, בשם NCaMP713, אשר מציג רגישות סידן דומה ורזולוציה זמנית לזו של GCaMP6s14. כדי לבטא את מחוון NCaMP7 בהיפוקמפוס, הזרקנו את וירוס rAAV / DJ-CAG-NCaMP7 באמצעות קנולה עירוי ויזמנו הדמיית קו אורך ב 14 ימים לאחר ההזרקה. כדי לתעד פעילות עצבית, השתמשנו בעדשת יעד אוויר 10x NA 0.3 ובמצלמת SCMOS של Hamamatsu OrcaFusion שאפשרה הדמיה ב- FOV של ~ 1.5x1.5 מ"מ בתדר של עד 100 הרץ. פלואורסצנטיות ירוקה התרגשה על ידי LED מסחרי זמין 470 ננומטר באמצעות ערכת מסנן GFP סטנדרטית. העומק הממוצע של הדמיה מושגת בערוץ ירוק הוא כ 50-120 מיקרומטר, המאפשר הקלטה של פעילות עצבית בעיקר בשכבות oriens ו pyramidale שכבה. עומק ההדמיה בערוצי אינפרא אדום כמעט יכול להיות עד 200 מיקרומטר להגיע לשכבות העמוקות יותר של ההיפוקמפוס8. זמן ההקלטה הממוצע ל-FOV היה 6-12 דקות, אם כי מפגשי הדמיה ארוכים בהרבה אפשריים מכיוון ש-NCaMP7 מאופיין בפוטו יציבות גבוהה במיוחד ולא נצפתה פוטוטוקסיות ניתנת לגילוי (איור 6).
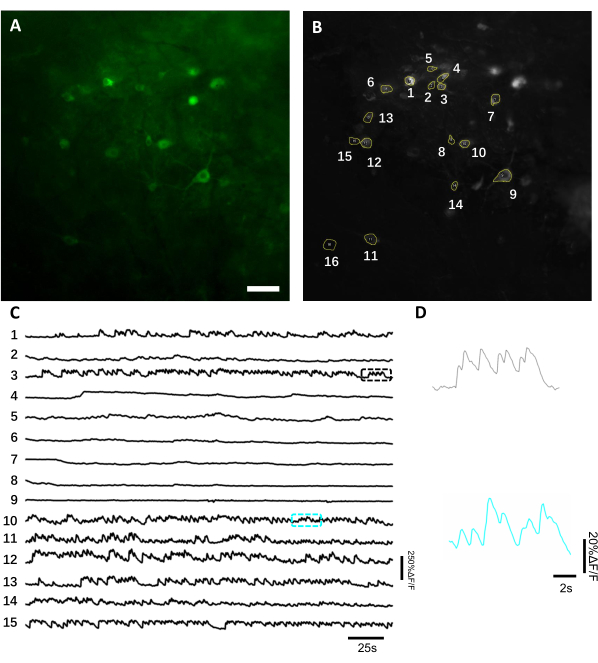
איור 6: הקלטה של הפעילות העצבית בנוירונים ההיפוקמפוסים באמצעות מחוון סידן מקודד גנטית פלואורסצנטי ירוק. (A) FOV נבחר בתמונה תחת מיקרוסקופ פלואורסצנטי רחב שדה בערוץ ירוק. (B)15 ההחזרים על ההשקעה המתאימים לנוירונים הבודדים המוצגים ב- A ונבחרים באמצעות הקרנת סטיית התקן של ההקלטה כולה. (C) עקבות פלואורסצנטיות מייצגות של 15 תאי העצב שנבחרו ב- B.(D)תצוגה מייצגת של 2 עקבות סידן המוצגות בתיבות צבע תואמות המוצגות ב- C. Scale bar, 100 מיקרומטר.
כדי להשיג עקבות פלואורסצנטיות, אזורי העניין (ROIs) המתאימים לסומות עצביות חולקו באופן ידני ונותחו על ידי תוכנת ImageJ. לפני תיקון תנועה ניתוח תמונה, נהלים נפוצים שלאחר הקלטה בבעלי חיים ערים לא נדרשו כמו datasets שנרכשו לא הפגינו חפצי תנועה בשל היציבות הגבוהה של השתל הדמיה. באיור 6מוצגת הקלטה אופטית מייצגת של פעילויות עצביות מההיפוקמפוס בעכבר ער . באיור 6B נבחרו באופן ידני 15 החזרי על ההשקעה המתאימים לסומאס עצבי מאותו FOV המוצג באיור 6B, ועקבות הפלואורסצנטיות של ניסוי יחיד בתוך כל החזר על ההשקעה מוצגות באיור 6C. איור 6D מציג שני חלקים מייצגים של עקבות פלואורסצנטיות משני ROIs שונים. ביצענו 4 הפעלות הדמיה רצופות עבור אותו FOV עם מרווחי זמן של 3 ימים. ניתן היה לזהות ולצלם את אותם נוירונים ב FOVs מסוימים לפחות שבועיים (מפגשי הדמיה ארוכים יותר לא בוצעו עבור מחקר זה, עם זאת, הכנה זהה שימשה עד 6 חודשים מחקר הדמיה בעכברים בעבר7; איור 7). במחקר זה השתמשנו בווקטור AAV/DJ-CAG, אשר גרם לביטוי חזק של גן העניין גם 21 יום לאחר מסירת הנגיף (איור משלים 1). הביטוי המתמשך סיבך זיהוי ארוך טווח של אותם נוירונים עקב רקע פלואורסצנטי מוגבר ומראה של נוירונים חדשים המבטאים את מחוון הסידן. לכן, הבחירה של Serotype AAV ו מקדם כדי לנהוג ביטוי גנים היעד צריך להיות אחד השיקולים החשובים במהלך תכנון ניסיוני בפרט אם הדמיה אורך של אותה תת קבוצה של נוירונים נדרש. איכות ההדמיה מותרת לפתור דנדריטים פרוקסימליים, כמו גם לדמיין את כלי הדם.
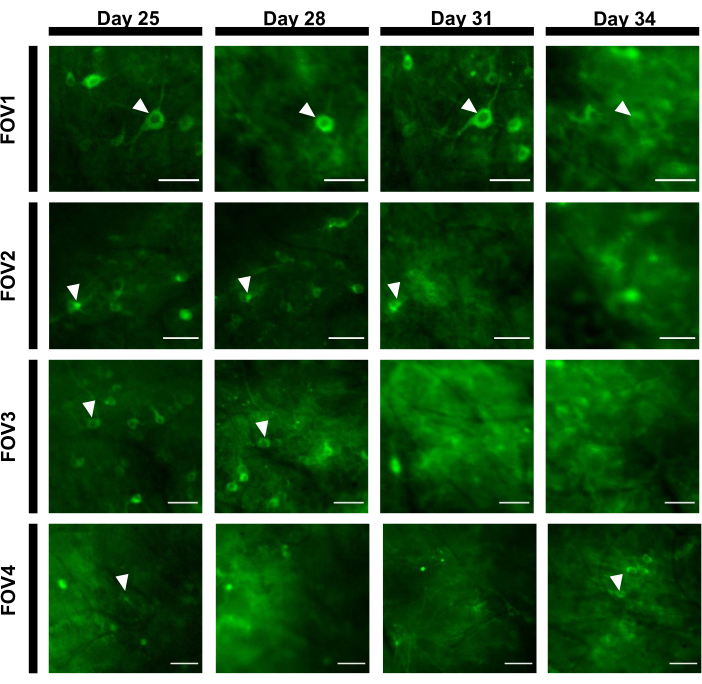
איור 7: רצף תמונות של ארבעה FOVs שונים מאזור ההיפוקמפוס במעקב במשך 12 ימים. החיה הושתלה עם החלון ביום 0 והוזרקה עם וירוס rAAV / DJ-CAG-NCaMP7 ביום 7. ראשי חץ מציינים את הנוירון במעקב בתוך FOV. סרגלי קנה מידה: 80 מיקרומטר.
בהדמיה vivo של פעילות עצבית באמצעות חיישן מתח מקודד גנטית.
במחקר זה, השתמשנו גם בחיישן מתח מקודדגנטיתחדשני, בשם SomArchon 7 , המאפשר הדמיית מתח ברזולוציה חד-תאית חד-תאית בבעליחייםמתנהגים 7,8. כדי לבטא SomArchon, הזרקנו וירוס rAAV / DJ-CAG-SomArchon באמצעות קנולה עירוי וביצע הדמיית מתח בעכבר התנהגות קבוע ראש מספר ימים לאחר ההזרקה. כדי לתעד פעילות עצבית, השתמשנו בעדשה אובייקטיבית 40x NA 0.8 ובמצלמת SCMOS של Hamamatsu OrcaFusion שאיפשרה לנו לדמיין 150x40 מיקרומטר FOV בקצב רכישה של עד 830 הרץ. חלבון GFP, אשר חלק SomArchon לבנות כדי להקל על הדמיה של ביטוי בטווח הנראה של הספקטרום, ניתן לדמיין בקלות בערוץ הירוק (עירור LED ב 470/20 ננומטר, פליטה 525/50 ננומטר) כדי לאתר תאים מעניינים עבור הדמיית מתח. הקלטות מתח אופטי בוצעו בערוץ כמעט אינפרא אדום (עירור לייזר 637 ננומטר ב 3.4 W / מ"מ2, פליטה 665 ננומטר מעבר ארוך) עם 4 x 4 binning בקצב רכישה 830 הרץ. תיעדנו את הפעילות הספונטנית של נוירון בהיפוקמפוס בעכבר ער עם ממוצע SNR של 7 לכל פוטנציאל פעולה (איור 8).
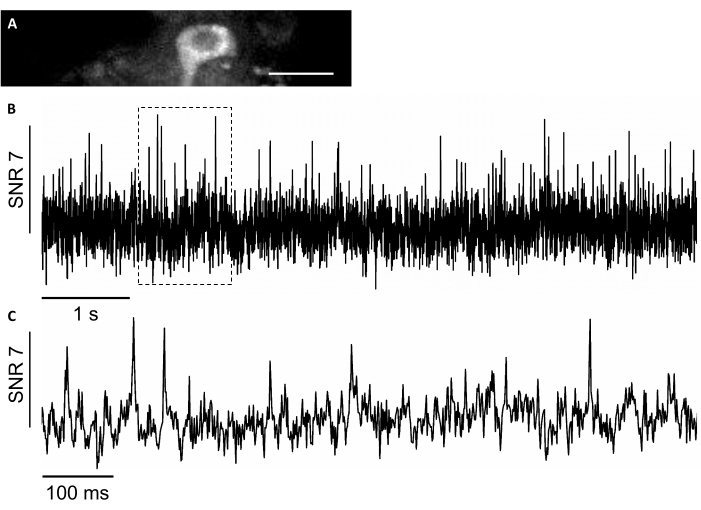
איור 8: הקלטה של הפעילות העצבית בנוירונים ההיפוקמפוסים באמצעות פלואורסצנטיות כמעט אינפרא אדום מקודד גנטית מחוון מתח SomArchon. (A)FOV נבחר בתמונה תחת מיקרוסקופ פלואורסצנטי רחב שדה בערוץ כמעט אינפרא אדום. (B) עקבות פלואורסצנטיות של הנוירון ב- A. (C) תצוגה זום מייצג של עקבות המתח בתיבה המתאימה המוצגת ב B. סרגל קנה מידה: 25 מיקרומטר.
היסטולוגיה
לאחר מחקר הדמיה תפקודית נעשה, ניתוח שלאחר המוות משמש כדי לאשר את המיקום הנכון של השתל, את האזור של ביטוי וירוס, לוקליזציה של חלבון של עניין נוירונים בתמונה. לצורך אימות היסטולוגי של ביטוי הנגיף ומיקום השתל, נבדקו חלקים מהמוח הקבוע של PFA תחת מיקרוסקופ שדה רחב פלואורסצנטי (איור 9A, C). מיקרוסקופ קונפוקל שימש לרכישת תמונות ברזולוציה גבוהה של נוירונים בודדים המבטאים את מחוון הסידן, כמו גם את מחוון המתח (איור 9B, D). כתמי DAPI שימשו כדי לדמיין את המורפולוגיה הכוללת של פרוסת המוח. בנוסף, ניתן להעריך את פרוסות המוח באמצעות אימונוהיסטוכימיה כדי לאמת אסטרוליוזיס או גליוזה הנגרמת על ידי השתלת חלון וביטוי ויראלי. המחקרים הקודמים שלנו הראו כי ההליך לא לגרוםהמורגשת 7.
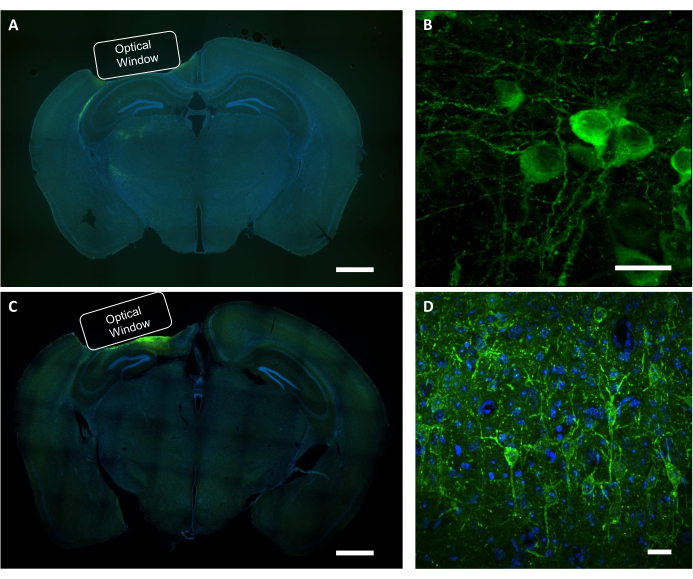
איור 9: אימות היסטולוגי של מיקום החלון האופטי וביטוי הווירוס. (A) תמונה פלואורסצנטית מייצגת של פרוסת המוח החלקית של הכתר המציגה את מיקום החלון האופטי מעכבר מבטא NCaMP. סרגל קנה מידה: 1 מ"מ.(B)תמונה קונפוקלית מייצגת של נוירונים המבטאים את מחווני NCaMP7. סרגל קנה מידה: 25 מיקרומטר (C) תמונת פלואורסצנטיות מייצגת של פרוסת המוח של החלק הקרונל המציגה את מיקום החלון האופטי מעכבר מבטא SomArchon. סרגל קנה מידה: 1 מ"מ.(D)תמונה קונפוקלית מייצגת של נוירונים המבטאים את מחווני SomArchon. סרגל קנה מידה: 25 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור משלים 1: ניתוח כמותי של עוצמת הפלואורסצנטיות היחסית יחד עם זמן הביטוי. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
כאן אנו מתארים שיטה להדמיה ארוכת טווח של אזור CA1 ההיפוקמפוס בעכברים מתנהגים. השיטה מבוססת על השתלה כרונית של חלון הדמיה בהתאמה אישית, המאפשר גם ניהול ממוקד של וירוסים או תרופות ישירות לנוירונים בעלי עניין. הפרוטוקול הנוכחי מורכב מארבעה חלקים עיקריים: i) הרכבה של שתל הדמיה; ii) התקנה של שתל הדמיה; iii) הזרקת וירוסים באמצעות שתל הדמיה; iv) הדמיה תפקודית בעכברים מתנהגים. להלן אנו מתארים ודנים בשלבים קריטיים בפרוטוקול, פתרון בעיות, שינויים ומגבלות של השיטה. כמו כן, אנו דנים בחשיבות השיטה וביישומיה החלופיים הפוטנציאליים.
ישנם מספר שלבים קריטיים בפרוטוקול המתואר החשובים למדי לניתוח מוצלח: (i) הכנת שתל הדמיה באיכות גבוהה; (ii) מצבים כירורגיים סטריליים; (iii) השאיפה של קליפת המוח; (iv) מיקום מדויק של שתל ההדמיה; (v) זריקה ויראלית. כפי ששלב 1.6 מציין, עודף פח הלחמה ידרוש גולגולת גדולה יותר ובכך מגדיל את הסיכון לדלקת. כמו כן חשוב מאוד להשתמש בכמות המתאימה של הדבק האופטי דבק בעת תיקון זכוכית הכיסוי לקנולה הדמיה, כפי שצוין בשלב 1.11, כמו כמות מספקת עלולה לגרום דליפה של נוזל השדרתי לתוך הצינורית הדמיה ולהפוך אותו אטום. מצד שני, עודף דבק אופטי יכול לגרום לירידה בשקיפות של חלון הזכוכית. זיהום אפשרי של שתל ההדמיה יכול לגרום לשגשוג פעיל של רקמת חיבור מתחת לחלון האופטי ו/או דלקת חמורה, שתוביל לסיום מוקדם של הניסוי. לכן, הדמיה השתל הרכבה והכנה לפני הניתוח הוא כמעט חשוב כמו ההליך הכירורגי עצמו.
במהלך הניתוח, החלק של קליפת המוח תחת גולגולת הוא ablated על ידי שאיפה עדינה, אשר גורם לדימום בלתי נמנע. דם באתר הכירורגי מפחית באופן משמעותי את הראות של רקמת המוח שיש להסיר. זה מסבך את ההערכה המדויקת של העומק הנדרש של אבלציה רקמות. שטיפה זהירה של האתר הכירורגי עם PBS בכל פעם לפני החלת יניקה כדי להסיר את החלק הבא של הרקמה מספק שליטה טובה יותר של עומק. יש להסיר תמיד את רקמת המוח בחלקים קטנים צעד אחר צעד המאשרים את עומק הרקמה המהותית לפני שתמשיך עם יניקה נוספת. שליטה עדינה יותר של יניקה יכולה להיות מושגת גם עם מחט קהה דק יותר. אנו ממליצים להשתמש במחט 26 G, עם זאת, קטן יותר מאשר 26 G קוטר נוטה יותר סתימת. יתר על כן, בדרך כלל נדרש תרגול רב כדי לקבוע את עומק השאיפה המדויק הנדרש עבור כל בעל חיים, שכן צבע קליפת המוח, כפיס המוח וההיפוקמפוס עשוי להשתנות מעכבר לעכבר (איור 3).
הכנסה ואבטחת שתל ההדמיה צריך להיעשות בדיוק רב כדי להבטיח את המיקום הקרוב ביותר האפשרי של חלון ההדמיה אל פני השטח הגביים של ההיפוקמפוס. גודל הגולגולת המוכנה צריך להתאים באופן הדוק את השתל ולאפשר החדרתו ללא התנגדות משמעותית. במקביל, לא צריך להיות פער גלוי בין הגולגולת לשתל כדי להבטיח איטום תקין ולהימנע מחשיפה לרקמות המוח. לחץ עדין ויציב צריך להיות מיושם על החלק העליון של השתל במהלך האיטום שלה לגולגולת. זה כמעט בלתי נמנע יש דם מתחת לחלון ההדמיה במהלך התקנת השתל. אם ההליך הכירורגי נעשה כראוי, החלון צריך לנקות ב 3-7 ימים, ואת כלי הדם במוח הופך גלוי בבירור. חשוב גם לוודא כי וירוס מוזרק כראוי מתחת לחלון. במקרה של ביטוי נכשל, וירוס ניתן reinjected מספר פעמים.
הסיבוך העיקרי שנתקלנו בו במקרים מסוימים הוא ראות מופחתת של חלון ההדמיה. ישנן מספר סיבות אפשריות לאיכות הדמיה ירודה: i) דלקת מתמשכת; ii) צמיחת רקמת חיבור על הזכוכית; iii) פער גדול בין החלון והיפוקמפוס. דלקת נגרמת בדרך כלל על ידי זיהום במהלך הניתוח או על ידי לא מעוקר כראוי השתל הדמיה. אנו ממליצים לחבוש אוטומטית את המכשירים הכירורגיים לפני ואחרי כל ניתוח, לחטא את אזור הניתוח ממש לפני ההליך, וללבוש ציוד מגן אישי נקי במהלך הניתוח. יש לנקות שתלי הדמיה לאחר ההרכבה, לעקר ולאחסן אותם בתנאים סטריליים. צמיחת רקמת החיבור על שתל ההדמיה יכולה לנבע מזיהום מכני על פני הזכוכית או מטראומה מוגזמת של רקמת המוח במהלך אבלציה של קליפת המוח. לאחר הרכבת השתל, חשוב לאשר את משטח הזכוכית נקי וחלק. כמו כן, יש להסיר בזהירות את כל חתיכות רקמת המוח הפגועה לפני החדרת שתל הדמיה לתוך הגולגולת. במקרים מסוימים, הפער בין חלון הזכוכית והיפוקמפוס גורם להצטברות של נוזל השדרתי, מה שמפחית את איכות ההדמיה. לכן, במהלך התקנת השתל, חיוני להכניס אותו כל הדרך בהבטחת מגע טוב בין ההיפוקמפוס לחלון הזכוכית. לפעמים, קשה לזהות את הסיבה המדויקת לחלון הדמיה אטום. אנו מציעים לבצע ניתוח שלאחר המוות כדי לחשוף את התנאים מתחת לחלון האופטי ולהתאים בהתאמה את הניתוחים הבאים.
לשיטה מספר מגבלות בסיסיות וטכניות שיש לקחת בחשבון לפני ובמהלך הדמיית vivo. אחת המגבלות העיקריות היא אבלציה קליפת המוח. חלק מקליפת המוח החזותית והחושית מוסר במהלך הניתוח. אמנם קשה להעריך במדויק את ההשפעה של אבלציה קליפת המוח, כמו רקמת המוח הוסר אינו מקרין ישירות על ההיפוקמפוס, מספר מחקרים הראו שום פגיעה ניכרת של למידה תלויי היפוקמפוס או פונקציות אחרות ההיפוקמפוס הרלוונטי15,16. יש לשקול גם את המגבלות האופטיות, במיוחד כאשר נעשה שימוש בעדשות אובייקטיביות גבוהות של NA. לדוגמה, במחקר זה השתמשנו בקנולה באורך 1.75 מ"מ בקוטר פנימי של 1.9 מ"מ. הגיאומטריה של קנולה זו לא תשמר את המטרה המלאה NA של האוויר עם NA יותר ~ 0.5 או מטרת מים עם NA יותר ~ 0.6 כפי שהוא יהיה קליפ חלק מהאור. מגבלה נוספת, הנפוצה בכל שתלי הדמיית המוח, היא שחלק מהמוח נחשף, ובכך מקדם אובדן חום17,18. עם זאת, טמפרטורת המוח הפיזיולוגית ניתן לשחזר בקלות במהלך הדמיה על ידי זלוף של חיץ חם.
ניתן לשנות או להתאים בקלות את השיטה המתוארת עבור יישומים אחרים. לדוגמה, ההכנה יכולה להיות מותאמת להדמיה של סטריאום7. כמו הסטריאטום שוכב קצת יותר עמוק מאשר ההיפוקמפוס, הצינורית הדמיה ארוכה יותר יש להשתמש להרכבת שתל הדמיה. אנו ממליצים להשתמש בקנולה הדמיה 2.0 מ"מ. יש להתאים את הקואורדינטות של הגולגולת בהתאמה (AP: +0.8 מ"מ, ML: -1.8 מ"מ). בנוסף, הזרקת וירוסים באמצעות קנולה עירוי מאפשרת להשיג את הביטוי של transgene בשכבה דקה של נוירונים בעת שימוש בסרוטיפ AAV עם התפשטות מוגבלת19,20. היא מועילה במיוחד להדמיית פוטון אחד עקב פלואורסצנטיות מופחתת מחוץ למיקוד משכבות עמוקות יותר, וכתוצאה מכך, הדמיה משופרת ברזולוציה של תא יחיד. יתר על כן, ניתן להשתמש בהזרקת קנולה גם במהלך הדמיה תפקודית לניהול תרופות או כימיקלים אחרים ישירות על הנוירונים ב- FOV (איור 5B). קנולה אינפוזיה הכוללת מוסיפה פונקציות שימושיות לשתל ההדמיה, משפרת את איכות ההדמיה בשל הביטוי הנגיפי הממוקד ומאפשרת גירוי תרופתי של נוירונים ב- FOV. לוחית הראש המשומשת מספקת יציבות יוצאת דופן של השתלת הדמיה הממזערת חפצי תנועה גם בבעלי חיים הנעים באופן פעיל על הליכון. צלחת הראש קטנה וקלילה, גורמת לאי נוחות מינימלית לבעלי חיים, ונשארת יציבה במשך מספר חודשים לאחר ההתקנה. שתל ההדמיה תואם גם להדמיה מולטי פוטון15,16,21 וניתן לשלבו עם מיקרו אנדוסקופים22,23. שתל הדמיה דומה שימש גם להדמיה מולטי פוטון של מבני ההיפוקמפוס העמוקים יותר, כולל רדיואטום שכבתי, סטראטום לקונוז, ו gyrus שקע16,24,25,26,27. עם זאת, מיקוד מבני ההיפוקמפוס העמוקים יותר עם AAVs באמצעות קנולה עירוי עשוי לדרוש אופטימיזציה נוספת של סרוטיפ AAV ונפח19.
אנו מאמינים כי הפרוטוקול המתואר יקל על מחקרים שמטרתם לחקור פעילות עצבית עם רזולוציה מרחבית גבוהה בהיפוקמפוס של עכברים מתנהגים באמצעות הגדרות הדמיה פוטון אחד פשוט ובמחיר סביר.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות לכל חברי קבוצת BioEngineering מולקולרית באוניברסיטת ווסטלייק על כל העזרה והדיון השימושי. אנו מודים גם לג'ינזה לי וג'יאה-מין ג'יה מאוניברסיטת ווסטלייק על העזרה בצילומי ההליך הכירורגי.
עבודה זו נתמכה על ידי מימון סטארט-אפ מקרן אוניברסיטת ווסטלייק, מענק החוקר הצעיר BBRF 2020, והקרן הלאומית למדעי הטבע של סין להעניק 32050410298 הכל ל- K.D.P.
Materials
| Name | Company | Catalog Number | Comments |
| Cover glass | Deckgläser | 72296-03 | |
| Denture Base Resin | ShangHai New Centery Dentel Material | N/A | Type I, self-solidifying |
| Dummy Cannula | RWD Life Science Co.,LTD | 62102 | OD 0.30mm |
| Guide Cannula | RWD Life Science Co.,LTD | 62003 | 26G |
| Head Fork | N/A | N/A | Custom made |
| Head Plate | N/A | N/A | Custom made |
| Imaging Cannula | N/A | N/A | Custom Made; OD 3mm, ID 2.7mm, Height 1.8mm, #108 stainless steel |
| Internal Cannula | RWD Life Science Co.,LTD | 62203 | 0.30*0.14 (OD*ID, mm) |
| Kwik Sil | World Precision Instruments | KWIK-SIL | |
| SuperBond C&B | SUN MEDICAL | N/A | SuperBond C&B kit |
| Treadmill Kit | N/A | N/A | Custom made |
| UV-cured Adhesive | NORLAND PRODUCTS | NOA 60 |
References
- Leutgeb, S., et al. Independent Codes for Spatial and Episodic Memory in Hippocampal Neuronal Ensembles. Science. 309 (5734), 619-623 (2005).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Polanco, J. C., et al. Amyloid-β and tau complexity - towards improved biomarkers and targeted therapies. Nature Reviews Neurology. 14 (1), 22-39 (2018).
- Henneman, W. J. P., et al. Hippocampal atrophy rates in Alzheimer disease. Added value over whole brain volume measures. 72 (11), 999-1007 (2009).
- Camicioli, R., et al. Parkinson's disease is associated with hippocampal atrophy. Mov Disord. 18 (7), 784-790 (2003).
- Piatkevich, K. D., Murdock, M. H., Subach, F. V. Advances in Engineering and Application of Optogenetic Indicators for Neuroscience. Applied Sciences. 9 (3), 562(2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Fan, L. Z., et al. All-Optical Electrophysiology Reveals the Role of Lateral Inhibition in Sensory Processing in Cortical Layer 1. Cell. 180 (3), 521-535 (2020).
- Shemesh, O. A., et al. Precision Calcium Imaging of Dense Neural Populations via a Cell-Body-Targeted Calcium Indicator. Neuron. 107 (3), 470-486 (2020).
- Villa, K. L., et al. Inhibitory Synapses Are Repeatedly Assembled and Removed at Persistent Sites In Vivo. Neuron. 89 (4), 756-769 (2016).
- Franklin, K. B. J., Paxinos, G. Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , (2013).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), e680(2008).
- Subach, O. M., et al. Novel Genetically Encoded Bright Positive Calcium Indicator NCaMP7 Based on the mNeonGreen Fluorescent Protein. International Journal of Molecular Sciences. 21 (5), 1644(2020).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Kaifosh, P., Lovett-Barron, M., Turi, G. F., Reardon, T. R., Losonczy, A. Septo-hippocampal GABAergic signaling across multiple modalities in awake mice. Nature Neuroscience. 16 (9), 1182-1184 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nature Neuroscience. 13 (11), 1433-1440 (2010).
- Kalmbach, A. S., Waters, J. Brain surface temperature under a craniotomy. Journal of neurophysiology. 108 (11), 3138-3146 (2012).
- Roche, M., et al. In vivo imaging with a water immersion objective affects brain temperature, blood flow and oxygenation. eLife. 8, 47324(2019).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neuroscience Research. 93, 144-157 (2015).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Gene Therapy for Neurological Disorders: Methods and Protocols. Manfredssonn, F. P. , Springer. New York. 133-149 (2016).
- Basu, J., et al. Gating of hippocampal activity, plasticity, and memory by entorhinal cortex long-range inhibition. Science. 351 (6269), (2016).
- Yashiro, H., Nakahara, I., Funabiki, K., Riquimaroux, H. Micro-endoscopic system for functional assessment of neural circuits in deep brain regions: Simultaneous optical and electrical recordings of auditory responses in mouse's inferior colliculus. Neuroscience Research. 119, 61-69 (2017).
- Attardo, A., Fitzgerald, J. E., Schnitzer, M. J. Impermanence of dendritic spines in live adult CA1 hippocampus. Nature. 523 (7562), 592-596 (2015).
- Mizrahi, A., Crowley, J. C., Shtoyerman, E., Katz, L. C. High-Resolution In Vivo Imaging of Hippocampal Dendrites and Spines. The Journal of Neuroscience. 24 (13), 3147(2004).
- Busche, M. A., et al. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proceedings of the National Academy of Sciences. 109 (22), 8740(2012).
- Attardo, A., et al. Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Cell Reports. 25 (3), 640-650 (2018).
- Castello-Waldow, T. P., et al. Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. PLOS Biology. 18 (11), 3000928(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved