Method Article
تقويم الزرد المنتبذ والخارج الرحم Xeno-Engraftion للورم الميلانيني العيني لتلخيص الورم الأولي وتطور النقائل التجريبي
In This Article
Summary
هنا ، نقدم بروتوكولا لإنشاء نماذج متعددة الاستخدامات لسمك الزرد الزرد لتقويم العظام وخارج الرحم للورم الميلانيني العيني لتقييم حركية نمو الورم الأولي ، والانتشار ، والتسرب ، وتكوين النقائل البعيدة حول الأوعية الدموية وتأثير التثبيط الكيميائي عليه.
Abstract
لا توجد حاليا نماذج حيوانية للورم الميلانيني النقيلي للعين. أدى عدم وجود نماذج للأمراض النقيلية إلى إعاقة البحث والتطوير لاستراتيجيات جديدة لعلاج الورم الميلانيني النقيلي للعين. في هذا البروتوكول ، نحدد طريقة سريعة وفعالة لإنشاء نماذج أسماك الزرد الجنينية لكل من المرحلة الأولية والمنتشرة من سرطان الجلد العيني ، باستخدام نقش الخلايا خارج الرحم داخل الأوعية الدموية ، على التوالي. من خلال الجمع بين هاتين الاستراتيجيتين المختلفتين للنقش ، يمكننا تلخيص مسببات السرطان في مجملها ، والتقدم من نمو الورم الأولي الموضعي تحت العين إلى تكوين ورم خبيث حول الأوعية الدموية في الذيل. تسمح لنا هذه النماذج بتعديل الخلايا السرطانية بسرعة وسهولة قبل الزرع باستخدام وضع علامات محددة أو تداخل جيني أو كيميائي. وعلاج العوائل المطعمة بمثبطات (جزيئية صغيرة) لتخفيف تطور الورم.
هنا ، نصف توليد وقياس كل من النقش التقويمي وخارج الرحم للأورام الميلانينية العينية (الورم الميلانيني الملتحمة والقعبي) باستخدام خطوط الخلايا المستقرة المسماة بالفلورسنت. ينطبق هذا البروتوكول أيضا على نقش الخلايا الأولية المشتقة من خزعة المريض والمواد المشتقة من المريض / PDX (المخطوطة قيد التحضير). في غضون ساعات بعد النقش ، يمكن تصور هجرة الخلايا وتكاثرها وقياسها كميا. كلا بؤرتي الورم متاحتان بسهولة للتصوير باستخدام كل من الفحص المجهري اللامع والفحص المجهري متحد البؤر. باستخدام هذه النماذج ، يمكننا تأكيد أو دحض نشاط استراتيجيات التثبيط الكيميائي أو الجيني في غضون أقل من 8 أيام بعد بدء التجربة ، مما يسمح ليس فقط بالفحص عالي الكفاءة على خطوط الخلايا المستقرة ، ولكن أيضا يمكن الفحص الموجه للمريض لأساليب الطب الدقيق.
Introduction
يعتبر الانتشار النقيلي السبب الرئيسي لوفاة الورم الميلانيني العيني. لا يوجد حاليا نظام علاج قابل للتطبيق للورم الميلانيني المنتشرالعيني 1،2. علاوة على ذلك ، لا توجد نماذج حيوانية متاحة للورم الميلانيني العيني الذي يعكس المرض النقيلي. لسد هذه الفجوة ، قمنا بإنشاء نموذجين متميزين لأسماك الزرد يلخصان إما تكوين الورم الأولي أو المراحل المبكرة من الانتشار النقيلي ، مما يسمح بسهولة بدراسة هذه العمليات التي يصعب دراستها عادة 3. تسمح نماذج ورم خبيث دقيق بتحليل المراحل الأخيرة من الانتشار النقيلي ، بما في ذلك التوجيه والاستعمار والخروج. يمكن أن توفر التدخلات الجينية أو الكيميائية في هذه المرحلة وما بعدها موطئ يد قوي في علاج الورم الميلانيني النقيلي للعين.
يتم دعم استخدام يرقات الزرد كمتلقي للطعوم الخيفية والغريبة من خلال نقاط القوة الجوهرية لهذا النوع ، مثل شفافيتها البصرية في المراحل المبكرة من التطور (أو دورة حياتها الكاملة لطفرات الكاسبر 4) ، والخصوبة العالية والتخصيب خارج الرحم 5. يضمن التماثل النسخي العالي في الفقاريات الاحتفاظ بآليات الإشارات الأساسية بين الزرد والبشر وبالتالي قابلية ترجمة عالية للنتائج 6 ، على الرغم من أن الأساليب الجينية تشوهها أو معقدة في بعض الأحيان بسبب ازدواجية الجينوم teleost 7. أكدت التطورات الأخيرة على أهمية نماذج الطعم الزيئي لأسماك الزرد باعتبارها "صورا" ما قبل السريرية للأمراض البشرية8 ، مما أدى بشكل فعال إلى العديد من نماذج علاج السرطان الشخصية للتقييم قبل السريري لاستراتيجيات العلاج من تجربة واحدة لسمك الزرد 9.
بالنظر إلى عدم وجود نماذج حيوانية والنقص التوافقي في خيارات العلاج للورم الميلانيني العيني النقيلي ، توفر نماذجنا منصة انتقالية سريعة وسهلة لفحص كل من التغيرات الجينية (الخلايا السرطانية الجوهرية) أو تطوير استراتيجيات التدخل الكيميائي في بيئة ما قبل السريرية. ضمن نفس النموذج ، يمكننا تصور وقياس حركية نمو الخلايا السرطانية ، ومعدل النقش / الإمكانات النقيلية ، وموجه الخلية على مستوى كامل باستخدام تكبير منخفض المستوى في مجهر فلوري استريو ، وإجراء قياسات مماثلة باستخدام تحليل مجهري متحد البؤر للتكبير المتوسط أو العالي لتشريح الخطوات المختلفة لتطور الورم الميلانيني العيني بدقة 10.
هنا ، نصف بروتوكولات شاملة ومفصلة من أجل: توليد الخلايا السرطانية المصنفة بالفلورسنت باستخدام نقل الفيروسات القشري المحسنللغاية 11. الحقن الوريدي اللاحق والرجعية المدارية (RO) من هذه الخلايا في 2 أيام بعد الإخصاب (DPF) يرقات الزرد لتوليد نماذج خارج الرحم وتقويم العظام على التوالي; يليه الحصول على البيانات وتحليلها. على الرغم من أن هذه الطرق شاملة للتطبيقات الموضحة هنا ، إلا أنها يمكن تعديلها لتطعيم الخلايا في تجويف الدماغ الخلفي والكبد ومساحة السبائير عند الحاجة (فقط عن طريق تغيير موقع الحقن أو وقت الحقن) 12،13.
كدليل على المفهوم ، قمنا بتفصيل النتائج التي توصل إليها Pontes et al. 2018 ، حيث أظهرنا جرعة وطفرة جوهرية للخلية استجابة محددة لخطوط خلايا الورم الميلانيني الملتحمة في نموذج الزرد 14. لقد توضحنا هذه النتائج من خلال إظهار فعالية مثبط VMURAFENIB الخاص بطفرة BRAF V600E في كل من نماذج الورم الميلانيني النقيلي والأولي.
Protocol
تمت الموافقة على جميع التجارب على من قبل لجنة التجارب على (Dier Experimenten Commissie، D.E.C.) بموجب ترخيص AVD1060020172410. تمت صيانة جميع وفقا للإرشادات المحلية باستخدام البروتوكولات القياسية (www.ZFIN.org).
1. التحضير
- الكواشف
- تحضير ماء البيض: 0.6 مجم / لتر ملح البحر بالتركيز النهائي.
- تحضير 5 مجم / مل من مخزون التريكايين 25x: اخلطي 5 جم من مسحوق Tricaine (ethyl 3-aminobenzoate methanesulfonate أو MS-222) ، و 900 مل من الماء منزوع المعادن ، و 21 مل من 1 M Tris (درجة الحموضة 9). اضبط على درجة الحموضة 7 واملأ ما يصل إلى 1 لتر ، ويمكن تخزين التريكائين عند 4 درجات مئوية على المدى القصير (حتى ستة أشهر) أو يمكن تخزينه في درجة حرارة الغرفة لمدة شهر في درجة حرارة الغرفة عند حمايته من أشعة الشمس.
- تحضير 1.5٪ (وزن / حجم) من الاغاروز في ماء البيض: 1.5 جم في 100 مل من DPBS. الميكروويف ليذوب.
- تحضير 1٪ (وزن / حجم) من الاغاروز منخفض الذوبان في ماء البيض: 1.5 جم في 100 مل من DPBS. الميكروويف ليذوب.
- قم بإعداد 2٪ (وزن / حجم) من مخزون PVP40 في DPBS: 1 جم من PVP40 في 50 مل من DPBS. دوامة وتحتضن عند 37 درجة مئوية لتسهيل الذوبان. يحفظ في درجة حرارة الغرفة.
- استخدم DMSO. غالبا ما يستخدم كمذيب في العلاجات الدوائية ويجب تخزينه في درجة حرارة 2-8 درجة مئوية في الظلام.
- استخدم TrypLE ، وهو بديل اصطناعي للتربسين أقل ضررا للخلايا ويسمح بالتشتت اللطيف للخلايا شديدة الالتصاق.
- تحضير محلول ملحي مخزن بالفوسفات (DPBS) من Dulbecco بدون Mg2+ و Ca2+ لغسل الخلايا. يؤدي نقص Ca2+ إلى إضعاف التصاق الخلايا الخلوية من خلال الكاديرين.
- تحضير البلازميدات الفيروسية العدسية: psPAX2 (البلازميد # 12260) و pMD2.G (البلازميد # 12259) موهوبة من ديدييه ترونو وإما GFP (بلازميد # 106172) أو tdTomato (بلازميد # 106173) ترميز بلازميد النقل (Addgene).
- استخدم LipodD293: كاشف تعداء عالي الكفاءة HEK293T محسن.
- طبق الاغاروز
ملاحظة: عند استخدام الأطباق المخزنة لفترة طويلة ، تأكد من إضافة كمية صغيرة من ماء البيض إلى الأطباق قبل بدء الحقن (سيمنع ذلك الأسماك من الجفاف بسرعة كبيرة).- تحضير أطباق مغلفة بالأغاروز بنسبة 1.5٪ (وزن / حجم) (أغاروز مذاب في ماء البيض).
- استخدميه على الفور ، أو خزنيه في درجة حرارة 4 درجات مئوية في وضع مقلوب.
2. الإبر
ملاحظة: تأكد من معايرة الشعيرات الدموية على الفتيل المستخدم. عند تبديل الفتيل أو الشعيرات الدموية ، حدد قيمة المنحدر للشعيرات الدموية على الفتيل المستخدم (انظر دليل مجتذب الإبرة).
- سينتج عن شعيرات دموية زجاجية واحدة إبرتين للحقن الدقيق. قبل صنع الإبر ، تحقق من السلامة الهيكلية للفتيل (خيوط صندوق 2.5 مم) لمجتذب الإبرة.
- تأكد من معايرة كل من الفتيل والشعرية للحصول على قيمة المنحدر المقابلة. عندما تتعرض السلامة الهيكلية للخيوط للخطر (أي غير متساوية ، ثقوب ، منصهرة ، إلخ) ، قم بتغيير الفتيل.
- استخدم البرنامج التالي (إبرة # 99 ، الحرارة = منحدر + 15 ، سحب = 95 ، السرعة = 60 ، الوقت = 90). قم بتخزين الإبر في طبق بتري مخصص (يحتوي إما على الطين أو الشريط اللاصق للصق الإبر به)
3. توليد جزيئات الفيروسات العدسية
ملاحظة: لمنع إضاعة الوقت والموارد ، يمكن إجراء فحص سريع للأورام قبل نقل الفيروسات العدسية. يتم ذلك للتأكد من أن خط الخلية المراد استخدامه هو مرض ورمي بدرجة كافية في نموذج الزرد ، ولهذه الغاية يمكن تلطيخ الخلايا ب CMdiI (أو متتبع مماثل) كما هو موضح في Liverani et al. 2017 15.
- لوحة HEK 293t الخلايا قبل يوم واحد من التعداء لتحقيق التقاء ما يقرب من 70٪ (يتم ذلك بشكل روتيني عن طريق تقسيم قارورة كاملة إلى نفس قارورة الثقافة بحجم 1: 3 قبل يوم واحد).
- في يوم التعدي ، قم بنقل البلازميدات العبوة المطلوبة psPAX2 و pMD2.G التي تعبر عن البلازميد جنبا إلى جنب مع GFP (Plasmid # 106172) أو tdTomato (Plasmid # 106173) التي تشفر بلازميد النقل. يتم تحديد الكمية الدقيقة من البلازميد المستخدم في الجدول 1.
ملاحظة: تم إهداء كل من psPAX2 و pMD2.G من قبل ديدييه ترونو (Addgene plasmid # 12260 و # 12259 ، على التوالي).
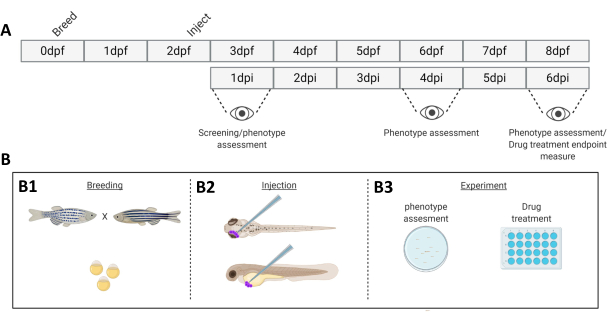
الشكل 1. تمثيل تخطيطي لنظام نقش سمك الزرد الموصوف. أ) الجدول الزمني للنهج ، مع تربية الزرد في اليوم 0 (B1). يتم حصاد الأسماك في الصباح بعد عبور الأسماك (اليوم 1). بعد 48-54 ساعة ، تفقس الأسماك إلى حد كبير (تتساقط المشيمة) ويتم حقن الأسماك (بشكل رجعي أو منهجي ، B2) بعد تنظيف الماء من حطام المشيمة (اليوم 2). يتم فحص اليرقات لاحقا باستخدام مجهر فلورسنت ستيريو ويتم التخلص من جميع اليرقات التي تعرض أنماطا ظاهرية غير مرغوب فيها (اليوم 3). اعتمادا على الهدف من التجربة ، يتم تصوير اليرقات بمرور الوقت (B3 ، حركية النقش ، تم تصويرها بعد 1 و 4 و 6 أيام من الحقن (dpi)) أو يتم توزيع الأسماك بشكل عشوائي وإدخالها في مجموعات تجريبية ، ومعالجتها بالأدوية ومقارنتها بالتحكم في السيارة (فحص الأدوية ، تم تصويرها بدقة 6 نقاط في البوصة). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- امزج جميع البلازميدات معا في 500 ميكرولتر من الوسط الخالي من المصل ، للسماح بالخلط الكامل لجميع البلازميدات. أضف 32 ميكرولتر من كاشف LipoD293 إلى 500 ميكرولتر من DMEM الخالي من المصل ، ودوامة لخلطها تماما. امزج كلا المجلدين معا جيدا. اسمح للبلازميدات و lipoD293 بالتجميع لمدة 20 دقيقة.
- أضف قطريا إلى قارورة ثقافة خلية مقاس 75 سم2 تحتوي على 70٪ خلايا HEK293T ملتصقة تحتوي على 9 مل من وسط الثقافة الكامل. أضف خليط التعدي مباشرة إلى طبقة الخلية باستخدام ماصة مصلية (قارورة في الاتجاه الأفقي).
- استبدل الوسط ب 20 مل من DMEM الطازج الكامل بعد 16 ساعة من التعدين. حصاد المادة الطافية بعد 72 ساعة من التعداد. Aliquot الطاف الفيروسي في 1 مل aliquots وتخزينها في -80 درجة مئوية. يكون الطافي الفيروسي الفاتح مستقرا عند -80 درجة مئوية لمدة عام واحد على الأقل.
4. نقل الفيروسات العدسية
- قبل نقل الفيروسات العدسية، قم بإنشاء منحنى قتل عند استخدام بنية فيروسات عدسية قابلة للتحديد.
- لمنحنى القتل ، قم بتحويل خط الخلية إلى صفيحة 12 بئر (التقاء حوالي 10-20٪). أضف منحنى جرعة من المحدد (التركيزات التقريبية لمنحنيات القتل: بورومايسين 0.5-10 ميكروغرام / مل ، بلاستيسيدين 1-20 ميكروغرام / مل ، جينيتيسين (G418) 100-2000 ميكروغرام / مل ، هيغروميسين 100-2000 ميكروغرام / مل).
- قم بتغيير الوسط كل ثلاثة أيام لضمان تركيز مستقر للمحدد المختار.
- أضف 1 مل من المادة الطافية الفيروسية إلى 9 مل من وسط المزرعة ، والتي تحتوي على تركيز نهائي قدره 8 ميكروغرام / مل من البوليبرين على 20-40٪ من الخلايا المتقاربة. يمكن تقليص الأحجام ، مع الحفاظ على هذه النسبة من المادة الطافية / الوسيطة.
- 16-24 ساعة بعد التنبيغ ، تبادل الوسيط. عند الحاجة ، كرر الخطوة السابقة لتعزيز اختراق النمط الظاهري (تحقق من التألق لتحديد ما إذا كان هناك حاجة إلى نقل آخر).
- بعد 48 ساعة من التنبيغ ، حدد الخلايا باستخدام المضاد الحيوي المقابل لعلامة المقاومة المدمجة في كاسيت الفيروس العسسي. يجب أن يقتل التركيز الذي يجب استخدامه في اختيار مجموعة الخلايا المنقولة السكان من النوع البري في غضون 7 أيام بعد تطبيق المادة الانتقائية (أي السماح للخلايا المنقولة بتجاوز مجموعة الأنواع البرية).
- ضع طافيا فيروسيا في تعدد مختلف من العدوى (MOI's) للتأكد من أن التنبيغ والآفات الوراثية التي يتكبدها الجينوم الخلوي لا تؤثر سلبا على بقاء الخلية أو الورم.
5. تربية سمك الزرد
- في اليوم 0 ، قبل يومين من نقش الخلايا السرطانية ، قم بتزاوج سمك الزرد البالغ بطريقة "الصليب العائلي" في درجة حرارة الغرفة (الشكل 1).
- قم بإزالة خزان الزرد من نظام الإسكان (يتم الحفاظ عليه عند 28.5 درجة مئوية).
- افصل الأسماك إلى مجموعات تربية صغيرة بنسبة 1: 1 ذكر: أنثى ، مع 10 أسماك لكل مجموعة. ضع الأسماك في أحواض تربية صغيرة ، في مياه مسحوبة من نظام الإسكان ، فوق شبكة مائلة (مائلة ، لتقليد المياه الضحلة حيث تفرخ أسماك الزرد بشكل طبيعي).
ملاحظة: ناتج عن انخفاض درجة الحرارة من 28.5 درجة مئوية إلى درجة حرارة الغرفة (25 درجة مئوية) والدخول إلى المرحلة الضوئية التالية من دورة الظلام / الضوء التي ستفرخ الأسماك. - بعد ذلك ، قم بإزالة البالغين ونقلهم إلى خزان السكن الخاص بهم.
- اجمع البيض واغسله بماء البيض باستخدام مصفاة. قسم البيض إلى حوالي 75-100 لكل طبق واحتفظ به عند 28.5 درجة مئوية.
- بعد حوالي 6 ساعات من الجمع ، قم بتنظيف أطباق الأجنة الميتة أو المشوهة.
- في صباح اليوم التالي ، استبدل ماء البيض ونظف أطباق الأجنة الميتة مرة أخرى.
6. خلايا الحصاد
ملاحظة: يعد التحضير المناسب للخلايا أمرا أساسيا لإجراء الزرع ، حيث يسمح استخدام كمية زائدة من الخلايا بمعالجة أسهل في اتجاه مجرى النهر. تعد خطوة الطرد المركزي الثالثة أمرا بالغ الأهمية ، حيث سيترك لك هذا مع حبيبات الخلية فقط ، فإن PBS المتبقي عالق على جانبي أنبوب الطرد المركزي يتجاوز بشكل كبير حجم إعادة التعليق النهائي.
- قم بتسخين جميع الوسائط والمحاليل المستخدمة في زراعة الخلايا في حمام مائي 37 درجة مئوية قبل الاستخدام.
- أضف 2 مل من TryplE لكل قارورة ثقافة 75 سم2 أو 1 مل لكل قارورة 25 سم2 واحتضنها حتى يتم تقريب جميع الخلايا. بالنسبة لمعظم خطوط الخلايا ، يجب أن تكون 2-5 دقائق كافية. بالنسبة للخلايا الظهارية العالية أو الخلايا الليفية ، يجب أن تسمح 5-10 دقائق بالانفصال المناسب (سيؤدي عدم كفاية التربسين إلى إعاقة العمليات النهائية ، وتسهيل تراكم الخلايا أثناء الزرع).
- اضغط برفق على جانب القارورة لإخراج الخلايا المتبقية.
- أضف ما يصل إلى حجم الثقافة الأصلي للوسط الكامل. الماصة لأعلى ولأسفل برفق ولكن بدقة باستخدام ماصة مصلية لقص كتل الخلايا في معلق خلية واحدة. لا تولد رغوة أثناء هذه العملية لأن الرغوة تدل على القص الميكانيكي للخلايا.
- انقله إلى أنبوب معقم سعة 15 مل وجهاز طرد مركزي لمدة 5 دقائق عند 200 × جم في درجة حرارة الغرفة. شفط طافي وأضف 1 مل من PBS المعقم. أعد تعليق الخلايا بعناية ودقة باستخدام ماصة معقمة سعة 1000 ميكرولتر.
- قم بإزالة تعليق الخلية سعة 20 ميكرولتر للعد ونقل معلق الخلية المتبقي إلى جهاز الطرد المركزي. جهاز طرد مركزي لمدة 4 دقائق عند 200 × جم في درجة حرارة الغرفة.
- الخطوة الحرجة: قم بإزالة جميع PBS ، وأجهزة الطرد المركزي لمدة 30 ثانية عند 200 × جم في درجة حرارة الغرفة ، وقم بإزالة PBS المتبقي.
- قم بتخفيف الخلايا إلى 250 خلية / لتر في 2٪ بولي فينيل بيروليدون 40 (PVP40 ، 2٪ (وزن / حجم) في DPBS) على النحو التالي:
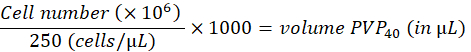
(على سبيل المثال،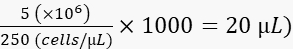
- إعادة تعليق الخلايا تماما ، مع منع تكوين فقاعات الهواء (يمكن الاحتفاظ بالخلايا لمدة ساعتين على الأقل في 2٪ PVP40 دون فقدان إمكانات الأورام).
7. نمذجة Xenograft
يجب إجراء جميع التجارب وفقا للوائح رعاية المحلية.
اعتمادا على التطبيق ، يتم تصنيف نوعين رئيسيين في التصميم التجريبي على أنهما تقييم النمط الظاهري (7.1 مرحلة ما قبل الفحص) وثانيا 7.2 شاشة حيث تم تعديل الخلايا إما قبل النقش أو 7.3 حيث يتم معالجة الأجنة بمثبط كيميائي.
- الفحص المسبق وتحديد إمكانات الأورام
- قم بتطعيم يرقات الزرد ذات الأهمية (WT أو خط المعدل وراثيا أو خط المراسل) عند 2 dpf مع عدد متفاوت من الخلايا الفلورية (أي 200 ، 400 ، 600 ±100).
- فحص اليرقات بعد 16-24 ساعة من الحقن لإزالة القيم المتطرفة (أعداد الخلايا العالية أو المنخفضة للغاية في الدورة الدموية للنموذج خارج الرحم ، أو الخلايا داخل الرأس لنموذج تقويم العظام) وإزالة الأسماك المطعمة بشكل خاطئ. حدد عدد اليرقات لكل مجموعة تجريبية لتحليل المجموعة مقابل التحليل الحركي لنفس اليرقات.
- راقب يرقات الزرد على فترات منتظمة (1،2،4،6 أيام بعد الحقن (dpi)) وقم بتصوير 20 فردا (كما هو موضح في الخطوتين 9 و 10) ، من بين مجموعة من ±50 يرقة.
- مراقبة النمط الظاهري العام وتطور المرض ثم تحديد الكمية باستخدام ImageJ (قياس الكثافة المتكاملة لإشارة الفلوروفور في الخلايا السرطانية).
- ارسم البيانات لتصور حركية نمو الخلايا السرطانية داخل سمك الزرد (الشكل 3).
- قم بتعديل الخلايا مسبقا (هدم أو إخراج جين ذي أهمية) وتطعيم في أسماك الزرد.
- تطعيم الأسماك وإزالة جميع الأنماط الظاهرية غير المرغوب فيها (حسب الحالة).
- قم بتصوير الأفراد بدقة 1 نقطة في البوصة (20 يرقة لكل مجموعة). يمكن تصوير الأفراد على فترات زمنية محددة (1 و 2 و 4 و 6 نقاط في البوصة).
- عند 6 نقاط في البوصة بعد التصوير ، قم بالقتل الرحيم للأسماك عن طريق تناول جرعات زائدة من التريكيين (10 أضعاف الجرعات عند 0.4 مجم / مل) وتخلص منها على ورق ماص مبطن للقمع.
- عالج الأسماك بالأدوية بعد النقش.
- قبل تطبيق الدواء على أسماك الزرد المطعمة ، حدد الجرعة القصوى المسموح بها (MTD) على أسماك الزرد (المعايرة من 10 ميكرومتر إلى 0.150 نانومتر ، باستخدام أعلى حجم من المذيب كعنصر تحكم سلبي) قمنا بتعيين MTD كتركيز حيث يعيش >80٪ من الأفراد على قيد الحياة من العلاج بأكمله.
- بعد يوم واحد من الحقن ، قم بإزالة الأنماط الظاهرية غير المرغوب فيها.
- قسم الأسماك بشكل عشوائي إلى مجموعات (36-48 فردا / حالة) واحتفظ بها في طبق 24 بئرا مع 6 يرقات لكل بئر في 1 مل من ماء البيض.
- ضع الأدوية بعد 24 ساعة من النقش. كعنصر تحكم ، استخدم نفس الكمية من المذيبات (DMSO و EtOH وما إلى ذلك) بأعلى حجم مطبق على مجموعة تجريبية.
- ابدأ العلاج الدوائي بالجرعة القصوى المسموح بها. قم بتغيير ماء البيض الذي يحتوي على الدواء كل يومين. قم بإزالة ماء البيض واليرقات الميتة بشكل كامل قدر الإمكان أثناء كل تغيير.
8. الحقن
ملاحظة: استخدم وحدة تحكم في النبض الهوائية مقترنة بخط هواء مضغوط، مما يوفر ضغطا فائضا قدره 100 رطل لكل بوصة مربعة. هذا يسمح بضغط كاف لكل من الحقن (≈20 رطل لكل بوصة مربعة) وإخراج مجاميع الخلايا المحتملة (≈100 رطل لكل بوصة مربعة). يجب أن يكون ضغط البدء والوقت حوالي 200 مللي ثانية عند 20 رطل لكل بوصة مربعة. إذا كان لا بد من تقليل أي منهما بأكثر من 50٪ في بداية الحقن ، فإما أن يكون تعليق الخلية سائلا جدا (تركيز الخلية أوPVP 40 منخفض جدا) أو أن فتحة الإبرة كبيرة جدا.
- قم بإزالة إبرة شعرية بعناية من الوعاء. اكسر الإبرة لتشكيل فتحة بحجم 20 ميكرومتر باستخدام ملقط ناعم لصانعي الساعات.
- أعد تعليق الخلايا بعناية ودقة باستخدام طرف ماصة سعة 20 ميكرولتر. تعليق خلية الماصة في الإبرة الشعرية الزجاجية المفتوحة باستخدام طرف طويل (محمل دقيق). قم بتحميل الإبرة في المناور الصغير.
- ضع ~ 20-40 يرقة مخدرة في 0.04 مجم / مل من التريكين على طبق الاغاروز باستخدام ماصة النقل. قم بإزالة الرطوبة الزائدة لتثبيت اليرقات باستخدام ماصة نقل. سيتم توجيه اليرقات في الغالب بطريقة جانبية بسبب وجود كيس صفار كبير نسبيا.
- حقن اليرقات بحوالي 200 و 400 و 600 خلية عبر قناة Cuvier (doC) للنموذج خارج الرحم.
- وبالمثل ، قم بحقن اليرقات بشكل رجعي (RO). لإنتاج نموذج تقويم العظام (حقن 100 ±50 خلية) ، قم بتعديل طول النبضة الهوائية على مضخة picopump (ابدأ عند ~ 20 رطل لكل بوصة مربعة ، 200 مللي ثانية واضبطها وفقا لذلك). أثناء الحقن تأكد من عدم جفاف اليرقات. تأكد من حقن جميع (أو معظم) اليرقات.
- اغسل اليرقات المحقونة بماء البيض العذب وانقلها إلى طبق بتري نظيف مكتوب عليه علامة (تجمع ما يصل إلى 150 فردا لكل طبق). كرر هذه العملية حتى يتم حقن يرقات كافية.
- بعد النقش ، حافظ على الأسماك عند 34 درجة مئوية في حاضنة رطبة ، حيث 34 درجة مئوية هي أعلى درجة حرارة تتحملها سمك الزرد بسهولة وتسمح بنقش فعال لخلايا سرطان الثدييات.
ملاحظة: بشكل عام ، مع حقن خطوط الخلية المفردة في كل من doC و RO ، لاحظنا وفيات تقريبية بسبب التلف الميكانيكي بنسبة <5٪ (الضرر الميكانيكي يقتل اليرقات بين 1-16 ساعة بعد الحقن).
9. الفحص
- باستخدام مجهر فلوري مجسم ، قم بفحص الأسماك بحثا عن النمط الظاهري المناسب بعد ساعة واحدة من الزرع عند مقارنة الخلايا المعدلة مسبقا (أو بعد يوم واحد من الزرع ، عند فحص الأدوية ، قبل التخصيص العشوائي في مجموعات العلاج).
- يجب أن تحتوي اليرقات المزروعة من خلال doC على خلايا في الذيل بين ساعة و 16 ساعة بعد الزرع. قم بإزالة جميع الأسماك الأخرى ، بما في ذلك الأسماك التي تظهر عليها شذوذا ، من البركة المحقونة.
ملاحظة: يجب أن تحتوي اليرقات المزروعة في الحجاب الرجعي على خلايا فقط في الخلال خلف العين ، ويتم إزالة اليرقات التي تحتوي على خلايا منتشرة في جميع أنحاء الرأس أو الجسم من البركة. - نظف اليرقات التي تم فحصها إيجابيا وقم بتعيينها عشوائيا للمجموعات التجريبية.
- بعد النقش ، حافظ على الأسماك عند 34 درجة مئوية في حاضنة رطبة وراقبها يوميا. يكون الانتشار الدموي للخلايا المزروعة من خلال doC فوريا تقريبا ، في حين أن الانتشار النقيلي للخلايا المزروعة في تجويف التناضح العكسي سينتشر بعد 2-4 أيام.
10. التصوير epifluorescent ليرقات الزرد
- تخدير يرقات سمك الزرد ب 0.2 مجم / مل من التريكائين ، إما عن طريق إضافة التريكيين إلى ماء الأسماك أو عن طريق نقل مجموعة فرعية من الأسماك من طبق الصيانة إلى طبق يحتوي على 0.2 مجم / مل من التريكائين.
- احتفظ بسمك الزرد في طبق به التريكيين حتى تظل ثابتة ، حتى لا يؤدي تحفيز الخط الجانبي إلى سلوك الطيران.
- انقل السمك إلى طبق بتري مغطى بالأغاروز ، حوالي 10 لكل طبق. قم بإزالة غالبية الماء مع رفع أحد طرفي الطبق برفق (السماح للماء بالتجمع برفق في الطرف السفلي من طبق بتري). إذا تم ذلك بعناية ، فسوف تتماشى جميع الأسماك ، وذيولها متجهة لأسفل.
- قم بتصوير جميع الأسماك من أعلى الطبق إلى الأسفل. ثم اغسل السمك بماء البيض في طبق بدون تريكيين.
- كرر حتى يتم تصوير عدد كاف من الأفراد.
- ثم انقل اليرقات إما مرة أخرى إلى 34 درجة مئوية أو تتخلص منها (عند 6 نقاط في البوصة) من خلال الجرعات الزائدة من التريكيين (أي 0.5 مجم / مل ، واحتضانها لمدة 10 دقائق ، قبل التخلص منها على ورق ماص مبطن للقمع).
11. التصوير متحد البؤر ليرقات الزرد (المطعمة)
- تخدير سمك الزرد ب 0.2 مجم / مل من التريكائين كما هو موضح سابقا.
- ضع طبقا متحدا بؤرة ذو قاع زجاجي تحت مجهر استريو وركز على قاع الطبق. انقل 5-10 يرقات إلى طبق متحد البؤر ذو قاع زجاجي. قم بإزالة أكبر قدر ممكن من الماء.
- غطي اليرقات ب 42 درجة مئوية ، 1٪ أغاروز منخفض الذوبان مذاب في ماء البيض. تأكد من أن الاغاروز قد برد إلى 42 درجة مئوية على الأقل قبل الاستخدام ؛ قد تؤدي درجات الحرارة المرتفعة إلى إلحاق الضرر باليرقات أو قتلها.
- باستخدام المجهر المجسم ، قم بتوجيه اليرقات بسرعة ولكن برفق لدفعها لأسفل ، باستخدام طرف محمل صغير مشذب. إذا كان الاتجاه البطني مطلوبا ، فقم بتثبيت اليرقات في مكانها باستخدام ملقط صانع الساعات (دون لمس الجنين).
- بينما تقوم مجموعات agarose بإجراء تعديلات دقيقة على اتجاه اليرقات. اسمح لليرقات بالتماسك تماما قبل نقلها إلى المجهر متحد البؤر.
12. ضبط المجهر متحد البؤر
- قم بتشغيل خطوط ليزر الإثارة الخضراء (488 نانومتر) والحمراء (564 نانومتر). ضع الطبق متحد البؤر في حامل المجهر متحد البؤر. باستخدام التألق العرضي ، حرك حزمة الضوء لتتحد مع السمكة الأولى (الإعداد x و y). من خلال ضبط العين التركيز ليتزامن مع مركز اليرقات (إعداد z).
- اضبط 700 كسب على كلتا القناتين الفلورية ، 1-5٪ طاقة ليزر. زيادة قوة الليزر وتقليل الإزاحة إلى النطاق الديناميكي الكامل تقريبا. لا تفرط في تشبع الإشارة ، ولكن قم بتحسين الإشارة لإظهار عدد قليل من وحدات البكسل المشبعة.
- عند التقاط غرزة ، اضبط بداية ونهاية اليرقات على طول محور واحد (إما x أو y) ، إذا تم تعيينه على طول محور واحد ، فيمكن تصوير جنين كامل في مقاطع 1 × 4 ويمكن معالجته في صورة واحدة باستخدام ImageJ.
- بعد التصوير ، قم بإزالة اليرقات من الاغاروز عن طريق تمزيقها برفق حول اليرقات المدمجة باستخدام ملقط صانع الساعات. خلاف ذلك ، قم بالقتل الرحيم لليرقات عن طريق تناول جرعات زائدة من التريكيين غير المخفف ، وتغطية الاغاروز بطبقة من التريكيين واحتضانها لمدة 10 دقائق.
13. تحليل البيانات
- افتح مجموعات البيانات الفردية في ImageJ / Fiji (أي التحكم ، الدواء A ، الدواء B ، الدواء A + B) بشكل منفصل ، بدءا من التحكم في السيارة.
- افتح ماكرو التحليل (يتوفر برنامج نصي مشروح) (http://doi.org/10.5281/zenodo.4290225).
- باختصار ، يقوم التحليل الكلي بما يلي: يتسلسل جميع الصور المفتوحة (شرط واحد) ؛ يقسم الصور إلى قنوات منفصلة تشتمل على الصورة ؛ يغلق جميع القنوات الملحقة (ترك قناة الخلية السرطانية) ؛ يدير خوارزمية عتبة ، على التسلسل المتسلسل بأكمله ؛ يقيس الكثافة المتكاملة لكل صورة على حدة ؛ ويحفظ المقاييس كورقة Excel في المجلد الجذر.
- قم بتشغيل التحليل الكلي على جميع الشروط.
- اجمع بين القياسات (بشكل عام على الأقل n = 2 * 20) وقم بإزالة القيم المتطرفة (Q-test في لوحة الرسم البياني Prism v8).
- تطبيع القياسات إما للتحكم في المذيبات أو إلى اليوم 1 (اعتمادا على نوع التجربة ، الأول لتجربة تثبيط الدواء والأخير لتجربة حركية النمو). عبر عن القياسات على أنها عبء طبيعي للخلايا السرطانية (المحور y ) بمرور الوقت أو الحالة (المحور x ) كما هو موضح في الشكل 3 والشكل 4 ، على التوالي.
النتائج
لقد قدمنا إرشادات خطوة بخطوة لنهج سريع وسهل للتقدم من خط خلية جديد إلى تحليله. نبدأ بالتعبير الزائد عن متتبع الفلورسنت باستخدام كاسيت الإفراط في التعبير عن الفيروسات (الخطوتان 3 و 4). يتبع ذلك تحضير الخلية لضمان أقل حجم ميت ممكن أثناء الحقن ، مما يسمح بحقن أعداد خلايا عالية في كل من doC والفضاء المداري الرجعي (الخطوتان 6 و 7). بعد ذلك ، نقوم بإجراء الحصول على بيانات شبه عالية الإنتاجية باستخدام الفحص المجهري الفلوري المجسم والفحص المجهري متحد البؤر للتكبير العالي للتحليل النوعي لانتشار الخلايا السرطانية في الجسم بالكامل (الشكل 2 والخطوات 10 و 11 و 12). يجب توخي الحذر عند الحصول على البيانات ، لضمان قابلية التكرار لكل من التصوير المجهري المجسم ومتحد البؤر ، يتم تحديد الإعدادات العامة والتوحيد القياسي (الخطوتان 11 و 12). تمت مناقشة تحليل البيانات (باستخدام imageJ / Fiji) 16 ، جنبا إلى جنب مع التوحيد القياسي باستخدام وحدات ماكرو imageJ (الخطوة 13).
في الخطوة 3 ذكرنا الملصقات العابرة للخلايا (السرطانية) لإجراء فحص مسبق سريع لتقييم إمكانات الأورام لخط الخلايا السرطانية الجديد. أحد التحذيرات المهمة هو أنه على الرغم من سهولة الاستخدام والعمر الطويل ، إلا أن البقعة العابرة الموصوفة هنا لديها إمكانية تكوين قطع أثرية (على سبيل المثال ، يجب توخي الحذر لضمان إمكانية تمييز شظايا الخلية عن الخلايا الكاملة كما تم إجراؤها على نطاق واسع من قبل فيور وزملاؤه 9). في تجربتنا ، يرتبط تكوين هذه القطع الأثرية ارتباطا مباشرا بالاستقرار الشديد للبقعة والسطوع (حتى بعد موت الخلية) ، حيث يتم تشتيت شظايا الخلايا وامتصاصها بواسطة الخلايا المناعية ، والتي يمكن استنتاجها لاحقا بشكل خاطئ أنها مشتقة من ورم خبيث نشط.
في كلا النموذجين الموصوفين ، فإن النقش الجهازي من خلال doC والنقش الموضعي في الفضاء المداري الرجعي ، والفحص الشامل لليرقات بعد يوم واحد من الحقن له أهمية قصوى. كما هو موضح في الشكل 2 ب ، يجب إزالة جميع اليرقات التي تعرض الإزاحة الميكانيكية للخلايا المطعمة في منطقة الرأس (خارج الموقع المداري الرجعي) في النموذج المداري الرجعي والخلايا الموجودة في كيس الصفار ، أو تظهر وذمة في حوض الحقن doC. يتم عرض جميع الأنماط الظاهرية المختارة سلبا كغرز متحد البؤر عالية الدقة في الشكل 2 ، ولكن يمكن رؤيتها بسهولة وإزالتها من خلال الملاحظة المجهرية المجسمة.
بمرور الوقت سوف تهاجر الخلايا وتتكاثر. بالنسبة للنموذج المداري الرجعي ، لاحظنا التسلل إلى الأنسجة المجاورة ل CRMM1 ، لكننا لاحظنا انتشارا أقل ل CRMM2. لقد لاحظنا بشكل لافت للنظر ورم خبيث بعيد ينشأ بين 2-4 نقطة في البوصة في بعض الأفراد (20٪) ، حيث قمنا بقياس فرق كبير عند 6 نقطة في البوصة ، كما هو موضح في الشكل 4. بالنسبة لكلا خطي الخلايا ، اختبرنا إمكانات التكاثر عند حقنها في كلا الموقعين. بالنسبة ل CRMM1 ، كانت هناك زيادة كبيرة (p<0.0001) في عدد الخلايا السرطانية لمواقع الحقن أو في مواقع الحقن ، عند عرضها على أنها عبء طبيعي للخلايا السرطانية ، مع تطبيعها إلى اليوم الأول لكل نموذج (زيادة 7.8 أضعاف ، ±3.2 لنموذج RO وزيادة قدرها 15 ضعفا ±8،8 لنموذج doC). لم يظهر CRMM2 نموا كبيرا عند تطبيعه في اليوم الأول لكل نموذج على حدة (زيادة 2.4 ضعفا ، وزيادة ±1.9 و 2.3 ضعفا ، ±1.14 لتناضح العكسي و doC). تم العثور على CRMM1 للتكاثر بسهولة في كل من الأنسجة المدارية الرجعية والأنسجة الذيلية المكونة للدم بعد النقش. كان خط الخلية CRMM2 أقل تكاثرا في كلا النموذجين ، ولكن من المثير للاهتمام أنه وجد أنه قادر على ورم خبيث بعيد عند حقنه في الفضاء المداري الرجعي كما هو موضح في الشكل3 ب ، ج.
بعد فحص اليرقات المحقونة بدقة 1 نقطة في البوصة وتعيين الأفراد بشكل عشوائي إما لمجموعات العلاج أو المراقبة ، تمت معالجة الأسماك لمدة 6 أيام ، وتغيير الماء الذي يحتوي على فيمورافينيب (يمكن استبدال هذا المثبط بسهولة بأي مركب مضاد للأورام معاير). اخترنا توضيح نموذج نشر الورم الميلانيني الملتحمة الدموي المنشور سابقا الذي تم تطعيم CRMM114 ، من خلال اختبار فعالية Vemurafenib على CRMM1 المطعمة تقويميا. أظهر CRMM1 انخفاضا قويا كبيرا في المجموعة المطعمة خارج الرحم المعالجة بفيتامين فيمورافينيب (P<0.0001) واستجابة متقزمة ولكنها مهمة للنموذج المطعوم تقويم العظام (p<0.05) كما هو موضح في الشكل 4.
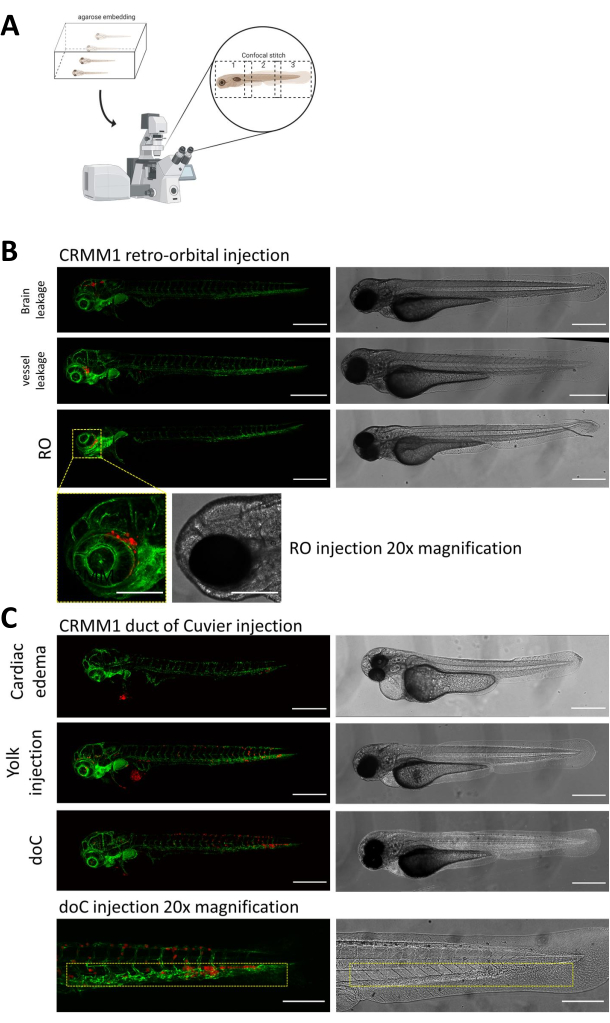
الشكل 2. تقييم النمط الظاهري والفحص بعد الحقن. أ) تصوير تخطيطي لتوليد غرزة متحد البؤر لأسماك الزرد ، مما ينتج عنه صور سلسة وعالية الدقة بعد دمج الإسقاط متحد البؤر اللاحق. هنا يتم تضمين الطعوم الغريبة لسمك الزرد في 1٪ من الاغاروز منخفض الذوبان ومثبتة على طبق متحد البؤر ذاعان زجاجي (كما هو موضح في الخطوة 11.3). ب) يتم عرض جميع النتائج المحتملة للحقن في النسيج الرجعي والقناة من كوفييه في أسماك الزرد الفلورية الخضراء (TG: fli: GFP) ، مع تلطيخ الخلايا من خلال الفيروس العدسي على التعبير عن tdTomato). نشير إلى النقش الصحيح عند 1 نقطة في البوصة (لوحة RO) والأنماط الظاهرية غير المرغوب فيها (تسرب الدماغ وتسرب الأوعية الدموية). يجب إزالة المجموعتين الأخيرتين للتأكد من أنهما لا يخلطان بين النتائج التجريبية في اتجاه المصب. ج) الأنماط الظاهرية غير المرغوب فيها للنقش الدموي من خلال قناة كوفييه (doC) هي الخطوط العريضة حيث يجب إزالة اليرقات الوذمية القلبية (وذمة القلب) واليرقات مع الخلايا التي تتسرب إلى كيس الصفار (حقن صفار البيض) لمنع التداخل مع القياسات النهائية. يتم إدخال اليرقات المحقونة بشكل صحيح في مجموعات تجريبية كما هو موضح في الخطوة 7.1. (جميع الصور التي تم الحصول عليها بدقة 1 نقطة في البوصة ، باستخدام مجهر متحد البؤر ، أشرطة مقياس 200 ميكرومتر. تشير المربعات الصفراء إلى المواقع النقيلية لكل من تطعيم التناضح العكسي و doC ، ومنطقة الرأس والأنسجة الذيلية المكونة للدم ، على التوالي). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
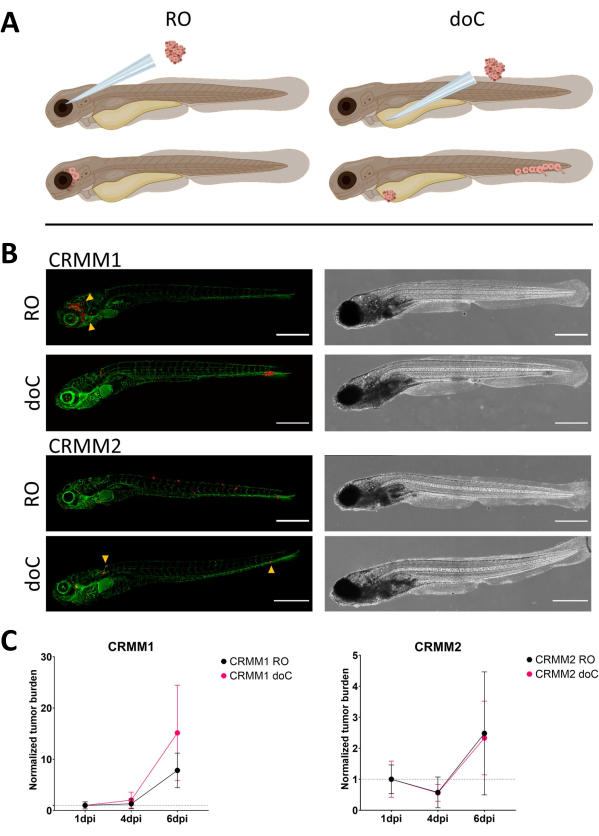
الشكل 3. يظهر التحليل المقارن لخطوط خلايا الورم الميلانيني الملتحمة CRMM1 و CRMM2 قدرة نقيلية ونمو تفاضلية. أ) التمثيل التخطيطي لنماذج الحقن ، والنموذج المداري الرجعي (RO) ونموذج النقش الدموي (doC) الأسماك المستخدمة هي مراسلو الأوعية الدموية الخضراء TG (fli: GFP) ، مع ظهور الخلايا فوق التعبير عن tdTomato باللون الأحمر. ب) الأنماط الظاهرية التمثيلية للأسماك المطعمة ب CRMM1 و CRMM2 ، يعرض CRMM1 نقشا فعالا (كل من RO و doC) وغزوا صغيرا في الأنسجة المحيطة بموقع نقش التناضح العكسي (RO ، رؤوس الأسهم الصفراء). يظهر CRMM2 كفاءة نقش أقل بشكل ملحوظ لكل من طرازي النقش ، ولكنه يظهر ورم خبيث بعيد عند حقنه بشكل رجعي (كما هو موضح في RO ، يشار إليه برؤوس الأسهم). (جميع الصور التي تم الحصول عليها بدقة 6 نقطة في البوصة ، مجهر متحد البؤر ، قضبان مقياس 200 ميكرومتر. تشير رؤوس الأسهم الصفراء إلى مواقع نقيلية لكل من تطعيم التناضح العكسي و doC ، ومنطقة الرأس والأنسجة الذيلية المكونة للدم على التوالي). ج) مخططات النقش الحركية لكل من CRMM1 و CRMM2 ، بمقارنة كلا نموذجي النقش باليوم 1 (التطبيع إلى اليوم 1) ، هناك زيادة كبيرة (p<0.0001) في عبء الورم الطبيعي لخط الخلية CRMM1 (بين 1 نقطة في البوصة و 6 نقطة في البوصة) حيث يوجد اتجاه تصاعدي (غير مهم) ل CRMM2. يكشف CRMM1 عن اختلاف كبير بين نمو التناضح العكسي و doC ، حيث يظهر نموذج doC معدل توسع أعلى للورم (أعلى بحوالي 2 مرة لليرقات المطعمة ب doC). تعرض الرسوم البيانية متوسط الخطأ والمعيار للمتوسط (SEM). تم تطبيع جميع المجموعات إلى 1 نقطة في البوصة لكل حالة على حدة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
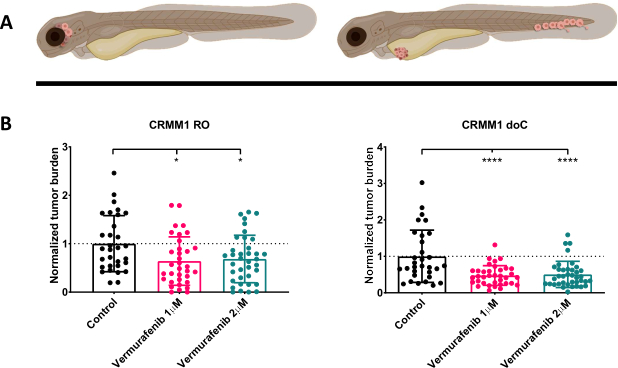
الشكل 4. يثبط مثبط BRAF V600E Vemurafenib بشكل كبير كل من الورم الميلانيني الملتحمة RO و doC يرقات الزرد المطعمة. أ) التمثيل التخطيطي للأنماط الظاهرية لأسماك الزرد ونماذج التناضح العكسي و doC. ب) تظهر كل من اليرقات المطعمة RO و doC ، المحقونة بخط خلية الورم الميلانيني الملتحمة CRMM1 انخفاضا كبيرا في عبء الورم الطبيعي (p<0.05 و P<0.001 على التوالي). تشير نماذج أسماك الزرد المطعمة ب doC إلى استجابة دوائية معززة وعلاقة مستقلة عن الجرعة بتثبيط الدواء ، مما يشير إلى تشبع محتمل للتثبيط). تظهر الرسوم البيانية متوسط الخطأ القياسي للمتوسط (SEM) ، وتم تطبيع جميع المجموعات للتحكم في كل خط خلية فردي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الكاشف | حجم |
| جهاز psPAX2 | 1.71 مليون مول (12.14 ميكروجرام) |
| بي إم دي 2.ز | 0.94 مليون مول (3.66 ميكروجرام) |
| نقل البلازميد * | 1.64 مليون دولار (حساب الحجم الدقيق) |
الجدول 1.
Discussion
هنا ، حددنا نهجا دقيقا لنمذجة الورم الميلانيني العيني الأولي والنقيلي في الطعوم الغريبة لأسماك الزرد. من خلال الجمع بين كل من الحقن الموضعي وتقويم العظام ونماذج الحقن الجهازية خارج الرحم ، قمنا بتلخيص مسببات التسرطن للسرطان حيث لم تكن هناك نماذج حيوانية متاحة من قبل. تسمح الشفافية المتأصلة في يرقة الزرد المبكرة بتتبع الخلايا السرطانية المصنفة بالفلورسنت على مستوى بأكمله ، مما يضمن سهولة تصور المواقع النقيليةالمحتملة 17. علاوة على ذلك ، يسمح لنا التحليل المجهري متحد البؤر عالي التكبير بتتبع الخلايا بدقة تحت الخلوية10.
لقد قدمنا إرشادات خطوة بخطوة لنهج سريع وسهل للتقدم من خط خلوي جديد إلى إنشاء الطعم الغريب وتحليله. نبدأ بالإفراط في التعبير عن متتبع الفلورسنت باستخدام كاسيت الإفراط في التعبير عن الفيروسات (الخطوتان 3 و 4) متبوعا بإعداد الخلية لضمان أقل حجم ميت ممكن أثناء الحقن. يتيح ذلك حقن أعداد خلايا عالية في كل من doC والفضاء المداري الرجعي (الخطوتين 7 و 8). ثم نقوم بإجراء الحصول على بيانات شبه عالية الإنتاجية باستخدام الفحص المجهري الفلوري المجسم والفحص المجهري متحد البؤر للتكبير العالي للتحليل النوعي لانتشار الخلايا السرطانية في الجسم بالكامل (الشكل 2 والخطوة 9 و 10). يجب توخي الحذر عند الحصول على البيانات ، لضمان قابلية التكرار لكل من التصوير المجهري المجسم ومتحد البؤر ، يتم تحديد الإعدادات العامة والتوحيد القياسي (الخطوتان 11 و 12). تمت مناقشة تحليل البيانات (باستخدام imageJ / Fiji) 16 ، جنبا إلى جنب مع التوحيد القياسي باستخدام وحدات ماكرو ImageJ (الخطوة 13).
في الخطوة 3 نذكر الملصقات العابرة للخلايا (السرطانية) لإجراء فحص مسبق سريع لتقييم الإمكانات السرطانية لخط الخلايا السرطانية الجديد. أحد التحذيرات المهمة هو أنه على الرغم من سهولة الاستخدام والعمر الطويل ، إلا أن البقعة العابرة الموصوفة هنا لديها إمكانية تكوين القطع الأثرية (على سبيل المثال ، يجب توخي الحذر لضمان إمكانية تمييز شظايا الخلايا عن الخلايا الكاملة كما تم إجراؤها على نطاق واسع من قبل فيور وزملاؤه 9). في تجربتنا ، يرتبط تكوين هذه القطع الأثرية ارتباطا مباشرا بالاستقرار الشديد للبقعة والسطوع (حتى بعد موت الخلية) ، حيث يتم تشتيت شظايا الخلايا وامتصاصها بواسطة الخلايا المناعية ، والتي يمكن استنتاجها لاحقا بشكل خاطئ أنها مشتقة من ورم خبيث نشط.
باستخدام هذه النماذج ، قمنا بمحاكاة تطور الورم الأولي عن طريق حصر الخلايا المطعمة جسديا داخل البيني المداري الرجعي. يضمن الفحص الشامل اللاحق بعد يوم واحد من النقش أن الخلايا الموجودة في موقع بعيد في وقت لاحق من التجربة قد انتشرت بنشاط (تم التسريح فيها ونشرها ، في النهاية إلى التسرب في مكانة النقيلية). يسمح النقش من خلال doC ، الوريد الأساسي المشترك الجنيني ، بزرع كميات كبيرة من الخلايا بسهولة وقابلة للتكرار بدرجة كبيرة (بفائض 600 خلية عند التركيز بشكل صحيح) ، والتحايل بشكل فعال على المراحل الأولية من الشلال النقيلي (التبديل) ويسمح لنا بالتركيز على المراحل اللاحقة من الشلال النقيلي (الالتصاق والتسرب والنتوء). على الرغم من أن الأدوات القوية عند استخدامها بشكل صحيح ، إلا أنه يجب مراقبة كلا النموذجين على نطاق واسع خلال اليوم الأول بعد النقش لضمان عدم استخلاص استنتاجات إيجابية خاطئة خلال المراحل اللاحقة من التجربة.
تماشيا مع المنشورات السابقة ، أظهرنا أن خطوط الورم الميلانيني الملتحمة تشكل بسهولة مستعمرات نقيلية بعد انتشارها في جميع أنحاء نظام الدورة الدموية لسمك الزرد14. نبلغ هنا عن توسع ذخيرة النقش مع الحقن المداري الرجعي كنموذج تقويم العظام ، والورم الخبيث النشط اللاحق إلى الأنسجة الذيلية المكونة للدم لخط الخلية CRMM2. بعد ذلك ، أبلغنا عن فعالية مثبط BRAF V600E المحدد Vemurafenib أيضا على الشكل الأساسي للورم الميلانيني الملتحمة عند نمذجته في يرقات الزرد.
باستخدام الطرق المذكورة أعلاه ، يمكن للباحث الماهر توليد ما يزيد عن مئات اليرقات المطعمة يوميا (حوالي 200 في الساعة) من أي من النموذجين المقترحين. في غضون أسبوعين ، يمكن معايرة الدواء للحصول على أقصى جرعة متسامحة ، وفحصه على نموذج xenograft المعمول به. من البداية إلى النهاية ، يمكن تحقيق استخدام خط خلوي غير محول ، إلى وجود ملف تعريف حساسية للأدوية في نموذج سمك الزرد في غضون شهر (بالنظر إلى أن خط الخلايا المحقون هو ورم داخل نموذج الزرد). في أيدينا ، أدى ما لا يقل عن 20 يرقة في كل تجربة وتكرارين بيولوجيين بشكل متكرر إلى تثبيط قوي للأدوية ، عندما تتعارض تجربتان فرديتان (أو لا تسفر عن تثبيط نمو ذي دلالة إحصائية) ، يمكن إجراء تكرار بيولوجي ثالث.
من خلال تعديلات طفيفة ، سمحت لنا هذه النماذج بتكييف استراتيجيات الزرع هذه بسرعة مع الورم الأرومي الدبقي (حقن تجويف الدماغ الخلفي) وسرطان الثدي (حقن doC) والساركوما العظمية (doC) من بين أمور أخرى 18،19،20،21. يمكن استخدام هذه النماذج لاحقا لكل من البحث الأساسي والفحص قبل السريري لكل من الأدوية الفردية واستراتيجيات الأدوية التوافقية. في الآونة الأخيرة ، وصفنا أنظمة إدارة مختلفة للأدوية وتنشيطها بالصور باستخدام هذه النماذج 13.
Disclosures
اي.
Acknowledgements
تم دعم هذا العمل بتمويل من برنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي بموجب اتفاقية المنحة رقم 667787 (مشروع UM Cure 2020 ، www.umcure2020.org). يتم الاعتراف بمجلس المنح الدراسية الصيني للحصول على منح الدكتوراه ل JY.
Materials
| Name | Company | Catalog Number | Comments |
| 2.5mm box filament | Science products | FB255B | for pulling micro injection needles using a Sutter P97 or P1000 |
| 3mL transfer pipettes | Merck | Z350796 | for transfer and selection of zebrafish embryos |
| Agarose | Milipore | 2120 | 1.5% (w/v) in eggwater, 1.5 g in 100 mL DPBS, microwave to dissolve, for injecting and stereofluorescence imaging of zebrafish larvae |
| Capillaries: borosilicate glass outer | World precision instruments | BF100-78-10 | Borosilicate glass capillaries used for needle preparation |
| DMSO | Sigma | D8418 | Often used as solvent in drug treatments, should be stored at 2-8°C the dark. |
| DPBS | Thermo Fischer Scientific | 14190144 | Dulbecco’s phosphate buffered saline, without Mg2+ and Ca2+ for washing the cells, lack of Ca2+ impairs cell-cell adhesion through cadherins and prevents cell aggregation during injection |
| Egg water | Instant ocean | SS15-10 | 0.6 mg/L final concentration sea salt in demineralized water |
| GFP encoding lentiviral transfer plasmid | Addgene | Plasmid #106172 | Generated in Snaar lab, available at Addgene |
| Hek293T | ATCC | CRL-3216 | Stable cell line for generating lentiviral particles, contains SV40-T antigen required for the generation of lentiviral particles |
| Leica sp8 confocal | Leica | Leica TCS SP8 | automated stage confocal microscope with 405/488/514/635nm lasers |
| LipodD293 | Signagen | SL100668 | Highly efficient HEK293t optimized transfection reagent |
| Low-melting agarose | Milipore | 2070 | 1% (w/v) in eggwater 1.5 g in 100 mL DPBS, microwave to dissolve, for embedding zebrafish larvae for confocal imaging |
| Micro loader tips | Fischer scientific | 10289651 | flexible microloader tips |
| Micro manipulator | World precision instruments | M3301R | x/y/z manual micro manipulator for microinjection |
| Needle puller: P-97 or P-1000 | Sutter | P-97 | needle puller used for generating standardized micro engraftment needles |
| Nr.5 watchmakers forceps | VWR | HAMMHSC818-11 | fine watchmakers forceps used for breaking back needles |
| Picopump | World precision instruments | SYS-PV820 | pulse controller supplying pressure for microinjection |
| pMD2.G | Addgene | plasmid #12259 | Gifted by Didier Trono, 2nd generation lentiviral virulence plasmid |
| psPAX2 | Addgene | plasmid #12260 | Gifted by Didier Trono, 2nd generation lentiviral packaging plasmid |
| PVP40 | Sigma-Aldrich | PVP40 | Polyvinylpyrrolidone average mol wt 40,000) PVP40 2% (w/v) in DPBS, 1 g PVP40 in 50 mL DPBS. Vortex and incubate at 37°C to facilitate dissolving. Store at room temperature. |
| tdTomato encoding lentiviral transfer plasmid | Addgene | Plasmid #106173 | Generated in Snaar lab, available at Addgene |
| transmitted light stereo microscope | Leica | leica M50 with (MDG33 base) | leica transmitted light microscope with mirror adjustable illumination. |
| Tricaine | Sigma-Aldrich | E10521 | Ethyl 3-aminobenzoate methanesulfonate or MS-222 |
| TryplE | Thermo Fischer Scientific | 12604-01 | Synthetic trypsine replacement, less damaging to the cells and allows for the gentle dispersion of strongly adherent cells. (Thermo- |
| willco dish | WillCo wells | GWST-5040 | 50mm glass bottom dishes, allow for the embedding of up to 20 zebrafish larvae, enabling the imaging of multiple conditions in one dish due to its large optical glass surfac |
References
- Yang, J., Manson, D. K., Marr, B. P., Carvajal, R. D. Treatment of uveal melanoma: where are we now. Therapeutic Advances in Medical Oncology. 10, (2018).
- Wong, J. R., Nanji, A. A., Galor, A., Karp, C. L. Management of conjunctival malignant melanoma: A review and update. Expert Review of Ophthalmology. 9, 185-204 (2014).
- Nguyen, D. X., Bos, P. D., Massagué, J. Metastasis: from dissemination to organ-specific colonization. Nature Reviews Cancer. 9, 274-284 (2009).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2, 183-189 (2008).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nature Reviews Drug Discovery. 4, 35-44 (2005).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Palmblad, M., et al. Parallel deep transcriptome and proteome analysis of zebrafish larvae. BMC Research Notes. 6, 428 (2013).
- Yan, C., et al. Visualizing Engrafted Human Cancer and Therapy Responses in Immunodeficient Zebrafish. Cell. 177, 1903-1914 (2019).
- Fior, R., et al. Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts. Proceedings of the National Academy of Sciences of the United States of America. 114, 8234-8243 (2017).
- Campbell, P. D., Chao, J. A., Singer, R. H., Marlow, F. L. Dynamic visualization of transcription and RNA subcellular localization in zebrafish. Development. 142, 1368-1374 (2015).
- Campeau, E., et al. A Versatile Viral System for Expression and Depletion of Proteins in Mammalian Cells. PLoS One. 4, 6529 (2009).
- vander Helm, D., et al. Mesenchymal stromal cells prevent progression of liver fibrosis in a novel zebrafish embryo model. Scientific Reports. 8, 16005 (2018).
- Chen, Q., et al. TLD1433 photosensitizer inhibits conjunctival melanoma cells in zebrafish ectopic and orthotopic tumour models. Cancers. 12, (2020).
- Pontes, K. C. d. e. S., et al. Evaluation of ( fli:GFP ) Casper Zebrafish Embryos as a Model for Human Conjunctival Melanoma. Investigative Opthalmology & Visual Science. 58, 6065 (2017).
- Liverani, C., et al. Innovative approaches to establish and characterize primary cultures: an ex vivo 3D system and the zebrafish model. Biology Open. 6, 133-140 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2, 183-189 (2008).
- Mercatali, L., et al. Development of a patient-derived xenograft (PDX) of breast cancer bone metastasis in a Zebrafish model. International Journal of Molecular Sciences. 17, (2016).
- Tulotta, C., et al. Imaging cancer angiogenesis and metastasis in a zebrafish embryo model. Advances in Experimental Medicine and Biology. 916, 239-263 (2016).
- Paauwe, M., et al. Endoglin expression on cancer-associated fibroblasts regulates invasion and stimulates colorectal cancer metastasis. Clinical Cancer Research. 24, 6331-6344 (2018).
- Cao, J., et al. Overexpression of EZH2 in conjunctival melanoma offers a new therapeutic target. Journal of Pathology. 245, (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved