Method Article
השתלת קסנו של דג זברה אורתו-רחמי וחוץ רחמי של מלנומה עינית כדי לסכם גידול ראשוני והתפתחות גרורות ניסיוניות
In This Article
Summary
כאן, אנו מציגים פרוטוקול להקמת מודלים רב-תכליתיים של דג זברה אורתוטופי וחוץ רחמי למלנומה עינית כדי להעריך את קינטיקת הצמיחה של הגידול הראשוני, התפשטות, אקסטרוואזציה והיווצרות גרורות רחוקות, פרי-וסקולריות והשפעת העיכוב הכימי עליהן.
Abstract
כיום אין מודלים של בעלי חיים למלנומה עינית גרורתית. היעדר מודלים של מחלות גרורות פגע מאוד במחקר ובפיתוח של אסטרטגיות חדשות לטיפול במלנומה עינית גרורתית. בפרוטוקול זה אנו מתארים דרך מהירה ויעילה ליצירת מודלים של דג זברה עוברי הן לשלב הראשוני והן לשלב המפוזר של מלנומה עינית, באמצעות השתלת תאים חוץ רחמיים רטרו-אורביטליים ותוך וסקולריים, בהתאמה. בשילוב שתי אסטרטגיות ההשתלה השונות הללו אנו יכולים לסכם את האטיולוגיה של הסרטן בכללותו, להתקדם מגידול גידול ראשוני ומקומי מתחת לעין להיווצרות גרורות פרי-וסקולריות בזנב. מודלים אלה מאפשרים לנו לשנות במהירות ובקלות את התאים הסרטניים לפני ההשתלה עם תיוג ספציפי, התערבות גנטית או כימית; ולטפל במארחים המושתלים במעכבים (מולקולריים קטנים) כדי להחליש את התפתחות הגידול.
כאן, אנו מתארים את היצירה והכימות של השתלה אורתוטופית וחוץ רחמית של מלנומות עיניים (מלנומה של הלחמית והענבה) באמצעות קווי תאים יציבים המסומנים פלואורסצנטית. פרוטוקול זה ישים גם להשתלה של תאים ראשוניים שמקורם בביופסיה של המטופל וחומר שמקורו בחולה/PDX (כתב יד בהכנה). תוך שעות לאחר ההשתלה ניתן לדמיין ולכמת את נדידת התאים והתפשטותם. שני מוקדי הגידול זמינים להדמיה הן במיקרוסקופיה אפיפלואורסצנטית והן במיקרוסקופיה קונפוקלית. באמצעות מודלים אלה, אנו יכולים לאשר או להפריך את הפעילות של אסטרטגיות עיכוב כימיות או גנטיות תוך 8 ימים בלבד לאחר תחילת הניסוי, מה שמאפשר לא רק סריקה יעילה ביותר על קווי תאים יציבים, אלא גם מאפשר סריקה מכוונת מטופל לגישות רפואה מדויקת.
Introduction
התפשטות גרורתית נחשבת לגורם המוות העיקרי של מלנומה עינית; נכון לעכשיו אין משטר טיפול בר-קיימא למלנומה עינית מפושטת 1,2. יתר על כן, אין מודלים זמינים של בעלי חיים למלנומה עינית המשקפת את המחלה הגרורתית. כדי לגשר על הפער הזה, יצרנו שני מודלים נפרדים של דג זברה המסכמים את היווצרות הגידול הראשוני או את השלבים המוקדמים של התפשטות גרורתית, ובכך מאפשרים בקלות לחקור את התהליכים הקשים בדרך כלל למחקר 3. מודלים של מיקרו-גרורות מאפשרים ניתוח של השלבים האחרונים של התפשטות גרורתית, כולל ביות, קולוניזציה ואקסטרווזציה. התערבויות גנטיות או כימיות בשלב זה ומעבר לכך יכולות לספק אחיזת יד חזקה בטיפול במלנומה עינית גרורתית.
השימוש בזחלי דג הזברה כמקבל של קסנו ואלוגרפט נתמך על ידי החוזקות הפנימיות של מין זה, כגון השקיפות האופטית שלו בשלבי ההתפתחות המוקדמים (או כל מחזור החיים שלו עבור מוטציות קספר 4), פוריות גבוהה והפריה מחוץ לרחם 5. הומולוגיה שעתוק גבוהה בבעלי חוליות מבטיחה שמירה על מנגנוני איתות הליבה בין דג הזברה לבני אדם ולכן יכולת תרגום פוטנציאלית גבוהה של תוצאות 6, אם כי גישות גנטיות לפעמים פגומות או מסובכות עקב שכפול גנום הטלאוסט 7. ההתפתחויות האחרונות הדגישו את החשיבות של מודלים של קסנוגרפט של דג הזברה כ"אווטרים" פרה-קליניים של מחלות אנושיות8, והניבו למעשה מספר רב של מודלים מותאמים אישית לטיפול בסרטן להערכה פרה-קלינית של אסטרטגיות טיפול מניסוי יחיד של דג זברה 9.
בהתחשב במחסור במודלים של בעלי חיים ובהיעדר אפשרויות טיפול במלנומה עינית גרורתית, המודלים שלנו מספקים פלטפורמת תרגום מהירה וקלה לסינון שינויים גנטיים (פנימיים של תאים סרטניים) או לפיתוח אסטרטגיות התערבות כימיות בסביבה פרה-קלינית. בתוך אותו מודל אנו יכולים לדמיין ולמדוד קינטיקה של צמיחת תאים סרטניים, קצב השתלה/פוטנציאל גרורתי, וביות תאים ברמת חיה שלמה באמצעות הגדלה ברמה נמוכה במיקרוסקופ פלואורסצנטי סטריאו, ולבצע מדידות דומות באמצעות ניתוח מיקרוסקופי קונפוקלי בהגדלה בינונית או גבוהה כדי לנתח שלבים שונים של התקדמות מלנומה בעין ברזולוציה תת-תאית 10.
כאן, אנו מתארים פרוטוקולים מקיפים ומפורטים עבור: יצירת תאים סרטניים בעלי תווית פלואורסצנטית באמצעות התמרה לנטי-ויראלית אופטימליתביותר 11; השתלות תוך-ורידיות ורטרו-אורביטליות (RO) עוקבות של תאים אלה לתוך יומיים לאחר ההפריה (DPF) זחלי דג הזברה כדי ליצור מודלים חוץ רחמיים ואורתוטופיים בהתאמה; ואחריו איסוף נתונים וניתוחם. שיטות אלה, למרות שהן מקיפות עבור היישומים המתוארים כאן, ניתנות לשינוי כדי להשתיל תאים בחלל המוח האחורי, בכבד ובחלל הפריביטלין בעת הצורך (אך ורק על ידי שינוי מקום ההזרקה, או זמן ההזרקה)12,13.
כהוכחת היתכנות הרחבנו את הממצאים של Pontes et al. 2018, שם הראינו מינון ותגובה ספציפית למוטציה מהותית של תאים של קווי תאי מלנומה של הלחמית במודל דג הזברה 14. הרחבנו את הממצאים הללו על ידי הצגת היעילות של מעכב המוטציה הספציפי למוטציה BRAF V600E vemurafenib הן במודלים של מלנומה גרורתית והן במודלים ראשוניים של מלנומה של הלחמית.
Protocol
כל הניסויים בבעלי חיים אושרו על ידי ועדת הניסויים בבעלי חיים (Dier Experimenten Commissie, D.E.C) ברישיון AVD1060020172410. כל בעלי החיים הוחזקו בהתאם להנחיות המקומיות תוך שימוש בפרוטוקולים סטנדרטיים (www.ZFIN.org).
1. הכנה
- ריאגנטים
- מכינים מי ביצים: 0.6 מ"ג/ליטר מלח ים בריכוז סופי.
- הכינו 5 מ"ג/מ"ל טריקאין 25x ציר: מערבבים 5 גרם אבקת טריקאין (אתיל 3-אמינובנזואט מתאן סולפונאט או MS-222), 900 מ"ל מים דה-מינרליים ו-21 מ"ל של 1 M Tris (pH 9). התאימו ל-pH 7 ומלאו עד 1 ליטר. ניתן לאחסן טריקאין בטמפרטורה של 4 מעלות צלזיוס לטווח קצר (עד שישה חודשים) או ניתן לאחסן אותו בטמפרטורת החדר למשך חודש בטמפרטורת החדר כאשר הוא מוגן מאור השמש.
- הכינו 1.5% (w/v) אגרוז במי ביצים: 1.5 גרם ב-100 מ"ל DPBS. מיקרוגל להמסה.
- הכן 1% (w/v) אגרוז נמס נמוך במי ביצים: 1.5 גרם ב-100 מ"ל DPBS. מיקרוגל להמסה.
- הכן מלאי PVP40 של 2% (w/v) ב-DPBS: 1 גרם של PVP40 ב-50 מ"ל של DPBS. מערבולת ודגירה בטמפרטורה של 37 מעלות צלזיוס כדי להקל על המסה. יש לאחסן בטמפרטורת החדר.
- השתמש ב-DMSO. הוא משמש לעתים קרובות כממס בטיפולים תרופתיים ויש לאחסן אותו בטמפרטורה של 2-8 מעלות צלזיוס בחושך.
- השתמש ב-TrypLE, תחליף טריפסין סינתטי שפחות מזיק לתאים ומאפשר פיזור עדין של תאים נצמדים חזק.
- הכינו את תמיסת המלח הפוספטית (DPBS) של Dulbecco ללא Mg2+ ו-Ca2+ לשטיפת התאים. היעדר Ca2+ פוגע בהידבקות תאים-תאים באמצעות קדרינים.
- הכן פלסמידים לנטיויראליים: psPAX2 (פלסמיד #12260) ו-pMD2.G (פלסמיד #12259) שהוענקו על ידי דידייה טרונו ו-GFP (פלסמיד #106172) או tdTomato (פלסמיד #106173) המקודד פלסמיד העברה (Addgene).
- השתמש ב-LipodD293: מגיב טרנספקציה יעיל HEK293T אופטימלי.
- מנת אגרוז
הערה: בעת שימוש בכלים שאוחסנו זמן רב הקפידו להוסיף נפח קטן של מי ביצים לכלים לפני תחילת ההזרקה (זה ימנע מהדג להתייבש מהר מדי).- מכינים 1.5% (w/v) כלים מצופים אגרוז (אגרוז מומס במי ביצה).
- יש להשתמש מיד, או לאחסן בטמפרטורה של 4 מעלות צלזיוס במצב הפוך.
2. מחטים
הערה: ודא שהנימים כוילו על החוט בו נעשה שימוש. בעת החלפת החוט או הנימים, קבע את ערך הרמפה של הנימים על החוט המשמש (ראה מדריך למושך מחט).
- נימי זכוכית אחד יניב שתי מחטי הזרקת מיקרו. לפני הכנת מחטים, בדוק את התקינות המבנית של החוט (חוט קופסה 2.5 מ"מ) של מושך המחט.
- ודא שגם החוט וגם הנימים מכוילים כדי לקבל את ערך הרמפה המתאים. כאשר השלמות המבנית של החוטים נפגעת (כלומר, לא אחיד, חורים, מותך וכו'), שנה את החוטים.
- השתמש בתוכנית הבאה (מחט #99, חום = רמפה + 15, משיכה = 95, מהירות = 60, זמן = 90). אחסן את המחטים בצלחת פטרי ייעודית (המכילה חימר או סרט להדביק את המחטים)
3. יצירת חלקיקים לנטי-ויראליים
הערה: כדי למנוע בזבוז זמן ומשאבים, ניתן לבצע בדיקת גידול מהירה לפני התמרה לנטי-ויראלית. זה נעשה כדי להבטיח שקו התאים שישמש יהיה גידולי מספיק במודל דג הזברה, לשם כך ניתן לצבוע את התאים ב-CMdiI (או עוקב אנלוגי) כמתואר ב-Liverani et al. 2017 15.
- צלחת תאי HEK 293t יום אחד לפני הטרנספקציה כדי להשיג מפגש של כ-70% (נעשה באופן שגרתי על ידי פיצול בקבוק מלא לאותו בקבוק תרבית בנפח בדילול של 1:3 יום אחד לפני).
- ביום הטרנספקציה, יש להעביר במשותף את פלסמידי האריזה הנדרשים psPAX2 ו-pMD2.G המעטפת הנגיפית המבטאת פלסמיד יחד עם GFP (Plasmid #106172) או tdTomato (Plasmid #106173) המקודד את פלסמיד ההעברה. הכמות המדויקת של הפלסמיד בשימוש מצוינת בטבלה 1.
הערה: גם psPAX2 וגם pMD2.G הוענקו במתנה על ידי דידייה טרונו (Addgene plasmid #12260 ו-#12259, בהתאמה).
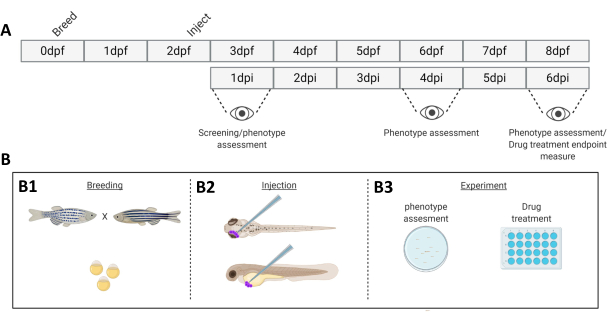
איור 1. ייצוג סכמטי של מערכת החריטה המתוארת של דג הזברה. א) ציר הזמן של הגישה, עם גידול דג הזברה ביום 0 (B1). הדגים נאספים בבוקר לאחר חציית הדג (יום 1). לאחר 48-54 שעות הדגים בקעו ברובם (משילים את הכוריון שלהם) והדגים מוזרקים (רטרו-אורביטלית או סיסטמית, B2) לאחר ניקוי המים מפסולת הכוריון (יום 2). הזחלים נבדקים לאחר מכן באמצעות מיקרוסקופ פלואורסצנטי סטריאו וכל הזחלים המציגים פנוטיפים לא רצויים מושלכים (יום 3). בהתאם למטרת הניסוי, הזחלים מצולמים לאורך זמן (B3, קינטיקה של השתלה, מצולמים ב-1, 4 ו-6 ימים לאחר ההזרקה (dpi)) או שהדגים מחולקים באופן אקראי ונכנסים לקבוצות ניסוי, מטופלים בתרופות ומושווים לביקורת רכב (בדיקת תרופות, מצולמת ב-6 dpi). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- מערבבים את כל הפלסמידים יחד ב-500 מיקרוליטר של מדיום נטול סרום, כדי לאפשר ערבוב מלא של כל הפלסמידים. הוסף 32 מיקרוליטר של מגיב LipoD293 ל-500 מיקרוליטר של DMEM ללא סרום, ומערבולת לערבב לחלוטין. מערבבים היטב את שני הכרכים יחד. אפשר לפלסמידים ול-lipoD293 להרכיב במשך 20 דקות.
- הוסף טיפה לבקבוק תרביתתאים בגודל 75 ס"מ המכיל 70% תאי HEK293T קונפלואנטים המכילים 9 מ"ל של מדיום תרבית שלם. הוסף את תערובת הטרנספקציה ישירות לשכבת התא באמצעות פיפטה סרולוגית (בקבוק בכיוון אופקי).
- החלף את המדיום ב-20 מ"ל של DMEM שלם טרי 16 שעות לאחר הטרנספקציה. קציר סופרנטנט לאחר 72 שעות לאחר הטרנספקציה. Aliquot supernatant ויראלי ב-1 מ"ל aliquots ומאחסנים ב-80 מעלות צלזיוס. הסופרנטנט הלנטי-ויראלי יציב בטמפרטורה של -80 מעלות צלזיוס למשך שנה אחת לפחות.
4. התמרה לנטיוויראלית
- לפני התמרה לנטי-ויראלית, קבע עקומת הריגה בעת שימוש במבנה לנטי-ויראלי לבחירה.
- עבור עקומת ההריגה, צלח את קו התא שיותמר בצלחת של 12 בארות (מפגש של כ-10-20%). הוסף עקומת מינון של הסלקטור (ריכוזים משוערים לעקומות הריגה: פורומיצין 0.5-10 מיקרוגרם/מ"ל, בלסטיצידין 1-20 מיקרוגרם/מ"ל, גנטיצין (G418) 100-2000 מיקרוגרם/מ"ל, היגרומיצין 100-2000 מיקרוגרם/מ"ל).
- החלף את המדיום כל שלושה ימים כדי להבטיח ריכוז יציב של הסלקנט הנבחר.
- הוסף 1 מ"ל של סופרנטנט לנטי-ויראלי ל-9 מ"ל של מדיום תרבית, המכיל ריכוז סופי של 8 מיקרוגרם/מ"ל פוליברן על 20-40% תאים קונפלואנטים. ניתן להקטין את הנפחים, תוך שמירה על יחס זה של סופרנטנט/מדיום.
- 16-24 שעות לאחר ההעברה, החלף את המדיום. במידת הצורך, חזור על השלב הקודם כדי לשפר את חדירת הפנוטיפ (בדוק את הקרינה כדי להחליט אם נדרשת התמרה נוספת).
- 48 שעות לאחר ההעברה, בחר את התאים באמצעות האנטיביוטיקה המתאימה לסמן העמידות המשולב בקלטת הלנטי-ויראלית. הריכוז שישמש לבחירת אוכלוסיית התאים המתומרת אמור להרוג את אוכלוסיית הבר תוך 7 ימים לאחר יישום הסלקנטנט (כלומר, לאפשר לתאים המומרים לגדול מעבר לאוכלוסיית הבר).
- השתמש בסופרנטנט ויראלי בריבוי זיהום שונה (MOI's) כדי להבטיח שההתמרה והנגעים הגנטיים שנגרמו על ידי הגנום התאי לא ישפיעו לרעה על כדאיות התא או הגידול.
5. גידול דג זברה
- ביום 0, יומיים לפני ההשתלה של תאים סרטניים, הזדווגו דגי זברה בוגרים בצורה של "הכלאה משפחתית" בטמפרטורת החדר (איור 1).
- הסר את מיכל דג הזברה ממערכת הדיור (נשמר בטמפרטורה של 28.5 מעלות צלזיוס).
- הפרד את הדגים לאשכולות רבייה קטנים ביחס של 1:1 זכר לנקבה, עם 10 דגים בכל אשכול. הניחו את הדגים במיכלי גידול קטנים, במים שנשאבים ממערכת הדיור, מעל סורג מלוכסן (מלוכסן, כדי לחקות את הרדודים שבהם דג הזברה היה משריץ באופן טבעי).
הערה: כתוצאה מירידה בטמפרטורה מ-28.5 מעלות צלזיוס לטמפרטורת החדר (25 מעלות צלזיוס) והכניסה לשלב האור הבא של מחזור החושך/אור הדגים ישריצו. - לאחר מכן, הסר את המבוגרים והעביר למיכל הדיור שלהם.
- אוספים את הביצים ושוטפים במי ביצים בעזרת מסננת. מחלקים את הביצים לכ-75-100 למנה ושומרים על 28.5 מעלות צלזיוס.
- כ-6 שעות לאחר האיסוף, יש לנקות את הכלים מעוברים מתים או מעוותים.
- למחרת בבוקר, החליפו את מי הביצים ושוב נקו את הכלים מעוברים מתים.
6. קצירת תאים
הערה: הכנת תאים נכונה היא המפתח להליך ההשתלה, שימוש בכמות מיותרת של תאים מאפשר עיבוד קל יותר במורד הזרם. שלב הצנטריפוגה השלישי הוא קריטי, מכיוון שזה ישאיר אותך רק עם כדור התא, ה-PBS הנותר תקוע בצידי צינור הצנטריפוגה עולה בהרבה על נפח ההשעיה הסופי.
- יש לחמם מראש את כל המדיה והתמיסות המשמשות בתרבית תאים באמבט מים של 37 מעלות צלזיוס לפני השימוש.
- מוסיפים 2 מ"ל TryplE לכל 75 ס"מ2 בקבוק תרבית או 1 מ"ל לכל 25 ס"מ2 בקבוק ודוגרים עד שכל התאים מעוגלים. עבור רוב קווי התאים 2-5 דקות אמורות להספיק. עבור תאים אפיתל גבוהים או תאים פיברובלסטיים, 5-10 דקות אמורות לאפשר ניתוק תקין (טריפסיניזציה לא מספקת תעכב תהליכים במורד הזרם, ותקל על צבירת תאים במהלך ההשתלה).
- הקש בעדינות על צד הבקבוק כדי לעקור את התאים הנותרים.
- הוסף לנפח התרבות המקורי של מדיום שלם. פיפטה למעלה ולמטה בעדינות אך ביסודיות עם פיפטה סרולוגית לגזירת גושי תאים לתרחיף תא בודד. אין לייצר קצף במהלך תהליך זה מכיוון שקצף מעיד על גזירה מכנית של התאים.
- מעבירים לצינור סטרילי של 15 מ"ל וצנטריפוגה למשך 5 דקות בחום של 200 x גרם בטמפרטורת החדר. שאפו סופרנטנט והוסיפו 1 מ"ל PBS סטרילי. השעו בזהירות וביסודיות את התאים באמצעות פיפטה סטרילית של 1000 מיקרוליטר.
- הסר את תרחיף התאים של 20 מיקרוליטר לספירה והעבר את תרחיף התאים הנותר לצנטריפוגה. צנטריפוגה למשך 4 דקות בחום של 200 x גרם בטמפרטורת החדר.
- שלב קריטי: הסר את כל PBS, צנטריפוגה למשך 30 שניות ב-200 x גרם בטמפרטורת החדר, והסר את ה-PBS הנותר.
- יש לדלל את התאים ל-250 תאים/נ"ל ב-2% פוליוויניל פירולידון 40 (PVP40, 2% (w/v) ב-DPBS) כדלקמן:
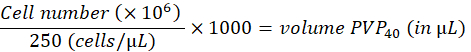
(לדוגמה,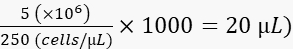
- השעיה יסודית של התאים, תוך מניעת היווצרות בועות אוויר (ניתן לשמור את התאים לפחות שעתיים ב- 2% PVP40 ללא אובדן פוטנציאל גידול).
7. דוגמנות Xenograft
כל הניסויים צריכים להתבצע בהתאם לתקנות רווחת בעלי החיים המקומיות.
בהתאם ליישום, שתי וריאציות עיקריות בתכנון הניסוי מסווגות כהערכת פנוטיפ (7.1 בשלב ההקרנה המקדים) ושנית, 7.2 מסך שבו התאים שונו לפני ההשתלה או 7.3 כאשר העוברים מטופלים במעכב כימי.
- סינון מקדים וקביעת פוטנציאל גידול
- השתל זחלי דג זברה מעניינים (WT, קו טרנסגני או מדווח) ב-2 dpf עם מספר משתנה של תאים פלואורסצנטיים (כלומר, 200, 400, 600 ±100).
- זחלי סקר 16-24 שעות לאחר ההזרקה כדי להסיר חריגים (מספר תאים גבוה או נמוך במיוחד במחזור עבור המודל החוץ רחמי, או תאים בתוך הראש עבור המודל האורתוטופי) ולהסיר דגים שהושתלו בצורה שגויה. ציין מספר זחלים לכל קבוצת ניסוי לניתוח קבוצתי לעומת ניתוח קינטי של אותם זחלים.
- עקוב אחר זחלי דג הזברה במרווחי זמן קבועים (1,2,4,6 ימים לאחר ההזרקה (dpi)) ודמיין 20 פרטים (כמתואר בשלבים 9 ו-10), מתוך מאגר של ±50 זחלים.
- לעקוב אחר פנוטיפ כללי והתקדמות המחלה ולאחר מכן לכמת באמצעות ImageJ (מדידת צפיפות משולבת של אות הפלואורופור בתאי הסרטן).
- שרטטו את הנתונים כדי להמחיש את קינטיקה של גדילת תאי הסרטן בתוך דג הזברה (איור 3).
- שנה תאים אפריורי (להפיל או להפיל גן מעניין) ולהשתיל לדג זברה.
- השתל דגים והסר את כל הפנוטיפים הלא רצויים (לפי תנאי).
- דמיינו את הפרטים ב-1 dpi (20 זחלים לקבוצה). ניתן לדמות פרטים במרווחי זמן קבועים (1,2,4 ו-6 dpi).
- ב-6dpi לאחר ההדמיה, המתת חסד של הדג על ידי מינון יתר עם טריקאין (פי 10 יותר במינון של 0.4 מ"ג/מ"ל) והשליך על נייר סופג המצפה משפך.
- טפל בדגים בתרופות לאחר ההשתלה.
- לפני יישום התרופה על דג זברה מושתל, קבע את המינון המקסימלי הנסבל (MTD) על דג הזברה (טיטראט ירד מ-10 מיקרומטר - 0.150 ננומטר, תוך שימוש בנפח הגבוה ביותר של ממס כבקרה שלילית) קבענו את ה-MTD כריכוז שבו >80% מהאנשים שורדים את כל הטיפול.
- יום אחד לאחר ההזרקה, הסר את הפנוטיפים הלא רצויים.
- חלקו את הדגים באופן אקראי לקבוצות (36-48 פרטים/מצב) ושמרו בצלחת של 24 בארות עם 6 זחלים לבאר ב-1 מ"ל מי ביצה.
- החל תרופות 24 שעות לאחר ההשתלה. כביקורת השתמש באותה כמות של ממס (DMSO, EtOH וכו') בנפח הגבוה ביותר המיושם עבור קבוצת ניסוי.
- התחל טיפול תרופתי במינון המקסימלי הנסבל. החלף את התרופה המכילה מי ביצה כל יומיים. הסר מי ביצים וזחלים מתים בצורה מלאה ככל האפשר במהלך כל שינוי.
8. הזרקה
הערה: השתמש בבקר דופק פנאומטי המחובר לקו אוויר דחוס, המספק לחץ בעודף של 100 psi. זה מאפשר מספיק לחץ הן להזרקה (≈20 psi) והן להוציא אגרגטים אפשריים של תאים (≈100 psi). לחץ ההתחלה והזמן צריכים להיות כ-200 אלפיות השנייה ב-20 psi. אם יש להפחית את אחד מהם ביותר מ-50% בתחילת ההזרקה, או שתרחיף התא נוזלי מדי (ריכוז תא או PVP40 נמוך מדי) או שפתח המחט גדול מדי.
- הסר בזהירות מחט נימית מהמיכל שלה. שברו את המחט ליצירת פתח של ø20 מיקרומטר, באמצעות מלקחיים עדינים של שענים.
- השעו בזהירות וביסודיות את התאים באמצעות קצה פיפטה של 20 מיקרוליטר. מתלה תאי פיפטה לתוך מחט נימי הזכוכית הפתוחה באמצעות קצה ארוך (מיקרו-מעמיס). טען את המחט לתוך המניפולטור המיקרו.
- מניחים ~20-40 זחלים מורדמים ב-0.04 מ"ג/מ"ל טריקאין על צלחת אגרוז באמצעות פיפטת העברה. הסר עודף לחות כדי לשתק את הזחלים באמצעות פיפטת העברה. הזחלים יהיו מכוונים לרוב בצורה רוחבית בשל נוכחותו של שק חלמון גדול יחסית.
- הזרקו לזחלים כ-200, 400 ו-600 תאים דרך צינור קובייה (doC) למודל חוץ רחמי.
- באופן דומה, הזרקו זחלים רטרו-אורביטלית (RO). כדי להניב את המודל האורתוטופי (הזרקת 100 ±50 תאים), שנה את אורך הדופק הפנאומטי על משאבת הפיקו (התחל ב-~20 psi, 200 ms והתאם בהתאם). במהלך ההזרקה יש לוודא שהזחלים לא יתייבשו. ודא שכל (או רוב) הזחלים מוזרקים.
- שטפו את הזחלים שהוזרקו במי ביצים טריים והעבירו לצלחת פטרי נקייה מסומנת (איגום של עד 150 פרטים למנה). חזור על תהליך זה עד להזרקת מספיק זחלים.
- לאחר ההשתלה, שמור על הדג בטמפרטורה של 34 מעלות צלזיוס בחממה לחה, שבה 34 מעלות צלזיוס היא הטמפרטורה הגבוהה ביותר הנסבלת בקלות על ידי דג הזברה ומאפשרת השתלה יעילה של תאי סרטן יונקים.
הערה: באופן כללי, עם הזרקת שורות תאים בודדים הן ב-doC והן ב-RO ראינו מוות משוער עקב נזק מכני של <5% (נזק מכני הורג את הזחלים בין 1-16 שעות לאחר ההזרקה).
9. הקרנה
- באמצעות מיקרוסקופ סטריאו-פלואורסצנטי, סנן את הדגים עבור הפנוטיפ המתאים שעה לאחר ההשתלה בעת השוואת תאים ששונו מראש (או יום אחד לאחר ההשתלה, בעת בדיקת תרופות, לפני ההקצאה האקראית לקבוצות טיפול).
- לזחלים המושתלים דרך ה-doC צריכים להיות תאים בזנב בין שעה ל-16 שעות לאחר ההשתלה. הסר את כל שאר הדגים, כולל דגים המציגים חריגות, מהבריכה המוזרקת.
הערה: זחלים המושתלים רטרו-אורביטליים צריכים להכיל תאים רק באינטרסטיציום שמאחורי העין, זחלים שיש להם תאים מפוזרים בכל הראש או הגוף מוסרים מהבריכה. - נקה זחלים שהוקרנו באופן חיובי והקצה באופן אקראי לקבוצות ניסוי.
- לאחר ההשתלה, שמור על דגים בטמפרטורה של 34 מעלות צלזיוס בחממה לחה ופקח מדי יום. פיזור המטוגני של תאים המושתלים דרך ה-doC הוא כמעט מיידי, ואילו התפשטות גרורתית של תאים המושתלים בחלל ה-RO תתפשט לאחר 2-4 ימים.
10. הדמיה אפיפלואורסצנטית של זחלי דג הזברה
- הרדמו זחלי דג זברה עם 0.2 מ"ג/מ"ל טריקאין, או על ידי הוספת טריקאין למי הדג או על ידי העברת תת-אוכלוסייה של דגים מצלחת התחזוקה לכלי המכיל 0.2 מ"ג/מ"ל טריקאין.
- שמור את דג הזברה בצלחת עם טריקאין עד שהם נשארים נייחים, עד שגירוי הקו הרוחבי אינו גורם להתנהגות טיסה.
- מעבירים דגים לצלחת פטרי מכוסה אגרוז, כ -10 למנה. הסר את רוב המים על ידי הרמה עדינה של קצה אחד של הכלי (אפשר למים להצטבר בעדינות בקצה התחתון של צלחת הפטרי). אם נעשה בזהירות כל הדגים יתיישרו, הזנבות פונים כלפי מטה.
- דמיינו את כל הדגים מהחלק העליון של המנה לתחתית. לאחר מכן שוטפים את הדג במי ביצה לכלי ללא טריקאין.
- חזור על הפעולה עד שמספיק אנשים מצולמים.
- לאחר מכן העבירו את הזחלים בחזרה ל-34 מעלות צלזיוס או הוצאו (ב-6 dpi) באמצעות מינון יתר עם טריקאין (כלומר, 0.5 מ"ג/מ"ל, דגירה למשך 10 דקות, לפני השלכה על נייר סופג המצפה משפך).
11. הדמיה קונפוקלית של זחלי דג זברה (מושתלים)
- להרדים דג זברה עם 0.2 מ"ג/מ"ל טריקאין כפי שתואר קודם לכן.
- מניחים צלחת קונפוקלית תחתית זכוכית מתחת למיקרוסקופ סטריאו ומתמקדים בתחתית המנה. מעבירים 5-10 זחלים לכלי קונפוקלי בתחתית זכוכית. הסר כמה שיותר מים.
- מכסים את הזחלים ב-42 מעלות צלזיוס, אגרוז נמס נמוך של 1% מומס במי ביצים. וודאו שהאגרוז התקרר ל-42 מעלות צלזיוס לפחות לפני השימוש; טמפרטורות גבוהות יותר עלולות לפגוע או להרוג את הזחלים.
- בעזרת הסטריאומיקרוסקופ, כוונו במהירות אך בעדינות את הזחלים הדוחפים אותו כלפי מטה, באמצעות קצה מעמיס מיקרו גזוז. אם נדרשת התמצאות גחונית, החזיקו את הזחלים במקומם בעזרת מלקחיים של שען (מבלי לגעת בעובר).
- בעוד שקבוצות האגרוז מבצעות התאמות עדינות לכיוון הזחלים. אפשר לזחלים להתייצב לחלוטין לפני העברתם למיקרוסקופ קונפוקלי.
12. הגדרת המיקרוסקופ הקונפוקלי
- הפעל את קווי לייזר העירור הירוק (488 ננומטר) והאדום (564 ננומטר). הנח את הכלי הקונפוקלי במחזיק המיקרוסקופ הקונפוקלי. בעזרת האפיפלואורסצנטי, הזיזו את צרור האור כדי להתמזג עם הדג הראשון (הגדרה x ו-y). דרך העין הגדר את המיקוד כך שיתאים למרכז הזחלים (הגדרת z).
- הגדר רווח של 700 בשני ערוצי הפלורסנט, 1-5% עוצמת לייזר. הגדל את עוצמת הלייזר והקטן את ההיסט לטווח דינמי מלא משוער. אל תרווי יתר על המידה את האות, אלא שפר את האות כך שיציג רק כמה פיקסלים רוויים.
- בעת לכידת תפר, הגדר את ההתחלה והסוף של הזחלים לאורך ציר אחד ( x או y), אם מוגדר לאורך ציר אחד ניתן לדמות עובר שלם במקטעים של 1 x 4 וניתן לעבד אותו לתמונה אחת באמצעות ImageJ.
- לאחר ההדמיה, הסר את הזחלים מהאגרוז על ידי קריעתו בעדינות סביב הזחלים המוטבעים באמצעות מלקחיים של שען. אחרת, המתת חסד של הזחלים על ידי מנת יתר עם טריקאין לא מדולל, כיסוי האגרוז בשכבת טריקאין ודגירה של 10 דקות.
13. ניתוח נתונים
- פתח את מערכי הנתונים הבודדים ב-ImageJ/Fiji (כלומר, בקרה, תרופה A, תרופה B, תרופה A+B) בנפרד, החל מבקרת הרכב.
- פתח את מאקרו הניתוח (קובץ Script עם הערות זמין) (http://doi.org/10.5281/zenodo.4290225).
- בקצרה, ניתוח המאקרו עושה את הדברים הבאים: משרשר את כל התמונות הפתוחות (תנאי אחד); מפצל את התמונות לערוצים נפרדים המרכיבים את התמונה; סוגר את כל ערוצי האביזרים (עוזב את תעלת התאים הסרטניים); מריץ אלגוריתם סף, על כל הרצף המשורשר; מודד צפיפות משולבת של כל תמונה בודדת; ושומר את המידות כגיליון אקסל בתיקיית השורש.
- הפעל את ניתוח המאקרו בכל התנאים.
- שלב מדידות (באופן כללי לפחות n=2*20) והסר חריגים (מבחן Q ב-Graph pad Prism v8).
- לנרמל את המדידות לבקרת ממס או ליום הראשון (תלוי בסוג הניסוי, הראשון לניסוי עיכוב תרופות והשני לניסוי קינטיקה של גדילה). מדידות מבוטאות כעומס תאי סרטן מנורמל (ציר y ) לאורך זמן או מצב (ציר x ) כפי שמוצג באיור 3 ובאיור 4, בהתאמה.
תוצאות
סיפקנו הוראות שלב אחר שלב לגישה מהירה וקלה להתקדמות מקו תאים חדש לניתוחו. אנו מתחילים עם ביטוי יתר של עוקב פלואורסצנטי באמצעות קלטת ביטוי יתר של לנטי-ויראלי (שלבים 3 ו-4). לאחר מכן מתבצעת הכנת תאים כדי להבטיח את הנפח המת הקטן ביותר האפשרי בזמן ההזרקה, מה שמאפשר להזריק מספרי תאים גבוהים הן לחלל doC והן לחלל רטרו-אורביטלי (שלבים 6 ו-7). לאחר מכן, אנו מבצעים רכישת נתונים בתפוקה גבוהה למחצה באמצעות מיקרוסקופיה סטריאו-פלואורסצנטית ומיקרוסקופיה קונפוקלית בהגדלה גבוהה יותר לניתוח איכותי של התפשטות תאי סרטן בכל הגוף (איור 2 ושלבים 10, 11 ו-12). יש לנקוט בזהירות בעת רכישת נתונים, שכן כדי להבטיח את יכולת השחזור הן להדמיה מיקרוסקופית סטריאו והן להדמיה מיקרוסקופית קונפוקלית, ההגדרות הגנריות והסטנדרטיזציה מוגדרות (שלבים 11 ו-12). ניתוח נתונים נדון (באמצעות imageJ/Fiji) 16, יחד עם סטנדרטיזציה באמצעות פקודות מאקרו imageJ (שלב 13).
בשלב 3 הזכרנו את התיוג החולף של תאים (סרטניים) כדי לבצע סינון מקדים מהיר כדי להעריך את הפוטנציאל הגידולי של קו תאים סרטני חדש. אזהרה חשובה אחת היא שלמרות שהוא קל לשימוש ואורך חיים ארוך, לכתם החולף המתואר כאן יש אפשרות ליצור חפצים (כלומר, יש לנקוט בזהירות כדי להבטיח שניתן יהיה להבחין בין שברי תאים לתאים שלמים כפי שבוצע בהרחבה על ידי פיור ועמיתיו 9). מניסיוננו, היווצרות חפצים אלה קשורה ישירות ליציבות הקיצונית של הכתם ולבהירות (גם לאחר מוות תאי), כאשר שברי תאים מתפזרים ונקלטים על ידי תאי חיסון, אשר לאחר מכן עלולים להסיק באופן שגוי כי הם נובעים מגרורות פעילות.
בשני המודלים המתוארים, יש חשיבות עליונה לחריטה המערכתית דרך ה-doC והחריטה המקומית בחלל הרטרו-אורביטלי, סינון יסודי של הזחלים יום לאחר ההזרקה. כפי שמוצג באיור 2B יש להסיר את כל הזחלים המציגים תזוזה מכנית של התאים המושתלים לאזור הראש (מעבר לאתר הרטרו-אורביטלי) במודל הרטרו-אורביטלי ותאים בשק החלמון, או המציגים בצקת במאגר המוזרק doC. כל הפנוטיפים שנבחרו באופן שלילי מוצגים כתפרים קונפוקליים ברזולוציה גבוהה באיור 2, אך ניתן לראות ולהסיר אותם בקלות באמצעות תצפית מיקרוסקופית סטריאו.
עם הזמן תאים גם ינדדו וגם יתרבו. עבור המודל הרטרו-אורביטלי, ראינו חדירה לרקמות שכנות עבור CRMM1, אך ראינו פחות התפשטות עבור CRMM2. ראינו באופן מדהים גרורות מרוחקות הנובעות בין 2-4 dpi בחלק מהאנשים (20%), שם מדדנו הבדל משמעותי ב-6 dpi, כפי שמוצג באיור 4. עבור שני קווי התאים, בדקנו את פוטנציאל ההתפשטות בעת הזרקה בשני האתרים. עבור CRMM1 הייתה עלייה משמעותית (p<0.0001) במספר תאי הסרטן באתרי ההזרקה או בהם, כאשר הם מוצגים כעומס תאי גידול מנורמל, מנורמל ליום הראשון עבור כל מודל (עלייה של פי 7.8, ±3.2 עבור מודל RO ועלייה של פי 15 ±8,8 עבור מודל doC). CRMM2 לא הציג צמיחה משמעותית כאשר נורמל ליום הראשון עבור כל דגם בנפרד (עלייה של פי 2.4, עלייה של פי ±1.9 ופי 2.3, ±1.14 עבור RO ו-doC). נמצא כי CRMM1 מתרבה בקלות הן ברקמה רטרו-אורביטלית והן ברקמה ההמטופויאטית הזנבית לאחר ההשתלה. קו התאים CRMM2 היה פחות מתפשט בשני המודלים, אך באופן מעניין נמצא מסוגל לשלוח גרורות מרוחקות כאשר הוזרק בחלל הרטרו-אורביטלי כפי שמוצג באיור3B,C.
לאחר סינון הזחלים שהוזרקו ב-1 dpi והקצאה אקראית של הפרטים לקבוצת טיפול או לקבוצת ביקורת, הדגים טופלו במשך 6 ימים, תוך שינוי המים המכילים Vemurafenib (מעכב זה ניתן להחלפה בקלות בכל תרכובת אנטי-גידולית אחרת). בחרנו להרחיב על מודל הפצת מלנומה הלחמית המטוגנית שפורסם בעבר המשתיל CRMM114, על ידי בדיקת היעילות של Vemurafenib על CRMM1 מושתל אורתוטופית. CRMM1 הראה ירידה משמעותית חזקה בקבוצת השתלה חיצונית שטופלה ב-Vemurafenib (P<0.0001) ותגובה מעוכבת אך משמעותית עבור המודל המושתל אורתוטופית (p<0.05) כפי שמוצג באיור 4.
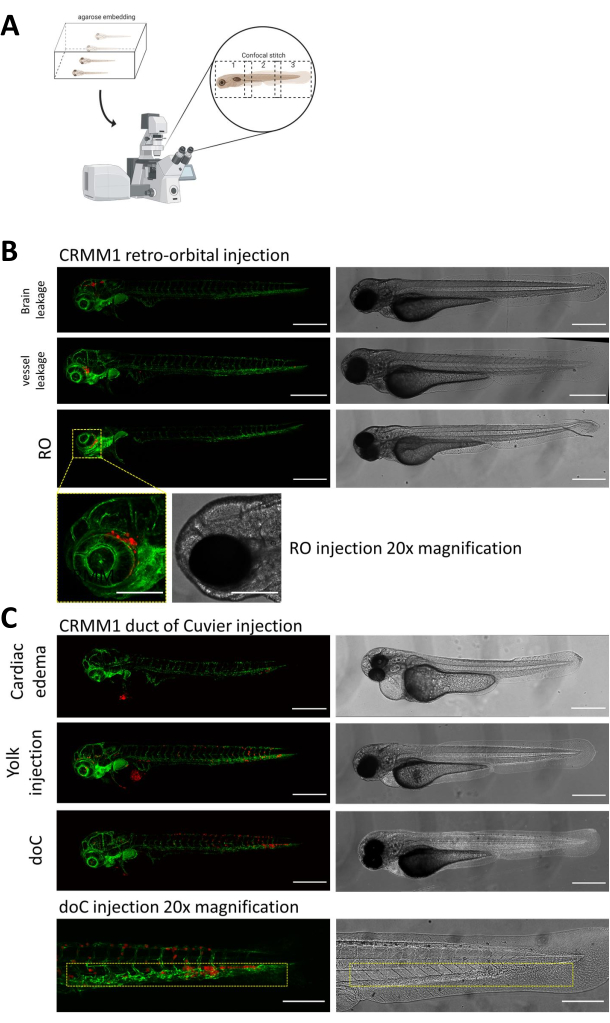
איור 2. הערכה פנוטיפית וסינון לאחר ההזרקה. א) תיאור סכמטי של יצירת תפרים קונפוקליים של דג הזברה, המניב תמונות חלקות ברזולוציה גבוהה לאחר שילוב של הקרנה קונפוקלית שלאחר מכן. כאן xenografts של דג הזברה משובצים באגרוז נמס נמוך של 1% ומורכבים על צלחת קונפוקלית עם תחתית זכוכית (כמתואר בשלב 11.3). ב) כל התוצאות האפשריות של רטרו-אורביטל וצינור של השתלת Cuvier מוצגות מוזרקות בדג זברה מדווח כלי דם פלואורסצנטי ירוק (TG:fli:GFP), עם תאים מוכתמים באמצעות לנטי-ויראלי על ביטוי של tdTomato). אנו מציינים את החריטה הנכונה ב-1 dpi (פאנל RO) ואת הפנוטיפים הלא רצויים (גם דליפת מוח וגם דליפת כלי דם). יש להסיר את שתי האוכלוסיות האחרונות כדי להבטיח שהן לא יבלבלו את ממצאי הניסוי במורד הזרם. ג) הפנוטיפים הלא רצויים לחריטה המטוגנית דרך צינור Cuvier (doC) הם קווי מתאר שבהם יש להסיר זחלים בצקתיים לבביים (בצקת לבבית) וזחלים עם תאים הדולפים לשק החלמון (הזרקת חלמון) כדי למנוע הפרעה למדידות במורד הזרם. הזחלים שהוזרקו כהלכה מוזנים לקבוצות ניסוי כמתואר בשלב 7.1. (כל התמונות נרכשו ב-1 dpi, באמצעות מיקרוסקופ קונפוקלי, מוטות קנה מידה של 200 מיקרומטר. קופסאות צהובות מציינות אתרים גרורתיים עבור השתלות RO ו-doC, אזור הראש והרקמה ההמטופויאטית הזנבית, בהתאמה). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
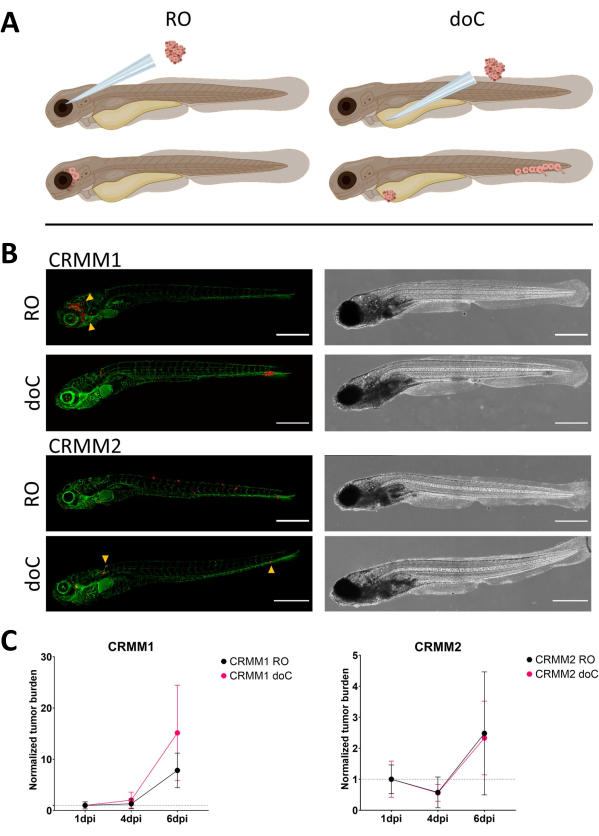
איור 3. ניתוח השוואתי של קווי תאי מלנומה של הלחמית CRMM1 ו-CRMM2 מראה יכולת גרורתית וגדילה. א) ייצוג סכמטי של מודלים של הזרקה, מודל רטרו-אורביטלי (RO) ומודל השתלה המטוגני (doC) הדגים המשמשים הם מדווחים על כלי דם ירוקים TG(fli:GFP), כאשר תאים המבטאים tdTomato מוצגים באדום. ב) פנוטיפים מייצגים של דגים שהושתלו ב-CRMM1 ו-CRMM2, CRMM1 מציג חריטה יעילה (הן RO והן doC) ופלישה בקנה מידה קטן לרקמה המקיפה את אתר ההשתלה RO (RO, ראשי חץ צהובים). CRMM2 מציג יעילות חריטה נמוכה להפליא עבור שני דגמי החריטה, אך מראה גרורות מרוחקות כאשר הוא מוזרק רטרו-אורביטלי (כפי שמוצג ב-RO, מסומן על ידי ראשי החצים). (כל התמונות שנרכשו ב-6 dpi, מיקרוסקופ קונפוקלי, פסי קנה מידה 200 מיקרומטר. ראשי חץ צהובים מצביעים על אתרים גרורתיים עבור השתלות RO ו-doC, אזור הראש והרקמה ההמטופויאטית הזנבית בהתאמה). ג) עלילות השתלה קינטיות הן עבור CRMM1 והן עבור CRMM2, בהשוואה לשני מודלי ההשתלה ליום 1 (מנורמל ליום 1), יש עלייה משמעותית (p<0.0001) בעומס הגידול המנורמל עבור קו התאים CRMM1 (בין 1 dpi ל-6 dpi) כאשר יש מגמת עלייה (לא משמעותית) עבור CRMM2. CRMM1 חושף הבדל משמעותי בין גידול RO ל-doC, כאשר מודל ה-doC מראה קצב התפשטות גידול גבוה יותר (גבוה בערך פי 2 עבור הזחלים המושתלים ב-doC). גרפים מציגים את הממוצע ואת שגיאת התקן של הממוצע (SEM). כל הקבוצות נורמלו ל-1 dpi עבור כל מצב בנפרד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
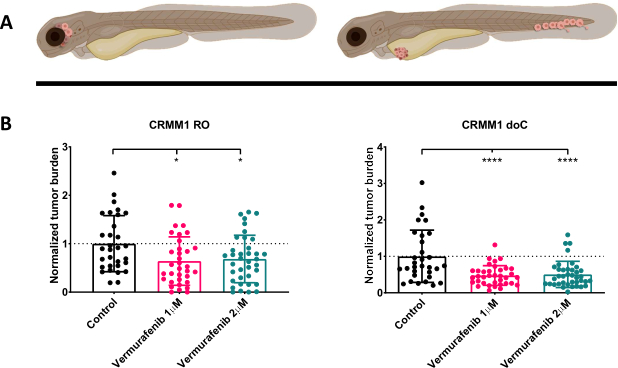
איור 4. מעכב BRAF V600E Vemurafenib מעכב באופן משמעותי הן RO והן doC מלנומה של הלחמית המושתלת זחלי דג הזברה. א) ייצוג סכמטי של פנוטיפים של דג הזברה, מודלים RO ו-doC. ב) גם זחלים מושתלים RO וגם doC, שהוזרקו עם קו תאי מלנומה של הלחמית CRMM1 מציגים הפחתה משמעותית של עומס הגידול המנורמל (p<0.05 ו-P<0.001 בהתאמה). המודלים של דג הזברה המושתל ב-doC מצביעים על תגובה מוגברת לתרופות וקשר בלתי תלוי במינון לעיכוב תרופות, מה שמעיד על רוויה אפשרית של עיכוב). גרפים מראים את הממוצע ואת שגיאת התקן של הממוצע (SEM), כל הקבוצות נורמלו לבקרה עבור כל שורת תאים בודדת. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מגיב | נפח |
| psPAX2 | 1.71 PMOL (12.14 מיקרוגרם) |
| pMD2.G | 0.94 PMOL (3.66 מיקרוגרם) |
| העברת פלסמיד* | 1.64 PMOL (חשב נפח מדויק) |
טבלה 1.
Discussion
כאן, הגדרנו גישה קפדנית למודל מלנומה עינית ראשונית וגרורתית ב-xenografts של דג הזברה. על ידי שילוב של הזרקה אורתוטופית מקומית ומודלים של הזרקה חוץ רחמית מערכתית, סיכמנו את האטיולוגיה של סרטן לסרטן שבו לא היו מודלים של בעלי חיים זמינים בעבר. השקיפות המובנית של זחל דג הזברה המוקדם מאפשרת מעקב אחר תאי סרטן המסומנים באופן פלואורסצנטי ברמת בעלי חיים שלמים, מה שמבטיח הדמיה קלה של אתרים גרורתיים פוטנציאליים17. יתר על כן, ניתוח מיקרוסקופי קונפוקלי בהגדלה גבוהה מאפשר לנו לעקוב אחר תאים ברזולוציה תת-תאית10.
סיפקנו הוראות שלב אחר שלב לגישה מהירה וקלה להתקדמות מקו תאים חדש להקמת הקסנוגרפט וניתוחו. אנו מתחילים בביטוי יתר של עוקב פלואורסצנטי באמצעות קלטת ביטוי יתר של לנטי-ויראלי (שלב 3 ו-4) ואחריו הכנת תאים כדי להבטיח את הנפח המת המינימלי האפשרי בזמן ההזרקה. זה מאפשר הזרקה של מספר תאים גבוה הן לחלל doC והן לחלל רטרו-אורביטלי (שלב 7 ו-8). לאחר מכן אנו מבצעים רכישת נתונים בתפוקה גבוהה למחצה באמצעות מיקרוסקופיה סטריאו-פלואורסצנטית ומיקרוסקופיה קונפוקלית בהגדלה גבוהה יותר לניתוח איכותי של התפשטות תאי סרטן בכל הגוף (איור 2 ושלב 9 ו-10). יש לנקוט בזהירות בעת רכישת נתונים, שכן כדי להבטיח את יכולת השחזור הן להדמיה מיקרוסקופית סטריאו והן להדמיה מיקרוסקופית קונפוקלית, ההגדרות הגנריות והסטנדרטיזציה מוגדרות (שלבים 11 ו-12). ניתוח נתונים נדון (באמצעות imageJ/Fiji) 16, יחד עם סטנדרטיזציה באמצעות פקודות מאקרו של ImageJ (שלב 13).
בשלב 3 אנו מזכירים את התיוג החולף של תאים (סרטניים) לביצוע סקר מקדים מהיר כדי להעריך את הפוטנציאל הגידולי של קו תאים סרטני חדש. אזהרה חשובה אחת היא שלמרות שהוא קל לשימוש ואורך חיים ארוך, לכתם החולף המתואר כאן יש אפשרות ליצור חפצים (למשל, יש לנקוט בזהירות כדי להבטיח שניתן יהיה להבחין בין שברי תאים לתאים שלמים כפי שבוצע בהרחבה על ידי פיור ועמיתיו 9). מניסיוננו, היווצרות חפצים אלה קשורה ישירות ליציבות הקיצונית של הכתם ולבהירות (גם לאחר מוות תאי), כאשר שברי תאים מתפזרים ונקלטים על ידי תאי חיסון, אשר לאחר מכן עלולים להסיק באופן שגוי כי הם נובעים מגרורות פעילות.
באמצעות מודלים אלה, סימולציה של התפתחות גידול ראשוני על ידי הגבלה פיזית של התאים המושתלים בתוך האינטרסטיס הרטרו-אורביטלי. סינון יסודי לאחר יום אחד לאחר ההשתלה מבטיח שתאים שנמצאו באתר מרוחק מאוחר יותר בניסוי שלחו גרורות באופן פעיל (תוך-וורד ומפוזר, בסופו של דבר לאקסטרוואזציה בנישה גרורתית). השתלה דרך ה-doC, הווריד הקרדינלי המשותף העוברי, מאפשרת השתלה קלה וניתנת לשחזור של כמויות גדולות לתאים (בעודף של 600 תאים כאשר הם מרוכזים כראוי), עוקפת ביעילות את השלבים הראשוניים של המפל הגרורתי (intravasation) ומאפשרת לנו להתמקד בשלבים המאוחרים יותר של המפל הגרורתי (הידבקות, אקסטרוואזציה וצמיחה). למרות שמשתמשים בכלים רבי עוצמה כאשר משתמשים בהם כראוי, יש לנטר את שני המודלים בהרחבה במהלך היום הראשון לאחר ההשתלה כדי להבטיח שלא יוסקו מסקנות חיוביות כוזבות בשלבים המאוחרים יותר של הניסוי.
בהתאם לפרסומים קודמים הראינו שקווי מלנומה של הלחמית יוצרים בקלות מושבות גרורות לאחר התפשטות בכל מערכת זרימת הדם של דג הזברה14. כאן אנו מדווחים על הרחבת רפרטואר ההשתלה עם הזרקת הרטרו-אורביטל כמודל אורתוטופי, והגרורות הפעילות שלאחר מכן לרקמה ההמטופויאטית הזנבית של קו התאים CRMM2. לאחר מכן אנו מדווחים על היעילות של מעכב BRAF V600E ספציפי Vemurafenib גם על הצורה העיקרית של מלנומה של הלחמית כאשר מודלים בזחלי דג הזברה.
באמצעות השיטות הנ"ל, חוקר מיומן מסוגל לייצר למעלה ממאות זחלים מושתלים ביום (כ-200 לשעה) מכל אחד מהמודלים המוצעים. בטווח זמן של שבועיים ניתן גם לטטר תרופה למינון המקסימלי הנסבל, וגם לסנן אותה במודל קסנוגרפט מבוסס. מתחילתו ועד סופו, באמצעות קו תאים שאינו מתמר, ועד לפרופיל רגישות לתרופות במודל דג הזברה ניתן להשיג תוך חודש (בהתחשב בכך שקו התאים המוזרק הוא גידולי במודל דג הזברה). בידינו רק 20 זחלים לניסויים ושתי חזרות ביולוגיות הניבו עיכוב תרופתי חזק, כאשר שני ניסויים בודדים מתנגשים (או אינם מניבים עיכוב גדילה מובהק סטטיסטית) ניתן לבצע חזרה ביולוגית שלישית.
באמצעות התאמות קלות, מודלים אלה אפשרו לנו להתאים במהירות את אסטרטגיות ההשתלה הללו לגליובלסטומה (הזרקת חלל המוח האחורי), סרטן השד (הזרקת doC) וסרקומה אוסטיאו (doC) בין היתר 18,19,20,21. לאחר מכן ניתן להשתמש במודלים אלה הן למחקר בסיסי והן לסינון פרה-קליני הן של תרופות בודדות והן של אסטרטגיות תרופות קומבינטוריות. לאחרונה, תיארנו משטרי מתן שונים של תרופות והפעלת הפוטו שלהן באמצעות מודלים אלה 13.
Disclosures
ללא.
Acknowledgements
עבודה זו נתמכה על ידי מימון מתוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי במסגרת הסכם מענק מס' 667787 (פרויקט UM Cure 2020, www.umcure2020.org). מועצת המלגות הסינית מודה בחביבות על מענקי דוקטורט לג'יי י.
Materials
| Name | Company | Catalog Number | Comments |
| 2.5mm box filament | Science products | FB255B | for pulling micro injection needles using a Sutter P97 or P1000 |
| 3mL transfer pipettes | Merck | Z350796 | for transfer and selection of zebrafish embryos |
| Agarose | Milipore | 2120 | 1.5% (w/v) in eggwater, 1.5 g in 100 mL DPBS, microwave to dissolve, for injecting and stereofluorescence imaging of zebrafish larvae |
| Capillaries: borosilicate glass outer | World precision instruments | BF100-78-10 | Borosilicate glass capillaries used for needle preparation |
| DMSO | Sigma | D8418 | Often used as solvent in drug treatments, should be stored at 2-8°C the dark. |
| DPBS | Thermo Fischer Scientific | 14190144 | Dulbecco’s phosphate buffered saline, without Mg2+ and Ca2+ for washing the cells, lack of Ca2+ impairs cell-cell adhesion through cadherins and prevents cell aggregation during injection |
| Egg water | Instant ocean | SS15-10 | 0.6 mg/L final concentration sea salt in demineralized water |
| GFP encoding lentiviral transfer plasmid | Addgene | Plasmid #106172 | Generated in Snaar lab, available at Addgene |
| Hek293T | ATCC | CRL-3216 | Stable cell line for generating lentiviral particles, contains SV40-T antigen required for the generation of lentiviral particles |
| Leica sp8 confocal | Leica | Leica TCS SP8 | automated stage confocal microscope with 405/488/514/635nm lasers |
| LipodD293 | Signagen | SL100668 | Highly efficient HEK293t optimized transfection reagent |
| Low-melting agarose | Milipore | 2070 | 1% (w/v) in eggwater 1.5 g in 100 mL DPBS, microwave to dissolve, for embedding zebrafish larvae for confocal imaging |
| Micro loader tips | Fischer scientific | 10289651 | flexible microloader tips |
| Micro manipulator | World precision instruments | M3301R | x/y/z manual micro manipulator for microinjection |
| Needle puller: P-97 or P-1000 | Sutter | P-97 | needle puller used for generating standardized micro engraftment needles |
| Nr.5 watchmakers forceps | VWR | HAMMHSC818-11 | fine watchmakers forceps used for breaking back needles |
| Picopump | World precision instruments | SYS-PV820 | pulse controller supplying pressure for microinjection |
| pMD2.G | Addgene | plasmid #12259 | Gifted by Didier Trono, 2nd generation lentiviral virulence plasmid |
| psPAX2 | Addgene | plasmid #12260 | Gifted by Didier Trono, 2nd generation lentiviral packaging plasmid |
| PVP40 | Sigma-Aldrich | PVP40 | Polyvinylpyrrolidone average mol wt 40,000) PVP40 2% (w/v) in DPBS, 1 g PVP40 in 50 mL DPBS. Vortex and incubate at 37°C to facilitate dissolving. Store at room temperature. |
| tdTomato encoding lentiviral transfer plasmid | Addgene | Plasmid #106173 | Generated in Snaar lab, available at Addgene |
| transmitted light stereo microscope | Leica | leica M50 with (MDG33 base) | leica transmitted light microscope with mirror adjustable illumination. |
| Tricaine | Sigma-Aldrich | E10521 | Ethyl 3-aminobenzoate methanesulfonate or MS-222 |
| TryplE | Thermo Fischer Scientific | 12604-01 | Synthetic trypsine replacement, less damaging to the cells and allows for the gentle dispersion of strongly adherent cells. (Thermo- |
| willco dish | WillCo wells | GWST-5040 | 50mm glass bottom dishes, allow for the embedding of up to 20 zebrafish larvae, enabling the imaging of multiple conditions in one dish due to its large optical glass surfac |
References
- Yang, J., Manson, D. K., Marr, B. P., Carvajal, R. D. Treatment of uveal melanoma: where are we now. Therapeutic Advances in Medical Oncology. 10, (2018).
- Wong, J. R., Nanji, A. A., Galor, A., Karp, C. L. Management of conjunctival malignant melanoma: A review and update. Expert Review of Ophthalmology. 9, 185-204 (2014).
- Nguyen, D. X., Bos, P. D., Massagué, J. Metastasis: from dissemination to organ-specific colonization. Nature Reviews Cancer. 9, 274-284 (2009).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2, 183-189 (2008).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nature Reviews Drug Discovery. 4, 35-44 (2005).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Palmblad, M., et al. Parallel deep transcriptome and proteome analysis of zebrafish larvae. BMC Research Notes. 6, 428 (2013).
- Yan, C., et al. Visualizing Engrafted Human Cancer and Therapy Responses in Immunodeficient Zebrafish. Cell. 177, 1903-1914 (2019).
- Fior, R., et al. Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts. Proceedings of the National Academy of Sciences of the United States of America. 114, 8234-8243 (2017).
- Campbell, P. D., Chao, J. A., Singer, R. H., Marlow, F. L. Dynamic visualization of transcription and RNA subcellular localization in zebrafish. Development. 142, 1368-1374 (2015).
- Campeau, E., et al. A Versatile Viral System for Expression and Depletion of Proteins in Mammalian Cells. PLoS One. 4, 6529 (2009).
- vander Helm, D., et al. Mesenchymal stromal cells prevent progression of liver fibrosis in a novel zebrafish embryo model. Scientific Reports. 8, 16005 (2018).
- Chen, Q., et al. TLD1433 photosensitizer inhibits conjunctival melanoma cells in zebrafish ectopic and orthotopic tumour models. Cancers. 12, (2020).
- Pontes, K. C. d. e. S., et al. Evaluation of ( fli:GFP ) Casper Zebrafish Embryos as a Model for Human Conjunctival Melanoma. Investigative Opthalmology & Visual Science. 58, 6065 (2017).
- Liverani, C., et al. Innovative approaches to establish and characterize primary cultures: an ex vivo 3D system and the zebrafish model. Biology Open. 6, 133-140 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2, 183-189 (2008).
- Mercatali, L., et al. Development of a patient-derived xenograft (PDX) of breast cancer bone metastasis in a Zebrafish model. International Journal of Molecular Sciences. 17, (2016).
- Tulotta, C., et al. Imaging cancer angiogenesis and metastasis in a zebrafish embryo model. Advances in Experimental Medicine and Biology. 916, 239-263 (2016).
- Paauwe, M., et al. Endoglin expression on cancer-associated fibroblasts regulates invasion and stimulates colorectal cancer metastasis. Clinical Cancer Research. 24, 6331-6344 (2018).
- Cao, J., et al. Overexpression of EZH2 in conjunctival melanoma offers a new therapeutic target. Journal of Pathology. 245, (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved