Method Article
眼黑色素瘤的正位和异位斑马鱼异种植入以概括原发肿瘤和实验性转移发展
摘要
在这里,我们提出了一种方案,用于建立用于眼黑色素瘤的多功能原位和异位斑马鱼异种移植模型,以评估原发肿瘤的生长动力学、播散、外渗和远处血管周围转移形成以及化学抑制对其的影响。
摘要
目前没有转移性眼部黑色素瘤的动物模型。转移性疾病模型的缺乏极大地阻碍了治疗转移性眼部黑色素瘤的新策略的研发。在该协议中,我们描述了一种快速有效的方法,分别使用眶后原位和血管内异位细胞植入,为眼黑色素瘤的原发期和播散期生成胚胎斑马鱼模型。结合这两种不同的植入策略,我们可以概括癌症的整体病因,从眼下原发性、局部肿瘤生长发展到尾部血管周围转移形成。这些模型使我们能够在植入前通过特异性标记、遗传或化学干扰快速轻松地修饰癌细胞;并用(小分子)抑制剂治疗移植的宿主以减轻肿瘤的发展。
在这里,我们描述了使用荧光标记的稳定细胞系(结膜和葡萄膜黑色素瘤)的原位和异位植入的产生和定量。该方案也适用于来自患者活检和患者/PDX 衍生材料(手稿正在准备中)的原代细胞的植入。在植入后数小时内,可以可视化和量化细胞迁移和增殖。这两个肿瘤病灶都可用于落射荧光显微镜和共聚焦显微镜的成像。使用这些模型,我们可以在实验开始后短短 8 天内确认或反驳化学或遗传抑制策略的活性,不仅可以对稳定细胞系进行高效筛选,还可以实现患者导向的精准医学方法筛查。
引言
转移播散被认为是眼部黑色素瘤死亡的主要原因;目前没有针对播散性眼部黑色素瘤的可行治疗方案 1,2。此外,没有反映转移性疾病的眼部黑色素瘤动物模型。为了弥合这一差距,我们生成了两个不同的斑马鱼模型,它们概括了原发性肿瘤的形成或转移播散的早期阶段,从而很容易研究这些通常难以研究的过程 3。微转移模型允许分析转移扩散的最后阶段,包括归巢、定植和外渗。此阶段及以后的遗传或化学干预可能会为转移性眼部黑色素瘤的治疗提供强大的帮助。
斑马鱼幼虫作为异种和同种异体移植物的接受者得到了该物种的内在优势的支持,例如它在发育早期阶段的光学透明度(或 卡斯帕 突变体的整个生命周期4)、高繁殖力和子宫 外 受精5。脊椎动物中的高转录同源性确保了斑马鱼和人类之间核心信号机制的保留,因此结果具有很高的潜在可翻译 性 6,尽管遗传方法有时会由于硬骨基因组复制而受损或复杂 7。最近的发展强调了斑马鱼异种移植模型作为人类疾病的临床前“化身”的重要性8,有效地产生了多种个性化的癌症治疗模型,用于从单个斑马鱼实验 9 中对治疗策略进行临床前评估。
考虑到缺乏动物模型和转移性眼黑色素瘤的一致缺乏治疗方案,我们的模型提供了一个快速简便的转化平台来筛选遗传改变(癌细胞内在)或在临床前环境中开发化学干预策略。在同一模型中,我们可以在立体荧光显微镜中使用低水平放大倍率在整个动物水平上可视化和测量癌细胞生长动力学、植入率/转移潜力和细胞归巢,并使用中放大倍率或高放大倍率共聚焦显微镜分析进行类似测量,以亚细胞分辨率解剖眼部黑色素瘤进展的不同步骤 10。
在这里,我们描述了全面而详细的方案:使用高度优化的慢病毒转导生成荧光标记的癌细胞11;随后将这些细胞静脉内和眶后 (RO) 植入受精后 2 天 (DPF) 斑马鱼幼虫中,分别产生异位和原位模型;其次是数据采集和分析。这些方法虽然对于本文描述的应用来说是全面的,但可以在需要时修改为在后脑腔、肝脏和玻璃周围间隙移植细胞(仅通过改变注射部位或注射时间)12,13。
作为概念验证,我们详细阐述了 Pontes 等人 2018 年的发现,其中我们展示了斑马鱼模型中结膜黑色素瘤细胞系的剂量和细胞内在突变特异性反应 14。我们通过展示 BRAF V600E 突变特异性抑制剂 vemurafenib 在转移性和原发性结膜黑色素瘤模型中的疗效来详细阐述这些发现。
研究方案
所有动物实验均经动物实验委员会 (Dier Experimenten Commissie, D.E.C.) 根据 AVD1060020172410 许可批准。所有动物均按照当地指南使用标准方案 (www.ZFIN.org) 进行饲养。
1. 准备工作
- 试剂
- 准备蛋水:终浓度为 0.6 mg/L 海盐。
- 制备 5 mg/mL 三卡因 25x 原液:混合 5 g 三卡因(3-氨基苯甲酸乙酯甲磺酸盐或 MS-222)粉末、900 mL 软化水和 21 mL 1 M Tris (pH 9)。三卡因可在 4 °C 下短期储存(长达六个月),也可在室温下避阳光下在室温下储存一个月。
- 在鸡蛋水中制备 1.5% (w/v) 琼脂糖:在 100 mL DPBS 中加入 1.5 g。微波炉溶解。
- 在鸡蛋水中制备 1% (w/v) 低熔点琼脂糖:1.5 g 在 100 mL DPBS 中。微波炉溶解。
- 在 DPBS 中制备 2% (w/v) PVP40 原液:在 50 mL DPBS 中加入 1 g PVP40。涡旋并在 37 °C 下孵育以促进溶解。在室温下储存。
- 使用 DMSO。常用作药物治疗中的溶剂,应在 2-8 °C 避光保存。
- 使用 TrypLE,这是一种合成胰蛋白酶替代品,对细胞的损伤较小,并且可以温和分散紧密贴壁的细胞。
- 准备不含 Mg2+ 和 Ca2+ 的 Dulbecco 磷酸盐缓冲盐水 (DPBS) 用于洗涤细胞。Ca2+ 的缺乏会损害钙粘蛋白的细胞间粘附。
- 准备慢病毒质粒:由 Didier Trono 赠送的 psPAX2(质粒 #12260)和 pMD2.G(质粒 #12259)以及编码转移质粒 (Addgene) 的 GFP(质粒 #106172)或 tdTomato(质粒 #106173)。
- 使用 LipodD293:高效HEK293T优化的转染试剂。
- 琼脂糖培养皿
注意:使用长时间存放的菜肴时,请务必在开始注射前向菜肴中加入少量鸡蛋水(这将防止鱼过快变干)。- 准备 1.5% (w/v) 琼脂糖涂层的培养皿(琼脂糖溶于鸡蛋水中)。
- 立即使用,或在 4 °C 下倒置储存。
2. 针
注意:确保已校准所用耗材上的毛细管。切换细丝或毛细管时,确定所用细丝上毛细管的斜坡值(参见拔针器手册)。
- 一个玻璃毛细管将产生两个微型注射针头。在制作针头之前,请检查拔针器的细丝(2.5 毫米盒形细丝)的结构完整性。
- 确保灯丝和毛细管都经过校准,以获得相应的斜坡值。当细丝的结构完整性受损(即不均匀、孔洞、熔融等)时,更换细丝。
- 使用以下程序(针 #99,热量 = 斜坡+15,拉力 = 95,速度 = 60,时间 = 90)。将针头存放在指定的培养皿中(包含粘土或胶带以将针头粘在上面)
3. 慢病毒颗粒的生成
注:为避免浪费时间和资源,可以在慢病毒转导之前进行快速的致瘤性检查。这样做是为了确保要使用的细胞系在斑马鱼模型中具有足够的致瘤性,为此,可以使用 CMdiI(或类似示踪剂)对细胞进行染色,如 Liverani 等人,2017 15 中所述。
- 转染前一天对 HEK 293t 细胞进行铺板,以达到约 70% 的汇合度(通常通过在转染前一天将装满的培养瓶以 1:3 的稀释度分液到相同体积的培养瓶中来完成)。
- 在转染当天,共转染所需的包装质粒 psPAX2 和 pMD2.G 病毒包膜表达质粒以及编码转移质粒的 GFP(质粒 #106172)或 tdTomato(质粒 #106173)。使用的质粒的确切量在 表 1 中指定。
注:psPAX2 和 pMD2.G 均由 Didier Trono(分别为 Addgene 质粒 #12260 和 #12259)提供。
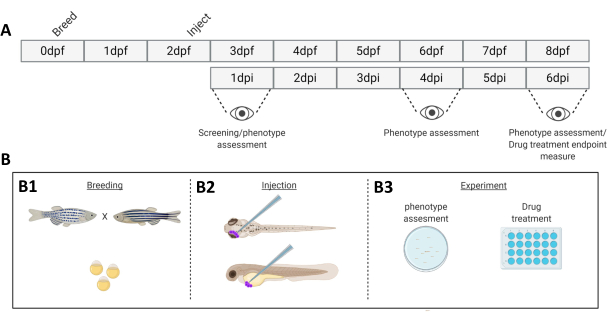
图 1.所描述的斑马鱼植入系统的示意图。 A) 方法的时间表,在第 0 天 (B1) 繁殖斑马鱼。鱼在杂交后的早晨(第 1 天)收获。48-54 小时后,鱼已基本孵化(脱落绒毛膜),并在清洁绒毛膜碎片后(第 2 天)注射鱼(眶后或全身, B2)。随后使用立体荧光显微镜筛选幼虫,并丢弃所有显示不需要的表型的幼虫(第 3 天)。根据实验的目标,要么对幼虫进行一段时间成像(B3,植入动力学,在注射后 1 天、4 天和 6 天成像 (dpi)),要么将鱼随机化并进入实验组,用药物治疗并与载体对照进行比较(药物筛选,在 6 dpi 成像)。 请单击此处查看此图的较大版本。
- 将所有质粒在 500 μL 无血清培养基中混合在一起,以使所有质粒完全混合。将 32 μL LipoD293 试剂添加到 500 μL 无血清 DMEM 中,涡旋以完全混合。将两个体积彻底混合在一起。让质粒和 lipoD293 复合 20 分钟。
- 滴加到含有 70% 汇合HEK293T含有 9 mL 完全培养基的细胞中的 75 cm2 细胞培养瓶中。使用血清移液管(水平方向的培养瓶)将转染混合物直接添加到细胞层中。
- 转染后 16 小时,用 20 mL 新鲜完全 DMEM 替换培养基。转染后 72 小时后收获上清液。将病毒上清液分装成 1 mL 等分试样并储存在 -80 °C。 慢病毒上清液在 -80 °C 下可稳定保存至少 1 年。
4. 慢病毒转导
- 在慢病毒转导之前,使用选择性慢病毒构建体时建立杀伤曲线。
- 对于杀伤曲线,将要转导的细胞系接种在 12 孔板中(汇合度约为 10-20%)。添加选择剂的剂量曲线(杀灭曲线的近似浓度:嘌呤霉素 0.5-10 μg/mL,杀稻瘟菌素 1-20 μg/mL,遗传霉素 (G418) 100-2000 μg/mL,潮霉素 100-2000 μg/mL)。
- 每三天更换一次培养基,以确保所选选择剂的浓度稳定。
- 将 1 mL 慢病毒上清液添加到 9 mL 培养基中,在 20-40% 汇合细胞上含有终浓度为 8 μg/mL 的聚凝胺。体积可以按比例缩小,同时保持上清液/培养基的比例。
- 转导后 16-24 小时,更换培养基。需要时,重复前一步以提高表型外显率(检查荧光以决定是否需要另一次转导)。
- 转导后 48 小时,使用与掺入慢病毒盒中的抗性标记物相对应的抗生素选择细胞。用于筛选转导细胞群的浓度应在施用筛选剂后 7 天内杀死野生型群体(即,允许转导的细胞生长出野生型群体)。
- 在不同的感染复数 (MOI) 中施用病毒上清液,以确保细胞基因组引起的转导和遗传损伤不会对细胞活力或致瘤性产生负面影响。
5. 繁殖斑马鱼
- 在第 0 天,即癌细胞植入前 2 天,在室温下以“家族杂交”方式与成年斑马鱼交配(图 1)。
- 从外壳系统中取出斑马鱼罐(保持在 28.5 °C)。
- 以 1:1 的比例将鱼分成小的繁殖群,雄性:雌性,每簇 10 条鱼。将鱼放在小型繁殖池中,在从住房系统抽取的水中,在倾斜的格栅(倾斜,以模仿斑马鱼自然生成的浅水区)上方。
注意:由于温度从 28.5°C 下降到室温 (25°C) 并进入暗/亮循环的下一个光照阶段,鱼将产卵。 - 随后,取出成虫并转移到它们的饲养箱中。
- 收集鸡蛋并使用过滤器用鸡蛋水清洗。将鸡蛋分成每道菜约 75-100 个,并保持在 28.5°C。
- 采集后约 6 小时,清洁死亡或畸形胚胎的培养皿。
- 第二天早上,交换鸡蛋水,再次清洗死胚胎的培养皿。
6. 收获细胞
注:适当的细胞制备是植入程序的关键,使用过多的细胞可以更轻松地进行下游处理。第三个离心步骤至关重要,因为这将只留下细胞沉淀,残留的 PBS 卡在离心管侧面,大大超过最终的重悬体积。
- 使用前,在 37 °C 水浴中预热细胞培养中使用的所有培养基和溶液。
- 每 75 cm2 培养瓶添加 2 mL TryplE 或每 25 cm2 培养瓶添加 1 mL TryplE,并孵育直至所有细胞变圆。对于大多数细胞系,2-5 分钟就足够了。对于高度上皮细胞或成纤维细胞,5-10 分钟应允许适当分离(胰蛋白酶消化不足会阻碍下游过程,并促进植入过程中的细胞聚集)。
- 轻轻敲击培养瓶的侧面以去除剩余的细胞。
- 加起来等于完全培养基的原始培养体积。用血清移液管轻轻但彻底地上下移液,将细胞团块剪切成单细胞悬液。在此过程中不要产生泡沫,因为泡沫表明细胞发生机械剪切。
- 转移至无菌 15 mL 试管中,在室温下以 200 x g 离心 5 分钟。吸出上清液并加入 1 mL 无菌 PBS。使用无菌 1000 μL 移液器小心彻底地重悬细胞。
- 取出 20 μL 细胞悬液进行计数,并将剩余的细胞悬液转移至离心机中。在室温下以 200 x g 离心 4 分钟。
- 关键步骤:去除所有 PBS,在室温下以 200 x g 离心 30 秒,然后去除剩余的 PBS。
- 在 2% 聚乙烯吡咯烷酮 40(PVP40,2% (w/v) 的 DPBS 中)中将细胞稀释至 250 个细胞/nL,如下所示:
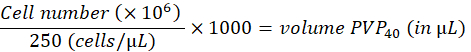
(例如,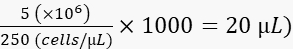
- 彻底重悬细胞,同时防止气泡的形成(细胞可在 2% PVP40 中保存至少 2 小时,而不会失去致瘤潜力)。
7. 异种移植建模
所有实验均应符合当地动物福利法规。
根据应用的不同,实验设计的两种主要变化分为表型评估(7.1,预筛选阶段)和7.2:筛选,其中细胞在植入前已被修饰,或 7.3,胚胎用化学抑制剂处理。
- 预筛选和确定致瘤潜力
- 在 2 dpf 下移植感兴趣的斑马鱼幼虫(WT、转基因或报告基因系),具有不同数量的荧光细胞(即 200、400、600 ±100)。
- 注射后 16-24 小时筛选幼虫以去除异常值(异位模型循环中的细胞数量极高或极低,或原位模型头部内的细胞)并去除错误移植的鱼。指示每个实验组的幼虫 nr,用于组分析与相同幼虫的动力学分析。
- 定期监测斑马鱼幼虫(注射后 1、2、4、6 天 (dpi))并从 ±50 只幼虫中对 20 个个体(如步骤 9 和 10 所述)进行成像。
- 监测一般表型和疾病进展,随后使用 ImageJ 进行量化(测量癌细胞中荧光团信号的积分密度)。
- 绘制数据以可视化斑马鱼内的癌细胞生长动力学(图 3)。
- 先验修饰细胞(敲除或敲除目标基因)并植入斑马鱼中。
- 移植鱼并去除所有不需要的表型(根据条件)。
- 以 1 dpi (每组 20 只幼虫) 对个体进行成像。可以按设定的间隔(1、2、4 和 6 dpi)对个体进行成像。
- 成像后 6 dpi,通过过量服用三卡因(0.4 mg/mL 剂量的 10 倍)对鱼实施安乐死,并丢弃在漏斗内衬的吸收性纸上。
- 植入后用药物治疗鱼。
- 在对移植的斑马鱼进行药物应用之前,确定斑马鱼的最大耐受剂量 (MTD)(从 10 μM-0.150 nM 滴定,使用最高体积的溶剂作为阴性对照)我们已将 MTD 设置为 >80% 的个体在整个治疗中存活的浓度。
- 注射后 1 天,去除不需要的表型。
- 将鱼随机分成几组(36-48 只/条件),并保存在 24 孔板中,每孔 6 只幼虫在 1 mL 蛋水中。
- 植入后 24 小时应用药物。作为对照,使用相同量的溶剂(DMSO、EtOH 等)以最高体积应用于实验组。
- 以最大耐受剂量开始药物治疗。每隔一天更换一次含蛋水的药物。在每次更换过程中,尽可能彻底去除卵水和死幼虫。
8. 注射
注意: 使用与压缩空气管路耦合的气动脉冲控制器,提供 100 psi 的超压。这允许足够的压力来注入 (≈20 psi) 和喷射可能的泡孔聚集体 (≈100 psi)。在 20 psi 下,起始压力和时间应约为 200 ms。如果在注射开始时必须减少 50% 以上,则细胞悬液太慢(细胞或 PVP40 浓度太低)或针头开口太大。
- 小心地从其容器中取出毛细管针头。使用精美的制表镊子将针头折断,形成一个 ø20 μm 的开口。
- 使用 20 μL 移液器吸头小心、彻底地重悬细胞。使用长(微型加载器)尖端将细胞悬液移液到打开的玻璃毛细管针中。将针头装入微型机械手。
- 使用移液管将 ~20-40 只在 0.04 mg/mL 三卡因中麻醉的幼虫放在琼脂糖培养皿上。使用移液管去除多余的水分以固定幼虫。由于存在仍然相对较大的卵黄囊,幼虫大多以横向方式定向。
- 通过居维叶导管 (doC) 向幼虫注射大约 200、400 和 600 个细胞,用于异位模型。
- 同样,眶后 (RO) 注射幼虫。为了产生原位模型(注射 100 ±50 个细胞),修改皮泵上的气动脉冲长度(从 ~20 psi,200 ms 开始并相应地调整)。在注射过程中,确保幼虫不会变干。确保注射所有(或大部分)幼虫。
- 用新鲜的蛋水冲洗注射的幼虫,然后转移到贴有标签的干净培养皿中(每个培养皿最多可合并 150 只)。重复此过程,直到注射到足够的幼虫。
- 植入后,将鱼在加湿培养箱中保持在 34 °C,其中 34 °C 是斑马鱼容易耐受的最高温度,可以有效植入哺乳动物癌细胞。
注:一般来说,在 doC 和 RO 中注射单细胞系后,我们观察到因机械损伤而死亡的大约 <5%(机械损伤在注射后 1-16 小时内杀死幼虫)。
9. 筛选
- 使用立体荧光显微镜,在比较先验修饰的细胞时(或植入后 1 天,当筛选药物时,在随机分配到治疗组之前)筛选鱼的适当表型。
- 通过 doC 植入的幼虫应在植入后 1 小时至 16 小时之间在尾部有细胞。从注入的池中取出所有其他鱼,包括出现异常的鱼。
注意:眶后植入的幼虫应仅在眼睛后面的间质中具有细胞,细胞分布在整个头部或身体的幼虫将从池中取出。 - 清洁阳性筛选的幼虫并随机分配到实验组。
- 植入后,将鱼保持在 34 °C 的加湿培养箱中,并每天监测。通过 doC 植入的细胞的血行播散几乎是瞬时的,而植入 RO 腔的细胞的转移扩散将在 2-4 天后播散。
10. 斑马鱼幼虫的落射荧光成像
- 用 0.2 mg/mL 三卡因麻醉斑马鱼幼虫,方法是在鱼水中加入三卡因,或者将鱼亚群从维持培养皿中移动到含有 0.2 mg/mL 三卡因的培养皿中。
- 将斑马鱼放在装有三卡因的培养皿中,直到它们保持静止,直到刺激侧线不会引起飞行行为。
- 将鱼转移到琼脂糖覆盖的培养皿中,每皿大约 10 个。轻轻抬起培养皿的一端,去除大部分水(让水轻轻地积聚在培养皿的下端)。如果小心处理,所有鱼都会对齐,尾巴朝下。
- 从盘子的顶部到底部对所有鱼进行成像。然后用蛋水将鱼洗净到没有三卡因的盘子中。
- 重复直到成像到足够的个体。
- 然后通过过量施用三卡因(即0.5 mg/mL,孵育10分钟,然后丢弃在漏斗内衬的吸收性纸上),将幼虫转移回34°C或剔除(6 dpi)。
11. (移植的)斑马鱼幼虫的共聚焦成像
- 如前所述,用 0.2 mg/mL 三卡因麻醉斑马鱼。
- 将玻璃底共聚焦皿置于立体显微镜下,并聚焦在培养皿底部。将 5-10 只幼虫转移到玻璃底共聚焦皿中。尽可能多地去除水分。
- 用 42 °C、1% 低熔点琼脂糖溶解在蛋水中覆盖幼虫。使用前确保琼脂糖已冷却至至少 42 °C;较高的温度可能会伤害或杀死幼虫。
- 使用立体显微镜,使用修剪下来的微型装载器尖端,快速但轻柔地定位幼虫将其向下推。如果需要腹侧方向,请用制表师镊子的钳子将幼虫固定到位(不要接触胚胎)。
- 而琼脂糖组对幼虫的方向进行微调。在转移到共聚焦显微镜之前,让幼虫完全凝固。
12. 设置共聚焦显微镜
- 打开绿色 (488 nm) 和红色 (564 nm) 激发激光线。将共聚焦培养皿放入共聚焦显微镜的支架中。使用落射荧光,移动光束以与第一条鱼合并(设置 x 和 y)。通过眼睛,将焦点设置为与幼虫的中心重合(设置 z)。
- 在两个荧光通道上设置 700 增益,1-5% 激光功率。增加激光功率并减少偏移以接近全动态范围。不要使信号过度饱和,而应增强信号以仅显示一些饱和像素。
- 捕获针迹时,沿一个轴( x 或 y)设置幼虫的起点和终点,如果沿一个轴设置,则可以以 1 x 4 段对整个胚胎进行成像,并且可以使用 ImageJ 后处理成一个图像。
- 成像后,使用 Watchmaker 的镊子在嵌入的幼虫周围轻轻撕扯,从琼脂糖中取出幼虫。否则,通过过量服用未稀释的三卡因对幼虫实施安乐死,用一层三卡因覆盖琼脂糖并孵育 10 分钟。
13. 数据分析
- 从 Vehicle Control 开始,分别打开 ImageJ/Fiji 中的各个数据集(即对照、药物 A、药物 B、药物 A+B)。
- 打开分析宏 (提供带注释的脚本) (http://doi.org/10.5281/zenodo.4290225)。
- 简而言之,宏分析执行以下作:连接所有打开的图像(一个条件);将图像拆分为组成图像的单独通道;关闭所有辅助通道(离开癌细胞通道);对整个串联序列运行阈值算法;测量每个单独图像的积分密度;并将度量作为 Excel 工作表保存在根文件夹中。
- 在所有条件下运行宏分析。
- 合并测量(通常至少为 n=2*20)并删除异常值(Graph pad Prism v8 中的 Q 检验)。
- 将测量值标准化为溶剂对照或第 1 天(取决于实验类型,前者用于药物抑制实验,后者用于生长动力学实验)。将测量值表示为随时间或条件(x 轴)的标准化癌细胞负荷(y 轴),分别如图 3 和图 4 所示。
结果
我们提供了分步说明,以一种快速简便的方法从新型细胞系进行到其分析。我们从使用慢病毒过表达盒的荧光示踪剂的过表达开始(步骤 3 和 4)。然后进行细胞制备,以确保注射时尽可能少的死体积,从而允许将大量细胞注射到 doC 和眶后空间(步骤 6 和 7)。随后,我们使用立体荧光显微镜和高倍率共聚焦显微镜进行半高通量数据采集,以定性分析全身癌细胞的传播(图 2 和步骤 10、11 和 12)。采集数据时必须小心,为了确保立体和共聚焦显微成像的可重复性,描述了通用设置和标准化(步骤 11 和 12)。讨论了数据分析(使用 imageJ/Fiji) 16,以及使用 imageJ 宏的标准化(步骤 13)。
在第 3 步中,我们提到了(癌症)细胞的瞬时标记,以进行快速预筛选以评估新癌细胞系的致瘤潜力。一个重要的警告是,尽管易于使用且寿命长,但此处描述的瞬时染色剂有可能形成伪影(即,必须注意确保细胞片段可以与整个细胞区分开来,就像 Fior 及其同事广泛进行的那样 9)。根据我们的经验,这些伪影的形成与染色剂的极端稳定性和亮度(即使在细胞死亡后)直接相关,其中细胞碎片被免疫细胞分散并吸收,随后可能被错误地断定为源于活动性转移。
在这两种模型中,通过 doC 的全身植入和眶后间隙的局部植入,注射后一天对幼虫进行彻底筛选至关重要。如图 2B 所示,在眶后模型中显示移植细胞机械位移到头部区域(超出眶后部位)和卵黄囊中的细胞,或在 doC 注射池中显示水肿的所有幼虫都应该被移除。所有负向选择的表型在 图 2 中显示为高分辨率共聚焦拼接,但可以通过立体显微镜观察很容易看到和去除。
随着时间的推移,细胞会迁移和增殖。对于眶后模型,我们观察到 CRMM1 浸润到邻近组织中,但我们观察到 CRMM2 的增殖较少。我们确实显着地观察到一些个体 (20%) 在 2-4 dpi 之间出现远处转移,我们在 6 dpi 时测量了显着差异,如图 4 所示。对于这两种细胞系,我们测试了注射到两个位点时的增殖潜力。对于 CRMM1,当显示为标准化肿瘤细胞负荷时,注射部位或注射部位的癌细胞数量显着增加 (p<0.0001),每个模型正常化至第 1 天 (增加 7.8 倍,RO 模型增加 ±3.2,doC 模型增加 15 倍 ±8,8)。当每个单独模型归一化到第一天时,CRMM2 没有显示出显着增长(增加 2.4 倍,±增加 1.9 倍和 2.3 倍,RO 和 doC 增加 ±1.14)。发现 CRMM1 在植入后很容易在眶后组织和尾部造血组织中增殖。细胞系 CRMM2 在两种模型中的增殖性较低,但有趣的是,当注射到眶后间隙时,发现能够进行远处转移,如图 3B、C 所示。
在 1 dpi 筛选注射的幼虫并将个体随机分配到治疗组或对照组后,将鱼处理 6 天,更换含有 Vemurafenib 的水(该抑制剂可以很容易地与任何其他滴定的抗肿瘤化合物互换)。我们选择通过测试 Vemurafenib 对原位移植 CRMM1 的疗效,详细阐述先前发表的血行结膜黑色素瘤播散模型移植 CRMM114。CRMM1 显示 Vemurafenib 处理的异位移植组 (P<0.0001) 的强烈显着减少,并且对原位移植模型 (p<0.05) 的反应发育迟缓但显着,如图 4 所示。
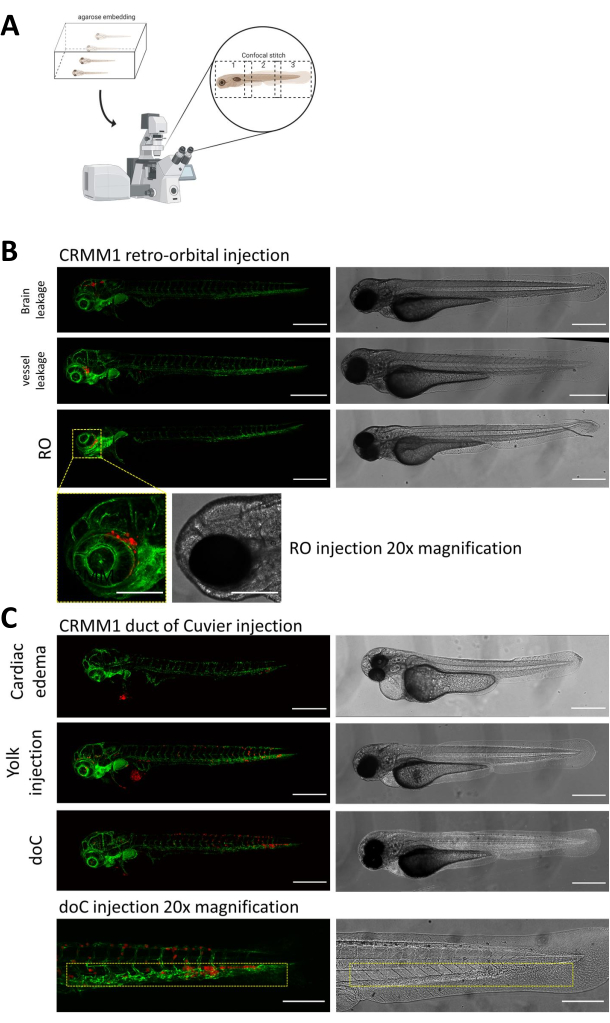
图 2.注射后的表型评估和筛查。A) 斑马鱼异种移植共聚焦拼接生成的示意图,在整合后续共聚焦投影后产生无缝、高分辨率的图像。在这里,斑马鱼异种移植物包埋在 1% 低熔点琼脂糖中,并安装在玻璃底共聚焦皿上(如步骤 11.3 所述)。 B) 在绿色荧光血管报告斑马鱼 (TG:fli:GFP) 中注射显示 Cuvier 植入的眶后和导管的所有可能结果,细胞通过慢病毒过表达 tdTomato 染色)。我们表示 1 dpi 的正确植入 (RO 面板) 和不需要的表型 (脑漏和血管漏)。必须删除后两个群体,以确保它们不会混淆下游实验结果。 C) 通过居维叶管 (doC) 进行血行植入的不需要的表型是轮廓,其中必须去除心脏水肿幼虫(心脏水肿)和细胞渗漏到卵黄囊(卵黄注射)的幼虫,以防止干扰下游测量。如步骤 7.1 所述,将正确注射的幼虫输入实验组。(所有图像均以 1 dpi 采集,使用共聚焦显微镜,比例尺 200 μm。黄色框分别表示 RO 和 doC 植入、头部区域和尾部造血组织的转移部位)。 请单击此处查看此图的较大版本。
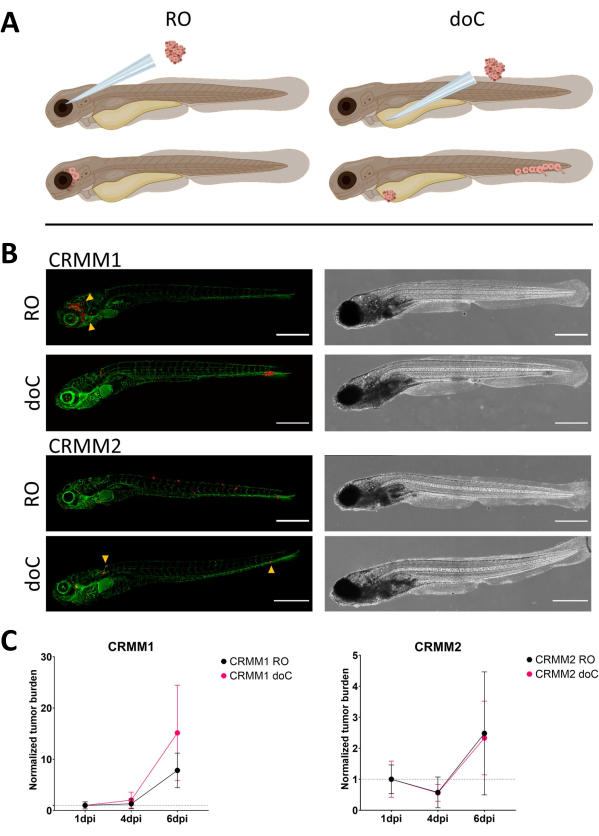
图 3.结膜黑色素瘤细胞系 CRMM1 和 CRMM2 的比较分析显示不同的转移和生长能力。A) 注射模型、眼眶后模型 (RO) 和血源性植入模型 (doC) 的示意图,使用的鱼是 TG(fli:GFP) 绿色血管报告基因,过度表达 tdTomato 的细胞显示为红色。 B) 用 CRMM1 和 CRMM2 移植的鱼的代表性表型,CRMM1 显示出有效的植入(RO 和 doC)和小规模侵入 RO 植入部位周围的组织(RO,黄色箭头)。CRMM2 在两种植入模型中都表现出显着较低的植入效率,但在眶后注射时显示远处转移(如 RO 所示,由箭头表示)。(所有图像均以 6 dpi 采集,共聚焦显微镜,比例尺 200 μm。黄色箭头分别表示 RO 和 doC 植入、头部区域和尾部造血组织的转移部位)。 C) CRMM1 和 CRMM2 的动力学植入图,将两种植入模型与第 1 天(标准化至第 1 天)进行比较,细胞系 CRMM1 的标准化肿瘤负荷显着增加 (p<0.0001) (在 1 dpi 和 6 dpi 之间),其中 CRMM2 有(不显着)上升趋势。CRMM1 揭示了 RO 和 doC 生长之间的显着差异,其中 doC 模型显示更高的肿瘤扩张率(doC 移植的幼虫大约高 2 倍)。图形显示平均值 (SEM) 的平均值和标准误差。对于每种情况,所有组均标准化为 1 dpi。 请单击此处查看此图的较大版本。
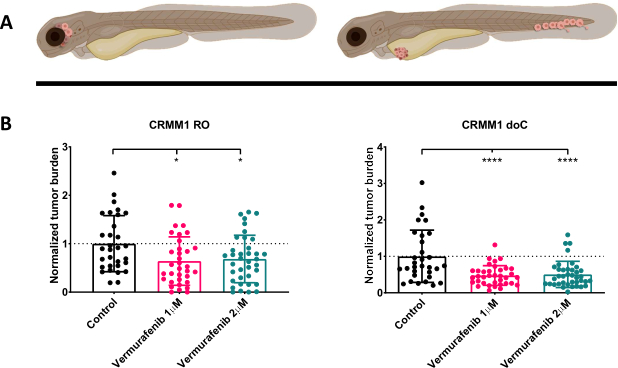
图 4.BRAF V600E 抑制剂 Vemurafenib 显着抑制 RO 和 doC 结膜黑色素瘤移植斑马鱼幼虫。 A) 斑马鱼表型、RO 和 doC 模型的示意图。 B) 注射结膜黑色素瘤细胞系 CRMM1 的 RO 和 doC 移植幼虫均显示正常化肿瘤负荷显着降低 (分别为 p<0.05 和 P<0.001)。doC 移植斑马鱼模型表明药物反应增强,并且与药物抑制呈剂量非依赖性关系,表明抑制可能饱和)。图表显示平均值 (SEM) 的平均值和标准误差,将所有组标准化以对照每个单独的细胞系。 请单击此处查看此图的较大版本。
| 试剂 | 卷 |
| psPAX2 抗体 | 1.71 pmol (12.14微克) |
| pMD2.G | 0.94 pmol (3.66微克) |
| 转移质粒* | 1.64 PMOL (计算精确体积) |
表 1.
讨论
在这里,我们定义了一种细致的方法来模拟斑马鱼异种移植物中的原发性和转移性眼部黑色素瘤。通过结合局部原位注射和全身异位注射模型,我们概括了以前没有动物模型的癌症致癌病因。早期斑马鱼幼虫固有的透明度允许在整个动物水平上追踪荧光标记的癌细胞,确保潜在转移部位的轻松可视化17。此外,高放大倍率共聚焦显微镜分析使我们能够以亚细胞分辨率跟踪细胞10。
我们提供了分步说明,以一种快速简便的方法从新型细胞系发展到建立异种移植物及其分析。我们首先使用慢病毒过表达盒(步骤 3 和 4)对荧光示踪剂进行过表达,然后进行细胞制备,以确保注射时尽可能少的死体积。这使得能够将高单元数注入 doC 和轨道后空间(步骤 7 和 8)。然后,我们使用立体荧光显微镜和更高放大倍率共聚焦显微镜进行半高通量数据采集,以定性分析全身癌细胞的播散(图 2 以及步骤 9 和 10)。采集数据时必须小心,为了确保立体和共聚焦显微成像的可重复性,描述了通用设置和标准化(步骤 11 和 12)。讨论了数据分析(使用 imageJ/Fiji) 16,以及使用 ImageJ 宏的标准化(步骤 13)。
在第 3 步中,我们提到了(癌)细胞的瞬时标记,以进行快速预筛选,以评估新癌细胞系的致瘤潜力。一个重要的警告是,尽管易于使用且寿命长,但本文描述的瞬时染色剂有可能形成伪影(例如,必须注意确保细胞片段可以与整个细胞区分开来,就像 Fior 及其同事广泛进行的那样 9)。根据我们的经验,这些伪影的形成与染色剂的极端稳定性和亮度(即使在细胞死亡后)直接相关,其中细胞碎片被免疫细胞分散并吸收,随后可能被错误地断定为源于活动性转移。
使用这些模型,我们通过将移植的细胞物理限制在眶后间隙内来模拟原发性肿瘤的发展。随后在植入后 1 天进行全面筛选,确保在实验后期在远处发现的细胞已经主动转移(内渗和播散,最终在转移性生态位外渗)。通过 doC(胚胎总主静脉)进行植入,可以轻松且高度可重复地大量植入细胞(适当浓缩时可盈余 600 个细胞),有效地规避了转移级联反应的初级阶段(内渗),并允许我们专注于转移级联反应的后期阶段(粘附、外渗和生长)。尽管如果使用得当,这两个模型都应进行广泛监测,但在植入后的第一天应进行广泛监测,以确保在实验的后期不会得出假阳性结论。
与以前的出版物一致,我们已经表明结膜黑色素瘤系在整个斑马鱼血液循环系统中传播后很容易形成转移性集落14。在这里,我们报道了作为原位模型的眶后注射的植入库的扩展,以及随后活动性转移至细胞系 CRMM2 的尾部造血组织。随后,我们报道了 BRAF V600E 特异性抑制剂 Vemurafenib 在斑马鱼幼虫中建模时对结膜黑色素瘤原发性形式的疗效。
使用上述方法,熟练的研究人员能够每天(约每小时 200 只)产生超过数百只移植幼虫。在两周的时间范围内,药物既可以滴定为最大耐受剂量,也可以在已建立的异种移植模型上进行筛选。从开始到结束,使用未转导的细胞系,到在斑马鱼模型中具有药物敏感性特征,都可以在一个月内实现(鉴于注射的细胞系在斑马鱼模型中是致瘤的)。在我们手中,每次实验只需 20 只幼虫,并且两个生物重复已可重复地产生强大的药物抑制,当两个单独的实验冲突(或未产生统计学上显着的生长抑制)时,可以进行第三次生物重复。
通过微小的调整,这些模型使我们能够快速适应胶质母细胞瘤(后脑腔注射)、乳腺癌(doC 注射)和骨肉瘤 (doC) 等 18,19,20,21。这些模型随后可用于单一药物和组合药物策略的基础研究和临床前筛选。最近,我们使用这些模型描述了不同的药物给药方案及其光激活 13。
披露声明
没有。
致谢
这项工作得到了欧盟 Horizon 2020 研究和创新计划的资助,根据第 667787 号赠款协议(UM Cure 2020 项目,www.umcure2020.org)。中国国家留学基金委衷心感谢 J.Y. 获得博士学位。
材料
| Name | Company | Catalog Number | Comments |
| 2.5mm box filament | Science products | FB255B | for pulling micro injection needles using a Sutter P97 or P1000 |
| 3mL transfer pipettes | Merck | Z350796 | for transfer and selection of zebrafish embryos |
| Agarose | Milipore | 2120 | 1.5% (w/v) in eggwater, 1.5 g in 100 mL DPBS, microwave to dissolve, for injecting and stereofluorescence imaging of zebrafish larvae |
| Capillaries: borosilicate glass outer | World precision instruments | BF100-78-10 | Borosilicate glass capillaries used for needle preparation |
| DMSO | Sigma | D8418 | Often used as solvent in drug treatments, should be stored at 2-8°C the dark. |
| DPBS | Thermo Fischer Scientific | 14190144 | Dulbecco’s phosphate buffered saline, without Mg2+ and Ca2+ for washing the cells, lack of Ca2+ impairs cell-cell adhesion through cadherins and prevents cell aggregation during injection |
| Egg water | Instant ocean | SS15-10 | 0.6 mg/L final concentration sea salt in demineralized water |
| GFP encoding lentiviral transfer plasmid | Addgene | Plasmid #106172 | Generated in Snaar lab, available at Addgene |
| Hek293T | ATCC | CRL-3216 | Stable cell line for generating lentiviral particles, contains SV40-T antigen required for the generation of lentiviral particles |
| Leica sp8 confocal | Leica | Leica TCS SP8 | automated stage confocal microscope with 405/488/514/635nm lasers |
| LipodD293 | Signagen | SL100668 | Highly efficient HEK293t optimized transfection reagent |
| Low-melting agarose | Milipore | 2070 | 1% (w/v) in eggwater 1.5 g in 100 mL DPBS, microwave to dissolve, for embedding zebrafish larvae for confocal imaging |
| Micro loader tips | Fischer scientific | 10289651 | flexible microloader tips |
| Micro manipulator | World precision instruments | M3301R | x/y/z manual micro manipulator for microinjection |
| Needle puller: P-97 or P-1000 | Sutter | P-97 | needle puller used for generating standardized micro engraftment needles |
| Nr.5 watchmakers forceps | VWR | HAMMHSC818-11 | fine watchmakers forceps used for breaking back needles |
| Picopump | World precision instruments | SYS-PV820 | pulse controller supplying pressure for microinjection |
| pMD2.G | Addgene | plasmid #12259 | Gifted by Didier Trono, 2nd generation lentiviral virulence plasmid |
| psPAX2 | Addgene | plasmid #12260 | Gifted by Didier Trono, 2nd generation lentiviral packaging plasmid |
| PVP40 | Sigma-Aldrich | PVP40 | Polyvinylpyrrolidone average mol wt 40,000) PVP40 2% (w/v) in DPBS, 1 g PVP40 in 50 mL DPBS. Vortex and incubate at 37°C to facilitate dissolving. Store at room temperature. |
| tdTomato encoding lentiviral transfer plasmid | Addgene | Plasmid #106173 | Generated in Snaar lab, available at Addgene |
| transmitted light stereo microscope | Leica | leica M50 with (MDG33 base) | leica transmitted light microscope with mirror adjustable illumination. |
| Tricaine | Sigma-Aldrich | E10521 | Ethyl 3-aminobenzoate methanesulfonate or MS-222 |
| TryplE | Thermo Fischer Scientific | 12604-01 | Synthetic trypsine replacement, less damaging to the cells and allows for the gentle dispersion of strongly adherent cells. (Thermo- |
| willco dish | WillCo wells | GWST-5040 | 50mm glass bottom dishes, allow for the embedding of up to 20 zebrafish larvae, enabling the imaging of multiple conditions in one dish due to its large optical glass surfac |
参考文献
- Yang, J., Manson, D. K., Marr, B. P., Carvajal, R. D. Treatment of uveal melanoma: where are we now. Therapeutic Advances in Medical Oncology. 10, (2018).
- Wong, J. R., Nanji, A. A., Galor, A., Karp, C. L. Management of conjunctival malignant melanoma: A review and update. Expert Review of Ophthalmology. 9, 185-204 (2014).
- Nguyen, D. X., Bos, P. D., Massagué, J. Metastasis: from dissemination to organ-specific colonization. Nature Reviews Cancer. 9, 274-284 (2009).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2, 183-189 (2008).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nature Reviews Drug Discovery. 4, 35-44 (2005).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Palmblad, M., et al. Parallel deep transcriptome and proteome analysis of zebrafish larvae. BMC Research Notes. 6, 428 (2013).
- Yan, C., et al. Visualizing Engrafted Human Cancer and Therapy Responses in Immunodeficient Zebrafish. Cell. 177, 1903-1914 (2019).
- Fior, R., et al. Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts. Proceedings of the National Academy of Sciences of the United States of America. 114, 8234-8243 (2017).
- Campbell, P. D., Chao, J. A., Singer, R. H., Marlow, F. L. Dynamic visualization of transcription and RNA subcellular localization in zebrafish. Development. 142, 1368-1374 (2015).
- Campeau, E., et al. A Versatile Viral System for Expression and Depletion of Proteins in Mammalian Cells. PLoS One. 4, 6529 (2009).
- vander Helm, D., et al. Mesenchymal stromal cells prevent progression of liver fibrosis in a novel zebrafish embryo model. Scientific Reports. 8, 16005 (2018).
- Chen, Q., et al. TLD1433 photosensitizer inhibits conjunctival melanoma cells in zebrafish ectopic and orthotopic tumour models. Cancers. 12, (2020).
- Pontes, K. C. d. e. S., et al. Evaluation of ( fli:GFP ) Casper Zebrafish Embryos as a Model for Human Conjunctival Melanoma. Investigative Opthalmology & Visual Science. 58, 6065 (2017).
- Liverani, C., et al. Innovative approaches to establish and characterize primary cultures: an ex vivo 3D system and the zebrafish model. Biology Open. 6, 133-140 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2, 183-189 (2008).
- Mercatali, L., et al. Development of a patient-derived xenograft (PDX) of breast cancer bone metastasis in a Zebrafish model. International Journal of Molecular Sciences. 17, (2016).
- Tulotta, C., et al. Imaging cancer angiogenesis and metastasis in a zebrafish embryo model. Advances in Experimental Medicine and Biology. 916, 239-263 (2016).
- Paauwe, M., et al. Endoglin expression on cancer-associated fibroblasts regulates invasion and stimulates colorectal cancer metastasis. Clinical Cancer Research. 24, 6331-6344 (2018).
- Cao, J., et al. Overexpression of EZH2 in conjunctival melanoma offers a new therapeutic target. Journal of Pathology. 245, (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。