Method Article
원발성 종양 및 실험적 전이 발달을 재현하기 위한 안구 흑색종의 ortho- and ectopic zebrafish Xeno-Engraftment
요약
여기에서는 원발성 종양의 성장 동역학, 파종, 파상, 혈관 밖 및 원거리, 혈관 주위 전이 형성 및 이에 대한 화학적 억제 효과를 평가하기 위해 안구 흑색종에 대한 다양한 정소성 및 이소성 제브라피시 이종이식 모델을 확립하기 위한 프로토콜을 제시합니다.
초록
현재 전이성 안구 흑색종에 대한 동물 모델은 없습니다. 전이성 질환 모델의 부족은 전이성 안구 흑색종의 치료를 위한 새로운 전략의 연구 개발을 크게 방해했습니다. 이 프로토콜에서는 각각 후안와 정소성 및 혈관내 이소성 세포 생착을 사용하여 안구 흑색종의 원발성 및 파종기 모두에 대한 배아 제브라피시 모델을 생성하는 빠르고 효율적인 방법을 설명합니다. 이 두 가지 다른 생착 전략을 결합하면 눈 밑의 원발성 국소 종양 성장에서 꼬리의 혈관 주위 전이 형성에 이르기까지 암의 병인을 전체적으로 요약할 수 있습니다. 이러한 모델을 통해 특정 라벨링, 유전적 또는 화학적 간섭으로 이식하기 전에 암세포를 빠르고 쉽게 수정할 수 있습니다. 그리고 종양 발달을 약화시키기 위해 생착된 숙주를 (소분자) 억제제로 치료합니다.
여기에서는 형광 표지된 안정한 세포주를 사용하여 안구 흑색종(결막 및 포도막 흑색종)의 정소성 및 이소성 생착의 생성 및 정량화에 대해 설명합니다. 이 프로토콜은 환자 생검 및 환자/PDX 유래 물질(준비 중인 원고)에서 유래한 일차 세포의 생착에도 적용할 수 있습니다. 생착 후 몇 시간 내에 세포의 이동 및 증식을 시각화하고 정량화할 수 있습니다. 두 종양 병소 모두 epifluorescence microscopy와 confocal microscopy로 이미징하는 데 쉽게 사용할 수 있습니다. 이러한 모델을 사용하여 실험 시작 후 8일 이내에 화학적 또는 유전적 억제 전략의 활성을 확인하거나 반박할 수 있으며, 이를 통해 안정적인 세포주에 대한 고효율 스크리닝을 수행할 수 있을 뿐만 아니라 정밀 의학 접근법에 대한 환자 주도 스크리닝을 수행할 수 있습니다.
서문
전이성 파종은 안구 흑색종의 주요 사망 원인으로 간주됩니다. 현재 파종성 안구 흑색종에 대한 실행 가능한 치료법은 없습니다 1,2. 또한, 전이성 질환을 반영하는 안구 흑색종에 사용할 수 있는 동물 모델은 없습니다. 이 간극을 메우기 위해 원발성 종양 형성 또는 전이성 전파의 초기 단계를 요약하는 두 개의 별개의 제브라피시 모델을 생성하여 일반적으로 연구하기 어려운 이러한 과정을 쉽게 연구할 수 있도록 했습니다 3. 미세전이 모델을 통해 귀환(homing), 집락화(colonization) 및 외출(extravasation)을 포함한 전이성 확산의 마지막 단계를 분석할 수 있습니다. 이 단계와 그 이후의 유전적 또는 화학적 개입은 잠재적으로 전이성 안구 흑색종 치료에 강력한 지지력을 제공할 수 있습니다.
제브라피시 유충을 이종이식과 동종이식의 수혜자로 사용하는 것은 발달 초기 단계( 또는 캐스퍼 돌연변이의 전체 생애 주기)4, 높은 번식력 및 자궁 외 수정5과 같은 이 종의 고유한 강점에 의해 뒷받침됩니다. 척추동물의 높은 전사 상동성은 제브라피시와 인간 사이의 핵심 신호 전달 메커니즘의 유지를 보장 하므로 결과의 높은 잠재적 번역 가능성6을 보장하지만, 유전적 접근은 teleost 게놈 복제로 인해 때때로 손상되거나 복잡합니다 7. 최근의 발전은인간 질병의 전임상 "아바타"로서 제브라피시 이종이식 모델의 중요성을 강조하고 있으며8, 단일 제브라피 시 실험9에서 치료 전략의 전임상 평가를 위한 수많은 맞춤형 암 치료 모델을 효과적으로 산출했습니다.
동물 모델의 부족과 전이성 안구 흑색종에 대한 치료 옵션의 부족을 고려할 때, 당사의 모델은 전임상 환경에서 유전자 변형(암세포 내인성)을 모두 스크리닝하거나 화학적 개입 전략을 개발할 수 있는 빠르고 쉬운 번역 플랫폼을 제공합니다. 동일한 모델 내에서 실체 형광 현미경에서 저농도 배율을 사용하여 전체 동물 수준에서 암세포 성장 역학, 생착 속도/전이 가능성 및 세포 귀환을 시각화 및 측정할 수 있으며, 중간 또는 고배율 컨포칼 현미경 분석을 사용하여 유사한 측정을 수행하여 세포 내 해상도 10에서 안구 흑색종 진행의 여러 단계를 해부할 수 있습니다.
여기에서는 다음을 위한 포괄적이고 상세한 프로토콜에 대해 설명합니다: 고도로 최적화된 렌티바이러스 형질도입11을 사용한 형광 표지된 암세포의 생성; 이후 이러한 세포를 2일 후 수정(DPF) 후 제브라피시 유충에 정맥 주사 및 역안와(RO) 생착하여 각각 이소성 및 정소성 모델을 생성하는 단계; 그 다음에는 데이터 수집 및 분석이 이어집니다. 이러한 방법은 본원에 설명된 응용 프로그램에 대해 포괄적이지만 필요할 때 (주사 부위 또는 주사 시간을 변경함으로써만) 뒷뇌강, 간 및 페리비텔린 공간에 세포를 생착하도록 수정할 수 있습니다12,13.
개념 증명(proof-of-concept)으로 우리는 Pontes et al. 2018의 연구 결과를 자세히 설명했으며, 여기서 우리는 제브라피시 모델 14에서 결막 흑색종 세포주의 용량 및 세포 고유 돌연변이 특이적 반응을 보여주었습니다. 우리는 전이성 및 원발성 결막 흑색종 모델 모두에서 BRAF V600E 돌연변이 특이적 억제제 베무라페닙의 효능을 보여줌으로써 이러한 결과를 정교화했습니다.
프로토콜
모든 동물 실험은 면허 AVD1060020172410에 따라 동물 실험 위원회(Dier Experimenten Commissie, D.E.C.)의 승인을 받았습니다. 모든 동물은 표준 프로토콜(www.ZFIN.org)을 사용하여 현지 지침에 따라 관리되었습니다.
1. 준비
- 시약
- 계란 물 준비: 0.6mg/L 최종 농도 바다 소금.
- 5mg/mL 트리카인 25x 스톡 준비: 트리카인(에틸 3-아미노벤조에이트 메탄설포네이트 또는 MS-222) 분말 5g, 탈염수 900mL, 1M 트리스(pH 9) 21mL를 혼합합니다. pH 7로 조정하고 최대 1L를 채울 수 있습니다. 트리카인은 단기(최대 6개월) 동안 4°C에서 보관하거나 햇빛으로부터 보호되는 실온에서 한 달 동안 실온에서 보관할 수 있습니다.
- 달걀 물에 1.5%(w/v) 아가로스를 준비합니다: DPBS 100mL에 1.5g. 전자레인지에 녹여주세요.
- 달걀 물에 1%(w/v) 저융점 아가로스를 준비합니다: DPBS 100mL에 1.5g. 전자레인지에 녹여주세요.
- DPBS로 PVP40 스톡 2%(w/v) 준비: DPBS 50mL에 PVP40 1g. 용해를 용이하게 하기 위해 37°C에서 소용돌이치고 배양합니다. 실온에서 보관하십시오.
- DMSO를 사용합니다. 그것은 약물 처리에 있는 용매로 자주 사용되고 2-8 °C 어둡에 저장되어야 합니다.
- 세포에 대한 손상이 적고 강력하게 부착된 세포가 부드럽게 분산될 수 있는 합성 트립신 대체품인 TrypLE를 사용하십시오.
- 세포 세척을 위해 Mg2+ 및 Ca2+ 가 없는 Dulbecco의 인산염 완충 식염수(DPBS)를 준비합니다. Ca2+ 가 부족하면 cadherin을 통한 세포-세포 부착이 손상됩니다.
- 렌티바이러스 플라스미드를 준비합니다: Didier Trono가 선물한 psPAX2 (plasmid #12260) 및 pMD2.G (plasmid #12259)와 GFP (Plasmid #106172) 또는 tdTomato (Plasmid #106173) 인코딩 전달 플라스미드 (Addgene).
- LipodD293 사용: 고효율 HEK293T 최적화된 transfection 시약.
- 아가로스 요리
알림: 장기간 보관된 접시를 사용할 때는 주입을 시작하기 전에 접시에 소량의 계란수를 넣어야 합니다(이렇게 하면 생선이 너무 빨리 마르는 것을 방지할 수 있습니다).- 1.5%(w/v) 아가로스 코팅 접시(달걀 물에 녹인 아가로스)를 준비합니다.
- 즉시 사용하거나 4°C에서 거꾸로 보관하십시오.
2. 바늘
알림: 사용된 필라멘트에서 모세관이 보정되었는지 확인하십시오. 필라멘트 또는 모세관을 전환할 때 사용된 필라멘트에 있는 모세관의 램프 값을 결정합니다(니들 풀러 설명서 참조).
- 하나의 유리 모세관으로 두 개의 마이크로 주사 바늘이 생성됩니다. 바늘을 만들기 전에 바늘 풀러의 필라멘트(2.5mm 상자 필라멘트)의 구조적 무결성을 확인하십시오.
- 필라멘트와 모세관이 모두 해당 램프 값을 얻기 위해 보정되었는지 확인하십시오. 필라멘트의 구조적 무결성이 손상되면(즉, 고르지 않은 경우, 구멍, 용융된 경우 등) 필라멘트를 교체하십시오.
- 다음 프로그램을 사용하십시오(Needle #99, Heat=ramp+15, pull=95, velocity=60, time=90). 바늘을 지정된 페트리 접시에 보관하십시오(바늘을 붙일 점토 또는 테이프 포함).
3. 렌티바이러스 입자의 생성
참고: 시간과 자원의 낭비를 방지하기 위해 렌티바이러스 형질도입 전에 빠른 종양원성 검사를 수행할 수 있습니다. 이는 사용되는 세포주가 제브라피시 모델에서 충분히 종양을 유발하는지 확인하기 위해 수행되며, 이를 위해 Liverani et al. 2017 15에 설명된 대로 세포를 CMdiI(또는 유사 추적자)로 염색할 수 있습니다.
- plate HEK 293t 세포는 transfection 하루 전에 약 70%의 포화도를 달성합니다(하루 전에 1:3 희석으로 동일한 부피의 배양 플라스크로 전체 플라스크를 분할하여 일상적으로 수행).
- transfection 당일, 전달 플라스미드를 인코딩하는 GFP(Plasmid #106172) 또는 tdTomato(Plasmid #106173)와 함께 플라스미드를 발현하는 필요한 패키징 플라스미드 psPAX2 및 pMD2.G 바이러스 외피를 동시 transfection합니다. 사용된 플라스미드의 정확한 양은 표 1에 명시되어 있습니다.
참고: psPAX2와 pMD2.G는 모두 Didier Trono(각각 Addgene plasmid #12260 및 #12259)에 의해 선물되었습니다.
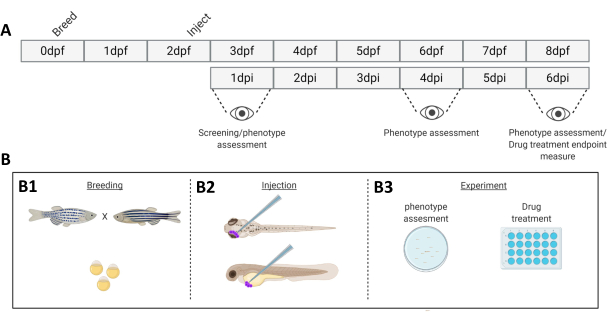
그림 1. 설명된 제브라피시 생착 시스템의 개략도. A) 0일차(B1)에 제브라피시를 번식시키는 접근 방식의 타임라인. 물고기는 물고기를 건너 (1 일째) 아침에 수확합니다. 48-54시간 후에 물고기는 대부분 부화하고(융모막을 흘림) 물고기는 융모막 잔해의 물을 청소한 후(2일차) 주입됩니다(역궤도 또는 전신적으로, B2). 그 후 실체 형광 현미경을 사용하여 유충을 스크리닝하고 원치 않는 표현형을 나타내는 모든 유충은 폐기합니다(3일차). 실험의 목적에 따라 시간이 지남에 따라 유충을 이미지화하거나(B3, 생착 동역학, 주입 후 1일, 4일 및 6일(dpi)에서 이미지화) 물고기를 무작위 배정하여 실험 그룹에 넣고 약물 처리 및 차량 대조군과 비교합니다(약물 스크리닝, 6dpi에서 이미지화). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 500 μL의 무혈청 배지에 모든 플라스미드를 함께 혼합하여 모든 플라스미드를 완전히 혼합할 수 있습니다. 32μL의 LipoD293 시약을 500μL의 무혈청 DMEM에 첨가하고 와류를 일으켜 완전히 혼합합니다. 두 볼륨을 완전히 혼합하십시오. 플라스미드와 lipoD293을 20분 동안 복합체로 만듭니다.
- 9mL의 완전 배양 배지를 함유한 70% 융합 HEK293T 세포를 함유한 75cm2 세포 배양 플라스크에 적가합니다. transfection 혼합물을 혈청학적 피펫(수평 방향의 플라스크)을 사용하여 세포층에 직접 추가합니다.
- transfection 16시간 후에 배지를 20mL의 새로운 완전 DMEM으로 교체합니다. transfection 후 72시간 후에 상층액을 수확합니다. 부분 표본 바이러스 상등액을 1mL 부분 표본에 넣고 -80 °C에서 보관합니다. 렌티바이러스 상등액은 -80°C에서 최소 1년 동안 안정적입니다.
4. 렌티바이러스 형질도입
- 렌티바이러스 형질도입 전에, 선택 가능한 렌티바이러스 구조체를 사용할 때 kill curve를 설정합니다.
- kill curve의 경우, 12웰 플레이트(confluence 약 10-20%)에 형질주입될 세포주를 플레이트화합니다. 선택제의 용량 곡선을 추가합니다(킬 곡선의 대략적인 농도: 퓨로마이신 0.5-10 μg/mL, 블라스티시딘 1-20 μg/mL, 게네티신(G418) 100-2000 μg/mL, 하이그로마이신 100-2000 μg/mL).
- 선택한 선택제의 안정적인 농도를 보장하기 위해 3일마다 배지를 교체하십시오.
- 20-40% 융합 세포에 8 μg/mL 폴리브레렌의 최종 농도를 함유한 9 mL의 배양 배지에 1 mL의 렌티바이러스 상등액을 첨가합니다. 부피는 상층액/매체의 비율을 유지하면서 축소할 수 있습니다.
- transduction 후에 16-24 시간은, 매체를 교환합니다. 필요한 경우 이전 단계를 반복하여 표현형 침투를 향상시킵니다(다른 형질도입이 필요한지 결정하기 위해 형광을 확인).
- 형질도입 48시간 후, 렌티바이러스 카세트에 통합된 내성 마커에 해당하는 항생제를 사용하여 세포를 선택합니다. 형질도입된 세포 집단의 선택에 사용할 농도는 선택제를 적용한 후 7일 이내에 야생형 집단을 사멸시켜야 합니다(즉, 형질도입된 세포가 야생형 집단을 능가하도록 허용).
- 세포 게놈에 의해 발생한 형질도입 및 유전적 병변이 세포 생존율 또는 종양원성에 부정적인 영향을 미치지 않도록 하기 위해 다양한 감염 다중성(MOI's)에 바이러스 상등액을 적용합니다.
5. 제브라피시 번식
- 암세포가 생착되기 2일 전인 0일째에 실온에서 "패밀리 크로스" 방식으로 성체 제브라피시를 짝짓습니다(그림 1).
- 하우징 시스템에서 제브라피시 탱크를 제거합니다(28.5°C에서 유지).
- 물고기를 수컷과 암컷의 1:1 비율로 작은 번식 클러스터로 분리하며, 클러스터당 10마리의 물고기를 잡습니다. 물고기를 작은 번식 탱크, 하우징 시스템에서 끌어온 물, 비스듬한 화격자 위(제브라피시가 자연적으로 산란하는 얕은 곳을 모방하기 위해 비스듬함) 위에 놓습니다.
참고: 온도가 28.5°C에서 실온(25°C)으로 떨어지고 어둡고 밝은 주기의 다음 밝은 단계로 진입함으로써 물고기가 산란합니다. - 그런 다음 성인을 제거하고 주택 탱크로 옮깁니다.
- 계란을 모으고 체를 사용하여 계란 물로 씻으십시오. 계란을 요리당 약 75-100개로 나누고 28.5°C를 유지합니다.
- 채취 후 약 6시간 후에 죽거나 기형인 배아의 접시를 청소합니다.
- 다음날 아침, 난물을 교환하고 죽은 배아의 접시를 다시 청소하십시오.
6. 세포 수확
참고: 적절한 세포 준비는 이식 절차의 핵심이며, 불필요한 양의 세포를 사용하면 다운스트림 처리가 더 쉬워집니다. 세 번째 원심분리 단계는 세포 펠릿만 남게 되고 원심분리기 튜브 측면에 붙어있는 나머지 PBS가 최종 재현탁액을 크게 초과하기 때문에 매우 중요합니다.
- 세포 배양에 사용되는 모든 배지와 용액을 사용하기 전에 37°C 수조에서 예열합니다.
- 75cm2 배양 플라스크당 2mL의 TryplE 또는 25cm2 플라스크당 1mL를 추가하고 모든 세포가 둥글어질 때까지 배양합니다. 대부분의 세포주에는 2-5분이면 충분합니다. 고도의 상피 세포 또는 섬유아세포 세포의 경우 5-10분 동안 적절한 분리가 가능해야 합니다(불충분한 트립신화는 다운스트림 과정을 방해하고 이식 중 세포 응집을 촉진합니다).
- 플라스크의 측면을 부드럽게 두드려 남아 있는 세포를 제거합니다.
- 완전한 매체의 원래 배양 볼륨에 추가하십시오. 피펫을 혈청학적 피펫으로 부드럽지만 철저하게 위아래로 피펫하여 세포 덩어리를 단세포 현탁액으로 전단합니다. 거품은 세포의 기계적 전단을 나타내므로 이 과정에서 거품을 생성하지 마십시오.
- 멸균 15mL 튜브에 넣고 실온에서 200 x g 에서 5분 동안 원심분리합니다. 상층액을 흡입하고 멸균 PBS 1mL를 추가합니다. 멸균 1000 μL 피펫을 사용하여 세포를 신중하고 철저하게 재현탁합니다.
- 카운팅을 위해 20μL 세포 현탁액을 제거하고 나머지 세포 현탁액을 원심분리기로 옮깁니다. 실온에서 200 x g에서 4분간 원심분리기를 사용합니다.
- 중요 단계: 모든 PBS를 제거하고 실온에서 30 x g에서 200초 동안 원심분리기를 제거하고 나머지 PBS를 제거합니다.
- 다음과 같이 2% 폴리비닐피롤리돈 40(PVP40, DPBS에서 2%(w/v))에서 세포를 250 cells/nL로 희석합니다.
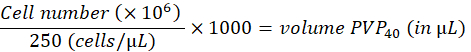
(예: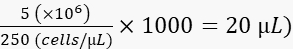
- 기포 형성을 방지하면서 세포를 철저히 재현탁시킵니다(세포는 종양 생성 전위의 손실 없이 2% PVP40 에서 최소 2시간 동안 유지될 수 있음).
7. 이종이식 모델링
모든 실험은 현지 동물 복지 규정에 따라 수행되어야 합니다.
응용 분야에 따라 실험 설계의 두 가지 주요 변형은 표현형 평가(7.1, 사전 스크리닝 단계)로 분류되고 두 번째는 생착 전에 세포가 변형된 스크리닝 또는 배아를 화학 억제제로 처리하는 7.3으로 분류됩니다.
- 종양 형성 가능성의 사전 스크리닝 및 결정
- 관심 제브라피쉬 유충(WT, 형질전환 또는 리포터 라인)을 다양한 수의 형광 세포(즉, 200, 400, 600 ±100)로 2 dpf에서 이식합니다.
- 주입 후 16-24시간 후에 유충을 스크리닝하여 이상치(이소성 모델의 경우 순환 중인 세포 수가 매우 높거나 낮거나 정소성 모델의 경우 머리 내부의 세포)를 제거하고 잘못 생착된 물고기를 제거합니다. 그룹 분석을 위한 실험 그룹별 유충의 nr 대 동일한 유충의 역학 분석을 표시합니다.
- 정기적으로(주입 후 1,2,4,6일(dpi)) 제브라피시 유충을 모니터링하고 ±50마리의 유충 풀에서 20마리(9단계 및 10단계 설명)를 이미지화합니다.
- 일반적인 표현형 및 질병 진행을 모니터링하고 이후 ImageJ(암세포 내 형광단 신호의 통합 밀도 측정)로 정량화합니다.
- 데이터를 플롯하여 제브라피시 내의 암세포 성장 역학을 시각화합니다(그림 3).
- 세포를 선험적으로 수정하고(관심 유전자를 knockdown 또는 knock out) 제브라피쉬에 생착합니다.
- 물고기를 생착시키고 원치 않는 모든 표현형을 제거합니다(조건별).
- 1dpi(그룹당 유충 20마리)에서 개체를 이미지화합니다. 설정된 간격(1,2,4 및 6dpi)으로 개체를 이미지화할 수 있습니다.
- 이미징 후 6dpi에서 트리카인을 과다 투여하여(0.4mg/mL에서 10배 초과) 물고기를 안락사시키고 깔때기를 감싸고 있는 흡수성 종이에 버립니다.
- 생착 후 물고기를 약물로 치료하십시오.
- 생착된 제브라피쉬에 약물을 적용하기 전에 제브라피쉬의 최대 허용 용량(MTD)을 측정하고(가장 높은 용량의 용매를 음성 대조군으로 사용하여 10μM-0.150nM에서 적정량) MTD를 >80%의 개체가 전체 치료에서 생존하는 농도로 설정했습니다.
- 주입 후 1일 후에 원치 않는 표현형을 제거합니다.
- 물고기를 무작위로 그룹(36-48명/조건)으로 나누고 24개의 우물 플레이트에 6마리의 달걀 물 1mL에 우물당 유충이 있는 상태로 유지합니다.
- 생착 후 24시간 후에 약물을 도포하십시오. 대조군은 실험군에 적용되는 가장 높은 부피의 동일한 양의 용매(DMSO, EtOH 등)를 사용합니다.
- 최대 허용 용량으로 약물 치료를 시작하십시오. 약물이 함유된 달걀 물을 격일로 교체하십시오. 교체할 때마다 달걀 물과 죽은 유충을 가능한 한 완전히 제거하십시오.
8. 주입
알림: 압축 공기 라인에 연결된 공압 펄스 컨트롤러를 사용하여 100psi의 잉여 압력을 공급합니다. 이를 통해 주입(≈20psi)과 가능한 세포 응집체(≈100psi)를 모두 배출할 수 있는 충분한 압력을 얻을 수 있습니다. 시작 압력과 시간은 20psi에서 약 200ms여야 합니다. 주입 시작 시 둘 중 하나를 50% 이상 줄여야 하는 경우, 세포 현탁액이 너무 유동적이거나(셀 또는 PVP40 농도가 너무 낮음) 바늘 구멍이 너무 큽니다.
- 용기에서 모세관 바늘을 조심스럽게 꺼냅니다. 바늘을 부러뜨려 ø20 μm의 구멍을 만들고 고급 시계 제작자의 집게를 사용합니다.
- 20 μL 피펫 팁을 사용하여 세포를 신중하고 철저하게 재현탁합니다. 피펫 세포를 긴 (마이크로 로더) 팁을 사용하여 열린 유리 모세관 바늘에 현탁액. 마이크로 매니퓰레이터에 바늘을 넣습니다.
- 전사 피펫을 사용하여 0.04 mg/mL 트리카인으로 마취된 ~20-40마리의 유충을 아가로스 접시에 놓습니다. 이송 피펫을 사용하여 유충을 고정시키기 위해 과도한 수분을 제거하십시오. 유충은 여전히 상대적으로 큰 난황 주머니가 있기 때문에 대부분 측면 방향으로 향합니다.
- 이소성 모델을 위해 도C(Duct of Cuvier)를 통해 약 200개, 400개 및 600개의 세포를 유충에 주입합니다.
- 마찬가지로, 유충을 역궤도(RO)로 주입합니다. orthotopic 모델(100±50개 세포 주입)을 생성하려면, 피코 펌프의 공압 펄스 길이를 수정합니다(~20psi, 200ms에서 시작하여 그에 따라 조정). 주입하는 동안 유충이 마르지 않도록 하십시오. 모든(또는 대부분의) 유충이 주입되었는지 확인하십시오.
- 주입된 유충을 신선한 달걀 물로 씻어내고 라벨이 붙은 깨끗한 페트리 접시로 옮깁니다(접시당 최대 150마리까지 모입니다). 충분한 유충이 주입될 때까지 이 과정을 반복합니다.
- 생착 후에는 제브라피시가 쉽게 견딜 수 있는 최고 온도인 34°C의 가습 인큐베이터에서 물고기를 34°C로 유지하고 포유류 암 세포를 효율적으로 생착할 수 있습니다.
참고: 일반적으로 doC와 RO 모두에서 단일 세포주를 주입할 경우 <5%의 기계적 손상으로 인한 대략적인 폐사가 관찰되었습니다(기계적 손상은 주입 후 1-16시간 사이에 유충을 죽입니다).
9. 심사
- 실체 형광 현미경을 사용하여 선험적으로 변형된 세포를 비교할 때 이식 1시간 후(또는 약물 스크리닝 시 이식 후 1일 전에 치료 그룹에 무작위로 할당하기 전)에 물고기의 적절한 표현형을 스크리닝합니다.
- doC를 통해 이식된 유충은 착상 후 1시간에서 16시간 사이에 꼬리에 세포가 있어야 합니다. 이상을 보이는 물고기를 포함하여 다른 모든 물고기를 주입된 수영장에서 제거합니다.
참고: 후안와에 이식된 유충은 눈 뒤의 간질에만 세포가 있어야 하며, 세포가 머리나 몸 전체에 퍼져 있는 유충은 수영장에서 제거됩니다. - 긍정적으로 선별된 유충을 청소하고 실험 그룹에 무작위로 할당합니다.
- 생착 후에는 가습 인큐베이터에서 물고기를 34 °C로 유지하고 매일 모니터링하십시오. doC를 통해 이식된 세포의 혈액 전파는 거의 즉각적으로 이루어지는 반면, RO 공동에 이식된 세포의 전이성 확산은 2-4일 후에 퍼집니다.
10. 제브라피쉬 유충의 epifluorescent imaging
- 물고기의 물에 트리카인을 첨가하거나 유지 관리 접시에서 0.2mg/mL 트리카인이 함유된 접시로 물고기의 하위 개체군을 이동하여 0.2mg/mL 트리카인으로 제브라피시 유충을 마취합니다.
- 제브라피시가 가만히 있을 때까지 트리카인이 든 접시에 담아 두고, 측선의 자극이 비행 행동을 유발하지 않을 때까지 유지합니다.
- 생선을 아가로스로 덮인 페트리 접시에 옮기며, 요리당 약 10개입니다. 접시의 한쪽 끝을 부드럽게 들어 올리면서 대부분의 물을 제거합니다(물이 페트리 접시의 아래쪽 끝에 부드럽게 고일 수 있도록 함). 조심스럽게 수행하면 모든 물고기가 꼬리가 아래를 향하도록 정렬됩니다.
- 접시의 위에서 아래까지 모든 물고기를 상상하십시오. 그런 다음 트리카인이 없는 접시에 계란물을 묻혀 생선을 씻어냅니다.
- 충분한 개체가 이미지화될 때까지 반복합니다.
- 그런 다음 유충을 34°C로 다시 옮기거나 트리카인 과다 투여(즉, 0.5mg/mL, 깔때기를 감싸는 흡수성 종이에 버리기 전에 10분 동안 배양)를 통해 도태(6dpi에서)합니다.
11. (생착된) 제브라피시 유충의 컨포칼 이미징
- 앞서 설명한 대로 0.2mg/mL 트리카인으로 제브라피시를 마취합니다.
- 실체 현미경 아래에 유리 바닥 컨포칼 접시를 놓고 접시 바닥에 초점을 맞춥니다. 5-10 마리의 유충을 유리 바닥 컨포칼 접시에 옮깁니다. 가능한 한 많은 물을 제거하십시오.
- 유충을 42 °C, 1 %의 낮은 용융 아가로스를 달걀 물에 녹여 덮습니다. 사용하기 전에 아가로스가 최소 42°C로 냉각되었는지 확인하십시오. 더 높은 온도는 유충을 해치거나 죽일 수 있습니다.
- 실체 현미경을 사용하여 트리밍된 마이크로 로더 팁을 사용하여 유충을 아래로 밀어내는 유충의 방향을 빠르고 부드럽게 지정합니다. 복부 방향이 필요한 경우 시계 제작자의 집게의 집게로 유충을 제자리에 고정하십시오(배아를 건드리지 않음).
- 아가로스 세트는 유충의 방향을 미세하게 조정합니다. 컨포칼 현미경으로 옮기기 전에 유충이 완전히 굳을 때까지 기다립니다.
12. 컨포칼 현미경 설정
- 녹색(488nm) 및 빨간색(564nm) 여기 레이저 라인을 켭니다. 컨포칼 접시를 컨포칼 현미경 홀더에 놓습니다. epifluorescence를 사용하여 light bundle을 이동하여 첫 번째 물고기와 합쳐지도록 합니다( x 및 y 설정). 안구를 통해 유충의 중심과 일치하도록 초점을 설정합니다( z 설정).
- 두 형광 채널에서 700 게인, 1-5% 레이저 출력을 설정합니다. 레이저 출력을 높이고 오프셋을 줄여 전체 다이내믹 레인지를 근사화합니다. 신호를 과포화시키지 말고 몇 개의 포화 픽셀만 표시하도록 신호를 강화하십시오.
- 스티치를 캡처할 때 한 축( x 또는 y)을 따라 유충의 시작과 끝을 설정하고, 한 축을 따라 설정하면 전체 배아를 1 x 4 세그먼트로 이미지화할 수 있으며 ImageJ를 사용하여 하나의 이미지로 후처리할 수 있습니다.
- 이미징 후 워치메이커의 집게를 사용하여 박힌 유충 주위를 부드럽게 찢어 아가로스에서 유충을 제거합니다. 그렇지 않으면 희석되지 않은 트리카인을 과다 투여하고 아가로스를 트리카인 층으로 덮고 10분 동안 배양하여 유충을 안락사시킵니다.
13. 데이터 분석
- ImageJ/Fiji의 개별 데이터 세트(즉, 대조군, 약물 A, 약물 B, 약물 A+B)를 차량 제어부터 시작하여 개별적으로 엽니다.
- 해석 매크로를 엽니다(주석이 추가된 스크립트 사용 가능)(http://doi.org/10.5281/zenodo.4290225).
- 간단히 말해서 매크로 분석은 다음을 수행합니다 : 열려있는 모든 이미지 (하나의 조건)를 연결합니다. 이미지를 포함하는 별개의 채널로 이미지를 분할하는 단계; 모든 부속 채널을 닫습니다(암세포 채널을 벗어남). 연결된 전체 시퀀스에서 임계값 알고리즘을 실행합니다. 각 개별 이미지의 통합 밀도를 측정합니다. 측정값을 루트 폴더에 Excel 시트로 저장합니다.
- 모든 조건에서 매크로 분석을 실행합니다.
- 측정값을 결합하고(일반적으로 n=2*20 이상) 이상값을 제거합니다(Graph pad Prism v8의 Q-test).
- 측정을 용매 제어 또는 1일차(실험 유형에 따라 다름, 전자는 약물 억제 실험, 후자는 성장 역학 실험)로 정규화합니다. 시간 경과에 따른 정규화된 암세포 부담(y 축) 또는 상태(x 축)로 측정을 표현하면 각각 그림 3 및 그림 4에 표시됩니다.
결과
당사는 새로운 세포주에서 분석까지 빠르고 쉽게 진행할 수 있는 접근 방식을 위한 단계별 지침을 제공했습니다. 렌티바이러스 과발현 카세트를 사용하는 형광 추적자의 과발현으로 시작합니다(3단계 및 4단계). 그 다음에는 주입하는 동안 가능한 최소한의 데드 볼륨을 보장하기 위해 세포 준비를 수행하여 높은 수의 세포를 doC 및 역안와 공간 모두에 주입할 수 있습니다(6단계 및 7단계). 그 후, 전신 암세포 파종의 정성적 분석을 위해 입체 형광 현미경과 고배율 컨포칼 현미경을 사용하여 준고처리량 데이터 수집을 수행합니다(그림 2 및 10, 11, 12단계). 데이터를 수집할 때 주의를 기울여야 하며, 스테레오 및 컨포칼 현미경 이미징 모두에 대한 재현성을 보장하기 위해 일반 설정 및 표준화가 설명됩니다(11단계 및 12단계). 데이터 분석(imageJ/Fiji 사용) 16과 imageJ 매크로를 사용한 표준화(13단계)에 대해 논의합니다.
3단계에서는 새로운 암 세포주의 종양 형성 가능성을 평가하기 위해 빠른 사전 스크리닝을 수행하기 위해 (암) 세포의 일시적인 라벨링에 대해 언급했습니다. 한 가지 중요한 주의 사항은 사용하기 쉽고 수명이 길지만, 본원에 기술된 일시적인 염색은 인공물을 형성할 가능성이 있다는 것입니다(즉, Fior와 동료들이 광범위하게 수행한 것처럼 세포 단편을 전체 세포와 구별할 수 있도록 주의를 기울여야 합니다 9). 우리의 경험에 따르면 이러한 인공물의 형성은 염색의 극도의 안정성 및 밝기(세포 사멸 후에도)와 직접적인 관련이 있으며, 여기서 세포 조각은 분산되어 면역 세포에 의해 흡수되며, 이는 나중에 활성 전이에서 파생된 것으로 잘못 결론을 내릴 수 있습니다.
설명된 두 모델 모두에서, doC를 통한 전신 생착과 후안와 공간에서의 국소적 생착, 주입 후 하루 만에 유충을 철저히 선별하는 것이 가장 중요합니다. 그림 2B 에서 볼 수 있듯이, 생착된 세포가 후안와 모델에서 머리 영역(후궤도 부위 너머)과 난황낭 내의 세포로 기계적으로 변위하거나 doC 주입 풀에서 부종을 보이는 모든 유충을 제거해야 합니다. 음으로 선택된 모든 표현형은 그림 2에서 고해상도 공초점 스티치로 표시되지만 입체 현미경 관찰을 통해 쉽게 볼 수 있고 제거할 수 있습니다.
시간이 지남에 따라 세포는 이동하고 증식합니다. 역궤도 모델의 경우, CRMM1의 경우 주변 조직으로의 침투가 관찰되었지만, CRMM2의 증식은 더 적었습니다. 일부 개인(20%)에서 2-4dpi 사이에서 발생하는 원격 전이가 관찰되었으며, 그림 4와 같이 6dpi에서 상당한 차이를 측정했습니다. 두 세포주 모두에 대해 두 부위에 주입했을 때의 증식 가능성을 테스트했습니다. CRMM1의 경우, 정규화된 종양 세포 부담으로 표시되었을 때 주사 부위에 대한 또는 주사 부위에서 암세포 수가 유의한(p<0.0001) 증가했으며, 각 모델에 대해 1일차로 정규화되었습니다(7.8배 증가, RO 모델의 경우 ±3.2배, 15배 증가±doC 모델의 경우 8,8). CRMM2는 각 개별 모델에 대해 첫날로 정규화했을 때 큰 성장을 보이지 않았습니다(2.4배 증가, ±1.9배 및 2.3배 증가, RO 및 doC의 경우 ±1.14배). CRMM1은 생착 후 후안와 조직과 꼬리 조혈 조직 모두에서 쉽게 증식하는 것으로 밝혀졌습니다. 세포주 CRMM2는 두 모델 모두에서 증식률이 낮았지만, 흥미롭게도 그림3B,C와 같이 후궤도 공간에 주입할 때 원격 전이가 가능한 것으로 밝혀졌습니다.
주입된 유충을 1dpi에서 스크리닝하고 개체를 치료 그룹 또는 대조군에 무작위로 할당한 후, 물고기를 6일 동안 처리하여 Vemurafenib이 포함된 물을 변경했습니다(이 억제제는 다른 적정 항종양 화합물로 쉽게 교체할 수 있음). 우리는 이전에 발표된 CRMM114를 삽입하는 혈액 결막 흑색종 보급 모델을 정교하게 다듬기 위해 정교화(orthotopically engraficad) CRMM1에 대한 베무라페닙(Vemurafenib)의 효능을 시험하기로 했다. CRMM1은 그림 4와 같이 Vemurafenib 치료제의 이소생착군(P<0.0001)이 크게 감소하였고, 정소성 생착 모델(p<0.05)에 대해서는 발육 부진이지만 유의한 반응을 보였습니다.
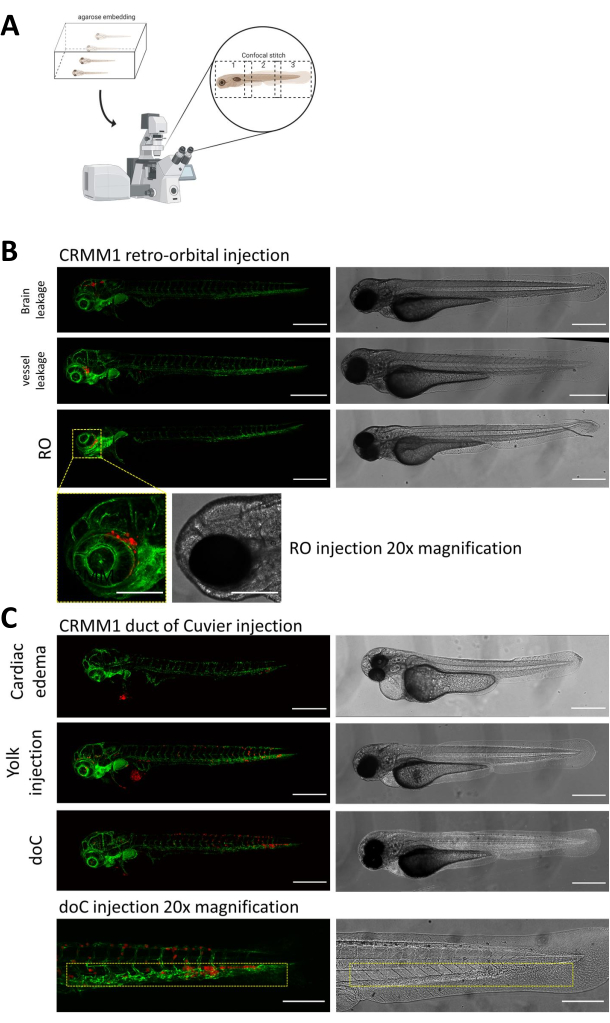
그림 2. 주사 후 표현형 평가 및 스크리닝. A) 제브라피시 이종 이식 컨포칼 스티치 생성의 개략적인 묘사로, 후속 컨포칼 프로젝션의 통합 후 매끄럽고 고해상도 이미지를 생성합니다. 여기서 제브라피시 이종이식편은 1% 저융점 아가로스에 삽입되어 유리 바닥 컨포칼 접시에 장착됩니다(11.3단계 설명 참조). B) 큐비에 생착의 후방안와관(retro-orbital and duct of Cuvier enphytment)의 모든 가능한 결과는 녹색 형광 혈관 리포터 제브라피시(TG:fli:GFP)에 주입되며, 세포는 tdtomato의 발현을 통해 렌티바이러스를 통해 염색된다. 1dpi(RO 패널)에서 올바른 생착과 원치 않는 표현형(뇌 누출 및 혈관 누출 모두)을 나타냅니다. 후자의 두 집단은 다운스트림 실험 결과를 혼동하지 않도록 제거해야 합니다. C) 큐비에관을 통한 혈액 생착에 대한 원치 않는 표현형(doC)은 하류 측정에 대한 간섭을 방지하기 위해 심장 부종 유충(심장 부종)과 난황낭으로 누출된 세포가 있는 유충(난황 주입)을 제거해야 하는 윤곽입니다. 올바르게 주입된 유충은 7.1단계에서 설명한 대로 실험 그룹에 들어갑니다. (컨포칼 현미경을 사용하여 1dpi에서 획득한 모든 이미지, 스케일 바 200μm. 노란색 상자는 각각 RO 및 doC 생착, 머리 부위 및 꼬리 조혈 조직에 대한 전이 부위를 나타냅니다.) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
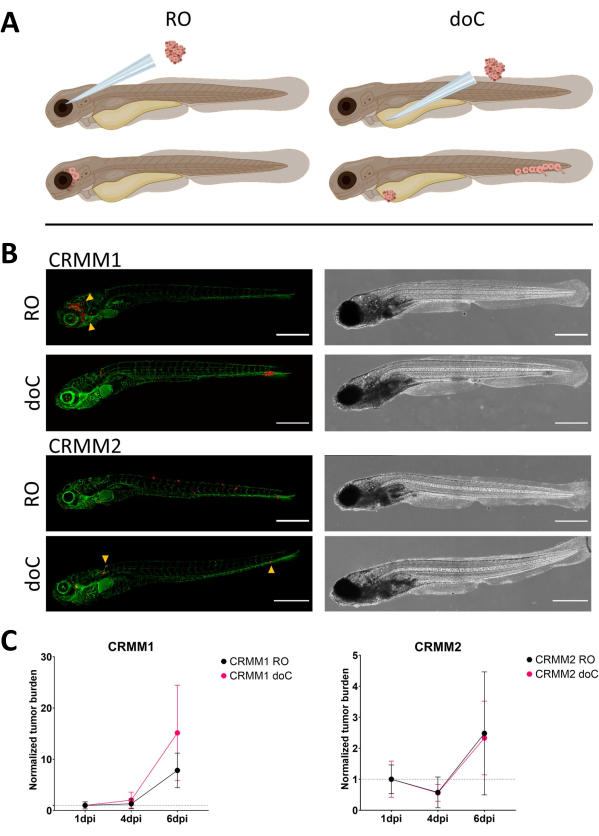
그림 3. 결막 흑색종 세포주 CRMM1과 CRMM2의 비교 분석은 전이성 및 성장 능력의 차이를 보여줍니다. A) 주입 모델의 개략적 표현, 역궤도 모델(RO) 및 혈기 생착 모델(doC)은 물고기가 사용한 TG(fli:GFP) 녹색 혈관 리포터이며, tdtomato를 과도하게 발현하는 세포는 빨간색으로 표시됩니다. B) CRMM1 및 CRMM2가 생착된 어류의 대표적인 표현형인 CRMM1은 RO 생착 부위를 둘러싼 조직(RO, 노란색 화살촉)에 효율적인 생착(RO 및 doC 모두)과 소규모 침입을 나타냅니다. CRMM2는 두 생착 모델 모두에서 현저히 낮은 생착 효율을 보이지만, 역궤도로 주입할 때 원격 전이를 보입니다(RO에서 화살표로 표시). (6dpi, 컨포칼 현미경, 스케일 바 200μm에서 획득한 모든 이미지. 노란색 화살표는 각각 RO 및 doC 생착, 머리 부위 및 꼬리 조혈 조직의 전이 부위를 나타냅니다.) C) CRMM1 및 CRMM2 모두에 대한 동생착 플롯, 두 생착 모델을 1일차(1일차로 정규화)와 비교한 결과, 세포주 CRMM1(1 dpi 및 6 dpi)에 대한 정규화된 종양 부담이 유의한(p<0.0001) 증가한 반면, CRMM2에 대해서는 (유의하지 않은) 상승 추세가 있습니다. CRMM1은 RO와 doC 성장 사이에 상당한 차이를 보여주며, 여기서 doC 모델은 더 높은 종양 확장률을 보여줍니다(doC 생착 유충의 경우 약 2배 더 높음). 그래프에는 평균과 평균의 표준 오차(SEM)가 표시됩니다. 모든 그룹은 각 개별 조건에 대해 1dpi로 정규화되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
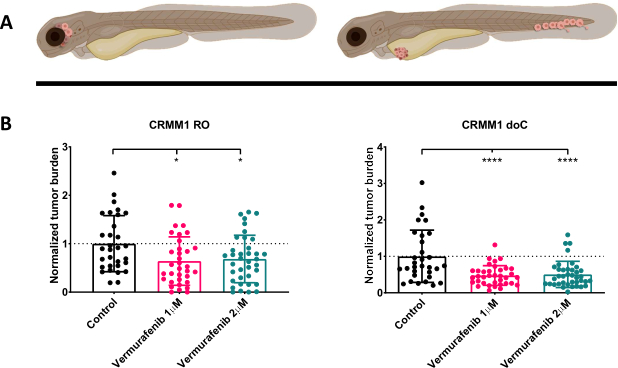
그림 4. BRAF V600E 억제제 Vemurafenib은 RO 및 doC 결막 흑색종에 의한 생착 제브라피시 유충을 모두 유의하게 억제합니다. A) 제브라피시 표현형, RO 및 doC 모델의 개략적 표현. B) 결막 흑색종 세포주 CRMM1을 주입한 RO 및 doC 생착 유충 모두 정규화된 종양 부담이 현저히 감소한 것으로 나타났습니다(각각 p<0.05 및 P<0.001). doC 생착 제브라피시 모델은 향상된 약물 반응 및 약물 억제에 대한 용량 독립적 관계를 나타내며, 이는 억제의 포화 가능성을 나타냅니다). 그래프는 평균의 평균과 표준 오차(SEM)를 보여주며, 모든 그룹은 각 개별 세포주에 대해 제어하기 위해 정규화되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 시약 | 음량 |
| PSPAX2 | 1.71 pmol (12.14μg) |
| pMD2.지 | 0.94 pmol (3.66μg) |
| 트랜스퍼 플라스미드* | 1.64 pmol (정확한 부피 계산) |
표 1.
토론
여기에서는 제브라피시 이종이식편에서 원발성 및 전이성 안구 흑색종을 모델링하기 위한 세심한 접근 방식을 정의했습니다. 국소적인 정소성 주사와 전신적인 이소성 주사 모델을 결합함으로써 이전에는 동물 모델을 사용할 수 없었던 암에 대한 발암의 원인을 요약했습니다. 초기 제브라피시 유충의 고유한 투명성으로 인해 전체 동물 수준에서 형광 표지된 암세포를 추적할 수 있으므로 잠재적인 전이 부위를 쉽게 시각화할 수 있습니다17. 또한 고배율 컨포칼 현미경 분석을 통해 세포 내 해상도10에서 세포를 추적할 수 있습니다.
당사는 새로운 세포주에서 이종이식편 확립 및 분석에 이르기까지 빠르고 쉽게 진행할 수 있는 접근 방식을 위한 단계별 지침을 제공했습니다. 렌티바이러스 과발현 카세트(3단계 및 4단계)를 사용하여 형광 추적자의 과발현으로 시작한 다음, 주입 중 사용량을 최소화하기 위해 세포를 준비합니다. 이를 통해 높은 세포 수를 doC 및 후방 궤도 공간 모두에 주입할 수 있습니다(7단계 및 8단계). 그런 다음 전신 암세포 파종의 정성적 분석을 위해 입체 형광 현미경과 고배율 컨포칼 현미경을 사용하여 반고처리량 데이터 수집을 수행합니다(그림 2 및 9단계 및 10단계). 데이터를 수집할 때 주의를 기울여야 하며, 스테레오 및 컨포칼 현미경 이미징 모두에 대한 재현성을 보장하기 위해 일반 설정 및 표준화가 설명됩니다(11단계 및 12단계). 데이터 분석은 ImageJ 매크로를 사용한 표준화와 함께 (imageJ/Fiji 사용) 16 (단계 13)에 대해 논의합니다.
3단계에서는 새로운 암 세포주의 종양 형성 가능성을 평가하기 위해 빠른 사전 스크리닝을 수행하기 위해 (암) 세포의 일시적인 라벨링에 대해 언급합니다. 한 가지 중요한 주의 사항은 사용하기 쉽고 수명이 길지만, 본원에 기술된 일시적인 염색은 인공물을 형성할 가능성이 있다는 것입니다(예를 들어, Fior와 동료들에 의해 광범위하게 수행된 바와 같이 세포 단편이 전체 세포와 구별될 수 있도록 주의를 기울여야 합니다 9). 우리의 경험에 따르면 이러한 인공물의 형성은 염색의 극도의 안정성 및 밝기(세포 사멸 후에도)와 직접적인 관련이 있으며, 여기서 세포 조각은 분산되어 면역 세포에 의해 흡수되며, 이는 나중에 활성 전이에서 파생된 것으로 잘못 결론을 내릴 수 있습니다.
이러한 모델을 사용하여 생착된 세포를 후안와 간극(retro-orbital interstice) 내에 물리적으로 가두어 원발성 종양 발달을 시뮬레이션했습니다. 생착 후 1일 후의 철저한 스크리닝을 통해 실험 후반부에 먼 곳에서 발견된 세포가 활발하게 전이되었는지 확인합니다(혈관 내 및 파종, 궁극적으로 전이성 틈새에서 유출). 배아 공통 추기경 정맥인 doC를 통한 생착은 세포에 대한 대량의 쉽고 재현성이 높은 이식을 가능하게 하여(적절하게 농축된 경우 600개 세포의 잉여로), 전이성 연쇄 반응(혈관 내)의 주요 단계를 효과적으로 우회하고 전이성 연쇄 반응의 후기 단계(접착, 유출 및 성장)에 집중할 수 있도록 합니다. 적절하게 사용하면 강력한 도구이지만, 실험의 후반 단계에서 거짓 긍정 결론이 도출되지 않도록 생착 후 첫날 동안 두 모델 모두를 광범위하게 모니터링해야 합니다.
이전 간행물과 일치하게, 우리는 결막 흑색종 라인이 제브라피시 혈액 순환계 전체에 퍼진 후 쉽게 전이성 집락을 형성한다는 것을 보여주었습니다14. 여기에서 우리는 orthotopic 모델로서의 retro-orbital injection을 통한 생착 레퍼토리의 확장과 세포주 CRMM2의 꼬리 조혈 조직으로의 후속 활성 전이를 보고합니다. 그 후, 제브라피시 유충을 모델링했을 때 BRAF V600E 특이적 억제제 Vemurafenib이 결막 흑색종의 원발성 형태에 대해서도 효능을 보고했습니다.
앞서 언급한 방법을 사용하여 숙련된 연구자는 제안된 모델 중 하나를 하루에 수백 마리(시간당 약 200마리) 이상의 생착된 유충을 생성할 수 있습니다. 2주간의 시간 동안 약물은 최대 허용 용량에 대해 적정되고 확립된 이종 이식 모델에서 스크리닝될 수 있습니다. 처음부터 끝까지 비형질도입 세포주를 사용하여 제브라피시 모델에서 약물 감수성 프로파일을 갖는 것은 한 달 이내에 달성할 수 있습니다(주입된 세포주가 제브라피시 모델 내에서 종양을 형성한다는 점을 감안할 때). 우리 손에서는 실험당 20마리의 유충과 두 번의 생물학적 반복으로 강력한 약물 억제를 재현 가능하게 산출했으며, 두 개의 개별 실험이 충돌할 때(또는 통계적으로 유의미한 성장 억제를 산출하지 않을 때) 세 번째 생물학적 반복을 수행할 수 있습니다.
이러한 모델은 약간의 조정을 통해 교모세포종(뒷뇌강 주사), 유방암(doC 주사) 및 골육종(doC)에 대한 이러한 이식 전략을 신속하게 적용할 수 있게 해주었습니다 18,19,20,21. 이러한 모델은 이후 단일 약물 및 조합 약물 전략에 대한 기초 연구와 전임상 스크리닝 모두에 활용될 수 있습니다. 최근에 우리는 이러한 모델을 사용하여 약물의 다양한 투여 체제와 사진 활성화에 대해 설명했습니다 13.
공개
없음.
감사의 말
이 작업은 보조금 계약 No 667787(UM Cure 2020 프로젝트, www.umcure2020.org)에 따라 유럽 연합의 Horizon 2020 연구 및 혁신 프로그램의 자금 지원을 받았습니다. Chinese Scholarship Council은 J.Y.에 대한 박사 학위 수여를 진심으로 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 2.5mm box filament | Science products | FB255B | for pulling micro injection needles using a Sutter P97 or P1000 |
| 3mL transfer pipettes | Merck | Z350796 | for transfer and selection of zebrafish embryos |
| Agarose | Milipore | 2120 | 1.5% (w/v) in eggwater, 1.5 g in 100 mL DPBS, microwave to dissolve, for injecting and stereofluorescence imaging of zebrafish larvae |
| Capillaries: borosilicate glass outer | World precision instruments | BF100-78-10 | Borosilicate glass capillaries used for needle preparation |
| DMSO | Sigma | D8418 | Often used as solvent in drug treatments, should be stored at 2-8°C the dark. |
| DPBS | Thermo Fischer Scientific | 14190144 | Dulbecco’s phosphate buffered saline, without Mg2+ and Ca2+ for washing the cells, lack of Ca2+ impairs cell-cell adhesion through cadherins and prevents cell aggregation during injection |
| Egg water | Instant ocean | SS15-10 | 0.6 mg/L final concentration sea salt in demineralized water |
| GFP encoding lentiviral transfer plasmid | Addgene | Plasmid #106172 | Generated in Snaar lab, available at Addgene |
| Hek293T | ATCC | CRL-3216 | Stable cell line for generating lentiviral particles, contains SV40-T antigen required for the generation of lentiviral particles |
| Leica sp8 confocal | Leica | Leica TCS SP8 | automated stage confocal microscope with 405/488/514/635nm lasers |
| LipodD293 | Signagen | SL100668 | Highly efficient HEK293t optimized transfection reagent |
| Low-melting agarose | Milipore | 2070 | 1% (w/v) in eggwater 1.5 g in 100 mL DPBS, microwave to dissolve, for embedding zebrafish larvae for confocal imaging |
| Micro loader tips | Fischer scientific | 10289651 | flexible microloader tips |
| Micro manipulator | World precision instruments | M3301R | x/y/z manual micro manipulator for microinjection |
| Needle puller: P-97 or P-1000 | Sutter | P-97 | needle puller used for generating standardized micro engraftment needles |
| Nr.5 watchmakers forceps | VWR | HAMMHSC818-11 | fine watchmakers forceps used for breaking back needles |
| Picopump | World precision instruments | SYS-PV820 | pulse controller supplying pressure for microinjection |
| pMD2.G | Addgene | plasmid #12259 | Gifted by Didier Trono, 2nd generation lentiviral virulence plasmid |
| psPAX2 | Addgene | plasmid #12260 | Gifted by Didier Trono, 2nd generation lentiviral packaging plasmid |
| PVP40 | Sigma-Aldrich | PVP40 | Polyvinylpyrrolidone average mol wt 40,000) PVP40 2% (w/v) in DPBS, 1 g PVP40 in 50 mL DPBS. Vortex and incubate at 37°C to facilitate dissolving. Store at room temperature. |
| tdTomato encoding lentiviral transfer plasmid | Addgene | Plasmid #106173 | Generated in Snaar lab, available at Addgene |
| transmitted light stereo microscope | Leica | leica M50 with (MDG33 base) | leica transmitted light microscope with mirror adjustable illumination. |
| Tricaine | Sigma-Aldrich | E10521 | Ethyl 3-aminobenzoate methanesulfonate or MS-222 |
| TryplE | Thermo Fischer Scientific | 12604-01 | Synthetic trypsine replacement, less damaging to the cells and allows for the gentle dispersion of strongly adherent cells. (Thermo- |
| willco dish | WillCo wells | GWST-5040 | 50mm glass bottom dishes, allow for the embedding of up to 20 zebrafish larvae, enabling the imaging of multiple conditions in one dish due to its large optical glass surfac |
참고문헌
- Yang, J., Manson, D. K., Marr, B. P., Carvajal, R. D. Treatment of uveal melanoma: where are we now. Therapeutic Advances in Medical Oncology. 10, (2018).
- Wong, J. R., Nanji, A. A., Galor, A., Karp, C. L. Management of conjunctival malignant melanoma: A review and update. Expert Review of Ophthalmology. 9, 185-204 (2014).
- Nguyen, D. X., Bos, P. D., Massagué, J. Metastasis: from dissemination to organ-specific colonization. Nature Reviews Cancer. 9, 274-284 (2009).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2, 183-189 (2008).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nature Reviews Drug Discovery. 4, 35-44 (2005).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Palmblad, M., et al. Parallel deep transcriptome and proteome analysis of zebrafish larvae. BMC Research Notes. 6, 428 (2013).
- Yan, C., et al. Visualizing Engrafted Human Cancer and Therapy Responses in Immunodeficient Zebrafish. Cell. 177, 1903-1914 (2019).
- Fior, R., et al. Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts. Proceedings of the National Academy of Sciences of the United States of America. 114, 8234-8243 (2017).
- Campbell, P. D., Chao, J. A., Singer, R. H., Marlow, F. L. Dynamic visualization of transcription and RNA subcellular localization in zebrafish. Development. 142, 1368-1374 (2015).
- Campeau, E., et al. A Versatile Viral System for Expression and Depletion of Proteins in Mammalian Cells. PLoS One. 4, 6529 (2009).
- vander Helm, D., et al. Mesenchymal stromal cells prevent progression of liver fibrosis in a novel zebrafish embryo model. Scientific Reports. 8, 16005 (2018).
- Chen, Q., et al. TLD1433 photosensitizer inhibits conjunctival melanoma cells in zebrafish ectopic and orthotopic tumour models. Cancers. 12, (2020).
- Pontes, K. C. d. e. S., et al. Evaluation of ( fli:GFP ) Casper Zebrafish Embryos as a Model for Human Conjunctival Melanoma. Investigative Opthalmology & Visual Science. 58, 6065 (2017).
- Liverani, C., et al. Innovative approaches to establish and characterize primary cultures: an ex vivo 3D system and the zebrafish model. Biology Open. 6, 133-140 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2, 183-189 (2008).
- Mercatali, L., et al. Development of a patient-derived xenograft (PDX) of breast cancer bone metastasis in a Zebrafish model. International Journal of Molecular Sciences. 17, (2016).
- Tulotta, C., et al. Imaging cancer angiogenesis and metastasis in a zebrafish embryo model. Advances in Experimental Medicine and Biology. 916, 239-263 (2016).
- Paauwe, M., et al. Endoglin expression on cancer-associated fibroblasts regulates invasion and stimulates colorectal cancer metastasis. Clinical Cancer Research. 24, 6331-6344 (2018).
- Cao, J., et al. Overexpression of EZH2 in conjunctival melanoma offers a new therapeutic target. Journal of Pathology. 245, (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유