Method Article
Орто- и эктопическое ксеноприживление меланомы глаза рыбками данио-рерио для повторения развития первичной опухоли и экспериментального метастазирования
В этой статье
Резюме
В данной работе мы представляем протокол создания универсальных моделей ортотопических и эктопических ксенотрансплантатов данио-рерио для меланомы глаза для оценки кинетики роста первичной опухоли, диссеминации, экстравазации и формирования отдаленных, периваскулярных метастазов и влияния на них химического ингибирования.
Аннотация
В настоящее время нет животных моделей метастатической меланомы глаза. Отсутствие моделей метастатического заболевания сильно затруднило исследования и разработку новых стратегий лечения метастатической меланомы глаза. В этом протоколе мы описываем быстрый и эффективный способ создания эмбриональных моделей рыбок данио для первичной и диссеминированной стадии меланомы глаза с использованием ретроорбитального ортотопического и внутрисосудистого приживления эктопических клеток соответственно. Комбинируя эти две различные стратегии приживления, мы можем резюмировать этиологию рака во всей его полноте, прогрессирующую от первичного, локализованного опухолевого роста под глазом до образования периваскулярных метастазов в хвосте. Эти модели позволяют нам быстро и легко модифицировать раковые клетки перед имплантацией с помощью специфической маркировки, генетического или химического вмешательства; и лечить привитых хозяев (небольшими молекулярными) ингибиторами для замедления развития опухоли.
В данной статье мы описываем генерацию и количественную оценку как ортотопического, так и эктопического приживления меланомы глаза (меланомы конъюнктивы и увеальной меланомы) с использованием флуоресцентно меченных стабильных клеточных линий. Этот протокол также применим для приживления первичных клеток, полученных в результате биопсии пациента и материала, полученного из PDX пациента (рукопись в стадии подготовки). В течение нескольких часов после приживления можно визуализировать и количественно оценить миграцию и пролиферацию клеток. Оба опухолевых очага легко доступны для визуализации с помощью эпифлуоресцентной микроскопии и конфокальной микроскопии. Используя эти модели, мы можем подтвердить или опровергнуть активность как химических, так и генетических стратегий ингибирования в течение всего 8 дней после начала эксперимента, что позволяет не только высокоэффективно проводить скрининг стабильных клеточных линий, но и проводить скрининг, направленный на пациента, для подходов точной медицины.
Введение
Метастатическая диссеминации считается основной причиной смерти от меланомы глаза; В настоящее время не существует жизнеспособного режима лечения диссеминированной меланомы глаза 1,2. Кроме того, не существует животных моделей меланомы глаза, которая отражает метастатическое заболевание. Чтобы восполнить этот пробел, мы создали две отдельные модели рыбок данио, которые повторяют либо первичное образование опухоли, либо ранние стадии метастатической диссеминации, что позволяет легко изучать эти обычно сложные для изучения процессы. Модели микрометастазирования позволяют анализировать последние фазы метастатического распространения, включая хоуминг, колонизацию и экстравазацию. Генетические или химические вмешательства на этой стадии и в последующий период потенциально могут обеспечить мощную поддержку в лечении метастатической меланомы глаза.
Использование личинок данио-рерио в качестве реципиента ксено- и аллотрансплантатов подкрепляется внутренними достоинствами этого вида, такими как его оптическая прозрачность на ранних стадиях развития (или весь жизненный цикл для каспер-мутантов 4), высокая плодовитость и внутриутробное оплодотворение5. Высокая транскрипционная гомология у позвоночных обеспечивает сохранение основных механизмов передачи сигналов между рыбками данио и человеком и, следовательно, высокую потенциальную переносимость результатов 6, хотя генетические подходы иногда искажаются или усложняются из-за дупликации костистого генома 7. Недавние разработки подчеркнули важность моделей ксенотрансплантатов рыбок данио в качестве доклинических «аватаров» болезни человека, эффективно создавая множество персонализированных моделей терапии рака для доклинической оценки стратегий лечения на основе одного эксперимента с рыбками данио.
Учитывая нехватку животных моделей и согласующуюся с этим нехватку вариантов лечения метастатической меланомы глаза, наши модели обеспечивают быструю и простую трансляционную платформу для скрининга как генетических изменений (врожденных раковых клеток), так и для разработки стратегий химического вмешательства в доклинических условиях. В рамках одной и той же модели мы можем визуализировать и измерить кинетику роста раковых клеток, скорость приживления/метастатический потенциал и самонаведение клеток на уровне всего животного с использованием низкого уровня увеличения в стереофлуоресцентном микроскопе, а также провести аналогичные измерения с помощью конфокального микроскопического анализа среднего или высокого увеличения для анализа различных этапов прогрессирования меланомы глаза с субклеточным разрешением 10.
Здесь мы описываем всеобъемлющие и подробные протоколы для: генерации флуоресцентно меченых раковых клеток с использованием высокооптимизированной лентивирусной трансдукции11; последующие внутривенные и ретроорбитальные (RO) приживления этих клеток личинкам данио-рерио через 2 дня после оплодотворения (DPF) для получения эктопических и ортотопических моделей соответственно; с последующим сбором и анализом данных. Эти способы, хотя и являются всеобъемлющими для описанных здесь применений, могут быть модифицированы для приживления клеток в задней полости мозга, печени и перивителлиновом пространстве, когда это необходимо (исключительно путем изменения места инъекции или времени инъекции)12,13.
В качестве доказательства концепции мы подробно остановились на выводах Pontes et al. 2018, где мы показали специфический ответ на дозу и внутреннюю мутацию клеток клеточных линий меланомы конъюнктивы в модели 14 рыбок данио. Мы развили эти результаты, показав эффективность мутационно-специфического ингибитора BRAF V600E вемурафениба как в метастатической, так и в первичной модели меланомы конъюнктивы.
протокол
Все эксперименты на животных были одобрены Комитетом по экспериментам на животных (Dier Experimenten Commissie, D.E.C.) по лицензии AVD1060020172410. Все животные содержались в соответствии с местными рекомендациями с использованием стандартных протоколов (www.ZFIN.org).
1. Подготовка
- Реагентов
- Подготовьте яичную воду: 0,6 мг/л конечной концентрации морской соли.
- Приготовьте 5 мг/мл трикаина 25 раз: смешайте 5 г порошка трикаина (этил3-аминобензоата метансульфоната или MS-222), 900 мл деминерализованной воды и 21 мл 1 М Триса (pH 9). Отрегулируйте pH 7 и заполните до 1 л. Трикейн можно хранить при температуре 4 °C в течение короткого периода времени (до шести месяцев) или можно хранить при комнатной температуре в течение месяца при комнатной температуре, защищенном от солнечных лучей.
- Приготовьте 1,5% (мас./об.) агарозы в яичной воде: 1,5 г на 100 мл DPBS. Разогрейте в микроволновой печи до полного растворения.
- Приготовьте 1% (масс./об.) легкоплавкую агарозу в яичной воде: 1,5 г на 100 мл DPBS. Разогрейте в микроволновой печи до полного растворения.
- Приготовьте 2% (по массе) PVP40 в DPBS: 1 г PVP40 на 50 мл DPBS. Сделайте вортекс и инкубируйте при 37 °C для облегчения растворения. Хранить при комнатной температуре.
- Используйте DMSO. Он часто используется в качестве растворителя при медикаментозном лечении и должен храниться при температуре 2-8 °C в темноте.
- Используйте TrypLE, синтетический заменитель трипсина, который менее повреждает клетки и обеспечивает мягкое диспергирование сильно адгезивных клеток.
- Приготовьте фосфатно-солевой буфер Дульбекко (DPBS) без Mg2+ и Ca2+ для промывания клеток. Недостаток Ca2+ ухудшает межклеточную адгезию через кадгерины.
- Подготовьте лентивирусные плазмиды: psPAX2 (плазмида #12260) и pMD2.G (плазмида #12259), подаренная Дидье Троно, и либо GFP (Plasmid #106172), либо tdTomato (Plasmid #106173), кодирующая транспортную плазмиду (Addgene).
- Используйте LipodD293: высокоэффективный HEK293T оптимизированный реагент для трансфекции.
- Блюдо из агарозы
ПРИМЕЧАНИЕ: При использовании посуды, которая хранилась в течение длительного времени, обязательно добавьте в посуду небольшой объем яичной воды перед началом впрыска (это предотвратит слишком быстрое высыхание рыбы).- Приготовьте посуду в агарозовой глазури 1,5% (по объему) (агарозу растворить в яичной воде).
- Используйте немедленно или храните при температуре 4 °C в перевернутом положении.
2. Иглы
ПРИМЕЧАНИЕ: Убедитесь, что капилляры были откалиброваны на используемой нити. При переключении нити или капилляра определите величину нарастания капилляров на используемой нити (см. инструкцию по съемнику иглы).
- Из одного стеклянного капилляра можно получить две микроинъекционные иглы. Перед изготовлением игл проверьте структурную целостность нити (коробчатой нити 2,5 мм) съемника игл.
- Убедитесь, что филамент и капилляр откалиброваны для получения соответствующего значения линейного изменения. Когда структурная целостность нитей нарушена (т.е. неровная, дырявая, расплавленная и т.д.), замените нить.
- Используйте следующую программу (Игла #99, Heat=ramp+15, pull=95, velocity=60, time=90). Храните иглы в специальной чашке Петри (содержащей глину или ленту для приклеивания игл)
3. Генерация лентивирусных частиц
ПРИМЕЧАНИЕ: Чтобы предотвратить напрасную трату времени и ресурсов, перед лентивирусной трансдукцией может быть проведена быстрая проверка онкогенности. Это делается для того, чтобы гарантировать, что используемая клеточная линия является достаточно опухолевой в модели рыбок данио, для этого клетки могут быть окрашены с помощью CMdiI (или аналогичного индикатора), как описано в Liverani et al. 2017 15.
- Пластина HEK 293t клеток за день до трансфекции для достижения конфлюенции примерно 70% (обычно это делается путем разделения полной колбы на колбу с тем же объемом в культуральной колбе при разведении 1:3 за день до этого).
- В день трансфекции необходимо совместно трансфектировать необходимые упаковочные плазмиды psPAX2 и вирусную оболочку pMD2.G, экспрессирующие плазмиду, а также либо GFP (Plasmid #106172), либо tdTomato (Plasmid #106173), кодирующую транспортную плазмиду. Точное количество используемой плазмиды указано в таблице 1.
ПРИМЕЧАНИЕ: Оба psPAX2 и pMD2.G были подарены Дидье Троно (плазмиды Addgene #12260 и #12259 соответственно).
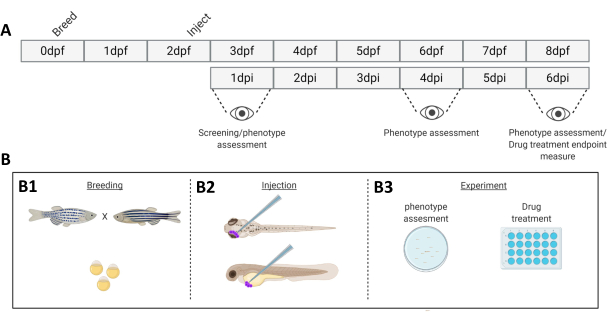
Рисунок 1. Схематическое изображение описанной системы приживления рыбок данио.А) График подхода, с разведением данио-рерио в день 0 (В1). Рыба вылавливается утром после скрещивания рыбы (день 1). Через 48-54 часа рыбы в основном вылупляются (сбрасывая хорион), и рыбы получают инъекции (ретроорбитально или системно, В2) после очистки воды от мусора хориона (день 2). Впоследствии личинки проверяют с помощью стереофлуоресцентного микроскопа, и все личинки, проявляющие нежелательные фенотипы, отбрасывают (день 3). В зависимости от цели эксперимента либо личинки визуализируются во времени (B3, кинетика приживления, визуализируется через 1-, 4- и 6-е сутки после инъекции (dpi)), либо рыб рандомизируют и распределяют по экспериментальным группам, обрабатывают препаратами и сравнивают с контролем носителя (скрининг лекарств, визуализированный при 6 dpi). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Смешайте все плазмиды в 500 μл бессывороточной среды, чтобы обеспечить полное смешивание всех плазмид. Добавьте 32 мкл реагента LipoD293 к 500 мкл бессывороточного DMEM и полностью перемешайте. Тщательно перемешайте оба объема вместе. Дайте плазмидам и lipoD293 вмешаться в течение 20 минут.
- Добавьте по каплям в колбу для клеточных культур диаметром 75 см2 , содержащую 70% сливающихся HEK293T клеток, содержащих 9 мл полной питательной среды. Добавьте трансфекционную смесь непосредственно в клеточный слой с помощью серологической пипетки (колбы в горизонтальной ориентации).
- Замените среду 20 мл свежей полной DMEM через 16 часов после трансфекции. Надосадочную жидкость собирают через 72 часа после трансфекции. Аликвот вирусного надосадочной жидкости в 1 мл аликвот и хранить при температуре -80 °С. Лентивирусный надосадочный слой стабилен при -80 °C в течение не менее 1 года.
4. Лентивирусная трансдукция
- Перед лентивирусной трансдукцией установите кривую уничтожения при использовании выбираемой лентивирусной конструкции.
- Для создания кривой уничтожения нанесите пластину на клеточную линию, которая должна быть трансдуцирована в 12-луночный планшет (слияние примерно 10-20%). Добавьте кривую дозы селектанта (примерные концентрации для кривых убийства: пуромицин 0,5-10 мкг/мл, бластицидин 1-20 мкг/мл, генетин (G418) 100-2000 мкг/мл, гигромицин 100-2000 мкг/мл).
- Меняйте среду каждые три дня, чтобы обеспечить стабильную концентрацию выбранного селектанта.
- Добавьте 1 мл лентивирусной надосадочной жидкости к 9 мл питательной среды, содержащей конечную концентрацию полибрена 8 мкг/мл на 20-40% конфлюентных клеток. Объемы могут быть уменьшены, сохраняя при этом это соотношение надосадочная жидкость/среда.
- Через 16-24 часа после трансдукции замените среду. При необходимости повторите предыдущий шаг для усиления пенетрантности фенотипа (проверьте флуоресценцию, чтобы решить, требуется ли еще одна трансдукция).
- Через 48 часов после трансдукции выберите клетки с помощью антибиотика, соответствующего маркеру резистентности, встроенному в лентивирусную кассету. Концентрация, используемая для отбора популяции трансдуцированных клеток, должна убивать популяцию дикого типа в течение 7 дней после применения селектанта (т.е. позволяя трансдуцированным клеткам перерасти популяцию дикого типа).
- Применяйте вирусную надосадочную жидкость при различных множественных инфекциях (MOI), чтобы гарантировать, что трансдукция и генетические повреждения, вызванные клеточным геномом, не оказывают негативного влияния на жизнеспособность клеток или онкогенность.
5. Разведение рыбок данио рерио
- На 0-й день, за 2 дня до приживления раковых клеток, спаривайте взрослых рыбок данио в стиле «семейного скрещивания» при комнатной температуре (Рисунок 1).
- Выньте аквариум с рыбками данио из системы содержания (поддерживается при температуре 28,5 °C).
- Разделите рыб на небольшие гнездовые кластеры в соотношении 1:1 самец: самка, по 10 рыб в группе. Поместите рыб в небольшие аквариумы для разведения, в воду, набранную из системы содержания, над наклонной решеткой (наклонной, чтобы имитировать мелководье, где данио-рерио естественным образом нерестятся).
ПРИМЕЧАНИЕ: Вызванное снижением температуры с 28,5°C до комнатной температуры (25°C) и вступлением в следующую световую фазу темного/светового цикла, рыба будет нереститься. - Впоследствии удалите взрослых особей и пересадите в их резервуар для жилья.
- Соберите яйца и промойте яичной водой с помощью ситечка. Разделите яйца примерно до 75-100 на блюдо и поддерживайте при температуре 28,5°C.
- Примерно через 6 часов после сбора очистите посуду от мертвых или уродливых эмбрионов.
- На следующее утро поменяйте яйца водой и снова очистите посуду от мертвых зародышей.
6. Сборные клетки
ПРИМЕЧАНИЕ: Правильная подготовка клеток является ключом к процедуре имплантации, использование избыточного количества клеток позволяет облегчить последующую обработку. Третий этап центрифугирования имеет решающее значение, так как при этом у вас останется только клеточная гранула, оставшаяся PBS, застрявшая по бокам центрифужной трубки, значительно превышает окончательный объем ресуспензии.
- Перед применением все среды и растворы, используемые в клеточных культурах, подогрейте на водяной бане при температуре 37 °C.
- Добавьте 2 мл TryplE на колбу для культур 75 см2 или 1 мл на колбу2 25 см и инкубируйте до округления всех клеток. Для большинства клеточных линий должно быть достаточно 2-5 минут. Для высокоэпителиальных клеток или фибробластических клеток 5-10 минут должны обеспечить надлежащую отслойку (недостаточная трипсинизация будет препятствовать нисходящим процессам и будет способствовать агрегации клеток во время имплантации).
- Аккуратно постучите по стенке колбы, чтобы выбить оставшиеся ячейки.
- Сложите с исходным объемом культуры готовую среду. Осторожно, но тщательно проводите пипеткой вверх и вниз с помощью серологической пипетки, чтобы срезать клеточные комки в одноклеточную суспензию. Не образуйте пену во время этого процесса, так как пена указывает на механический сдвиг ячеек.
- Переложите в стерильную пробирку объемом 15 мл и центрифугируйте в течение 5 минут при плотности 200 x g при комнатной температуре. Аспират надосадочной жидкости и добавьте 1 мл стерильного PBS. Осторожно и тщательно суспендируйте клетки с помощью стерильной пипетки объемом 1000 μл.
- Удалите суспензию клеток объемом 20 мкл для подсчета и перенесите оставшуюся суспензию клеток в центрифугу. Центрифугируйте в течение 4 минут при температуре 200 x g при комнатной температуре.
- КРИТИЧЕСКИЙ ШАГ: Удалите все PBS, центрифугируйте в течение 30 с при 200 x g при комнатной температуре и удалите оставшийся PBS.
- Разбавляют клетки до 250 клеток/нл в 2% поливинилпирролидоне 40 (PVP40, 2% (w/v) в DPBS) следующим образом:
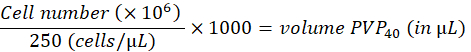
(например,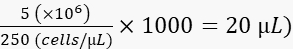
- Тщательно суспендировать клетки, не допуская при этом образования пузырьков воздуха (клетки можно выдерживать не менее 2 часов при 2% PVP40 без потери опухолевого потенциала).
7. Моделирование ксенотрансплантата
Все эксперименты должны проводиться в соответствии с местными правилами благополучия животных.
В зависимости от применения, два основных варианта экспериментального плана классифицируются как оценка фенотипа (7.1 стадия предварительного скрининга) и, во-вторых, 7.2: скрининг, при котором клетки либо были модифицированы до приживления, либо 7.3, когда эмбрионы обрабатываются химическим ингибитором.
- Предварительный скрининг и определение онкогенного потенциала
- Приживите личинок данио-рерио, представляющих интерес (WT, трансгенную или репортерную линию) с разной концентрацией 2 dpf с различным числом флуоресцентных клеток (т.е. 200, 400, 600 ±100).
- Через 16-24 часа после инъекции проведите скрининг личинок, чтобы удалить выбросы (чрезвычайно высокое или низкое количество клеток в циркуляции для эктопической модели или клетки внутри головы для ортотопической модели) и удалить неправильно прижившихся рыб. Укажите количество личинок на экспериментальную группу для группового анализа по сравнению с кинетическим анализом тех же личинок.
- Наблюдайте за личинками рыбок данио через равные промежутки времени (через 1,2,4,6 дней после инъекции (dpi)) и сделайте снимок 20 особей (как описано в шагах 9 и 10) из пула из ±50 личинок.
- Отслеживайте общий фенотип и прогрессирование заболевания и последующее количественное определение с помощью ImageJ (измерение интегральной плотности сигнала флуорофора в раковых клетках).
- Построение графика данных для визуализации кинетики роста раковых клеток у рыбок данио (рис. 3).
- Модифицировать клетки априори (выбить или выбить из организма интересующий ген) и приживить к рыбкам данио.
- Приживите рыбу и удалите все нежелательные фенотипы (по условию).
- Сфотографируйте особей с разрешением 1 dpi (20 личинок в группе). Отдельные особи могут быть визуализированы с заданными интервалами (1,2,4 и 6 dpi).
- При 6 dpi после визуализации усыпьте рыбу путем передозировки трикаином (в 10 раз больше дозы 0,4 мг/мл) и выбросьте на абсорбирующую бумагу, выстилающую воронку.
- Лечите рыб препаратами после приживления.
- Перед применением препарата на привитых рыбках данио-рерио, определить максимально переносимую дозу (MTD) на рыбках данио (титровать от 10 мкМ до 0,150 нМ, используя наибольший объем растворителя в качестве отрицательного контроля) мы установили MTD в качестве концентрации, при которой >80% особей выживают после всего лечения.
- Через день после инъекции удалите нежелательные фенотипы.
- Случайным образом разделите рыб на группы (36-48 особей в кондиции) и выдержите в 24 лунках тарелку с 6 личинками на лунку в 1 мл икройной воды.
- Применяют препараты через 24 часа после приживления. В качестве контроля используют такое же количество растворителя (ДМСО, EtOH и др.) в наибольшем объеме, применяемом для опытной группы.
- Начинайте лечение препаратом с максимально переносимой дозы. Меняйте яйцо на водусодержащее препарат через день. Удаляйте яичную воду и мертвых личинок как можно полнее во время каждой смены.
8. Инъекция
ПРИМЕЧАНИЕ: Используйте пневматический импульсный контроллер, подключенный к линии сжатого воздуха, обеспечивающий избыточное давление 100 фунтов на квадратный дюйм. Это обеспечивает достаточное давление как для впрыска (≈20 фунтов на квадратный дюйм), так и для выталкивания возможных агрегатов ячеек (≈100 фунтов на квадратный дюйм). Пусковое давление и время должны составлять примерно 200 мс при давлении 20 фунтов на квадратный дюйм. Если в начале инъекции необходимо уменьшить количество суспензии более чем на 50%, либо суспензия клеток слишком текучая (слишком низкая концентрация клеток или PVP40 ), либо отверстие иглы слишком велико.
- Осторожно извлеките капиллярную иглу из емкости. Сломайте иглу, чтобы образовалось отверстие ø20 μм, с помощью тонких часовых щипцов.
- Осторожно и тщательно ресуспендируйте клетки с помощью наконечника для пипетки объемом 20 мкл. Суспензию клеток пипетки в открытую стеклянную капиллярную иглу с помощью длинного (микрозагрузчика) наконечника. Загрузите иглу в микроманипулятор.
- Поместите ~20-40 личинок, обезболенных 0,04 мг/мл трикаина, на агарозную чашку с помощью переводной пипетки. Удалите лишнюю влагу для обездвиживания личинок с помощью передаточной пипетки. Личинки в основном ориентируются в боковом направлении из-за наличия все еще относительно большого желточного мешка.
- Введите личинкам примерно 200, 400 и 600 клеток через проток Кювье (doC) для эктопической модели.
- Аналогичным образом вводят личинки ретроорбитально (RO). Чтобы получить ортотопическую модель (ввод 100 ±50 элементов), измените длину пневматического импульса на пиконасосе (начните с ~20 фунтов на квадратный дюйм, 200 мс и отрегулируйте соответствующим образом). Во время инъекции следите за тем, чтобы личинки не пересыхали. Убедитесь, что введены все (или большинство) личинок.
- Промойте инъекционных личинок свежей яичной водой и переложите в промаркированную чистую чашку Петри (до 150 особей в одной чашке). Повторяйте этот процесс до тех пор, пока не будет введено достаточное количество личинок.
- После приживления поддерживайте рыб при температуре 34 °C в увлажненном инкубаторе, где 34 °C является самой высокой температурой, легко переносимой рыбками данио, и позволяет эффективно приживлять раковые клетки млекопитающих.
ПРИМЕЧАНИЕ: В целом, при введении одиночных клеточных линий как в doC, так и в RO мы наблюдаем приблизительную гибель от механических повреждений в <5% (механическое повреждение убивает личинки в период от 1 до 16 часов после инъекции).
9. Скрининг
- С помощью стереофлуоресцентного микроскопа провести скрининг рыб на соответствующий фенотип через 1 час после имплантации при сравнении клеток, модифицированных априори (или через 1 день после имплантации, при скрининге препаратов, перед случайным распределением по группам лечения).
- Личинки, имплантированные через ДК, должны иметь клетки в хвосте в период от 1 до 16 часов после имплантации. Удалите всех остальных рыб, включая рыб с отклонениями от нормы, из инъекционного бассейна.
ПРИМЕЧАНИЕ: Личинки, имплантированные ретроорбитально, должны иметь клетки только в интерстиции за глазом, личинки, у которых клетки распределены по всей голове или телу, удаляются из бассейна. - Очистите положительно отсеянных личинок и случайным образом распределите по экспериментальным группам.
- После приживления поддерживайте рыб при температуре 34 °C в увлажненном инкубаторе и ежедневно контролируйте. Гематогенная диссеминации клеток, имплантированных через ДК, происходит практически мгновенно, в то время как метастатическое распространение клеток, имплантированных в полость РО, распространяется через 2-4 дня.
10. Эпифлюоресцентная визуализация личинок рыбок данио-рерио
- Обезболите личинок рыбок данио рерио 0,2 мг/мл трикаина, добавив трикаин в воду рыбы или переместив субпопуляцию рыб из питательной миски в чашку, содержащую 0,2 мг/мл трикаина.
- Держите рыбок данио в миске с трикаином до тех пор, пока они не останутся неподвижными, пока стимуляция боковой линии не вызовет полетное поведение.
- Переложите рыбу в чашку Петри, покрытую агарозой, примерно по 10 штук на блюдо. Удалите большую часть воды, осторожно приподняв один конец чашки (позволяя воде осторожно скапливаться в нижнем конце чашки Петри). Если все делать аккуратно, то вся рыба будет выровнена хвостами вниз.
- Изобразите всю рыбу от верха блюда до дна. Затем смойте рыбу яичной водой в блюдо без трикаина.
- Повторяйте до тех пор, пока не будет изображено достаточное количество особей.
- Затем перенесите личинок либо обратно до 34 °C, либо отбракуйте (при 6 dpi) путем передозировки трикаином (т.е. 0,5 мг/мл, инкубируя в течение 10 минут, прежде чем выбросить на абсорбирующую бумагу, выстилающую воронку).
11. Конфокальная визуализация (прижившихся) личинок данио рерио
- Обезболите рыбок данио 0,2 мг/мл трикаина, как описано ранее.
- Поместите конфокальную чашку со стеклянным дном под стереомикроскоп и сфокусируйтесь на дне чашки. Перенесите 5-10 личинок в конфокальную тарелку со стеклянным дном. Удалите как можно больше воды.
- Накройте личинок температурой 42 °С, 1% низкоплавящейся агарозой, растворенной в яичной воде. Перед использованием убедитесь, что агароза остыла не менее чем до 42 °C; Более высокие температуры могут нанести вред или убить личинок.
- С помощью стереомикроскопа быстро, но аккуратно сориентируйте личинок, продавливая его вниз, с помощью обрезанного наконечника микрозагрузчика. Если требуется вентральная ориентация, удерживайте личинки на месте с помощью щипцов часовщика (не касаясь эмбриона).
- В то время как агарозные наборы вносят тонкие коррективы в ориентацию личинок. Дайте личинкам полностью схватиться перед переносом в конфокальный микроскоп.
12. Настройка конфокального микроскопа
- Включите зеленую (488 нм) и красную (564 нм) лазерные линии возбуждения. Поместите конфокальную чашку в держатель конфокального микроскопа. Используя эпифлуоресценцию, переместите световой пучок так, чтобы он слился с первой рыбой (установив x и y). Через окуляр установите фокус так, чтобы он совпадал с центром личинки (установка z).
- Установите усиление 700 на обоих флуоресцентных каналах, 1-5% мощности лазера. Увеличьте мощность лазера и уменьшите смещение до приблизительного полного динамического диапазона. Не перенасыщайте сигнал, а усиливайте его, чтобы показать всего несколько насыщенных пикселей.
- При захвате стежка установите начало и конец личинок по одной оси ( x или y), если установить вдоль одной оси, весь эмбрион может быть изображен в сегментах 1 x 4 и может быть обработан в одно изображение с помощью ImageJ.
- После визуализации извлеките личинки из агарозы, аккуратно разорвав ее вокруг внедренных личинок с помощью часовых щипцов. В противном случае усыпьте личинок путем передозировки неразведенным трикаином, покрыв агарозу слоем трикаина и высиживая 10 минут.
13. Анализ данных
- Откройте отдельные наборы данных в ImageJ/Fiji (т. е. контроль, препарат A, препарат B, препарат A+B) отдельно, начиная с управления транспортным средством.
- Откройте макрос анализа (доступен аннотированный скрипт) (http://doi.org/10.5281/zenodo.4290225).
- Вкратце макроанализ делает следующее: объединяет все открытые изображения (одно условие); разбивает изображения на отдельные каналы, составляющие изображение; закрывает все добавочные каналы (оставляя канал раковой клетки); запускает алгоритм порогового значения для всей конкатенированной последовательности; измеряет интегральную плотность каждого отдельного изображения; и сохраняет показатели в виде листа Excel в корневой папке.
- Запустите макроанализ по всем условиям.
- Объедините измерения (в общем случае не менее n=2*20) и удалите выбросы (Q-тест в Graph pad Prism v8).
- Нормализуйте измерения либо до контроля растворителя, либо до дня 1 (в зависимости от типа эксперимента, первый для эксперимента с ингибированием лекарств, а второй для эксперимента с кинетикой роста). Выразите измерения в виде нормализованной нагрузки раковых клеток (ось y ) во времени или состоянии (ось x ), как показано на рисунке 3 и рисунке 4 соответственно.
Результаты
Мы предоставили пошаговые инструкции для быстрого и простого перехода от новой клеточной линии к ее анализу. Мы начнем с сверхэкспрессии флуоресцентного индикатора с помощью кассеты с гиперэкспрессией лентивируса (шаги 3 и 4). Затем следует подготовка клеток для обеспечения минимально возможного мертвого объема во время инъекции, что позволяет вводить большое количество клеток как в doC, так и в ретроорбитальное пространство (шаги 6 и 7). Затем мы выполняем полувысокопроизводительный сбор данных с помощью стереофлуоресцентной микроскопии и конфокальной микроскопии с большим увеличением для качественного анализа диссеминации раковых клеток всего тела (рис. 2 и шаги 10, 11 и 12). При сборе данных необходимо проявлять осторожность, так как для обеспечения воспроизводимости как стерео, так и конфокальной микроскопической визуализации очерчиваются общие настройки и стандартизация (шаги 11 и 12). Обсуждается анализ данных (с использованием imageJ/Fiji) 16, а также стандартизация с использованием макросов imageJ (шаг 13).
На шаге 3 мы упомянули о временной маркировке (раковых) клеток для проведения быстрого предварительного скрининга для оценки опухолевого потенциала новой линии раковых клеток. Одним из важных предостережений является то, что, несмотря на простоту использования и долговечность, описанное здесь преходящее окрашивание может образовывать артефакты (т.е. необходимо позаботиться о том, чтобы фрагменты клеток можно было отличить от целых клеток, как это было широко сделано Фиором и коллегами 9). По нашему опыту, образование этих артефактов напрямую связано с чрезвычайной стабильностью пятна и яркостью (даже после гибели клеток), когда фрагменты клеток рассеиваются и поглощаются иммунными клетками, которые впоследствии могут быть ошибочно признаны производными от активных метастазов.
В обеих описанных моделях системного приживления через doC и локализованного приживления в ретроорбитальном пространстве тщательный скрининг личинок через сутки после инъекции имеет первостепенное значение. Как показано на рисунке 2В , все личинки, которые демонстрируют механическое смещение привитых клеток в область головы (за пределы ретроорбитального сайта) в ретроорбитальной модели и клетки в желточном мешке, или проявляющие отек в пуле для инъекции doC, должны быть удалены. Все отрицательно выбранные фенотипы показаны на рисунке 2 в виде конфокальных стежков с высоким разрешением, но их можно легко увидеть и удалить с помощью стереомикроскопического наблюдения.
Со временем клетки будут мигрировать и размножаться. Для ретроорбитальной модели мы наблюдали инфильтрацию в соседние ткани для CRMM1, но мы наблюдали меньшую пролиферацию для CRMM2. Поразительно, но мы наблюдали отдаленные метастазы, возникающие между 2-4 точками на дюйм у некоторых людей (20%), где мы измерили значительную разницу при 6 точках на дюйм, как показано на рисунке 4. Для обеих клеточных линий мы проверили пролиферативный потенциал при введении в оба сайта. Для CRMM1 наблюдалось достоверное (p<0,0001) увеличение числа раковых клеток в местах инъекций или в местах инъекции, когда оно отображалось в виде нормализованной нагрузки опухолевых клеток, нормализовавшись к первому дню для каждой модели (увеличение в 7,8 раза, ±3,2 для модели RO и увеличение в 15 раз ±8,8 для модели doC). CRMM2 не показала существенного роста при нормализации к первому дню для каждой отдельной модели (увеличение в 2,4 раза, ±увеличение в 1,9 и 2,3 раза, ±1,14 для RO и doC). Было обнаружено, что CRMM1 легко пролиферирует как в ретроорбитальной ткани, так и в каудальной кроветворной ткани после приживления. Клеточная линия CRMM2 была менее пролиферативной в обеих моделях, но, что интересно, было обнаружено, что она способна к отдаленному метастазированию при введении в ретроорбитальное пространство, как показано на рисунке3B, C.
После скрининга введенных личинок с концентрацией 1 dpi и случайного распределения особей либо в группы лечения, либо в контрольную группу, рыб обрабатывали в течение 6 дней, меняя воду, содержащую вемурафениб (этот ингибитор можно легко заменить на любое другое титруемое противоопухолевое соединение). Мы решили развить ранее опубликованную модель распространения гематогенной меланомы конъюнктивы с приживлением CRMM114, проверив эффективность вемурафениба на ортотопически приживленных CRMM1. CRMM1 показал значительное значительное снижение в группе эктопически привитых пациентов, получавших Вемурафениб (P<0,0001) и задержку роста, но значимый ответ на ортотопическую модель (p<0,05), как показано на рисунке 4.
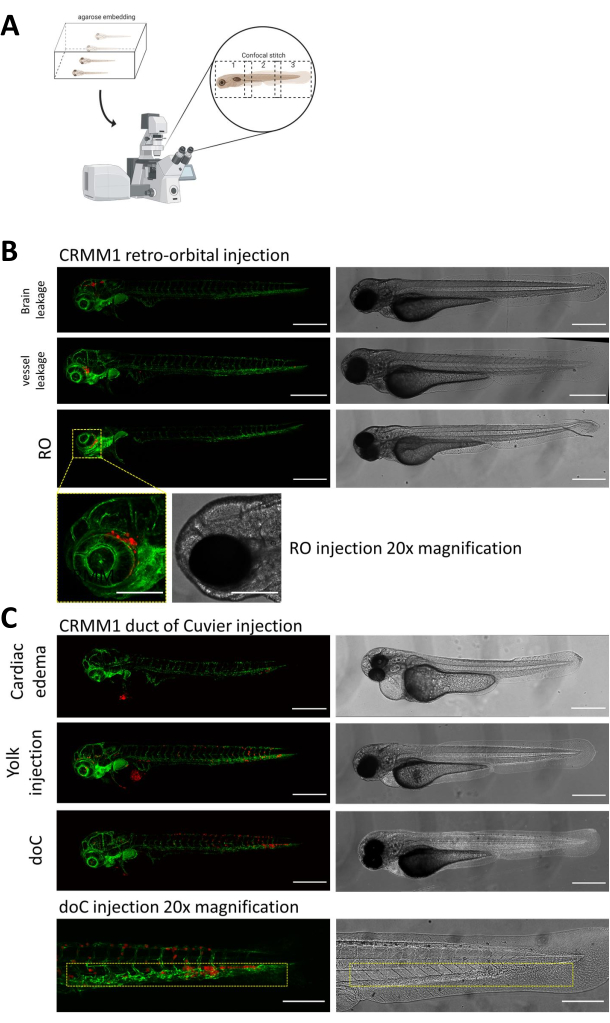
Рисунок 2. Фенотипическая оценка и скрининг после инъекций. А) Схематическое изображение генерации конфокального стежка ксенотрансплантата данио-рерио, дающее бесшовные изображения с высоким разрешением после интеграции последующей конфокальной проекции. Здесь ксенотрансплантаты данио-рерио помещаются в 1% низкоплавкую агарозу и устанавливаются на стеклянное дно конфокальной чашки (как описано в шаге 11.3). Б) Все возможные исходы ретроорбитального и протокового приживления Кювье отображаются при введении зеленого флуоресцентного кровеносного сосуда репортера данио-рерио (TG:fli:GFP), с клетками, окрашенными лентивирусом поверх экспрессии tdTomato). Мы обозначаем правильное приживление при 1 dpi (панель RO) и нежелательные фенотипы (как утечка в мозг, так и утечка из кровеносных сосудов). Последние две популяции должны быть удалены, чтобы гарантировать, что они не исказят результаты последующих экспериментов. В) Нежелательные фенотипы для гематогенного приживления через проток Кювье (doC) представляют собой контуры, в которых должны быть удалены отечные личинки сердца (сердечный отек) и личинки с клетками, просачивающимися в желточный мешок (инъекция желтка), чтобы предотвратить вмешательство в последующие измерения. Правильно введенные личинки объединяются в экспериментальные группы, как описано на шаге 7.1. (Все изображения получены с разрешением 1 dpi, с помощью конфокального микроскопа, масштабные линейки 200 мкм. Желтыми прямоугольниками обозначены метастатические участки как для приживлений RO, так и для doC, области головы и каудальной кроветворной ткани соответственно). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
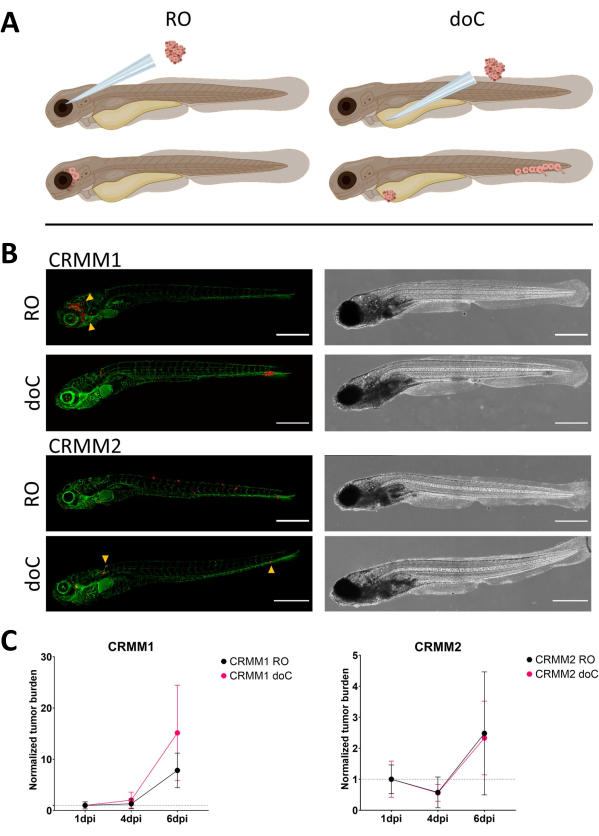
Рисунок 3. Сравнительный анализ клеточных линий меланомы конъюнктивы CRMM1 и CRMM2 показывает дифференциальную метастатическую способность и способность к росту. А) Схематическое изображение моделей инъекции, ретроорбитальной модели (RO) и модели гематогенного приживления (doC), используемые рыбы представляют собой TG(fli:GFP) зеленые репортеры кровеносных сосудов, с клетками сверхэкспрессии tdTomato, показанными красным цветом. Б) Репрезентативные фенотипы рыб, привитых с помощью CRMM1 и CRMM2, CRMM1 демонстрирует эффективное приживление (как RO, так и doC) и мелкомасштабную инвазию в ткани, окружающие место приживления RO (RO, желтые стрелки). CRMM2 демонстрирует значительно более низкую эффективность приживления для обеих моделей приживления, но демонстрирует отдаленные метастазы при инъекции ретро-орбитально (как показано в RO, обозначенных наконечниками стрелок). (Все изображения получены при 6 dpi, конфокальный микроскоп, масштабные линейки 200 мкм. Желтые стрелки указывают на метастатические участки как для приживлений RO, так и для doC, область головы и каудальную кроветворную ткань соответственно). C) Графики кинетического приживления для CRMM1 и CRMM2, сравнивая обе модели приживления к 1-му дню (нормализация к 1-му дню), отмечается значительное (p<0,0001) увеличение нормализованной опухолевой нагрузки для клеточной линии CRMM1 (между 1 dpi и 6 dpi), где наблюдается (незначительная) тенденция к росту для CRMM2. CRMM1 показывает значительную разницу между ростом RO и doC, где модель doC показывает более высокую скорость роста опухоли (примерно в 2 раза выше для приживленных личинок doC). На графиках отображается среднее значение и стандартная ошибка среднего значения (SEM). Все группы были нормализованы до 1 dpi для каждого отдельного состояния. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
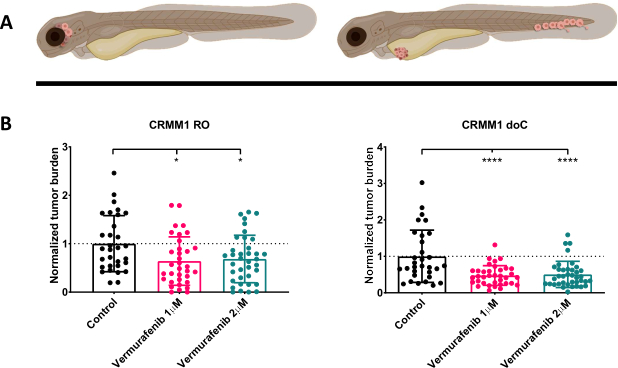
Рисунок 4. Ингибитор BRAF V600E вемурафениб значительно ингибирует как RO, так и doC привитых личинок меланомы рерио. А) Схематическое изображение фенотипов рыбок данио, моделей RO и doC. Б) Как приживленные, так и приживленные личинки, привитые RO и doC, которым вводили клеточную линию меланомы конъюнктивы CRMM1, демонстрируют значительное снижение нормализованной опухолевой нагрузки (p<0,05 и P<0,001 соответственно). Модели привитых рыбок данио-рерио указывают на усиленный реакцию на лекарство и зависимую от дозы связь с ингибированием препарата, что указывает на возможное насыщение ингибирования. Графики показывают среднюю и стандартную ошибку среднего значения (SEM), все группы были нормализованы для контроля для каждой отдельной клеточной линии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Реагент | Том |
| Приложение psPAX2 | 1,71 пмоль (12,14μг) |
| pMD2.G | 0,94 пмоль (3,66 мкг) |
| Трансферная плазмида* | 1.64 пмоль (рассчитать точный объем) |
Таблица 1.
Обсуждение
В данной работе мы определили тщательный подход к моделированию первичной и метастатической меланомы глаза у ксенотрансплантатов данио-рерио. Комбинируя локализованную ортотопическую инъекцию и системную эктопическую инъекцию, мы резюмировали этиологию канцерогенеза для рака, где ранее не было доступно животных моделей. Присущая личинкам рыбок данио прозрачность позволяет отслеживать флуоресцентно меченые раковые клетки на уровне всего животного, обеспечивая легкую визуализацию потенциальных метастатических участков17. Кроме того, конфокальный микроскопический анализ с большим увеличением позволяет отслеживать клетки с субклеточным разрешением10.
Мы предоставили пошаговые инструкции для быстрого и легкого перехода от новой клеточной линии к созданию ксенотрансплантата и его анализу. Мы начинаем с сверхэкспрессии флуоресцентного индикатора с помощью лентивирусной кассеты с гиперэкспрессией (шаги 3 и 4), за которой следует подготовка клеток для обеспечения минимально возможного мертвого объема при введении. Это позволяет вводить большое количество клеток как в doC, так и в ретроорбитальное пространство (этапы 7 и 8). Затем мы выполняем полувысокопроизводительный сбор данных с помощью стереофлуоресцентной микроскопии и конфокальной микроскопии с большим увеличением для качественного анализа распространения раковых клеток во всем теле (рис. 2 и шаги 9 и 10). При сборе данных необходимо проявлять осторожность, так как для обеспечения воспроизводимости как стерео, так и конфокальной микроскопической визуализации очерчиваются общие настройки и стандартизация (шаги 11 и 12). Обсуждается анализ данных (с использованием imageJ/Fiji) 16, а также стандартизация с использованием макросов ImageJ (шаг 13).
На шаге 3 мы упоминаем о временной маркировке (раковых) клеток для проведения быстрого предварительного скрининга для оценки опухолевого потенциала новой линии раковых клеток. Одним из важных предостережений является то, что, несмотря на простоту использования и долговечность, описанное здесь преходящее окрашивание может образовывать артефакты (например, необходимо позаботиться о том, чтобы фрагменты клеток можно было отличить от целых клеток, как это было широко сделано Фиором и коллегами 9). По нашему опыту, образование этих артефактов напрямую связано с чрезвычайной стабильностью пятна и яркостью (даже после гибели клеток), когда фрагменты клеток рассеиваются и поглощаются иммунными клетками, которые впоследствии могут быть ошибочно признаны производными от активных метастазов.
Используя эти модели, мы смоделировали развитие первичной опухоли путем физического ограничения привитых клеток в пределах ретроорбитального междоузлия. Последующий тщательный скрининг через 1 день после приживления гарантирует, что клетки, обнаруженные в отдаленном месте позже в эксперименте, активно метастазировали (интравировались и диссеминировались, в конечном итоге экстравазируя в метастатической нише). Приживление через doC, эмбриональную общую кардинальную вену, позволяет легко и с высокой степенью воспроизводимости имплантировать большое количество клеток (с избытком до 600 клеток при правильной концентрации), эффективно обходя первичные стадии метастатического каскада (интравазацию) и позволяя нам сосредоточиться на более поздних стадиях метастатического каскада (адгезия, экстравазация и рост). Несмотря на то, что при правильном использовании обе модели являются эффективными инструментами, их следует тщательно контролировать в течение первого дня после приживления, чтобы гарантировать, что на более поздних стадиях эксперимента не будет сделано ложноположительных выводов.
В соответствии с предыдущими публикациями мы показали, что линии меланомы конъюнктивы легко образуют метастатические колонии после распространения по всей системе кровообращения рыбок данио-рерио14. В данной работе мы сообщаем о расширении репертуара приживления с помощью ретроорбитальной инъекции в качестве ортотопической модели и последующем активном метастазировании в каудальную кроветворную ткань клеточной линии CRMM2. Впоследствии мы сообщаем об эффективности специфического ингибитора BRAF V600E Vemurafenib также в отношении первичной формы меланомы конъюнктивы при моделировании на личинках рыбок данио.
Используя вышеупомянутые методы, опытный исследователь способен генерировать более сотни привитых личинок в день (примерно 200 в час) любой из предложенных моделей. В течение двух недель препарат можно как титровать до максимально переносимой дозы, так и проводить скрининг на установленной модели ксенотрансплантата. От начала и до конца, с использованием нетрансдуцированной клеточной линии, до получения профиля чувствительности к лекарственным препаратам в модели данио-рерио может быть достигнуто в течение месяца (учитывая, что введенная клеточная линия является опухолевой в модели данио-рерио). В наших руках всего 20 личинок за эксперимент и два биологических повтора воспроизводимо привели к сильному ингибированию лекарств, когда два отдельных эксперимента конфликтуют (или не приводят к статистически значимому ингибированию роста), может быть проведен третий биологический повтор.
Благодаря незначительным корректировкам, эти модели позволили нам быстро адаптировать эти стратегии имплантации для глиобластомы (инъекция в заднюю полость мозга), рака молочной железы (инъекция doC) и остеосаркомы (doC) 18,19,20,21. Эти модели впоследствии могут быть использованы как для фундаментальных исследований, так и для доклинического скрининга как отдельных препаратов, так и комбинаторных лекарственных стратегий. Недавно мы описали различные режимы введения препаратов и их фотоактивацию с помощью этих моделей 13.
Раскрытие информации
Никакой.
Благодарности
Эта работа была поддержана финансированием в рамках программы исследований и инноваций Европейского Союза «Горизонт 2020» в рамках грантового соглашения No 667787 (проект UM Cure 2020, www.umcure2020.org). Китайский совет по стипендиям выражает благодарность за гранты на соискание ученой степени доктора философии для J.Y.
Материалы
| Name | Company | Catalog Number | Comments |
| 2.5mm box filament | Science products | FB255B | for pulling micro injection needles using a Sutter P97 or P1000 |
| 3mL transfer pipettes | Merck | Z350796 | for transfer and selection of zebrafish embryos |
| Agarose | Milipore | 2120 | 1.5% (w/v) in eggwater, 1.5 g in 100 mL DPBS, microwave to dissolve, for injecting and stereofluorescence imaging of zebrafish larvae |
| Capillaries: borosilicate glass outer | World precision instruments | BF100-78-10 | Borosilicate glass capillaries used for needle preparation |
| DMSO | Sigma | D8418 | Often used as solvent in drug treatments, should be stored at 2-8°C the dark. |
| DPBS | Thermo Fischer Scientific | 14190144 | Dulbecco’s phosphate buffered saline, without Mg2+ and Ca2+ for washing the cells, lack of Ca2+ impairs cell-cell adhesion through cadherins and prevents cell aggregation during injection |
| Egg water | Instant ocean | SS15-10 | 0.6 mg/L final concentration sea salt in demineralized water |
| GFP encoding lentiviral transfer plasmid | Addgene | Plasmid #106172 | Generated in Snaar lab, available at Addgene |
| Hek293T | ATCC | CRL-3216 | Stable cell line for generating lentiviral particles, contains SV40-T antigen required for the generation of lentiviral particles |
| Leica sp8 confocal | Leica | Leica TCS SP8 | automated stage confocal microscope with 405/488/514/635nm lasers |
| LipodD293 | Signagen | SL100668 | Highly efficient HEK293t optimized transfection reagent |
| Low-melting agarose | Milipore | 2070 | 1% (w/v) in eggwater 1.5 g in 100 mL DPBS, microwave to dissolve, for embedding zebrafish larvae for confocal imaging |
| Micro loader tips | Fischer scientific | 10289651 | flexible microloader tips |
| Micro manipulator | World precision instruments | M3301R | x/y/z manual micro manipulator for microinjection |
| Needle puller: P-97 or P-1000 | Sutter | P-97 | needle puller used for generating standardized micro engraftment needles |
| Nr.5 watchmakers forceps | VWR | HAMMHSC818-11 | fine watchmakers forceps used for breaking back needles |
| Picopump | World precision instruments | SYS-PV820 | pulse controller supplying pressure for microinjection |
| pMD2.G | Addgene | plasmid #12259 | Gifted by Didier Trono, 2nd generation lentiviral virulence plasmid |
| psPAX2 | Addgene | plasmid #12260 | Gifted by Didier Trono, 2nd generation lentiviral packaging plasmid |
| PVP40 | Sigma-Aldrich | PVP40 | Polyvinylpyrrolidone average mol wt 40,000) PVP40 2% (w/v) in DPBS, 1 g PVP40 in 50 mL DPBS. Vortex and incubate at 37°C to facilitate dissolving. Store at room temperature. |
| tdTomato encoding lentiviral transfer plasmid | Addgene | Plasmid #106173 | Generated in Snaar lab, available at Addgene |
| transmitted light stereo microscope | Leica | leica M50 with (MDG33 base) | leica transmitted light microscope with mirror adjustable illumination. |
| Tricaine | Sigma-Aldrich | E10521 | Ethyl 3-aminobenzoate methanesulfonate or MS-222 |
| TryplE | Thermo Fischer Scientific | 12604-01 | Synthetic trypsine replacement, less damaging to the cells and allows for the gentle dispersion of strongly adherent cells. (Thermo- |
| willco dish | WillCo wells | GWST-5040 | 50mm glass bottom dishes, allow for the embedding of up to 20 zebrafish larvae, enabling the imaging of multiple conditions in one dish due to its large optical glass surfac |
Ссылки
- Yang, J., Manson, D. K., Marr, B. P., Carvajal, R. D. Treatment of uveal melanoma: where are we now. Therapeutic Advances in Medical Oncology. 10, (2018).
- Wong, J. R., Nanji, A. A., Galor, A., Karp, C. L. Management of conjunctival malignant melanoma: A review and update. Expert Review of Ophthalmology. 9, 185-204 (2014).
- Nguyen, D. X., Bos, P. D., Massagué, J. Metastasis: from dissemination to organ-specific colonization. Nature Reviews Cancer. 9, 274-284 (2009).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2, 183-189 (2008).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nature Reviews Drug Discovery. 4, 35-44 (2005).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Palmblad, M., et al. Parallel deep transcriptome and proteome analysis of zebrafish larvae. BMC Research Notes. 6, 428(2013).
- Yan, C., et al. Visualizing Engrafted Human Cancer and Therapy Responses in Immunodeficient Zebrafish. Cell. 177, 1903-1914 (2019).
- Fior, R., et al. Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts. Proceedings of the National Academy of Sciences of the United States of America. 114, 8234-8243 (2017).
- Campbell, P. D., Chao, J. A., Singer, R. H., Marlow, F. L. Dynamic visualization of transcription and RNA subcellular localization in zebrafish. Development. 142, Cambridge. 1368-1374 (2015).
- Campeau, E., et al. A Versatile Viral System for Expression and Depletion of Proteins in Mammalian Cells. PLoS One. 4, 6529(2009).
- vander Helm, D., et al. Mesenchymal stromal cells prevent progression of liver fibrosis in a novel zebrafish embryo model. Scientific Reports. 8, 16005(2018).
- Chen, Q., et al. TLD1433 photosensitizer inhibits conjunctival melanoma cells in zebrafish ectopic and orthotopic tumour models. Cancers. 12, (2020).
- Pontes, K. C. deS., et al. Evaluation of ( fli:GFP ) Casper Zebrafish Embryos as a Model for Human Conjunctival Melanoma. Investigative Opthalmology & Visual Science. 58, 6065(2017).
- Liverani, C., et al. Innovative approaches to establish and characterize primary cultures: an ex vivo 3D system and the zebrafish model. Biology Open. 6, 133-140 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2, 183-189 (2008).
- Mercatali, L., et al. Development of a patient-derived xenograft (PDX) of breast cancer bone metastasis in a Zebrafish model. International Journal of Molecular Sciences. 17, (2016).
- Tulotta, C., et al. Imaging cancer angiogenesis and metastasis in a zebrafish embryo model. Advances in Experimental Medicine and Biology. 916, Springer New York LLC. 239-263 (2016).
- Paauwe, M., et al. Endoglin expression on cancer-associated fibroblasts regulates invasion and stimulates colorectal cancer metastasis. Clinical Cancer Research. 24, 6331-6344 (2018).
- Cao, J., et al. Overexpression of EZH2 in conjunctival melanoma offers a new therapeutic target. Journal of Pathology. 245, (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены