A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أدوات للتقييم في الوقت الحقيقي لنموذج عدوى السودوموناس aeruginosa
In This Article
Summary
الاصطناعية التليف الكيسي البلغم المتوسطة (SCFM2) يمكن استخدامها في تركيبة مع كل من الليزر confocal المسح المجهري والفلورسينس تنشيط فرز الخلايا لمراقبة المجاميع البكتيرية في قرار عالية. تفصل هذه الورقة طرق تقييم المجموعات السكانية الإجمالية أثناء العلاج المضاد للميكروبات كمنصة للدراسات المستقبلية.
Abstract
Pseudomonas aeruginosa (Pa) هي واحدة من مسببات الأمراض الانتهازية الأكثر شيوعا المرتبطة بالتليف الكيسي (CF). بمجرد تأسيس استعمار السلطة الفلسطينية ، تشكل نسبة كبيرة من البكتيريا المصابة الأغشية الحيوية داخل بغم مجرى الهواء. وقد ثبت أن الأغشية الحيوية Pa المعزولة عن البلغم CF تنمو في مجاميع صغيرة وكثيفة من ~ 10-1000 خلية يتم تنظيمها مكانيا وتظهر الأنماط الظاهرية ذات الصلة سريريا مثل تحمل مضادات الميكروبات. أحد أكبر التحديات لدراسة كيفية استجابة مجاميع Pa لبيئة البلغم المتغيرة هو عدم وجود أنظمة ذات صلة من الناحية التغذوية وقوية تعزز التكوين الكلي. باستخدام وسيطة البلغم CF الاصطناعية (SCFM2)، يمكن ملاحظة تاريخ حياة المجاميع السلطة الفلسطينية باستخدام المجهر المسح بالليزر confocal (CLSM) وتحليل الصور في قرار خلية واحدة. يسمح هذا النظام في المختبر بمراقبة آلاف المجاميع ذات الحجم المتفاوت في الوقت الحقيقي وثلاثة أبعاد وعلى مقياس ميكرون. وعلى المستويين الفردي والسكاني، فإن القدرة على تجميع المجاميع حسب النمط الظاهري والموقع تسهل مراقبة المجاميع في مراحل النمو المختلفة واستجابتها للتغيرات في البيئة الدقيقة، مثل العلاج بالمضادات الحيوية، التي يمكن تمييزها بدقة.
Introduction
Pseudomonas aeruginosa (Pa) هو ممرض انتهازي يؤسس التهابات مزمنة في الأفراد الذين يتعرضون للخطر المناعي. بالنسبة لأولئك الذين يعانون من التليف الكيسي المرض الوراثي (CF)، يمكن لهذه العدوى تمتد على مدى العمر. CF يسبب تراكم البلغم لزجة وغنية بالمغذيات في الشعب الهوائية، والتي تصبح مستعمرة من قبل مجموعة متنوعة من مسببات الأمراض الميكروبية مع مرور الوقت. السلطة الفلسطينية هي واحدة من مسببات الأمراض CF الأكثر انتشارا، واستعمار الشعب الهوائية في مرحلة الطفولة المبكرة وإنشاء العدوى التي يصعب علاجها1. السلطة الفلسطينية لا تزال مشكلة سريرية كبيرة ويعتبر السبب الرئيسي للوفيات في أولئك الذين يعانون من CF, على الرغم من تحسين نظم العلاج في السنوات الأخيرة2,3. وقد أكسب هذا النمط الظاهري المستمر وزيادة تحمل المضادات الحيوية Pa مكانا في مجموعة من مسببات الأمراض التي حددها كل من مراكز مكافحة الأمراض (CDC) ومنظمة الصحة العالمية (WHO) كأولويات بحثية لتطوير استراتيجيات علاجية جديدة - مسببات الأمراض ESKAPE4.
مثل مسببات الأمراض الأخرى ESKAPE، اكتسبت مقاومة المضادات الحيوية أمر شائع في السلطة الفلسطينية،ولكن هناك أيضا العديد من الخصائص الجوهرية التي تسهم في التسامح Pa مضادات الميكروبات. من بين هذه هي قدرة السلطة الفلسطينية لتشكيل مجموعات المجاميع كثيفة للغاية من ~ 10-1000 الخلايا، والتي يمكن ملاحظتها في التهابات متعددة، بما في ذلك CF البلغم المريض5،6. على غرار Pa التي تمت دراستها في أنظمة بيو فيلم أخرى ، تعرض مجاميع Pa الأنماط الظاهرية ذات الصلة سريريا مثل زيادة مقاومة المضادات الحيوية وتنشيط الاتصالات الخلوية الخلية (استشعار النصاب القانوني (QS)). على سبيل المثال، وقد ثبت أن المجاميع من السلطة الفلسطينية لاستخدام السلوكيات QS التي تنظمها لمكافحة الميكروبات الأخرى، فضلا عن تحمل العلاجات المضادة للميكروبات مثل إنتاج البايوسيانين7. القدرة على دراسة مثل هذه السلوكيات يقدم نظرة مثيرة في النظم الإيكولوجية البكتيرية في بيئة مماثلة لتلك التي توجد في جسم الإنسان.
أحد أكبر التحديات لدراسة كيفية استجابة مجاميع Pa لبيئة البلغم المتغيرة هو عدم وجود أنظمة ذات صلة من الناحية التغذوية وقوية تعزز التكوين الكلي. وقد تم اكتشاف الكثير مما هو معروف عن السلطة الفلسطينية باستخدام النظم المختبرية التي تنمو الخلايا العوالق أو في سطح مميز المرفقة، "الفطر" العمارة التي لم يلاحظ في الجسم الحي8. في حين أن نماذج نمو البيو فيلم الكلاسيكية، مثل خلايا التدفق أو أجار الصلبة، قد أسفرت عن معرفة واسعة وقيمة حول السلوكيات البكتيرية وآليات التسامح مع المضادات الحيوية، وهذه النتائج لا تترجم دائما في الجسم الحي. العديد من النماذج في المختبر لديها قدرة محدودة على محاكاة بيئة النمو في موقع العدوى البشرية، مما يتطلب مكلفة في الدراسات الحية. بدوره، يفتقر العديد من نماذج الجسم الحي إلى المرونة والدقة التي توفرها التقنيات المختبرية.
تم تصميم البلغم التليف الكيسي الاصطناعية (SCFM2) لتوفير بيئة لنمو السلطة الفلسطينية مماثلة لتلك التي شهدتها خلال العدوى المزمنة في الرئة CF. SCFM2 يشمل المصادر الغذائية المحددة في sputa CF المتوقعة بالإضافة إلى الموسين والدهون والحمض النووي. السلطة الفلسطينية النمو في SCFM2 يتطلب مجموعة الجينات متطابقة تقريبا لتلك المطلوبة للنمو في البلغم الفعلي ويدعم الطبيعية السلطة الفلسطينية تشكيل الكلي9,10. بعد التطعيم، تشكل الخلايا العوالق مجاميع تزيد في الحجم من خلال التوسع. يتم تحرير الخلايا الفردية (يشار إليها باسم المهاجرين) من المجاميع، والهجرة إلى مناطق غير مستعمرة، وتشكيل مجاميع جديدة10. يمكن ملاحظة تاريخ الحياة هذا باستخدام CLSM وتحليل الصورة بدقة خلية واحدة. المجاميع من السلطة الفلسطينية التي تشكلت في SCFM2 هي من أحجام مماثلة لتلك التي لوحظت في الرئة CF10. يسمح هذا النموذج بمراقبة مجاميع متعددة ذات حجم مختلف في الوقت الفعلي وفي ثلاثة أبعاد على مقياس ميكرون. يسمح الفحص المجهري الفاصل زمنيا بتتبع الآلاف (حوالي 50,000) من المجاميع في تجربة واحدة. يسمح استخدام برنامج تحليل الصور بتقدير الأنماط الظاهرية الكلية من الصور الدقيقة، بما في ذلك الحجم الكلي والمساحة السطحية والموقع في ثلاثة أبعاد لأقرب 0.1 ميكرومتر، على مستوى التجميع الفردي والسكان على حد سواء. وجود القدرة على تجميع المجاميع حسب النمط الظاهري والموقف يسمح لتمايز المجاميع في مراحل النمو المختلفة بدقة ، فضلا عن استجابتها للبيئة الدقيقة المتغيرة6،11.
تطبيق SCFM2 لدراسة المجاميع السلطة الفلسطينية في حجم منخفض وأعلى الإنتاجية المقايسات جعله نموذجا مرنا وفعالا من حيث التكلفة. كوسيط محدد، يوفر SCFM2 التوحيد والتكرار عبر منصات متعددة، وتوفير طريقة ذات صلة من الناحية التغذوية والبدنية لدراسة المجاميع السلطة الفلسطينية في المختبر9. وتشمل التطبيقات استخدامه في تركيبة مع CLSM لمراقبة التنظيم المكاني والتسامح مع المضادات الحيوية بدقة عالية (كما هو موضح في ورقة الأساليب هذه). القدرة على إجراء التجارب التي توفر في الوقت الحقيقي، والبيانات على نطاق ميكرون يسمح لدراسة التفاعلات داخل الأنواع وبين الأنواع لأنها قد تحدث في الجسم الحي. على سبيل المثال، سبق استخدام SCFM2 لدراسة الديناميات المكانية للاتصال بين الخلايا في مجموعات سكانية إجمالية عبر شبكة من الأنظمة التي تستخدمها السلطة الفلسطينية لتنظيم الجينات المتعددة التي تساهم في الفوعة ومسببات الأمراض6.

الشكل 1: تصوير رسومية من الخطوات التجريبية الرئيسية. (أ) يتم تلقيح SCFM2 مع خلايا السلطة الفلسطينية ويسمح لتشكيل المجاميع في طبق ثقافة الزجاج القاع. (ب)يتم نقل المجاميع إلى المجهر confocal، ويتم إضافة المضادات الحيوية. يصور ثلاثة تكرارات تقنية (الغرف 1-3) وبخير تحكم (4) من SCFM2 الملقح دون علاج بالمضادات الحيوية. يتم تصوير المجاميع باستخدام CLSM على مدار 18 ساعة (C) بعد التصوير الأولي 18 ساعة ، يتم التعامل مع المجاميع مع يوديد البروبيديوم لتصور الخلايا الميتة وتصويرها باستخدام CLSM (D) يتم فصل المجاميع مع النمط الظاهري المطلوب من SCFM2 باستخدام FACS. الاختصارات: SCFM2 = الاصطناعية التليف الكيسي البلغم المتوسط; السلطة الفلسطينية = Pseudomonas aeruginosa; CLSM = المسح المجهري بالليزر confocal؛ FACS = فرز الخلايا المنشطة بالفلورسينس. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
هنا ، يتم إثبات فائدة SCFM2 لدراسة تأثير العلاج بالمضادات الحيوية على مجاميع Pa في الوقت الفعلي ، يليها استخدام نهج فرز الخلايا لعزل مجموعات المجاميع ذات الأنماط الظاهرية المتميزة لتحليل المصب(الشكل 1).
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد الاصطناعية التليف الكيسي المتوسط (SCFM2)
ملاحظة: يتضمن إعداد SCFM2 ثلاث مراحل رئيسية موضحة أدناه (الشكل 2). للاطلاع على التفاصيل والمراجع الكاملة، انظر9و10و12.
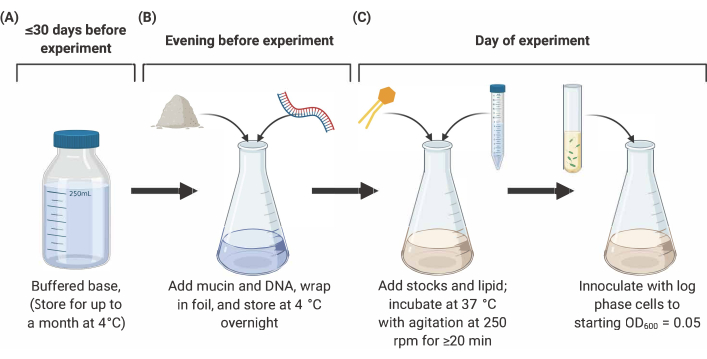
الشكل 2: إعداد وتطعيم SCFM2 المتوسطة. (أ)يتم إعداد قاعدة المخزنة باستخدام الأملاح والأحماض الأمينية المدرجة في الجدول 1 والجدول 2. يمكن تخزين القاعدة المخزنة مؤقتا عند درجة حرارة 4 درجات مئوية لمدة تصل إلى 30 يوما، ولكن يجب حمايتها من التعرض للضوء. (ب)تضاف الموسين والحمض النووي إلى aliquot من قاعدة المخزنة مؤقتا وحلها في حل بين عشية وضحاها في 4°C.( C ) تضاف الدهون ومخزونات إضافية إلى الحل بين عشية وضحاها واحتضانها في 37 درجة مئوية مع التحريض في 250 دورة في الدقيقة لمدة 20 دقيقة. ثم يتم تلقيح SFCM2 مع غسلها, خلايا مرحلة السجل في OD600 = 0.05. الاختصارات: SCFM2 = الاصطناعية التليف الكيسي البلغم المتوسط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تعقيم الموسين البورسيني
- إعداد الموسين العقيم بتركيز نهائي من 5 ملغم /مل في SCFM2. على سبيل المثال، لحجم 5 مل من SCFM2، تزن 25 ملغ من نوع الثاني mucin في طبق بيتري معقمة، ووضعها في الأشعة فوق البنفسجية (الأشعة فوق البنفسجية) معقم لمدة 4 ساعة، والتحريض بلطف كل ساعة.
- بعد 4 ساعة، نقل الموسين المعالج بالأشعة فوق البنفسجية إلى أنابيب 1.7 مل م م في ظروف معقمة، وتخزينها في -20 درجة مئوية.
- لتأكيد التعقيم الكامل، قم بإذابة عينة من الموسين في سائل معقم، مثل الماء أو مرق لوريا بيرتاني (LB)، ولاحظ تحت المجهر.
ملاحظة: يمكن تخزين الموسين المعقم عند -20 درجة مئوية لمدة تصل إلى 6 أشهر.
- إعداد قاعدة المخزنة مؤقتا
- إعداد الملح والأحماض الأمينية حلول المخزون عن طريق إضافة كميات مناسبة من حيث الوزن إلى المياه deionized كما هو مدرج في الجدول 1. تصفية تعقيم جميع المحاليل الأسهم باستخدام مرشح 0.22 μm، التفاف في احباط للحماية من تدهور الضوء، وتخزينها في 4 درجة مئوية لمدة تصل إلى شهر واحد.
- إعداد قاعدة المخزنة مؤقتا عن طريق الجمع بين 190 مل من المياه deionized مع الأحماض الأمينية وحلول مخزون الملح حسب الأحجام المدرجة في الجدول 1. ضبط الحل إلى درجة الحموضة 6.8، وزيادة إلى حجم النهائي من 250 مل. تصفية تعقيم باستخدام مرشح 0.22 ميكرومتر، وتخزينها في 4 درجة مئوية لمدة تصل إلى 30 يوما.
- في المساء قبل التجربة، aliquot الكمية المطلوبة من قاعدة المخزنة مؤقتا في قارورة ثقافة الزجاج، وإضافة موسين (5 ملغ / مل كما هو موضح في الخطوة 1.1.1) وتنقية الحمض النووي الحيوانات المنوية السلمون (0.6 ملغ / مل). هياج بلطف، والتفاف في احباط، وترك في 4 درجة مئوية بين عشية وضحاها للسماح mucin والحمض النووي لتذوب في الحل.
ملاحظة: يجب إذابة حمض السلمون المنوي على الجليد، ودوامة، وإضافتها إلى قاعدة عازلة والموسين. يجب إعداد حلول التربتوفان والهليون والتيروزين في حلول NaOH (انظر الجدول 1 للتركيزات) بدلا من الماء المتأين. الحفاظ على قاعدة المخزنة مؤقتا وجميع الحلول الأسهم ملفوفة في احباط للحماية من التعرض للضوء. معظم الأسهم ستكون مستقرة لمدة تصل إلى شهر. لا ينبغي استخدام المخزونات التي تصبح ملونة وينبغي استبدالها قبل الاستخدام.
- إضافة المخزونات التكميلية
- في يوم التجربة، أضف المخزونات المدرجة في الجدول 2 إلى القاعدة المخزنة مؤقتا التي تحتوي على الموسين والحمض النووي.
ملاحظة: إعداد حل FeSO4 الطازجة في يوم التجربة، ولكن يمكن إجراء جميع المخزونات الأخرى في وقت مبكر وتخزينها لمدة 30 يوما في 4 درجة مئوية. التعامل بحذر، ولا تستخدم بالقرب من اللهب المفتوح. بعد إضافة DOPC، احتضان SCFM2 عند 37 درجة مئوية مع اهتزاز (250 دورة في الدقيقة) لمدة 20 دقيقة على الأقل (لثقافة 5 مل). تسمح فترة الحضانة هذه للكلوروفورم في DOPC بالتبخر. وينبغي ألا تكون القارورة محكمة الإغلاق؛ بل ينبغي أن تكون كذلك. بدلا من ذلك، تغطية قارورة فتح فضفاضة مع احباط.
- في يوم التجربة، أضف المخزونات المدرجة في الجدول 2 إلى القاعدة المخزنة مؤقتا التي تحتوي على الموسين والحمض النووي.
2. تقييم الوقت الحقيقي للتحمل مضادات الميكروبات في المجاميع البكتيرية
- إعداد الثقافات بين عشية وضحاها
- في المساء قبل التجربة، تلقيح 5 مل من مرق LB مع عدة مستعمرات من Pa PAO1-pMRP9-113 من لوحة أجار LB تحتوي على مضاد حيوي (كاربينسيلين 300 ميكروغرام/مل). تنمو بين عشية وضحاها عند 37 درجة مئوية مع التحريض في 250 دورة في الدقيقة.
ملاحظة: تنمو الثقافات بين عشية وضحاها مع إضافة المضادات الحيوية اللازمة لاختيار البلازميدات المطلوبة (هنا، والبروتين الفلوري الأخضر (GFP) التعبير البلازميد، pMRP9-1). لاحظ أنه يجب غسل خلايا Pa قبل تلقيح SCFM2. يمكن استبدال LB لوسائل الإعلام المختبرية الغنية الأخرى للثقافات بين عشية وضحاها. يجب معالجة جميع العزلات البكتيرية باستخدام إرشادات BSL-2 المناسبة في جميع أنحاء هذا البروتوكول.
- في المساء قبل التجربة، تلقيح 5 مل من مرق LB مع عدة مستعمرات من Pa PAO1-pMRP9-113 من لوحة أجار LB تحتوي على مضاد حيوي (كاربينسيلين 300 ميكروغرام/مل). تنمو بين عشية وضحاها عند 37 درجة مئوية مع التحريض في 250 دورة في الدقيقة.
- تلقيح SCFM2
- في يوم التجربة ، تضعف الثقافات بين عشية وضحاها من السلطة الفلسطينية 1:10 (الثقافة : وسائل الإعلام السائلة) عن طريق تلقيح 500 ميكرولتر في 5 مل من مرق LB الطازجة. تنمو الخلايا حتى مرحلة السجل (60-90 دقيقة) في 37 درجة مئوية مع التحريض في 250 دورة في الدقيقة.
- ثقافات مرحلة سجل الطرد المركزي في 10،000 × غرام لمدة 5 دقائق. اغسل الخلايا عن طريق إزالة الناموستات الفائقة وإعادة تعليقها في 3 مل من المالحة المعقمة بالفوسفات المعقمة (PBS, pH 7.0). كرر مرتين، وإعادة إنفاق بيليه في مجلد نهائي من 1 مل من برنامج تلفزيوني.
- قياس امتصاص الخلايا المغسولة باستخدام مطياف في 600 نانومتر (OD600),وحساب حجم الثقافة المطلوبة لOD600 بدءا من 0.05 في 5 مل من SCFM2. تلقيح السلطة الفلسطينية في SCFM2، ودوامة بلطف لتوزيع الخلايا في جميع أنحاء. ماصة 1 مل من SCFM2 تلقيح في كل غرفة من 4-جيدا، قاع الزجاج، طبق بصري، واحتضان لمدة 4 ساعة بشكل ثابت في 37 درجة مئوية.
ملاحظة: يعتمد مضاعفة الوقت لثقافات السلطة الفلسطينية على السلالة وتوافر الأكسجين. في SCFM2، في ظل الظروف المذكورة هنا، ومضاعفة الوقت من السلطة الفلسطينية هو ~ 1.4 ساعة10.
3. تصور المجاميع أثناء العلاج بالمضادات الحيوية مع المجهر المسح بالليزر confocal (CLSM)
ملاحظة: يصف هذا القسم استخدام مجهر المسح الضوئي بالليزر البؤري وبرامج التقاط الصور لتصوير تجميعات Pa في SCFM2. والهدف من ذلك هو مراقبة وتوصيف الكتلة الحيوية البكتيرية المتبقية (المتسامحة) بعد العلاج بالمضادات الحيوية. ويمكن تنفيذ الخطوات المبينة بنجاح على المجاهر confocal أخرى، على الرغم من أن دليل تشغيل الصك ينبغي أن يشار إليه لتوجيهات محددة.
- صورة السلطة الفلسطينية الثقافات باستخدام إما غرفة ساخنة أو لوحة صغيرة ساخنة تركيبها على مرحلة المجهر للحفاظ على درجة حرارة المحيطة من 37 درجة مئوية. بدء وحدة الحضانة على الأقل 2 ساعة قبل بداية التجربة للسماح لجميع الأجهزة للوصول إلى درجة الحرارة المطلوبة، والحد من مزيد من التوسع والحركة أثناء جمع البيانات.
- بعد 4 ساعة، نقل الثقافات SCFM2 التي تحتوي على خلايا السلطة الفلسطينية إلى مرحلة المجهر ساخنة. تعيين 3 من أصل 4 آبار كما يكرر التقنية للعلاج بالمضادات الحيوية، والنظر في4 th فضلا عن عدم السيطرة على العلاج، التي تحتوي على خلايا السلطة الفلسطينية فقط في SCFM2، دون المضادات الحيوية. تحديد المجاميع باستخدام المجهر برايتفيلد ضمن علامة التبويب تحديد موقع قبل أي إثارة من المراسلين الفلورسنت. تحديد منطقة للتصوير داخل كل بئر، وتخزين موضعها (إحداثيات x-y-z) باستخدام وحدة المواضع في برنامج التصوير.
- استخدام هدف 63x النفط الغمر لتصور الثقافات السلطة الفلسطينية التي تحتوي على التعبير GFP pMRP9-1 في SCFM2 مع الطول الموجي الإثارة من 488 نانومتر والطول الموجي للانبعاثات من 509 نانومتر. التقاط الصور باستخدام خيار z-stack داخل وحدة Acquisition على فترات 1 ميكرومتر (إجمالي 60 شريحة). استخدم وحدة متوسط الخط لتقليل الإضاءة الخلفية في قناة GFP ضمن الحجم الإجمالي لصور المكدس z 60 ميكرومتر (1,093.5 مم3). التقاط صور التحكم SCFM2 غير الملقح باستخدام إعدادات متطابقة لتحديد مضان الخلفية لتحليل الصور.
ملاحظة: يتم الحصول على الصور من خلال إنتاج 512 بكسل × 512 بكسل (0.26 ميكرومتر × 0.26 ميكرومتر بكسل) صور z-stack 8 بت التي هي 60 ميكرومتر من قاعدة الغطاء. - استخدم خيار السلسلة الزمنية ضمن برنامج التصوير لالتقاط 60 شريحة في كل موضع (جيد) على فترات 15 دقيقة على مدى فترة 18 ساعة. استخدام استراتيجية التركيز محددة داخل البرنامج لتخزين طائرة محورية لكل موقف، والتي يتم إرجاعها إلى في كل نقطة زمنية طوال التجربة.
- بعد ما مجموعه 4.5 ساعة من الحضانة، صورة كل موقف باستخدام الإعدادات المذكورة أعلاه لتحديد الكتلة الحيوية الكلية داخل كل من الآبار الأربعة قبل إضافة المضادات الحيوية.
- بعد 6 ساعة من الحضانة الكلية، أضف المضادات الحيوية عند الحد الأدنى للتركيز المثبط (MIC) إلى كل تكرار. ماصة مباشرة وبلطف في منتصف البئر، فقط تحت interphase الهواء السائل. الحفاظ على جميع الثقافات في غرفة confocal ساخنة.
ملاحظة: هنا، تم استخدام كبريتات الكوليستين بتركيز 140 ميكروغرام/مل. - ابدأ التصوير بعد العلاج بالمضادات الحيوية بالنقر على خيار بدء التجربة ضمن برنامج التصوير.
ملاحظة: تركيز المضادات الحيوية المستخدمة تعتمد على المضادات الحيوية, عزل السلطة الفلسطينية, وما إذا كان المستخدم ترغب في دراسة آثار القتل أو التسامح. تستخدم هذه التجربة جرعة واحدة. يمكن إضافة جرعات إضافية دون تعطيل الثقافات إذا لزم الأمر.
4. بروبيديوم يوديد تلطيخ المجاميع السلطة الفلسطينية
ملاحظة: يستخدم عادة البروبيديوم يوديد (PI) ككاشف تلطيخ لتحديد الخلايا البكتيرية غير قابلة للحياة (الميتة) في الثقافة. هنا، يتم استخدامه لتحديد المجاميع الحساسة للعلاج بالمضادات الحيوية المطبقة في القسم 3. في جميع أنحاء هذا البروتوكول، يتم استخدام التعبير والكشف عن GFP في خلايا السلطة الفلسطينية كوكيل رئيسي لقابلية الخلية. تسمح هذه الخطوة الأخيرة باستخدام التصوير البؤري مرة أخرى لتحديد المواقع المكانية للمجاميع الحية / الميتة فيما يتعلق ببعضها البعض. بالإضافة إلى ذلك، يتم تعريف التجميعات ك أحياء/ميتة لمزيد من الفرز النهائي للخلايا في القسم 5.
- بعد 18 ساعة، أضف PI إلى كل بئر من الطبق السفلي البصري ذو الأربع غرف الذي يحتوي على ثقافات SCFM2. اتبع تعليمات الشركة المصنعة لحجم PI ووقت الحضانة(على سبيل المثال، ~ 2 ميكرولتر لكل مل من الثقافة ، ~ 20-30 دقيقة).
5. عزل الخلايا الحية عن المجاميع باستخدام نهج FACS
ملاحظة: يقدم FACS منصة قوية لفرز وعزل مجموعات من الخلايا وفقا لظاهرة الموسومة فلوريا. هنا، يتم استخدام FACS لعزل المجاميع الحية (المتسامحة مع المضادات الحيوية) عن المجاميع غير القابلة للتطبيق.
- بعد تلطيخ مع يوديد البروبيديوم، وإزالة الثقافات من الحضانة، ونقلها إلى أداة FACS في حاوية معزولة للحفاظ على 37 درجة مئوية.
- تشغيل 1 مل aliquots من SCFM2 التي تحتوي على المجاميع السلطة الفلسطينية في أدنى معدل تدفق.
ملاحظة: كل aliquot سوف تحتوي على ~ 15،000 المجاميع. - للكشف عن GFP، تضيء الخلايا مع ليزر 488 نانومتر، وتسجيل ارتفاع إشارة الفلورسنت في 530/30 نانومتر. تصور تلطيخ PI عن طريق الإثارة مع ليزر 561 نانومتر، وتسجيل ارتفاع إشارة الفلورسنت في 610/20 نانومتر. قم بإجراء الفرز باستخدام فوهة 70-u.
ملاحظة: يمكن تجميع التجميعات مفروزة بطرق متعددة اعتمادا على تطبيق المستخدم. في هذه الحالة، تم استخدام FACS لفرز المجاميع السلطة الفلسطينية قابلة للحياة لتسلسل الحمض النووي الريبي المصب. وتناقش التطبيقات البديلة أدناه.
6. تحليل الصور
ملاحظة: ينشئ المجهر الفاصل الزمني كميات كبيرة من البيانات. وتحدد تجربة 18 ساعة لمراقبة مجاميع السلطة الفلسطينية في SCFM2 ما يزيد على 000 50 مجموع بمرور الوقت، يمكن أن تتسم بالحجم وتحديد المواقع المكانية. استخدم برنامج تحليل الصور لتحديد الديناميكيات المجمعة في SCFM2:
- بالنسبة للدراسات المجمعة في SCFM2، يمكنك تحديد فلورة GFP الخلفية من خلال إنشاء رسم بياني للتعول في قناة GFP التي يتم إنتاجها ل SCFM2 و SCFM2 غير الملقحين بسلالة Pa PAO1 التي تحمل pMRP9-1. لضمان ارتباط voxels GFP المكتشفة بالكتلة الحيوية Pa، حدد voxel GFP+ على أنه ≥1.5x قيمة عدد الخلفيات GFP.
ملاحظة: يتم تعريف مضان الخلفية كأعلى قيمة voxel من ثلاثة مواقع تم اختيارها عشوائيا، في المتوسط. يتم طرح تعداد الخلفية ، كمقياس قياسي ، من جميع وحدات البكسل في الصور التجريبية بواسطة برنامج تحليل الصور. - بعد طرح الخلفية في وحدة تجاوز، إنتاج isosurfaces لجميع voxels المتبقية.
- للكشف عن التجميعات الفردية، قم بتمكين خيار تقسيم الكائنات، وحدد التجميعات ككائنات ذات وحدات تخزين ≥5 ميكرومتر3. استخدم الوحدة النمطية الفضل في برنامج تحليل الصور لحساب وحدة التخزين و x-y-z ومجموع voxels GFP لكل كائن فردي. تصدير هذه البيانات إلى منصة إحصائية خارجية.
ملاحظة: تسمح بعض برامج تحليل الصور بتصدير عدة فينتويبات كمية في وقت واحد، مما يسمح بحساب الارتباطات. - تصفية البيانات المصدرة من وحدة الفضل حسب الحجم لضمان عدم بقاء أية أجسام <0.5 ميكرومتر3 (الكتلة الحيوية المشتتة). لكل كائن فردي داخل الصورة، احسب المسافة من نفسه فيما يتعلق بالكائنات الأخرى (التجميعات) باستخدام وحدة Vantage لبرنامج تحليل الصور أو يدويا بالمعادلة التالية.
د = sqrt ((x2- ×1)2 + (ص2- ص1)2 + (ض2- ض1)2) (1) - استخدم حسابات SUM و المتوسط للعثور على إجمالي الكتلة الحيوية ومتوسط الحجم الإجمالي. وبدلا من ذلك، تصدير البيانات إلى منصات أو نصوص إحصائية أخرى، مثلتوزيع المجاميع عبر الكتلة الحيوية كما نوقشت في النتائج التمثيلية (نص غير منشور بالتعاون مع مختبر وايتلي، معهد جورجيا للتكنولوجيا).
Access restricted. Please log in or start a trial to view this content.
النتائج
هذا العمل تفاصيل أساليب لمراقبة المجاميع السلطة الفلسطينية في قرار عالية وفي بيئة مماثلة لتلك التي من العدوى المزمنة في الرئة CF9,10,12. يوفر SCFM2 نظام المختبر الذي يعزز التجميع الطبيعي للخلايا السلطة الفلسطينية في أحجام مماثل?...
Access restricted. Please log in or start a trial to view this content.
Discussion
وقد أدخل هذا العمل منهجيات يمكن دمجها لدراسة المجموعات البكتيرية الإجمالية في وجود وغياب العلاج بالمضادات الحيوية. تسمح CLSM عالية الدقة بتصور التغيرات في الكتلة الحيوية الكلية والتوجه الهيكلي للمجاميع في الوقت الفعلي عند التعرض للمضادات الحيوية. وبالإضافة إلى ذلك، يمكن قياس السمات الفي?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ولا يوجد بين أصحاب البلاغ تضارب في المصالح.
Acknowledgements
ويدعم S.E.D من قبل صناديق بدء التشغيل التي تقدمها وزارة الطب الجزيئي، وجامعة جنوب فلوريدا، فضلا عن منحة بحثية CFF (DARCH19G0) وN.I.H (5R21AI147654 - 02 (PI، تشن)) ومعهد USF على الميكروبيوم. نشكر مختبر وايتلي على التعاون المستمر الذي يشمل مجموعات البيانات المتعلقة بهذه المخطوطة. نشكر الدكتور تشارلز Szekeres لتسهيل فرز FACS. تم إنشاء الأرقام من قبل A.D.G و S.E.D باستخدام Biorender.com.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Amino acids | |||
| Alanine | Acros Organics | 56-41-7 | |
| Arginine HCl | MP | 1119-34-2 | |
| Asparagine | Acros Organics | 56-84-8 | Prepared in 0.5 M NaOH |
| Cystine HCl | Alfa Aesar | L06328 | |
| Glutamic acid HCl | Acros Organics | 138-15-8 | |
| Glycine | Acros Organics | 56-40-6 | |
| Histidine HCl H2O | Alfa Aesar | A17627 | |
| Isoleucine | Acros Organics | 73-32-5 | |
| Leucine | Alfa Aesar | A12311 | |
| Lysine HCl | Alfa Aesar | J62099 | |
| Methionine | Acros Organics | 63-68-3 | |
| Ornithine HCl | Alfa Aesar | A12111 | |
| Phenylalanine | Acros Organics | 63-91-2 | |
| Proline | Alfa Aesar | A10199 | |
| Serine | Alfa Aesar | A11179 | |
| Threonine | Acros Organics | 72-19-5 | |
| Tryptophan | Acros Organics | 73-22-3 | Prepared in 0.2 M NaOH |
| Tyrosine | Alfa Aesar | A11141 | Prepared in 1.0 M NaOH |
| Valine | Acros Organics | 72-18-4 | |
| Antibiotic | |||
| Carbenicillin | Alfa Aesar | J6194903 | |
| Day-of Stocks | |||
| CaCl2 * 2H2O | Fisher Chemical | C79-500 | |
| Dextrose (D-glucose) | Fisher Chemical | 50-99-7 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Fisher (Avanti Polar Lipids) | 4235-95-4 | shake 15-20 min at 37 °C to evaporate chloroform |
| FeSO4 * 7H2O | Acros Organics | 7782-63-0 | this stock equals 1 mg/mL, MUST make fresh |
| L-lactic acid | Alfa Aesar | L13242 | pH stock to 7 with NaOH |
| MgCl2 * 6H2O | Acros Organics | 7791-18-6 | |
| N-acetylglucosamine | TCI | A0092 | |
| Prepared solids | |||
| Porcine mucin | Sigma | M1778-100G | UV-sterilize |
| Salmon sperm DNA | Invitrogen | 15632-011 | |
| Stain | |||
| Propidium iodide | Alfa Aesar | J66764MC | |
| Salts | |||
| K2SO4 | Alfa Aesar | A13975 | |
| KCl | Alfa Aesar | J64189 | add solid directly to buffered base |
| KNO3 | Acros Organics | 7757-79-1 | |
| MOPS | Alfa Aesar | A12914 | add solid directly to buffered base |
| NaCl | Fisher Chemical | S271-500 | add solid directly to buffered base |
| Na2HPO4 | RPI | S23100-500.0 | |
| NaH2PO4 | RPI | S23120-500.0 | |
| NH4Cl | Acros Organics | 12125-02-9 | add solid directly to buffered base |
| Consumables | |||
| Conical tubes (15 mL) | Olympus plastics | 28-101 | |
| Conical tubes (50 mL) | Olympus plastics | 28-106 | |
| Culture tubes w/air flow cap | Olympus plastics | 21-129 | |
| 35 mm four chamber glass-bottom dish | CellVis | NC0600518 | |
| Luria Bertani (LB) broth | Genessee Scientific | 11-118 | |
| Phosphate-buffered saline (PBS) | Fisher Bioreagents | BP2944100 | |
| Pipet tips (p200) | Olympus plastics | 23-150RL | |
| Pipet tips (p1000) | Olympus plastics | 23-165RL | |
| Serological pipets (5 mL) | Olympus plastics | 12-102 | |
| Serological pipets (25 mL) | Olympus plastics | 12-106 | |
| Serological pipets (50 mL) | Olympus plastics | 12-107 | |
| Ultrapure water (RNase/DNase free); nanopure water | Genessee Scientific | 18-194 | Nanopure water used for preparation of solutions in Table 1 |
| Syringes (10 mL) | BD | 794412 | |
| Syringes (50 mL) | BD | 309653 | |
| 0.22 mm PES syringe filter | Olympus plastics | 25-244 | |
| PS cuvette semi-mico | Olympus plastics | 91-408 | |
| Software | |||
| Biorender | To prepare the figures | ||
| FacsDiva6.1.3 | Becton Dickinson, San Jose, CA | ||
| Imaris | Bitplane | version 9.6 | |
| Zen Black | |||
| Equipment | |||
| FacsAriallu | Becton Dickinson, San Jose, CA | ||
| LSM 880 confocal laser scanning microscope | Zeiss |
References
- Ramsay, K. A., et al. The changing prevalence of pulmonary infection in with fibrosis: A longitudinal analysis. Journal of Cystic Fibrosis. 16 (1), 70-77 (2017).
- Bessonova, L., et al. Data from the US and UK cystic fibrosis registries support disease modification by CFTR modulation with ivacaftor. Thorax. 73 (8), 731-740 (2018).
- Breuer, O., et al. Changing prevalence of lower airway infections in young children with cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 200 (5), 590-599 (2019).
- O'Donnell, J. N., Bidell, M. R., Lodise, T. P. Approach to the treatment of patients with serious multidrug-resistant Pseudomonas aeruginosa infections. Pharmacotherapy. 40 (9), 952-969 (2020).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Darch, S. E., et al. Spatial determinants of quorum signaling in a Pseudomonas aeruginosa infection model. Proceedings of the National Academy of Sciences of the United States of America. 115 (18), 4779-4784 (2018).
- Zhu, K., Chen, S., Sysoeva, T. A., You, L. Universal antibiotic tolerance arising from antibiotic-triggered accumulation of pyocyanin in Pseudomonas aeruginosa. PLoS Biology. 17 (12), 3000573(2019).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and resistance of Pseudomonas aeruginosa biofilms to antimicrobial agents-how P. aeruginosa can escape antibiotics. Frontiers in Microbiology. 10, 913(2019).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proceedings of the National Academy of Sciences of the United States of America. 112 (13), 4110-4115 (2015).
- Darch, S. E., et al. Phage inhibit pathogen dissemination by targeting bacterial migrants in a chronic infection model. MBio. 8 (2), 00240(2017).
- Jorth, P., et al. Regional isolation drives bacterial diversification within cystic fibrosis lungs. Cell Host & Microbe. 18 (3), 307-319 (2015).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Davies, D. G., et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science. 280 (5361), 295-298 (1998).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Stacy, A., et al. Bacterial fight-and-flight responses enhance virulence in a polymicrobial infection. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7819-7824 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved