Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Pseudomonas aeruginosa Enfeksiyon Modelinin Gerçek Zamanlı Değerlendirilmesi için Araçlar
Bu Makalede
Özet
Sentetik kistik fibrozis balgam ortamı (SCFM2), bakteriyel agregaları yüksek çözünürlükte gözlemlemek için hem konfokal lazer tarama mikroskopisi hem de floresan ile aktive hücre sıralama ile birlikte kullanılabilir. Bu makalede, antimikrobiyal tedavi sırasında toplam popülasyonları gelecekteki çalışmalar için bir platform olarak değerlendirme yöntemleri ayrıntılı olarak açıklar.
Özet
Pseudomonas aeruginosa (Pa), kistik fibrozis (CF) ile ilişkili en yaygın fırsatçı patojenlerden biridir. Pa kolonizasyonu kurulduktan sonra, enfekte olan bakterilerin büyük bir kısmı hava yolu balgamının içinde biyofilmler oluşturur. CF balgamından izole edilen pa biyofilmlerinin, mekansal olarak organize edilmiş ve antimikrobiyal tolerans gibi klinik olarak ilgili fenotipler sergileyen ~10-1.000 hücrenin küçük, yoğun agregalarında büyüdüğü gösterilmiştir. Pa agregalarının değişen balgam ortamına nasıl tepki verdiğini incelemenin en büyük zorluklarından biri, agrega oluşumunu destekleyen besinsel olarak alakalı ve sağlam sistemlerin olmamasıdır. Sentetik bir CF balgam ortamı (SCFM2) kullanılarak, Pa agregalarının yaşam öyküsü konfokal lazer tarama mikroskopisi (CLSM) ve tek bir hücrenin çözünürlüğünde görüntü analizi kullanılarak gözlemlenebilir. Bu in vitro sistem, değişen büyüklükteki binlerce agreganın gerçek zamanlı, üç boyutlu ve mikron ölçeğinde gözlemlenmesine izin verir. Birey ve nüfus düzeylerinde, agregaları fenotip ve pozisyona göre gruplama yeteneğine sahip olmak, agregaların farklı gelişim aşamalarında gözlemlenmesine ve antibiyotik tedavisi gibi mikroçevrimdeki değişikliklere yanıtlarının hassasiyetle ayırt edilmesine kolaylaştırır.
Giriş
Pseudomonas aeruginosa (Pa), bağışıklık sistemi zayıf bireylerde kronik enfeksiyonlar oluşturan fırsatçı bir patojendir. Genetik hastalığı kistik fibrozis (CF) olanlar için, bu enfeksiyonlar ömür boyu sürebilir. CF, zaman içinde çeşitli mikrobiyal patojenler tarafından kolonize edilen hava yollarında viskoz, besin bakımından zengin bir balganın birikmesine neden olur. Pa, erken çocukluk döneminde hava yollarını kolonlaştıran ve tedavisi zor enfeksiyonlar kuran en yaygın CF patojenlerinden biridir1. Pa önemli bir klinik sorun olmaya devam ediyor ve son yıllarda iyileştirilmiş tedavi rejimlerine rağmen CF'lilerde önde gelen bir ölüm nedeni olarak kabul ediliyor2,3. Bu kalıcılık fenotipi ve artan antibiyotik toleransı, Pa'ya hem Hastalık Kontrol Merkezleri (CDC) hem de Dünya Sağlık Örgütü (WHO) tarafından yeni terapötik stratejilerin geliştirilmesi için araştırma öncelikleri olarak tanımlanan bir grup patojende yer kazandırdı-ESKAPE patojenleri4.
Diğer ESKAPE patojenleri gibi, edinilmiş antibiyotik direnci Pa'da yaygındır, ancak Pa antimikrobiyal toleransa katkıda bulunan birçok içsel özellik de vardır. Bunlar arasında Pa'nın CF hasta balgam 5,6dahil olmak üzere birden fazla enfeksiyonda gözlemlenebilen ~ 10-1.000 hücreden oluşan agregalar-son derece yoğun kümeler oluşturma yeteneği vardır. Diğer biyofilm sistemlerinde çalışılan Pa'ya benzer şekilde, Pa agregaları antibiyotiklere karşı direncin artması ve hücre-hücre iletişiminin aktivasyonu (çekirdek algılama (QS)) gibi klinik olarak ilgili fenotipler gösterir. Örneğin, Pa agregalarının diğer mikroplarla mücadele etmek ve piocyanin üretimi gibi antimikrobiyal tedavileri tolere etmek için QS tarafından düzenlenmiş davranışları kullandığı gösterilmiştir7. Bu tür davranışları inceleme yeteneği, insan vücudunda var olduklarına benzer bir ortamda bakteri ekosistemleri hakkında heyecan verici bir içgörü sunar.
Pa agregalarının değişen balgam ortamına nasıl tepki verdiğini incelemenin en büyük zorluklarından biri, agrega oluşumunu destekleyen besinsel olarak alakalı ve sağlam sistemlerin olmamasıdır. Pa hakkında bilinenlerin çoğu, hücrelerin planktonik olarak büyüdüğü in vitro sistemler kullanılarak veya in vivo8'degözlemlenmeyen karakteristik bir yüzeye bağlı "mantar" mimarisi kullanılarak keşfedilmiştir. Akış hücreleri veya katı agar gibi klasik biyofilm büyüme modelleri bakteriyel davranışlar ve antibiyotik tolerans mekanizmaları hakkında kapsamlı ve değerli bilgiler vermiş olsa da, bu bulgular her zaman in vivo olarak çevrilmez. Birçok in vitro model, insan enfeksiyon bölgesinin büyüme ortamını taklit etme yeteneğine sahiptir ve pahalı in vivo çalışmalar gerektirir. Buna karşılık, birçok in vivo model in vitro tekniklerin sağladığı esneklik ve çözünürlükten yoksundur.
Sentetik kistik fibrozis balgam (SCFM2), CF akciğerinde kronik enfeksiyon sırasında yaşananlara benzer pa büyümesi için bir ortam sağlamak üzere tasarlanmıştır. SCFM2, müsin, lipitler ve DNA'ya ek olarak balgam sputasında tanımlanan besin kaynaklarını içerir. SCFM2'deki pa büyümesi, gerçek balgamda büyüme için gerekene ayarlanmış neredeyse aynı geni gerektirir ve doğal Pa agrega oluşumunudestekler 9,10. Aşılamadan sonra, planktonik hücreler genişleme yoluyla boyutu artan agregalar oluşturur. Tek tek hücreler (göçmenler olarak adlandırılır) agregalardan serbest bırakılır, kavunlanmamış alanlara geçirilir ve yeni agregalaroluşturur 10. Bu yaşam öyküsü, tek bir hücrenin çözünürlüğünde CLSM ve görüntü analizi kullanılarak gözlemlenebilir. SCFM2'de oluşan Pa agregaları CF akciğer10'dagözlenenlere benzer boyutlardadır. Bu model, mikron ölçeğinde gerçek zamanlı ve üç boyutta değişen boyutta birden fazla agreganın gözlemlenmesine izin verir. Zaman atlamalı mikroskopi, bir deneyde binlerce (~50.000) agreganın izlenmesini sağlar. Görüntü analizi yazılımının kullanımı, toplam hacim, yüzey alanı ve konum dahil olmak üzere mikrograflardan agrega fenotiplerinin hem bireysel toplam hem de popülasyon seviyelerinde en yakın 0,1 μm'ye kadar üç boyutta ölçülmesine olanak tanır. Agregaları fenotip ve konuma göre gruplandırma yeteneğine sahip olmak, farklı gelişim aşamalarındaki agregaların hassasiyetle farklılaştırılmasına ve değişen bir mikroçevreme6,11'eyanıt vermelerine izin verir.
SCFM2'nin Pa agregalarını düşük hacimli ve yüksek verimli testlerde incelemek için uygulanması, onu esnek, uygun maliyetli bir model haline getirir. Tanımlanmış bir ortam olarak SCFM2, birden fazla platformda homojenlik ve tekrarlanabilirlik sunarak Pa agregalarını in vitro9'daincelemek için besinsel ve fiziksel olarak alakalı bir yöntem sağlar. Uygulamalar, mekansal organizasyonu ve antibiyotik toleransını yüksek çözünürlükte gözlemlemek için CLSM ile birlikte kullanılmasını içerir (bu yöntem makalesinde açıklandığı gibi). Gerçek zamanlı, mikron ölçeğinde veriler sağlayan deneyler yapabilme yeteneği, tür içi ve türler arası etkileşimlerin vivo olarak ortaya çıkabileceği şekilde incelenmesineizin verir. Örneğin, SCFM2 daha önce virülans ve patogenez6'yakatkıda bulunan birden fazla geni düzenlemek için Pa tarafından kullanılan bir sistem ağı aracılığıyla hücre-hücre iletişiminin toplam popülasyonlardaki mekansal dinamiklerini incelemek için kullanılmıştır.

Şekil 1: Ana deneysel adımların grafiksel tasviri. (A) SCFM2 Pa hücreleri ile aşılanır ve cam tabanlı bir kültür çanağı içinde agrega oluşturmasına izin verilir. (B) Agregalar konfokal mikroskopa aktarılır ve antibiyotik eklenir. Antibiyotik tedavisi olmadan üç teknik kopya (oda 1-3) ve aşılanmış SCFM2 kontrol kuyusu (4) tasvir edilir. Toplamlar 18 saat boyunca CLSM kullanılarak görüntülenir. Kısaltmalar: SCFM2 = sentetik kistik fibrozis balgam ortamı; Pa = Pseudomonas aeruginosa; CLSM = konfokal lazer tarama mikroskopisi; FACS = floresanla etkinleştirilen hücre sıralama. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Burada, SCFM2'nin antibiyotik tedavisinin Pa agregaları üzerindeki etkisini gerçek zamanlı olarak incelemek için faydası gösterilmiştir, ardından aşağı akış analizi için farklı fenotiplere sahip agrega popülasyonlarını izole etmek için bir hücre sıralama yaklaşımının kullanılması (Şekil 1).
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Sentetik kistik fibrozis ortamı (SCFM2) hazırlayın
NOT: SCFM2'nin hazırlanması aşağıda özetlenen üç ana aşamadan oluşur (Şekil 2). Tüm ayrıntılar ve referanslar içinbkz.
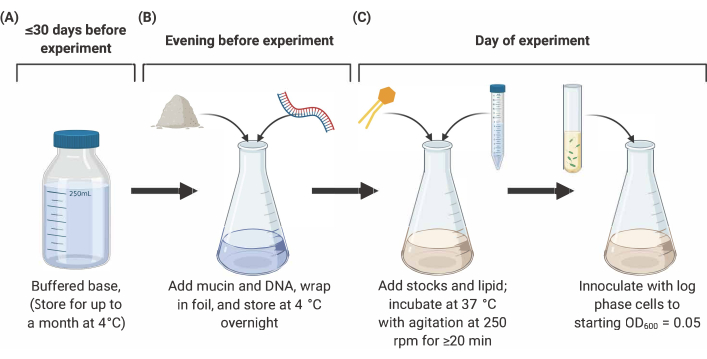
Şekil 2: SCFM2 ortamının hazırlanması ve aşılanma. (A) Tamponlu baz, Tablo 1 ve Tablo 2'delistelenen tuzlar ve amino asitler kullanılarak hazırlanır. Tamponlu taban 30 güne kadar 4 °C'de saklanabilir, ancak ışığa maruz kalmadan korunmalıdır. (B) Tamponlu baz aliquot'a mucin ve DNA eklenir ve bir gecede4 °C'de çözeltiye çözülür Lipid ve ek stoklar gece çözeltisine eklenir ve 20 dakika boyunca 250 rpm'de ajitasyon ile 37 °C'de inkübe edilir. Kısaltmalar: SCFM2 = sentetik kistik fibrozis balgam ortamı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Porcine mucin sterilizasyonu
- SCFM2'de 5 mg/mL'lik son konsantrasyonda steril mücin hazırlayın. Örneğin, 5 mL'lik bir SCFM2 hacmi için, steril bir Petri kabında 25 mg Tip II mucin tartın ve her saat hafifçe çalkalan 4 saat boyunca ultraviyole (UV) sterilizatöre yerleştirin.
- 4 saat sonra, UV ile işlenmiş mücinleri steril koşullar altında otoklavlanmış 1,7 mL tüplere aktarın ve -20 °C'de saklayın.
- Tam sterilizasyonu doğrulamak için, su veya Luria Bertani (LB) suyu gibi steril bir sıvıda bir mucin örneğini çözün ve mikroskop altında gözlemleyin.
NOT: Sterilize edilmiş mücin -20 °C'de 6 aya kadar saklanabilir.
- Tamponlu tabanın hazırlanması
- Tablo 1'de listelendiği gibi deiyonize suya ağırlık olarak uygun miktarları ekleyerek tuz ve amino asit stok çözeltileri hazırlayın. 0,22 μm filtre kullanarak tüm stok çözeltilerini filtreleyin, ışık bozulmasından korumak için folyoya sarın ve bir aya kadar 4 °C'de saklayın.
- Tablo1'de listelenen hacimlere göre 190 mL deiyonize suyu amino asit ve tuz stok çözeltileri ile birleştirerek tamponlu taban hazırlayın. Çözeltiyi pH 6.8'e ayarlayın ve 250 mL'lik son hacme yükseltin. 0,22 μm filtre kullanarak sterilize edin ve 4 °C'de 30 güne kadar saklayın.
- Deneyden önceki akşam, istenen miktarda tamponlanmış tabanı bir cam kültür şişesine aliquot ve mucin (adım 1.1.1'de açıklandığı gibi 5 mg / mL) ve saflaştırılmış somon sperm DNA'sı (0.6 mg / mL) ekleyin. Yavaşça çalkalayın, folyoya sarın ve mucin ve DNA'nın çözeltiye dönüşmesini sağlamak için bir gecede 4 °C'de bırakın.
NOT: Somon sperm DNA aliquots buz üzerinde çözülmeli, girdaplı ve tamponlu baz ve mücin eklenmelidir. Triptofan, kuşkonmaz ve tirozin stok çözeltileri deiyonize su yerine NaOH çözeltilerinde (konsantrasyonlar için Tablo 1'e bakınız) hazırlanmalıdır. Işık maruziyetinden korunmak için tamponlu tabanı ve tüm stok çözümlerini folyoya sarılmış tutun. Hisse senetlerinin çoğu bir aya kadar stabil olacak. Renksizleşen stoklar kullanılmamalı ve kullanılmadan önce değiştirilmelidir.
- Ek stokların eklenmesi
- Deney günü, Tablo 2'de listelenen hisse senetlerini mucin ve DNA içeren tamponlanmış tabana ekleyin.
NOT: Deney günü taze bir FeSO4 çözeltisi hazırlayın, ancak diğer tüm stoklar önceden yapılabilir ve 4 °C'de 30 gün saklanabilir. Dikkatli davranın ve açık alevlerin yakınında kullanmayın. DOPC'nin eklenmesinden sonra, SCFM2'yi 37 °C'de en az 20 dakika (5 mL kültür için) sallama (250 rpm) ile kuluçkaya yatırın. Bu kuluçka süresi, DOPC'deki kloroformun buharlaşmasını sağlar. Şişe hava geçirmez olmamalıdır; bunun yerine, şişe açıklığı folyo ile gevşek bir şekilde örtün.
- Deney günü, Tablo 2'de listelenen hisse senetlerini mucin ve DNA içeren tamponlanmış tabana ekleyin.
2. Bakteriyel agregalarda antimikrobiyal toleransın gerçek zamanlı değerlendirilmesi
- Gece kültürleri hazırlayın
- Deneyden önceki akşam, antibiyotik içeren bir LB agar plakasından (karbenisilin 300 μg / mL) pa PAO1-pMRP9-113 kolonileri ile 5 mL LB suyu aşıla. 37 °C'de 250 rpm'de ajitasyon ile bir gecede büyüyün.
NOT: Gerekli plazmidlerin seçimi için gerekli antibiyotiklerin eklenmesiyle gece kültürlerini büyütün (burada, yeşil floresan protein (GFP) ekspresyon plazmid, pMRP9-1). Pa hücrelerinin SCFM2 aşılanmadan önce yıkanacağını unutmayın. LB, gece kültürleri için diğer zengin laboratuvar ortamlarının yerine geçebilir. Tüm bakteriyel izolatlar bu protokol boyunca uygun BSL-2 yönergeleri kullanılarak ele alınmalıdır.
- Deneyden önceki akşam, antibiyotik içeren bir LB agar plakasından (karbenisilin 300 μg / mL) pa PAO1-pMRP9-113 kolonileri ile 5 mL LB suyu aşıla. 37 °C'de 250 rpm'de ajitasyon ile bir gecede büyüyün.
- AŞı SCFM2
- Deney günü, 500 μL'yi 5 mL taze LB suyuna aşılayarak Pa 1:10'un (kültür: sıvı ortam) geceleme kültürlerini geri seyreltin. 37 °C'de 250 rpm'de ajitasyon ile log fazı (60-90 dk) kadar hücreleri büyütün.
- 5 dakika boyunca 10.000 × g'da santrifüj kütük faz kültürleri. Süpernatantı çıkararak ve filtre sterilize edilmiş fosfat tamponlu salin (PBS, pH 7.0) 3 mL'de yeniden dirilterek hücreleri yıkayın. İki kez tekrarlayın ve peleti 1 mL PBS'lik son bir hacimde yeniden dirildi.
- 600 nm'de (OD 600) bir spektrofotometre kullanarak yıkanmış hücrelerin emiciliğini ölçün ve SCFM2'nin 5 mL'sinde0,05'in başlangıç OD 600'leri için gereken kültür hacmini hesaplayın. Pa'yı SCFM2'ye aşılayın ve hücreleri dağıtmak için yavaşça girdaplayın. Aşılanmış SCFM2'nin pipeti 1 mL'yi 4 kuyulu, cam alt, optik bir kabın her odasına yerleştirin ve 37 °C'de statik olarak 4 saat boyunca kuluçkaya yatırın.
NOT: Pa kültürlerinin iki katına çıkması, zorlanmaya ve oksijenin mevcudiyetine bağlıdır. SCFM2'de, burada açıklanan koşullar altında, Pa'nın iki katına çıkması ~ 1.4 h10 'dur.
3. Konfokal lazer tarama mikroskopisi (CLSM) ile antibiyotik tedavisi sırasında agregaların görselleştirilmesi
NOT: Bu bölümde, SCFM2'de Pa agregalarının görüntülenmesi için konfokal lazer tarama mikroskobu ve görüntü yakalama yazılımının kullanımı açıklanmaktadır. Amaç antibiyotiklerle tedaviden sonra kalan (hoşgörülü) bakteriyel biyokütleyi gözlemlemek ve karakterize etmektir. Belirtilen adımlar diğer konfokal mikroskoplarda başarıyla gerçekleştirilebilir, ancak cihaz kullanım kılavuzuna belirli bir kılavuz için başvurulmalıdır.
- 37 °C ortam sıcaklığını korumak için mikroskop aşamasına monte edilmiş ısıtmalı bir oda veya ısıtılmış bir mikro plaka kullanan Image Pa kültürleri. Tüm cihazların istenen sıcaklığa ulaşmasına izin vermek ve veri toplama sırasında daha fazla genişleme ve hareketi azaltmak için denemenin başlangıcından en az 2 saat önce Kuluçka modülunu başlatın.
- 4 saat sonra Pa hücrelerini içeren SCFM2 kültürlerini ısıtılmış mikroskop aşamasına aktarın. 4 kuyudan 3'ü antibiyotik tedavisi için teknik çoğaltmalar olarak belirleyin ve4'ü ve scfm2'de antibiyotik içermeyen sadece Pa hücrelerini içeren bir tedavisiz kontrol düşünün. Floresan muhabirlerin herhangi bir şekilde heyecanlanmadan önce Bul sekmesindeki brightfield mikroskopisini kullanarak agregaları tanımlayın. Her kuyuda görüntüleme için bir alan tanımlayın ve görüntüleme yazılımındaki Konumlar modülünü kullanarak konumunu (x-y-z koordinatları) saklayın.
- SCFM2'deki GFP ekspresyon plazmid pMRP9-1'i içeren Pa kültürlerini 488 nm'lik bir heyecan dalga boyu ve 509 nm emisyon dalga boyu ile görselleştirmek için 63x yağ daldırma hedefi kullanın. Edinme modülü içindeki z-stack seçeneğini kullanarak 1 μm aralıklarla (toplam 60 dilim) görüntü alın. 60 μm z-stack görüntülerin (1.093,5 mm3)toplam hacmi içinde GFP kanalındaki arka plan floresanını azaltmak için Hat ortalama modülini kullanın. Görüntü analizi için arka plan floresanını belirlemek için aynı ayarları kullanarak, uninoculated SCFM2'nin kontrol görüntülerini alın.
NOT: Görüntüler, kapak kapağının tabanından 60 μm olan 512 piksel x 512 piksel (0,26 μm x 0,26 μm piksel) 8 bit z-stack görüntüler üretilerek elde edilir. - 18 saatlik bir süre boyunca 15 dakikalık aralıklarla her konumda (kuyu) 60 dilim yakalamak için görüntüleme yazılımındaki zaman serisi seçeneğini kullanın. Deney boyunca her zaman noktasında döndürülen her pozisyon için bir odak düzlemi depolamak için yazılım içindeki kesin odak stratejisini kullanın.
- Toplam 4,5 saat inkübasyondan sonra, antibiyotik eklenmeden önce dört kuyunun her birinde toplam biyokütleyi belirlemek için yukarıdaki ayarları kullanarak her pozisyonu görüntüleyin.
- Toplam inkübasyondan 6 saat sonra, her bir kopyaya minimum inhibitör konsantrasyonun (MIC) 2 kat altında antibiyotik ekleyin. Pipet doğrudan ve yavaşça kuyunun ortasına, hava-sıvı ara fazının hemen altına. Isıtılmış konfokal haznede tüm kültürleri koruyun.
NOT: Burada 140 μg/mL konsantrasyonda colistin sülfat kullanılmıştır. - Görüntüleme programı içindeki Deneyi Başlat seçeneğine tıklayarak antibiyotik sonrası tedaviyi görüntülemeye başlayın.
NOT: Kullanılan antibiyotik konsantrasyonu antibiyotiğe, Pa izolatuna ve kullanıcının öldürme veya tolerans etkilerini incelemek isteyip istemediğine bağlıdır. Bu deneyde tek doz var. Gerekirse kültürleri bozmadan ek dozlar eklenebilir.
4. Pa agregalarının propidium iyodür lekesi
NOT: Propidium iyodür (PI), kültürde canlı olmayan (ölü) bakteri hücrelerini tanımlamak için genellikle bir boyama reaktifi olarak kullanılır. Burada bölüm 3'te uygulanan antibiyotik tedavisine duyarlı agregaları tanımlamak için kullanılır. Bu protokol boyunca, Pa hücrelerinde GFP'nin ifadesi ve algısı hücre canlılığı için ana proxy olarak kullanılır. Bu son adım, canlı/ölü agregaların birbirleriyle ilişkili uzamsal konumlarını tanımlamak için konfokal görüntülemenin bir kez daha kullanılmasına izin verir. Ayrıca, bölüm 5'te daha fazla aşağı akış hücre sıralama için agregalar canlı/ölü olarak tanımlanır.
- 18 saat sonra, SCFM2 kültürleri içeren dört odalı optik alt çanağın her kuyusuna PI ekleyin. Pi hacmi ve kuluçka süresi için üreticinin talimatlarını izleyin(örneğin,kültür mL başına ~2 μL, ~20-30 dk).
5. FACS yaklaşımı kullanarak canlı hücreleri agregalardan izole etme
NOT: FACS, floresan etiketli bir fenotipe göre hücre gruplarını sıralamak ve izole etmek için güçlü bir platform sunar. Burada, FACS canlı (antibiyotik hoşgörülü) agregaları canlı olmayan agregalardan izole etmek için kullanılır.
- Propidium iyodür ile boyandıktan sonra, kültürleri kuluçkadan çıkarın ve 37 °C'yi korumak için yalıtımlı bir kaptaki bir FACS cihazına aktarın.
- Pa agregalarını içeren SCFM2'nin 1 mL aliquots'larını en düşük akış hızında çalıştırın.
NOT: Her aliquot ~15.000 toplama içerir. - GFP'yi tespit etmek için hücreleri 488 nm lazerle aydınlatın ve floresan sinyal yüksekliğini 530/30 nm'de kaydedin. PI boyamayı 561 nm lazerle heyecanlandırarak görselleştirin ve floresan sinyal yüksekliğini 610/20 nm'de kaydedin. 70-u nozül kullanarak sıralama gerçekleştirin.
NOT: Sıralanmış toplamalar, kullanıcının uygulamasına bağlı olarak birden çok şekilde bir araya toplanabilir. Bu durumda, FACS aşağı akış RNA dizilimi için uygulanabilir Pa agregalarını sıralamak için kullanılmıştır. Alternatif uygulamalar aşağıda tartışılmıştır.
6. Görüntü analizi
NOT: Zaman atlamalı mikroskopi büyük miktarda veri üretir. SCFM2'deki Pa agregalarının gözlemlenmesi için yapılan 18-h deneyi, zaman içinde hacim ve uzamsal konumlandırma için karakterize edileme potansiyeline sahip ~50.000 agregayı tanımlar. SCFM2'de toplama dinamiklerini ölçmek için bir görüntü analizi yazılımı kullanın:
- SCFM2'deki toplu çalışmalar için, GFP kanalında, pMRP9-1 taşıyan Pa strain PAO1 ile aşılanmış, uninokülasyonsuz SCFM2 ve SCFM2 için üretilen sayımların bir histogramını oluşturarak arka plan GFP floresanını ölçün. Algılanan GFP voksellerinin Pa biyokütlesi ile ilişkili olduğundan emin olmak için, GFP+ vokselini GFP arka plan sayısı değerinin 1,5 kat ≥ olarak tanımlayın.
NOT: Arka plan floresan, ortalama olarak rastgele seçilen üç pozisyonun en yüksek voksel değeri olarak tanımlanır. Arka plan sayıları, standart bir ölçü olarak, görüntü analizi yazılımı tarafından deneysel görüntülerdeki tüm piksellerden çıkarılır. - Surpass modülünde arka plan çıkarmadan sonra, kalan tüm vokseller için izosurfaces üretin.
- Tek tek toplamaları algılamak için Nesneleri Böl seçeneğini etkinleştirin ve toplamları ≥5 μm3hacimli nesneler olarak tanımlayın. Her bir nesne için GFP voksellerinin hacmini, x-y-z'sini ve toplamını hesaplamak için görüntü çözümleme yazılımındaki Vantage modülünü kullanın. Bu verileri harici bir istatistik platformuna verin.
NOT: Bazı görüntü analizi yazılımları, aynı anda birden fazla nicel fentoipsin dışa aktarmasına izin vererek korelasyonların hesapılmasına izin verir. - Vantage modülünden dışa aktarılan verileri boyuta göre filtreleyin ve <0,5 μm3 (dağınık biyokütle) nesne kalmadığından emin olun. Görüntü içindeki her bir nesne için, görüntü çözümleme yazılımının Vantage modülünü kullanarak veya aşağıdaki denklemle el ile diğer nesnelere (toplamalar) göre kendisinden uzaklığı hesaplayın.
d = karekt((x2− x1)2 + (y2−y 1)2 + (z2− z1)2) (1) - Toplam biyokütleyi ve ortalama toplam hacmi bulmak için TOPLA ve ORTALAMA hesaplamalarını kullanın. Alternatif olarak, verileri diğer istatistiksel platformlara veya komut dosyalarına dışa aktarın, örneğin,temsili sonuçlarda tartışıldığı gibi toplamların biyokütleye dağılımı (Whiteley laboratuvarı, Georgia Teknoloji Enstitüsü ile işbirliği içinde yayınlanmamış komut dosyası).
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu çalışma, Pa agregalarını yüksek çözünürlükte ve CF akciğer 9 ,10,12'nin kronik enfeksiyonuna benzer bir ortamda gözlemleme yöntemlerinidetaylandırıyor. SCFM2, Pa hücrelerinin gerçek enfeksiyon sırasında gözlemlenenlere benzer boyutlarda doğal olarak toplanmasını destekleyen bir in vitro sistem sağlar10. SCFM2'nin tanımlanmış bir ortam olarak uyarla...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu çalışma, antibiyotik tedavisinin varlığında ve yokluğunda bakteriyel agrega popülasyonlarını incelemek için birleştirilebilen metodolojileri getirmiştir. Yüksek çözünürlüklü CLSM, agrega biyokütleslerindeki değişikliklerin görselleştirilmesine ve antibiyotiklere maruz kaldığında agregaların gerçek zamanlı olarak yapısal yönelimine olanak tanır. Ek olarak, antibiyotiklerle tedaviden sonra kalan biyokütlenin fiziksel ve yapısal özellikleri, bu gözlemleri RNA-seq kullanarak gelecekte...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların çıkar çatışması yoktur.
Teşekkürler
S.E.D, Güney Florida Üniversitesi Moleküler Tıp Bölümü tarafından sağlanan başlangıç fonlarının yanı sıra CFF araştırma hibesi (DARCH19G0) N.I.H (5R21AI147654 - 02 (PI, Chen)) ve USF Mikrobiyom enstitüsü tarafından desteklenmektedir. Whiteley laboratuvarına bu makaleyle ilgili veri setlerini içeren devam eden işbirliği için teşekkür ederiz. Dr. Charles Szekeres'e FACS sıralamasını kolaylaştıran için teşekkür ederiz. Rakamlar A.D.G ve S.E.D tarafından Biorender.com kullanılarak oluşturulmuştur.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amino acids | |||
| Alanine | Acros Organics | 56-41-7 | |
| Arginine HCl | MP | 1119-34-2 | |
| Asparagine | Acros Organics | 56-84-8 | Prepared in 0.5 M NaOH |
| Cystine HCl | Alfa Aesar | L06328 | |
| Glutamic acid HCl | Acros Organics | 138-15-8 | |
| Glycine | Acros Organics | 56-40-6 | |
| Histidine HCl H2O | Alfa Aesar | A17627 | |
| Isoleucine | Acros Organics | 73-32-5 | |
| Leucine | Alfa Aesar | A12311 | |
| Lysine HCl | Alfa Aesar | J62099 | |
| Methionine | Acros Organics | 63-68-3 | |
| Ornithine HCl | Alfa Aesar | A12111 | |
| Phenylalanine | Acros Organics | 63-91-2 | |
| Proline | Alfa Aesar | A10199 | |
| Serine | Alfa Aesar | A11179 | |
| Threonine | Acros Organics | 72-19-5 | |
| Tryptophan | Acros Organics | 73-22-3 | Prepared in 0.2 M NaOH |
| Tyrosine | Alfa Aesar | A11141 | Prepared in 1.0 M NaOH |
| Valine | Acros Organics | 72-18-4 | |
| Antibiotic | |||
| Carbenicillin | Alfa Aesar | J6194903 | |
| Day-of Stocks | |||
| CaCl2 * 2H2O | Fisher Chemical | C79-500 | |
| Dextrose (D-glucose) | Fisher Chemical | 50-99-7 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Fisher (Avanti Polar Lipids) | 4235-95-4 | shake 15-20 min at 37 °C to evaporate chloroform |
| FeSO4 * 7H2O | Acros Organics | 7782-63-0 | this stock equals 1 mg/mL, MUST make fresh |
| L-lactic acid | Alfa Aesar | L13242 | pH stock to 7 with NaOH |
| MgCl2 * 6H2O | Acros Organics | 7791-18-6 | |
| N-acetylglucosamine | TCI | A0092 | |
| Prepared solids | |||
| Porcine mucin | Sigma | M1778-100G | UV-sterilize |
| Salmon sperm DNA | Invitrogen | 15632-011 | |
| Stain | |||
| Propidium iodide | Alfa Aesar | J66764MC | |
| Salts | |||
| K2SO4 | Alfa Aesar | A13975 | |
| KCl | Alfa Aesar | J64189 | add solid directly to buffered base |
| KNO3 | Acros Organics | 7757-79-1 | |
| MOPS | Alfa Aesar | A12914 | add solid directly to buffered base |
| NaCl | Fisher Chemical | S271-500 | add solid directly to buffered base |
| Na2HPO4 | RPI | S23100-500.0 | |
| NaH2PO4 | RPI | S23120-500.0 | |
| NH4Cl | Acros Organics | 12125-02-9 | add solid directly to buffered base |
| Consumables | |||
| Conical tubes (15 mL) | Olympus plastics | 28-101 | |
| Conical tubes (50 mL) | Olympus plastics | 28-106 | |
| Culture tubes w/air flow cap | Olympus plastics | 21-129 | |
| 35 mm four chamber glass-bottom dish | CellVis | NC0600518 | |
| Luria Bertani (LB) broth | Genessee Scientific | 11-118 | |
| Phosphate-buffered saline (PBS) | Fisher Bioreagents | BP2944100 | |
| Pipet tips (p200) | Olympus plastics | 23-150RL | |
| Pipet tips (p1000) | Olympus plastics | 23-165RL | |
| Serological pipets (5 mL) | Olympus plastics | 12-102 | |
| Serological pipets (25 mL) | Olympus plastics | 12-106 | |
| Serological pipets (50 mL) | Olympus plastics | 12-107 | |
| Ultrapure water (RNase/DNase free); nanopure water | Genessee Scientific | 18-194 | Nanopure water used for preparation of solutions in Table 1 |
| Syringes (10 mL) | BD | 794412 | |
| Syringes (50 mL) | BD | 309653 | |
| 0.22 mm PES syringe filter | Olympus plastics | 25-244 | |
| PS cuvette semi-mico | Olympus plastics | 91-408 | |
| Software | |||
| Biorender | To prepare the figures | ||
| FacsDiva6.1.3 | Becton Dickinson, San Jose, CA | ||
| Imaris | Bitplane | version 9.6 | |
| Zen Black | |||
| Equipment | |||
| FacsAriallu | Becton Dickinson, San Jose, CA | ||
| LSM 880 confocal laser scanning microscope | Zeiss |
Referanslar
- Ramsay, K. A., et al. The changing prevalence of pulmonary infection in with fibrosis: A longitudinal analysis. Journal of Cystic Fibrosis. 16 (1), 70-77 (2017).
- Bessonova, L., et al. Data from the US and UK cystic fibrosis registries support disease modification by CFTR modulation with ivacaftor. Thorax. 73 (8), 731-740 (2018).
- Breuer, O., et al. Changing prevalence of lower airway infections in young children with cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 200 (5), 590-599 (2019).
- O'Donnell, J. N., Bidell, M. R., Lodise, T. P. Approach to the treatment of patients with serious multidrug-resistant Pseudomonas aeruginosa infections. Pharmacotherapy. 40 (9), 952-969 (2020).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Darch, S. E., et al. Spatial determinants of quorum signaling in a Pseudomonas aeruginosa infection model. Proceedings of the National Academy of Sciences of the United States of America. 115 (18), 4779-4784 (2018).
- Zhu, K., Chen, S., Sysoeva, T. A., You, L. Universal antibiotic tolerance arising from antibiotic-triggered accumulation of pyocyanin in Pseudomonas aeruginosa. PLoS Biology. 17 (12), 3000573(2019).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and resistance of Pseudomonas aeruginosa biofilms to antimicrobial agents-how P. aeruginosa can escape antibiotics. Frontiers in Microbiology. 10, 913(2019).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proceedings of the National Academy of Sciences of the United States of America. 112 (13), 4110-4115 (2015).
- Darch, S. E., et al. Phage inhibit pathogen dissemination by targeting bacterial migrants in a chronic infection model. MBio. 8 (2), 00240(2017).
- Jorth, P., et al. Regional isolation drives bacterial diversification within cystic fibrosis lungs. Cell Host & Microbe. 18 (3), 307-319 (2015).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Davies, D. G., et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science. 280 (5361), 295-298 (1998).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Stacy, A., et al. Bacterial fight-and-flight responses enhance virulence in a polymicrobial infection. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7819-7824 (2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır