JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
슈도모나스 아에루기노사 감염 모델의 실시간 평가를 위한 도구
요약
합성 낭포성 섬유증 가래 배지(SCFM2)는 공초점 레이저 스캐닝 현미경 검사 및 형광 활성화 세포 분류와 함께 사용하여 고해상도에서 세균 응고체를 관찰할 수 있다. 이 논문은 향후 연구를 위한 플랫폼으로서 항균 치료 중 집계 인구를 평가하는 방법을 자세히 설명합니다.
초록
슈도모나스 아에루기노사(Pa)는 낭포성 섬유증(CF)과 관련된 가장 흔한 기회성 병원균 중 하나입니다. 일단 Pa 식민지가 확립되면, 감염박테리아의 큰 비율은 기도 가래 내의 생물막을 형성합니다. CF 가래로부터 분리된 Pa 생물막은 공간적으로 조직되고 항균 내성과 같은 임상적으로 관련된 표현형을 나타내는 ~ 10-1,000개의 세포의 작고 조밀한 응집체에서 성장하는 것으로 나타났습니다. Pa aggregates가 변화하는 가래 환경에 어떻게 반응하는지 연구하는 가장 큰 과제 중 하나는 집계 형성을 촉진하는 영양적으로 관련성이 있고 견고한 시스템이 부족하다는 것입니다. 합성 CF 가래 매체(SCFM2)를 사용하여 Pa 골재의 수명 기록은 단일 셀의 해상도에서 공초점 레이저 스캐닝 현미경 검사(CLSM) 및 이미지 분석을 사용하여 관찰될 수 있다. 이 체외 계통은 실시간으로, 3 차원, 그리고 미크론 규모에 다양한 크기의 집계의 수천의 관찰을 할 수 있습니다. 개인 및 인구 수준에서, 표현형 및 위치에 의해 골재를 그룹화하는 능력을 갖는 것은 다른 발달 단계에서 골재의 관찰과 항생제 치료와 같은 미세 환경의 변화에 대한 반응을 정밀하게 분화할 수 있도록 용이하게 한다.
서문
슈도모나스 아에루기노사(Pa)는 면역이 손상된 개인에 있는 만성 감염을 설치하는 기회성 병원체입니다. 유전 질환 낭포성 섬유증 (CF)을 가진 사람들을 위해, 이 감염은 일생의 과정을 걸이 수 있습니다. CF는 시간이 지남에 따라 다양한 미생물 병원균에 의해 식민지화되는 기도에 점성영양이 풍부한 가래의 축적을 유발합니다. Pa는 가장 널리 퍼진 CF 병원체 중 하나이며, 어린 시절에 기도를 식민지화하고 치료하기 어려운 감염1을확립합니다. Pa는 중요한 임상 문제로 남아 있으며 최근2,3에서개선 된 치료 요법에도 불구하고 CF를 가진 사람들의 사망의 주요 원인으로 간주됩니다. 이러한 지속성 표현형과 항생제 내성이 증가하는 Pa는 새로운 치료 전략인 ESKAPE 병원균4의개발을 위한 연구 우선 순위로서 질병통제센터(CDC)와 세계보건기구(WHO)에 의해 확인된 병원균 군에서 Pa를 한 자리에 얻었다.
다른 ESKAPE 병원체와 마찬가지로, 취득한 항생제 내성은 Pa에서일반적이지만 Pa 항균 내성에도 기여하는 많은 본질적인 특성이 있습니다. 이들 중에서도 PA가 CF 환자 가래5,6을포함하여 다중 감염에서 관찰될 수 있는 ~10-1,000개의 세포의 고밀도 클러스터를 형성하는 능력이 있다. 다른 생물막 시스템에서 연구된 Pa 와 마찬가지로, Pa 골재는 항생제에 대한 내성 증가 및 세포 세포 통신의 활성화(쿼럼 센싱(QS)와 같은 임상적으로 관련된 표현형을 표시합니다. 예를 들어, Pa의 골재는 다른 미생물에 대항하고 피오시닌7의생산과 같은 항균 치료를 용인하기 위해 QS 조절 된 행동을 사용하는 것으로 나타났습니다. 이러한 행동을 연구하는 능력은 인체에 존재하는 것과 유사한 환경에서 세균 생태계에 대한 흥미로운 통찰력을 제공합니다.
Pa aggregates가 변화하는 가래 환경에 어떻게 반응하는지 연구하는 가장 큰 과제 중 하나는 집계 형성을 촉진하는 영양적으로 관련성이 있고 견고한 시스템이 부족하다는 것입니다. Pa에 대해 알려진 많은 것은 세포가 플랑크톤또는 생체 내에서 관찰되지 않은 특징적인 표면 부착된 "버섯" 아키텍처에서 자라는 체외 시스템을 사용하여 발견되었습니다. 유량 세포 또는 고체 천과 같은 고전적인 생물 막 성장 모델은 세균성 행동과 항생제 내성의 메커니즘에 대한 광범위하고 귀중한 지식을 산출했지만, 이러한 사실 인정은 항상 생체 내에서 번역되지 않습니다. 많은 시험관 내 모델은 인간 감염 부위의 성장 환경을 모방하는 제한된 능력을 가지고 있으며 생체 내 연구에 비용이 많이 듭니다. 차례로, 많은 생체 내 모델은 시험관 내 기술에 의해 제공되는 유연성과 해상도가 부족합니다.
합성 낭포성 섬유증 가래 (SCFM2)는 CF 폐에서 만성 감염 시 경험한 것과 유사한 Pa 성장을위한 환경을 제공하도록 설계되었습니다. SCFM2에는 뮤신, 지질 및 DNA 외에도 예상되는 CF 스푸타에서 확인된 영양 공급원이 포함됩니다. SCFM2의 Pa 성장은 실제 가래의 성장에 필요한 거의 동일한 유전자를 필요로 하며 천연 Pa 골재 형성9,10을지원합니다. 접종 후, 판자 세포는 확장을 통해 크기가 증가하는 응집체를 형성합니다. 개별 셀(이민자라고 함)은 골재에서 방출되고, 콜로니언 영역으로 마이그레이션하고, 새로운골재(10)를형성한다. 이러한 생명 기록은 단일 셀의 해상도에서 CLSM 및 이미지 분석을 사용하여 관찰할 수 있습니다. SCFM2에서 형성된 Pa의 응집체는 CF폐(10)에서관찰된 것과 유사한 크기이다. 이 모델을 사용하면 미크론 스케일에서 실시간으로 다양한 크기의 여러 응집체를 실시간으로 3차원에서 관찰할 수 있습니다. 시간 경과 현미경 검사법은 한 실험에서 수천(~50,000개)의 응집체를 추적할 수 있게 해줍니다. 이미지 분석 소프트웨어를 사용하면 개별 집계 및 인구 수준에서 가장 가까운 0.1 μm에 대한 3차원의 집계 부피, 표면적 및 위치를 포함하여 현미경 그래프에서 집계 표현형의 정량화를 허용합니다. 표현형 및 위치에 의해 응집체를 그룹화할 수 있는 능력을 갖는 것은 변화하는 마이크로환경에 대한 반응뿐만 아니라 변화하는 마이크로환경에 대한 반응뿐만 아니라 정밀하게 다른 발달 단계에서 골재를 분화할 수 있게 한다6,11.
SCFM2를 적용하여 낮은 볼륨과 높은 처리량 분석으로 Pa 집계를 연구하면 유연하고 비용 효율적인 모델이 됩니다. 정의된 매체로서 SCFM2는 여러 플랫폼에서 균일성과 재현성을 제공하여 체외9에서 Pa 골재를 연구하는 영양및 신체적 관련 방법을 제공합니다. 응용 프로그램은 CLSM과 함께 고해상도에서 공간 조직 및 항생제 내성을 관찰하는 사용을 포함한다 (이 방법 종이에 설명된 바와 같이). 실시간 미크로네 규모의 데이터를 제공하는 실험을 수행하는 능력은 생체 내에서 발생할 수 있는 종 내 및 종 간 상호 작용에대한 연구를 가능하게 합니다. 예를 들어, SCFM2는 이전에 Pa가 이용한 시스템 네트워크를 통해 복합 체내 통신의 공간 역학을 연구하여 독성 및 발병률6에기여하는 다중 유전자를 조절하는 데 사용되어 왔다.

그림 1: 주요 실험 단계의 그래픽 묘사. (A)SCFM2는 Pa 세포로 접종되어 유리 바닥 배양 접시에 골재를 형성할 수 있습니다. (B)골재는 공초점 현미경으로 옮겨지고 항생제가 첨가된다. 묘사된 3개의 기술 복제(챔버 1-3) 및 항생제 처리 없이 접종된 SCFM2의 제어 우물(4)이 묘사된다. 골재는 18h.(C)초기 18h 이미징 후 CLSM을 사용하여 이미지화되며, 골재는 죽은 세포를 시각화하기 위해 프로피듐 요오드로 처리되고 CLSM(D) 원하는 표현형을 사용한 골재는 FACS를 사용하여 SCFM2로부터 분리된다. 약어: SCFM2 = 합성 낭포성 섬유증 가래 배지; Pa = 슈도모나스 아루기노사; CLSM = 공초점 레이저 스캐닝 현미경 검사; FACS = 형광 활성화 셀 정렬. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
여기서, SCFM2의 실용성은 실시간으로 Pa 골재에 대한 항생제 치료의 영향을 연구하는 것이 입증되고, 다운스트림 분석을 위한 뚜렷한 표현형을 가진 골재의 집단을 격리하기 위한 세포 선별 접근법의 사용(그림1).
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 합성 낭포성 섬유증 물질 준비 (SCFM2)
참고: SCFM2의 준비는 아래에 설명된 세 가지 주요 단계로구성됩니다(그림 2). 자세한 내용 및 참조는9,10,12를참조하십시오.
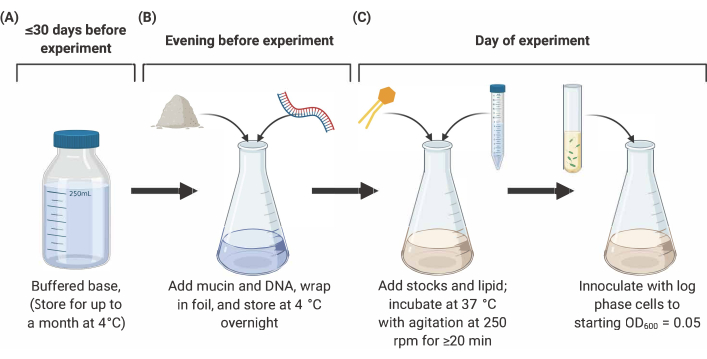
그림 2: SCFM2 매체의 준비 및 접종. (A)완충염염은 표 1과 표 2에나열된 염과 아미노산을 사용하여 제조된다. 완충 된 베이스는 최대 30 일 동안 4 °C에 저장할 수 있지만 빛 노출로부터 보호해야합니다. (B)Mucin 및 DNA는 완충염염의 알리쿼트에 첨가되어4°C(C)지질 및 추가 재고를 하룻밤 사이에 용액에 첨가하고 20분 동안 250rpm에서 교반하여 37°C에서 배양된다. SFCM2는 이어서 6000=050.05의 세척, 로그 상 세포로 접종된다. 약어: SCFM2 = 합성 낭포성 섬유증 가래 배지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 돼지 무신의 살균
- SCFM2에서 5 mg/mL의 최종 농도로 멸균 뮤신을 준비합니다. 예를 들어, SCFM2의 5mL 부피의 경우, 멸균 페트리 접시에 25 mg의 타입 II 뮤신을 계량하고, 4시간 동안 자외선(UV) 멸균기에 넣고 매시간 부드럽게 교반합니다.
- 4 시간 후, UV 처리 된 뮤신을 멸균 조건하에서 1.7 mL 튜브로 옮기고 -20 °C에 보관하십시오.
- 완전한 살균을 확인하기 위해 물이나 루리아 베르타니 (LB) 국물과 같은 멸균 액체에 뮤신 샘플을 용해하고 현미경으로 관찰하십시오.
참고: 멸균 된 뮤신은 최대 6 개월 동안 -20 °C에서 보관 할 수 있습니다.
- 버퍼링된 베이스의 준비
- 표 1에나열된 바와 같이 염분 및 아미노산 스톡 솔루션을 중량별로 적정량을 탈온수에 첨가하여 준비한다. 0.22 μm 필터를 사용하여 모든 스톡 용액을 필터 살균하고, 호일에 싸서 빛의 분해로부터 보호하고, 최대 1개월 동안 4°C에 보관하십시오.
- 표1에 나열된 부피로 190mL의 산화수와 아미노산 및 염분 스톡 솔루션을 결합하여 완충된 베이스를 준비한다. 솔루션을 pH 6.8로 조정하고 최종 부피가 250mL로 증가합니다. 0.22 μm 필터를 사용하여 필터 살균하고 최대 30일 동안 4°C에 보관하십시오.
- 실험 전 저녁에, 유리 배양 플라스크에 완충된 염기의 원하는 양을 알리쿼트하고, mucin (단계 1.1.1에 설명된 대로 5 mg/mL) 및 정제 연어 정자 DNA(0.6 mg/mL)를 첨가한다. 부드럽게 동요하고 호일로 감싸고 하룻밤 사이에 4°C로 방치하여 뮤신과 DNA가 용액으로 녹을 수 있도록 합니다.
참고 : 연어 정자 DNA 알리쿼트는 얼음에 해동, 소용돌이, 완충 된 기지와 뮤신에 추가해야합니다. 트립토판, 아스파라진 및 티로신 재고 솔루션은 탈온화 된 물 대신 NaOH (농도에 대한 표 1 참조)의 솔루션으로 준비해야합니다. 버퍼링된 베이스와 모든 스톡 솔루션을 포일로 감싸서 광 노출로부터 보호하십시오. 대부분의 주식은 최대 한 달 동안 안정될 것입니다. 변색된 주식은 사용해서는 안 되며 사용하기 전에 교체해야 합니다.
- 추가 주식 추가
- 실험 당일 표 2에 나열된 주식을 뮤신과 DNA를 포함하는 완충된 베이스에 추가합니다.
참고: 실험 당일 신선한 FeSO4 용액을 준비하지만, 다른 모든 주식은 4°C. 1,2-디오레오틸-센-글리세로-3-인포콜린(DOPC)에 30일 동안 저장되어 클로로폼을 함유하고 있다. 조심스럽게 처리하고, 화염 근처에 사용하지 마십시오. DOPC를 추가한 후, SCFM2를 37°C에서 37°C에서 흔들림(250rpm)으로 적어도 20분(5mL 배양용)으로 배양한다. 이 잠복기는 DOPC의 클로로폼이 증발할 수 있게 한다. 플라스크는 밀폐되어서는 안됩니다. 대신 플라스크 개구부를 호일로 느슨하게 덮습니다.
- 실험 당일 표 2에 나열된 주식을 뮤신과 DNA를 포함하는 완충된 베이스에 추가합니다.
2. 세균성 골재에서 항균 내성의 실시간 평가
- 하룻밤 문화 준비
- 실험 전날 저녁에는 항생제(카베니실린 300 μg/mL)를 함유한 LB 한천판에서 Pa PAO1-pMRP9-13의 여러 콜로니를 함유한 LB 국물의 5mL를 접종한다. 250 rpm에서 동요와 함께 37 °C에서 하룻밤 성장.
참고: 필요한 플라스미드의 선택에 필요한 항생제를 첨가하여 하룻밤 문화를 성장시다(여기, 녹색 형광 단백질(GFP) 발현 플라스미드, pMRP9-1). Pa 셀은 SCFM2가 접종되기 전에 세척되어야 합니다. LB는 하룻밤 문화에 대 한 다른 풍부한 실험실 미디어대체 될 수 있습니다. 모든 세균 성 격리는이 프로토콜 전반에 걸쳐 적절한 BSL-2 지침을 사용하여 처리되어야한다.
- 실험 전날 저녁에는 항생제(카베니실린 300 μg/mL)를 함유한 LB 한천판에서 Pa PAO1-pMRP9-13의 여러 콜로니를 함유한 LB 국물의 5mL를 접종한다. 250 rpm에서 동요와 함께 37 °C에서 하룻밤 성장.
- 접종 SCFM2
- 실험 당일, 500 μL을 신선한 LB 국물에 500 μL을 접종하여 Pa 1:10 (문화: 액체 매체)의 하룻밤 문화를 백 희석시. 250 rpm에서 교반과 37 °C에서 로그 단계 (60-90 분)까지 세포를 성장.
- 원심분리기 로그 위상 배양은 5분 동안 10,000 × g로 배양합니다. 필터 멸균 인산염 완충식 식염수(PBS, pH 7.0)의 3mL에서 상체를 제거하고 재연하여 세포를 세척한다. 두 번 반복하고, PBS의 1 mL의 최종 볼륨에서 펠릿을 다시 중단.
- 600nm(OD600)에서분광계를 이용하여 세척된 세포의 흡광도를 측정하고, SCFM2의 5mL에서 0.05의 시작 OD600에 필요한 배양량을 계산한다. SCFM2에 Pa를 접종하고, 소용돌이를 부드럽게 통해 세포를 분배합니다. 피펫 1 mL의 접종된 SCFM2는 4웰, 유리 바닥, 광학 접시의 각 챔버로 37°C에서 정적으로 4h에 대한 배양한다.
참고: Pa 문화의 두 배 시간은 긴장과 산소의 가용성에 따라 달라집니다. SCFM2에서, 여기에 설명된 조건하에서, Pa의 두 배 시간은 ~1.4h10이다.
3. 공초점 레이저 스캐닝 현미경 검사 (CLSM)로 항생제 치료 중 골재 시각화
참고: 이 섹션에서는 SCFM2에서 Pa 골재 의 이미징을 위한 공초점 레이저 스캐닝 현미경 및 이미지 캡처 소프트웨어의 사용을 설명합니다. 목표는 항생제로 치료 한 후 나머지 (관용) 세균 바이오 매스를 관찰하고 특성화하는 것입니다. 설명된 단계는 다른 공초점 현미경에서 성공으로 수행 될 수 있지만, 악기 작동 매뉴얼은 특정 지침을 참조해야하지만.
- 이미지 Pa 배양은 37°C의 주변 온도를 유지하기 위해 현미경 단계에 장착된 가열된 챔버 또는 가열된 마이크로플레이트를 사용하여 배양한다. 실험 시작 2시간 전에 인큐베이션 모듈을 시작하여 모든 장치가 원하는 온도에 도달할 수 있도록 하고, 데이터 수집 시 추가 팽창 및 움직임을 줄입니다.
- 4시간 후, 파 세포를 함유하는 SCFM2 배양을 가열된 현미경 단계로 이송한다. 4개의 우물 중 3개를 항생제 치료를 위한 기술적 복제로 지정하고, 항생제 없이 SCFM2에 있는 Pa 세포만 을 포함하는 처리 되지 않는 대조군으로4번째 우물을 고려한다. 형광 기자의 여기 전에 찾기 탭 내에서 밝은 필드 현미경 검사를 사용하여 집계를 식별합니다. 각 웰 내에서 이미징 영역을 정의하고 이미징 소프트웨어에 위치 모듈을 사용하여 위치(x-y-z 좌표)를 저장합니다.
- 63배 의 오일 침지 목표를 사용하여 SCFM2에서 GFP 발현 플라스미드 pMRP9-1을 포함하는 Pa 배양을 488nm의 내분 파장과 509nm의 배출 파장을 시각화합니다. 1 μm 간격(총 60개의 슬라이스)에서 획득 모듈 내에서 z 스택 옵션을 사용하여 이미지를 가져가라. 라인 평균 모듈을 사용하여 60 μm z-스택 이미지(1,093.5 mm3)의총 부피 내에서 GFP 채널의 배경 형광을 줄입니다. 동일한 설정을 사용하여 이미지 분석을 위한 배경 형광을 결정하여 단화된 SCFM2의 이미지를 제어합니다.
참고: 이미지는 커버슬립의 베이스에서 60μm인 512픽셀 x 512픽셀(0.26 μm x 0.26 μm 픽셀) 8비트 z-스택 이미지를 생성하여 획득합니다. - 이미징 소프트웨어 내에서 타임시리즈 옵션을 사용하여 18시간 동안 15분 간격으로 각 위치(잘)에서 60개의 슬라이스를 캡처합니다. 소프트웨어 내의 명확한 초점 전략을 사용하여 실험 전체의 각 시점으로 반환되는 각 위치에 대한 초점 평면을 저장합니다.
- 총 4.5h의 배양 후, 상기 설정을 이용하여 각 위치를 이미지하여 항생제를 첨가하기 전에 4개의 우물 내의 골재 바이오매스를 결정한다.
- 총 인큐베이션의 6 시간 후, 각각의 복제에 2x 이하 최소 억제 농도 (MIC)에서 항생제를 추가합니다. 파이펫은 공기 액체 상 바로 아래, 우물의 중간에 직접 부드럽게. 가열 된 공초점 챔버에서 모든 문화를 유지합니다.
참고: 여기서, 140 μg/mL의 농도에서 콜리신 황산염이 사용되었다. - 이미징 프로그램 내에서 시작 실험 옵션을 클릭하여 항생 후 치료를 시작합니다.
참고: 사용되는 항생제 농도는 항생제, Pa 격리 및 사용자가 살인 또는 내성 효과를 검사하고 싶은지 여부에 따라 달라집니다. 이 실험은 단일 용량을 사용합니다. 필요한 경우 문화를 방해하지 않고 추가 복용량을 추가할 수 있습니다.
4. 파 골재의 요오드 염색 프로피듐
참고: 프로피듐 요오드(PI)는 배양에서 실행 불가능한(죽은) 세균 세포를 식별하기 위해 염색 시약으로 일반적으로 활용된다. 여기서, 제3항에 적용된 항생제 치료에 민감한 골재를 식별하는 데 사용된다. 이 프로토콜 전반에 걸쳐 Pa 셀에서 GFP의 발현 및 검출이 세포 생존가능성을 위한 주요 프록시로 사용됩니다. 이 마지막 단계를 사용하면 공초점 이미징을 다시 한 번 사용하여 서로 관련하여 라이브/데드 응집체의 공간 위치를 식별할 수 있습니다. 또한, 집계는 섹션 5에서 추가 다운스트림 셀 정렬을 위해 라이브/데드로 식별됩니다.
- 18h 이후, SCFM2 배양을 포함하는 4 챔버 광학 바닥 접시의 각 웰에 PI를 추가합니다. PI 및 인큐베이션시간(예:mL당 ~2μl, ~20~30분)의 부피에 대한 제조업체의 지침을 따릅니다.
5. FACS 접근 방식을 사용하여 집계에서 라이브 셀을 격리
참고: FACS는 형광 태그 표현형에 따라 세포 그룹을 정렬하고 분리하는 강력한 플랫폼을 제공합니다. 여기서 FACS는 생존할 수 없는 골재로부터 라이브(항생제 내성) 응집체를 분리하는 데 사용됩니다.
- 공증요오드로 염색한 후 배양으로부터 배양을 제거하고 37°C를 유지하기 위해 절연 용기에 있는 FACS 기기로 이송한다.
- 가장 낮은 유량에서 Pa 집계를 포함하는 SCFM2의 1mL 알리쿼트실행합니다.
참고: 각 알리쿼트에는 ~15,000개의 집계가 포함됩니다. - GFP를 검출하려면 488 nm 레이저로 세포를 조명하고 530/30 nm에서 형광 신호 높이를 기록합니다. 561 nm 레이저로 여기로 PI 염색을 시각화하고 610/20 nm에서 형광 신호 높이를 기록합니다. 70-u 노즐을 사용하여 정렬을 수행합니다.
참고: 정렬된 집계는 사용자의 응용 프로그램에 따라 여러 가지 방법으로 풀로 작성할 수 있습니다. 이 경우, FACS는 다운스트림 RNA 시퀀싱을 위해 실행 가능한 Pa 응집체를 정렬하는 데 사용되었습니다. 대체 응용 프로그램은 아래에 설명되어 있습니다.
6. 이미지 분석
참고: 시간 경과 현미경 검사법은 많은 양의 데이터를 생성합니다. SCFM2에서 Pa 골재의 관측을 위한 18-h 실험은 시간이 지남에 따라 ~50,000개의 골재를 식별하며, 이는 볼륨 및 공간 포지셔닝을 특징으로 할 가능성이 있습니다. 이미지 분석 소프트웨어를 사용하여 SCFM2의 집계 역학을 정량화합니다.
- SCFM2의 집계 연구의 경우, PMRP9-1을 운반하는 Pa 균주 PAO1로 접종된 단화된 SCFM2 및 SCFM2용으로 생성되는 GFP 채널에서 카운트의 히스토그램을 만들어 배경 GFP 형광을 정량화한다. 검출된 GFP 복셀이 Pa 바이오매스와 상관관계가 있는지 확인하려면 GFP+ 복셀을 GFP 백그라운드 수 값의 ≥1.5배로 정의합니다.
참고: 배경 형광은 평균적으로 선택된 세 개의 임의로 선택된 위치중 가장 높은 복셀 값으로 정의됩니다. 배경 수는 표준 측정값으로 이미지 분석 소프트웨어에 의해 실험 이미지의 모든 픽셀에서 빼는 것입니다. - 능가 모듈에서 배경 빼기 후 남은 모든 복셀에 대한 등위 표면을 생성합니다.
- 개별 집계를 감지하려면 분할 오브젝트 옵션을 사용하도록 설정하고 집계를 ≥5 μm3의볼륨이 있는 개체로 정의합니다. 이미지 분석 소프트웨어의 Vantage 모듈을 사용하여 각 개별 개체에 대한 볼륨, x-y-z 및 GFP 복셀 합계를 계산합니다. 이 데이터를 외부 통계 플랫폼으로 내보냅니다.
참고: 일부 이미지 분석 소프트웨어는 여러 정량 페토이페를 한 번에 내보낼 수 있으므로 상관 관계를 계산할 수 있습니다. - 크기별로 Vantage 모듈에서 내보낸 필터 데이터를 사용하여 <0.5 μm3(분산된 바이오매스)의 개체가 남아 있지 않도록 합니다. 이미지 내의 각 개별 오브젝트에 대해 이미지 분석 소프트웨어의 Vantage 모듈을 사용하여 또는 다음 방정식으로 수동으로 다른 개체(aggregates)와 관련하여 자체로부터의 거리를 계산합니다.
d = sqrt (x2- x1)2 + (y2- y1)2 + (z2- z1)2) (1) - SUM 및 평균 계산을 사용하여 총 바이오매스 및 평균 집계 볼륨을 찾습니다. 또는, 다른 통계 플랫폼 이나 스크립트에 데이터를 수출, 예를 들어,대표 결과에서 설명 한 대로 바이오 매스 에 걸쳐 집계의 분포 (화이트리 실험실과 공동으로 게시 되지 않은 스크립트, 조지아 공과 대학).
Access restricted. Please log in or start a trial to view this content.
결과
이 작품은 CF 폐9,10,12의만성 감염과 유사한 환경에서 고해상도 및 환경에서 Pa 골재를 관찰하는 방법을 자세히설명합니다. SCFM2는 실제감염(10)동안 관찰된 것과 유사한 크기로 Pa 세포의 자연적인 응집을 촉진하는 체외 시스템을 제공한다. 정의된 매체로 SCFM2의 적응성은 많은 연구 도로에 ?...
Access restricted. Please log in or start a trial to view this content.
토론
이 작품은 항생제 치료의 존재와 부재에서 세균 성 집계 인구를 연구하기 위해 결합 될 수있는 방법론을 도입했다. 고해상도 CLSM은 항생제에 노출될 때 골재의 변화와 실시간으로 응집물의 구조적 방향을 시각화할 수 있게 합니다. 또한, 항생제로 치료 한 후 남아있는 바이오매스의 물리적 및 구조적 특징은 RNA-seq를 활용한 미래 유전자 발현 연구와 이러한 관찰을 상호 연관시키는 것을 목표로 정?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 이해상충이 없습니다.
감사의 말
S.E.D는 분자 의학과, 사우스 플로리다 대학, N.I.H (5R21AI147654 - 02 (PI, 첸) 및 미생물군유전체에 대한 USF 연구소에서 제공하는 창업 기금에 의해 지원됩니다. 이 원고와 관련된 데이터 세트와 관련된 지속적인 협업에 대해 Whiteley 연구소에 감사드립니다. FACS 분류를 촉진해 주신 찰스 세케레스 박사에게 감사드립니다. 수치는 Biorender.com 사용하여 A.D.G와 S.E.D에 의해 만들어졌습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Amino acids | |||
| Alanine | Acros Organics | 56-41-7 | |
| Arginine HCl | MP | 1119-34-2 | |
| Asparagine | Acros Organics | 56-84-8 | Prepared in 0.5 M NaOH |
| Cystine HCl | Alfa Aesar | L06328 | |
| Glutamic acid HCl | Acros Organics | 138-15-8 | |
| Glycine | Acros Organics | 56-40-6 | |
| Histidine HCl H2O | Alfa Aesar | A17627 | |
| Isoleucine | Acros Organics | 73-32-5 | |
| Leucine | Alfa Aesar | A12311 | |
| Lysine HCl | Alfa Aesar | J62099 | |
| Methionine | Acros Organics | 63-68-3 | |
| Ornithine HCl | Alfa Aesar | A12111 | |
| Phenylalanine | Acros Organics | 63-91-2 | |
| Proline | Alfa Aesar | A10199 | |
| Serine | Alfa Aesar | A11179 | |
| Threonine | Acros Organics | 72-19-5 | |
| Tryptophan | Acros Organics | 73-22-3 | Prepared in 0.2 M NaOH |
| Tyrosine | Alfa Aesar | A11141 | Prepared in 1.0 M NaOH |
| Valine | Acros Organics | 72-18-4 | |
| Antibiotic | |||
| Carbenicillin | Alfa Aesar | J6194903 | |
| Day-of Stocks | |||
| CaCl2 * 2H2O | Fisher Chemical | C79-500 | |
| Dextrose (D-glucose) | Fisher Chemical | 50-99-7 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Fisher (Avanti Polar Lipids) | 4235-95-4 | shake 15-20 min at 37 °C to evaporate chloroform |
| FeSO4 * 7H2O | Acros Organics | 7782-63-0 | this stock equals 1 mg/mL, MUST make fresh |
| L-lactic acid | Alfa Aesar | L13242 | pH stock to 7 with NaOH |
| MgCl2 * 6H2O | Acros Organics | 7791-18-6 | |
| N-acetylglucosamine | TCI | A0092 | |
| Prepared solids | |||
| Porcine mucin | Sigma | M1778-100G | UV-sterilize |
| Salmon sperm DNA | Invitrogen | 15632-011 | |
| Stain | |||
| Propidium iodide | Alfa Aesar | J66764MC | |
| Salts | |||
| K2SO4 | Alfa Aesar | A13975 | |
| KCl | Alfa Aesar | J64189 | add solid directly to buffered base |
| KNO3 | Acros Organics | 7757-79-1 | |
| MOPS | Alfa Aesar | A12914 | add solid directly to buffered base |
| NaCl | Fisher Chemical | S271-500 | add solid directly to buffered base |
| Na2HPO4 | RPI | S23100-500.0 | |
| NaH2PO4 | RPI | S23120-500.0 | |
| NH4Cl | Acros Organics | 12125-02-9 | add solid directly to buffered base |
| Consumables | |||
| Conical tubes (15 mL) | Olympus plastics | 28-101 | |
| Conical tubes (50 mL) | Olympus plastics | 28-106 | |
| Culture tubes w/air flow cap | Olympus plastics | 21-129 | |
| 35 mm four chamber glass-bottom dish | CellVis | NC0600518 | |
| Luria Bertani (LB) broth | Genessee Scientific | 11-118 | |
| Phosphate-buffered saline (PBS) | Fisher Bioreagents | BP2944100 | |
| Pipet tips (p200) | Olympus plastics | 23-150RL | |
| Pipet tips (p1000) | Olympus plastics | 23-165RL | |
| Serological pipets (5 mL) | Olympus plastics | 12-102 | |
| Serological pipets (25 mL) | Olympus plastics | 12-106 | |
| Serological pipets (50 mL) | Olympus plastics | 12-107 | |
| Ultrapure water (RNase/DNase free); nanopure water | Genessee Scientific | 18-194 | Nanopure water used for preparation of solutions in Table 1 |
| Syringes (10 mL) | BD | 794412 | |
| Syringes (50 mL) | BD | 309653 | |
| 0.22 mm PES syringe filter | Olympus plastics | 25-244 | |
| PS cuvette semi-mico | Olympus plastics | 91-408 | |
| Software | |||
| Biorender | To prepare the figures | ||
| FacsDiva6.1.3 | Becton Dickinson, San Jose, CA | ||
| Imaris | Bitplane | version 9.6 | |
| Zen Black | |||
| Equipment | |||
| FacsAriallu | Becton Dickinson, San Jose, CA | ||
| LSM 880 confocal laser scanning microscope | Zeiss |
참고문헌
- Ramsay, K. A., et al. The changing prevalence of pulmonary infection in with fibrosis: A longitudinal analysis. Journal of Cystic Fibrosis. 16 (1), 70-77 (2017).
- Bessonova, L., et al. Data from the US and UK cystic fibrosis registries support disease modification by CFTR modulation with ivacaftor. Thorax. 73 (8), 731-740 (2018).
- Breuer, O., et al. Changing prevalence of lower airway infections in young children with cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 200 (5), 590-599 (2019).
- O'Donnell, J. N., Bidell, M. R., Lodise, T. P. Approach to the treatment of patients with serious multidrug-resistant Pseudomonas aeruginosa infections. Pharmacotherapy. 40 (9), 952-969 (2020).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Darch, S. E., et al. Spatial determinants of quorum signaling in a Pseudomonas aeruginosa infection model. Proceedings of the National Academy of Sciences of the United States of America. 115 (18), 4779-4784 (2018).
- Zhu, K., Chen, S., Sysoeva, T. A., You, L. Universal antibiotic tolerance arising from antibiotic-triggered accumulation of pyocyanin in Pseudomonas aeruginosa. PLoS Biology. 17 (12), 3000573(2019).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and resistance of Pseudomonas aeruginosa biofilms to antimicrobial agents-how P. aeruginosa can escape antibiotics. Frontiers in Microbiology. 10, 913(2019).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proceedings of the National Academy of Sciences of the United States of America. 112 (13), 4110-4115 (2015).
- Darch, S. E., et al. Phage inhibit pathogen dissemination by targeting bacterial migrants in a chronic infection model. MBio. 8 (2), 00240(2017).
- Jorth, P., et al. Regional isolation drives bacterial diversification within cystic fibrosis lungs. Cell Host & Microbe. 18 (3), 307-319 (2015).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Davies, D. G., et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science. 280 (5361), 295-298 (1998).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Stacy, A., et al. Bacterial fight-and-flight responses enhance virulence in a polymicrobial infection. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7819-7824 (2014).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유