需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
伪多莫纳斯航空感染模型实时评估工具
摘要
合成囊性纤维化痰介质(SCFM2)可与共聚焦激光扫描显微镜和荧光活性细胞分拣相结合,以高分辨率观察细菌聚集物。本文详细介绍了在抗菌治疗期间评估总人口的方法,作为未来研究的平台。
摘要
伪多莫纳斯航空(Pa) 是与囊性纤维化(CF)相关的最常见的机会型病原体之一。 一旦Pa 殖民化建立,很大一部分感染细菌在气道痰中形成生物膜。从CF痰中分离出来的 Pa 生物膜已被证明生长在小而密集的聚集体中,这些聚合体为+10-1,000细胞,这些细胞在空间上组织起来,并表现出临床上相关表型,如抗菌耐受性。研究 Pa 聚合物如何应对不断变化的痰环境的最大挑战之一是缺乏营养相关和强大的系统,促进聚合形成。使用合成的 CF 痰介质 (SCFM2),可以使用共聚焦激光扫描显微镜 (CLSM) 和单个细胞分辨率的图像分析来观察 Pa 聚合物的寿命历史。这种 体外 系统允许实时、三维和微米尺度观察数千个大小不一的聚合物。在个体和人口层面,能够按表型和位置对聚合进行分组,有助于观察处于不同发育阶段的聚合物,并有助于精确区分它们对微环境变化的反应,如抗生素治疗。
引言
伪多莫纳斯航空(Pa)是一种机会型病原体,可在免疫受损个体中建立慢性感染。对于那些有遗传性疾病囊性纤维化 (CF) 的人,这些感染可以跨越一生的过程。CF导致气道中粘稠、营养丰富的痰的积聚,随着时间的推移,这种痰会被各种微生物病原体殖民。Pa是最常见的CF病原体之一,在幼儿期殖民气道,并建立难以治疗的感染1。Pa仍然是一个严重的临床问题,被认为是CF患者的主要死因,尽管近年来治疗方案有所改善。这种持续表型和增加抗生素耐受性使Pa在疾病控制中心(CDC)和世界卫生组织(WHO)确定为开发新治疗策略的研究重点的病原体中占有一席之地——ESKAPE病原体4。
像其他ESKAPE病原体一样,获得抗生素耐药性在Pa中很常见,但也有许多内在特性有助于Pa抗菌耐药性。其中包括Pa形成+10-1,000细胞的聚集高度密集的集群的能力,这可以在多种感染中观察到,包括CF患者痰5,6。与其他生物膜系统研究的Pa相似,Pa聚合显示临床相关表型,如对抗生素的耐药性增加和细胞细胞通信(量子传感(QS)的激活。例如,Pa的聚合已被证明使用QS调节的行为来对抗其他微生物,以及耐受抗菌治疗,如生产皮奥氰宁7。研究这些行为的能力为人们提供了对细菌生态系统的令人兴奋的洞察,其环境与它们存在于人体中的生态系统相似。
研究Pa聚合物如何应对不断变化的痰环境的最大挑战之一是缺乏营养相关和强大的系统,促进聚合形成。关于Pa的很多已知的东西都是使用体外系统发现的,其中细胞以浮子或在一个典型的表面附着的"蘑菇"结构中生长,而这种结构在体内8中是没有观察到的。虽然经典的生物膜生长模型,如流动细胞或固体阿加,已经产生了关于细菌行为和抗生素耐受机制的广泛和有价值的知识,这些发现并不总是在体内转化。许多体外模型模仿人类感染部位生长环境的能力有限,因此需要昂贵的体内研究。反过来,许多体内模型缺乏体外技术提供的灵活性和分辨率。
合成囊性纤维化痰 (SCFM2) 旨在为Pa生长提供类似于 CF 肺慢性感染期间的环境。SCFM2 包括预期 CF 痰中发现的营养来源,以及粘液、脂质和 DNA。PA生长在SCFM2需要一个几乎相同的基因集,需要在实际痰生长,并支持自然Pa聚合形成9,10。接种后,浮子细胞形成聚合体,通过膨胀增加体积。单个细胞(称为移民)从聚合体中释放出来,迁移到非殖民化地区,并形成新的聚合体10。使用 CLSM 和图像分析在单个细胞的分辨率下观察到此生命史。在SCFM2中形成的Pa的聚合体与CF肺10中观察到的体积大小相似。此模型允许在微米尺度上实时和三维观察不同大小的多个聚合体。延时显微镜可在一个实验中跟踪数千个(+50,000)的聚合物。使用图像分析软件可以从显微图中量化聚合表型,包括聚合体积、表面积和位置三个维度,以最近的 0.1 μm 为数,包括单个聚合度和人口水平。能够按表型和位置对聚合进行分组,可以精确区分不同发育阶段的聚合,以及它们对不断变化的微环境6、11的反应。
SCFM2 应用于低体积和高吞吐量检测中的Pa聚合物研究,使其成为一个灵活、经济高效的模型。作为一种定义的介质,SCFM2在多个平台上提供均匀性和可重复性,为研究Pa聚合体外9提供了营养和物理相关的方法。应用包括它与 CLSM 结合使用,以高分辨率观察空间组织和抗生素耐受性(如本方法本文所述)。能够进行实验,提供实时的,微米级的数据,允许研究物种内部和物种间相互作用,因为它们可能发生在体内。例如,SCFM2以前曾被用来研究细胞细胞通信的空间动力学在总人口通过一个系统网络利用Pa用于调节多个基因,导致毒性和发病机理6。

图1:主要实验步骤的图形描述。(A) SCFM2与Pa细胞一起接种,并允许在玻璃底培养皿中形成聚合物。(B) 聚合物被转移到共聚焦显微镜,并添加抗生素。描述是三个技术复制(室1-3)和控制井(4)接种SCFM2没有抗生素治疗。聚合物在初始 18 小时成像后使用 CLSM进行成像,用碘化物处理聚合物,以可视化死细胞,使用 CLSM(D)使用所需表型的聚合物使用 FACS 从 SCFM2 中分离图像。缩写:SCFM2 = 合成囊性纤维化痰介质;帕=伪多莫纳斯航空;CLSM = 聚焦激光扫描显微镜;FACS = 荧光激活细胞排序。请单击此处查看此图的较大版本。
在这里,SCFM2的效用,以研究抗生素治疗对Pa聚合物的实时影响,然后使用细胞分拣方法,以隔离人群与不同的表型进行下游分析(图1)。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 准备合成囊性纤维化介质(SCFM2)
注:SCFM2的编制包括以下三个主要阶段(图2)。有关完整详细信息和参考,请参阅 9、10、12。
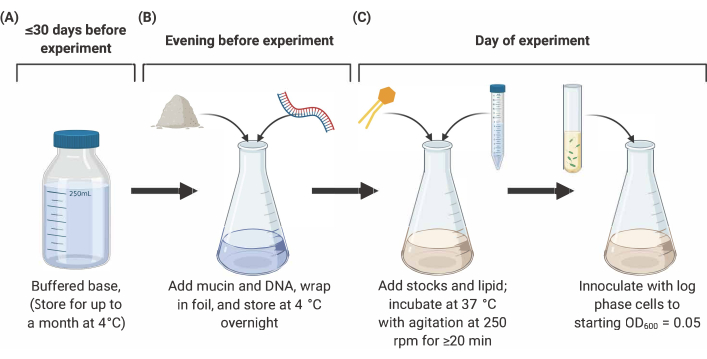
图2:SCFM2介质的制备和接种。(A) 缓冲碱是使用表1和表2中列出的盐和氨基酸制备的。缓冲底座可在 4 °C 下存储长达 30 天,但必须保护其免受光线照射。(B) 粘液和DNA被添加到缓冲基座的液泡中,并在4°C(C)脂质下溶解到溶液中过夜,并在隔夜溶液中加入其他库存,在37°C下孵育,在250转/分处搅拌20分钟。 缩写: SCFM2 = 合成囊性纤维化痰介质。请单击此处查看此图的较大版本。
- 猪粘液灭菌
- 在SCFM2中最后浓度为5毫克/毫升时准备无菌粘液。例如,对于 5 mL 体积的 SCFM2,在无菌的培养皿中重 25 毫克 II 型粘液,并放入紫外线 (UV) 消毒器中 4 小时,每小时轻轻搅拌。
- 4 小时后,将紫外线处理的粘液在无菌条件下转移到自动结块的 1.7 mL 管中,并储存在 -20 °C 下。
- 为了确认完全绝育,在无菌液体(如水或卢里亚·贝尔塔尼(LB)肉汤中溶解粘液样本,并在显微镜下观察。
注:消毒粘液可在 -20 °C 下储存长达 6 个月。
- 准备缓冲基地
- 准备盐和氨基酸库存解决方案,通过添加适当的重量到电离水, 如表1所列。使用 0.22 μm 滤光片对所有库存溶液进行过滤消毒,用铝箔包裹,以防止光线退化,并将储存在 4 °C 下长达一个月。
- 准备缓冲基地,结合190mL的电离水与氨基酸和盐库存溶液的卷在 表1列出。将溶液调整为 pH 6.8,并增加到最终体积 250 mL。使用 0.22 μm 过滤器进行过滤消毒,并在 4 °C 下存储长达 30 天。
- 在实验前一天晚上,将所需的缓冲碱基量放入玻璃培养瓶中,并加入粘液(如第1.1.1步所述)和纯化鲑鱼精子DNA(0.6毫克/毫升)。轻轻搅拌,用铝箔包裹,在4°C下过夜,让粘液和DNA溶解成溶液。
注:三文鱼精子DNA碱液应在冰上解冻,漩涡,并添加到缓冲基地和粘液中。色氨酸、芦笋和酪氨酸库存解决方案必须在 NaOH 的溶液中准备(请参阅 表 1 以表示浓度),而不是去离子水。保持缓冲基座和所有用铝箔包裹的库存溶液,以防止光线暴露。大多数股票将稳定长达一个月。变色库存不应使用,在使用前应更换。
- 补充库存的添加
- 在实验当天,将 表2 中列出的股票添加到含有粘液和DNA的缓冲基座中。
注:在实验当天准备一个新的FeSO4 溶液,但所有其他库存可以提前制作,并在4°C.1,2-二醇-sn-甘油-3-磷酸(DOPC)中储存30天,含有氯仿。小心处理,不要在明火附近使用。加入 DOPC 后,在 37 °C 处孵育 SCFM2,摇晃(250 rpm)至少 20 分钟(用于 5 mL 培养)。此潜伏期允许 DOPC 中的氯仿蒸发。烧瓶不应密封:相反,用铝箔松散地盖住烧瓶的开口。
- 在实验当天,将 表2 中列出的股票添加到含有粘液和DNA的缓冲基座中。
2. 细菌聚合物抗菌耐受性的实时评估
- 准备通宵文化
- 在实验前一天晚上,用含有抗生素(卡苯西林300微克/兆升)的LB琼脂板,用几粒 Pa PAO1-pMRP9-113 菌落接种5mL的LB肉汤。在 37 °C 下生长过夜,在 250 rpm 时激动。
注:通过添加所需的质粒所需的抗生素(这里,绿色荧光蛋白(GFP)表达质粒,pMRP9-1)来生长通宵培养物。请注意,在 SCFM2 接种之前,将清洗 Pa 细胞。LB 可以替代其他丰富的实验室媒体来替代隔夜文化。在整个协议中,所有细菌隔离物应使用适当的 BSL-2 指南进行处理。
- 在实验前一天晚上,用含有抗生素(卡苯西林300微克/兆升)的LB琼脂板,用几粒 Pa PAO1-pMRP9-113 菌落接种5mL的LB肉汤。在 37 °C 下生长过夜,在 250 rpm 时激动。
- 接种SCFM2
- 在实验当天,通过将 500 μL 接种到 5 mL 的新鲜 LB 汤中,对 Pa 1:10(培养物:液体介质)的隔夜培养物进行反稀释。在 37 °C 下生长细胞,直到日志相(60-90 分钟),在 250 rpm 时激动。
- 离心机日志相培养在 10,000 × g 5 分钟。通过去除超高酸酯,在3mL的过滤消毒磷酸盐缓冲盐水(PBS,pH 7.0)中重新吸收,清洗细胞。重复两次,并在 PBS 的最后卷 1 mL 中重新悬回颗粒。
- 使用光谱光度计(OD 600)测量洗涤细胞的吸收量,并计算SCFM2 5 mL 0.05的起始OD600所需的培养量。将Pa接种到 SCFM2 中,然后轻轻地涡流将细胞分布到整个细胞中。Pipette 1 mL 的接种 SCFM2 进入 4 井、玻璃底、光学盘的每个腔室,并在 37 °C 下静态孵育 4 小时。
注:Pa文化的加倍时间取决于应变和氧气的可用性。在SCFM2中,根据这里描述的条件,Pa的加倍时间是1.4小时10。
3. 用共聚焦激光扫描显微镜(CLSM)可视化抗生素治疗期间的聚合物
注:本节描述了在SCFM2中使用共聚焦激光扫描显微镜和图像捕获软件对 Pa 聚合物进行成像。目标是在用抗生素治疗后观察和描述剩余的(耐受的)细菌生物量。概述的步骤可以在其他共聚焦显微镜上成功执行,但应参考仪器操作手册以进行具体指导。
- 图像 Pa 培养物使用加热室或安装在显微镜舞台上的加热显微板来保持 37 °C 的环境温度。 在实验开始前至少 2 小时启动 孵化 模块,使所有设备都达到所需的温度,并减少数据收集过程中的进一步扩展和移动。
- 4小时后,将含有 Pa 细胞的SCFM2培养物转移到加热显微镜阶段。指定4口井中的3口为抗生素治疗的技术复制品,并考虑第 4口井以及无治疗控制,在SCFM2中只含有 Pa 细胞,不含抗生素。在荧光记者的任何激发之前,使用 定位 标签内的亮场显微镜识别聚合物。定义每个井内的成像区域,并使用成像软件中的 "位置" 模块存储其位置(x-y-z 坐标)。
- 使用 63 倍的浸油目标可视化包含 SCFM2 中包含 GFP 表达质粒 pMRP9-1 的 Pa 文化,激发波长为 488 nm,发射波长为 509 nm。以 1 μm 间隔(共 60 片)使用 收购 模块中的 z 堆栈选项拍摄图像。使用 平均线 模块,在 60 μm z 堆栈图像(1,093.5 mm3)的总体积内减少 GFP 通道中的背景荧光。使用相同的设置来确定图像分析的背景荧光,从而控制未开启的 SCFM2 的图像。
注:通过生成 512 像素 x 512 像素(0.26 μm x 0.26 μm 像素)从盖片底部生成 60μm 的 8 位 z 堆栈图像来获取图像。 - 使用成像软件中的时间系列选项,在 18 小时内以 15 分钟间隔在每个位置(井)捕获 60 片。使用软件中的明确对焦策略为每个位置存储一个焦距平面,该平面在整个实验中每个时间点返回。
- 经过总共4.5小时的孵化后,使用上述设置对每个位置进行成像,以确定在添加抗生素之前,四口井中每个井内的生物量总量。
- 在总孵化6小时后,在每个复制中加入低于最低抑制浓度(MIC)2倍的抗生素。派佩特直接轻轻地进入井中间,就在气液相间的正下方。在加热的圆锥体中保持所有文化。
注:这里使用了浓度为140μg/mL的硫酸二醇。 - 通过单击成像程序中的 "开始实验 "选项,开始成像后抗生素治疗。
注:使用的抗生素浓度取决于抗生素 ,Pa 隔离,以及用户是否希望检查杀戮或耐受性的影响。这个实验使用单一剂量。如果需要,可以在不破坏培养物的情况下添加额外的剂量。
4. Pa 聚合物的碘化物污渍
注:碘化物(PI)通常用作染色试剂,以识别培养中不可存活的(死亡)细菌细胞。在这里,它用于识别对第 3 节中应用的抗生素治疗敏感的聚合物。在整个协议中 ,Pa 细胞中 GFP 的表达和检测被用作细胞生存能力的主要代理。最后一步允许再次使用共聚焦成像来识别彼此之间活/死聚合物的空间定位。此外,聚合物被确定为活/死,用于第 5 节中进一步进行下游细胞排序。
- 18 小时后,在包含 SCFM2 培养物的四室光学底盘的每口井中加入 PI。按照制造商的说明说明 PI 的体积和孵化时间(例如,每 ML 培养品 ±2 μL,+20-30 分钟)。
5. 使用 FACS 方法将活细胞与聚合体隔离
注:FACS 提供了一个强大的平台,根据荧光标记表型对细胞群进行排序和隔离。在这里,FACS 用于将活体(抗生素耐受性)聚合物与不可活性聚合物隔离。
- 染上碘化物后,将培养物从孵化中取出,并转移到绝缘容器中的 FACS 仪器以保持 37 °C。
- 以最低流量运行包含 Pa 聚合物的 SCFM2 的 1 mL aliquot。
注:每个阿利报价将包含 +15,000 聚合物。 - 为了检测GFP,用488纳米激光照亮细胞,并将荧光信号高度记录在530/30纳米。使用 561 nm 激光激发可视化 PI 染色,并将荧光信号高度记录为 610/20 nm。使用 70u 喷嘴进行排序。
注意:根据用户的应用,分拣聚合可以以多种方式进行聚合。在这种情况下,FACS 用于为下游 RNA 测序对可行的 Pa 聚合进行排序。下面讨论替代应用程序。
6. 图像分析
注:延时显微镜生成大量数据。SCFM2 中用于观察 Pa 聚合物的 18 小时实验可识别 50,000 个聚合物,这些聚合体具有在体积和空间定位方面具有特征。使用图像分析软件量化 SCFM2 中的聚合动态:
- 对于 SCFM2 的综合研究,通过在 GFP 通道中创建一个直方图来量化背景 GFP 荧光,该直方图用于未接种的 SCFM2 和 SCFM2 接种 ,Pa 应变 PAO1 携带 pMRP9-1。为确保检测到的 GFP voxel 与 Pa 生物质相关,将 GFP® voxel 定义为 GFP 背景计数值的 ≥.5 倍。
注:背景荧光被定义为三个随机选择位置的最高词汇值,平均值。作为标准衡量标准,背景计数是通过图像分析软件从实验图像中的所有像素中减去的。 - 在超越模块中的背景减法后,为所有剩余的 voxels 生成等同体。
- 要检测单个聚合体,启用 拆分对象 选项,并将聚合体定义为体积为 ≥ 5 μm3的对象。使用图像分析软件中的 Vantage 模块来计算每个对象的体积、x-y-z 和 GFP 词汇量。将此数据导出到外部统计平台。
注:某些图像分析软件允许同时导出多个定量苯丙酸酯,从而可以计算相关性。 - 按大小过滤 Vantage 模块输出的数据,以确保不会保留 0.5 μm3( 分散生物质)<对象。对于图像中的每个对象,使用图像分析软件的 Vantage 模块或手动使用以下方程计算与其他对象(聚合)的距离。
d = sqrt ((x2= x1)2 = (y2= y1)2 = (z2= z1)2) (1) - 使用 SUM 和平均计算来查找生物质总量和平均总量。或者,将数据出口到其他统计平台或脚本中, 例如,代表结果中讨论的生物量聚合物分布(与佐治亚理工学院怀特利实验室合作未发表的脚本)。
Access restricted. Please log in or start a trial to view this content.
结果
这项工作详细说明了观察Pa聚合在高分辨率和环境类似于慢性感染CF肺9,10,12。SCFM2提供了一个体外系统,促进Pa细胞的自然聚集,其大小与实际感染期间观察到的相似。SCFM2 作为定义介质的适应性可以利用它来接近许多研究途径。这项工作的目标是突出工作流程,包括显微镜和 FACS 的组?...
Access restricted. Please log in or start a trial to view this content.
讨论
这项工作引入了方法,可以结合研究细菌聚集人群的存在和缺乏抗生素治疗。高分辨率 CLSM 允许在接触抗生素时实时可视化聚合生物量的变化和聚合物的结构方向。此外,可以量化抗生素治疗后剩余生物量的物理和结构特征,目的是利用RNA-seq将这些观测结果与未来的基因表达研究联系起来。虽然使用GFP表达细胞可以可视化抗生素耐药细胞的集体和个人行为,但它只提供了整体情况的一部分。从没...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有利益冲突。
致谢
S.E.D由南佛罗里达大学分子医学系提供的启动资金以及CFF研究赠款(DARCH19G0)N.I.H(5R21AI147654-02(PI,Chen)和美国F微生物群系研究所提供支持。我们感谢怀特利实验室持续合作,涉及与此手稿相关的数据集。我们感谢查尔斯·塞克斯博士为FACS分拣提供便利。数字是由A.D.G和S.E.D使用 Biorender.com 创建的。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Amino acids | |||
| Alanine | Acros Organics | 56-41-7 | |
| Arginine HCl | MP | 1119-34-2 | |
| Asparagine | Acros Organics | 56-84-8 | Prepared in 0.5 M NaOH |
| Cystine HCl | Alfa Aesar | L06328 | |
| Glutamic acid HCl | Acros Organics | 138-15-8 | |
| Glycine | Acros Organics | 56-40-6 | |
| Histidine HCl H2O | Alfa Aesar | A17627 | |
| Isoleucine | Acros Organics | 73-32-5 | |
| Leucine | Alfa Aesar | A12311 | |
| Lysine HCl | Alfa Aesar | J62099 | |
| Methionine | Acros Organics | 63-68-3 | |
| Ornithine HCl | Alfa Aesar | A12111 | |
| Phenylalanine | Acros Organics | 63-91-2 | |
| Proline | Alfa Aesar | A10199 | |
| Serine | Alfa Aesar | A11179 | |
| Threonine | Acros Organics | 72-19-5 | |
| Tryptophan | Acros Organics | 73-22-3 | Prepared in 0.2 M NaOH |
| Tyrosine | Alfa Aesar | A11141 | Prepared in 1.0 M NaOH |
| Valine | Acros Organics | 72-18-4 | |
| Antibiotic | |||
| Carbenicillin | Alfa Aesar | J6194903 | |
| Day-of Stocks | |||
| CaCl2 * 2H2O | Fisher Chemical | C79-500 | |
| Dextrose (D-glucose) | Fisher Chemical | 50-99-7 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Fisher (Avanti Polar Lipids) | 4235-95-4 | shake 15-20 min at 37 °C to evaporate chloroform |
| FeSO4 * 7H2O | Acros Organics | 7782-63-0 | this stock equals 1 mg/mL, MUST make fresh |
| L-lactic acid | Alfa Aesar | L13242 | pH stock to 7 with NaOH |
| MgCl2 * 6H2O | Acros Organics | 7791-18-6 | |
| N-acetylglucosamine | TCI | A0092 | |
| Prepared solids | |||
| Porcine mucin | Sigma | M1778-100G | UV-sterilize |
| Salmon sperm DNA | Invitrogen | 15632-011 | |
| Stain | |||
| Propidium iodide | Alfa Aesar | J66764MC | |
| Salts | |||
| K2SO4 | Alfa Aesar | A13975 | |
| KCl | Alfa Aesar | J64189 | add solid directly to buffered base |
| KNO3 | Acros Organics | 7757-79-1 | |
| MOPS | Alfa Aesar | A12914 | add solid directly to buffered base |
| NaCl | Fisher Chemical | S271-500 | add solid directly to buffered base |
| Na2HPO4 | RPI | S23100-500.0 | |
| NaH2PO4 | RPI | S23120-500.0 | |
| NH4Cl | Acros Organics | 12125-02-9 | add solid directly to buffered base |
| Consumables | |||
| Conical tubes (15 mL) | Olympus plastics | 28-101 | |
| Conical tubes (50 mL) | Olympus plastics | 28-106 | |
| Culture tubes w/air flow cap | Olympus plastics | 21-129 | |
| 35 mm four chamber glass-bottom dish | CellVis | NC0600518 | |
| Luria Bertani (LB) broth | Genessee Scientific | 11-118 | |
| Phosphate-buffered saline (PBS) | Fisher Bioreagents | BP2944100 | |
| Pipet tips (p200) | Olympus plastics | 23-150RL | |
| Pipet tips (p1000) | Olympus plastics | 23-165RL | |
| Serological pipets (5 mL) | Olympus plastics | 12-102 | |
| Serological pipets (25 mL) | Olympus plastics | 12-106 | |
| Serological pipets (50 mL) | Olympus plastics | 12-107 | |
| Ultrapure water (RNase/DNase free); nanopure water | Genessee Scientific | 18-194 | Nanopure water used for preparation of solutions in Table 1 |
| Syringes (10 mL) | BD | 794412 | |
| Syringes (50 mL) | BD | 309653 | |
| 0.22 mm PES syringe filter | Olympus plastics | 25-244 | |
| PS cuvette semi-mico | Olympus plastics | 91-408 | |
| Software | |||
| Biorender | To prepare the figures | ||
| FacsDiva6.1.3 | Becton Dickinson, San Jose, CA | ||
| Imaris | Bitplane | version 9.6 | |
| Zen Black | |||
| Equipment | |||
| FacsAriallu | Becton Dickinson, San Jose, CA | ||
| LSM 880 confocal laser scanning microscope | Zeiss |
参考文献
- Ramsay, K. A., et al. The changing prevalence of pulmonary infection in with fibrosis: A longitudinal analysis. Journal of Cystic Fibrosis. 16 (1), 70-77 (2017).
- Bessonova, L., et al. Data from the US and UK cystic fibrosis registries support disease modification by CFTR modulation with ivacaftor. Thorax. 73 (8), 731-740 (2018).
- Breuer, O., et al. Changing prevalence of lower airway infections in young children with cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 200 (5), 590-599 (2019).
- O'Donnell, J. N., Bidell, M. R., Lodise, T. P. Approach to the treatment of patients with serious multidrug-resistant Pseudomonas aeruginosa infections. Pharmacotherapy. 40 (9), 952-969 (2020).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Darch, S. E., et al. Spatial determinants of quorum signaling in a Pseudomonas aeruginosa infection model. Proceedings of the National Academy of Sciences of the United States of America. 115 (18), 4779-4784 (2018).
- Zhu, K., Chen, S., Sysoeva, T. A., You, L. Universal antibiotic tolerance arising from antibiotic-triggered accumulation of pyocyanin in Pseudomonas aeruginosa. PLoS Biology. 17 (12), 3000573(2019).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and resistance of Pseudomonas aeruginosa biofilms to antimicrobial agents-how P. aeruginosa can escape antibiotics. Frontiers in Microbiology. 10, 913(2019).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proceedings of the National Academy of Sciences of the United States of America. 112 (13), 4110-4115 (2015).
- Darch, S. E., et al. Phage inhibit pathogen dissemination by targeting bacterial migrants in a chronic infection model. MBio. 8 (2), 00240(2017).
- Jorth, P., et al. Regional isolation drives bacterial diversification within cystic fibrosis lungs. Cell Host & Microbe. 18 (3), 307-319 (2015).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Davies, D. G., et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science. 280 (5361), 295-298 (1998).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Stacy, A., et al. Bacterial fight-and-flight responses enhance virulence in a polymicrobial infection. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7819-7824 (2014).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。