É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ferramentas para a avaliação em tempo real de um modelo de infecção por pseudomonas aeruginosa
Neste Artigo
Resumo
O meio de escarro de fibrose cística sintética (SCFM2) pode ser utilizado em combinação com microscopia de varredura a laser confocal e classificação celular ativada por fluorescência para observar agregados bacterianos em alta resolução. Este artigo detalha métodos para avaliar populações agregadas durante o tratamento antimicrobiano como uma plataforma para estudos futuros.
Resumo
Pseudomonas aeruginosa (Pa) é um dos patógenos oportunistas mais comuns associados à fibrose cística (CF). Uma vez estabelecida a colonização pa, uma grande proporção das bactérias infectantes formam biofilmes dentro da escória das vias aéreas. Os biofilmes pa isolados da escarro cf têm se mostrado que crescem em pequenos agregados densos de ~10-1.000 células que são organizadas espacialmente e exibem fenótipos clinicamente relevantes, como a tolerância antimicrobiana. Um dos maiores desafios para estudar como os agregados pa respondem à mudança do ambiente de escarro é a falta de sistemas nutricionalmente relevantes e robustos que promovam a formação agregada. Utilizando um meio de escarro CF sintético (SCFM2), a história de vida dos agregados pa pode ser observada usando microscopia de varredura a laser confocal (CLSM) e análise de imagem na resolução de uma única célula. Este sistema in vitro permite a observação de milhares de agregados de tamanho variável em tempo real, três dimensões e na escala de mícingos. Nos níveis individual e populacional, ter a capacidade de agrupar agregados por fenótipo e posição facilita a observação de agregados em diferentes estágios de desenvolvimento e sua resposta a mudanças no microambiente, como o tratamento com antibióticos, para ser diferenciado com precisão.
Introdução
Pseudomonas aeruginosa (Pa) é um patógeno oportunista que estabelece infecções crônicas em indivíduos imuno-comprometidos. Para aqueles com a doença genética fibrose cística (CF), essas infecções podem percorrer o curso de uma vida. Cf causa o acúmulo de uma escarro viscosa e rica em nutrientes nas vias aéreas, que se torna colonizada por uma variedade de patógenos microbianos ao longo do tempo. Pa é um dos patógenos cf mais prevalentes, colonizando as vias aéreas na primeira infância e estabelecendo infecções difíceis de tratar1. O pa continua sendo um problema clínico significativo e é considerado uma das principais causas de mortalidade naqueles com CF, apesar da melhoria dos regimes terapêuticos nos últimos anos2,3. Esse fenótipo de persistência e o aumento da tolerância a antibióticos têm conquistado ao Pa um lugar em um grupo de patógenos identificados tanto pelos Centros de Controle de Doenças (CDC) quanto pela Organização Mundial da Saúde (OMS) como prioridades de pesquisa para o desenvolvimento de novas estratégias terapêuticas - os patógenos ESKAPE4.
Como outros patógenos ESKAPE, a resistência a antibióticos adquirida é comum no Pa,mas também existem muitas propriedades intrínsecas que contribuem para a tolerância antimicrobiana pa. Entre eles está a capacidade do Pa de formar aglomerados agregados altamente densos de ~10-1.000 células, que podem ser observadas em múltiplas infecções, incluindo a escarro do paciente CF5,6. Semelhante ao Pa estudado em outros sistemas de biofilme, os agregados pa apresentam fenótipos clinicamente relevantes, como aumento da resistência a antibióticos e ativação da comunicação celular-célula (sensoriamento de quórum (QS). Por exemplo, agregados de Pa têm sido mostrados para usar comportamentos regulados por QS para combater outros micróbios, bem como tolerar tratamentos antimicrobianos, como a produção de pyocyanin7. A capacidade de estudar tais comportamentos oferece uma visão emocionante dos ecossistemas bacterianos em um ambiente semelhante ao em que eles existem no corpo humano.
Um dos maiores desafios para estudar como os agregados pa respondem à mudança do ambiente de escarro é a falta de sistemas nutricionalmente relevantes e robustos que promovam a formação agregada. Muito do que se sabe sobre pa foi descoberto usando sistemas in vitro nos quais as células crescem pltipicamente ou em uma arquitetura característica anexada à superfície, "cogumelo" que não foi observada in vivo8. Embora modelos clássicos de crescimento de biofilmes, como células de fluxo ou ágar sólido, tenham gerado amplo e valioso conhecimento sobre comportamentos bacterianos e mecanismos de tolerância a antibióticos, esses achados nem sempre se traduzem in vivo. Muitos modelos in vitro têm uma capacidade limitada de imitar o ambiente de crescimento do local de infecção humana, exigindo estudos in vivo caros. Por sua vez, muitos modelos in vivo carecem da flexibilidade e resolução proporcionadas por técnicas in vitro.
A fibrose sintética sputum (SCFM2) foi projetada para fornecer um ambiente para o crescimento de Pa semelhante ao experimentado durante a infecção crônica no pulmão CF. O SCFM2 inclui fontes nutricionais identificadas em sputa cf gestante, além de mucina, lipídios e DNA. O crescimento de Pa no SCFM2 requer um conjunto genético quase idêntico ao necessário para o crescimento da escória real e suporta a formação agregada pa natural9,10. Após a inoculação, as células planctônicas formam agregados que aumentam de tamanho através da expansão. As células individuais (referidas como migrantes) são liberadas de agregados, migram para áreas não colonizadas e formam novos agregados10. Este histórico de vida pode ser observado usando CLSM e análise de imagem na resolução de uma única célula. Os agregados de Pa formados em SCFM2 são de tamanhos semelhantes aos observados no pulmãoCF 10. Este modelo permite a observação de múltiplos agregados de tamanho variável em tempo real e em três dimensões na escala de mícingos. A microscopia de lapso de tempo permite o rastreamento de milhares (~50.000) de agregados em um experimento. O uso de software de análise de imagens permite a quantificação de fenótipos agregados de micrografos, incluindo volume agregado, área de superfície e posição em três dimensões até os 0,1 μm mais próximos, tanto nos níveis agregado individual quanto populacional. Ter a capacidade de agrupar agregados por fenótipo e posição permite a diferenciação de agregados em diferentes estágios de desenvolvimento com precisão, bem como sua resposta a um microambiente em mudança6,11.
A aplicação do SCFM2 para estudar agregados pa em ensaios de baixo volume e alto rendimento torna-o um modelo flexível e econômico. Como um meio definido, o SCFM2 oferece uniformidade e reprodutibilidade em várias plataformas, fornecendo um método nutricional e fisicamente relevante para estudar agregados pa in vitro9. As aplicações incluem seu uso em combinação com o CLSM para observar a organização espacial e a tolerância a antibióticos em alta resolução (como descrito neste artigo de métodos). A capacidade de realizar experimentos que fornecem dados em tempo real, em escala de micron, permite o estudo de interações intra-espécies e interespécies, pois elas podem ocorrer in vivo. Por exemplo, o SCFM2 já foi usado para estudar a dinâmica espacial da comunicação celular em populações agregadas através de uma rede de sistemas utilizados pela Pa para regular múltiplos genes que contribuem para a virulência e a patogênese6.

Figura 1: Representação gráfica dos principais passos experimentais. (A) SCFM2 é inoculado com células Pa e permitido formar agregados em um prato de cultura com fundo de vidro. (B) Os agregados são transferidos para o microscópio confocal, e o antibiótico é adicionado. São retratadas três réplicas técnicas (câmaras 1-3) e um poço de controle (4) de SCFM2 inoculado sem tratamento antibiótico. Agregados são imagens usando CLSM ao longo de 18 h. (C) Após a imagem inicial de 18h, os agregados são tratados com iodeto de propídio para visualizar células mortas e imagens usando CLSM (D) Agregados com fenótipo desejado são separados do SCFM2 usando FACS. Abreviaturas: SCFM2 = meio de escarro de fibrose cística sintética; Pa = Pseudomonas aeruginosa; CLSM = microscopia de varredura a laser confocal; FACS = classificação celular ativada por fluorescência. Clique aqui para ver uma versão maior desta figura.
Aqui, demonstra-se a utilidade do SCFM2 para estudar o impacto do tratamento antibiótico nos agregados de pa em tempo real, seguida pelo uso de uma abordagem de classificação celular para isolar populações de agregados com fenótipos distintos para análise a jusante(Figura 1).
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Prepare o meio de fibrose cística sintética (SCFM2)
NOTA: A preparação do SCFM2 compreende três etapas principais descritas abaixo (Figura 2). Para obter detalhes e referências completos, consulte9,10,12.
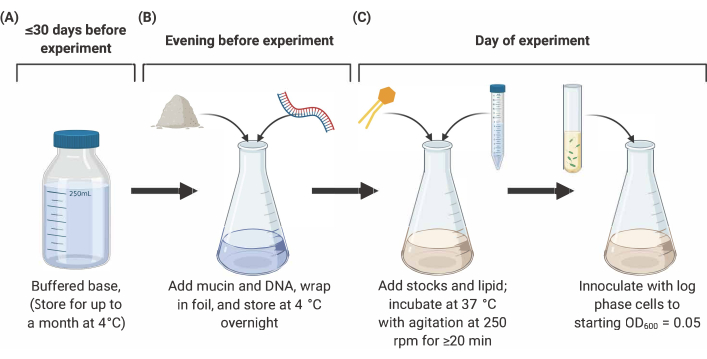
Figura 2: Preparação e inoculação do meio SCFM2. (A) A base tamponada é preparada utilizando sais e aminoácidos listados na Tabela 1 e Tabela 2. A base tamponada pode ser armazenada a 4 °C por até 30 dias, mas deve ser protegida contra exposição à luz. (B) A mucina e o DNA são adicionados a uma alíquota de base tamponada e dissolvidos em solução durante a noite a 4 °C. (C) Estoques lipídes e adicionais são adicionados à solução durante a noite e incubados a 37 °C com agitação a 250 rpm por 20 min. SFCM2 é então inoculado com células de fase de tronco lavadas em um OD600 = 0,05. Abreviaturas: SCFM2 = meio de escarro de fibrose cística sintética. Clique aqui para ver uma versão maior desta figura.
- Esterilização de mucina suína
- Prepare a mucina estéril em uma concentração final de 5 mg/mL em SCFM2. Por exemplo, para um volume de 5 mL de SCFM2, pese 25 mg de mucina tipo II em uma placa de Petri estéril e coloque em um esterilizador ultravioleta (UV) por 4h, suavemente agitando a cada hora.
- Após 4h, transfira a mucina tratada por UV em tubos de 1,7 mL autoclavados em condições estéreis e armazene a -20 °C.
- Para confirmar a esterilização completa, dissolva uma amostra de mucina em um líquido estéril, como água ou caldo de Luria Bertani (LB), e observe sob um microscópio.
NOTA: A mucina esterilizada pode ser armazenada a -20 °C por até 6 meses.
- Preparação de base tamponada
- Prepare soluções de sal e aminoácidos adicionando as quantidades apropriadas em peso à água desionizada conforme listado na Tabela 1. Esterilize todas as soluções de estoque usando um filtro de 0,22 μm, enrole em papel alumínio para proteger contra a degradação da luz e armazene a 4 °C por até um mês.
- Prepare a base tamponada combinando 190 mL de água deionizada com soluções de aminoácidos e sal por volumes listados na Tabela 1. Ajuste a solução para pH 6.8 e aumente para um volume final de 250 mL. Esterilize o filtro usando um filtro de 0,22 μm e armazene a 4 °C por até 30 dias.
- Na noite anterior ao experimento, aliquotar a quantidade desejada de base tamponada em um frasco de cultura de vidro, e adicionar mucina (5 mg/mL como descrito na etapa 1.1.1) e DNA purificado de esperma de salmão (0,6 mg/mL). Agitar suavemente, enrolar em papel alumínio e deixar a 4 °C durante a noite para permitir que a mucina e o DNA se dissolvam em solução.
NOTA: As alíquotas de DNA de esperma de salmão devem ser descongeladas no gelo, vórtices e adicionadas à base tamponada e à mucina. As soluções de estoque de triptofano, asparagine e tyrosina devem ser preparadas em soluções de NaOH (ver Tabela 1 para concentrações) em vez de água desionizada. Mantenha a base tamponada e todas as soluções de estoque embrulhadas em papel alumínio para proteger da exposição à luz. A maioria das ações ficará estável por até um mês. Os estoques que se tornam descoloridos não devem ser utilizados e devem ser substituídos antes do uso.
- Adição de estoques suplementares
- No dia do experimento, adicione os estoques listados na Tabela 2 à base tamponada contendo mucina e DNA.
NOTA: Prepare uma nova solução FeSO4 no dia do experimento, mas todos os outros estoques podem ser feitos com antecedência e armazenados por 30 dias a 4 °C. 1,2-Dioleoyl-sn-glycero-3-fosfocholina (DOPC) contém clorofórmio. Manuseie com cautela e não use chamas quase abertas. Após a adição do DOPC, incubar o SCFM2 a 37 °C com agitação (250 rpm) por pelo menos 20 min (para cultura de 5 mL). Este período de incubação permite que o clorofórmio no DOPC evapore. O frasco não deve ser hermético; em vez disso, cubra o frasco abrindo vagamente com papel alumínio.
- No dia do experimento, adicione os estoques listados na Tabela 2 à base tamponada contendo mucina e DNA.
2. Avaliação em tempo real da tolerância antimicrobiana em agregados bacterianos
- Prepare culturas noturnas
- Na noite anterior ao experimento, inocular 5 mL de caldo LB com várias colônias de Pa PAO1-pMRP9-113 de uma placa de ágar LB contendo antibiótico (carbenicilina 300 μg/mL). Cresça durante a noite a 37 °C com agitação a 250 rpm.
NOTA: Cultivar culturas durante a noite com a adição de antibióticos necessários para a seleção de plasmídeos necessários (aqui, a expressão de proteína fluorescente verde (GFP) plasmid, pMRP9-1). Observe que as células Pa devem ser lavadas antes que o SCFM2 seja inoculado. LB pode ser substituído por outros ricos meios de comunicação laboratoriais por culturas noturnas. Todos os isolados bacterianos devem ser tratados usando diretrizes BSL-2 apropriadas ao longo deste protocolo.
- Na noite anterior ao experimento, inocular 5 mL de caldo LB com várias colônias de Pa PAO1-pMRP9-113 de uma placa de ágar LB contendo antibiótico (carbenicilina 300 μg/mL). Cresça durante a noite a 37 °C com agitação a 250 rpm.
- Inoculado SCFM2
- No dia do experimento, diluir de volta as culturas noturnas de Pa 1:10 (cultura: mídia líquida) inoculando 500 μL em 5 mL de caldo LB fresco. Cresça células até a fase de tronco (60-90 min) a 37 °C com agitação a 250 rpm.
- Culturas de fase de registro de centrífugas a 10.000 × g por 5 min. Lave as células removendo o supernasciente e resusus pendentes em 3 mL de soro fisco esterilizado por filtro (PBS, pH 7.0). Repita duas vezes e resuspense a pelota em um volume final de 1 mL de PBS.
- Meça a absorção das células lavadas utilizando um espectotômetro a 600 nm (OD600),e calcule o volume de cultura necessário para um ODinicial de 600 de 0,05 em 5 mL de SCFM2. Inocular Pa no SCFM2, e vórtice suavemente para distribuir células por toda parte. Pipeta 1 mL do SCFM2 inoculado em cada câmara de um 4-well, fundo de vidro, prato óptico, e incubar por 4 h estaticamente a 37 °C.
NOTA: O tempo de duplicação das culturas Pa depende da tensão e da disponibilidade de oxigênio. No SCFM2, sob as condições descritas aqui, o tempo de duplicação de Pa é ~1,4 h10.
3. Visualização de agregados durante o tratamento com antibióticos com microscopia de varredura a laser confocal (CLSM)
NOTA: Esta seção descreve o uso de microscópio de varredura a laser confocal e software de captura de imagem para a imagem de agregados pa em SCFM2. O objetivo é observar e caracterizar a biomassa bacteriana restante (tolerante) após o tratamento com antibióticos. As etapas delineadas podem ser executadas com sucesso em outros microscópios confocal, embora o manual de operação do instrumento deva ser referenciado para orientação específica.
- Culturas Image Pa usando uma câmara aquecida ou uma microplacão aquecida instalada no palco do microscópio para manter uma temperatura ambiente de 37 °C. Inicie o módulo de Incubação pelo menos 2h antes do início do experimento para permitir que todos os aparelhos atinjam a temperatura desejada e reduzam ainda mais a expansão e o movimento durante a coleta de dados.
- Após 4h, transfira as culturas SCFM2 contendo células Pa para o estágio de microscópio aquecido. Designe 3 de 4 poços como réplicas técnicas para o tratamento de antibióticos, e considere o4º, bem como um controle sem tratamento, contendo apenas células Pa em SCFM2, sem antibiótico. Identifique agregados usando microscopia brightfield dentro da guia Localizar antes de qualquer excitação de repórteres fluorescentes. Defina uma área para imagem dentro de cada poço e armazene sua posição (coordenadas x-y-z) usando o módulo Posições no software de imagem.
- Use um objetivo de imersão em óleo de 63x para visualizar culturas Pa contendo a expressão GFP plasmid pMRP9-1 em SCFM2 com um comprimento de onda de excitação de 488 nm e comprimento de onda de emissão de 509 nm. Tire imagens usando a opção z-stack dentro do módulo Aquisição em intervalos de 1 μm (total de 60 fatias). Use o módulo de média de linha para reduzir a fluorescência de fundo no canal GFP dentro do volume total das imagens de pilha z de 60 μm (1.093,5 mm3). Tome imagens de controle de SCFM2 não clicado usando configurações idênticas para determinar a fluorescência de fundo para análise de imagem.
NOTA: As imagens são adquiridas produzindo 512 pixels x 512 pixels (0,26 μm x 0,26 μm pixels) imagens de 8 bits de pilha z que estão a 60 μm da base do deslizamento de tampas. - Use a opção de série temporal dentro do software de imagem para capturar 60 fatias em cada posição (bem) em intervalos de 15 minutos durante um período de 18 h. Use a estratégia de foco definitiva dentro do software para armazenar um plano focal para cada posição, que é retornado a cada ponto de tempo durante todo o experimento.
- Após um total de 4,5 h de incubação, imagem cada posição usando as configurações acima para determinar a biomassa agregada dentro de cada um dos quatro poços antes da adição de antibiótico.
- Após 6h de incubação total, adicione antibiótico a 2x-abaixo da concentração inibitória mínima (MIC) a cada réplica. Pipeta direta e suavemente no meio do poço, logo abaixo da interfase ar-líquido. Mantenha todas as culturas na câmara confocal aquecida.
NOTA: Aqui, foi utilizado sulfato de colistina com uma concentração de 140 μg/mL. - Comece a imagem após o tratamento com antibióticos clicando na opção Iniciar experimento dentro do programa de imagem.
NOTA: A concentração de antibióticos utilizada depende do antibiótico, do isolamento pa e se o usuário gostaria de examinar os efeitos de morte ou tolerância. Este experimento usa uma única dose. Doses adicionais podem ser adicionadas sem interromper culturas, se necessário.
4. Mancha de iodeto de propidium de pa agregados
NOTA: O iodeto de propidium (PI) é comumente utilizado como reagente de coloração para identificar células bacterianas inviáveis (mortas) na cultura. Aqui, é usado para identificar agregados sensíveis ao tratamento antibiótico aplicado na seção 3. Ao longo deste protocolo, a expressão e detecção de GFP em células Pa é usada como o principal proxy para viabilidade celular. Esta etapa final permite que a imagem confocal seja usada mais uma vez para identificar o posicionamento espacial de agregados vivos/mortos em relação uns aos outros. Além disso, os agregados são identificados como vivos/mortos para classificação de células a jusante na seção 5.
- Depois de 18 h, adicione PI a cada poço do prato de fundo óptico de quatro câmaras contendo culturas SCFM2. Siga as instruções do fabricante para o volume de PI e tempo de incubação (por exemplo,~2 μL por mL de cultura, ~20-30 min).
5. Isolar células vivas de agregados usando uma abordagem FACS
NOTA: A FACS apresenta uma plataforma poderosa para classificar e isolar grupos de células de acordo com um fenótipo marcado fluorescentemente. Aqui, o FACS é usado para isolar agregados vivos (tolerantes a antibióticos) de agregados não viáveis.
- Após a coloração com iodeto de propídio, remova as culturas da incubação e transfira para um instrumento FACS em um recipiente isolado para manter 37 °C.
- Execute 1 mL aliquots de SCFM2 contendo agregados pa na menor taxa de fluxo.
NOTA: Cada alíquota conterá ~15.000 agregados. - Para detectar gfp, ilumine as células com um laser de 488 nm e grave a altura do sinal fluorescente a 530/30 nm. Visualize a mancha pi por excitação com um laser de 561 nm e regise a altura do sinal fluorescente em 610/20 nm. Realize a classificação usando um bocal de 70 u.
NOTA: Os agregados classificados podem ser agrupados de várias maneiras, dependendo do aplicativo do usuário. Neste caso, o FACS foi usado para classificar agregados pa viáveis para sequenciamento de RNA a jusante. As aplicações alternativas são discutidas abaixo.
6. Análise de imagem
NOTA: A microscopia de lapso de tempo gera grandes quantidades de dados. Um experimento de 18 h para a observação de agregados pa em SCFM2 identifica ~50.000 agregados ao longo do tempo, que têm o potencial de ser caracterizado para volume e posicionamento espacial. Use um software de análise de imagem para quantificar dinâmicas agregadas no SCFM2:
- Para estudos agregados em SCFM2, quantifique a fluorescência de GFP de fundo criando um histograma de contagens no canal GFP que é produzido para SCFM2 nãoculado e SCFM2 inoculado com pa strain PAO1 carregando pMRP9-1. Para garantir que os voxels GFP detectados se correlacionem com a biomassa Pa, defina um voxel GFP+ como ≥1,5x o valor da contagem de fundo do GFP.
NOTA: A fluorescência de fundo é definida como o maior valor voxel de três posições escolhidas aleatoriamente, médias. As contagens de fundo são, como medida padrão, subtraídas de todos os pixels em imagens experimentais pelo software de análise de imagens. - Após subtração de fundo no módulo 'Ultrapassar', produza isosuperfícies para todos os voxels restantes.
- Para detectar agregados individuais, habilite a opção Objetos divididos e defina agregados como objetos com volumes de ≥5 μm3. Use o módulo Vantage no software de análise de imagens para calcular o volume, x-y-z e a soma de voxels GFP para cada objeto individual. Exporte esses dados para uma plataforma estatística externa.
NOTA: Alguns softwares de análise de imagem permitem a exportação de vários fentoypes quantitativos ao mesmo tempo, permitindo que as correlações sejam calculadas. - Filtrar dados exportados do módulo Vantage por tamanho para garantir que nenhum objeto de <0,5 μm3 (biomassa dispersa) permaneça. Para cada objeto individual dentro da imagem, calcule a distância de si mesmo em relação a outros objetos (agregados) usando o módulo Vantage do software de análise de imagem ou manualmente com a seguinte equação.
d = sqrt((x2− x1)2 + (y2− y1)2 + (z2− z1)2) (1) - Use cálculos SOMA e MÉDIA para encontrar a biomassa total e o volume agregado médio. Alternativamente, exportar dados para outras plataformas estatísticas ou scripts, por exemplo,a distribuição de agregados através da biomassa como discutido nos resultados representativos (script inédito em colaboração com o laboratório Whiteley, Georgia Institute of Technology).
Access restricted. Please log in or start a trial to view this content.
Resultados
Este trabalho detalha métodos para observar os agregados pa em alta resolução e em um ambiente semelhante ao da infecção crônica do pulmão CF9,10,12. O SCFM2 fornece um sistema in vitro que promove a agregação natural de células Pa em tamanhos semelhantes aos observados durante a infecção real10. A adaptabilidade do SCFM2 como um meio definido pode ser aproveitada pa...
Access restricted. Please log in or start a trial to view this content.
Discussão
Este trabalho introduziu metodologias que podem ser combinadas para estudar populações bacterianas agregadas na presença e ausência de tratamento antibiótico. O CLSM de alta resolução permite a visualização de mudanças na biomassa agregada e a orientação estrutural dos agregados em tempo real quando expostos a antibióticos. Além disso, podem ser quantificadas as características físicas e estruturais da biomassa que permanecem após o tratamento com antibióticos, com o objetivo de correlacionar essas obse...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
A S.E.D é apoiada por fundos iniciantes fornecidos pelo Departamento de Medicina Molecular da Universidade do Sul da Flórida, bem como uma bolsa de pesquisa CFF (DARCH19G0) o N.I.H (5R21AI147654 - 02 (PI, Chen)) e o UsF Institute on Microbiomes. Agradecemos ao laboratório whiteley pela colaboração contínua envolvendo conjuntos de dados relacionados a este manuscrito. Agradecemos ao Dr. Charles Szekeres por facilitar a classificação da FACS. Os números foram criados pela A.D.G e S.E.D usando Biorender.com.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Amino acids | |||
| Alanine | Acros Organics | 56-41-7 | |
| Arginine HCl | MP | 1119-34-2 | |
| Asparagine | Acros Organics | 56-84-8 | Prepared in 0.5 M NaOH |
| Cystine HCl | Alfa Aesar | L06328 | |
| Glutamic acid HCl | Acros Organics | 138-15-8 | |
| Glycine | Acros Organics | 56-40-6 | |
| Histidine HCl H2O | Alfa Aesar | A17627 | |
| Isoleucine | Acros Organics | 73-32-5 | |
| Leucine | Alfa Aesar | A12311 | |
| Lysine HCl | Alfa Aesar | J62099 | |
| Methionine | Acros Organics | 63-68-3 | |
| Ornithine HCl | Alfa Aesar | A12111 | |
| Phenylalanine | Acros Organics | 63-91-2 | |
| Proline | Alfa Aesar | A10199 | |
| Serine | Alfa Aesar | A11179 | |
| Threonine | Acros Organics | 72-19-5 | |
| Tryptophan | Acros Organics | 73-22-3 | Prepared in 0.2 M NaOH |
| Tyrosine | Alfa Aesar | A11141 | Prepared in 1.0 M NaOH |
| Valine | Acros Organics | 72-18-4 | |
| Antibiotic | |||
| Carbenicillin | Alfa Aesar | J6194903 | |
| Day-of Stocks | |||
| CaCl2 * 2H2O | Fisher Chemical | C79-500 | |
| Dextrose (D-glucose) | Fisher Chemical | 50-99-7 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Fisher (Avanti Polar Lipids) | 4235-95-4 | shake 15-20 min at 37 °C to evaporate chloroform |
| FeSO4 * 7H2O | Acros Organics | 7782-63-0 | this stock equals 1 mg/mL, MUST make fresh |
| L-lactic acid | Alfa Aesar | L13242 | pH stock to 7 with NaOH |
| MgCl2 * 6H2O | Acros Organics | 7791-18-6 | |
| N-acetylglucosamine | TCI | A0092 | |
| Prepared solids | |||
| Porcine mucin | Sigma | M1778-100G | UV-sterilize |
| Salmon sperm DNA | Invitrogen | 15632-011 | |
| Stain | |||
| Propidium iodide | Alfa Aesar | J66764MC | |
| Salts | |||
| K2SO4 | Alfa Aesar | A13975 | |
| KCl | Alfa Aesar | J64189 | add solid directly to buffered base |
| KNO3 | Acros Organics | 7757-79-1 | |
| MOPS | Alfa Aesar | A12914 | add solid directly to buffered base |
| NaCl | Fisher Chemical | S271-500 | add solid directly to buffered base |
| Na2HPO4 | RPI | S23100-500.0 | |
| NaH2PO4 | RPI | S23120-500.0 | |
| NH4Cl | Acros Organics | 12125-02-9 | add solid directly to buffered base |
| Consumables | |||
| Conical tubes (15 mL) | Olympus plastics | 28-101 | |
| Conical tubes (50 mL) | Olympus plastics | 28-106 | |
| Culture tubes w/air flow cap | Olympus plastics | 21-129 | |
| 35 mm four chamber glass-bottom dish | CellVis | NC0600518 | |
| Luria Bertani (LB) broth | Genessee Scientific | 11-118 | |
| Phosphate-buffered saline (PBS) | Fisher Bioreagents | BP2944100 | |
| Pipet tips (p200) | Olympus plastics | 23-150RL | |
| Pipet tips (p1000) | Olympus plastics | 23-165RL | |
| Serological pipets (5 mL) | Olympus plastics | 12-102 | |
| Serological pipets (25 mL) | Olympus plastics | 12-106 | |
| Serological pipets (50 mL) | Olympus plastics | 12-107 | |
| Ultrapure water (RNase/DNase free); nanopure water | Genessee Scientific | 18-194 | Nanopure water used for preparation of solutions in Table 1 |
| Syringes (10 mL) | BD | 794412 | |
| Syringes (50 mL) | BD | 309653 | |
| 0.22 mm PES syringe filter | Olympus plastics | 25-244 | |
| PS cuvette semi-mico | Olympus plastics | 91-408 | |
| Software | |||
| Biorender | To prepare the figures | ||
| FacsDiva6.1.3 | Becton Dickinson, San Jose, CA | ||
| Imaris | Bitplane | version 9.6 | |
| Zen Black | |||
| Equipment | |||
| FacsAriallu | Becton Dickinson, San Jose, CA | ||
| LSM 880 confocal laser scanning microscope | Zeiss |
Referências
- Ramsay, K. A., et al. The changing prevalence of pulmonary infection in with fibrosis: A longitudinal analysis. Journal of Cystic Fibrosis. 16 (1), 70-77 (2017).
- Bessonova, L., et al. Data from the US and UK cystic fibrosis registries support disease modification by CFTR modulation with ivacaftor. Thorax. 73 (8), 731-740 (2018).
- Breuer, O., et al. Changing prevalence of lower airway infections in young children with cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 200 (5), 590-599 (2019).
- O'Donnell, J. N., Bidell, M. R., Lodise, T. P. Approach to the treatment of patients with serious multidrug-resistant Pseudomonas aeruginosa infections. Pharmacotherapy. 40 (9), 952-969 (2020).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Darch, S. E., et al. Spatial determinants of quorum signaling in a Pseudomonas aeruginosa infection model. Proceedings of the National Academy of Sciences of the United States of America. 115 (18), 4779-4784 (2018).
- Zhu, K., Chen, S., Sysoeva, T. A., You, L. Universal antibiotic tolerance arising from antibiotic-triggered accumulation of pyocyanin in Pseudomonas aeruginosa. PLoS Biology. 17 (12), 3000573(2019).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and resistance of Pseudomonas aeruginosa biofilms to antimicrobial agents-how P. aeruginosa can escape antibiotics. Frontiers in Microbiology. 10, 913(2019).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proceedings of the National Academy of Sciences of the United States of America. 112 (13), 4110-4115 (2015).
- Darch, S. E., et al. Phage inhibit pathogen dissemination by targeting bacterial migrants in a chronic infection model. MBio. 8 (2), 00240(2017).
- Jorth, P., et al. Regional isolation drives bacterial diversification within cystic fibrosis lungs. Cell Host & Microbe. 18 (3), 307-319 (2015).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Davies, D. G., et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science. 280 (5361), 295-298 (1998).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Stacy, A., et al. Bacterial fight-and-flight responses enhance virulence in a polymicrobial infection. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7819-7824 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados