このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
緑膿菌感染モデルのリアルタイム評価ツール
要約
合成嚢胞性線維化痰培地(SCFM2)は、共焦点レーザー走査顕微鏡と蛍光活性化細胞選別の両方と組み合わせて利用して、細菌凝集体を高分解能で観察することができる。本論文では、将来の研究のためのプラットフォームとして抗菌治療中の集団を評価する方法を詳述する。
要約
緑膿菌(Pa)は 嚢胞性線維症(CF)に関連する最も一般的な日和見病原体の1つである。 Pa のコロニー形成が確立されると、感染菌の大部分が気道痰内にバイオフィルムを形成する。CF痰から分離された Pa バイオフィルムは、空間的に組織化され、抗菌耐性などの臨床的に関連する表現型を示す〜10〜1,000個の細胞の小さく密な凝集体で増殖することが示されている。変化する痰環境に Pa 凝集体がどのように反応するかを研究する上で最大の課題の1つは、凝集形成を促進する栄養的に関連性の高い堅牢なシステムの欠如です。合成CF痰培地(SCFM2)を用いて 、Pa 凝集体の寿命を観察するには、共焦点レーザー走査顕微鏡(CLSM)と単一細胞の分解能での画像解析を用いる。この インビトロ システムは、リアルタイム、3次元、およびミクロンスケールでの様々なサイズの数千の集合体の観察を可能にする。個体レベルおよび集団レベルでは、表現型および位置によって集合体をグループ化する能力を有することは、異なる発達段階での凝集体の観察を容易にし、抗生物質治療などの微小環境の変化に対する応答を精密に区別することを促進する。
概要
緑膿菌(Pa)は、免疫障害を持つ個人に慢性感染を確立する日和見病原体です。遺伝性疾患嚢胞性線維症(CF)を有する人にとって、これらの感染症は一生に一度の経過に及ぶ可能性がある。CFは、気道に粘性のある栄養豊富な痰の蓄積を引き起こし、時間の経過とともに様々な微生物病原体によって植民地化される。Paは最も普及しているCF病原体の1つで、幼児期に気道を植民地化し、治療が困難な感染症1を確立する。Paは依然として重大な臨床的問題であり、近年2,3で改善された治療レジメンにもかかわらず、CFを有する人々における死亡率の主要な原因と考えられている。この持続性表現型および抗生物質耐性の増加は、新しい治療戦略の開発のための研究の優先事項として、疾病管理センター(CDC)と世界保健機関(WHO)の両方によって同定された病原体群のPaに位置を獲得している- ESKAPE病原体4。
他のESKAPE病原体と同様に、獲得した抗生物質耐性はPaでは一般的であるが、Pa抗菌耐性に寄与する多くの固有の特性もある。これらの中には、−10〜1,000細胞の凝集高密度クラスターを形成するPaの能力があり、これはCF患者痰5、6を含む複数の感染症で観察することができる。他のバイオフィルムシステムで研究されたPaと同様に、Pa凝集体は、抗生物質に対する耐性の増加や細胞間コミュニケーションの活性化(クォーラムセンシング(QS))などの臨床的に関連する表現型を表示する。例えば、Paの集合体は、他の微生物と戦うとともに、ピオシャニン7の産生などの抗菌治療を容認するためにQS規制行動を使用することが示されている。このような行動を研究する能力は、人体に存在する環境と同様の環境で細菌生態系に関するエキサイティングな洞察を提供します。
変化する痰環境にPa凝集体がどのように反応するかを研究する上で最大の課題の1つは、凝集形成を促進する栄養的に関連性の高い堅牢なシステムの欠如です。Paについて知られていることの多くは、細胞がプランクトニックに成長するインビトロシステムを使用して発見された、または生体内8で観察されていない特徴的な表面に付着した「キノコ」アーキテクチャで発見されている。フローセルや固体寒天などの古典的なバイオフィルム成長モデルは、細菌の挙動と抗生物質耐性のメカニズムに関する広範かつ貴重な知識を生み出していますが、これらの知見は必ずしもin vivoで翻訳されるとは限りません。多くのin vitroモデルは、ヒト感染部位の成長環境を模倣する能力が限られており、生体内研究では高価なコストが必要である。さらに、多くのin vivoモデルは、インビトロ技術によって得られる柔軟性と解像度を欠いている。
合成嚢胞性線維症痰(SCFM2)は、CF肺の慢性感染時に経験したようなPa成長の環境を提供するように設計されている。SCFM2は、ムチン、脂質、およびDNAに加えて、期待CF痰で同定された栄養源を含む。SCFM2のPa成長は、実際の痰の成長に必要なほぼ同一の遺伝子を必要とし、自然なPa凝集形成9、10をサポートする。接種後、プランクトニック細胞は膨張によって大きさが大きくなる凝集体を形成する。個々のセル (移民と呼ばれます) は、集合から解放され、非植民地化された領域に移行され、新しい集合体10を形成します。この生命史は、単一の細胞の解像度でCLSMおよび画像解析を使用して観察することができる。SCFM2で形成されたPaの集合体は、CF肺10で観察されるものと同様のサイズである。このモデルは、リアルタイムで、ミクロンスケールで3次元で様々なサイズの複数の集合体を観察することができます。タイムラプス顕微鏡は、1回の実験で数千個(約50,000)の集合体を追跡することを可能にします。画像解析ソフトウェアを使用することで、個々の集合体レベルと母集団レベルの両方で、3次元の集合体積、表面積、位置を含むマイクログラフの集合式の定量を可能にします。表現型と位置によって集合体をグループ化する能力を有することで、異なる発達段階での凝集体の分化と、変化する微小環境6,11への応答が可能となる。
SCFM2を使用してPa集合体を低容量および高スループットアッセイで研究すると、柔軟で費用対効果の高いモデルになります。定義された媒体として、SCFM2は複数のプラットフォームにわたって均一性および再現性を提供し、vitro9でPa集合体を研究するための栄養的および物理的に関連する方法を提供する。アプリケーションには、CLSMと組み合わせて空間組織と抗生物質耐性を高解像度で観察するアプリケーションが含まれます(この方法の論文で説明したように)。リアルタイムのミクロンスケールのデータを提供する実験を行う能力は、それらが生体内で起こり得る種間および種間相互作用の研究を可能にする。例えば、SCFM2は以前、P.が毒性および病原性に寄与する複数の遺伝子を調節するために利用するシステムのネットワークを介して、集合集団における細胞間コミュニケーションの空間的ダイナミクスを研究するために使用されてきた。

図1: 主な実験工程のグラフィカル描写( A)SCFM2はPa細胞を接種し、ガラス底培養皿に凝集体を形成させる。(B)凝集体を共焦点顕微鏡に移し、抗生物質を加える。描かれているのは、抗生物質治療を伴わない3つの技術的複製(チャンバー1-3)と、接種されたSCFM2のコントロールウェル(4)である。凝集体は、18時間にわたってCLSMを用いて画像化され、(C)初期18時間イメージング後、死細胞を視覚化するためにヨウ化プロピジウムで骨材を処理し、所望の表現型を有する凝集体をFACSを用いてSCFM2から分離する。略語: SCFM2 = 合成嚢胞性線維症痰培地;Pa =緑膿菌CLSM = 共焦点レーザー走査顕微鏡;FACS = 蛍光活性化細胞分類。この図の大きなバージョンを表示するには、ここをクリックしてください。
ここで、リアルタイムでPa集合体に対する抗生物質治療の影響を研究するSCFM2の有用性が示され、続いて下流分析のための明確な型素型を有する集合体の集団を分離する細胞選別アプローチの使用が示される(図1)。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 合成嚢胞性線維症培地(SCFM2)を調製する
注: SCFM2 の準備は、以下に概説する 3 つの主要な段階から構成されます (図 2)。詳細と参照については、9、 10、12を参照してください。
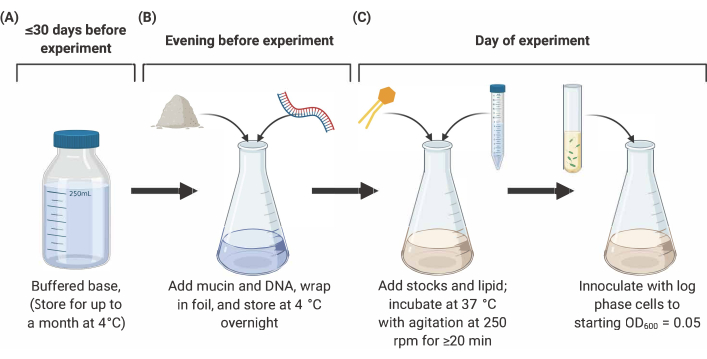
図2: SCFM2培地の調製と接種(A)緩衝塩基は、表1および表2に記載されている塩およびアミノ酸を用いて調製される。緩衝ベースは、最大30日間4°Cで保存できますが、光の露出から保護する必要があります。(B)ムチンとDNAを緩衝塩基のアリコートに添加し、4°C(C)で一晩溶液に溶解し、脂質および追加のストックを一晩溶液に添加し、250rpmで250rpmで37°Cで20分間インキュベーションしてインキュベートし、SFCM2は洗浄された、ログ相細胞をOD600= 0.05で接種する。略語: SCFM2 = 合成嚢胞性線維症痰培地.この図の大きなバージョンを表示するには、ここをクリックしてください。
- ブタムチンの殺菌
- SCFM2で5mg/mLの最終濃度で滅菌ムチンを調製します。例えば、SCFM2の5mL体積の場合、滅菌ペトリ皿中の25mgのタイプのムチンを秤量し、紫外線(UV)滅菌器に4時間、穏やかに1時間攪拌する。
- 4時間後、UV処理されたムチンを無菌状態でオートクレーブ1.7mLチューブに移し、-20°Cで保存します。
- 完全な滅菌を確認するには、水やルリアベルタニ(LB)ブロスなどの滅菌液にムチンのサンプルを溶解し、顕微鏡で観察します。
注:滅菌されたモチンは、6ヶ月まで-20°Cで保存することができます。
- 緩衝された基盤の準備
- 塩およびアミノ酸ストック液を、 表1に記載されているように脱イオン水に適量を加えて調製する。0.22 μmフィルターを使用してすべてのストックソリューションをフィルター滅菌し、ホイルで包んで光の劣化から保護し、4°Cで最大1ヶ月間保存します。
- 190 mLの脱イオン水とアミノ酸および塩ストック溶液を組み合わせて、 表1に記載された体積で緩衝塩基を調製する。pH 6.8に溶液を調整し、250 mLの最終容積に増加させます。0.22 μmフィルターを使用してフィルター滅菌し、4°Cで最大30日間保存します。
- 実験前の夕方、ガラス培養フラスコに緩衝塩基の所望の量をアリコートし、ムチン(ステップ1.1.1で説明した5mg/mL)および精製されたサケ精子DNA(0.6mg/mL)を加えた。軽く撹拌し、ホイルで包み、4°Cで一晩放置し、ムチンとDNAを溶液に溶解させます。
注:サケ精子DNAアリコートは、氷の上で解凍し、渦を起こさせ、緩衝塩基およびムチンに添加するべきである。トリプトファン、アスパラギン、およびチロシンストック溶液は、脱イオン水の代わりにNaOH(濃度については 表1 を参照)の溶液で調製されなければならない。光の露出から保護するために、バッファ付きベースとすべてのストックソリューションをホイルで包み込んでおきます。ほとんどの株は最大1ヶ月間安定しています。変色した銘柄は使用しないでくださいし、使用前に交換する必要があります。
- 補足株式の追加
- 実験当日に、 表2 に記載されているストックを、ムチンとDNAを含む緩衝ベースに追加します。
注:実験の日に新鮮なFeSO4 溶液を準備しますが、他のすべての在庫は、事前に作ることができ、4 °Cで30日間保存することができます、2-ジオレオイル-sn-グリセロ-3-ホスホコリン(DOPC)はクロロホルムが含まれています。注意して取り扱い、炎の近くで使用しないでください。DOPCを添加した後、SCFM2を37°Cで、少なくとも20分間(5mL培養)の揺れ(250rpm)でインキュベートする。このインキュベーション期間は、DOPCのクロロホルムが蒸発することを可能にする。フラスコは気密であってはならない。代わりに、フラスコの開口部をホイルでゆるく覆います。
- 実験当日に、 表2 に記載されているストックを、ムチンとDNAを含む緩衝ベースに追加します。
細菌凝集体における抗菌耐性のリアルタイム評価
- 一晩の文化を準備する
- 実験前の夕方に、抗生物質(カルベニシリン300 μg/mL)を含むLB寒天プレートからPaPAO1-pMRP9-113のコロニーを含むLBスープの5 mLを接種する。250 rpmで撹拌して37°Cで一晩成長させます。
注:必要なプラスミドの選択に必要な抗生物質を添加して一晩培養を成長させます(ここでは、緑色蛍光タンパク質(GFP)発現プラスミド、pMRP9-1)。なお 、Pa 細胞はSCFM2が接種される前に洗浄される。LBは、一晩培養のために他のリッチラボメディアに置き換えることができます。すべての細菌分離株は、このプロトコル全体で適切なBSL-2ガイドラインを使用して処理する必要があります。
- 実験前の夕方に、抗生物質(カルベニシリン300 μg/mL)を含むLB寒天プレートからPaPAO1-pMRP9-113のコロニーを含むLBスープの5 mLを接種する。250 rpmで撹拌して37°Cで一晩成長させます。
- イノキュレート SCFM2
- 実験の日に 、Pa 1:10(培養:液体培地)の一晩培養物を5mLに5mLの新鮮なLBスープに接種して、一晩培養した後ろに希釈します。250 rpmで撹拌して37°Cで丸ごと(60〜90分)まで細胞を成長させます。
- 遠心分離機は、5分間10,000×gでの相培養をログします。上清を除去し、フィルター滅菌したリン酸緩衝食塩(PBS、pH 7.0)の3mLで再懸濁して細胞を洗浄します。2回繰り返し、PBSの最終体積1mLでペレットを再懸濁する。
- 600 nm(OD600)の分光光度計を用いて洗浄細胞の吸光度を測定し、SCFM2の5mLで0.05の開始OD600 に必要な培養量を算出する。 Pa をSCFM2に接種し、渦を穏やかにして細胞全体に分配します。4ウェル、ガラス底、光学皿の各チャンバーに接種したSCFM2のピペット1mLを、37°Cで4h静的にインキュベートする。
注:Pa培養の倍加時間は、歪みと酸素の利用可能性に依存します。SCFM2では、ここで説明する条件の下で、Paの倍加時間は〜1.4時間10.
3. 共焦点レーザー走査顕微鏡(CLSM)による抗生物質治療中の凝集体の可視化
注: このセクションでは、SCFM2での Pa 集合体のイメージング用の共焦点レーザー走査顕微鏡と画像キャプチャソフトウェアの使用について説明します。目的は、抗生物質による治療後に残っている(耐性の)細菌バイオマスを観察し、特徴付ける。説明した手順は、他の共焦点顕微鏡で成功して実行できますが、器械操作マニュアルは特定の指導のために参照されるべきである。
- 画像 Pa 培養は、37°Cの周囲温度を維持するために、顕微鏡ステージに取り付けられた加熱室または加熱マイクロプレートのいずれかを使用した。 実験開始の少なくとも2時間前に インキュベーション モジュールを起動して、全ての装置が所望の温度に達するようにし、データ収集中にさらなる膨張と移動を低減します。
- 4時間後 、Pa 細胞を含むSCFM2培養物を加熱顕微鏡ステージに移す。4つの井戸のうち3つの井戸を抗生物質治療のための技術的複製として指定し、4番目 の治療コントロールと、抗生物質なしでSCFM2の Pa 細胞のみを含むノー治療コントロールと考えてください。蛍光レポーターの励起の前に 、位置指定 タブ内の明視野顕微鏡を使用して凝集体を識別します。各ウェル内でイメージング用の領域を定義し、イメージ作成ソフトウェアの 位置 モジュールを使用して位置(x-y-z座標)を保存します。
- 63x油浸性目標を使用して、488 nmの励起波長と509nmの発光波長を有するSCFM2のGFP発現プラスミドpMRP9-1を含む Pa 培養物を視覚化します。1 μm間隔(合計60スライス)で 、取得 モジュール内のZスタックオプションを使用して画像を撮影します。 ライン平均 化モジュールを使用して、60 μm z スタックイメージの総容量内での GFP チャネルのバックグラウンド蛍光を低減します (1,093.5 mm3)。同一の設定を使用して、画像分析のための背景蛍光を決定することにより、単線SCFM2の制御画像を取ります。
注:画像は、カバースリップの底部から60 μmの8ビットzスタック画像を512ピクセルx 512ピクセル(0.26 μm x 0.26 μmピクセル)生成することによって取得されます。 - イメージングソフトウェア内の時系列オプションを使用して、18時間の15分間隔で各位置(ウェル)で60枚のスライスをキャプチャします。ソフトウェア内の明確な焦点戦略を使用して、各位置の焦点面を保存し、実験全体を通して各時点で戻されます。
- 合計4.5時間のインキュベーションの後、上記の設定を使用して各位置を画像化し、抗生物質を添加する前に4つのウェルのそれぞれ内の総バイオマスを決定します。
- 6時間の全インキュベーションの後、各複製に2x以下の最小阻害濃度(MIC)で抗生物質を添加する。ピペットは、空気液体間相のすぐ下の井戸の真ん中に直接、穏やかに入ります。加熱された共焦点室ですべての培養物を維持する。
注:ここでは、140μg/mLの濃度でコリスチン硫酸を使用しました。 - イメージングプログラム内の実験 開始オプションを クリックして、抗生物質後の治療のイメージングを開始します。
注:使用される抗生物質濃度は、抗生物質 、Pa 分離物、およびユーザーが殺す効果または耐性効果を調べたいかどうかに依存します。この実験は、単一の用量を使用します。追加の用量は、必要に応じて培養を中断することなく追加することができます。.
4. パ凝集体のヨウ化プロピジウム染色
注:ヨウ化プロピジウム(PI)は、培養中の生存不可能な(死んだ)細菌細胞を同定するための染色試薬として一般的に利用されています。ここでは、セクション3で適用される抗生物質治療に敏感な凝集体を同定するために用いられる。このプロトコルを通して 、Pa 細胞におけるGFPの発現および検出は細胞生存能の主要な代理として使用される。この最終ステップでは、共焦点イメージングをもう一度使用して、互いに関連して生きている/死んだ集合体の空間的位置を特定することができます。さらに、セクション 5 でのさらに下流セルの並べ替えのために、集約はライブ/デッドとして識別されます。
- 18時間後、SCFM2培養物を含む4チャンバ式光学底皿の各ウェルにPIを加える。PIの容積とインキュベーション時間(例えば、培養液のmLあたり〜2μL、〜20〜30分)のメーカーの指示に従ってください。
5. FACS アプローチを使用して、集合体から生細胞を分離する
注: FACS は、蛍光タグ付き表現型に従って細胞のグループを選別し、分離する強力なプラットフォームを提供します。ここで、FACSは、生存(抗生物質耐性)凝集を生存不能な集合体から分離するために使用される。
- ヨウ化プロピジウムで染色した後、培養から培養液を除去し、37°Cを維持するために絶縁容器内のFACS器具に移す。
- 最も低い流量でPa集合体を含むSCFM2の1 mLアリコートを実行する。
注:各アリコートには約15,000個の集計が含まれます。 - GFPを検出するには、488 nmレーザーで細胞を照らし、530/30 nmの蛍光信号高さを記録します。561 nmレーザーで励起してPI染色を可視化し、610/20nmで蛍光信号の高さを記録します。70-u ノズルを使用してソートを実行します。
注: 並べ替えられた集計は、ユーザーのアプリケーションに応じて複数の方法でプールできます。この場合、FACSは、下流RNAシーケンシングのために実行可能な Pa 凝集体をソートするために使用されました。代替アプリケーションについては、以下で説明します。
6. 画像解析
注意: タイムラプス顕微鏡は大量のデータを生成します。SCFM2で Pa 集合体を観測する18時間の実験では、時間の経過とともに約50,000個の集合体を特定し、体積および空間位置決めに特徴付けられる可能性を有する。画像解析ソフトウェアを使用して、SCFM2 の集約ダイナミクスを定量化します。
- SCFM2の集合研究では、pMRP9-1を運ぶ Pa 株PAO1を接種した単線SCFM2およびSCFM2のために産生されるGFPチャンネルでカウントのヒストグラムを作成することによって、GFP蛍光の背景を定量化する。検出された GFP ボクセルが Pa バイオマスと相関していることを確認するには、GFP+ ボクセルを gFP バックグラウンドカウント値 ≥1.5x として定義します。
注: バックグラウンド蛍光は、3つのランダムに選択された位置の最高ボクセル値として定義され、平均されます。背景数は、標準的な尺度として、画像解析ソフトウェアによって実験画像内のすべてのピクセルから差し引かれます。 - 「昇天」モジュールで背景を減算した後、残りのすべてのボクセルに対して等値面を生成します。
- 個々の集計を検出するには、[ オブジェクトの分割 ]オプションを有効にし、ボリュームが≥5 μm3のオブジェクトとして集約を定義します。イメージ解析ソフトウェアの Vantage モジュールを使用して、個々のオブジェクトの GFP ボクセルのボリューム、x-y-z、合計を計算します。このデータを外部の統計プラットフォームにエクスポートします。
注: 一部の画像解析ソフトウェアでは、複数の定量フェントイを一度にエクスポートできるため、相関を計算できます。 - Vantageモジュールからサイズでエクスポートされたフィルターデータは、<0.5 μm3(分散バイオマス)の物体が残らないようにします。画像内の個々のオブジェクトごとに、画像解析ソフトウェアのVantageモジュールを使用するか、次の式を使用して手動で他のオブジェクト(集計)に対してそれ自体からの距離を計算します。
d = sqrt(((x2- x1)2 + (y2- y1)2 + (z2- z1)(1) - 合計と平均の計算を使用して、総バイオマスと平均総計量を見つけます。あるいは、データを他の統計プラットフォームまたはスクリプト( 例えば、代表的な結果で説明されているようにバイオマス全体の集合体の分布)にエクスポートする(ジョージア工科大学ホワイトリー研究所と共同で未発表のスクリプト)。
Access restricted. Please log in or start a trial to view this content.
結果
この研究は、CF肺9、10、12の慢性感染と同様の環境において、高分解能でPa凝集体を観察する方法を詳述する。SCFM2は、実際の感染時に観察されたものと同様のサイズでPa細胞の自然な凝集を促進するインビトロシステムを提供する10。定義された媒体としてのSCFM2の適応性は、多くの研?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この研究は、抗生物質治療の有無において細菌集合体集団を研究するために組み合わせることができる方法論を導入した。高解像度CLSMは、抗生物質にさらされると、凝集バイオマスの変化と、リアルタイムでの凝集物の構造的指向の可視化を可能にします。また、抗生物質による処理後に残るバイオマスの物理的・構造的特徴を定量化し、RNA-seqを用いた将来の遺伝子発現研究とこれらの観?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者には利益相反はありません。
謝辞
S.E.Dは、南フロリダ大学分子医学部のスタートアップ資金と、CFF研究助成金(DARCH19G0)N.I.H(5R21AI147654 - 02(PI、陳))およびUSF微生物叢研究所によって支援されています。ホワイトリー・ラボは、この原稿に関連するデータセットを含む継続的なコラボレーションに感謝します。FACSの選別を促進してくれたチャールズ・シェカーズ博士に感謝します。数字は、Biorender.com を使用してA.D.GとS.E.Dによって作成されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Amino acids | |||
| Alanine | Acros Organics | 56-41-7 | |
| Arginine HCl | MP | 1119-34-2 | |
| Asparagine | Acros Organics | 56-84-8 | Prepared in 0.5 M NaOH |
| Cystine HCl | Alfa Aesar | L06328 | |
| Glutamic acid HCl | Acros Organics | 138-15-8 | |
| Glycine | Acros Organics | 56-40-6 | |
| Histidine HCl H2O | Alfa Aesar | A17627 | |
| Isoleucine | Acros Organics | 73-32-5 | |
| Leucine | Alfa Aesar | A12311 | |
| Lysine HCl | Alfa Aesar | J62099 | |
| Methionine | Acros Organics | 63-68-3 | |
| Ornithine HCl | Alfa Aesar | A12111 | |
| Phenylalanine | Acros Organics | 63-91-2 | |
| Proline | Alfa Aesar | A10199 | |
| Serine | Alfa Aesar | A11179 | |
| Threonine | Acros Organics | 72-19-5 | |
| Tryptophan | Acros Organics | 73-22-3 | Prepared in 0.2 M NaOH |
| Tyrosine | Alfa Aesar | A11141 | Prepared in 1.0 M NaOH |
| Valine | Acros Organics | 72-18-4 | |
| Antibiotic | |||
| Carbenicillin | Alfa Aesar | J6194903 | |
| Day-of Stocks | |||
| CaCl2 * 2H2O | Fisher Chemical | C79-500 | |
| Dextrose (D-glucose) | Fisher Chemical | 50-99-7 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Fisher (Avanti Polar Lipids) | 4235-95-4 | shake 15-20 min at 37 °C to evaporate chloroform |
| FeSO4 * 7H2O | Acros Organics | 7782-63-0 | this stock equals 1 mg/mL, MUST make fresh |
| L-lactic acid | Alfa Aesar | L13242 | pH stock to 7 with NaOH |
| MgCl2 * 6H2O | Acros Organics | 7791-18-6 | |
| N-acetylglucosamine | TCI | A0092 | |
| Prepared solids | |||
| Porcine mucin | Sigma | M1778-100G | UV-sterilize |
| Salmon sperm DNA | Invitrogen | 15632-011 | |
| Stain | |||
| Propidium iodide | Alfa Aesar | J66764MC | |
| Salts | |||
| K2SO4 | Alfa Aesar | A13975 | |
| KCl | Alfa Aesar | J64189 | add solid directly to buffered base |
| KNO3 | Acros Organics | 7757-79-1 | |
| MOPS | Alfa Aesar | A12914 | add solid directly to buffered base |
| NaCl | Fisher Chemical | S271-500 | add solid directly to buffered base |
| Na2HPO4 | RPI | S23100-500.0 | |
| NaH2PO4 | RPI | S23120-500.0 | |
| NH4Cl | Acros Organics | 12125-02-9 | add solid directly to buffered base |
| Consumables | |||
| Conical tubes (15 mL) | Olympus plastics | 28-101 | |
| Conical tubes (50 mL) | Olympus plastics | 28-106 | |
| Culture tubes w/air flow cap | Olympus plastics | 21-129 | |
| 35 mm four chamber glass-bottom dish | CellVis | NC0600518 | |
| Luria Bertani (LB) broth | Genessee Scientific | 11-118 | |
| Phosphate-buffered saline (PBS) | Fisher Bioreagents | BP2944100 | |
| Pipet tips (p200) | Olympus plastics | 23-150RL | |
| Pipet tips (p1000) | Olympus plastics | 23-165RL | |
| Serological pipets (5 mL) | Olympus plastics | 12-102 | |
| Serological pipets (25 mL) | Olympus plastics | 12-106 | |
| Serological pipets (50 mL) | Olympus plastics | 12-107 | |
| Ultrapure water (RNase/DNase free); nanopure water | Genessee Scientific | 18-194 | Nanopure water used for preparation of solutions in Table 1 |
| Syringes (10 mL) | BD | 794412 | |
| Syringes (50 mL) | BD | 309653 | |
| 0.22 mm PES syringe filter | Olympus plastics | 25-244 | |
| PS cuvette semi-mico | Olympus plastics | 91-408 | |
| Software | |||
| Biorender | To prepare the figures | ||
| FacsDiva6.1.3 | Becton Dickinson, San Jose, CA | ||
| Imaris | Bitplane | version 9.6 | |
| Zen Black | |||
| Equipment | |||
| FacsAriallu | Becton Dickinson, San Jose, CA | ||
| LSM 880 confocal laser scanning microscope | Zeiss |
参考文献
- Ramsay, K. A., et al. The changing prevalence of pulmonary infection in with fibrosis: A longitudinal analysis. Journal of Cystic Fibrosis. 16 (1), 70-77 (2017).
- Bessonova, L., et al. Data from the US and UK cystic fibrosis registries support disease modification by CFTR modulation with ivacaftor. Thorax. 73 (8), 731-740 (2018).
- Breuer, O., et al. Changing prevalence of lower airway infections in young children with cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 200 (5), 590-599 (2019).
- O'Donnell, J. N., Bidell, M. R., Lodise, T. P. Approach to the treatment of patients with serious multidrug-resistant Pseudomonas aeruginosa infections. Pharmacotherapy. 40 (9), 952-969 (2020).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Darch, S. E., et al. Spatial determinants of quorum signaling in a Pseudomonas aeruginosa infection model. Proceedings of the National Academy of Sciences of the United States of America. 115 (18), 4779-4784 (2018).
- Zhu, K., Chen, S., Sysoeva, T. A., You, L. Universal antibiotic tolerance arising from antibiotic-triggered accumulation of pyocyanin in Pseudomonas aeruginosa. PLoS Biology. 17 (12), 3000573(2019).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and resistance of Pseudomonas aeruginosa biofilms to antimicrobial agents-how P. aeruginosa can escape antibiotics. Frontiers in Microbiology. 10, 913(2019).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proceedings of the National Academy of Sciences of the United States of America. 112 (13), 4110-4115 (2015).
- Darch, S. E., et al. Phage inhibit pathogen dissemination by targeting bacterial migrants in a chronic infection model. MBio. 8 (2), 00240(2017).
- Jorth, P., et al. Regional isolation drives bacterial diversification within cystic fibrosis lungs. Cell Host & Microbe. 18 (3), 307-319 (2015).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Davies, D. G., et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science. 280 (5361), 295-298 (1998).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Stacy, A., et al. Bacterial fight-and-flight responses enhance virulence in a polymicrobial infection. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7819-7824 (2014).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved