A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل السلف ميغاكاريوسيت الماوس
In This Article
Erratum Notice
Summary
تصف هذه الطريقة تنقية التدفق الخلوي ل MEP و MKp من عظام الفخذ والساق وعظام الحوض.
Abstract
خلايا نخاع العظم الضخمة هي خلايا متعددة الأضلاع كبيرة تضمن إنتاج الصفائح الدموية. أنها تنشأ من الخلايا الجذعية الدموية من خلال megakaryopoiesis. المراحل النهائية من هذه العملية معقدة وتنطوي كلاسيكيا على السلف Megakaryocyte-Erythrocyte ثنائي القدرة (MEP) وسلفات Megakaryocyte أحادية القدرة (MKp). هذه المجموعات السكانية تسبق تشكيل الخلايا الضخمة حسنة النية ، وعلى هذا النحو ، يمكن عزلها وتوصيفها تسمح للتحليل قوية وغير متحيزة لتشكيل megakaryocyte. يقدم هذا البروتوكول بالتفصيل الإجراء لجمع الخلايا الدموية من نخاع عظم الفأر ، وإثراء السلف الدموية من خلال الاستنفاد المغناطيسي وأخيرا استراتيجية فرز الخلايا التي تسفر عن مجموعات MEP و MKp شديدة النقاء. أولا، يتم جمع خلايا نخاع العظم من عظم الفخذ، والساق، وأيضا قمة الحرقفي، وهو العظم الذي يحتوي على عدد كبير من السلف الدموية. استخدام عظام قمة الحرقفي يزيد بشكل كبير من إجمالي عدد الخلايا التي تم الحصول عليها لكل فأر، وبالتالي يساهم في استخدام أكثر أخلاقية للحيوانات. تم تحسين استنفاد النسب المغناطيسي باستخدام حبات مغناطيسية 450 نانومتر مما يسمح لفرز الخلايا بكفاءة عالية عن طريق قياس التدفق الخلوي. وأخيرا ، فإن البروتوكول يقدم وضع العلامات وgating استراتيجية لفرز اثنين من السكان السلف megakaryocyte تنقية عالية : MEP (لين--SCA - 1--ج كيت+CD16/32--CD150+CD9خافت)وMKP (لين-- SCA - 1--ج كيت+CD16/32--CD150+CD9مشرق ). هذه التقنية سهلة التنفيذ وتوفر ما يكفي من المواد الخلوية لأداء 1) التوصيف الجزيئي لمعرفة أعمق لهويتها وبيولوجيتها ، 2) في اختبارات التمايز المختبري ، من شأنها أن توفر فهما أفضل لآليات نضوج الخلايا العملاقة ، أو 3) في نماذج المختبر للتفاعل مع بيئتها الدقيقة.
Introduction
يتم إنتاج الصفائح الدموية بواسطة الخلايا العملاقة. وتقع هذه الخلايا الكبيرة متعددة الأضلاع في نخاع العظام وبالنسبة لجميع خلايا الدم فهي مشتقة من الخلايا الجذعية الدموية (HSC)1. المسار الكلاسيكي لإنتاج megakaryocytes في نخاع العظام ينبع من HSC وينطوي على جيل من السلف المختلفة التي تقيد تدريجيا إمكاناتها التمايز2. أول سلف التوقيع على الالتزام النسب megakaryocytic هو Megakaryocyte-Erythrocyte السلف (MEP)، سلف ثنائي القدرة قادرة على إنتاج كل من خلايا الغدة الدرقية وmegakaryocytes3،4،5. ثم تنتج وزارة التربية والميكارسين سلف وحيد القدرة / السلائف (MKp) التي سوف تفرق إلى megakaryocyte ناضجة قادرة على إنتاج الصفائح الدموية. الآليات التي ينطوي عليها توليد هؤلاء السلف ، فضلا عن تمايزها ونضوجها في الخلايا العملاقة معقدة ومفهومة جزئيا فقط. وبالإضافة إلى ذلك، فإن عدم تجانس السكان MEP من حيث إمكانات التمايز ومستوى الالتزام الجوهري لهذه الخلايا لا تزال غير واضحة. ولفك رموز هذه العمليات، من الضروري الحصول على (أو الوصول إلى) مجموعات منقى من MEP و MKp لإجراء تحليلات جزيئية وخلايا واحدة دقيقة.
وقد أظهرت العديد من الدراسات مجموعات معينة من علامات سطح الخلية لتحديد السلف ملتزمة النسب megakaryocytic في الماوس6،7،8. من هذه تم ابتكار طريقة تسمح لتنقية MEP و MKp من الفئران. تم تحسين هذه الطريقة للحصول على خلايا في عدد كاف ونوعية لعدد كبير من المقايسات. مع الاعتبارات الأخلاقية في الاعتبار، ومن أجل تقليل عدد الحيوانات المشاركة في التجارب، ونحن استحثت لحصاد نخاع العظم من عظم الفخذ والساق، وأيضا من قمة الحرقفي. يحتوي هذا العظم على تردد عال وعدد من السلف الدموية ومعظم الوقت معطوب أثناء حصاد العظام الطويل. هنا هو طريقة مفصلة لجمع موثوق بها من هذه العظام.
المعيار الثاني للتحسين هو إنتاج مجموعات خلايا عالية النقاء. الفلورسنت تنشيط فرز الخلية (FACS) هو وسيلة للاختيار من أجل الحصول على السكان تنقية من الخلايا ذات الاهتمام. ومع ذلك، يتم الوصول إلى غلة منخفضة عندما يكون السكان الخلية من الفائدة نادرة جدا. ولذلك فإن إجراءات الإثراء ضرورية. في هذا البروتوكول، تم اختيار إجراء اختيار سلبي باستخدام الخرز المغناطيسي.
Access restricted. Please log in or start a trial to view this content.
Protocol
وقد أجريت بروتوكولات تشمل الحيوانات وفقا للجنة CREMEAS المعنية بأخلاقيات التجارب على الحيوانات التابعة لجامعة ستراسبورغ (Comité Régional d'Ethique en Matière d'Expérimentation Animale Strasbourg). رقم التصريح: E67-482-10).
1. جمع العظام الماوس
- التضحية بالحيوان وفقا للمبادئ التوجيهية المؤسسية.
ملاحظة: تم الحصول على البيانات الواردة في هذه المخطوطة من فئران C57Bl/6 التي يتراوح عمرها بين 8 أسابيع و12 أسبوعا. قد يختلف عدد الخلايا التي تم الحصول عليها وتواتر المجموعات السكانية المذكورة حسب العمر وسلالة الماوس. - رش الجسم مع الإيثانول 70٪.
- باستخدام مقص، وجعل شق 0.5-1 سم من الجلد عمودي على العمود الفقري وتمزيق الجلد في جميع أنحاء الجسم كله. سحب أسفل الجلد من الجزء السفلي من الجسم وإزالة الجلد.
- ضع الحيوان على لوحة التشريح، ووجهه للأسفل. حدد موقع عظام الحوض عن طريق انزلاق أصابعك على طول العمود الفقري المكشوف من أعلى إلى أسفل. لتحديد موقع قمة الحرقفي، حدد عثرة صغيرة في المنطقة القطنية بالقرب من hindlimbs (المنطقة الأمامية من عظم الحوض). الشكل 1A، B يقدم تمثيل تخطيطي لتشريح الماوس.
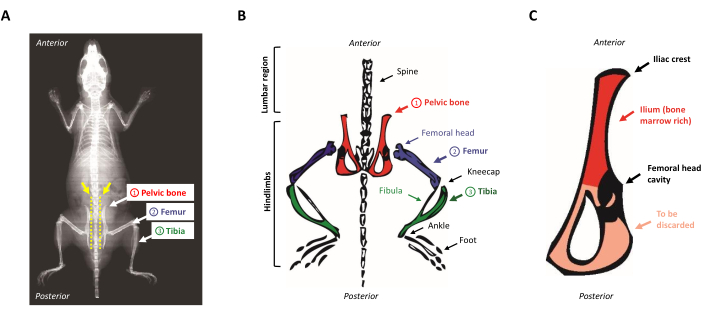
الشكل 1: تشريح الماوس. (أ) الماوس الأشعة السينية تظهر العظام الخلفية. لاحظ المسافة بين عظم الحوض والعمود الفقري (السهم الأصفر)، حيث يجب إدخال المقص لفصل الأطراف الخلفية بشكل صحيح عن جسم الماوس (خط منقط أصفر). (ب) التمثيل التخطيطي للعظام الغنية بنخاع العظم ذات الاهتمام. يتم تصوير عظام الحوض باللون الأحمر، وعظم الفخذ باللون الأرجواني، والظنبوب باللون الأخضر. (ج) التمثيل التخطيطي لعظم الحوض الماوس. يتوافق السيليوم مع الجزء الغني بنخاع العظم الحوضي ويتم تمييزه باللون الأحمر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- ضع المقص الموازي للعمود الفقري ضد الفقرات وعلى مقربة من نتوء قمة الحرقفي. المضي قدما لقطع العضلات على طول الجانب من العمود الفقري فوق عظم الحوض عن طريق انزلاق مقص على طول الفقرات على طول الطريق وصولا الى الذيل.
ملاحظة: يمكن أيضا إجراء هذا القسم الأول من العضلات باستخدام شفرة مشرط. - ضع المقص الموازي للعمود الفقري وشرع في القطع بين الفقرات وقمة الحرقفية ، كما هو مبين في الخط الأصفر المنقط على الشكل 1A. تأكد من البقاء على مقربة من الفقرات قدر الإمكان. قطع العضلات المتبقية لفصل الطرف من الجسم.
ملاحظة: يجب أن يكون هناك مقاومة قليلة أو معدومة. - كرر على الجانب الآخر لفصل الطرف الثاني.
- نقل الأطراف على سطح نظيف والتخلص من بقية الجسم وفقا للمبادئ التوجيهية المؤسسية.
- كشف الحوض, عظم الفخذ, وعظام الظنبوب عن طريق إزالة أكبر قدر ممكن من الأنسجة المحيطة مع ملقط والمشرط.
- المضي قدما في خلع بعناية رأس الفخذ من عظم الحوض عن طريق عقد نهاية البعيدة من عظم الفخذ مع ملقط في حين تشريح بلطف العضلات حول التعبير مع المشرط. تذبذب العظام لتسهيل الخلع.
- كشط قبالة العضلات المتبقية من عظم الحوض وقطع مع مشرط في منتصف التجويف التي لم تعقد رأس عظم الفخذ. يتم الاحتفاظ الهيليوم كما أنها غنية في السلف الدموية في حين يتم التخلص من الجانب الثلاثي رقيقة جدا من العظام، كما هو مبين في الشكل 1C.
- إزالة الأنسجة المتبقية حول السيليوم مع مشرط ووضع العظام تنظيفها في برنامج تلفزيوني عقيم تكملها 2٪ مصل العجل حديثي الولادة (PBS-2٪NBCS).
- باستخدام مقص، وقطع القدم من الساق في الكاحل.
- عقد الجزء السفلي من الساق مع ملقط وكشط العضلات حتى نحو الركبة. تجاهل الشظية وقطع عبر الهضبة الظنبوبية مع مشرط. ضع الساق في برنامج تلفزيوني معقم-2٪NBCS.
- إزالة الأنسجة المتبقية حول عظم الفخذ مع مشرط.
- عقد الجانب العلوي من عظم الفخذ مع ملقط; ضع شفرة المشرط في قاعدة الرضفة. تطبيق قوة نحو الركبة موازية لعظم الفخذ حتى انفصال الرضفة. ضع عظم الفخذ في برنامج تلفزيوني معقم-2٪NBCS. إزالة الرضفة يوفر الوصول نظيفة لإدخال إبرة لمسح النخاع.
2. الاستنفاد المغناطيسي للخلايا الإيجابية النسب
- في خزانة تدفق صفح، نقل العظام في طبق بيتري عقيمة مليئة عقيمة PBS-2٪NBCS.
- مع مشرط قطع رأس عظم الفخذ.
- ملء حقنة 1 مل مع برنامج تلفزيوني معقمة-2٪ NBCS وإرفاق إبرة 21 G إلى منفذ.
- ملء أنبوب البولي بروبلين 5 مل مع 2 مل من برنامج تلفزيوني عقيم-2٪NBCS.
- عقد عظم الفخذ مع ملقط; أدخل الإبرة برفق في الأخدود الأيسر بعد إزالة الرضفة. تطبيق دوران على الإبرة أثناء إدراج لتجنب توصيل الإبرة. تأكد من إدخال الإبرة بالكامل في العظم حتى الشارف.
- نقل العظام مع الإبرة في أنبوب يحتوي على 2 مل من برنامج تلفزيوني-2٪NBCS. الاستغناء عن وتوبيخ برنامج تلفزيوني-2٪ NBCS من الحقنة حتى العظام واضحة.
- إزالة الإبرة من عظم الفخذ وإدراجه في حفرة في الجانب الآخر حيث كان رأس عظم الفخذ. الاستغناء عن وتوبيخ المخزن المؤقت مرة أخرى وتجاهل العظام.
- لقمة الحرقفي والساق، عقد العظام مع ملقط. أدخل الإبرة برفق في الجانب المفتوح. تطبيق دوران على الإبرة أثناء إدراج لتجنب توصيل الإبرة. تأكد من إدخال الإبرة بالكامل في العظم حتى الشارف. نقل العظام مع الإبرة في أنبوب يحتوي على 2 مل من برنامج تلفزيوني-2٪NBCS. الاستغناء عن وتوبيخ برنامج تلفزيوني-2٪ NBCS من الحقنة حتى العظام واضحة. تجاهل العظام.
ملاحظة: يمكن مسح العظام من ثلاثة فئران حتى في نفس الأنبوب. تجمع تعليق الخلية. - تمرير تعليق الخلية المجمعة من خلال غطاء مصفاة الخلية 40 ميكرومتر وضعت على أنبوب البوليسترين 5 مل معقمة.
- تابع عد الخلايا.
ملاحظة: يمكن إجراء عدد الخلايا باستخدام أي مقياس للخلايا، باستخدام Trypan Blue لتقييم الجدوى، أو باستخدام أي عداد خلايا مؤتمت. فأرة واحدة عادة ما تسفر عن 105 ± 7 × 106 خلايا. - خذ جانبا 100 ميكرولتر من تعليق الخلية كما نخاع العظم الكلي، إضافة 500 ميكروغرام من برنامج تلفزيوني-2٪ NBCS وحفظه على الجليد لإجراء تلطيخ.
- بيليه تعليق تصفيتها عن طريق الطرد المركزي في 400 × ز لمدة 5 دقائق في 4 درجة مئوية والتخلص من supernatant.
ملاحظة: يمكن تحلل خلايا الدم الحمراء عن طريق إعادة تعليق بيليه في محلول التحلل الطازج (1/10في dH2O). حضانة لمدة 5 دقائق حتى يصبح تعليق واضحة وحمراء زاهية وإضافة 10 مجلدات من برنامج تلفزيوني عقيم. المضي قدما لغسل الخلايا في برنامج تلفزيوني-2٪ NBCS عن طريق الطرد المركزي في 400 × ز لمدة 5 دقائق في 4 درجة مئوية. كن حذرا عند إزالة supernatant كما بيليه الخلية فضفاضة جدا. قم بإجراء غسلة ثانية باستخدام PBS-2٪ NBCS عن طريق الطرد المركزي عند 400 × ز لمدة 5 دقائق عند 4 درجات مئوية وانتقل إلى الخطوة 2.13. - إعادة إنفاق بيليه الخلية في كوكتيل الأجسام المضادة الأولية الطازجة مع نسبة 100 ميكرولتر لكل 1 × 107 خلايا. احتضان على الجليد لمدة 30-45 دقيقة.
| جسم | التخفيف |
| Gr-1-البيوتين | 1:500 |
| B220 البيوتين | 1:500 |
| ماك-1-البيوتين | 1:500 |
| CD3 البيوتين | 1:500 |
| CD4 البيوتين | 1:500 |
| CD5 البيوتين | 1:500 |
| CD8 البيوتين | 1:500 |
| TER119-البيوتين | 1:1000 |
| CD127 البيوتين | 1:500 |
الجدول 1 - الجداول
- خذ جانبا 10 ميكرولتر من تعليق الخلية في أنبوب البوليسترين 5 مل معقم المسمى لين بوس كسر. إضافة 90 ميكرولتر من برنامج تلفزيوني-2٪ NBCS وحفظه على الجليد لإجراء تلطيخ.
- المضي قدما لغسل الخلايا مرتين مع عقيمة PBS-2٪ NBCS عن طريق الطرد المركزي في 400 × ز لمدة 5 دقائق في 4 درجة مئوية. تأكد من القيام بالغسيل الأخير في أنبوب البولي بروبلين المعقم سعة 5 مل.
- أثناء خطوات الغسيل، قم بإعداد الخرز للنضوب المغناطيسي.
- Resuspend الخرز في القارورة عن طريق دوامة تماما لمدة 30 s.
- نقل حجم من الخرز المقابلة لاثنين من الخرز لكل خلية الهدف في أنبوب البولي بروبلين 5 مل.
- غسل الخرز مرتين مع برنامج تلفزيوني-2٪ NBCS عن طريق وضع الأنبوب على المغناطيس وإزالة العازلة الغسيل باستخدام ماصة باستور الزجاج العقيم.
- Resuspend الخرز في 500 ميكرولتر من عقيمة PBS-2NBCS٪.
- Resuspend بيليه من الخلايا المسماة في 250 ميكرولتر من الخرز وتخلط بلطف لمدة 5 دقائق على الجليد. إضافة 2 مل من برنامج تلفزيوني عقيم-2٪NBCS وتخلط بلطف. لا تهز الأنبوب.
- ضع الأنبوب على المغناطيس لمدة دقيقتين.
- المضي قدما لجمع كسر غير المغناطيسي مع ماصة باستور الزجاج العقيم وإضافته إلى 250 ميكرولتر المتبقية من الخرز المغناطيسي. ختم أنبوب مع البارافيلم.
- ضع الأنبوب على بكرة أنبوب لمدة 20 دقيقة عند 4 درجات مئوية.
- إضافة 2 مل من برنامج تلفزيوني عقيم-2٪NBCS وتخلط بلطف. لا تهز الأنبوب.
- ضع الأنبوب في المغناطيس لمدة دقيقتين.
- المضي قدما لجمع كسر غير المغناطيسي في أنبوب البولي بروبلين 5 مل معقم المسمى لين نيغ كسر مع ماصة باستور الزجاج العقيم.
- بيليه الخلايا عن طريق الطرد المركزي في 400 × ز لمدة 5 دقائق في 4 درجة مئوية وإزالة supernatant.
- إعادة إنفاق الخلايا غير المغناطيسية في 500 ميكرولتر من برنامج تلفزيوني عقيم-2٪ NBCS.
- تابع عد الخلايا.
ملاحظة: ماوس واحد عادة ينتج 3.9 ± 1.1 × 106 خلايا. يتم عرض النسب النموذجي تلطيخ قبل وبعد الاستنفاد في الشكل 2B.
3. فرز الخلية من السلف megakaryocyte عن طريق قياس التدفق الخلوي
- خذ الأنابيب المسماة مجموع نخاع العظم، لين بوس كسر، ولين نيغ كسر.
- المضي قدما لتقسيم محتوى أنبوب مجموع نخاع العظم بالتساوي إلى ستة أنابيب البوليسترين 5 مل معقمة. تسمية الأنابيب مع الأرقام 1-6.
- المضي قدما لتسمية أنبوب لين بوس كسر مع عدد 7.
- المضي قدما لتقسيم محتوى أنبوب لين نيغ كسر على النحو التالي.
- نقل 50 ميكرولتر إلى أنبوب البوليسترين 5 مل معقمة تحتوي على 250 ميكرولتر من برنامج تلفزيوني معقم-2٪ NBCS. ثم، تقسيم محتواه بالتساوي إلى 3 أنابيب البوليسترين 5 مل معقمة. تسمية هذه الأنابيب مع الأرقام 8-10.
- المتبقية 450 μL من لين نيغ كسر تعليق الخلية يتوافق مع أنبوب مع عدد 11.
- إضافة الأجسام المضادة إلى الأنابيب كما هو موضح في الجدول 2.
| أنبوب | تسميه | كوكتيل الأجسام المضادة |
| مجموع نخاع العظم | ||
| 1 | التحكم غير الملطخ | |
| 2 | تحكم واحد ملطخ | CD45-FITC (1/200) |
| 3 | تحكم واحد ملطخ | CD45-PE (1/200) |
| 4 | تحكم واحد ملطخ | TER119-APC (1/200) |
| 5 | تحكم واحد ملطخ | CD45-PECy7 (1/200) |
| 6 | تحكم واحد ملطخ | CD45-APC-Cy7 البيوتين (1/200) |
| كسر لين بوس | ||
| 7 | تحكم واحد ملطخ | تحكم واحد ملطخ. ستريبتافيدين-APC-Cy7 (1/500) |
| لين نيغ كسر | ||
| 8 | FMO FITC التحكم | ج- كيت - APC (1/200) + SCA-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + ستريبتافيدين-APC-Cy7 (1/500) |
| 9 | FMO PE التحكم | CD9-FITC (1/200) + ج-عدة-APC (1/200) + CD150-PECy7 (1/200) + ستريبتافيدين-APC-Cy7 (1/500) |
| 10 | FMO PECy7 التحكم | CD9-FITC (1/200) + ج-عدة-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + ستريبتافيدين-APC-Cy7 (1/500) |
| 11 | أنبوب إيجابي للفرز | CD9-FITC (1/200) + ج-عدة-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + ستريبتافيدين-APC-Cy7 (1/500) |
الجدول 2 - الأرباح
- احتضان على الجليد لمدة 30-45 دقيقة في الظلام.
- غسل الخلايا مع عقيمة PBS-2٪ NBCS عن طريق الطرد المركزي في 400 x ز لمدة 5 دقائق في 4 °C.
- إعادة إنفاق الكريات الخلية على النحو التالي.
- للأنابيب 1 إلى 10، resuspend بيليه في 300 ميكرولتر من برنامج تلفزيوني عقيم-2٪ NBCS تكملها مع 7AAD (2.5 ميكروغرام / مل النهائي) (PBS-7AAD).
تنبيه: 7AAD هو فاصل الحمض النووي وبالتالي يجب التعامل مع معدات الوقاية الشخصية المناسبة (قفازات). - للأنبوب 11، إعادة إنفاق بيليه في برنامج تلفزيوني عقيم-7AAD في تركيز أقصى من 5 × 106 خلايا لكل مل والحد الأدنى لحجم 1 مل.
- للأنابيب 1 إلى 10، resuspend بيليه في 300 ميكرولتر من برنامج تلفزيوني عقيم-2٪ NBCS تكملها مع 7AAD (2.5 ميكروغرام / مل النهائي) (PBS-7AAD).
- إعداد اثنين من أنابيب جمع البولي بروبلين المسمى MEP و MKp التي تحتوي على 2 مل من PBS-2٪ NBCS.
ملاحظة: بدلا من ذلك، يمكن تجميع الخلايا في المخزن المؤقت culture medium أو تحلل الخلية اعتمادا على التطبيق اللاحق للخلايا التي تم فرزها. لا ينصح باستخدام أنابيب البوليسترين بسبب التداخل المحتمل مع القطرات المشحونة التي تحتوي على الخلايا ذات الاهتمام. - إبقاء جميع الأنابيب على الجليد في الظلام.
- انتقل إلى إعداد مفرز الخلية.
- استخدام أنابيب 1-7 لإعداد الجهد والتعويض، أنابيب 7-10 لتحديد بوابات الفرز للسكان الخلية من الفائدة وأنبوب 11 لفرز الخلايا.
- وتهدف الخطوات الأولى من استراتيجية النهاية إلى استبعاد الخلايا المزدوجة والخلايا الميتة من التحليل، كما هو موضح في الشكل 3. تحديد خلايا واحدة قابلة للحياة وعرض SSC مقابل لين-APC-Cy7 نقطة مؤامرة لتأكيد كفاءة استنفاد النسب. من لين- الخلايا يتم تعيين بوابة لتحديد الخلايا إيجابية لc-عدة وسلبية أو قاتمة لSCA-1 وCD16/32. يسمح رسم نقطة التعبير CD9 مقابل CD150 للخلايا المحددة بتحديد أربعة مجموعات سكانية.
ملاحظة: خلايا MEP و MKp كلاهما موجبة ل CD150. يمكن تعريف ثلاثة مستويات من التعبير عن CD9 (neg، خافت، وعالي). MKp التعبير عن مستوى عال من CD9 وMEP التعبير CD9 على مستوى كثافة مضان وسيطة. السكان MEP يتوافق مع لين- ج كيت+ SCA-1-CD16/32-/DIM CD150+ CD9خافت والسكان MKp يتوافق مع لين- ج كيت+ SCA-1-CD16/32-/DIM CD150+ CD9مشرق. التمييز بين CD9 عالية وCD9 السكان قاتمة للخلايا الإيجابية CD150 يتم تعيين على أساس المستوى الأقصى للتعبير CD9 في السكان السلبية CD150. فأرة واحدة عادة ما تسفر عن 5.3 ± 0.6 × 103 MKp و 27.2 ± 2.4 × 103 MEP.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم إجراء تحليل Phenotypic للخلايا التي تم تحديدها على أنها MEP و MKp عن طريق قياس التدفق الخلوي. وسمت الخلايا بأجسام مضادة مضانة مترافقة مع CD41a وCD42c، وهي علامات كلاسيكية للنساب الضخمة والصفائح الدموية. وأعرب عن كل من علامات من قبل خلايا السكان MKP في حين لم يتم الكشف عن هذه العلامات حتى الآن على سطح خ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
الطريقة الموصوفة في هذه الورقة يسمح لاستخراج وتنقية الماوس MEP و MKp. وكان من السمات الهامة في تحسين البروتوكول الحصول على عدد كاف من الخلايا التي من شأنها أن تكون متوافقة مع معظم المقايسات الجزيئية والخلوية. عادة ما تتكون الممارسة العامة لجمع عظام الفأر لاستخراج الخلايا المكونة للدم في حصا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ولا يعلن صاحبا البلاغ عن وجود مصالح مالية متنافسة.
Acknowledgements
ويود المؤلفون أن يشكروا مونيك فرويند وكاثرين زيسيل وكيتي على المساعدة التقنية. وقد دعم هذا العمل الرابطة العامة لمناهضة الانتخابات ومنظمة أطباء بلا حدود، وغرانت ANR-17-CE14-0001-01 إلى Henri.de la. سال.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
References
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14(2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
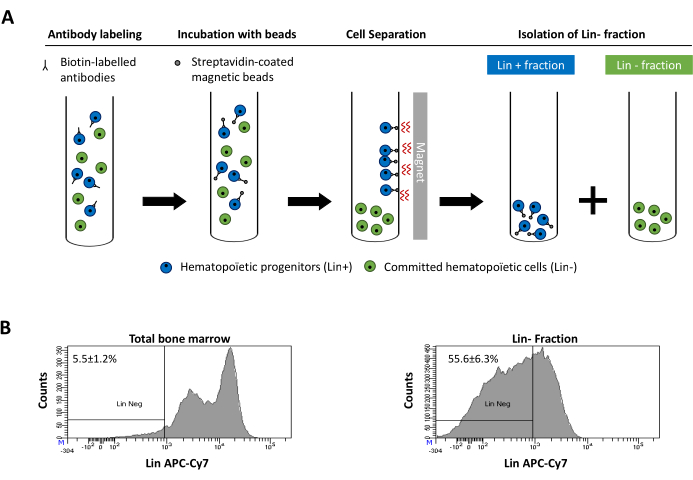
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
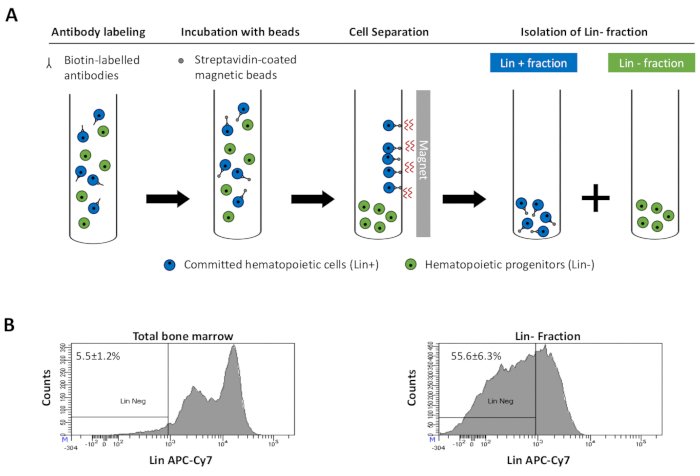
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved