Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fare Megakaryosit Progenitors İzolasyonu
Bu Makalede
Erratum Notice
Özet
Bu yöntem, MEP ve MKp'nin fare femurları, kaval kemiği ve pelvik kemiklerden akış sitometrisi ile saflaştırılmasını açıklar.
Özet
Kemik iliği megakaryositleri kan trombositlerinin üretimini sağlayan büyük poliploid hücrelerdir. Megakaryopoez yoluyla hematopoetik kök hücrelerden kaynaklanırlar. Bu sürecin son aşamaları karmaşıktır ve klasik olarak bipotent Megakaryosit-Eritrosit Progenitors (MEP) ve tek kişilik Megakaryosit Progenitors 'u (MKp) içerir. Bu popülasyonlar iyi niyetli megakaryositlerin oluşumundan önce gelir ve bu nedenle izolasyonları ve nitelemeleri megakaryosit oluşumunun sağlam ve tarafsız analizine izin verebilir. Bu protokol, fare kemik iliğinden hematopoetik hücreleri toplama prosedürünü, hematopoetik progenitörlerin manyetik tükenme yoluyla zenginleştirilmesini ve son olarak yüksek oranda saflaştırılmış MEP ve MKp popülasyonları veren bir hücre sıralama stratejisini ayrıntılı olarak sunar. İlk olarak, kemik iliği hücreleri femurdan, kaval kemiğinden ve ayrıca yüksek sayıda hematopoetik progenitör içeren bir kemik olan iliak arktan toplanır. İlyak tepe kemiklerinin kullanımı, fare başına elde edilen toplam hücre sayısını büyük ölçüde arttırır ve böylece hayvanların daha etik bir şekilde kullanılmasına katkıda bulunur. Manyetik soy tükenmesi, akış sitometrisine göre çok verimli bir hücre sıralamaya izin vererek 450 nm manyetik boncuk kullanılarak optimize edildi. Son olarak, protokol iki yüksek saflaştırılmış megakaryosit progenitör popülasyonunun sıralanması için etiketleme ve gating stratejisini sunar: MEP (Lin-Sca-1-c-Kit+CD16/32-CD150+CD9dim)ve MKp (Lin- Sca-1-c-Kit+CD16/32-CD150+CD9parlak ). Bu tekniğin uygulanması kolaydır ve i) kimlikleri ve biyolojileri hakkında daha derin bir bilgi için moleküler karakterizasyon, ii) megakaryositlerin olgunlaşma mekanizmalarının daha iyi anlaşılmasını sağlayacak in vitro farklılaşma tahlilleri veya iii) mikroçevrimle etkileşimin in vitro modellerini gerçekleştirmek için yeterli hücresel materyal sağlar.
Giriş
Kan trombositleri megakaryositler tarafından üretilir. Bu büyük poliploid hücreler kemik iliğinde bulunur ve tüm kan hücrelerine gelince Hematopoetik Kök Hücrelerden (HSC) türetilirler1. Kemik iliğindeki megakaryositlerin klasik üretim yolu HSC'den kaynaklanır ve farklılaşma potansiyellerini giderek kısıtlayan farklı ataların neslini içerir2. Megakaryosit soyuna bağlılığı imzalayan ilk ata, hem eritroid hücreleri hem de megakaryositler3,4,5 üretebilen bir bipotent progenitör olan Megakaryosit-Eritrosit Progenitor'dur(MEP). MEP daha sonra trombosit üretebilen olgun bir megakaryosit olarak farklılaşacak tek kişilik bir ata /öncül (MKp) üretir. Bu ataların üretilmesinde yer alan mekanizmaların yanı sıra megakaryositlere farklılaşmaları ve olgunlaşmaları karmaşıktır ve sadece kısmen anlaşılmıştır. Ayrıca MEP popülasyonunun farklılaşma potansiyeli açısından heterojenliği ve bu hücrelerin içsel bağlılık düzeyi hala belirsizdir. Bu süreçleri deşifre etmek için, ince moleküler ve tek hücreli analizler için MEP ve MKp'nin saflaştırılmış popülasyonlarını elde etmek (veya bunlara erişmek) esastır.
Çeşitli çalışmalar, fare 6,7,8'dekimegakaryositik soyuna bağlı atalarıntanımlanması için hücre yüzeyi belirteçlerinin belirli kombinasyonlarını göstermiştir. Bunlardan MEP ve MKp'nin farelerden arındırılmasına izin sağlayan bir yöntem tasarlanmıştır. Bu yöntem, çok sayıda tahlil için yeterli sayıda ve kalitede hücre elde etmek için optimize edilmiştir. Etik hususları göz önünde bulundurarak ve deneylerde yer alan hayvan sayısını en aza indirmek için kemik iliğini femur ve kaval kemiğinden ve ayrıca iliak arktan hasat etmek için ortaya çıkarız. Bu kemik yüksek sıklıkta ve hematopoetik ataların sayısını içerir ve çoğu zaman uzun kemik hasadı sırasında hasar görür. Burada sunulan bu kemiğin güvenilir toplanması için ayrıntılı bir yöntemdir.
Optimizasyonun ikinci kriteri, yüksek oranda saflaştırılmış hücre popülasyonları üretmektir. Floresan Aktif Hücre Sıralama (FACS), arıtılmış hücre popülasyonları elde etmek için tercih edilen bir yöntemdir. Bununla birlikte, ilgi hücre popülasyonu çok nadir olduğunda düşük verime ulaşılır. Bu nedenle zenginleştirme prosedürleri gereklidir. Bu protokolde manyetik boncuklar kullanılarak negatif bir seçim prosedürü tercih edildi.
Protokol
Hayvanları içeren protokoller, CREMEAS Strazburg Üniversitesi Hayvan Deneyleri Etik Komitesi (Comité Régional d'Ethique en Matière d'Expérimentation Animale Strasbourg) uyarınca gerçekleştirildi. İzin Numarası: E67-482-10).
1. Fare kemiği koleksiyonu
- Hayvanı kurumsal yönergelere uygun olarak kurban edin.
NOT: Bu yazıda sunulan veriler 8 ila 12 haftalık C57Bl/6 farelerden elde edilmiştir. Elde edilen hücre sayısı ve atıf yapılan popülasyonların sıklığı yaş ve fare zorlanmasına göre değişebilir. - Vücuda% 70 etanol püskürtün.
- Makas kullanarak, omurgaya dik olan cildin 0,5-1 cm'lik bir kesisini yapın ve cildi tüm vücudun etrafında yırtın. Cildi alt gövdeden aşağı çekin ve cildi çıkarın.
- Hayvanı diseksiyon pedi üzerine yerleştirin, yüzüstü. Parmaklarınızı açıkta kalan omurga boyunca yukarıdan aşağıya doğru kaydırarak pelvik kemikleri bulun. İlyak armasını bulmak için, bel bölgesindeki arka ayakların yakınındaki küçük tümseği (pelvik kemiğin anterosuperior bölgesi) tanımlayın. Şekil 1A,B fare anatomisinin şematik bir gösterimini sunar.
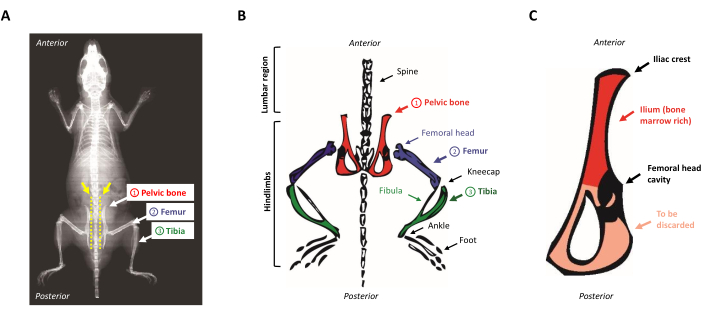
Şekil 1: Fare anatomisi. (A) Arkadaki kemikleri gösteren Fare X-ışını. Pelvik kemik ile omurga (sarı ok) arasındaki boşluğa dikkat edin, burada arka ayakları farenin gövdesinden düzgün bir şekilde ayırmak için makasın yerleştirilmesi gerekir (sarı noktalı çizgi). (B) Kemik iliği bakımından zengin kemiklerin şematik temsili. Pelvik kemikler kırmızı, uyluk kemiği mor ve kaval kemiği yeşil olarak tasvir edilmiştir. (C) Fare pelvik kemiğinin şematik gösterimi. İlyum pelvik kemiğin ilik bakımından zengin kısmına karşılık gelir ve kırmızı ile vurgulanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Makası omurgaya paralel olarak omurlara ve iliak tepe tümseğine yakın yerleştirin. Omurganın yanındaki kasları pelvik kemiğin üzerinde kesmeye devam edin, makası omur boyunca kuyruğa kadar kaydırarak.
NOT: Kasların bu ilk bölümü neşter bıçağı kullanılarak da yapılabilir. - Makası omurgaya paralel yerleştirin ve Şekil 1A'dakisarı noktalı çizgide belirtildiği gibi omurlar ve iliak tepe arasında kesmeye devam edin. Omurlara mümkün olduğunca yakın kaldığından emin olun. Uzuvları vücuttan ayırmak için kalan kasları kesin.
NOT: Çok az direnç olmalıdır. - İkinci uzvu ayırmak için diğer tarafta tekrarlayın.
- Uzuvları temiz bir yüzeye aktarın ve vücudun geri kalanını kurumsal yönergelere uygun olarak atın.
- Peripler ve neşterlerle mümkün olduğunca fazla çevre dokuyu çıkararak pelvik, femoral ve tibial kemikleri açığa çıkarın.
- Neşterlerle eklem etrafındaki kasları hafifçe keserken femurun distal ucunupsla tutarak femoral başı pelvik kemikten dikkatlice ayırmaya devam edin. Çıkığı kolaylaştırmak için kemikleri oynatın.
- Pelvik kemikten kalan kası kazıyın ve uyluk kemiğini tutan boşluğun ortasında neşterle kesin. İlyum, hematopoetik progenitörler bakımından zengin olduğu için tutulurken, kemiğin üçgen çok ince tarafı, Şekil 1C'degösterildiği gibi atılır.
- Neşterle iliyum çevresindeki artık dokuları çıkarın ve temizlenen kemiği% 2 Yenidoğan Baldır Serumu (PBS-% 2 NBCS) ile desteklenmiş steril PBS'ye yerleştirin.
- Makas kullanarak ayak bileğinden ayağını kesin.
- Kaval kemiğinin alt kısmını tokmaklarla tutun ve kası dizine doğru kazıyın. Fibulae atın ve neşter ile tibial plato boyunca kesin. Kaval kemiğini steril PBS-%2 NBCS'ye yerleştirin.
- Uyluk kemiğinin etrafındaki artık dokuları neşterle çıkarın.
- Femurun üst tarafını asalarla tutun; neşter bıçağını diz kapağının tabanına yerleştirin. Diz kapağının kopuşa kadar uyluk kemiğine paralel diz kapağına doğru bir kuvvet uygulayın. Uyluk kemiğini steril PBS-%2 NBCS'ye yerleştirin. Diz kapağının çıkarılması, ilik yıkama için iğnenin yerleştirilmesi için temiz bir erişim sağlar.
2. Soy pozitif hücrelerinin manyetik tükenmesi
- Laminer akış kabininde, kemikleri steril PBS-% 2 NBCS ile dolu steril bir Petri kabına aktarın.
- Uyluk kemiğinin başını kesen bir neşterle.
- 1 mL'lik bir şırıngayı steril PBS-%2 NBCS ile doldurun ve prize 21 G'lik bir iğne takın.
- 5 mL polipropilen tüpü 2 mL steril PBS-%2 NBCS ile doldurun.
- Uyluk kemiğini asalarla tutun; diz kapağı çıkarıldıktan sonra iğneyi sol oluğa hafifçe yerleştirin. İğnenin takılmasını önlemek için takarken iğneye döndürme uygulayın. İğnenin tamamen kemiğe kadar eğime sokulmasını sağlayın.
- İğne ile kemiği 2 mL PBS-2% NBCS içeren tüpe aktarın. PBS-%2 NBCS'yi şırınnadan kemik temizlenine kadar dağıtın ve aspire edin.
- İğneyi uyluk kemiğinden çıkarın ve uyluk kafasının olduğu karşı taraftaki deliğe yerleştirin. Tamponu tekrar dağıtın ve epire edin ve kemiği atın.
- İlyak arması ve kaval kemiği için, forseps ile kemiği tutun; iğneyi açık tarafa hafifçe yerleştirin. İğnenin takılmasını önlemek için takarken iğneye döndürme uygulayın. İğnenin tamamen kemiğe kadar eğime sokulmasını sağlayın. İğne ile kemiği 2 mL PBS-2% NBCS içeren tüpe aktarın. PBS-%2 NBCS'yi şırınnadan kemik temizlenine kadar dağıtın ve aspire edin. Kemikleri atın.
NOT: En fazla üç fareden kemikler aynı tüpe yıkanabilir. Hücre süspansiyonlarını bire birle. - Havuza alınan hücre süspansiyonunu steril 5 mL polistiren tüpe yerleştirilen 40 μm hücreli süzgeç kapağından geçirin.
- Hücreleri saymaya devam edin.
NOT: Hücre sayısı herhangi bir hemositometre ile, canlılık değerlendirmesi için Trypan Blue kullanılarak veya herhangi bir otomatik hücre sayacı ile gerçekleştirilebilir. Bir fare genellikle 105 ± 7 x 106 hücre verir. - Hücre süspansiyonunun 100 μL'sini Total Bone Marrow olarak bir kenara alın, 500 μL PBS-2% NBCS ekleyin ve boyama işlemi için buzda saklayın.
- Filtrelenmiş süspansiyonu 4 °C'de 5 dakika boyunca 400 x g'da santrifüjleme ile peletleyin ve süpernatantı atın.
NOT: Kırmızı kan hücreleri, peletin taze hazırlanmış Lizis Çözeltisinde (dH2O'da 1/10) yeniden canlandırılarak lizize edilebilir. Süspansiyon netleşene ve parlak kırmızı olana kadar 5 dakika kuluçkaya yaslanın ve 10 cilt steril PBS ekleyin. PBS-%2 NBCS'deki hücreleri 4 °C'de 5 dakika boyunca 400 x g'da santrifüjleme ile yıkamaya devam edin. Hücre peletı çok gevşek olduğu için süpernatantı çıkarırken dikkatli olun. PBS-2% NBCS ile 4 °C'de 5 dakika boyunca 400 x g'da santrifüjleme ile ikinci bir yıkama gerçekleştirin ve 2.13 adımına geçin. - Hücre peletini 1 x 107 hücre başına 100 μL oranı ile taze hazırlanmış birincil antikor kokteylinde yeniden biriktirin. 30-45 dakika buzda kuluçkaya yaslanın.
| Antikor | Seyreltme |
| Gr-1-biotin | 1:500 |
| B220-biotin | 1:500 |
| Mac-1-biotin | 1:500 |
| CD3-biotin | 1:500 |
| CD4-biotin | 1:500 |
| CD5-biotin | 1:500 |
| CD8-biotin | 1:500 |
| TER119-biotin | 1:1000 |
| CD127-biotin | 1:500 |
Tablo 1.
- Lin-Pos Fraksiyonu etiketli steril 5 mL polistiren tüpe 10 μL hücre süspansiyonunu bir kenara alın. 90 μL PBS-2% NBCS ekleyin ve boyama prosedürü için buza kaydedin.
- Hücreleri steril PBS-%2 NBCS ile iki kez 4 °C'de 5 dakika boyunca 400 x g'da santrifüjleme ile yıkamaya devam edin. Son yıkamayı steril 5 mL polipropilen tüpte yaptığından emin olun.
- Yıkama adımları sırasında, boncukları manyetik tükenme için hazırlayın.
- 30 sn boyunca iyice girdaplayarak şişedeki boncukları yeniden depola.
- Hedef hücre başına iki boncuklara karşılık gelen bir boncuk hacmini 5 mL polipropilen tüpe aktarın.
- Tüpü mıknatısın üzerine yerleştirerek ve steril bir cam Pasteur pipet kullanarak yıkama tamponunu çıkararak boncukları PBS-2% NBCS ile iki kez yıkayın.
- Boncukları 500 μL steril PBS-2NBCS% olarak yeniden satın alın.
- Etiketli hücrelerin peletini 250 μL boncuk halinde yeniden biriktirin ve buz üzerinde 5 dakika boyunca hafifçe karıştırın. 2 mL steril PBS-%2 NBCS ekleyin ve hafifçe karıştırın. Tüpü sallamayın.
- Tüpü 2 dakika boyunca mıknatısın üzerine yerleştirin.
- Manyetik olmayan fraksiyonu steril bir cam Pasteur pipetle toplamaya devam edin ve kalan 250 μL manyetik boncuk üzerine ekleyin. Tüpü parafilm ile kapatın.
- Tüpü 4 °C'de 20 dakika boyunca bir tüp silindirinin üzerine yerleştirin.
- 2 mL steril PBS-%2 NBCS ekleyin ve hafifçe karıştırın. Tüpü sallamayın.
- Tüpü mıknatısa 2 dakika yerleştirin.
- Manyetik olmayan fraksiyonu steril bir cam Pasteur pipet ile Lin-Neg Fraksiyonu etiketli steril bir 5 mL polipropilen tüpe toplamaya devam edin.
- Hücreleri 4 °C'de 5 dakika boyunca 400 x g'da santrifüjleme ile pelet edin ve süpernatantı çıkarın.
- Manyetik olmayan hücreleri 500 μL steril PBS-%2 NBCS'de yeniden biriktirin.
- Hücreleri saymaya devam edin.
NOT: Bir fare genellikle 3,9 ± 1,1 x 106 hücre verir. Tipik soy boyama öncesi ve sonrası tükenme Şekil 2B'desunulmuştur.
3. Megakaryosit progenitörlerinin akış sitometrisine göre hücre sıralanması
- Total Bone Marrow, Lin-Pos Fraction ve Lin-Neg Fraction etiketli tüpleri alın.
- Total Bone Marrow tüpünün içeriğini altı steril 5 mL polistiren tüpe eşit olarak bölmeye devam edin. Tüpleri 1-6 numaralarıyla etiketle.
- Lin-Pos Fraksiyon tüpünü 7 sayısıyla etiketlemeye devam edin.
- Lin-Neg Fraksiyonu tüpünün içeriğini aşağıdaki gibi bölmeye devam edin.
- 50 μL'yi 250 μL steril PBS-%2 NBCS içeren steril 5 mL polistiren tüpe aktarın. Daha sonra, içeriğini eşit olarak 3 steril 5 mL polistiren tüpe bölün. Bu tüpleri 8-10 numaralarıyla etiketle.
- Kalan 450 μL Lin-Neg Fraksiyon hücre süspansiyonu 11 numaralı tüpe karşılık gelir.
- Antikorları Tablo 2'deaçıklandığı gibi tüplere ekleyin.
| Tüp | Etiket | Antikor kokteyli |
| Toplam Kemik İliği | ||
| 1 | Denetlenmeyen | |
| 2 | Tek boyamalı kontrol | CD45-FITC (1/200) |
| 3 | Tek boyamalı kontrol | CD45-PE (1/200) |
| 4 | Tek boyamalı kontrol | TER119-APC (1/200) |
| 5 | Tek boyamalı kontrol | CD45-PECy7 (1/200) |
| 6 | Tek boyamalı kontrol | CD45-APC-Cy7 biotin (1/200) |
| Lin-Pos Kesir | ||
| 7 | Tek boyamalı kontrol | Tek lekeli kontrol. Streptavidin-APC-Cy7 (1/500) |
| Lin-Neg Fraksiyonu | ||
| 8 | FMO FITC denetimi | c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 9 | FMO PE kontrolü | CD9-FITC (1/200) + c-kit-APC (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 10 | FMO PECy7 denetimi | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 11 | Sıralama için pozitif tüp | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
Tablo 2.
- Karanlıkta 30-45 dakika buzda kuluçkaya yaslanın.
- Hücreleri steril PBS-%2 NBCS ile 4 °C'de 5 dakika boyunca 400 x g'da santrifüjleme ile yıkayın.
- Hücre topaklarını aşağıdaki gibi yeniden süsün.
- 1 ila 10 numaralı tüpler için peleti 7AAD (2,5 μg/mL final) (PBS-7AAD) ile birlikte 300 μL steril PBS-%2 NBCS'de yeniden diriltin.
DİkKAT: 7AAD bir DNA interkalanttır ve bu nedenle uygun KKD (eldiven) ile ele alınmalıdır. - Tüp 11 için, peleti steril PBS-7AAD'de mL başına maksimum 5 x 106 hücre konsantrasyonunda ve minimum 1 mL hacimde yeniden biriktirin.
- 1 ila 10 numaralı tüpler için peleti 7AAD (2,5 μg/mL final) (PBS-7AAD) ile birlikte 300 μL steril PBS-%2 NBCS'de yeniden diriltin.
- 2 mL PBS-%2 NBCS içeren MEP ve MKp etiketli iki polipropilen toplama tüpü hazırlayın.
NOT: Alternatif olarak, hücreler sıralanmış hücreler için sonraki uygulamaya bağlı olarak kültür ortamı veya hücre liziz arabelleğine toplanabilir. İlgi çeken hücreleri içeren yüklü damlacıklara olası müdahale nedeniyle polistiren tüplerin kullanılması önerilmez. - Karanlıkta tüm tüpleri buzda tutun.
- Hücre sıralayıcısı kurulumuna geçin.
- Gerilim ve kompanzasyon kurmak için 1-7 tüpleri, ilgi çekici hücre popülasyonları için sıralama kapılarını belirlemek için 7-10 tüplerini ve hücre sıralama için tüp 11'i kullanın.
- Gating stratejisinin ilk adımları, Şekil 3'teaçıklandığı gibi, çiftleri ve ölü hücreleri analizden dışlamayı amaçlamaktadır. Tek uygulanabilir hücreleri tanımlayın ve soy tükenmesinin verimliliğini onaylamak için SSC-vs Lin-APC-Cy7 nokta grafiğini görüntüleyin. Lin- hücrelerinden bir kapı c-kit için pozitif ve Sca-1 ve CD16/32 için negatif veya loş hücreleri seçmek için ayarlanır. Seçili hücreler için CD9 vs CD150 ifade nokta çizimi, dört popülasyonun tanımlanmasına izin verir.
NOT: MEP ve MKp hücrelerinin her ikisi de CD150 için pozitiftir. CD9 için üç ifade düzeyi tanımlanabilir (neg, dim ve high). MKp, orta floresan yoğunluk seviyesinde yüksek düzeyde CD9 ve MEP ekspres CD9 ifade eder. MEP popülasyonu Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9dim ve MKp popülasyonu Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9parlakınakarşılık gelir. CD150 pozitif hücreleri için CD9 yüksek ve CD9 dim popülasyonları arasındaki ayrım, CD150 negatif popülasyonundaki en fazla CD9 ifade düzeyine göre ayarlanır. Bir fare genellikle 5,3 ± 0,6 x 103 MKp ve 27,2 ± 2,4 x 103 MEP verir.
Sonuçlar
MEP ve MKp olarak tanımlanan hücrelerin fenotipik analizi akış sitometrisi ile yapıldı. Hücreler, megakaryositik ve trombosit soylarının klasik belirteçleri olan CD41a ve CD42c'ye floresan konjuge antikorlarla etiketlendi. Her iki belirteç de MKp popülasyonunun hücreleri tarafından ifade edilirken, bu belirteçler MEP popülasyonunun hücrelerinin yüzeyinde henüz tespit edilmiştir (Şekil 4Ai,4Aii). Poliploidi megakaryositlerin ayırt edici özelliğidir. S?...
Tartışmalar
Bu makalede açıklanan yöntem, fare MEP ve MKp'nin çıkarılmasına ve saflaştırılmasına izin verir. Protokolün optimizasyonunda önemli bir parametre, çoğu moleküler ve hücresel tabanlı tahlille uyumlu yeterli sayıda hücre elde etmekti. Hematopoetik hücre ekstraksiyonu için fare kemiği toplamanın genel uygulaması genellikle her farenin hem uyluk kemiğinin hem de kaval kemiğinin toplanmasından oluşur. Hematopoetik malzemenin başka bir kaynağı olan pelvik kemik, bu nedenle sıklıkla göz ardı ...
Açıklamalar
Yazarlar rakip finansal çıkarlar beyan etmemektedir.
Teşekkürler
Yazarlar monique Freund, Catherine Ziessel ve Ketty'ye teknik yardım için teşekkür etmek istiyor. Bu çalışma ARMESA (Association de Recherche et Développement en Médecine et Santé Publique) ve Grant ANR-17-CE14-0001-01 tarafından Henri.de la'ya desteklendi. Salle.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
Referanslar
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14 (2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
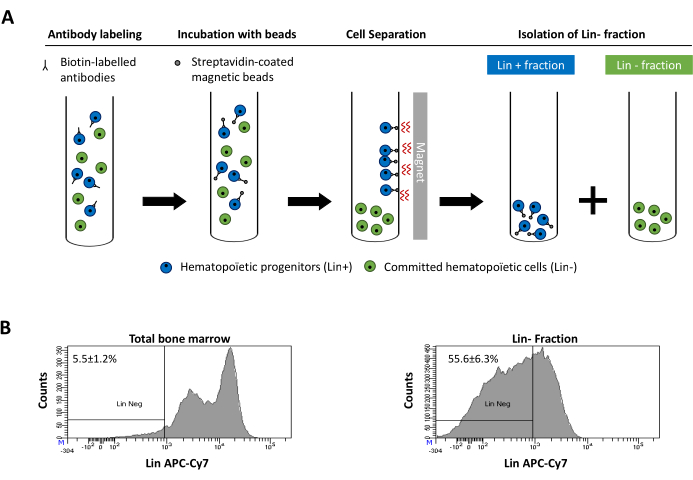
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
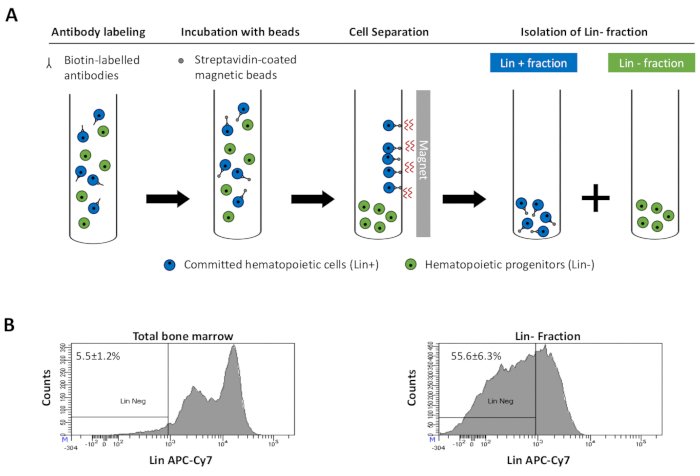
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır