Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento de progenitores de megacariocitos de ratón
En este artículo
Erratum Notice
Resumen
Este método describe la purificación por citometría de flujo de MEP y MKp de fémures, tibias y huesos pélvicos de ratones.
Resumen
Los megacariocitos de la médula ósea son células poliploides grandes que aseguran la producción de plaquetas sanguíneas. Surgen de las células madre hematopoyéticas a través de la megacariopoyesis. Las etapas finales de este proceso son complejas y clásicamente involucran a los progenitores bipotentes de megacariocitos-eritrocitos (MEP) y los progenitores de megacariocitos unipotentes (MKp). Estas poblaciones preceden a la formación de megacariocitos de buena fe y, como tales, su aislamiento y caracterización podrían permitir el análisis robusto e imparcial de la formación de megacariocitos. Este protocolo presenta en detalle el procedimiento para recolectar células hematopoyéticas de la médula ósea de ratón, el enriquecimiento de progenitores hematopoyéticos a través del agotamiento magnético y, finalmente, una estrategia de clasificación celular que produce poblaciones MEP y MKp altamente purificadas. Primero, las células de la médula ósea se recolectan del fémur, la tibia y también la cresta ilíaca, un hueso que contiene un alto número de progenitores hematopoyéticos. El uso de huesos de la cresta ilíaca aumenta drásticamente el número total de células obtenidas por ratón y, por lo tanto, contribuye a un uso más ético de los animales. Se optimizó un agotamiento del linaje magnético utilizando perlas magnéticas de 450 nm que permiten una clasificación celular muy eficiente por citometría de flujo. Finalmente, el protocolo presenta la estrategia de etiquetado y gating para la clasificación de las dos poblaciones progenitoras de megacariocitos altamente purificadas: MEP (Lin-Sca-1-c-Kit+CD16/32-CD150+CD9dim)y MKp (Lin- Sca-1-c-Kit+CD16/32-CD150+CD9brillante) ). Esta técnica es fácil de implementar y proporciona suficiente material celular para realizar i) caracterización molecular para un conocimiento más profundo de su identidad y biología, ii) ensayos de diferenciación in vitro, que proporcionarán una mejor comprensión de los mecanismos de maduración de los megacariocitos, o iii) modelos in vitro de interacción con su microambiente.
Introducción
Las plaquetas sanguíneas son producidas por los megacariocitos. Estas grandes células poliploides se localizan en la médula ósea y como para todas las células sanguíneas se derivan de las Células Madre Hematopoyéticas (HSC)1. La vía clásica de producción de megacariocitos en la médula ósea se origina a partir de HSC e implica la generación de diferentes progenitores que restringen progresivamente su potencial de diferenciación2. El primer progenitor que firma el compromiso con el linaje megacariocítico es el Progenitor Megacariocito-Eritrocito (MEP), un progenitor bipotente capaz de producir tanto células eritroides como megacariocitos3,4,5. El MEP produce entonces un progenitor/precursor unipotente (MKp) que se diferenciará en un megacariocito maduro capaz de producir plaquetas. Los mecanismos implicados en la generación de estos progenitores, así como su diferenciación y maduración en megacariocitos son complejos y sólo parcialmente comprendidos. Además, la heterogeneidad de la población DE MEP en términos de potencial de diferenciación y el nivel de compromiso intrínseco de estas células aún no están claros. Para descifrar estos procesos, es esencial obtener (o tener acceso a) poblaciones purificadas de MEP y MKp para análisis moleculares finos y unicelulares.
Varios estudios han demostrado combinaciones particulares de marcadores de superficie celular para la identificación de progenitores comprometidos con el linaje megacariocítico en elratón 6,7,8. A partir de estos se ideó un método que permite la purificación de MEP y MKp de ratones. Este método fue optimizado para obtener células en número y calidad adecuados para un gran número de ensayos. Con consideraciones éticas en mente, y con el fin de minimizar el número de animales involucrados en los experimentos, obtuvimos la recolección de la médula ósea del fémur y la tibia, y también de la cresta ilíaca. Este hueso contiene una alta frecuencia y número de progenitores hematopoyéticos y la mayoría de las veces se daña durante la recolección ósea larga. Aquí se presenta un método detallado para la recolección confiable de este hueso.
El segundo criterio de optimización es producir poblaciones celulares altamente purificadas. Fluorescent Activated Cell Sorting (FACS) es un método de elección para obtener poblaciones purificadas de células de interés. Sin embargo, los bajos rendimientos se alcanzan cuando la población celular de interés es muy rara. Por lo tanto, son necesarios procedimientos de enriquecimiento. En este protocolo, se optó por un procedimiento de selección negativa utilizando perlas magnéticas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Los protocolos con animales se realizaron de acuerdo con el Comité CREMEAS sobre la Ética de los Experimentos con Animales de la Universidad de Estrasburgo (Comité Régional d'Ethique en Matière d'Expérimentation Animale Strasbourg. Número de permiso: E67-482-10).
1. Colección de hueso de ratón
- Sacrificar al animal de acuerdo con los lineamientos institucionales.
NOTA: Los datos presentados en este manuscrito se obtuvieron de ratones C57Bl/6 de 8 a 12 semanas de edad. El número de células obtenidas y la frecuencia de las poblaciones citadas pueden variar con la edad y la cepa del ratón. - Rocíe el cuerpo con etanol al 70%.
- Usando tijeras, haga una incisión de 0.5-1 cm de la piel perpendicular a la columna vertebral y rasgue la piel alrededor de todo el cuerpo. Tire hacia abajo de la piel de la parte inferior del cuerpo y retire la piel.
- Coloque al animal en la almohadilla de disección, boca abajo. Localice los huesos pélvicos deslizando los dedos a lo largo de la columna vertebral expuesta de arriba a abajo. Para localizar la cresta ilíaca, identifique la pequeña protuberancia en la región lumbar cerca de las extremidades posteriores (la región anterosuperior del hueso pélvico). La Figura 1A,B presenta una representación esquemática de la anatomía del ratón.
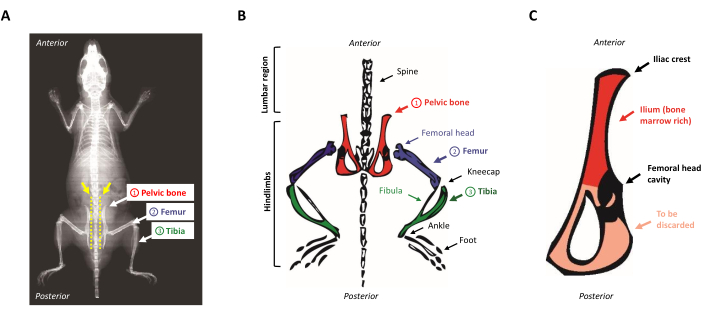
Figura 1: Anatomía del ratón. (A) Radiografía del ratón que muestra los huesos de las extremidades posteriores. Tenga en cuenta el espacio entre el hueso pélvico y la columna vertebral (flecha amarilla), donde se deben insertar las tijeras para separar adecuadamente las extremidades posteriores del cuerpo del ratón (línea punteada amarilla). (B) Representación esquemática de los huesos ricos en médula ósea de interés. Los huesos pélvicos se representan en rojo, los fémures en púrpura y las tibias en verde. (C) Representación esquemática del hueso pélvico del ratón. El ilion corresponde a la parte rica en médula del hueso pélvico y se resalta en rojo. Haga clic aquí para ver una versión más grande de esta figura.
- Coloque las tijeras paralelas a la columna vertebral contra las vértebras y cerca de la protuberancia de la cresta ilíaca. Proceda a cortar los músculos a lo largo del lado de la columna vertebral por encima del hueso pélvico deslizando las tijeras a lo largo de las vértebras hasta la cola.
NOTA: Esta primera sección de los músculos también se puede realizar utilizando una cuchilla de bisturí. - Coloque las tijeras paralelas a la columna vertebral y proceda a cortar entre las vértebras y la cresta ilíaca, como lo indica la línea punteada amarilla en la Figura 1A. Asegúrese de permanecer lo más cerca posible de las vértebras. Corte los músculos restantes para separar la extremidad del cuerpo.
NOTA: Debe haber poca o ninguna resistencia. - Repita en el otro lado para separar la segunda extremidad.
- Transfiera las extremidades sobre una superficie limpia y deseche el resto del cuerpo de acuerdo con las pautas institucionales.
- Exponga los huesos pélvicos, femorales y tibiales eliminando la mayor cantidad posible de tejido circundante con las pórceps y los bisturíes.
- Proceda a dislocar cuidadosamente la cabeza femoral del hueso pélvico sosteniendo el extremo distal del fémur con las pórceps mientras corta suavemente los músculos alrededor de la articulación con los bisturíes. Mueva los huesos para facilitar la dislocación.
- Raspe el músculo restante del hueso pélvico y corte con un bisturí en el medio de la cavidad que sostuvo la cabeza del fémur. El ilion se mantiene ya que es rico en progenitores hematopoyéticos mientras que el lado triangular muy delgado del hueso se descarta, como se muestra en la Figura 1C.
- Retire los tejidos residuales alrededor del ilion con el bisturí y coloque el hueso limpio en PBS estéril suplementado con 2% newborn Calf Serum (PBS-2% NBCS).
- Usando tijeras, corte el pie de la pierna en el tobillo.
- Sostenga la parte inferior de la tibia con los pórceps y raspe el músculo hacia la rodilla. Deseche los peroné y corte a través de la meseta tibial con el bisturí. Coloque la tibia en PBS-2% NBCS estéril.
- Retire los tejidos residuales alrededor del fémur con bisturíes.
- Sostenga la parte superior del fémur con pórceps; coloque la hoja del bisturí en la base de la rótula. Aplicar una fuerza hacia la rótula paralela al fémur hasta el desprendimiento de la rótula. Coloque el fémur en PBS-2% NBCS estéril. La extracción de la rótula proporciona un acceso limpio para insertar la aguja para el enrojecimiento de la médula.
2. Agotamiento magnético de las células positivas del linaje
- En un gabinete de flujo laminar, transfiera los huesos en una placa de Petri estéril llena de PBS-2% NBCS estéril.
- Con un bisturí corta la cabeza de los fémures.
- Llene una jeringa de 1 ml con PBS-2% NBCS estéril y conecte una aguja de 21 G a la salida.
- Llene un tubo de polipropileno de 5 ml con 2 ml de PBS-2% NBCS estéril.
- Sostenga el fémur con los pórceps; Inserte suavemente la aguja en el surco que queda después de la extracción de la rótula. Aplique rotación a la aguja mientras inserta para evitar el taponamiento de la aguja. Asegúrese de que la aguja esté completamente insertada en el hueso hasta el bisel.
- Transfiera el hueso con la aguja al tubo que contiene 2 ml de PBS-2%NBCS. Dispense y aspire el PBS-2%NBCS de la jeringa hasta que el hueso esté claro.
- Retire la aguja del fémur e insértela en el orificio en el lado opuesto donde estaba la cabeza del fémur. Dispensar y aspirar el tampón de nuevo y desechar el hueso.
- Para la cresta ilíaca y la tibia, sostenga el hueso con las pórceps; Inserte suavemente la aguja en el lado abierto. Aplique rotación a la aguja mientras inserta para evitar el taponamiento de la aguja. Asegúrese de que la aguja esté completamente insertada en el hueso hasta el bisel. Transfiera el hueso con la aguja al tubo que contiene 2 ml de PBS-2%NBCS. Dispense y aspire el PBS-2%NBCS de la jeringa hasta que el hueso esté claro. Deseche los huesos.
NOTA: Los huesos de hasta tres ratones se pueden enjuagar en el mismo tubo. Pool las suspensiones celulares. - Pase la suspensión de células agrupadas a través de una tapa de colador de células de 40 μm colocada sobre un tubo estéril de poliestireno de 5 ml.
- Proceda a contar las celdas.
NOTA: El recuento de células se puede realizar con cualquier hemocitómetro, utilizando Trypan Blue para la evaluación de viabilidad, o con cualquier contador celular automatizado. Un ratón normalmente produce 105 ± 7 x 106 células. - Apartar 100 μL de la suspensión celular como Médula Ósea Total, añadir 500 μL de PBS-2%NBCS y guardarlo en hielo para el procedimiento de tinción.
- Pellet la suspensión filtrada por centrifugación a 400 x g durante 5 min a 4 °C y desechar el sobrenadante.
NOTA: Los glóbulos rojos se pueden lisar resuspiendo el pellet en solución de lisis recién preparada (1/10 en dH2O). Incubar durante 5 min hasta que la suspensión se vuelva clara y de color rojo brillante y añadir 10 volúmenes de PBS estéril. Proceda a lavar las células en PBS-2%NBCS por centrifugación a 400 x g durante 5 minutos a 4 °C. Tenga cuidado al retirar el sobrenadante, ya que el pellet celular está muy suelto. Realice un segundo lavado con PBS-2%NBCS por centrifugación a 400 x g durante 5 min a 4 °C y proceda al paso 2.13. - Resuspend el pellet celular en un cóctel de anticuerpos primarios recién preparado con una proporción de 100 μL por 1 x 107 células. Incubar en hielo durante 30-45 min.
| Anticuerpo | Dilución |
| Gr-1-biotina | 1:500 |
| B220-biotina | 1:500 |
| Mac-1-biotina | 1:500 |
| CD3-biotina | 1:500 |
| CD4-biotina | 1:500 |
| CD5-biotina | 1:500 |
| CD8-biotina | 1:500 |
| TER119-biotina | 1:1000 |
| CD127-biotina | 1:500 |
Tabla 1.
- Apartar 10 μL de la suspensión celular en un tubo estéril de poliestireno de 5 ml con la etiqueta Lin-Pos Fracción. Agregue 90 μL de PBS-2% NBCS y guárdelo en hielo para el procedimiento de tinción.
- Proceda a lavar las células dos veces con PBS-2% NBCS estéril por centrifugación a 400 x g durante 5 min a 4 °C. Asegúrese de hacer el último lavado en un tubo estéril de polipropileno de 5 ml.
- Durante los pasos de lavado, prepare las cuentas para el agotamiento magnético.
- Resuspend las perlas en el vial mediante el vórtice completo durante 30 s.
- Transfiera un volumen de perlas correspondiente a dos perlas por celda objetivo en un tubo de polipropileno de 5 ml.
- Lave las perlas dos veces con PBS-2% NBCS colocando el tubo en el imán y retirando el tampón de lavado con una pipeta Pasteur de vidrio estéril.
- Resuspend las perlas en 500 μL de PBS-2NBCS estéril.
- Vuelva a colocar el pellet de células etiquetadas en 250 μL de perlas y mezcle suavemente durante 5 minutos sobre hielo. Agregue 2 ml de PBS-2% NBCS estéril y mezcle suavemente. No agite el tubo.
- Coloque el tubo sobre el imán durante 2 min.
- Proceda a recoger la fracción no magnética con una pipeta Pasteur de vidrio estéril y agréguela sobre los 250 μL restantes de perlas magnéticas. Selle el tubo con parafilm.
- Coloque el tubo en un rodillo de tubo durante 20 minutos a 4 °C.
- Agregue 2 ml de PBS-2% NBCS estéril y mezcle suavemente. No agite el tubo.
- Coloque el tubo en el imán durante 2 min.
- Proceda a recoger la fracción no magnética en un tubo estéril de polipropileno de 5 ml etiquetado como Fracción Lin-Neg con una pipeta Pasteur de vidrio estéril.
- Peletizar las células por centrifugación a 400 x g durante 5 min a 4 °C y retirar el sobrenadante.
- Resuspend las células no magnéticas en 500 μL de PBS-2%NBCS estéril.
- Proceda a contar las celdas.
NOTA: Un ratón normalmente produce 3,9 ± 1,1 x 106 celdas. La tinción típica del linaje antes y después del agotamiento se presenta en la Figura 2B.
3. Clasificación celular de progenitores de megacariocitos por citometría de flujo
- Tome los tubos etiquetados como Médula ósea total, fracción Lin-Pos y fracción Lin-Neg.
- Proceda a dividir el contenido del tubo de médula ósea total por igual en seis tubos estériles de poliestireno de 5 ml. Etiquete los tubos con los números 1-6.
- Proceda a etiquetar el tubo Lin-Pos Fracción con el número 7.
- Proceda a dividir el contenido de la fracción Lin-Neg del tubo de la siguiente manera.
- Transfiera 50 μL a un tubo estéril de poliestireno de 5 ml que contenga 250 μL de PBS-2%NBCS estéril. Luego, divida su contenido por igual en 3 tubos estériles de poliestireno de 5 ml. Etiquete estos tubos con los números 8-10.
- Los 450 μL restantes de suspensión celular de fracción Lin-Neg corresponden al tubo con el número 11.
- Añadir los anticuerpos a los tubos como se describe en la Tabla 2.
| Tubo | Etiqueta | Cóctel de anticuerpos |
| Médula ósea total | ||
| 1 | Control no manchado | |
| 2 | Control de mancha única | CD45-FITC (1/200) |
| 3 | Control de mancha única | CD45-PE (1/200) |
| 4 | Control de mancha única | TER119-APC (1/200) |
| 5 | Control de mancha única | CD45-PECy7 (1/200) |
| 6 | Control de mancha única | Biotina CD45-APC-Cy7 (1/200) |
| Fracción Lin-Pos | ||
| 7 | Control de mancha única | Control de mancha única. Streptavidin-APC-Cy7 (1/500) |
| Fracción Lin-Neg | ||
| 8 | Control FMO FITC | c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 9 | Control FMO PE | CD9-FITC (1/200) + c-kit-APC (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 10 | Control FMO PECy7 | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 11 | Tubo positivo para clasificación | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
Tabla 2.
- Incubar en hielo durante 30-45 minutos en la oscuridad.
- Lavar las células con PBS-2%NBCS estéril por centrifugación a 400 x g durante 5 min a 4 °C.
- Resuspenda los gránulos celulares de la siguiente manera.
- Para los tubos 1 a 10, resusped el pellet en 300 μL de PBS-2%NBCS estéril suplementado con 7AAD (2,5 μg/mL final) (PBS-7AAD).
PRECAUCIÓN: 7AAD es un intercalante de ADN y, por lo tanto, debe manipularse con los EPI (guantes) adecuados. - Para el tubo 11, vuelva a colocar el pellet en PBS-7AAD estéril a una concentración máxima de 5 x 106 células por ml y un volumen mínimo de 1 ml.
- Para los tubos 1 a 10, resusped el pellet en 300 μL de PBS-2%NBCS estéril suplementado con 7AAD (2,5 μg/mL final) (PBS-7AAD).
- Prepare dos tubos de recolección de polipropileno etiquetados como MEP y MKp que contengan 2 ml de PBS-2% NBCS.
NOTA: Alternativamente, las células se pueden recolectar en medio de cultivo o tampón de lisis celular dependiendo de la aplicación posterior para las células clasificadas. No se recomienda el uso de tubos de poliestireno debido a la posible interferencia con las gotas cargadas que contienen las células de interés. - Mantenga todos los tubos en hielo en la oscuridad.
- Vaya a la configuración del clasificador de celdas.
- Utilice los tubos 1-7 para configurar el voltaje y la compensación, los tubos 7-10 para determinar las compuertas de clasificación para las poblaciones celulares de interés y el tubo 11 para la clasificación celular.
- Los primeros pasos de la estrategia de gating tienen como objetivo excluir los dobletes y las células muertas del análisis, como se describe en la Figura 3. Identifique células viables individuales y muestre el diagrama de puntos SSC-vs Lin-APC-Cy7 para confirmar la eficiencia del agotamiento del linaje. Desde las celdas Linse establece una puerta para seleccionar celdas positivas para c-kit y negativas o tenues para Sca-1 y CD16/32. Un diagrama de puntos de expresión CD9 vs CD150 para las celdas seleccionadas permite la identificación de cuatro poblaciones.
NOTA: Las células MEP y MKp son positivas para CD150. Se pueden definir tres niveles de expresión para CD9 (neg, dim y high). MKp expresa un alto nivel de CD9 y MEP expresa CD9 a un nivel intermedio de intensidad de fluorescencia. La población MEP corresponde a Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9dim y la población MKp corresponde a Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9brillante. La discriminación entre las poblaciones CD9 alta y CD9 tenue para las células CD150 positivas se establece en función del nivel máximo de expresión de CD9 en la población CD150 negativa. Un ratón normalmente produce 5,3 ± 0,6 x 103 MKp y 27,2 ± 2,4 x 103 MEP.
Access restricted. Please log in or start a trial to view this content.
Resultados
El análisis fenotípico de las células identificadas como MEP y MKp se realizó mediante citometría de flujo. Las células fueron etiquetadas con anticuerpos conjugados de fluorescencia a CD41a y CD42c, marcadores clásicos de los linajes megacariocítico y plaquetario. Ambos marcadores fueron expresados por las células de la población MKp mientras que estos marcadores aún no se detectan en la superficie de las células de la población MEP (Figura 4Ai,4Aii). La polipl...
Access restricted. Please log in or start a trial to view this content.
Discusión
El método descrito en este documento permite la extracción y purificación de MEP y MKp de ratón. Un parámetro importante en la optimización del protocolo fue obtener un número suficiente de células que fueran compatibles con la mayoría de los ensayos moleculares y celulares. La práctica general de la recolección de hueso de ratón para la extracción de células hematopoyéticas generalmente consiste en cosechar tanto los fémures como las tibias de cada ratón. Por lo tanto, el hueso pélvico, otra fuente de ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no declaran intereses financieros contrapuestos.
Agradecimientos
Los autores desean agradecer a Monique Freund, Catherine Ziessel y Ketty por su asistencia técnica. Este trabajo fue apoyado por ARMESA (Association de Recherche et Développement en Médecine et Santé Publique), y por Grant ANR-17-CE14-0001-01 a Henri.de la. Salle.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
Referencias
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14(2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
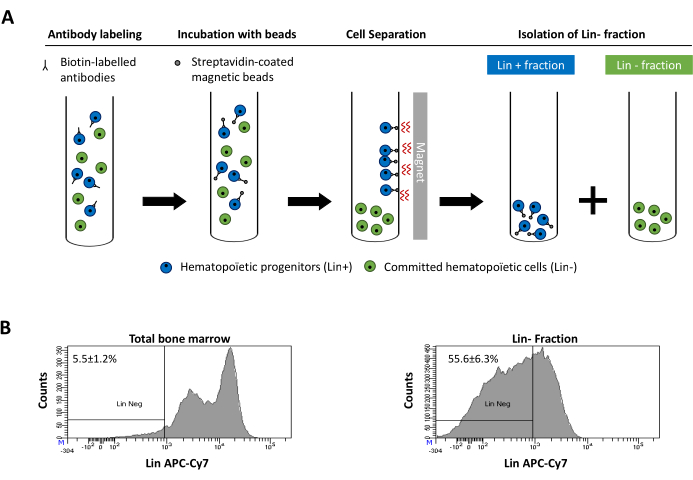
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
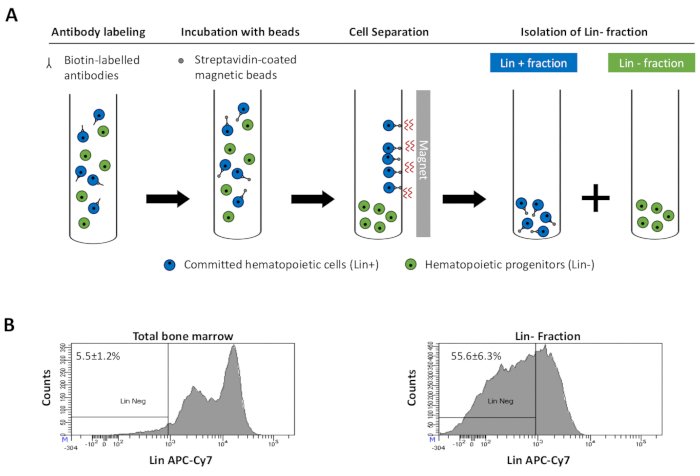
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados