このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスメガ核球前駆細胞の分離
Erratum Notice
要約
この方法は、マウス大腿骨、脛骨、および骨盤骨からのMEPおよびMKpのフローサイトメトリーによる精製を記述する。
要約
骨髄巨核球は血小板の産生を保障する大きい多倍化細胞である。彼らは、造血幹細胞から巨核代を介して生じる。このプロセスの最終段階は複雑で古典的に二能性の巨核球-赤血球前駆細胞(MEP)と単一の巨大核球前駆細胞(MKp)を含む。これらの集団は、ボナフィデス巨核球の形成に先行し、そのように、その分離と特徴付けは、巨核球形成の堅牢で公平な分析を可能にする可能性がある。このプロトコルは、マウス骨髄から造血細胞を収集する手順、磁気枯渇を介した造血前駆物質の濃縮、そして最後に高度に精製されたMEPおよびMKp集団をもたらす細胞選別戦略を提示する。まず、骨髄細胞は大腿骨、脛骨、および腸骨紋から採取され、また、造血前駆腫の数が多い骨である。腸骨の骨の使用は、マウスごとに得られる総細胞数を大幅に増加させ、したがって、動物のより倫理的な使用に貢献する。450 nmの磁気ビーズを使用して磁気系統の枯渇を最適化し、フローサイトメトリーによる非常に効率的な細胞選別を可能にしました。最後に、このプロトコルは、MEP(Lin - Sca-1-c-Kit + CD16/32-CD150+CD9薄暗い)とMKp(Lin - Sca-1-c-kit + CD16/32 - CD150 + CD99)の選別のためのラベリングと格子戦略を提示します。).この技術は実装が容易で、i)分子特性評価を行うのに十分な細胞材料を提供し、そのアイデンティティと生物学のより深い知識、ii)インビトロ分化アッセイは、巨大核球の成熟のメカニズムのより良い理解を提供する、またはiii)彼らの微小環境との相互作用のインビトロモデルをより良く理解する。
概要
血小板は巨核球によって産生される。これらの大きな多倍細胞は骨髄に位置し、すべての血液細胞については造血幹細胞(HSC)1に由来する。骨髄における巨核球の産生の古典的な経路はHSCに由来し、それらの分化電位を徐々に制限する異なる前駆物質の生成を伴う2。巨核細胞性系統へのコミットメントに署名する最初の前駆子は、巨核球赤血球前駆細胞(MEP)であり、赤血球細胞と巨核球3、4、5の両方を産生することができる二能性前駆細胞である。その後、MEPは血小板を産生できる成熟した巨核球に分化する一能性前駆細胞/前駆体(MKp)を産生する。これらの前駆体の生成に関与するメカニズムは、巨大核球への分化および成熟と同様に複雑であり、部分的にしか理解されていない。また、分化ポテンシャルとこれらの細胞の本質的なコミットメントレベルの観点からMEP集団の不均一性は依然として不明である。これらのプロセスを解読するには、微細な分子および単一細胞解析のために、MEPおよびMKpの精製された集団を得る(またはアクセス権を持つ)必要があります。
いくつかの研究は、マウス6、7、8の巨核球系にコミットされた前駆体の同定のための細胞表面マーカーの特定の組み合わせを実証している。これらの方法からマウスからのMEPおよびMKpの精製を可能にする方法が考案された。この方法は、多数のアッセイに対して十分な数および品質の細胞を得るために最適化された。倫理的な配慮を念頭に置き、実験に関与する動物の数を最小限に抑えるために、大腿骨や脛骨から骨髄を収穫し、また腸骨の紋章から骨髄を収穫することを引き出しました。この骨は高周波と造血前駆物質の数を含み、長い骨採取中に損傷を受けるほとんどの時間です。ここで提示すると、この骨の信頼性の高いコレクションのための詳細な方法です。
最適化の第2の基準は、高度に精製された細胞集団を生成することです。蛍光活性化細胞選別(FACS)は、目的の細胞の精製集団を得るために選択する方法である。しかし、関心のある細胞集団が非常にまれである場合、低収量に達する。したがって、エンリッチメント手順が必要です。このプロトコルでは、磁気ビーズを使用して負の選択手順を選択しました。
プロトコル
動物に関する議定書は、ストラスブール大学動物実験倫理に関するCREMEAS委員会(コミテ・レジオナル・デ・エティック・アン・マティエール・ド・エクスペリメンテーション・アニマル・ストラスブール)に従って実施された。許可番号:E67-482-10)。
1. マウスの骨の収集
- 制度的ガイドラインに従って動物を犠牲にする。
注:この原稿に記載されたデータは、8〜12週齢のC57Bl/ 6マウスから得られた。得られた細胞の数、および引用された集団の頻度は、年齢およびマウス株によって異なる場合がある。 - 70%エタノールでボディをスプレーします。
- はさみを使用して、脊椎に垂直な皮膚の0.5〜1cmの切開を行い、全身の皮膚を引き裂きます。下半身から皮膚を引き下げ、皮膚を取り除きます。
- 動物を解剖パッドの上に置き、下に向けます。露出した背骨に沿って指を上から下にスライドさせて骨盤の骨を見つけます。腸骨の紋章を見つけるには、後肢(骨盤骨の前部の下方領域)の近くの腰部の小さな隆起を特定する。図1A,Bはマウス解剖学の概略表現を示す。
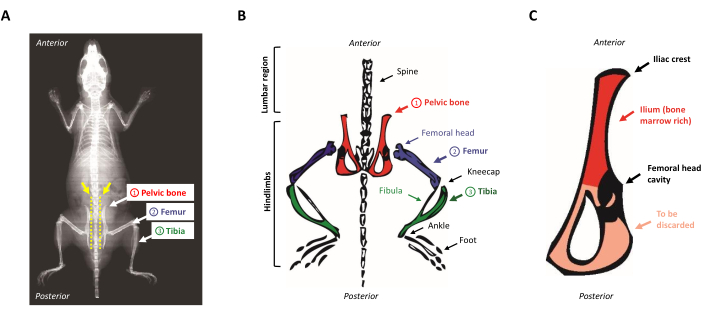
図1:マウス解剖学(A)後肢骨を示すマウスX線骨盤の骨と背骨の間のスペース(黄色の矢印)に注意してください。そこではさみがマウスの体から後肢を適切に分離するために挿入されなければなりません(黄色の点線)。(B) 目的の骨髄が豊富な骨の模式図。骨盤の骨は赤、大腿骨は紫、ティビアは緑色で描かれています。(C)マウス骨盤骨の模式的表現。イリウムは骨盤骨の骨髄が豊富な部分に相当し、赤で強調表示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
- はさみを脊椎に対して脊椎に対して平行に配置し、腸骨の紋章のバンプに近づけます。椎骨に沿ってはさみを尾まで滑らせて、骨盤骨の上の背骨の側面に沿って筋肉を切ります。
注:筋肉のこの最初のセクションは、メスの刃を使用して行うこともできます。 - はさみを脊椎に平行に置き、 図1Aの黄色い点線で示すように、椎骨と腸骨の紋章の間を切り取る。可能な限り椎骨の近くに残るようにしてください。残りの筋肉を切って、体から手足を切り離します。
注:抵抗がほとんどないはずです。 - 反対側で繰り返して、2 番目の四肢を切り離します。
- 清潔な表面に手足を移し、制度的ガイドラインに従って体の残りの部分を捨てます。
- 鉗子およびメスとできるだけ多くの周囲のティッシュを取り除くことによって骨盤、大腿骨および脛骨の骨を露出させる。
- 大腿骨の遠位端を鉗子で保持し、メスで関節の周りの筋肉をそっとスライスして骨盤骨から大腿骨の頭部を慎重に離脱させる。脱臼を容易にするために骨を揺らす。
- 骨盤の骨から残りの筋肉を削り取り、大腿骨の頭を保持した空洞の真ん中にメスで切り取ります。 図1Cに示すように、骨の非常に薄い三角形側が廃棄される間、イリウムは造血前駆物質が豊富であるように保たれている。
- メスでイリウムの周りの残留組織を取り除き、2%新生児子牛血清(PBS-2%NBCS)を補充した無菌PBSに洗浄された骨を入れる。
- はさみを使って、足首の脚から足を切り落とします。
- 脛部の下部を鉗子で保持し、筋肉を膝に向かってこすり上げます。フィブラエを捨て、メスで脛骨高原を横切ってカットします。滅菌PBS-2%NBCSに脛を置きます。
- メスで大腿骨の周りの残留組織を除去します。
- 大腿骨の上側を鉗子で保持します。膝蓋骨の付け根にメスの刃を置きます。膝蓋骨の剥離まで大腿骨に平行に膝蓋骨に向かって力を加える。大腿骨を無菌PBS-2%NBCSに入れる。ニーキャップの除去は骨髄の洗い流しのための針を挿入するためのきれいなアクセスを提供する。
2. 系統陽性細胞の磁気枯渇
- 層流キャビネットで、滅菌PBS-2%NBCSで満たされた滅菌ペトリ皿の骨を移す。
- メスで大腿骨の頭を切り落とす。
- 1 mL の注射器に無菌 PBS-2%NBCS を充填し、21 G の針をコンセントに取り付けます。
- 滅菌PBS-2%NBCSの2 mLで5 mLポリプロピレンチューブを充填します。
- 鉗子で大腿骨を保持します。膝蓋骨の取り外し後に、左の溝に針をそっと挿入します。針の差し込みが行われないように、挿入時に針に回転を適用します。針がベベルまで骨に完全に挿入されていることを確認します。
- 針で骨を2 mLのPBS-2%NBCSを含むチューブに移します。骨がはっきりするまで、注射器からPBS-2%NBCSを分配し、吸引する。
- 大腿骨から針を取り出し、大腿骨の頭部があった反対側の穴に挿入します。再び緩衝液を分配し、吸引し、骨を捨てる。
- 腸骨の紋章と脛骨の場合は、鉗子で骨を保持します。開いた側に針をそっと挿入します。針の差し込みが行われないように、挿入時に針に回転を適用します。針がベベルまで骨に完全に挿入されていることを確認します。針で骨を2 mLのPBS-2%NBCSを含むチューブに移します。骨がはっきりするまで、注射器からPBS-2%NBCSを分配し、吸引する。ボーンを破棄します。
注:最大3匹のマウスのボーンを同じチューブにフラッシュできます。セルのサスペンションをプールします。 - プールされたセル懸濁液を、滅菌5 mLポリスチレンチューブに置いた40 μmのセルストレーナーキャップを通して通過させます。
- セルのカウントに進みます。
注:細胞数は、生存率評価のためにトリパンブルーを使用して、または任意の自動化されたセルカウンターで、任意のヘモサイトメーターで実行することができます。1 つのマウスは、通常、7 x 10 6 個のセル± 105 個を生成します 。 - 細胞懸濁液を総骨髄として100μL脇に置き、PBS-2%NBCSの500 μLを加え、染色手順のために氷の上に保存します。
- ペレットを4°Cで5分間400xgで遠心分離して懸濁液を濾過し、上清を捨てる。
注:赤血球は、新鮮な溶解溶液(dH2Oで1/10th)でペレットを再懸濁させることによって溶解することができます。懸濁液が明るく真っ赤になるまで5分間インキュベートし、10巻の無菌PBSを加えます。4°Cで5分間400 x gで遠心分離によりPBS-2%NBCSで細胞を洗浄する。 細胞ペレットが非常に緩んでいるため、上清を除去する際には注意が必要です。4°Cで5分間400 x gで遠心分離してPBS-2%NBCSで2回目の洗浄を行い、ステップ2.13に進みます。 - 細胞ペレットを、1 x 107 細胞あたり100 μLの比率で調製したばかりの一次抗体カクテルで再懸濁します。氷の上で30〜45分間インキュベートします。
| 抗体 | 希釈 |
| Gr-1-ビオチン | 1:500 |
| B220-ビオチン | 1:500 |
| マック-1ビオチン | 1:500 |
| CD3ビオチン | 1:500 |
| CD4ビオチン | 1:500 |
| CD5ビオチン | 1:500 |
| CD8ビオチン | 1:500 |
| TER119-ビオチン | 1:1000 |
| CD127-ビオチン | 1:500 |
表 1.
- 細胞懸濁液の10 μLを、Lin-Posフラクションとラベル付けされた無菌5 mLポリスチレンチューブに取り込みます。PBS-2%NBCSの90 μLを加え、氷の上に保存して染色手順を行います。
- 4°Cで5分間400 x g で遠心分離することにより、滅菌PBS-2%NBCSで細胞を2回洗浄する。 滅菌5 mLポリプロピレンチューブで最後の洗浄を行うことを確認してください。
- 洗浄工程中に、ビーズを磁気枯渇に備えます。
- 30 sの場合は完全に渦を出して、バイアル内のビーズを再び停止します。
- ターゲットセルあたり2個のビーズに対応するビーズの体積を5 mLのポリプロピレンチューブに移します。
- 磁石の上にチューブを置き、滅菌ガラスパスツールピペットを使用して洗浄バッファーを取り除くことによって、PBS-2%NBCSでビーズを2回洗浄します。
- ビーズを500 μLの滅菌PBS-2NBCS%で再懸濁します。
- 標識された細胞のペレットを250 μLのビーズで再懸濁し、氷の上で5分間穏やかに混ぜます。滅菌PBS-2%NBCSの2 mLを加え、穏やかに混ぜます。チューブを振らないで下さいます。
- チューブをマグネットに2分間置きます。
- 無菌ガラスパスツールピペットで非磁性分画を収集し、残りの250 μLの磁気ビーズに追加します。パラフィルムでチューブを密封します。
- チューブローラーにチューブを4°Cで20分間置きます。
- 滅菌PBS-2%NBCSの2 mLを加え、穏やかに混ぜます。チューブを振らないで下さいます。
- チューブを磁石に2分間入れ、
- 無菌ガラスパスツールピペットとLin-Neg画分とラベル付けされた無菌5 mLポリプロピレンチューブに非磁性分数を収集するに進みます。
- 4°Cで5分間400xgで遠心分離して細胞をペレット化し、上清を除去する。
- 非磁性細胞を500 μLの無菌PBS-2%NBCSで再懸濁します。
- セルのカウントに進みます。
注: 通常、1 つのマウスは 3.9 ± 1.1 x 106 セル になります。典型的な系統染色前および枯渇後を 図2Bに示す。
3. フローサイトメトリーによる巨核球前駆細胞の細胞選別
- 総骨髄、Lin-Pos画分、および Lin-Neg 画分とラベル付けされたチューブを取ります。
- チューブの含有量を全骨髄を6つの無菌5 mLポリスチレンチューブに均等に分割する。チューブに 1 から 6 の番号を付けます。
- チューブ Lin-Pos Fraction に番号 7 のラベルを付けます。
- 次のように、チューブLin-Neg画分の内容を分割する。
- 滅菌PBS-2%NBCSの250 μLを含む無菌5 mLポリスチレンチューブに50 μLを移します。次に、その含有量を3つの無菌5 mLポリスチレンチューブに均等に分割する。これらのチューブに8-10の番号を付けます。
- Lin-Neg画分セル懸濁液の残りの450 μLは、チューブの番号11に対応します。
- 表2に記載されているように、チューブに抗体を追加します。
| 管 | ラベル | 抗体カクテル |
| 総骨髄 | ||
| 1 | 未染色制御 | |
| 2 | 単一の染色されたコントロール | CD45-FITC (1/200) |
| 3 | 単一の染色されたコントロール | CD45-PE (1/200) |
| 4 | 単一の染色されたコントロール | TER119-APC (1/200) |
| 5 | 単一の染色されたコントロール | CD45-PECy7 (1/200) |
| 6 | 単一の染色されたコントロール | CD45-APC-Cy7 ビオチン (1/200) |
| リンポス画分 | ||
| 7 | 単一の染色されたコントロール | 単一の染色されたコントロール。ストレプトアビジン-APC-Cy7 (1/500) |
| リンネグ分数 | ||
| 8 | FMOフィットコントロール | cキットAPC (1/200) + スカ-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + ストレプトアビジン-APC-Cy7 (1/500) |
| 9 | FMO PE 制御 | CD9-FITC (1/200) + c-kit-APC (1/200) + CD150-PECy7 (1/200) + ストレプトアビジン-APC-Cy7 (1/500) |
| 10 | FMO PECy7 コントロール | CD9-FITC (1/200) + c-kit-APC (1/200) + スカ-1-PE (1/200) + CD16/32-PE (1/200) + ストレプトアビジン-APC-Cy7 (1/500) |
| 11 | 選別のための正の管 | CD9-FITC (1/200) + c-kit-APC (1/200) + スカ-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + ストレプトアビジン-APC-Cy7 (1/500) |
表 2.
- 暗闇の中で30〜45分間氷の上でインキュベートします。
- 4°Cで5分間400 x g で遠心分離して、滅菌PBS-2%NBCSで細胞を洗浄します。
- 細胞ペレットを次のように再懸濁する。
- チューブ1〜10の場合、7AAD(2.5 μg/mL末日)を補充した無菌PBS-2%NBCSの300 μL(PBS-7AAD)でペレットを再懸濁します。
注意:7AADはDNAインターカラントであるため、適切なPPE(手袋)で取り扱う必要があります。 - チューブ11の場合、無菌PBS-7AAD中のペレットを、mL当たり5 x106 細胞の最大濃度および1mLの最小体積で再懸濁する。
- チューブ1〜10の場合、7AAD(2.5 μg/mL末日)を補充した無菌PBS-2%NBCSの300 μL(PBS-7AAD)でペレットを再懸濁します。
- PBS-2%NBCSの2 mLを含むMEPとMKpとラベル付けされた2つのポリプロピレンコレクションチューブを準備します。
注:または、細胞は、ソートされた細胞の後続のアプリケーションに応じて、培養培地または細胞のリシスバッファーに収集することができます。ポリスチレンチューブの使用は、関心のある細胞を含む帯電液滴との干渉の可能性があるため、推奨されません。 - 暗闇の中で氷の上にすべてのチューブを保ちます。
- セルソーターのセットアップに進みます。
- チューブ1〜7を使用して電圧と補償を設定し、チューブ7〜10を使用して、対象の細胞集団の選別ゲートと細胞選別用のチューブ11を決定します。
- 格紙戦略の最初のステップは、 図 3に示すように、分析からダブレットとデッド セルを除外することを目的としています。単一の生存細胞を識別し、系統枯渇の効率を確認するためにSSC-対Lin-APC-Cy7ドットプロットを表示します。Lin- セルからゲートは、C-kitに正のセルを選択し、Sca-1およびCD16/32に対して陰性または薄暗い細胞を選択するように設定されます。選択したセルの CD9 と CD150 の式ドット プロットでは、4 つの母集団を識別できます。
メモ: MEP セルと MKp セルは、CD150 の場合も正の値です。CD9 の 3 つのレベルの式を定義できます (ネグ、ディム、高)。MKpは、中間蛍光強度レベルでCD9およびMEP発現CD9の高レベルを発現する。MEPの人口は、リン- c-Kit+ Sca-1-CD16 /32-/薄暗い CD150+ CD9薄暗い およびMKpの人口は、リン- c-キット+ Sca-1-CD16/32-/薄暗い CD150+ CD9明るい.CD150陽性細胞のCD9高位とCD9薄暗い集団の間の差別は、CD150陰性集団におけるCD9発現の最大レベルに基づいて設定される。1 つのマウスは、通常、0.6 x 10 3 MKp ± 5.3、2.4 x 103 MEP ± 27.2を 生成します。
結果
MEPおよびMKpとして同定された細胞の表現型分析は、フローサイトメトリーによって行った。細胞は、CD41aおよびCD42c、巨核球および血小板系統の古典的マーカーに対する蛍光共役抗体で標識した。両方のマーカーは、これらのマーカーがMEP集団の細胞の表面でまだ検出されていない間にMKp集団の細胞によって発現した(図4Ai,4Aii)。多倍数は巨核球の特徴です。...
ディスカッション
本論文では、マウスMEPやMKpの抽出と精製が可能です。プロトコルの最適化における重要なパラメータは、ほとんどの分子および細胞ベースのアッセイと互換性のある十分な数の細胞を得ることだった。造血細胞抽出のためのマウス骨採取の一般的な実践は、通常、各マウスの大腿骨および脛骨の両方を収穫することにある。造血材料のもう一つの供給源である骨盤骨は、見落とされがちであ?...
開示事項
著者らは、競合する財政的利益を宣言しない。
謝辞
著者らは、モニーク・フロイント、キャサリン・ジーゼル、ケティの技術支援に感謝したいと考えています。この作品は、ARMESA(メデシン・エ・サンテ・パブリケ協会)とグラントANR-17-CE14-0001-01によって Henri.de ラによって支えられました。サル。
資料
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
参考文献
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14 (2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
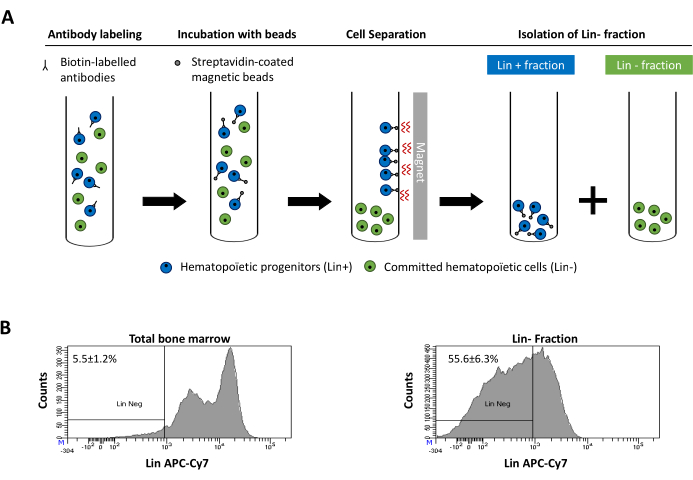
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
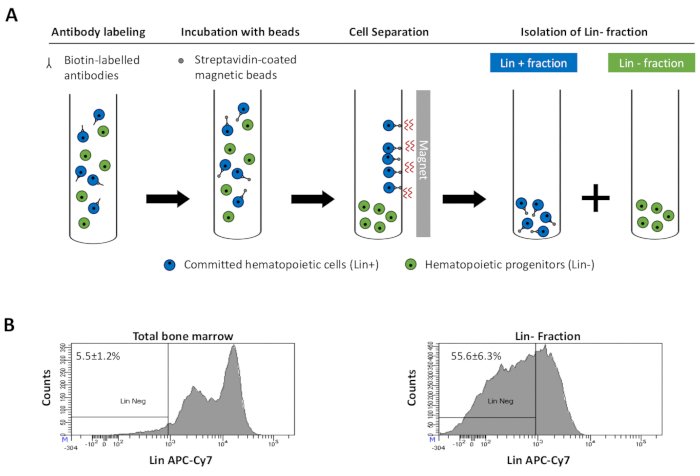
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved