JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스 메가카요시테 전조자의 격리
Erratum Notice
요약
이 방법은 마우스 대퇴골, 티바이어스 및 골반 뼈로부터 MEP 및 MKp의 혈류 세포질에 의한 정화를 설명합니다.
초록
골수 메가카요세포는 혈액 혈소판의 생산을 보장하는 큰 폴리플로이드 세포입니다. 그(것)들은 거대 karyopoiesis를 통해 조혈 줄기 세포에서 생겨나. 이 과정의 최종 단계는 복잡하고 고전적으로 이중성 메가카요세포-에리스로세포 전구체(MEP)와 단능한 메가카요시테 전조자(MKp)를 포함한다. 이 인구는 선의의 거대 카르요세포의 형성을 선행하고, 그 격리와 특성화는 거대 카르요세포 형성의 강력하고 편견없는 분석을 허용할 수 있었다. 이 프로토콜은 마우스 골수에서 조혈 세포를 수집하는 절차를 자세히 제시, 자기 고갈을 통해 조혈 선조의 농축과 마지막으로 매우 정제 MEP와 MKp 인구를 산출 세포 선별 전략. 첫째, 골수 세포는 대퇴골, 경골 및 또한 일강 문장, 조혈 선조의 높은 수를 포함하는 뼈에서 집합된다. iliac 문장 뼈의 사용은 마우스 당 얻은 총 세포 수를 크게 증가시키고 따라서 동물의 더 윤리적 사용에 기여한다. 450nm 자성 구슬을 사용하여 자기 계보 고갈을 최적화하여 유동 세포측정에 의한 매우 효율적인 세포 선별을 가능하게 했습니다. 마지막으로, 프로토콜은 두 개의 고도로 정제 된 메가 카요 세포 선조 모집단의 정렬을위한 라벨링 및 게이팅 전략을 제시합니다 : MEP (Lin-Sca-1-c-Kit+CD16 / CD9 dim ) 및 MKp (Lin- Sca-1-c 키트+CD16 + CD16 +CD16 + CD16 - CD16 - CD16 - CD16 - CD16 - CD16 + CD16 + CD16 + CD10 + CD10 + CD9dim)및 CD16 + CD16 + CD16 + CD16+CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD16 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10 + CD10+ ). 이 기술은 구현하기 쉽고 i) 그들의 정체성과 생물학의 깊은 지식에 대한 분자 특성화를 수행하기에 충분한 세포 물질을 제공합니다, ii) 체외 분화 소사, 그 메가 카르요세포의 성숙의 메커니즘의 더 나은 이해를 제공 할 것입니다, 또는 iii) 자신의 마이크로 환경과의 상호 작용의 체외 모델.
서문
혈액 혈소판은 거대 카르요세포에 의해 생성됩니다. 이러한 큰 폴리플로이드 세포는 골수에 위치하며 모든 혈액 세포는 혈액 세포(HSC)1에서유래된다. 골수에 있는 거대 카르요세포의 생산의 고전적인 통로는 HSC에서 유래하고 점진적으로 그들의 분화 잠재력을 제한하는 다른 선조의 생성을 관련시킵니다2. 메가카요시틱 혈통에 대한 헌신에 서명한 첫 번째 선조는 에리스로이드 세포와 메가카요세포3,4,5를모두 생산할 수 있는 양성선조인 메가카르요세포-에리스로세포 전구(MEP)이다. 그런 다음 MEP는 혈소판을 생산할 수 있는 성숙한 메가카요시테로 분화하는 단능한 전구체/전구체(MKp)를 생성합니다. 이 선조의 생성에 관련되었던 기계장치는, megakaryocytes로의 그들의 분화 및 성숙 뿐 아니라 복잡하고 부분적으로만 이해됩니다. 추가적으로, 이러한 세포의 분화 잠재력과 본질적인 약정 수준의 관점에서 MEP 인구의 이질성은 여전히 불분명하다. 이러한 프로세스를 해독하기 위해서는 미세 분자 및 단일 세포 분석을 위해 MEP 및 MKp의 정제 된 인구를 얻거나 (또는 액세스 할 수 있음)하는 것이 필수적입니다.
몇몇 연구는 마우스6,7,8에서거대 핵세포 계보에 전념하는 선조의 식별을 위한 세포 표면 마커의 특정 조합을입증했습니다. 이러한 방법에서 마우스로부터 MEP 및 MKp의 정제를 허용하는 방법이 고안되었다. 이 방법은 많은 수의 분석에 대해 적절한 수와 품질로 세포를 얻기 위해 최적화되었습니다. 윤리적 고려 사항을 염두에 두고 실험에 관련된 동물의 수를 최소화하기 위해 대퇴골과 경골, 그리고 또한 일강 문장에서 골수를 수확하도록 유도했습니다. 이 뼈는 높은 주파수와 조혈 선조의 수를 포함하고 긴 뼈 수확 도중 손상된 시간의 대부분입니다. 여기에 이 뼈의 신뢰할 수 있는 컬렉션에 대 한 자세한 방법은 소개.
최적화의 두 번째 기준은 고도로 정제된 세포 집단을 생산하는 것입니다. 형광 활성화 세포 분류 (FACS)는 관심있는 세포의 정제 된 인구를 얻기 위해 선택의 방법입니다. 그러나, 낮은 수익률은 관심의 세포 인구가 매우 드물 때 도달한다. 따라서 농축 절차가 필요합니다. 이 프로토콜에서는 마그네틱 구슬을 사용하여 음수 선택 절차를 선택했습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
동물관련 프로토콜은 스트라스부르 대학의 동물 실험 윤리에 대한 CREMEAS 위원회에 따라 수행되었습니다(코미테 레지오날 데티크 앙 마티에르 디에르 데티크 앙 마티에르 데프레시먼트 애니멀 스트라스부르. 허가 번호: E67-482-10).
1. 마우스 뼈 컬렉션
- 제도적 지침에 따라 동물을 희생하십시오.
참고: 이 원고에 제시된 데이터는 8 주에서 12주 전에 C57Bl/6 마우스로부터 얻어졌습니다. 얻어진 세포의 수와 인용된 집단의 빈도는 나이와 마우스 변형에 따라 다를 수 있다. - 몸에 70% 에탄올을 뿌림합니다.
- 가위를 사용하여 척추에 수직으로 피부를 0.5-1cm 절개를 하고 몸 전체의 피부를 찢어버린다. 하체에서 피부를 당기고 피부를 제거합니다.
- 동물을 해부 패드에 놓고 아래로 향합니다. 노출된 척추를 따라 손가락을 위에서 아래로 밀어골반 뼈를 찾습니다. iliac 문장을 찾으려면 뒷다리 근처의 요추 부위의 작은 범프 (골반 뼈의 전방 우페리어 지역)를 식별하십시오. 도 1A,B는 마우스 해부학의 회로도 표현을 제시한다.
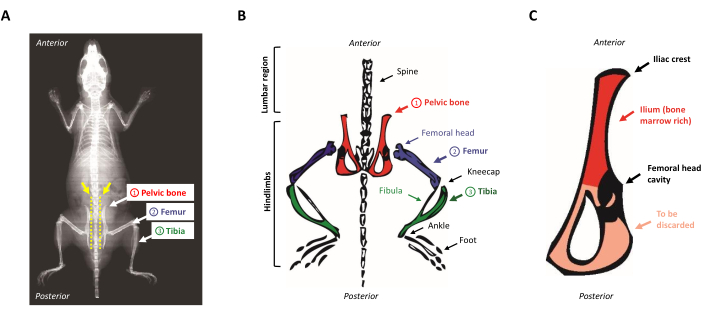
그림 1: 마우스 해부학. (A)마우스 엑스레이는 뒷다리 뼈를 보여주는. 골반 뼈와 척추 (노란색 화살표) 사이의 공간을 유의하십시오, 여기서 가위는 마우스의 몸 (노란색 점선)에서 뒷다리를 적절하게 분리하기 위해 삽입해야합니다. (B)골수가 풍부한 뼈의 회로도 표현. 골반 뼈는 빨간색으로 묘사되고, 대퇴골은 보라색으로 묘사되고, 녹색의 티비아는 묘사됩니다. (C)마우스 골반 뼈의 회로도 표현. ilium은 골반 뼈의 골수가 풍부한 부분에 해당하며 빨간색으로 강조 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 척추에 대한 척추에 평행하게 가위를 배치하고 iliac 문장 범프에 가까이. 척추를 따라 가위를 꼬리까지 미끄러지면서 골반 뼈 위의 척추 측면을 따라 근육을 자르는 방향으로 진행합니다.
참고: 메스 블레이드를 사용하여 근육의 첫 번째 섹션도 수행할 수 있습니다. - 가위를 척추와 평행하게 놓고 도 1A의노란색 점선으로 표시된 척추와 일강 문장 사이를 절단합니다. 척추에 가능한 한 가깝게 유지해야 합니다. 나머지 근육을 잘라 몸에서 사지를 분리합니다.
참고: 저항은 거의 또는 전혀 없어야 합니다. - 두 번째 사지를 분리하기 위해 다른 쪽에서 반복합니다.
- 깨끗한 표면에 사지를 옮기고 기관 지침에 따라 신체의 나머지 부분을 폐기하십시오.
- 집게와 메스로 가능한 한 많은 주변 조직을 제거하여 골반, 대퇴, 경골 뼈를 노출시하십시오.
- 대퇴골뼈에서 대퇴골 머리를 조심스럽게 탈구하는 동시에 메스로 관절 주위의 근육을 부드럽게 자르는 동안 대퇴골의 말단을 집게로 잡아서 조심스럽게 탈구한다. 탈구를 용이하게하기 위해 뼈를 흔들어.
- 골반 뼈에서 남은 근육을 긁어 내고 대퇴골 머리를 잡고 있었다 구멍의 중간에 메스로 잘라. 일륨은 조혈 선조가 풍부하므로 유지되며 뼈의 삼각형은 매우 얇은 뼈가 버려지며 도 1C에도시된 바와 같이.
- 메스로 일륨 주위의 잔류 조직을 제거하고 2 %의 신생아 송아지 혈청 (PBS-2 % NBCS)으로 보충 멸균 PBS에 청소 된 뼈를 배치합니다.
- 가위를 사용하여 발목다리에서 발을 잘라냅니다.
- 집게로 경골의 하부를 잡고 근육을 무릎쪽으로 긁어냅니다. 비골을 버리고 메스로 경골 고원을 가로질러 자른다. 멸균 PBS-2%NBCS에 경골을 놓습니다.
- 메스로 대퇴골 주위의 잔류 조직을 제거합니다.
- 대퇴골의 위쪽을 집게로 잡으십시오. 메스 블레이드를 슬개골 바닥에 놓습니다. 슬개골이 분리될 때까지 대퇴골과 평행하게 슬개골쪽으로 힘을 가한다. 대퇴골을 멸균 PBS-2%NBCS에 배치합니다. 슬개골 제거는 골수 플러싱을 위한 바늘을 삽입하기 위한 깨끗한 접근을 제공합니다.
2. 계보 양성 세포의 자기 고갈
- 라미나르 플로우 캐비닛에서 멸균 PBS-2%NBCS로 채워진 멸균 페트리 접시에 뼈를 옮겨 보입니다.
- 대퇴골의 머리를 잘라 메스와 함께.
- 멸균 PBS-2%NBCS로 1mL 주사기를 채우고 21G 바늘을 콘센트에 부착합니다.
- 멸균 PBS-2%NBCS의 2mL로 5mL 폴리 프로필렌 튜브를 채웁니다.
- 대퇴골을 집게로 잡으십시오. 슬개골 제거 후 왼쪽 홈에 바늘을 부드럽게 삽입합니다. 바늘의 연결되지 않도록 삽입하는 동안 바늘에 회전을 적용합니다. 바늘이 완전히 배꼽까지 뼈에 삽입되었는지 확인합니다.
- PBS-2%NBCS의 2mL를 포함하는 관으로 바늘로 뼈를 전송합니다. 뼈가 명확해질 때까지 PBS-2%NBCS를 주사기에서 분배하고 흡인시합니다.
- 대퇴골에서 바늘을 제거하고 대퇴골 머리가 있던 반대쪽의 구멍에 삽입합니다. 버퍼를 다시 분배하고 흡인하고 뼈를 버립니다.
- 일강 문장과 경골의 경우, 집게로 뼈를 잡으십시오. 바늘을 열린 쪽에 부드럽게 삽입합니다. 바늘의 연결되지 않도록 삽입하는 동안 바늘에 회전을 적용합니다. 바늘이 완전히 배꼽까지 뼈에 삽입되었는지 확인합니다. PBS-2%NBCS의 2mL를 포함하는 관으로 바늘로 뼈를 전송합니다. 뼈가 명확해질 때까지 PBS-2%NBCS를 주사기에서 분배하고 흡인시합니다. 뼈를 버립니다.
참고: 최대 3개의 마우스에서 뼈는 동일한 관으로 플러시될 수 있습니다. 셀 서스펜션을 풀. - 풀이 된 셀 서스펜션을 멸균 5mL 폴리스티렌 튜브에 배치한 40 μm 셀 스트레이너 캡을 통과합니다.
- 셀 수를 계속 합니다.
참고: 셀 카운트는 생존 가능성 평가를 위해 Trypan Blue를 사용하거나 자동화된 셀 카운터를 사용하여 모든 혈종계로 수행할 수 있습니다. 한 마우스는 일반적으로 105 ± 7 x 106 세포를 산출합니다. - 총 골수로 셀 서스펜션의 100 μL을 따로 가져 와서 PBS-2 % NBCS의 500 μL을 추가하고 염색 절차를 위해 얼음에 저장하십시오.
- 4°C에서 5분 동안 400 x g에서 원심분리에 의해 여과된 서스펜션을 펠릿하고 상퍼를 폐기한다.
참고: 적혈구는 갓 준비된 리시스 용액(dH2O에서1/10)에서 펠릿을 재보펜하여 용액을 제거하여 용액을 제거할 수 있다. 서스펜션이 명확하고 밝은 빨간색이 될 때까지 5 분 동안 배양하고 멸균 PBS 10 볼륨을 추가합니다. PBS-2%NBCS에서 4°C에서 5분 동안 400 x g에서 원심분리로 세포를 세척합니다. 셀 펠릿이 매우 느슨하기 때문에 상체를 제거할 때주의하십시오. PBS-2% NBCS를 4°C에서 5분 동안 400 x g에서 원심분리로 제2 세척을 수행하고 2.13단계로 진행한다. - 1 x 107 세포 당 100 μL의 비율로 갓 준비 된 1 차 적인 항체 칵테일에서 세포 펠릿을 다시 중단합니다. 30-45분 동안 얼음에 배양합니다.
| 항체 | 희석 |
| Gr-1-비오틴 | 1:500 |
| B220-비오틴 | 1:500 |
| 맥-1-비오틴 | 1:500 |
| CD3 비오틴 | 1:500 |
| CD4 비오틴 | 1:500 |
| CD5 비오틴 | 1:500 |
| CD8 비오틴 | 1:500 |
| TER119 비오틴 | 1:1000 |
| CD127-비오틴 | 1:500 |
표 1.
- 셀 서스펜션의 10 μL을 멸균 5mL 폴리스티렌 튜브에 제쳐두십시오. PBS-2% NBCS의 90 μL을 추가하고 염색 절차를 위해 얼음에 저장합니다.
- 멸균 PBS-2%NBCS로 세포를 4°C에서 5분 동안 400 x g에서 원심분리하여 두 번 세척합니다. 멸균 5 mL 폴리 프로필렌 튜브에서 마지막 세척을해야합니다.
- 세척 단계에서 는 자기 고갈을 위해 구슬을 준비하십시오.
- 30초 동안 철저히 소용돌이를 통해 바이알의 구슬을 재중단합니다.
- 대상 셀당 두 개의 비드에 해당하는 비드의 부피를 5mL 폴리프로필렌 튜브로 옮기다.
- BEADS를 PBS-2% NBCS로 자석에 놓고 멸균 유리 파스퇴르 파이펫을 사용하여 세척 버퍼를 제거하여 구슬을 두 번 씻으십시오.
- 멸균 PBS-2NBCS %의 500 μL에서 구슬을 다시 중단합니다.
- 표시된 세포의 펠릿을 250 μL의 구슬에 다시 놓고 얼음 위에 5분간 부드럽게 섞습니다. 멸균 PBS-2% NBCS의 2mL을 추가하고 부드럽게 섞습니다. 튜브를 흔들지 마십시오.
- 튜브를 자석에 2분 동안 놓습니다.
- 멸균 유리 파스퇴르 파이펫으로 비자기 분획을 수집하고 나머지 250 μL의 자기 비드에 추가합니다. 파라필름으로 튜브를 밀봉합니다.
- 튜브를 튜브 롤러에 20분 동안 4°C로 놓습니다.
- 멸균 PBS-2% NBCS의 2mL을 추가하고 부드럽게 섞습니다. 튜브를 흔들지 마십시오.
- 튜브를 자석에 2분 동안 놓습니다.
- 멸균 유리 파스퇴르 파이펫으로 린-네그 분획으로 라벨이 붙은 멸균 5 mL 폴리프로필렌 튜브로 비자기 분획을 수집합니다.
- 4°C에서 5분 동안 400 x g에서 원심분리로 세포를 펠릿하고 상체를 제거합니다.
- 멸균 PBS-2%NBCS의 500 μL에서 비자기 세포를 다시 중단합니다.
- 셀 수를 계속 합니다.
참고: 한 마우스는 일반적으로 3.9 ± 1.1 x 106 셀을 생성합니다. 일반적인 계보 염색 사전 및 고갈 후 도 2B에제시된다.
3. 유동 세포측정에 의한 메가카요세포 전구의 세포 분류
- 총 골수, 린 포 분수 및 린-네그 분획이라고 표시된 튜브를 가져 가라.
- 튜브 총 골수의 함량을 6개의 멸균 5mL 폴리스티렌 튜브로 균등하게 분할합니다. 숫자 1-6로 튜브에 레이블을 지정합니다.
- 튜브 Lin-Pos 분획에 번호 7로 레이블을 지정합니다.
- 다음과 같이 튜브 린-네그 분획의 내용을 분할진행합니다.
- 멸균 PBS-2%NBCS의 250 μL을 포함하는 멸균 5 mL 폴리스티렌 튜브로 50 μL을 전송합니다. 그런 다음 그 함량을 멸균 5 mL 폴리스티렌 튜브 3개로 균등하게 분할합니다. 숫자 8-10으로 이 튜브에 라벨을 붙입니다.
- Lin-Neg 분획 셀 서스펜션의 나머지 450 μL은 숫자 11을 가진 튜브에 해당합니다.
- 표 2에설명된 바와 같이 항체를 튜브에 첨가한다.
| 관 | 레이블 | 항체 칵테일 |
| 총 골수 | ||
| 1 | 얼룩지지 않은 컨트롤 | |
| 2 | 단일 스테인드 컨트롤 | CD45-FITC (1/200) |
| 3 | 단일 스테인드 컨트롤 | CD45-PE (1/200) |
| 4 | 단일 스테인드 컨트롤 | TER119-APC (200년 1월) |
| 5 | 단일 스테인드 컨트롤 | CD45-PECy7 (1/200) |
| 6 | 단일 스테인드 컨트롤 | CD45-APC-Cy7 비오틴 (1/200) |
| 린 포 분획 | ||
| 7 | 단일 스테인드 컨트롤 | 단일 스테인드 컨트롤. 스트렙타비딘-APC-Cy7 (1/500) |
| 린 네그 분획 | ||
| 8 | FMO FITC 제어 | c-키트-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + 스트렙타비딘-APC-Cy7 (1/500) |
| 9 | FMO PE 제어 | CD9-FITC (1/200) + c-kit-APC (1/200) + CD150-PECy7 (1/200) + 스트렙타비딘-APC-Cy7 (1/500) |
| 10 | FMO PECy7 제어 | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + 스트렙타비딘-APC-Cy7 (1/500) |
| 11 | 정렬을 위한 포지티브 튜브 | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + 스트렙타비딘-APC-Cy7 (1/500) |
표 2.
- 어둠 속에서 30-45 분 동안 얼음에 배양하십시오.
- 멸균 PBS-2% NBCS로 세포를 4°C에서 5분 동안 400 x g에서 원심분리하여 세척합니다.
- 다음과 같이 세포 펠릿을 다시 중단합니다.
- 튜브 1 에서 10의 경우, 7AAD (2.5 μg /mL 최종)(PBS-7AAD)로 보충된 멸균 PBS-2%NBCS의 300 μL에서 펠릿을 재연한다.
주의: 7AAD는 DNA 인터칼레미트이므로 적절한 PPE(장갑)로 처리해야 합니다. - 튜브 11의 경우, mL당 최대 농도 5 x 106 셀및 최소 부피 1mL로 멸균 PBS-7AAD로 펠릿을 재연한다.
- 튜브 1 에서 10의 경우, 7AAD (2.5 μg /mL 최종)(PBS-7AAD)로 보충된 멸균 PBS-2%NBCS의 300 μL에서 펠릿을 재연한다.
- PBS-2%NBCS의 2mL를 포함하는 MEP 및 MKp로 표시된 폴리프로필렌 수집 튜브 2개를 준비합니다.
참고: 대안적으로, 셀은 정렬된 셀에 대한 후속 응용 프로그램에 따라 배양 배지 또는 세포 용해 완충제로 수집될 수 있다. 폴리스티렌 튜브의 사용은 관심있는 세포를 포함하는 충전 된 물방울과의 간섭이 가능하기 때문에 권장되지 않습니다. - 어둠 속에서 얼음에 모든 튜브를 유지합니다.
- 셀 선별기 설정으로 진행합니다.
- 튜브 1-7을 사용하여 전압 및 보정을 설정하고, 튜브 7-10을 사용하여 셀 정렬을 위한 관심 있는 세포 집단 및 튜브(11)의 선별 게이트를 결정합니다.
- 게이팅 전략의 첫 번째 단계는 도 3에설명된 바와 같이 분석에서 이중 및 죽은 세포를 배제하는 것을 목표로 한다. 단일 실행 가능한 셀을 식별하고 계보 고갈의 효율성을 확인하기 위해 SSC 대 Lin-APC-Cy7 도트 플롯을 표시합니다. Lin에서- 세포는 C-kit및 Sca-1 및 CD16/32에 대한 음수 또는 희미한 세포를 선택하도록 설정됩니다. 선택한 셀에 대한 CD9 대 CD150 발현 점 플롯을 사용하면 4개의 집단을 식별할 수 있습니다.
참고: MEP 및 MKp 셀은 CD150에 대해 모두 양성입니다. CD9에 대한 세 가지 식 수준을 정의할 수 있습니다(neg, dim 및 높음). MKp는 중간 형광 강도 수준에서 높은 수준의 CD9 및 MEP 익스프레스 CD9를 표현합니다. MEP 인구는 Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9딤 및 MKp 모집단이Lin에 해당합니다 - c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9밝은. CD150 양성 셀에 대한 CD9 높고 CD9 딤도집단 간의 차별은 CD150 음수 집단의 CD9 발현의 최대 수준에 따라 설정됩니다. 한 마우스는 일반적으로 5.3 ± 0.6 x 103 MKp 및 27.2 ± 2.4 x 103 MEP를 산출합니다.
Access restricted. Please log in or start a trial to view this content.
결과
MEP 및 MKp로 확인된 세포의 Phenotypic 분석은 유동 세포측정에 의해 수행되었다. 세포는 형광 컨쥬게이징 항체로 CD41a 및 CD42c, 메가카요시틱 및 혈소판 계보의 고전적인 마커로 표지되었다. 두 마커모두 MKp 집단의 세포에 의해 발현되었으며, 이들 마커는 아직 MEP 집단의 세포의 표면에서 검출되지않았다(도 4Ai,4Aii). 폴리플로이디는 메가카요사이클의 특징입니다. 선...
Access restricted. Please log in or start a trial to view this content.
토론
이 논문에 설명된 방법은 마우스 MEP 및 MKp의 추출 및 정제를 허용합니다. 프로토콜의 최적화에 있는 중요한 매개 변수는 대부분의 분자 및 세포 기지를 둔 분석과 호환될 세포의 충분한 수를 얻는 것이었습니다. 조혈 세포 추출을 위한 마우스 뼈 수집의 일반적인 사례는 일반적으로 각 마우스의 대퇴골과 티바이어스를 모두 수확하는 것으로 구성됩니다. 골반 뼈, 조혈 물질의 또 다른 소스, 따라서...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 경쟁 적인 재정적 이익을 선언하지 않습니다.
감사의 말
저자는 모니크 프룬드, 캐서린 지셀, 케티에게 기술 지원을 부탁드립니다. 이 작품은 ARMESA (협회 드 Recherche et Développement en Médecine et Santé Publique)에 의해 지원되었으며 그랜트 ANR-17-CE14-0001-01에서 Henri.de 라에 의해 지원되었습니다. 솔.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
참고문헌
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14(2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
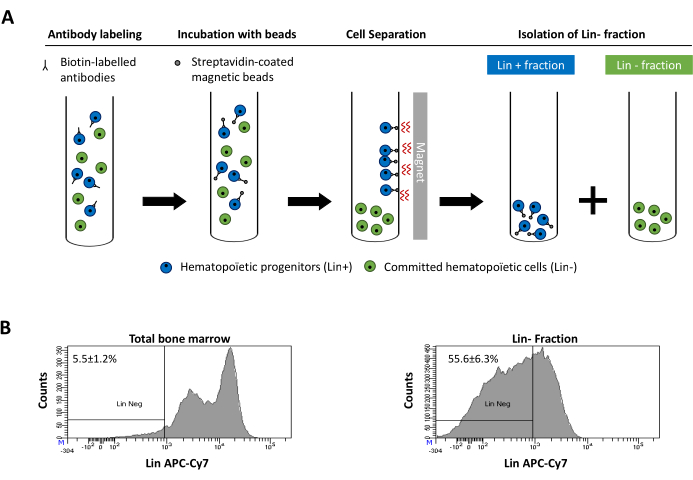
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
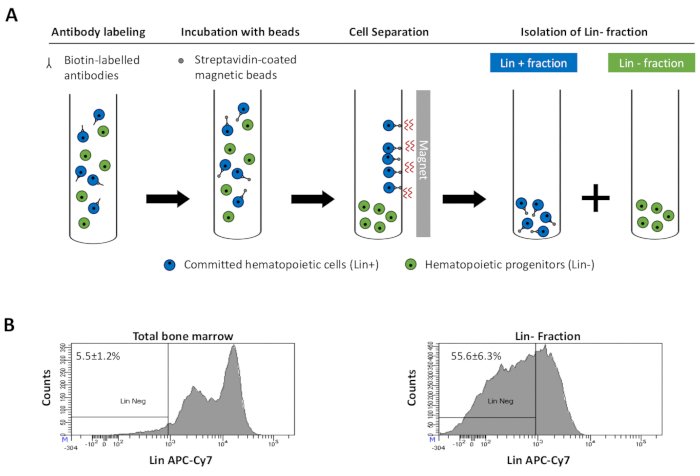
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유