A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד אבות מקרוציטים עכבר
In This Article
Erratum Notice
Summary
שיטה זו מתארת את הטיהור על ידי ציטומטריית זרימה של MEP ו- MKP מעצמות הירך של העכברים, השוקה ועצמות האגן.
Abstract
מגהקריוציטים של מח עצם הם תאים פוליפלואידיים גדולים המבטיחים ייצור של טסיות דם. הם נובעים מתאי גזע hematopoietic דרך megakaryopoiesis. השלבים הסופיים של תהליך זה הם מורכבים וקלאסיים מעורבים אבות Megakaryocyte-אריתרוציטים דו-פוטנטיים (MEP) ואת אבות המגקריוציטים (MKp) החד-פעמיים. אוכלוסיות אלה מקדימות את היווצרותם של מגה-קריוציטים בתום לב, וככאלה, בידודם ואפיונם עלולים לאפשר ניתוח חזק ובלתי משוחד של היווצרות מגה-קריוציטים. פרוטוקול זה מציג בפירוט את ההליך לאיסוף תאים hematopoietic ממח עצם העכבר, העשרה של אבות hematopoietic באמצעות דלדול מגנטי ולבסוף אסטרטגיית מיון תאים המניבים אוכלוסיות MEP ו- MKP מטוהרות מאוד. ראשית, תאי מח עצם נאספים מעצם הירך, השוקה, וגם סמל הכסל, עצם המכילה מספר גבוה של אבות hematopoietic. השימוש בעצמות פסגת הכסל מגדיל באופן דרסטי את מספר התא הכולל המתקבל לעכבר ובכך תורם לשימוש אתי יותר בבעלי חיים. דלדול שושלת מגנטית היה אופטימיזציה באמצעות חרוזים מגנטיים 450 ננומטר המאפשר מיון תאים יעיל מאוד על ידי ציטומטריית זרימה. לבסוף, הפרוטוקול מציג את אסטרטגיית התיוג וההתארגנות למיון שתי אוכלוסיות אבות מגהקריוציט מטוהרות מאוד: MEP (לין-Sca-1-c-Kit+CD16/32-CD150+CD9עמום) ו- MKP (לין- Sca-1-c-Kit+CD16/32-CD150+CD9בהיר ). טכניקה זו קלה ליישום ומספקת מספיק חומר תאי לביצוע i) אפיון מולקולרי לידע מעמיק יותר של זהותם וביולוגיה שלהם, ii) במבחנה הבחנה assays, שיספק הבנה טובה יותר של מנגנוני ההתבגרות של megakaryocytes, או iii) במודלים במבחנה של אינטראקציה עם microenvironment שלהם.
Introduction
טסיות דם מיוצרות על ידי מגה-קריוציטים. תאים פוליפלואידיים גדולים אלה ממוקמים במח העצם ובפי כל תאי הדם הם נגזרים מתאי גזע Hematopoietic (HSC)1. המסלול הקלאסי של ייצור של megakaryocytes במח העצם מקורו HSC ומערב את הדור של אבות שונים המגבילים בהדרגה את פוטנציאל הבידול שלהם2. האב הקדמון הראשון החתום על המחויבות לשושלת המקרוציטית הוא האבות Megakaryocyte-אריתרוציט (MEP), צאצא דו-פונטי המסוגל לייצר הן תאי אריתרויד והן מגהקריוציטים3,4,5. לאחר מכן מייצר ה- MEP צאצא /מבשר חד-קומתי (MKP) שיבדל למגקריוציט בוגר המסוגל לייצר טסיות דם. המנגנונים המעורבים בדור אבות אלה, כמו גם הבידול וההתבגרות שלהם למגקריוציטים הם מורכבים ומובנים חלקית בלבד. בנוסף, ההטרוגניות של אוכלוסיית MEP במונחים של פוטנציאל בידול ורמת המחויבות המהותית של תאים אלה עדיין לא ברורה. כדי לפענח תהליכים אלה, חיוני להשיג (או לקבל גישה) אוכלוסיות מטוהרות של MEP ו- MKp עבור ניתוחים מולקולריים ותאיים בודדים עדינים.
מספר מחקרים הדגימו שילובים מסוימים של סמני פני השטח של התא לזיהוי אבות המחויבים לשושלת המגקריוציטית בעכבר6,7,8. מתוך אלה הומצאה שיטה המאפשרת טיהור של MEP ו- MKP מעכברים. שיטה זו הייתה ממוטבת כדי להשיג תאים במספר ובאיכות נאותים עבור מספר רב של בדיקות. מתוך שיקולים אתיים, וכדי לצמצם את מספר בעלי החיים המעורבים בניסויים, עוררנו לקצור את מח העצם מעצם הירך ומהשוקה, וגם מפסגת הכסל. עצם זו מכילה תדירות גבוהה ומספר אבות hematopoietic והוא רוב הזמן פגום במהלך קצירת עצם ארוכה. מוצג כאן היא שיטה מפורטת עבור אוסף אמין של עצם זו.
הקריטריונים השניים של אופטימיזציה הוא לייצר אוכלוסיות תאים מטוהרות מאוד. מיון תאים מופעל פלואורסצנטי (FACS) היא שיטה של בחירה על מנת להשיג אוכלוסיות מטוהרות של תאים מעניינים. עם זאת, תשואות נמוכות מגיעות כאשר אוכלוסיית התאים של עניין היא נדירה מאוד. לכן יש צורך בהליכי העשרה. בפרוטוקול זה, הליך בחירה שלילי נבחר באמצעות חרוזים מגנטיים.
Access restricted. Please log in or start a trial to view this content.
Protocol
פרוטוקולים הנוגעים לבעלי חיים בוצעו בהתאם לוועדת CREMEAS לאתיקה של ניסויים בבעלי חיים של אוניברסיטת שטרסבורג (Comité Régional d'Ethique en Matière d'Expérimentation Animale Strasbourg). מספר היתר: E67-482-10).
1. אוסף עצמות עכבר
- להקריב את החיה בהתאם להנחיות המוסדיות.
הערה: הנתונים המוצגים בכתב יד זה התקבלו מעכברים C57Bl/6 בני 8 עד 12 שבועות. מספר התאים שהושגו, ותדירות האוכלוסיות המצוטטים עשויים להשתנות בהתאם לגיל ולמתח העכבר. - לרסס את הגוף עם 70% אתנול.
- באמצעות מספריים, לבצע 0.5-1 ס"מ פירוק של העור בניצב לעמוד השדרה ולקרוע את העור סביב כל הגוף. מוציאים את העור מהגוף התחתון ומסירים את העור.
- מניחים את החיה על משטח ההפצה, עם הפנים כלפי מטה. אתר את עצמות האגן על ידי הזזת האצבעות לאורך עמוד השדרה החשוף מלמעלה למטה. כדי לאתר את סמל הכסל, לזהות את הבליטה הקטנה באזור המותני ליד האחוריים (האזור הטרטרוסקופי של עצם האגן). איור 1A,B מציג ייצוג סכמטי של האנטומיה של העכבר.
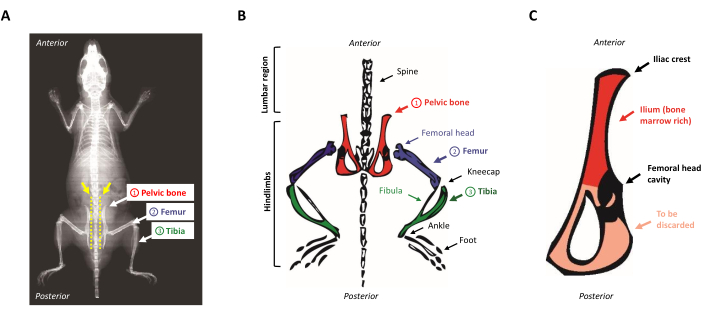
איור 1: אנטומיה של עכבר. (A)צילום רנטגן של עכבר המציג את העצמות האחוריות. שים לב למרווח בין עצם האגן לעמוד השדרה (חץ צהוב), שבו המספריים חייבים להיות מוכנסים כדי להפריד כראוי את האחוריים מגוף העכבר (קו מקווקו צהוב). (ב)ייצוג סכמטי של עצמות עשירות במח העצם של עניין. עצמות האגן מתוארות באדום, עצם הירך בסגול, ואת השוקה בירוק. (C)ייצוג סכמטי של עצם האגן של העכבר. האיליה מתאים לחלק העשיר במח העצם של עצם האגן ומודגש באדום. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- מניחים את המספריים במקביל לעמוד השדרה כנגד החוליות וקרובים לבליטת פסגת הכסל. המשך לחתוך את השרירים לאורך הצד של עמוד השדרה מעל עצם האגן על ידי הזזת המספריים לאורך החוליות כל הדרך למטה לזנב.
הערה: חלק ראשון זה של השרירים יכול להתבצע גם באמצעות להב אזמל. - הניחו את המספריים מקבילים לעמוד השדרה והמשיכו לחתוך בין החוליות לפסגת הכסל, כפי שמציינים הקו המקווקו הצהוב באיור 1A. הקפד להישאר קרוב לחוליות ככל האפשר. חותכים את השרירים הנותרים כדי לנתק את האיבר מהגוף.
הערה: צריכה להיות התנגדות מועטה עד לא קיימת. - חזור על הפעולה בצד השני כדי לנתק את האיבר השני.
- מעבירים את הגפיים על משטח נקי ומשליכים את שאר הגוף בהתאם להנחיות המוסדיות.
- לחשוף את עצמות האגן, הירך, ו tibial על ידי הסרת הרקמה שמסביב ככל האפשר עם המלקחיים ואת האזמלים.
- המשך לפרוק בזהירות את ראש הירך מעצם האגן על ידי החזקת הקצה הדיסטלי של עצם הירך עם המלקחיים תוך חיתוך עדין של השרירים סביב הניסוח עם האזמלים. נענע את העצמות כדי להקל על הנקע.
- לגרד את השריר הנותר מעצם האגן לחתוך עם אזמל באמצע החלל כי החזיק את ראש הירך. האיליום נשמר מכיוון שהוא עשיר באבות המטופויים, בעוד הצד המשולש הדק מאוד של העצם מושלך, כפי שמוצג באיור 1C.
- הסר את שאריות הרקמות סביב האיליום עם האזמל ומניחים את העצם המנוקה PBS סטרילי בתוספת 2% סרום עגל שזה עתה נולד (PBS-2%NBCS).
- בעזרת מספריים, חותכים את הרגל מהרגל בקרסול.
- החזק את החלק התחתון של השוקה עם המלקחיים ולגרד את השריר לכיוון הברך. להשליך את השוביות לחתוך על פני הרמה tibial עם האזמל. מניחים את השוקה ב- PBS-2% NBCS סטרילי.
- הסר את שאריות הרקמות סביב עצם הירך עם אזמלים.
- החזק את הצד העליון של עצם הירך עם מלקחיים; מניחים את להב האזמל בבסיס פיקת הברך. החל כוח לכיוון פיקת הברך במקביל עצם הירך עד ניתוק פיקת הברך. מניחים את עצם הירך ב-PBS-2% סטריליים NBCS. הסרת פיקת הברך מספקת גישה נקייה להכנסת המחט לשטיפה של מח העצם.
2. דלדול מגנטי של תאים חיוביים שושלת
- בארון זרימה למינאר, להעביר את העצמות בצלחת פטרי סטרילית מלא PBS-2% NBCS סטרילי.
- עם אזמל חתוך את ראש עצם הירך.
- מלא מזרק 1 מ"ל עם PBS-2% NBCS סטרילי ולחבר מחט 21 G לשקע.
- מלא צינור פוליפרופילן 5 מ"ל עם 2 מ"ל של PBS-2% NBCS סטרילי.
- החזק את עצם הירך עם המלקחיים; הכנס בעדינות את המחט לחריץ שנותר לאחר הסרת פיקת הברך. החל סיבוב על המחט בעת החדרה כדי למנוע חיבור של המחט. ודא כי המחט מוכנסת לחלוטין לתוך העצם עד שיפוע.
- העבר את העצם עם המחט לתוך הצינור המכיל 2 מ"ל של PBS-2%NBCS. לוותר ולשאוף PBS-2%NBCS מהמזרק עד העצם ברורה.
- הסר את המחט מ עצם הירך ולהכניס אותו לחור בצד הנגדי שבו ראש עצם הירך היה. מחלקים ושואפים שוב את החיץ ומשליכים את העצם.
- עבור סמל הכסל והשוקה, להחזיק את העצם עם מלקחיים; הכנס בעדינות את המחט לצד הפתוח. החל סיבוב על המחט בעת החדרה כדי למנוע חיבור של המחט. ודא כי המחט מוכנסת לחלוטין לתוך העצם עד שיפוע. העבר את העצם עם המחט לתוך הצינור המכיל 2 מ"ל של PBS-2%NBCS. לוותר ולשאוף PBS-2%NBCS מהמזרק עד העצם ברורה. זרוק את העצמות.
הערה: עצמות של עד שלושה עכברים ניתן לשטוף לתוך אותו צינור. תאחדו את ההשעיות של התאים. - להעביר את השעיית התא המאגד דרך מכסה מסננת תא 40 מיקרומטר להציב על צינור פוליסטירן סטרילי 5 מ"ל.
- המשך לספור את התאים.
הערה: ניתן לבצע ספירת תאים עם כל המוציטומטר, באמצעות Trypan Blue להערכת כדאיות, או עם כל מונה תאים אוטומטי. עכבר אחד מניב בדרך כלל 105 ± 7 x 106 תאים. - קח הצידה 100 μL של השעיית התא כמו מח עצם הכולל, להוסיף 500 μL של PBS-2%NBCS ולשמור אותו על קרח עבור הליך הכתם.
- גלם את המתלים המסוננים על ידי צנטריפוגה ב 400 x g במשך 5 דקות ב 4 °C (70 °F) ולהשליך את supernatant.
הערה: תאי דם אדומים יכולים להיות lysed על ידי שימוש חוזר את הכדור בתמיסת ליזה מוכן טרי (1/10th ב- dH2O). דגירה במשך 5 דקות עד המתלה הופך ברור ואדום בוהק ולהוסיף 10 כרכים של PBS סטרילי. המשך לשטוף את התאים PBS-2%NBCS על ידי צנטריפוגה ב 400 x g במשך 5 דקות ב 4 °C (70 °F). היזהר בעת הסרת supernatant כמו גלולה התא הוא רופף מאוד. בצע שטיפה שנייה עם PBS-2%NBCS על ידי צנטריפוגה ב 400 x g במשך 5 דקות ב 4 °C (70 °F) ולהמשיך לשלב 2.13. - Resuspend גלולה התא בקוקטייל נוגדנים ראשוני מוכן טרי עם יחס של 100 μL לכל 1 x 107 תאים. דגירה על קרח במשך 30-45 דקות.
| נוגדן | דילול |
| Gr-1-ביוטין | 1:500 |
| B220-ביוטין | 1:500 |
| מק-1-ביוטין | 1:500 |
| CD3-ביוטין | 1:500 |
| CD4-ביוטין | 1:500 |
| CD5-ביוטין | 1:500 |
| CD8-ביוטין | 1:500 |
| TER119-ביוטין | 1:1000 |
| CD127-ביוטין | 1:500 |
טבלה 1.
- קח הצידה 10 μL של השעיית התא לתוך צינור פוליסטירן סטרילי 5 מ"ל שכותרתו שבר לין-Pos. הוסף 90 μL של PBS-2%NBCS ולשמור אותו על קרח עבור הליך הכתמה.
- המשך לשטוף את התאים פעמיים עם PBS-2%NBCS סטרילי על ידי צנטריפוגה ב 400 x גרם במשך 5 דקות ב 4 °C (70 °F). הקפד לעשות את הכביסה האחרונה בצינור פוליפרופילן סטרילי 5 מ"ל.
- במהלך שלבי הכביסה, הכינו את החרוזים לדלדול המגנטי.
- resuspend החרוזים בקסנה על ידי מערבולת ביסודיות במשך 30 s.
- העבר נפח של חרוזים המתאימים לשני חרוזים לכל תא יעד לתוך צינור פוליפרופילן 5 מ"ל.
- לשטוף את החרוזים פעמיים עם PBS-2%NBCS על ידי הצבת הצינור על המגנט והסרת חיץ הכביסה באמצעות פיפטה פסטר זכוכית סטרילית.
- resuspend החרוזים ב 500 μL של PBS-2NBCS סטרילי%.
- Resuspend הכדור של תאים מסומנים ב 250 μL של חרוזים ומערבבים בעדינות במשך 5 דקות על קרח. הוסיפו 2 מ"ל של PBS-2% סטריליים של NBCS וערבבו בעדינות. אל תנער את הצינור.
- מניחים את הצינור על המגנט למשך 2 דקות.
- ממשיכים לאסוף את השבר הלא מגנטי עם פיפטה פסטר זכוכית סטרילית ולהוסיף אותו על 250 μL הנותרים של חרוזים מגנטיים. לאטום את הצינור עם parafilm.
- מניחים את הצינור על רולר צינור במשך 20 דקות ב 4 °C (70 °F).
- הוסיפו 2 מ"ל של PBS-2% סטריליים של NBCS וערבבו בעדינות. אל תנער את הצינור.
- מניחים את הצינור במגנט למשך 2 דקות.
- המשך לאסוף את השבר הלא מגנטי לתוך צינור פוליפרופילן סטרילי 5 מ"ל שכותרתו לין-שלילי שבר עם פיפטת פסטר זכוכית סטרילית.
- גלולה את התאים על ידי צנטריפוגה ב 400 x גרם במשך 5 דקות ב 4 °C (70 °F) ולהסיר את supernatant.
- resuspend התאים הלא מגנטיים ב 500 μL של PBS-2% NBCS סטרילי.
- המשך לספור את התאים.
הערה: עכבר אחד מניב בדרך כלל 3.9 ± 1.1 x 106 תאים. כתמי שושלת אופייניים מלפני ופוסט-דלדול מוצגים באיור 2B.
3. מיון תאים של אבות megakaryocyte על ידי cytometry זרימה
- קח את הצינורות שכותרתם מח עצם כולל, שבר לין-פו, ושבר לין שלילי.
- המשך לפצל את התוכן של הצינור מח עצם סה"כ באופן שווה לתוך שישה צינורות פוליסטירן סטרילי 5 מ"ל. תייג את הצינורות עם המספרים 1-6.
- המשך לתייג את שבר לין-פו של הצינור עם המספר 7.
- המשך לפצל את התוכן של שבר לין-שלילי הצינור כדלקמן.
- העבר 50 μL לתוך צינור פוליסטירן סטרילי 5 מ"ל המכיל 250 μL של PBS-2%NBCS סטרילי. לאחר מכן, לפצל את התוכן שלה באופן שווה לתוך 3 צינורות פוליסטירן 5 מ"ל סטרילי. תייג את הצינורות האלה עם המספרים 8-10.
- 450 μL הנותרים של השעיית תא לין-שלילי שבר מתאים לצינור עם המספר 11.
- הוסף את הנוגדנים לצינורות כמתואר בטבלה 2.
| צינור | תווית | קוקטייל נוגדנים |
| סה"כ מח עצם | ||
| 1 | פקד לא נגוע | |
| 2 | שליטה מוכתמת בודדת | CD45-FITC (1/200) |
| 3 | שליטה מוכתמת בודדת | CD45-PE (1/200) |
| 4 | שליטה מוכתמת בודדת | TER119-נגמ"ש (1/200) |
| 5 | שליטה מוכתמת בודדת | CD45-PECy7 (1/200) |
| 6 | שליטה מוכתמת בודדת | CD45-APC-Cy7 ביוטין (1/200) |
| שבר לין-קופה | ||
| 7 | שליטה מוכתמת בודדת | שליטה מוכתמת אחת. סטרפטבידין-נגמ"ש-סיי7 (1/500) |
| שבר לין-שלילי | ||
| 8 | בקרת FITC FMO | c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + סטרפטבידין-APC-Cy7 (1/500) |
| 9 | בקרת FMO PE | CD9-FITC (1/200) + c-kit-APC (1/200) + CD150-PECy7 (1/200) + סטרפטאבידין-APC-Cy7 (1/500) |
| 10 | בקרת FMO PECy7 | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + סטרפטבידין-APC-Cy7 (1/500) |
| 11 | שפופרת חיובית למיון | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + סטרפטבידין-APC-Cy7 (1/500) |
טבלה 2.
- דגירה על קרח במשך 30-45 דקות בחושך.
- לשטוף את התאים עם PBS-2%NBCS סטרילי על ידי צנטריפוגה ב 400 x גרם במשך 5 דקות ב 4 °C (70 °F).
- resuspend כדורי התא כדלקמן.
- עבור הצינורות 1 עד 10, resuspend הכדור ב 300 μL של PBS-2%NBCS סטרילי בתוספת 7AAD (2.5 מיקרוגרם / מ"ל סופי) (PBS-7AAD).
אזהרה: 7AAD הוא intercalant DNA ולכן יש לטפל עם PPE מתאים (כפפות). - עבור צינור 11, resuspend הכדור ב PBS-7AAD סטרילי בריכוז מרבי של 5 x 106 תאים למ"ל ונפח מינימלי של 1 מ"ל.
- עבור הצינורות 1 עד 10, resuspend הכדור ב 300 μL של PBS-2%NBCS סטרילי בתוספת 7AAD (2.5 מיקרוגרם / מ"ל סופי) (PBS-7AAD).
- הכן שני צינורות איסוף פוליפרופילן שכותרתם MEP ו- MKP המכילים 2 מ"ל של PBS-2%NBCS.
הערה: לחלופין, ניתן לאסוף תאים למאגר תמזה בינוני או תאי של תרבית בהתאם ליישום הבא עבור התאים ממוינים. השימוש בצינורות פוליסטירן אינו מומלץ בגלל הפרעה אפשרית עם טיפות טעונות המכילות את התאים של עניין. - שמור את כל הצינורות על קרח בחושך.
- המשך לגדר סדרן התאים.
- השתמש בצינורות 1-7 כדי להגדיר מתח ופיצוי, צינורות 7-10 כדי לקבוע את שערי המיון עבור אוכלוסיות התאים של עניין צינור 11 למיון תאים.
- הצעדים הראשונים של אסטרטגיית הג'טינג נועדו להוציא מהניתוח מכפילים ותאים מתים, כמתואר באיור 3. זהה תאים יחידים קיימא ולהציג SSC-לעומת Lin-APC-Cy7 נקודה plot כדי לאשר את היעילות של דלדול שושלת היוחז. מתוך תאי Lin- שער מוגדר לבחור תאים חיוביים עבור c-kit ושלילי או עמום עבור Sca-1 ו- CD16/32. התוויית נקודות של ביטוי CD9 לעומת CD150 עבור התאים שנבחרו מאפשרת זיהוי של ארבע אוכלוסיות.
הערה: תאי MEP ו- MKp שניהם חיוביים עבור CD150. ניתן להגדיר שלוש רמות ביטוי עבור CD9 (שלילה, עמום וגבוה). MKp מבטא רמה גבוהה של CD9 ו- MEP express CD9 ברמת עוצמת פלואורסצנטיות ביניים. אוכלוסיית MEP מתאימה ללין- c-Kit+ Sca-1-CD16/32-/עמום CD150+ CD9עמום ואוכלוסיית MKP תואמת את לין- c-Kit+ Sca-1-CD16/32-/עמום CD150+ CD9בהיר. האפליה בין אוכלוסיות עמומות CD9 ו- CD9 עבור התאים החיוביים CD150 מוגדרת בהתבסס על הרמה המרבית של ביטוי CD9 באוכלוסייה השלילית CD150. עכבר אחד מניב בדרך כלל 5.3 ± 0.6 x 103 MKp ו- 27.2 ± 2.4 x 103 MEP.
Access restricted. Please log in or start a trial to view this content.
תוצאות
ניתוח פנוטיפי של התאים שזוהו כ- MEP ו- MKp בוצעו על ידי ציטומטריית זרימה. תאים סומנו בנוגדנים מצומדים פלואורסצנטיים ל- CD41a ו- CD42c, סמנים קלאסיים של שושלות המגקריוציטיות והטסיות. שני הסמנים התבטאו בתאי אוכלוסיית הח"כים בעוד סמנים אלה עדיין לא זוהו על פני השטח של תאי אוכלוסיית MEP (איור 4A...
Access restricted. Please log in or start a trial to view this content.
Discussion
השיטה המתוארת במאמר זה מאפשרת מיצוי וטיהור של עכבר MEP ו- MKp. פרמטר חשוב באופטימיזציה של הפרוטוקול היה להשיג מספר מספיק של תאים שיהיו תואמים לרוב ההסתה המולקולרית והתאית. הנוהג הכללי של איסוף עצמות עכבר להפקת תאים hematopoietic בדרך כלל מורכב קצירת הן עצם הירך והן השוקה של כל עכבר. עצם האגן, מקור נו?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים שאין אינטרסים כלכליים מתחרים.
Acknowledgements
המחברים מבקשים להודות למוניק פרוינד, קתרין זיסל וקאטי על הסיוע הטכני. עבודה זו נתמכה על ידי ARMESA (Association de Recherche et Développement en Médecine et Santé Publique), ועל ידי גרנט ANR-17-CE14-0001-01 כדי Henri.de לה. סאל.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
References
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14(2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
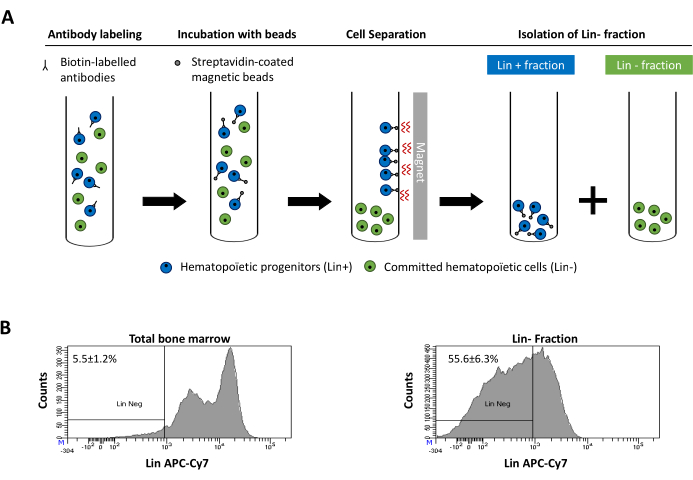
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
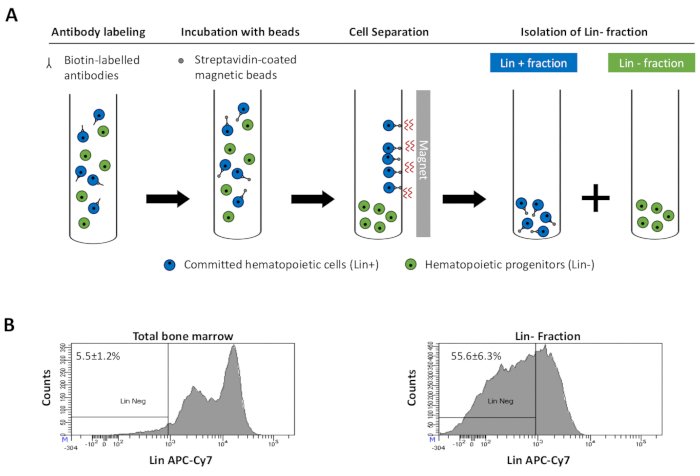
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved