Method Article
عزل الخلايا الليفية الأولية المرتبطة بالسرطان من نموذج مورين السينجيني لسرطان الثدي لدراسة الجسيمات النانوية المستهدفة
* These authors contributed equally
In This Article
Summary
تهدف هذه الورقة إلى توفير بروتوكول لعزل وثقافة الخلايا الليفية الأولية المرتبطة بالسرطان من نموذج مورين سينجيني لسرطان الثدي ثلاثي السلبية وتطبيقها للدراسة قبل السريرية للجسيمات النانوية الجديدة المصممة لاستهداف البيئة الدقيقة للورم.
Abstract
الخلايا الليفية المرتبطة بالسرطان (CAFs) هي الجهات الفاعلة الرئيسية في سياق البيئة الدقيقة للورم. على الرغم من انخفاض عددها بالمقارنة مع الخلايا السرطانية ، فإن CAFs تنظم تطور الورم وتوفر الحماية من مناعة مضادة للورم. تهدف استراتيجيات مضادات السرطان الناشئة إلى إعادة تشكيل البيئة الدقيقة للورم من خلال استئصال CAFs المؤيدة للورم أو إعادة برمجة وظائف CAFs وحالة تنشيطها. ومن النهج الواعدة تطوير عوامل توصيل نانوية الحجم قادرة على استهداف ال CAFs، مما يسمح بتوصيل الأدوية والجزيئات النشطة على وجه التحديد. وفي هذا السياق، قد يوفر النموذج الخلوي لصناديق الخلايا المكيالة أداة مفيدة للفحص المختبري والتحقيق الأولي في هذه الأشكال النانوية.
تصف هذه الدراسة عزلة وثقافة CAFs الأولية من نموذج مورين 4T1 syngeneic لسرطان الثدي الثلاثي السلبي. استخدمت الخرز المغناطيسي في عملية فصل من خطوتين لاستخراج CAFs من الأورام المفككة. تم إجراء التحكم في الفينوتيبينج المناعي باستخدام قياس التدفق الخلوي بعد كل مقطع للتحقق من عائد العملية. يمكن استخدام CAFs المعزولة لدراسة القدرة على استهداف الأشكال النانوية المختلفة المصممة لمعالجة البيئة الدقيقة للورم. تم استخدام الجسيمات النانوية H-ferritin المسماة بالفلورسنت كجسيمات نانوية مرشحة لإعداد الطريقة. تم تحليل الجسيمات النانوية ، إما عارية أو مترافقة مع ليغاند الاستهداف ، لربطها ب CAFs. تشير النتائج إلى أن استخراج الجسم الحي السابق من CAFs الثدي قد يكون نظاما مفيدا لاختبار والتحقق من صحة الجسيمات النانوية لاستهداف محدد من CAFs tumorigenic.
Introduction
خلال العقود الماضية ، أصبح من الواضح أن قتل الخلايا السرطانية عادة ما لا يكفي للقضاء على الأورام الخبيثة ، حيث أن البيئة الدقيقة للورم قد تدفع إلى انتكاس الورم وتحفز المقاومة العلاجية1،2. ثم ظهر نموذج جديد: استهداف الورم ستروما لحرمان الورم من العوامل الداعمة وبالتالي، تعزيز فعالية العلاج الكيميائي3،4،5. على وجه الخصوص، الخلايا الليفية المرتبطة بالسرطان (CAFs) هي هدف سترومال مثيرة للاهتمام في العديد من الأورام الصلبة6،7. CAFs هي مجموعة غير متجانسة جدا من الخلايا التي تتفاعل مع الخلايا السرطانية وخلايا الجهاز المناعي من خلال إفراز عوامل النمو والسيتوكينات والكيموكينات. بناء وإعادة تشكيل مصفوفة خارج الخلية؛ وتمكين تشكيل الانبثاث8،9،10،11،12. اعتمادا على نوع الورم، تظهر CAFs وظائف مؤيدة للورم، في حين أن الأنواع الفرعية الأخرى من CAFs يبدو أن لديها وظائف قمع الورم13،14. لتوضيح هذا الانقسام بشكل أفضل ، من المهم توصيف شامل ل CAFs من الأورام الأولية والمنقشورية.
في هذا السياق، ركز مجال أبحاث ناشئ على تطوير عوامل نانوية مصممة لاستهداف و/أو تدمير CAFs من خلال تقديم جزيئات وأدوية نشطة قادرة على إعادة تشكيل البيئة الدقيقة للورم15و16و17و18. وقد تم تصميم عدة أنواع من الجسيمات النانوية لتحقيق الاستئصال CAF عن طريق الأدوية السامة للخلايا, للحث على العلاج الديناميكي الضوئي CAF المستهدفة, أو لإعادة برمجة CAFs عن طريق إعادتها إلى حالة هادئة أو حث TNF ذات الصلة المبرمج الناجم عن تعبير ليغاند, الذي يحفز موت الخلايا السرطانية المجاورة16,19. وعلاوة على ذلك، فإن قدرة العديد من الجسيمات النانوية على استهداف علامات بيولوجية محددة بنشاط تثير الأمل في اختيار مجموعات فرعية من ال CAF لاستهدافها. على الرغم من أن خصوصية مطلقة ل CAF لا يزال موضع تساؤل, بروتين تنشيط الخلايا الليفية (FAP) هي واحدة من الأهداف الواعدة من ستروما الموالية tumorigenic ويتم استغلالها لتوجيه تسليم المخدرات النانوية, مما يمهد الطريق لتطوير العلاج النانوي CAF استهداف20,21,22.
تصف هذه الورقة عزل CAFs الأولية من نموذج سينجيني لسرطان الثدي مورين وتقارير استخدامها في دراسة القدرة على استهداف الجسيمات النانوية المهندسة للتعرف على علامة CAF، FAP. وتستخدم الكواجس النانوية فيريتين كأنظمة نانوية مرشحة لإعداد هذه الطريقة، كما قد تتشكل خصوصية التسليم من قبل التعرض السطحي لاستهداف moieties23،24. وعلاوة على ذلك، ثبت بنجاح فيريتينس أن تكون ممتازة مكوكات متوافقة بيولوجيا لتطبيقات مضادة للورم، مما أدى إلى تراكم سريع للحمولة في كتلة الورم25،26،27. حتى الآن، وقد شاركت الدراسات قبل السريرية من أنظمة النانو CAF استهداف في المختبر اختبار على خطوط الخلايا الليفية حفز في الثقافة مع تحويل عامل النمو بيتا للحث على تنشيط الخلية والتعبير عن بعض الميزات المناعية من CAFs28،29. عادة ما يتم تطبيق هذه الطريقة على خطوط الخلايا الخالدة (مثل NIH3T3، LX-2) وسريعة وبسيطة جدا، مما يؤدي إلى تنشيط الخلايا في غضون ساعات أو أيام قليلة. وهناك قيود على أنه على الرغم من التحفيز في المختبر يحفز التعبير عن بعض الجينات المنسوبة إلى الخلايا الميوفيبروبلاست المنشطة، فإنه لا يمكن تلخيص تماما جميع السمات البيولوجية من CAFs الحقيقي، وخاصة عدم التجانس في الجسم الحي.
استراتيجية أخرى تنطوي على استخراج CAFs الأولية من عينات ورم الإنسان أو الماوس30،31. وهذا يضمن أن يحدث تنشيط CAF في سياق فسيولوجي، وأنه يتم الحفاظ على عدم التجانس من الخلايا الفرعية CAF. ووفقا لهدف البحث، يمكن أن تستمد الصناديق الاستئمانية المعتمدة من مصادر مختلفة، مما يتيح إمكانية دراسة الحالة الأكثر موثوقية. البروتوكول المبلغ عنه هنا سيكون ذا قيمة للعلماء الذين يسعون إلى إجراء تقييم أولي لوظائف الجسيمات النانوية الجديدة المصممة لاستهداف CAFs من نموذج سرطان الثدي مورين. CAFs معزولة ستكون مفيدة لفحص تلك الجسيمات النانوية التي تعد بما فيه الكفاية للمضي قدما في تقييم الجسم الحي في النماذج الحيوانية للسرطان. وسيكون ذلك ذا صلة خلال الخطوات الأولى لإنتاج الجسيمات النانوية، مما يدفع علماء التكنولوجيا النانوية نحو تحسين تصميم الجسيمات النانوية من خلال النظر بشكل رئيسي في استراتيجية شل حركة الليغند لتحقيق خصائص الاستهداف المثلى.
Protocol
1. إنشاء نموذج 4T1 syngeneic لسرطان الثدي
ملاحظة: يصف البروتوكول الحالي عزل CAFs الأساسي من ورم الثدي 4T1 الماوس. وقد وافقت وزارة الصحة الإيطالية على الدراسة الحيوانية الموصوفة هنا (رقم 110/2018-PR).
- زراعة الخلايا السرطانية وزرعها
- تذوب 1 × 106 4T1-luc الخلايا في قارورة T75 مع 10 مل من معهد روزويل بارك التذكاري (RPMI) 1640 المتوسطة تكملها 10٪ مصل البقر الجنيني (FBS)، 1٪ البنسلين / ستريبتومايسين (P /S)، و 1٪ L-الجلوتامين. إضافة عامل إزالة الميكوبلازما (1:100) في وسط الثقافة.
ملاحظة: 4T1-لوك الخلايا التعبير عن لوسيفيراز بشكل ثابت ويمكن تصورها من قبل الإضاءة الحيوية (BLI) على التحفيز السليم مع D-لوسيفيرين. وهذا يسمح في رصد الجسم الحي من حيوية وانتشار الخلايا السرطانية عند زرعها في الفئران (الشكل 1). - الحفاظ على الخلايا عند 37 درجة مئوية و 5٪ CO2 في جو رطب حتى التقاء ~ 80٪، عن طريق تغيير الوسط كل يومين.
ملاحظة: مواصلة العلاج مع عامل إزالة الميكوبلازما لمدة أسبوع واحد (~ 2/3 الممرات) قبل الحقن في الفئران لضمان أن الخلايا المحقونة خالية من الميكوبلازما. - في يوم الإجراء، فصل الخلايا باستخدام 1 مل من محلول حمض تريبسين-إيثيلينديامينتتراستيك (EDTA) (تريبسين 1:250) لمدة 5 دقائق عند 37 درجة مئوية. إيقاف نشاط التريبسين بإضافة وسيط الثقافة، عد الخلايا مع الأزرق تريبان (1:1)، وحساب عدد الخلايا / مل.
- ماصة حجم المقابلة ل1 × 106 خلايا والطرد المركزي لمدة 5 دقائق في 400 × غرام. صب قبالة supernatant، وإعادة إنفاق بيليه في 1 مل من RPMI 1640 قاعدة المتوسطة. إبقاء الخلايا على الجليد حتى جاهزة للحقن.
ملاحظة: لكل ماوس، هناك حاجة إلى 1 × 105 خلايا؛ ومع ذلك، حساب دائما لأكثر من 2 الفئران (المقابلة ل2 × 105 خلايا) لتخفيف تحميل حقنة. - قبل يوم واحد من العملية ، حلق فرو 8 فئران BALB / c (أنثى ، عمرها سبعة أسابيع) لفضح منطقة الغدد الثديية البطنية على الجانب الأيمن. استخدام ماكينة حلاقة كهربائية وتطبيق طبقة رقيقة من كريم إزالة الشعر لمدة 4 دقائق. ثم، يغسل كريم بالماء وقطعة من الورق.
- حث التخدير عن طريق استنشاق مستمر من غاز isoflurane 2٪ ل ~ 5 دقيقة، وإجراء حقن تحت الجلد في منطقة الغدد الثديية البطن مع حقنة 27 G tuberculin. تحويل الإبرة صعودا لدخول الجلد تحت الجلد; ثم، عقد الجلد صعودا وحقن ببطء 100 ميكرولتر من تعليق الخلية (1 × 105 خلايا). بدوره قليلا الإبرة حولها قبل التراجع ببطء الحقنة.
ملاحظة: تذكر إحضار تعليق الخلية إلى درجة حرارة الغرفة 15 دقيقة قبل الحقن.
- تذوب 1 × 106 4T1-luc الخلايا في قارورة T75 مع 10 مل من معهد روزويل بارك التذكاري (RPMI) 1640 المتوسطة تكملها 10٪ مصل البقر الجنيني (FBS)، 1٪ البنسلين / ستريبتومايسين (P /S)، و 1٪ L-الجلوتامين. إضافة عامل إزالة الميكوبلازما (1:100) في وسط الثقافة.
- نمو الورم وتشريحه
- في 5 أيام بعد حقن الخلية، وحقن 150 ملغم/كغ D-لوسيفيرين intraperitoneally (100 ميكرولتر) 5 دقائق قبل التصوير. التقط صور BLI باستخدام نظام تصوير في الجسم الحي يعمل على ضبط التعرض 10 s، و binning متوسط، و f/stop عند 4. حدد المنطقة الإنارة للورم على أنها منطقة الاهتمام (ROI)، وحدد إجمالي الإشارة في عائدالاستثمار (الفوتون/الثانية/م2) باستخدام برنامج التصوير.
- كرر إجراء التصوير (1.2.1) كل 5 أيام من الحقن لمراقبة نمو الورم من حيث زيادة في BLI.
- لتحديد حجم الورم، أمسك الماوس وفضح بطنه. استخدم الفرجار لقياس طول الورم (L) والعرض (W) مرة واحدة في الأسبوع. حساب حجم الورم (V) باستخدام المعادلة 1.
[V = (Lx W 2)/2] (1) - في 20 يوما بعد حقن الخلية، التضحية بالحيوانات عن طريق خلع عنق الرحم، وتفكيك الأورام من الجلد مع مقص، وجمعها في محلول تخزين الأنسجة (انظر جدول المواد).
ملاحظة: يمكن استخدام عينات الورم فورا للتفكك إلى خلايا مفردة (القسم 2) أو تخزينها عند درجة حرارة 4 درجات مئوية لمدة تصل إلى 48 ساعة.
2. فصام الورم إلى خلايا واحدة
ملاحظة: للخطوات التالية، استخدم الكواشف المعقمة والأدوات القابلة للتصرف في غطاء تدفق صفح. العمل مع 4 أورام في وقت واحد.
- ضع عينة الورم في طبق بيتري، وأزل بعناية أي جزء من الجلد والدهون والمناطق النخرية بمساعدة الملاقط والمشرط. ثم، والحد من الورم إلى قطع صغيرة من 1-2 ملم تقريبا ونقلها إلى أنبوب(الشكل 2A).
ملاحظة: الأورام 4T1 تصبح نخرية للغاية في حين تنمو، مع ميل إلى تقرح. من المهم إزالة المناطق النخرية بعناية لتجنب أي تداخل للحطام مع الخطوات التالية. - إعداد مزيج الهضم لانفصام الورم: مزيج 2.35 مل من RPMI 1640 المتوسطة، 100 ميكرولتر من الإنزيم D، 50 ميكرولتر من إنزيم R، و 12.5 ميكرولتر من الإنزيم A. نقع شظايا الورم في الحل وإغلاق الأنبوب بإحكام.
ملاحظة: الأحجام المشار إليها من مزيج الهضم صالحة للأورام تصل إلى 1 غرام ويمكن تعديلها للأورام أكبر وفقا لوزنها. أورام 4T1 نمت لمدة 20 يوما وعادة ما تكون في نطاق 0.5-0.8 غرام. - بدوره أنبوب رأسا على عقب، والتحقق من أن جميع قطع الورم تقف في الجزء السفلي من الأنبوب نحو الغطاء. قم بتوصيل الأنبوب بجهاز فك فصام ميكانيكي في المسكن المناسب، واجري برنامجا محددا للتفكك مصمم للأورام الصعبة (انظر تعليمات الشركة المصنعة).
ملاحظة: قد تكون هناك حاجة أنابيب خاصة لتناسب في المفكك. تحمل أنابيب C دوارا داخل الغطاء لتعزيز التفكك الميكانيكي للأنسجة. - فصل الأنبوب، والحفاظ عليه رأسا على عقب، واحتضان العينة في 37 درجة مئوية لمدة 40 دقيقة مع اهتزاز لطيف. ثم قم بتوصيل الأنبوب بالانشقاق في السكن المناسب، واجري برنامج الانفصال المحدد التالي المصمم للأورام الصعبة مرتين. تأكد من عدم وجود قطع كبيرة من الأنسجة في نهاية الإجراء (الشكل 2B).
ملاحظة: للانشقاق الورم، يمكن استخدام الكوكتيلات إنزيم أخرى لتحلل مصفوفة خارج الخلية. ومع ذلك ، في هذا البروتوكول ، تم استخدام مجموعة تفكك الورم المتاحة تجاريا والتي تحتوي على مزيج إنزيم محسن (الإنزيمات D و R و A) ومفكك شبه آلي ينقسم ميكانيكيا عن الأنسجة. وقد ضمن هذا المزيج تدهورا سليما للمصفوفة خارج الخلية إلى جانب الحفاظ على سلامة الخلية وأسطح الخلايا. - تصفية العينة من خلال مصفاة خلية 40 ميكرومتر في أنبوب 50 مل، وغسل مرشح مع 10 مل من RPMI 1640 المتوسطة، والطرد المركزي أنبوب لمدة 7 دقائق في 300 × غرام. إذا كانت بيليه الخلية تظهر حمراء، lyse erythrocytes بإضافة 1 مل من الأمونيوم-كلوريد-البوتاسيوم (ACK) lysing العازلة لمدة 5 دقائق في درجة حرارة الغرفة، وغسل مع 10 مل من RPMI 1640، ونقل تعليق الخلية في أنبوب 15 مل، والطرد المركزي مرة أخرى.
- Resuspend بيليه في 1 مل من العازلة PBE تتألف من المالحة العازلة الفوسفات (PBS)، 0.5٪ ألبوم مصل البقر (BSA)، و 2 M M EDTA، والعد الخلايا مع تريبان الأزرق (1:1). في حالة كتل الخلية، قم بتصفية تعليق الخلية من خلال مصفاة خلايا 70 ميكرومتر، كانت غارقة سابقا في برنامج تلفزيوني.
ملاحظة: خاصة عندما تكون الأورام كبيرة، من المهم التحقق من عدد الخلايا وفي نهاية المطاف لتقسيم كل عينة ورم في أنابيب مختلفة مع ما لا يزيد عن 107 خلايا في كل أنبوب قبل الشروع في الخطوة 2.7. - إعداد العازلة إزالة الخلية الميتة ملزمة عن طريق تمييع 20x ملزمة المخزن المؤقت الأسهم الحل (انظر جدول المواد)مع الماء المعقم المقطر المزدوج. غسل الخلايا مع 5 مل من 1× العازلة ملزمة (الشكل 2C).
ملاحظة: الاحتفاظ المخزن المؤقت عند 4 درجة مئوية. - الطرد المركزي لمدة 7 دقائق في 300 × ز، وإعادة إنفاق بيليه الخلية مع 0.1 مل من الميكروبات إزالة الخلايا الميتة (انظر جدول المواد). تخلط جيدا واحتضان في درجة حرارة الغرفة لمدة 15 دقيقة.
- أثناء الحضانة مع الخرز، وإعداد موقف المغناطيسي تحت غطاء محرك السيارة وتعليق أعمدة فصل المغناطيسي الحديدي (عمود واحد لمدة تصل إلى 107 خلايا) على ذلك مع نصائح مشيرا إلى أسفل. إعادة توازن الأعمدة مع 0.5 مل من البارد 1× ربط المخزن المؤقت. انتظر حتى يتدفق الحل تحت الجاذبية
ملاحظة: من المهم عدم تجاوز عدد الخلايا لكل عمود لتجنب أي خطر من تخثر السرير العمود وتقليل العائد الاسترداد. عند العمل مع أكثر من 107 خلايا، إما استخدام أعمدة أكثر وفقا لإجمالي عدد الخلايا أو استخدام أعمدة أكبر. في مثل هذه الحالات، ضبط وحدات التخزين الكاشفة الموضحة في الخطوات التالية لتلك التي أشار إليها المصنع. - في نهاية الحضانة، أضف 400 ميكرولتر من البارد 1× العازلة ملزمة لتعليق حبة / الخلية، وتحميل وحدة التخزين بأكملها على العمود، وجمع النفايات السائلة (المقابلة للخلايا غير البادلة) في أنبوب 15 مل.
- اغسل العمود أربع مرات مع 0.5 مل من العازلة الباردة 1× الربط، وجمع إجمالي النفايات السائلة (المقابلة لكسر الخلية الحية) في نفس الأنبوب.
- عد الخلايا مع تريبان الأزرق (1:1). ضع 1 × 105 خلايا في أنبوبين لفرز الخلايا المنشطة الفلورية (FACS)، والاحتفاظ بها عند 4 درجات مئوية حتى التحقق من صحة العملية (انظر الخطوة 4.1): استخدم الأنبوب الأول لتعيين معلمات التحليل ومناطق الإيجابية (أنبوب التحكم) والآخر لتحليل العلامات الحيوية (أنبوب العينة). استخدم الخلايا المتبقية لاستخراج CAFs (راجع القسم 3).
ملاحظة: إزالة الخلايا الميتة مهم للحد من ردود الفعل غير محددة مع الميكروبات في القسم 3. ومع ذلك، لتحسين الغلة، وتجنب إزالة الخلايا الميتة إذا كانت نسبة الخلايا الميتة <20٪.
3. استخراج CAFs الأولية من ورم الثدي
ملاحظة: بالنسبة للقسم 3، استخدم مجموعة عزل الخلايا الليفية المرتبطة بالورم الماوس التي تحتوي على كوكتيل استنفاد الخلايا الليفية غير المرتبطة بالورم والميكروبات الليفية المرتبطة بالورم المناسبة للتسمية المغناطيسية للخلايا (انظر جدول المواد).
- استنفاد الخلايا الليفية غير المرتبطة بالسرطان
- ترطيب مصفاة خلية 70 ميكرومتر مع برنامج تلفزيوني، وتصفية تعليق الخلية لإزالة أي كتل. ثم، الطرد المركزي الخلايا لمدة 10 دقيقة في 300 × ز ونسبر supernatant.
ملاحظة: إذا تم تقسيم ورم واحد إلى عينتين للخطوة 2.7، تجمع تعليق الخلية اثنين من اثنين قبل الشروع في الخطوة 3.1.2. - Resuspend بيليه في 80 ميكرولتر من البارد PBE العازلة، وإضافة 20 ميكرولتر من غير الورم المرتبطة كوكتيل استنفاد الخلايا الليفية. تخلط جيدا واحتضان في 4 درجة مئوية لمدة 15 دقيقة في الظلام.
- أثناء الحضانة بالخرز، قم بإعداد أعمدة الاستنفاد المغناطيسي الحديدي (1 لكل عينة) على حامل مغناطيسي، وتوازن الأعمدة مع 2 مل من حاجز PBE البارد. انتظر حتى يتم تدفق الحل من خلال.
- في نهاية الحضانة، أضف 400 ميكرولتر من العازل البارد PBE إلى تعليق الخرز/الخلية، وحمل الحجم بالكامل على العمود، وجمع النفايات السائلة (المقابلة للخلايا غير المبوبة) في أنبوب 15 مل.
- غسل العمود مرتين مع 2 مل من العازلة PBE الباردة، وجمع مجموع النفايات السائلة في نفس الأنبوب. الطرد المركزي لمدة 10 دقيقة في 300 × غرام وإعادة الإنفاق في 0.1 مل من العازلة PBE الباردة.
ملاحظة: استنفاد الخلايا الليفية غير المرتبطة بالسرطان يقلل بشكل كبير من إجمالي كمية الخلايا المستردة. من الضروري عموما ويوصى لتجميع تعليق الخلية من أربع عينات مختلفة للحصول على بيليه مرئية وخلايا كافية للخطوة 3.2. وهذا سيضمن الغلة المثلى. - ضع 20 ميكرولتر من تعليق الخلية في أنبوب FACS وأبقه عند 4 درجات مئوية للتحقق من العملية (انظر القسم 4). استخدم الخلايا المتبقية لتحديد CAF (راجع الخطوة 3.2).
- ترطيب مصفاة خلية 70 ميكرومتر مع برنامج تلفزيوني، وتصفية تعليق الخلية لإزالة أي كتل. ثم، الطرد المركزي الخلايا لمدة 10 دقيقة في 300 × ز ونسبر supernatant.
- اختيار إيجابي للخلايا الليفية المرتبطة بالسرطان
- إضافة 20 ميكرولتر من الميكروبات الليفية المرتبطة بالورم إلى 80 ميكرولتر من تعليق الخلية. تخلط جيدا واحتضان في 4 درجة مئوية لمدة 15 دقيقة في الظلام.
- أثناء الحضانة بالخرز، قم بإعداد أعمدة فصل مغناطيسية (1 لكل عينة) على حامل مغناطيسي، وتوازن الأعمدة مع 0.5 مل من حاجز PBE البارد. انتظر حتى يتم تدفق الحل من خلال.
- في نهاية الحضانة، أضف 400 ميكرولتر من المخزن المؤقت البارد PBE إلى تعليق الخرز/الخلية، وحمل وحدة التخزين بأكملها على العمود، والسماح للخلايا غير المبوبة بالتدفق إلى أنبوب 15 مل.
- اغسل العمود ثلاث مرات مع 0.5 مل من المخزن المؤقت البارد PBE ، وجمع إجمالي النفايات السائلة في نفس الأنبوب.
ملاحظة: يحتوي التدفق عبر خلايا غير توصف CD90.2-سالبة، والتي يمكن التخلص منها كخلايا ليفية غير مرتبطة بالسرطان. - إزالة العمود من المغناطيس ووضعه في أنبوب 1.5 مل. إضافة 1 مل من PBE الباردة على العمود، ودفع على الفور المكبس في العمود لطرد الخلايا.
- الطرد المركزي لمدة 10 دقيقة في 400 × غرام وإعادة الإنفاق في 0.1 مل من العازلة PBE الباردة. ضع 20 ميكرولتر من تعليق الخلية في أنبوب FACS وأبقه عند 4 درجات مئوية للتحقق من العملية (انظر القسم 4).
ملاحظة: بعد الطرد المركزي، قد تكون الكريات بالكاد مرئية، خاصة عندما تكون الأورام الأصلية صغيرة. استخدام أنابيب الطرد المركزي السفلي مخروطية وتوخي الحذر من فقدان أي خلايا عندما تطمح supernatant. - تمييع الخلايا المتبقية في حجم مناسب من متوسط النسر المعدلة في دولبيكو (DMEM)/هام F-12 تكملها 15٪ FBS، 2 MM L-glutamine، 1٪ P /S، و 1٪ الأحماض الأمينية غير الأساسية، والبذور الخلايا في لوحة زرع الأنسجة.
- تحقق من كثافة الخلية تحت المجهر، ووضع لوحة في حاضنة في 37 درجة مئوية و 5٪ CO2 للسماح للخلايا الانضمام والنمو.
ملاحظة: إذا كانت الخلايا كثيفة جدا، على الفور تقسيم تعليق الخلية إلى بئرين من لوحة زراعة الأنسجة قبل وضع لوحة في الحاضنة.
4. التحقق من صحة العملية
- قياس التدفق الخلوي
ملاحظة: لا يتطلب القسم 4.1 حالات معقمة ويمكن إجراؤه خارج غطاء غطاء الرأس. إجراء القسم 4.1 بالتوازي مع العينات التي تم جمعها في الخطوة 2.11 (الورم المفكك)، والخطوة 3.1.6 (بعد استنفاد الخلايا الليفية غير المرتبطة بالسرطان)، والخطوة 3.2.6 (بعد إثراء الخلايا الليفية المرتبطة بالسرطان).- أجهزة الطرد المركزي أنابيب FACS المعدة في الخطوات 2.11، 3.1.6، و 3.2.6 لمدة 10 دقائق في 300 × غرام. تجاهل الناتنات الفائق.
ملاحظة: إعداد أنبوب إضافي واحد على الأقل، والذي يحتوي على خلايا غير ملطخة تعمل كعنصر تحكم لتعيين المعلمات للتحليل. - في أنابيب العينة، خلايا إعادة الإنفاق في 88 ميكرولتر من PBE، وإضافة 2 ميكرولتر من الأجسام المضادة CD45 المقترنة مع ايزوثيوسيانات الفلورسين (FITC، 1:50 التخفيف، وفقا لتعليمات الشركة المصنعة) و 10 ميكروغرام من الأجسام المضادة CD90.2 المقترنة مع فيكوريثرين (PE، 1:10 التخفيف، وفقا لتعليمات الشركة المصنعة). تخلط جيدا واحتضان لمدة 10 دقيقة في 4 درجة مئوية في الظلام. في أنبوب التحكم (غير ملطخة)، إعادة الإنفاق الخلايا في 100 ميكرولتر من PBE. احتضان لمدة 10 دقيقة في 4 درجة مئوية في الظلام لتكرار الإجراء المتبع للخلايا الملطخة بالأجسام المضادة.
ملاحظة: يجب فحص درجة الحرارة ووقت الحضانة بعناية ، حيث أن الاختلاف في مثل هذه المتغيرات قد يؤدي إلى تلطيخ ضعيف أو غير محدد ، وبالتالي تغيير النتائج. - بعد الانتهاء من خطوة الحضانة، قم بإجراء غسل بإضافة 1 مل من PBE. جهاز طرد مركزي لمدة 10 دقائق عند 300 × ز. تجاهل الناتنات الفائق.
- إعادة الإنفاق الخلايا (جميع الأنابيب) في 500 ميكرولتر من برنامج تلفزيوني.
- تخلط جيدا والمضي قدما في تحليل قياس التدفق الخلوي. تعيين القنوات لقياس مضان الأجسام المضادة (أي FITC و PE).
- من أنبوب التحكم، حدد جميع الخلايا القابلة للحياة عن طريق رسم البوابة الأولى (P1) على مخطط مبعثر إلى الأمام مقابل الجانب (FSC vs SSC). ضمن P1، قم بتعيين بوابة ثانية (P2) تتألف من خلايا مفردة فقط.
- باستخدام قنوات الفلورسينس المحددة للأجسام المضادة (أي FITC و PE) ، قم بتعيين بوابات مناسبة لتمييز الخلايا الملطخة بشكل إيجابي.
- بدء التحليل وتسجيل ما لا يقل عن 10،000 الأحداث في P2. اقرأ الإشارات من كلتا القناتين في وقت واحد.
ملاحظة: إذا كان العدد الإجمالي للخلايا أقل من المتوقع، فقد يكون من الأفضل قراءة الأنبوب بأكمله. - (اختياري) إذا تم برمجة المزيد من التلطيخ بالأجسام المضادة /الفلوروفوريس الإضافية، ف وضعنا مصفوفة تعويض مناسبة قبل البدء في التحليل.
- أجهزة الطرد المركزي أنابيب FACS المعدة في الخطوات 2.11، 3.1.6، و 3.2.6 لمدة 10 دقائق في 300 × غرام. تجاهل الناتنات الفائق.
- رصد مورفولوجيا الخلايا وخصائصها
ملاحظة: بمجرد البذر، يجب معالجة الخلايا في ظل ظروف معقمة.- في اليوم التالي للبذر، تصور الخلايا تحت المجهر البصري للتحقق من التصاق الخلايا ومورفولوجيا. يستنشق supernatant واستبدالها مع المتوسطة الطازجة.
ملاحظة: CAFs هي خلايا كبيرة على شكل مغزل ، والتي يمكن تمييزها بسهولة عن البنية الشبيهة بالظهارية لخلايا الورم 4T1. - الحفاظ على الخلايا عند 37 درجة مئوية و 5٪ CO2 في جو رطب، وتغيير المتوسط كل يومين.
- عندما تصل الخلايا إلى التقاء ~ 80٪ (حوالي 4-6 أيام بعد البذر)، فصل الخلايا باستخدام TrypLE حدد الحل (انظر جدول المواد) لمدة 5 دقائق في درجة حرارة الغرفة. إضافة متوسطة جديدة (4:1)، الطرد المركزي تعليق الخلية في 400 × غرام لمدة 5 دقائق، وإعادة إنفاق بيليه في المتوسط الطازج.
- تقسيم الخلايا 1:2، وتوسيع الثقافة حتى يتم الحصول على عدد الخلايا اللازمة للتجربة.
- في كل مرور، تحقق من مورفولوجيا الخلايا والنمو تحت المجهر البصري. إذا لم يكن مورفولوجيا الخلايا متجانسا (على سبيل المثال، استنساخ خلايا صغيرة مستديرة الشكل تظهر في الثقافة)، قم بتحليل عينة من الخلايا حسب قياس التدفق الخلوي كما هو موضح في القسم 4.1. إذا كانت متجانسة، انتقل إلى الخطوة 4.2.7.
ملاحظة: قد تشير التغيرات في مورفولوجيا الخلايا إلى التلوث من قبل الخلايا الليفية غير المرتبطة بالسرطان، والتي تحتاج إلى إزالتها لضمان نقاء الثقافة. - تحليل نتائج قياس التدفق الخلوي والمضي قدما وفقا لأحد السيناريوهات التالية: (1) إذا تلوث CD90.2-/CD45-الخلايا يحدث، وجمع جميع الخلايا، وتكرار الاختيار الإيجابي باتباع الخطوة 3.2؛ '2' إذا حدث تلوث لخلايا CD45+ أيضا، اجمع جميع الخلايا، وكرر الاستنفاد في الخطوة 3-1؛ '3' إذا لم يحدث تلوث (لا توجد سوى خلايا CD90.2+/CD45)، احتفظ بالخلايا في حالة زراعة ثم انتقل مباشرة إلى 4.2.7.
ملاحظة: كما تكرار عملية الاستنفاد مع الميكروبات سوف يقلل من استعادة الخلية، فمن المستحسن فقط عندما لا تحتاج الخلايا لاستخدامها على الفور. - عد الخلايا مع تريبان الأزرق (1:1)، ووضع 5 × 105 خلايا في اثنين من أنابيب FACS، والطرد المركزي لمدة 10 دقيقة في 300 × ز. تجاهل supernatant، وإعادة إنفاق بيليه في 0.5 مل من العازلة حجب (PBS تكملها مع 2٪ BSA، 2٪ مصل الماعز) لمدة 15 دقيقة في درجة حرارة الغرفة.
ملاحظة: يعمل أنبوب واحد كتحكم يتكون من خلايا غير ملطخة فقط، في حين أن الخلايا الموجودة في الأنبوب الثاني ستكون ملطخة لتحليل قياس التدفق الخلوي. - الطرد المركزي لمدة 10 دقيقة في 300 × غرام، والتخلص من supernatant وإعادة الإنفاق في 99 ميكرولتر من العازلة حجب. أضف 1 ميكروغرام من الأجسام المضادة ل FAP إلى أنبوب العينة و1 مل من حاجز الحجب إلى أنبوب التحكم. تخلط جيدا واحتضان لمدة 15 دقيقة في درجة حرارة الغرفة.
ملاحظة: FAP هو علامة سطحية من ستروما الورم التفاعلي ويمكن استخدامها لتحديد وتوصيف CAFs. - اغسل ثلاث مرات باستخدام برنامج تلفزيوني، وأجهزة الطرد المركزي، واحتضن الجسم المضاد الثانوي المناسب المقترن بصبغة فلورية (1 ميكروغرام) في حاجز الحجب لمدة 15 دقيقة في درجة حرارة الغرفة.
- اغسل ثلاث مرات باستخدام برنامج تلفزيوني، وتحلل حسب قياس التدفق الخلوي (اتبع الخطوات من 4.1.5 إلى 4.1.7 عن طريق تعيين القناة المناسبة للكشف عن الفلوروفور المستخدم). ثم استخدم الخلايا للتجارب (الخطوة 5.2).
- (اختياري) تجميد عينة من الخلايا في 1 مل من 90٪ FBS و 10٪ ثنائي ميثيل سلفوإكسيد (DMSO)؛ تخزين في -80 درجة مئوية لمزيد من الاستخدام.
- في اليوم التالي للبذر، تصور الخلايا تحت المجهر البصري للتحقق من التصاق الخلايا ومورفولوجيا. يستنشق supernatant واستبدالها مع المتوسطة الطازجة.
5. استهداف CAFs بواسطة جسيمات فيريتين النانوية المهندسة
ملاحظة: تم استخدام متغير المؤتلف من سلسلة الفيريتين الثقيلة البشرية (HFn) كجسيمات نانوية عارية أو تم اقترانه باستهداف moieties. هنا، تم إعداد الجسيمات النانوية HFn وظيفية مع الجزء المتغير من الأجسام المضادة للFAP (Fab@FAP) من قبل NanoBioLab في جامعة ميلانو بيكوكا في اثنين من نسب الضرس HFn:Fab@FAP، 1:1 و 1:5، وفقا لبروتوكول وصف سابقا32.
- وضع العلامات الفلورية للجسيمات النانوية HFn
ملاحظة: يتم وضع علامة فلورية على كل من أقفاص HFn النانوية العارية والوظيفية باستخدام FITC.- حل مسحوق FITC في الإيثانول 99٪ للحصول على تركيز 2 ملغم / مل.
ملاحظة: يجب إعداد هذا الحل حديثا. - احتضان 50 ميكرولتر من المحلول المعد (200 ميكروغرام من FITC) لكل 1 ملغ من البروتين (أي 100 ميكرولتر من HFn بمعدل 10 ملغم / مل). إضافة 50 ميكرولتر من بيكربونات الصوديوم 1 م (NaHCO3)،وضبط حجم إلى 500 ميكرولتر مع 0.1 M NaHCO3.
ملاحظة: توسيع نطاق الأحجام وفقا للاحتياجات التجريبية. - احتضان خليط التفاعل في درجة حرارة الغرفة، في الظلام، ومع التحريك المستمر لمدة 1 ساعة.
- إزالة فائض FITC من اقتران بواسطة الترشيح هلام باستخدام عمود تحلية تدور (7 كيلودا MWCO).
- تقييم تركيز البروتين المسمى المسترد باستخدام مطياف. تقدير كميات البروتين والصبغ عن طريق قياس الامتصاص في 280 نانومتر و 488 نانومتر على التوالي.
- حل مسحوق FITC في الإيثانول 99٪ للحصول على تركيز 2 ملغم / مل.
- ربط الجسيمات النانوية HFn إلى CAFs
ملاحظة: استخدام CAFs من لا يتجاوز مقاطع 4-5 في culture.- ضع 5 × 105 خلايا في كل أنبوب FACS، جهاز الطرد المركزي لمدة 10 دقائق في 300 × غرام، و resuspend في 0.5 مل من برنامج تلفزيوني, 0.3٪ BSA تكملها 0.1 ملغ / مل من الاستعدادات المختلفة للجسيمات النانوية (HFn عارية, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) وصفت سابقا مع FITC.
ملاحظة: تشغيل كل شرط في ثلاثة نسخ. إعداد أنبوب إضافي كعينة تحكم غير تسمية التي يتم إضافة أي جسيمات نانوية. - احتضان لمدة 2 ساعة في 4 درجة مئوية في الظلام، والطرد المركزي، وغسل ثلاث مرات في برنامج تلفزيوني.
- Resuspend الخلايا مع 0.5 مل برنامج تلفزيوني، مزيج جيد، وتحليل حسب قياس التدفق الخلوي. تعيين القنوات لقياس مضان FITC.
- بعد الحصول على خلايا حية واحدة، والحصول على 20،000 الأحداث. استخدام أنبوب التحكم غير تسمية لتعيين بوابة الإيجابية FITC والحصول على النسبة المئوية للأحداثFITC + (المقابلة لربط الجسيمات النانوية).
- ضع 5 × 105 خلايا في كل أنبوب FACS، جهاز الطرد المركزي لمدة 10 دقائق في 300 × غرام، و resuspend في 0.5 مل من برنامج تلفزيوني, 0.3٪ BSA تكملها 0.1 ملغ / مل من الاستعدادات المختلفة للجسيمات النانوية (HFn عارية, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) وصفت سابقا مع FITC.
6. التحليل الإحصائي والتجريبية تكرار
- الحيوانات
- إجراء ثلاث تجارب مستقلة لنمو الورم وعزل CAFs ، باستخدام 8 لكل تجربة واحدة ، كما هو موضح في 1.1.5. لتحسين إنتاجية عزل CAFs، قم بتقسيم الأنسجة المقتطعة إلى مجموعات فرعية (n=4) ومعالجتها، باتباع الخطوات الموضحة في القسم 2.
- تفاعل HFn مع الخلايا
- تقييم تفاعل HFn الوظيفي وغير الوظيفي مع الخلايا المستهدفة وغير المستهدفة (CAFs و 4T1 على التوالي) من حيث النسبة المئوية للخلايا الملطخة بشكل إيجابي بواسطة الخلايا النانوية الموسومة بالفلورسنت. الإبلاغ عن النتائج كمتوسط انحراف معياري ± ثلاث تجارب مستقلة.
- التحليل الإحصائي
- لحساب الأهمية الإحصائية في تجارب ربط الخلية مع HFn و HFn-FAP، استخدم اختبار ANOVA أحادي الاتجاه العادي.
النتائج
في إعداد نموذج vivo لعزل CAFs الأمثل
حقن 105 4T1-luc الخلايا في وسادة الدهون الثديي من الفئران BALB / ج الإناث يؤدي إلى نمو كتلة الورم يمكن الكشف عنها في 5 أيام بعد زرع. من خلال قياس حجم الورم من قبل الفرجار وقابلية بقاء الخلية السرطانية من قبل BLI ، تم رصد نمو الورم لمدة شهر واحد بعد الزرع. لإيجاد نافذة التضحية التي هي كافية لعزل CAFs، تم السعي إلى حل وسط الأمثل بين ارتفاع حجم الورم وBLI من ناحية وتقرح الورم الناشئة ونخر من ناحية أخرى (الشكل 1). كما يظهر نواة نخرية بعد 20 يوما من زرع، ويتضخم في 25 و 30 يوما (كما هو موثق من قبل الصور BLI في الشكل 1C)،تم تعيين اليوم 20 كنقطة زمنية لتحسين استعادة الخلية بعد عملية العزل. حتى بعد إزالة جميع المناطق النخرية المرئية بعناية خلال الخطوات الأولى من التعامل مع الورم في الجسم الحي ،تم العثور على نسبة عالية من الخلايا الميتة في نهاية الانفصال إلى خلايا واحدة ( الجدول1). وبما أن هذه النسبة المئوية قد تكون ذات صلة، خاصة مع الزيادة في حجم الورم، فإن إزالة الخلايا الميتة ضرورية دائما عند العمل مع نموذج 4T1.
تحسين إجراءات عزل CAFs والثقافة والتوصيف
هناك حاجة إلى مقطعين آخرين لعزل سكان CAFs (CD90.2+ CD45- )من لوحة الخلايا القابلة للحياة التي تم جمعها: استنفاد الخلايا الليفية غير المرتبطة بالورم وإثراء الخلايا الليفية المرتبطة بالورم (الشكل 2). مزيج حبة الاستنفاد يزيل بكفاءة CD45+ الخلايا (تمثل 67.35٪ و 0.69٪ من إجمالي الخلايا قبل وبعد الاستنفاد، على التوالي، الجدول 2)، وكان يستخدم دائما لمعالجة ورم واحد واحد في كل عمود. وكما هو مبين في الجدول 1،انخفض عدد الخلايا الملتوية من متوسط 3 × 106 إلى 1 × 105 بعد خطوة الاستنفاد. بسبب هذا الانخفاض الهائل في إجمالي عدد الخلايا ، من المريح تجميع الخلايا التي تم جمعها من 2 على الأقل إلى 4 أورام كحد أقصى في أنبوب واحد قبل المضي قدما في خطوة التخصيب. من خلال القيام بذلك ، تم الحصول على عدد كاف من الخلايا لاحتضان حبات الخلايا الليفية المرتبطة بالورم ومرت عبر عمود فصل واحد للحصول على متوسط نهائي قدره 93٪ من CD90.2+ CD45- الخلايا (الجدول 2).
مرة واحدة بذر على لوحات زراعة الأنسجة، وهذه الخلايا المستردة تعلق على البلاستيك وكشفت عن مورفولوجيا كبيرة على شكل مغزل نموذجية من الخلايا الليفية(الشكل 3A،B)ومختلفة عن الخلايا السرطانية 4T1 (الشكل 3D). عدم تجميع الأورام بعد الاستنفاد يسبب العائد الخلوي مع الميكروبات الليفية المرتبطة بالورم لتكون منخفضة جدا لتأسيس ثقافة. في حالات أخرى، عندما لا يتم الحفاظ على مدة ودرجة حرارة الحضانات مع الميكروبات بعناية، قد تحدث بعض الربط غير محددة. وفي مثل هذه الحالات، كانت خطوات الإثراء أقل كفاءة، كما تم استرداد نسب أعلى من CD90.2- CD45+ وCD90.2- CD45- مع CD90.2+ CAFs (5.97 ± 1.5 و 16.75 ± 1.1 على التوالي)(الشكل 4 والجدول 3). هذه الخلايا الملوثة من المرجح أن تكون مسؤولة عن وجود في ثقافة المستنسخين الصغيرة مع مورفولوجيا مختلفة(الشكل 4B، رؤوس الأسهم السوداء) التي نمت بشكل أسرع من CAFs وغلبت على ثقافة CAF الأولية(الشكل 4C). أكدت هذه النتائج دون المستوى الأمثل أهمية التحقق المزدوج دائما من تعبير CD90.2 و CD45 ، وكذلك مورفولوجيا الخلايا في نهاية عملية الإثراء وأثناء نمو الخلايا في الثقافة.
استخدام الخلايا المعزولة لتقييم إمكانات استهداف CAF للأدوية النانوية المهندسة
يمكن استخدام CAFs المعزولة حديثا للعديد من التطبيقات التي تتراوح بين الأبحاث الأساسية والدراسات الدوائية. هدف هذه المجموعة هو تطوير أقفاص نانوية HFn التي يمكن أن تستهدف على وجه التحديد CAFs. تم تشغيل HFn مع جزء معين من الأجسام المضادة ل FAP (HFn-FAP) بنسبتين مختلفتين من البروتين: الأجسام المضادة (أقل 1:1 وأعلى 1:5) ، وتم اختبار ربطها مع CAFs. كما تم استخدام FAP كعلامة بيولوجية سطحية من CAFs الموالية tumorigenic، كان من الأهمية الأساسية للتحقق من التعبير FAP على CAFs معزولة(الشكل 3C). تم اتباع تعبير FAP على مدى 5 مقاطع في الثقافة لتأكيد أن ثقافة CAF الأساسية حافظت على خصائصها الأصلية.
تبين أن الوظيفة FAP على HFn تساهم في تحول كبير نحو استهداف CAF بالمقارنة مع HFn العارية ، وكان انخفاض كمية الأجسام المضادة (1:1) كافيا لمراقبة هذا التأثير(الشكل 5A). ومع ذلك، لم يلاحظ هذا مع خلايا الورم 4T1 المستخدمة لإعداد نموذج الورم في الجسم الحي، حيث أظهرت HFn عارية ملزمة أعلى من HFn وظيفية (الشكل 5B). وكان هذا على الأرجح بسبب عدم وجود التعبير المفرط FAP في خلايا 4T1 والتفاعل التفضيلي لHFN مع TfR1، الذي ينظم امتصاص HFn في الخلايا، كما ذكرت على نطاق واسع من قبل هذه المجموعة27،33. تؤكد هذه النتائج فائدة استخدام الثقافات الأولية ل CAFs الثدي لفحص قدرة استهداف الجسيمات النانوية المصممة لمعالجة البيئة الدقيقة للورم بشكل أولي.
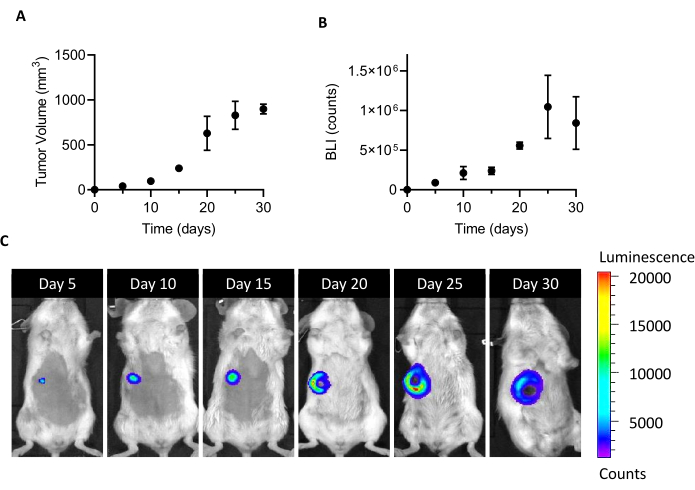
الشكل 1: إنشاء نموذج الورم 4T1. تم حقن الخلايا(10 5 خلايا / الماوس) في وسادة الدهون الثديية. وأعقب نمو الورم في الأيام 5 و 10 و 15 و 20 و 25 و 30 بعد الزرع(أ)عن طريق قياس حجم الورم مع الفرجار و (ب) عن طريق التصوير الإضاءة الحيوية. يتم التعبير عن أحجام الورم وBLI كملم3 والتهم، على التوالي. يتم الإبلاغ عن النتائج كمتوسط ± SEM (n = 6). (ج)صور ممثل BLI التي تم الحصول عليها 5 و 10 و 15 و 20 و 25 و 30 يوما بعد زرع الخلايا تؤكد نمو الورم حتى اليوم 25 ، عندما يبدو أنه يصل إلى هضبة. في آخر نقطة تحليل (30 يوما) ، لا يزيد BLI بالمقارنة مع اليوم 25. ابتداء من اليوم 20 ، تبدأ مناطق النخر والتقرح في الظهور في الجزء الأوسط من الورم. مقياس اللون: الحد الأدنى = 1,194، الحد الأقصى = 20,462. المختصرات: BLI = التصوير الإضاءة الحيوية؛ SEM = خطأ قياسي في المتوسط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
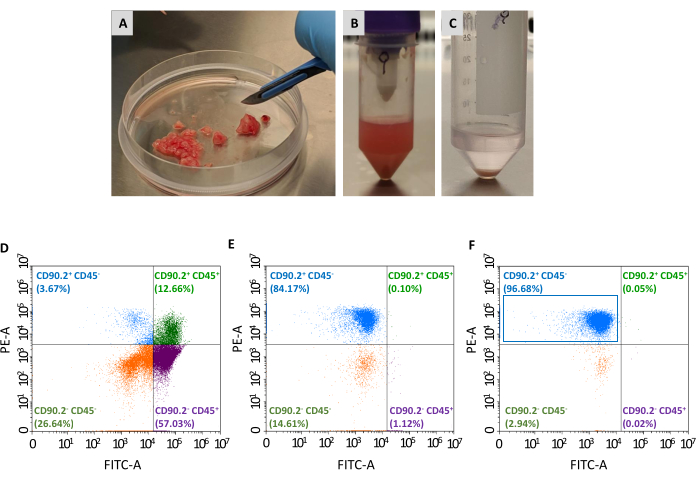
الشكل 2: إعداد عينة الورم وتوصيف قياس التدفق الخلوي ل CAFs المعزولة. تم استئصال الأورام وخفضها إلى (أ) قطع صغيرة من 1-2 مم تقريبا بمساعدة مشرط. (ب) تعليق خلية واحدة بعد هضم الأنسجة والتفكك الميكانيكي للورم المقتطع؛ (ج) بيليه الخلية التي تم الحصول عليها بعد تحلل خلايا الدم الحمراء; (د)تحليل تدفق قياس الخلايا من CD45 و CD90.2 التعبير في الخلايا التي تم الحصول عليها بعد إزالة خلايا الدم الحمراء والخلايا الميتة،(ه)بعد استنفاد الخلايا الليفية غير المرتبطة بالسرطان، و (F) بعد إثراء الخلايا الليفية المرتبطة بالسرطان، حيث غالبية الخلايا هي CD90.2+ CD45- (المستطيل الأزرق). المختصرات: CAFs = الخلايا الليفية المرتبطة بالسرطان؛ CD = مجموعة من التمايز؛ PE-A = منطقة فيكوريثرين; FITC-A = مناطق ايزوثيوسيانات الفلورسين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
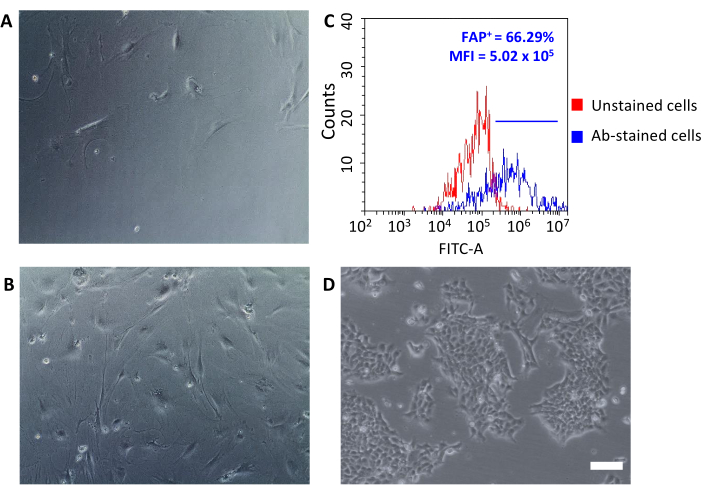
الشكل 3: تم فحصالتحليل المورفولوجيللتعبير CAFs و FAP. (A ، B) CAFs morphology في جميع مقاطع الثقافة عن طريق المجهر البصري (مستويات مختلفة من الالتقاء عند الممر 2 والممر 5) وبالمقارنة مع (D) 4T1 الخلايا السرطانية ؛ تم تقييم أشرطة المقياس = 10 ميكرومتر (C) تعبير تنشيط الخلايا الليفية (FAP) عن طريق قياس التدفق الخلوي في نهاية عملية العزل على CD90.2+ CD45- الخلايا لتأكيد خصائصها الجزيئية. تم تعيين عتبة مضان على خلايا التحكم غير الملطخة (الرسم البياني الأحمر) لتحديد متوسط كثافة الفلورسينس والنسبة المئوية للخلايا الإيجابية (FAP+) بين الخلايا الملطخة بالأجسام المضادة (الرسم البياني الأزرق). المختصرات: CAFs = الخلايا الليفية المرتبطة بالسرطان؛ FAP = بروتين تنشيط الخلايا الليفية؛ CD = مجموعة من التمايز؛ MFI = متوسط كثافة الفلورسينس؛ Ab = الأجسام المضادة; FITC-A = منطقة ايزوثيوسيانات الفلورسين; FAP + = الخلايا الإيجابية FAP. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: مثال على عملية عزل CAFs دون المستوى الأمثل. (أ) كشف تقييم قياس التدفق الخلوي بعد خطوة العزل النهائية عن وجود خلايا CD90.2- CD45+ و CD90.2- CD45- الخلايا. (ب)يمكن أن ينظر إلى هذه الخلايا على أنها استنساخ مع مورفولوجيا مستديرة صغيرة على البذر (رؤوس الأسهم السوداء و inset في الزاوية اليسرى السفلى من اللوحة) أن(C)سادت على CAFs بعد مرور الثالث في الثقافة. أشرطة المقياس = 10 ميكرومتر. المختصرات: CAF = الخلايا الليفية المرتبطة بالسرطان؛ CD = مجموعة من التمايز؛ PE-A = منطقة فيكوريثرين; FITC-A = مناطق ايزوثيوسيانات الفلورسين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
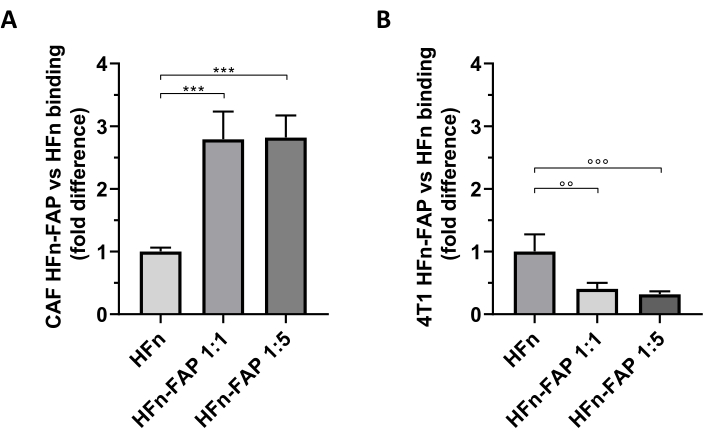
الشكل 5: ربط أقفاص نانوية HFn على CAFs و 4T1. تم تسمية أقفاص نانوية HFn بفلورسنت مع FITC ، تعمل بشظايا الأجسام المضادة ل FAP (HFn-FAP) بنسبتين مختلفتين للبروتين والأجسام المضادة (1:1 و 1:5) ، وتم احتضانها مع (A) CAFs الهدف و (B) 4T1 الخلايا في 4 درجة مئوية لمدة 2 ساعة. تم تقييم الربط عن طريق قياس التدفق الخلوي. (أ)HFn-FAP الربط مع CAFs هو زيادة كبيرة في كل من تركيزات شظايا الأجسام المضادة من قبل ثلاثة أضعاف بالمقارنة مع HFn العارية. (ب) في المقابل، لوحظ ربط أعلى بكثير من HFn عارية في الخلايا 4T1، حيث لا يتم تعزيز الربط من قبل الاعتراف FAP. يتم الإبلاغ عن النتائج كمتوسط انحراف معياري ± ثلاث تجارب مستقلة. p = 0.0003; °° p = 0.0021 ; °°p = 0.0008. المختصرات: CAFs = الخلايا الليفية المرتبطة بالسرطان؛ FAP = بروتين تنشيط الخلايا الليفية؛ HFn = البديل المؤتلف من سلسلة الفيريتين الثقيلة البشرية المستخدمة كجسيمات نانوية عارية أو مترافقة؛ HFN-FAP = جسيمات نانوية HFn تعمل مع الجزء المتغير من الأجسام المضادة ل FAP التي تم إعدادها في نسبتين ضوليتين HFn:Fab@FAP، 1:1 و 1:5. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| رقم الخلية (متوسط ± SD) | إجمالي غلة الاستخراج (لكل مرور) | |
| استئصال الورم (بعد إزالة خلايا الدم الحمراء) | 1.27 × 108 ± 9.81 × 107 | 100% |
| استئصال الورم (إزالة الخلايا الميتة بعد) | 3.01 × 106 ± 9.61 × 105 | 2.38% |
| كوكتيل ما بعد الاستنفاد | 1.15 × 105 ± 4.95 × 104 | 0.11% (3.82%) |
| إثراء ما بعد | 3.00 × 104 ± 1.2 × 104 | 0.027% (26.09%) |
الجدول 1: إجمالي عدد الخلايا بعد كل خطوة من عزل الخلايا الليفية المرتبطة بالسرطان.
| توزيع الخلية (٪) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| استئصال الورم (إزالة الخلايا الميتة بعد) | 1.81 ± 0.98 | 10.78 ± 4.51 | 56.57 ± 14.05 | 28.20 ± 17.57 |
| كوكتيل ما بعد الاستنفاد | 69.33 ± 16.75 | 0.14 ± 0.13 | 0.55 ± 0.63 | 39.89 ± 30.31 |
| إثراء ما بعد | 93.14 ± 3.3 | 0.09 ± 0.1 | 0.09 ± 0.08 | 6.69 ± 3.4 |
الجدول 2: توزيع الخلايا وفقا للتعبير عن CD90.2 و CD45 بعد كل مرور عزل الخلايا الليفية المرتبطة بالسرطان.
| توزيع الخلية (٪) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| إثراء آخر (بدون تجميع) | 75.80 ± 2.9 | 1.49 ± 0.4 | 5.97 ± 1.5 | 16.75 ± 1.1 |
الجدول 3: تعبير CD90.2 وCD45 عن الخلايا التي تم جمعها بعد تجربة عزل شبه مثالية مرتبطة بالسرطان في الخلايا الليفية.
Discussion
تظهر CAFs كلاعبين رئيسيين في إعادة عرض المصفوفة خارج الخلية ، وتعزيز تطور الانبثاث ، والحد من الوصول إلى الدواء إلى موقع الورم34. ومع ذلك ، نظرا تجانسها ، لا تزال أدوارها مثيرة للجدل - بعض CAFs هي الأورام ، في حين يبدو أن بعض الأنواع الفرعية الأخرى لها دور قمع الورم. في هذا السياق، يمكن عزلتهم تكون ذات أهمية قصوى لتسليط المزيد من الضوء على دورها الكثير من الجدل في تطور السرطان، والتي سيكون لها آثار سريرية هامة12،31. وعلاوة على ذلك، فإن الاستخراج الناجح ل CAF من نماذج ورم الفأر البشرية وقبل السريرية من شأنه أيضا أن يسهل تطوير أدوية جديدة تستهدف CAF. هذه الورقة تقارير طريقة لعزل بكفاءة والثقافة CAFs الأولية من نموذج ما قبل السريرية syngeneic من سرطان الثدي. واستنادا إلى الخبرة، تؤثر ثلاث خطوات تجريبية في الغالب على نجاح البروتوكول.
الأول يعمل بسرعة لتجنب تجميع تعليق الخلايا المرتبطة بخطر التخثر في العمود وإبطاء ارتجاع الخلايا: في الواقع، عندما تم تجميع الخلايا التي مرت عبر العمود معا، زاد احتمال حدوث عملية عزل دون المستوى الأمثل، واحتوت الثقافات النهائية على استنساخ خلايا "ملوثة". والثاني هو تجميع الخلايا من أورام مختلفة بعد مرور الاستنفاد لضمان ما يكفي من الخلايا لتمريرها في خطوة الإثراء النهائية. القضية الحرجة الأخيرة هي طلاء الخلايا المستخرجة بكثافات خلايا عالية ، على الأرجح بدءا من بئر واحد من لوحة 24 بئرا لتعزيز نمو الخلايا وتوسع المستعمرة لمدة تصل إلى 4-5 مقاطع. إذا كانت الخلايا بذر في كثافات منخفضة، فإنها توسعت على السطح الحر وتوقفت بسرعة تكرار.
وقد وصفت العديد من الدراسات بالفعل أساليب استخراج CAF من أصل الإنسان والفأر على حد سواء، لدراسة دورها في تعزيز تطور السرطان والتوغل. وقد تم ذلك في العديد من أنواع الأورام, بما في ذلك سرطان الثدي, سرطان الجلد, سرطان الأوعية الدموية, وسرطان الغدة ال غدي البنكرياس35,36,37,38. ومع ذلك ، بسبب عدم وجود علامات CAF محددة وعدم تجانسها ، لا تزال نتائج هذه العمليات دون المستوى الأمثل.
هنا، تم استخدام الخلايا المعزولة للتحقق من صحة قدرة استهداف CAF من الكعك النانوي HFn وظيفية مع مكافحة FAP استهداف moieties. كان استخدام الثقافات الأولية ل CAFs ميزة كبيرة ، مما سمح بالتحقق من صحة النانوستراتيجي ex vivo بتجربة ربط أبسط بكثير وفعالة من حيث التكلفة من القيام بذلك مباشرة في الجسم الحي في هذه المرحلة الأولية من تحسين المخدرات النانوية.
وبهذا المعنى، يمكن أن يسبق اختبار الجسم الحي السابق على CAFs في التجارب الحيوانية الحية من خلال السماح بفحص واختيار الجسيمات النانوية الواعدة للاستهداف الأمثل ل CAF. يمكن أيضا استخدام نموذج CAF المعروض هنا لدراسات الفعالية الأولية ، عند تحميل الجسيمات النانوية بالأدوية النشطة. سيتم استخدام الحيوانات في وقت لاحق فقط لتقييم التوزيع الحيوي ، وعلم الصيدلة ، ودراسات الفعالية.
ويجري تطوير العديد من العقاقير النانوية التي تستهدف CAF، مثل الكوابير النانوية فيريتين للعلاج الضوئي في سرطان الثدي والجسيمات القائمة على الببتيد لتقديم الدوكسوروبيسين في نماذج سرطان البروستاتا39،40. ومع ذلك ، لم تركز العديد من الدراسات على عزل CAFs كمنصات للخلايا لتحسين المخدرات النانوية.
هذا البروتوكول له بعض القيود. أولا، إنه بروتوكول يستغرق وقتا طويلا، ويتطلب إعداد وشراء العديد من الكواشف والمواد. ثانيا، نظرا لندرة CAFs في ورم الثدي 4T1، غلتها منخفضة. وينبغي التخطيط لتجارب الجسيمات النانوية وتنفيذها بمجرد تحقيق رقم الخلية المطلوب، حيث تخضع الخلايا الكافورة الأولية للانارة ولا يمكن الحفاظ عليها في الثقافة لفترة طويلة. في الختام، يمكن أن تكون هذه الطريقة لعزل وزراعة وتوصيف CAFs أداة قوية لتسريع تطوير أدوية نانوية مستهدفة جديدة في مكافحة السرطان.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل Associazione Italiana لكل لا Ricerca sul Cancro (AIRC) بموجب مشروع IG 2017-ID. 20172 - P.I. Corsi Fabio. SM تعترف مركز البحوث السريرية للأطفال "روميو وإنريكا Invernizzi" التي تدعم موقفها. AB تشكر AIRC (مشروع ID. 20172) وجامعة ميلانو على زمالة البحث. زمالات ما بعد الدكتوراه والدكتوراه في جامعة ميلانو تدعمها.
Materials
| Name | Company | Catalog Number | Comments |
| ACK Lysing buffer | Lonza | 10-548E | Store at +15° to +30 °C. |
| Alexa Fluor 488 goat anti-human antibody | Immunological Science | IS-20022 | Protect from light. |
| Anti-FAP Fab fragment (3F2) | Creative Biolabs | TAB-024WM-F(E) | |
| BALB/c mice | Charles River | 028BALB/C | 7 weeks old female mice |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | Store at 2-8 °C. |
| CD45 antibody | Miltenyi Biotec | 130-110-796 | FITC-conjugated fluorescent antibody; clone REA 737; Store protected from light at 2–8 °C. |
| CD90.2 antibody | Miltenyi Biotec | 130-102-960 | PE-conjugated fluorescent antibody; clone 30-H12; Store protected from light at 2–8 °C. |
| Cell strainers 70 µm | VWR | 732-2758 | |
| CytoFLEX | Beckman Coulter | laser configuration B4-R2-V0 | |
| Dead cell Removal Kit | Miltenyi Biotec | 130-090-101 | contains 10 mL of Dead Cell Removal MicroBeads; 25 mL of 20× Binding Buffer Stock Solution. Store protected from light at 2−8 °C. |
| D-Luciferin | Caliper | 760504 | reagent for in vivo imaging |
| DMEM High Glucose w/o L-Glutamine w/ Sodium Pyruvate | Euroclone | ECB7501L | Warm at 37 °C in a water bath before use. |
| DMSO | Sigma-Aldrich | D2650 | |
| DPBS w/o Calcium, w/o Magnesium | Euroclone | ECB4004L | Keep at room temperature. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E9884 | |
| Fetal Bovine Serum | Euroclone | ECS0180L | Before use, heat at 56 °C for 30 min to kill all the complement proteins. |
| Fluorescein Istothiocyanate isomer I (FITC) | Sigma-Aldrich | F7250 | Store protected from light at 2–8 °C. |
| GentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | They are used in combination with the gentleMACS Dissociator. |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | Two samples can be processed in parallel. Special protocols have been developed for various tissues. |
| Goat serum | Euroclone | ECS0200D | |
| Ham's F12 w/o L-Glutamine | Euroclone | ECB7502L | Warm at 37 °C in a water bath before use. |
| IVIS Lumina II imaging system | Caliper Life Sciences | This imaging system is easy to use for both fluorescent and bioluminescent imaging in vivo. Equipped with a Living Image Software for analysis | |
| LD columns | Miltenyi Biotec | 130-042-901 | Composed of ferromagnetic spheres, designed for stringent depletion of unwanted cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use |
| L-Glutamine | Euroclone | ECB3000D | 200 mM stock |
| Light/fluorescence microscope equipped with camera | Leica Microsystems | DM IL LED Fluo/ ICC50 W CameraModule | inverted microscope for live cells with camera |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Separation Unit | Miltenyi Biotec | 130-090-976 | Position the magnet on appropriate stand before use. |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MS columns | Miltenyi Biotec | 130-042-201 | Composed of ferromagnetic spheres, designed for positive selection of cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use. |
| Mycoplasma Removal Agent | Euroclone | ECMC210A | Dilute in culture medium 1:100. |
| NaHCO3 | Invitrogen | A10235 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000C | |
| Non essential aminoacids | Euroclone | ECB3054D | |
| Penicillin-Streptomycin | Euroclone | ECB3001D | |
| Recombinant Human apoferritin H-homopolymer (HFn) | Molirom | MLR-P018 | |
| RPMI 1640 w/o L-Glutamine | Euroclone | ECB9006L | Warm at 37 °C in a water bath before use. |
| Tumor-Associated Fibroblast Isolation kit | Miltenyi Biotec | 130-116-474 | Contains 1 mL of Non-Tumor-Associated Fibroblast Depletion Cocktail, mouse; 1 mL of CD90.2 (Tumor-Associated Fibroblast) MicroBeads,mouse. Store protected from light at 2-8 °C. |
| Tumor Dissociation Kit | Miltenyi Biotec | 130-096-730 | Contains lyophilized enzymes (D, R, A) and buffer A; reconstitute enzymes according to the manufacturer's instructions, aliquot and store at - 20 °C. |
| Trypan blue 0.4% | Lonza | 17-942E | dilute 1:1 with a sample of cell suspension before counting the cells |
| TrypLE select | Gibco | 12563-029 | use at room temperature |
| Trypsin-EDTA | Lonza | BE17-161E | Warm at 37 °C in a water bath before use |
| T75 Primo TC flask | Euroclone | ET7076 | |
| Zeba Spin Desalting Columns | Thermo Fisher Scientific | 89890 | 7K MWCO, 2 mL |
| 1.5 mL tubes | Biosigma | CL15.002.0500 | |
| 15 mL tubes | Euroclone | ET5015B | |
| 4T1-luc2 | Caliper | Mouse mammary gland cancer cell line stably transfected with firefly luciferase gene | |
| 50 mL tubes | Euroclone | ET5050B |
References
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nature Medicine. 19 (11), 1423-1437 (2013).
- Velaei, K., Samadi, N., Barazvan, B., Soleimani Rad, J. Tumor microenvironment-mediated chemoresistance in breast cancer. Breast. 30, 92-100 (2016).
- Cheng, J. D., Weiner, L. M., et al. Tumors and their microenvironments: tilling the soil. Commentary re: A. M. Scott et al., A Phase I dose-escalation study of sibrotuzumab in patients with advanced or metastatic fibroblast activation protein-positive cancer. Clinical Cancer Research. 9 (5), 1690-1695 (2003).
- Hui, L., Chen, Y. Tumor microenvironment: Sanctuary of the devil. Cancer Letters. 368 (1), 7-13 (2015).
- Balkwill, F. R., Capasso, M., Hagemann, T. The tumor microenvironment at a glance. Journal of Cell Science. 125, 5591-5596 (2012).
- Chen, X., Song, E. Turning foes to friends: targeting cancer-associated fibroblasts. Nature Review. Drug Discovery. 18 (2), 99-115 (2019).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Seminars in Cell & Developmental Biology. 21 (1), 33-39 (2010).
- LeBleu, V. S., Kalluri, R. A peek into cancer-associated fibroblasts: origins, functions and translational impact. Disease Models & Mechanisms. 11, (2018).
- Li, X. -. Y., Hu, S. -. Q., Xiao, L. The cancer-associated fibroblasts and drug resistance. European Review for Medical and Pharmacological Sciences. 19 (11), 2112-2119 (2015).
- Luo, H., Tu, G., Liu, Z., Liu, M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Letters. 361 (2), 155-163 (2015).
- Truffi, M., Sorrentino, L., Corsi, F. Fibroblasts in the tumor microenvironment. Advances in Experimental Medicine and Biology. 1234, 15-29 (2020).
- Sugimoto, H., Mundel, T. M., Kieran, M. W., Kalluri, R. Identification of fibroblast heterogeneity in the tumor microenvironment. Cancer Biology & Therapy. 5 (12), 1640-1646 (2006).
- Costa, A., et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell. 33 (3), 463-479 (2018).
- Ishii, G., Ochiai, A., Neri, S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Advances Drug Delivery Reviews. 99, 186-196 (2016).
- Chen, Q., et al. Remodeling the tumor microenvironment with emerging nanotherapeutics. Trends in Pharmacological Sciences. 39 (1), 59-74 (2018).
- Truffi, M., et al. Nano-strategies to target breast cancer-associated fibroblasts: rearranging the tumor microenvironment to achieve antitumor efficacy. International Journal of Molecular Sciences. 20 (6), 1263 (2019).
- Tong, R., Langer, R. Nanomedicines Targeting the Tumor Microenvironment. Cancer Journal. 21 (4), 314-321 (2015).
- Kaps, L., Schuppan, D. Targeting cancer associated fibroblasts in liver fibrosis and liver cancer using nanocarriers. Cells. 9 (9), 2027 (2020).
- Miao, L., et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors. Cancer Research. 77 (3), 719-731 (2017).
- Kelly, T., Huang, Y., Simms, A. E., Mazur, A. Fibroblast activation protein-α: a key modulator of the microenvironment in multiple pathologies. International Review of Cell and Molecular Biology. 297, 83-116 (2012).
- Brennen, W. N., Isaacs, J. T., Denmeade, S. R. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy. Molecular Cancer Therapeutics. 11 (2), 257-266 (2012).
- Juillerat-Jeanneret, L., Tafelmeyer, P., Golshayan, D. Fibroblast activation protein-α in fibrogenic disorders and cancer: more than a prolyl-specific peptidase. Expert Opinion on Therapeutic Targets. 21, 977-991 (2017).
- Falvo, E., et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin. Nanoscale. 5 (24), 12278-12285 (2013).
- Truffi, M., et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research. 107, 57-65 (2016).
- Cai, Y., et al. Enhanced magnetic resonance imaging and staining of cancer cells using ferrimagnetic H-ferritin nanoparticles with increasing core size. International Journal of Nanomedicine. 10, 2619-2634 (2015).
- Heger, Z., Skalickova, S., Zitka, O., Adam, V., Kizek, R. Apoferritin applications in nanomedicine. Nanomedicine. 9 (14), 2233-2245 (2014).
- Mazzucchelli, S., et al. Nanometronomic treatment of 4T1 breast cancer with nanocaged doxorubicin prevents drug resistance and circumvents cardiotoxicity. Oncotarget. 8 (5), 8383-8396 (2017).
- Yu, Q., et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy. Journal of Controlled Release. 321, 564-575 (2020).
- Mertens, J. C., et al. Therapeutic effects of deleting cancer-associated fibroblasts in cholangiocarcinoma. Cancer Research. 73 (2), 897-907 (2013).
- Kovács, D., et al. Core-shell nanoparticles suppress metastasis and modify the tumour-supportive activity of cancer-associated fibroblasts. Journal of Nanobiotechnology. 18, 18 (2020).
- Sharon, Y., Alon, L., Glanz, S., Servais, C., Erez, N. Isolation of normal and cancer-associated fibroblasts from fresh tissues by Fluorescence Activated Cell Sorting (FACS). Journal of Visualized Experiments. (71), e4425 (2013).
- Sitia, L., et al. Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax. Cells. 10 (2), 328 (2021).
- Bellini, M., et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells. Journal of Controlled Release. 196, 184-196 (2014).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nature Reviews Cancer. 20, 174-186 (2020).
- Dvořánková, B., Lacina, L., Smetana, K. Isolation of normal fibroblasts and their cancer-associated counterparts (CAFs) for biomedical research. Methods in Molecular Biology. 1879, 393-406 (2018).
- Calvo, F., Hooper, S., Sahai, E. Isolation and immortalization of fibroblasts from different tumoral stages. Bio-protocol. 4 (7), 1097 (2014).
- Sha, M., et al. Isolation of cancer-associated fibroblasts and its promotion to the progression of intrahepatic cholangiocarcinoma. Cancer Medicine. 7 (9), 4665-4677 (2018).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Zhen, Z., et al. Protein nanocage mediated fibroblast-activation protein targeted photoimmunotherapy to enhance cytotoxic T cell infiltration and tumor control. Nano Letters. 17 (2), 862-869 (2017).
- Ji, T., et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery. Advances Materials. 27 (11), 1865-1873 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved