Method Article
Isolamento de fibroblastos associados ao câncer primário de um modelo de murina síndica do câncer de mama para o estudo de nanopartículas-alvo
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo tem como objetivo fornecer um protocolo para o isolamento e cultura de fibroblastos primários associados ao câncer a partir de um modelo de murina síngênica de câncer de mama triplo-negativo e sua aplicação para o estudo pré-clínico de novas nanopartículas projetadas para atingir o microambiente tumoral.
Resumo
Os fibroblastos associados ao câncer (CAFs) são atores-chave no contexto do microambiente tumoral. Apesar de ter sido reduzido em número em comparação com as células tumorais, os CAFs regulam a progressão do tumor e fornecem proteção contra imunidade antitumoral. Estratégias anticancerígenas emergentes visam remodelar o microambiente tumoral através da ablação de CAFs pró-tumorigênicos ou reprogramação das funções dos CAFs e seu status de ativação. Uma abordagem promissora é o desenvolvimento de agentes de entrega nanosized capazes de atingir CAFs, permitindo assim a entrega específica de medicamentos e moléculas ativas. Neste contexto, um modelo celular de CAFs pode fornecer uma ferramenta útil para triagem in vitro e investigação preliminar de tais nanoformulações.
Este estudo descreve o isolamento e a cultura dos CAFs primários do modelo síngênico 4T1 murine de câncer de mama triplo-negativo. Contas magnéticas foram usadas em um processo de separação em 2 etapas para extrair CAFs de tumores dissociados. O controle de imunofenofoteping foi realizado utilizando-se a citometria de fluxo após cada passagem para verificar o rendimento do processo. CaFs isolados podem ser empregados para estudar a capacidade de segmentação de diferentes nanoformulações projetadas para combater o microambiente tumoral. Nanocages de H-ferritin fluorescentes foram usadas como nanopartículas candidatas para configurar o método. Nanopartículas, nuas ou conjugadas com ligante de alvo, foram analisadas para sua vinculação aos CAFs. Os resultados sugerem que a extração ex vivo de CAFs mamários pode ser um sistema útil para testar e validar nanopartículas para o direcionamento específico de CAFs tumorigênicos.
Introdução
Durante as últimas décadas, ficou claro que matar células tumorais geralmente não é suficiente para erradicar a malignidade, pois o microambiente tumoral pode provocar recaída tumoral e induzir resistência terapêutica1,2. Em seguida, surgiu um novo paradigma: direcionar o estroma tumoral para privar o tumor de fatores de apoio e, assim, aumentar a eficácia da quimioterápica3,4,5. Em particular, os fibroblastos associados ao câncer (CAFs) são um alvo estromacal interessante em muitos tumores sólidos6,7. Os CAFs são um grupo muito heterogêneo de células que interagem com células cancerosas e células do sistema imunológico através da secreção de fatores de crescimento, citocinas e quimiocinas; construir e remodelar a matriz extracelular; e permitir a formação de metástase8,9,10,11,12. Dependendo do tipo de tumor, os CAFs apresentam funções pró-tumorigênicas, enquanto outros subtipos de CAFs parecem ter funções supressivas de tumor13,14. Para esclarecer melhor essa dicotomia, é importante uma caracterização completa dos CAFs de tumores primários e metastáticos.
Nesse contexto, um campo emergente de pesquisa tem focado no desenvolvimento de agentes nanosized projetados para atingir e/ou destruir CAFs, fornecendo moléculas ativas e drogas capazes de remodelar o microambiente tumoral15,16,17,18. Vários tipos de nanopartículas foram projetadas para alcançar a ablação do CAF por meio de drogas citotóxiximicas, para induzir a terapia fotodinâmica direcionada ao CAF, ou para reprogramar CAFs revertendo-os para um estado quiescente ou induzindo a apoptose induzida pela TNF, expressão de ligante induzida pela Apoptose, que induz a apoptose das células cancerígenas vizinhas16,19. Além disso, o potencial de muitas nanopartículas para atingir ativamente marcadores biológicos específicos dá origem à esperança de selecionar subconjuntos da CAF para atingir. Embora sua especificidade absoluta para o CAF ainda seja questionada, a proteína de ativação do fibroblasto (FAP) é um dos alvos mais promissores do estroma pró-tumorigênico e é explorada para orientar a entrega de nanodrogas, pavimentando assim o caminho para o desenvolvimento da nanoterapêutica direcionada ao CAF20,21,22.
Este artigo descreve o isolamento dos CAFs primários de um modelo síngênico de câncer de mama murina e relata seu uso no estudo da capacidade de segmentação de nanopartículas projetadas para reconhecer o marcador CAF, FAP. As nanocagens de ferritina são usadas como nanosistemas candidatos para configurar o método, pois sua especificidade de entrega pode ser moldada pela exposição superficial de moieties de alvo23,24. Além disso, os ferritins têm sido comprovados com sucesso como excelentes transportes biocompatíveis para aplicações antitumorais, desencadeando o rápido acúmulo da carga na massa tumoral25,26,27. Até o momento, estudos pré-clínicos de nanosistemas direcionados ao CAF envolveram testes in vitro em linhas celulares de fibroblasto estimulados na cultura com a transformação do fator de crescimento-beta para induzir a ativação celular e a expressão de algumas características imunofenópicas dos CAFs28,29. Este método é geralmente aplicado a linhas celulares imortalizadas (como NIH3T3, LX-2) e é bastante rápido e simples, produzindo células ativadas em poucas horas ou dias. Uma limitação é que, embora a estimulação in vitro induz a expressão de alguns genes atribuídos a miofibroblasts ativados, não pode recapitular inteiramente todas as características biológicas dos CAFs reais, especialmente sua heterogeneidade in vivo.
Outra estratégia envolve a extração de CAFs primários de amostras de tumor humanos ou camundongos30,31. Isso garante que a ativação do CAF ocorra em um contexto fisiológico, e que a heterogeneidade das subpopulações do CAF seja mantida. De acordo com o objetivo da pesquisa, os CAFs podem ser derivados de diferentes fontes, oferecendo assim a possibilidade de estudar a condição mais confiável. O protocolo aqui relatado seria valioso para cientistas que buscam realizar uma avaliação preliminar da funcionalidade de novas nanopartículas projetadas para atingir CAFs de um modelo de câncer de mama murina. CAFs isolados seriam úteis para o rastreamento dessas nanopartículas que são promissoras o suficiente para proceder à avaliação in vivo em modelos animais de câncer. Isso será relevante durante os primeiros passos da produção de nanopartículas, levando os nanotecnólogos para o refinamento do design de nanopartículas, considerando principalmente a estratégia de imobilização de ligantes e para alcançar propriedades de mira ideais.
Protocolo
1. Estabelecer um modelo síngênico 4T1 de câncer de mama
NOTA: O presente protocolo descreve o isolamento dos CAFs primários de um tumor de mama 4T1 do rato. O estudo em animais descrito aqui foi aprovado pelo Ministério da Saúde italiano (aut. número 110/2018-PR).
- Cultura e implantação de células tumorais
- Degelo 1 × 106 células 4T1-luc em um frasco T75 com 10 mL de Roswell Park Memorial Institute (RPMI) 1640 médio suplementado com 10% de soro bovino fetal (FBS), 1% penicilina/estreptomicina (P/S) e 1% L-glutamina. Adicionar agente de remoção mycoplasma (1:100) no meio de cultura.
NOTA: As células 4T1-luc expressam a luciferase e podem ser visualizadas por bioluminescência (BLI) mediante a estimulação adequada com D-luciferina. Isso permite o monitoramento in vivo da viabilidade e proliferação de células tumorais após a implantação em camundongos (Figura 1). - Mantenha as células a 37 °C e 5% de CO2 em uma atmosfera umidificada até ~80% de confluência, mudando o meio a cada 2 dias.
NOTA: Continue o tratamento com o agente de remoção de Mycoplasma por 1 semana (~2/3 passagens) antes da injeção em camundongos para garantir que as células injetadas sejam livres de micoplasma. - No dia do procedimento, destache as células usando 1 mL de solução de ácido extraacético trippsin-etilenodiaminete (EDTA) (trypsin 1:250) por 5 min a 37 °C. Pare a atividade de trippsina adicionando meio de cultura, conte as células com azul trypan (1:1) e calcule o número de células/mL.
- Pipeta o volume correspondente a 1 × 106 células e centrífuga por 5 min a 400 × g. Despeje o supernasce e resuspense a pelota em 1 mL de meio base RPMI 1640. Mantenha as células no gelo até ficar pronto para a injeção.
NOTA: Para cada rato, são necessárias 1 ×10 5 células; no entanto, calcule sempre para um excesso de 2 camundongos (correspondente a 2 × 105 células) para facilitar o carregamento da seringa. - Um dia antes da operação, raspe a pele de 8 camundongos BALB/c (fêmeas, de sete semanas) para expor a área das glândulas mamárias abdominais do lado direito. Use uma máquina de barbear elétrica e aplique uma fina camada de creme depilatório por 4 min; em seguida, lave o creme com água e um pedaço de papel.
- Induzir anestesia por inalação contínua de 2% de gás isoflurane por ~5 min, e realizar uma injeção subcutânea na região das glândulas mamárias abdominais com uma seringa de tuberculina de 27 G. Gire a agulha para cima para entrar na pele subcutânea; em seguida, segure a pele para cima e injete lentamente 100 μL de suspensão celular (1 × 105 células). Gire levemente a agulha antes de retrair lentamente a seringa.
NOTA: Lembre-se de levar a suspensão da célula à temperatura ambiente 15 minutos antes da injeção.
- Degelo 1 × 106 células 4T1-luc em um frasco T75 com 10 mL de Roswell Park Memorial Institute (RPMI) 1640 médio suplementado com 10% de soro bovino fetal (FBS), 1% penicilina/estreptomicina (P/S) e 1% L-glutamina. Adicionar agente de remoção mycoplasma (1:100) no meio de cultura.
- Crescimento e dissecção do tumor
- Aos 5 dias após a injeção de células, injete 150 mg/kg D-luciferin intraperitoneally (100 μL) 5 min antes da imagem. Capture imagens BLI usando um sistema de imagem in vivo configurando exposição de 10 s, binning médio e f/stop às 4. Defina a área luminescente do tumor como a região de interesse (ROI) e quantifique o sinal total no ROI (fóton/seg/m2) utilizando software de imagem.
- Repita o procedimento de imagem (1.2.1) a cada 5 dias a partir da injeção para monitorar o crescimento do tumor em termos de aumento da BLI.
- Para estabelecer o volume do tumor, segure o rato e exponha sua barriga. Use pinças para medir o comprimento do tumor (L) e largura (W) uma vez por semana. Calcule o volume do tumor (V) usando a equação 1.
[V = (L x W2)/2] (1) - Aos 20 dias após a injeção de células, sacrifique os animais por luxação cervical, dissocia os tumores da pele com uma tesoura e colete-os em uma solução de armazenamento de tecidos (veja a Tabela de Materiais).
NOTA: As amostras tumorais podem ser usadas imediatamente para dissociação em células únicas (seção 2) ou armazenadas a 4 °C por até 48 h.
2. Dissociação tumoral em células únicas
NOTA: Para as seguintes etapas, use reagentes estéreis e descartáveis em uma coifa de fluxo laminar. Trabalhar com 4 tumores de cada vez.
- Coloque a amostra de tumor em uma placa de Petri, e remova cuidadosamente qualquer fragmento de pele, gordura e áreas necrosas com a ajuda de pinças e bisturi. Em seguida, reduza o tumor em pequenos pedaços de aproximadamente 1-2 mm e transfira-os para um tubo(Figura 2A).
NOTA: Os tumores 4T1 tornam-se altamente necrosos enquanto crescem, com tendência à ulceração. É importante remover cuidadosamente as áreas necróticas para evitar qualquer interferência dos detritos com os próximos passos. - Prepare uma mistura de digestão para dissociação tumoral: misture 2,35 mL de RPMI 1640 médio, 100 μL de enzima D, 50 μL de enzima R e 12,5 μL de enzima A. Mergulhe os fragmentos tumorais na solução e feche bem o tubo.
NOTA: Os volumes indicados de mix de digestão são válidos para tumores de até 1 g e podem ser ajustados para tumores maiores de acordo com seu peso. Os tumores 4T1 cultivados por 20 dias normalmente estão em uma faixa de 0,5-0,8 g. - Vire o tubo de cabeça para baixo, verificando se todos os pedaços do tumor estão na parte inferior do tubo em direção à tampa. Conecte o tubo a um dissociador mecânico na carcaça adequada e execute um programa de dissociação específico projetado para tumores resistentes (veja as instruções do fabricante).
NOTA: Podem ser necessários tubos especiais para encaixar no dissociador. Os tubos C carregam um rotor dentro da tampa para promover a dissociação mecânica do tecido. - Retire o tubo, mantenha-o de cabeça para baixo e incubar a amostra a 37 °C por 40 min com agitação suave. Em seguida, conecte o tubo ao dissociador na carcaça adequada e execute o seguinte programa específico de dissociação projetado para tumores resistentes duas vezes. Certifique-se de que não há grandes pedaços de tecido no final do procedimento(Figura 2B).
NOTA: Para dissociar o tumor, outros coquetéis enzimáticos poderiam ser usados para degradar a matriz extracelular. No entanto, neste protocolo, foi utilizado um kit de Dissociação tumoral comercialmente disponível contendo uma mistura de enzimas otimizada (enzimas D, R, A) e um dissociador semi-automatizado que dissocia mecanicamente o tecido. Essa combinação garantiu uma degradação adequada da matriz extracelular, juntamente com a manutenção da integridade celular e epítopos da superfície celular. - Filtre a amostra através de um coador de células de 40 μm em um tubo de 50 mL, lave o filtro com 10 mL de meio RPMI 1640 e centrifugar o tubo por 7 min a 300 × g. Se a pelota de célula parecer vermelha, eritrócitos de lise adicionando 1 mL de tampão de lise amônio-cloreto-potássio (ACK) por 5 minutos à temperatura ambiente, lave com 10 mL de RPMI 1640, transfira a suspensão celular em um tubo de 15 mL e centrífuga novamente.
- Resuspenque a pelota em 1 mL de tampão PBE composto por soro fisco tampão-de-fosfato (PBS), 0,5% de albumina de soro bovino (BSA) e 2 mM EDTA, e conte as células com azul trypan (1:1). No caso de aglomerados celulares, filtre a suspensão celular através de um coador de células de 70 μm, previamente encharcado com PBS.
NOTA: Especialmente quando os tumores são grandes, é importante verificar a contagem de células e, eventualmente, dividir cada amostra de tumor em diferentes tubos com no máximo10 7 células em cada tubo antes de proceder à etapa 2.7. - Prepare o tampão de ligação de remoção de células mortas diluindo a solução de estoque tampão de ligação de 20x (ver a Tabela de Materiais) com água estéril dupla destilada. Lave as células com 5 mL de tampão de ligação de 1×(Figura 2C).
NOTA: Mantenha o buffer a 4 °C. - Centrifugar por 7 min a 300 × g, e resuspensar a pelota celular com 0,1 mL de microesferas de remoção de células mortas (ver a Tabela de Materiais). Misture bem e incubar à temperatura ambiente por 15 minutos.
- Durante a incubação com contas, prepare um suporte magnético sob o capô e pendure colunas de separação ferromagnéticas (uma coluna para até10 7 células) com as pontas apontando para baixo. Equilibre as colunas com 0,5 mL de tampão de ligação de 1× frio. Espere até que a solução flua sob gravidade.
NOTA: É importante não exceder o número de células por coluna para evitar qualquer risco de coagulação do leito da coluna e redução do rendimento da recuperação. Ao trabalhar com mais de 107 células, ou usa mais colunas de acordo com o número total de células ou usa colunas maiores. Nesses casos, ajuste os volumes de reagentes descritos nas etapas a seguir às indicadas pelo fabricante. - Ao final da incubação, adicione 400 μL de tampão de ligação fria de 1× à suspensão da conta/célula, carregue todo o volume na coluna e colete o efluente (correspondente a células não rotuladas) em um tubo de 15 mL.
- Lave a coluna quatro vezes com 0,5 mL de tampão de ligação de 1× frio e colete o efluente total (correspondente à fração de célula viva) no mesmo tubo.
- Conte as células com azul trypan (1:1). Coloque 1 × 105 células em dois tubos para Fluorescência Ativada Destruturação celular (FACS), e mantenha-as a 4 °C até a validação do processo (ver etapa 4.1): use o primeiro tubo para definir os parâmetros de análise e as regiões de positividade (tubo de controle) e o outro para análise biomarcador (tubo amostra). Use as células restantes para extração de CAFs (ver seção 3).
NOTA: A remoção de células mortas é importante para reduzir reações não específicas com as microesferas na seção 3. No entanto, para melhorar o rendimento, evite a remoção de células mortas se a proporção de células mortas for <20%.
3. Extração de CAFs primários do tumor de mama
NOTA: Para a seção 3, use o kit de isolamento do fibroblasto associado ao tumor do camundongo contendo coquetel de esgotamento do fibroblasto não associado ao tumor e microesferas do fibroblasto associadas ao tumor adequados para rotulagem magnética das células (veja a Tabela de Materiais).
- Esgotamento de fibroblastos não associados ao câncer
- Umedeça um coador de células de 70 μm com PBS e filtre a suspensão da célula para remover qualquer aglomerado. Em seguida, centrifugar as células por 10 minutos a 300 × g e aspirar o supernante.
NOTA: Se um único tumor foi dividido em duas amostras para a etapa 2.7, acumule a suspensão celular dois a dois antes de prosseguir com a etapa 3.1.2. - Resuspenque a pelota em 80 μL de tampão PBE frio, e adicione 20 μL de Coquetel de Esgotamento do Fibroblasto Não Associado ao Tumor. Misture bem e incubar a 4 °C por 15 min no escuro.
- Durante a incubação com contas, prepare colunas de esgotamento ferromagnético (1 por amostra) em um suporte magnético e equilibre as colunas com 2 mL de tampão PBE frio. Espere até que a solução flua.
- No final da incubação, adicione 400 μL de tampão PBE frio à suspensão da conta/célula, carregue todo o volume na coluna e colete o efluente (correspondente a células não rotuladas) em um tubo de 15 mL.
- Lave a coluna duas vezes com 2 mL de tampão PBE frio e colete o efluente total no mesmo tubo. Centrifugar por 10 min a 300 × g e resuspend em 0,1 mL de tampão PBE frio.
NOTA: O esgotamento dos fibroblastos não associados ao câncer reduz drasticamente a quantidade total de células recuperadas. É geralmente necessário e recomendado reunir suspensões celulares de quatro amostras diferentes para obter uma pelota visível e células suficientes para a etapa 3.2. Isso garantirá um rendimento ideal. - Coloque 20 μL da suspensão celular em um tubo FACS e mantenha-o a 4 °C para validação do processo (ver seção 4). Use as células restantes para seleção de CAF (ver etapa 3.2).
- Umedeça um coador de células de 70 μm com PBS e filtre a suspensão da célula para remover qualquer aglomerado. Em seguida, centrifugar as células por 10 minutos a 300 × g e aspirar o supernante.
- Seleção positiva de fibroblastos associados ao câncer
- Adicione 20 μL de Microesferas fibroblastos associadas ao tumor a 80 μL de suspensão celular. Misture bem e incubar a 4 °C por 15 min no escuro.
- Durante a incubação com contas, prepare colunas de separação ferromagnética (1 por amostra) em um suporte magnético e equilibre as colunas com 0,5 mL de tampão PBE frio. Espere até que a solução flua.
- No final da incubação, adicione 400 μL de tampão PBE frio à suspensão da conta/célula, carregue todo o volume na coluna e deixe as células sem rótulo fluir em um tubo de 15 mL.
- Lave a coluna três vezes com 0,5 mL de tampão PBE frio e colete o efluente total no mesmo tubo.
NOTA: O fluxo contém células CD90.2-negativas não rotuladas, que podem ser descartadas como fibroblastos não associados ao câncer. - Remova a coluna do ímã e coloque-a em um tubo de 1,5 mL. Adicione 1 mL de PBE frio na coluna e empurre imediatamente o êmbolo para dentro da coluna para lavar as células.
- Centrifugar por 10 min a 400 × g e resuspend em 0,1 mL de tampão PBE frio. Coloque 20 μL de suspensão celular em um tubo FACS e mantenha-o a 4 °C para validação do processo (ver seção 4).
NOTA: Após a centrifugação, a pelota pode ser pouco visível, especialmente quando os tumores originais são pequenos. Use tubos cônicos de centrífugas inferiores e tenha cuidado para não perder nenhuma célula ao aspirar o supernante. - Diluir as células restantes em um volume apropriado do Médio de Águia Modificada (DMEM)/F-12 de Ham de Dulbecco complementado com 15% de FBS, 2 mM L-glutamina, 1% P/S e 1% aminoácidos não essenciais, e semear as células em uma placa de cultura tecidual.
- Verifique a densidade celular sob um microscópio e coloque a placa em uma incubadora a 37 °C e 5% de CO2 para que as células aderam e cresçam.
NOTA: Se as células forem muito densas, divida imediatamente a suspensão celular em dois poços da placa de cultura tecidual antes de colocar a placa na incubadora.
4. Validação do processo
- Citometria de fluxo
NOTA: A seção 4.1 não requer condições estéreis e pode ser realizada fora do capô laminar. Realizar a seção 4.1 em paralelo para amostras coletadas na etapa 2.11 (tumor dissociado), etapa 3.1.6 (após esgotamento de fibroblastos não associados ao câncer) e etapa 3.2.6 (após enriquecimento de fibroblastos associados ao câncer).- Centrifugar os tubos FACS preparados nas etapas 2.11, 3.1.6 e 3.2.6 por 10 min a 300 × g. Descarte o supernatante.
NOTA: Prepare pelo menos um tubo adicional, que contém células não manchadas atuando como um controle para definir os parâmetros para análise. - Em tubos de amostra, células resuspendas em 88 μL de PBE, e adicionar 2 μL de anticorpo anti-CD45 conjugado com isothiocianato fluoresceína (FITC, diluição 1:50, de acordo com as instruções do fabricante) e 10 μL de anticorpo anti-CD90.2 conjugado com ficoerticrina (PE, diluição 1:10, de acordo com as instruções do fabricante). Misture bem e incubar por 10 min a 4 °C no escuro. No tubo de controle (não manchado), resuspend células em 100 μL de PBE. Incubar por 10 min a 4 °C no escuro para replicar o procedimento seguido de células manchadas de anticorpos.
NOTA: A temperatura e o tempo de incubação devem ser verificados cuidadosamente, pois uma variação nessas variáveis pode resultar em manchas ruins ou não específicas, alterando assim os resultados. - Após completar a etapa de incubação, realize uma lavagem adicionando 1 mL de PBE. Centrifugar por 10 min a 300 x g. Descarte o supernatante.
- Células resuspend (todos os tubos) em 500 μL de PBS.
- Misture bem e prossiga com a análise de citometria de fluxo. Defina os canais para medir a fluorescência dos anticorpos (ou seja, FITC e PE).
- Do tubo de controle, selecione todas as células viáveis desenhando um primeiro portão (P1) no gráfico de dispersão Para Frente versus Lado (FSC vs SSC). Dentro de P1, defina um segundo portão (P2) compreendendo apenas células individuais.
- Utilizando os canais específicos de fluorescência dos anticorpos (ou seja, FITC e PE), defina portões adequados para discernir células manchadas positivamente.
- Inicie a análise e regise pelo menos 10.000 eventos em P2. Leia sinais de ambos os canais simultaneamente.
NOTA: Se o número total de células for menor do que o esperado, pode ser preferível ler todo o tubo. - (OPCIONAL) Se for programada uma coloração adicional com anticorpos/fluoroforos adicionais, defina uma matriz de compensação adequada antes de iniciar a análise.
- Centrifugar os tubos FACS preparados nas etapas 2.11, 3.1.6 e 3.2.6 por 10 min a 300 × g. Descarte o supernatante.
- Monitoramento da morfologia celular e características
NOTA: Uma vez semeadas, as células devem ser manuseadas em condições estéreis.- No dia seguinte à semeadura, visualize as células sob um microscópio óptico para verificar a adesão celular e a morfologia. Aspire o supernaste e substitua por meio fresco.
NOTA: Os CAFs são grandes células em forma de fuso, que podem ser facilmente distinguidas da estrutura epitelial das células tumorais 4T1. - Mantenha as células a 37 °C e 5% de CO2 em uma atmosfera umidificada, mudando o meio a cada 2 dias.
- Quando as células atingem ~80% de confluência (aproximadamente 4-6 dias após a semeadura), desprendem as células usando a solução TrypLE Select (ver a Tabela de Materiais) por 5 minutos à temperatura ambiente. Adicione meio fresco (4:1), centrifugar a suspensão celular a 400 × g por 5 min, e resuspensar a pelota em meio fresco.
- Divida as células 1:2, e expanda a cultura até que o número de células necessárias para o experimento seja obtido.
- Em cada passagem, verifique a morfologia celular e o crescimento sob um microscópio óptico. Se a morfologia celular não for homogênea (por exemplo, clones de pequenas células de forma redonda que aparecem na cultura), analise uma amostra de células por citometria de fluxo, conforme descrito na seção 4.1. Se homogêneo, prossiga para a etapa 4.2.7.
NOTA: Mudanças na morfologia celular podem indicar contaminação por fibroblastos não associados ao câncer, que precisam ser removidos para garantir a pureza da cultura. - Analisar os resultados da citometria de fluxo e proceder de acordo com um dos seguintes cenários: (i) se ocorrer contaminação das células CD90.2/CD45, coletar todas as células e repetir a seleção positiva seguindo o passo 3.2; (ii) se a contaminação das células CD45+ também ocorrer, coletar todas as células e repetir o esgotamento na etapa 3.1; (iii) se não ocorrer contaminação (apenas células CD90.2+/CD45- estão presentes), mantenha as células em cultura e prossiga diretamente para 4.2.7.
NOTA: Como repetir o processo de esgotamento com microesferas reduzirá a recuperação celular, é recomendado apenas quando as células não precisam ser usadas imediatamente. - Conte as células com azul trypan (1:1), coloque 5 × 105 células em dois tubos FACS, e centrífuga por 10 min a 300 × g. Descarte o supernasciente e resuspenque a pelota em 0,5 mL de tampão de bloqueio (PBS complementado com 2% de BSA, 2% soro de cabra) por 15 minutos à temperatura ambiente.
NOTA: Um tubo atua como um controle constituído apenas por células não manchadas, enquanto as células do segundo tubo serão manchadas para análise de citometria de fluxo. - Centrifugar por 10 min a 300 × g, descartar o supernatante e resuspend em 99 μL de tampão de bloqueio. Adicione 1 μg de anticorpo anti-FAP ao tubo de amostra e 1 mL de tampão de bloqueio ao tubo de controle. Misture bem e incubar por 15 minutos à temperatura ambiente.
NOTA: Fap é um marcador superficial de estroma tumora reativa e pode ser usado para identificar e caracterizar CAFs. - Lave três vezes com PBS, centrífuga e incubar com o anticorpo secundário apropriado conjugado com um corante fluorescente (1 μg) no tampão de bloqueio por 15 minutos à temperatura ambiente.
- Lave três vezes com PBS e analise por citometria de fluxo (siga os passos 4.1.5 a 4.1.7 definindo o canal apropriado para detectar o fluorohore usado). Em seguida, use as células para experimentos (passo 5.2).
- (OPCIONAL) Congelar uma amostra de células em 1 mL de 90% FBS e 10% de sulfóxido de dimetil (DMSO); armazenar a -80 °C para uso posterior.
- No dia seguinte à semeadura, visualize as células sob um microscópio óptico para verificar a adesão celular e a morfologia. Aspire o supernaste e substitua por meio fresco.
5. CAFs alvo de nanopartículas de ferritina projetadas
NOTA: Uma variante recombinante da cadeia pesada de ferritina humana (HFn) foi usada como nanopartícula nua ou foi conjugada com moieties de alvo. Aqui, as nanopartículas HFn funcionalizadas com a porção variável de um anticorpo anti-FAP (Fab@FAP) foram preparadas pelo NanoBioLab da Universidade de Milão-Bicocca em duas relações HFn:Fab@FAP molar, 1:1 e 1:5, de acordo com um protocolo descrito anteriormente32.
- Rotulagem fluorescente de nanopartículas HFn
NOTA: As nanocagens HFn nuas e funcionalizadas são fluorescentes rotuladas com FITC.- Dissolva o pó FITC em 99% de etanol para obter uma concentração de 2 mg/mL.
NOTA: Esta solução deve ser preparada recentemente. - Incubar 50 μL da solução preparada (200 μg de FITC) para cada 1 mg de proteína (ou seja, 100 μL de HFn a 10 mg/mL). Adicione 50 μL de 1 M de bicarbonato de sódio (NaHCO3),e ajuste o volume para 500 μL com 0,1 M NaHCO3.
NOTA: Aumente os volumes de acordo com as necessidades experimentais. - Incubar a mistura de reação à temperatura ambiente, no escuro, e com agitação contínua por 1h.
- Remova o excesso de FITC do conjugado por filtragem de gel usando uma coluna de dessecação de spin (7 kDa MWCO).
- Avalie a concentração da proteína rotulada recuperada usando um espectotômetro. Estimar quantidades de proteína e corante medindo a absorvância a 280 nm e a 488 nm, respectivamente.
- Dissolva o pó FITC em 99% de etanol para obter uma concentração de 2 mg/mL.
- Vinculação de nanopartículas HFn aos CAFs
NOTA: Use CAFs de no máximo as passagens 4-5 na cultura.- Coloque 5 × 105 células em cada tubo FACS, centrífuga por 10 min a 300 × g, e resuspendido em 0,5 mL de PBS, 0,3% BSA complementado com 0,1 mg/mL das diferentes preparações de nanopartículas (HFn nua, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) previamente rotulado com FITC.
NOTA: Execute cada condição em triplicado. Prepare um tubo adicional como uma amostra de controle sem rótulo para a qual não são adicionadas nanopartículas. - Incubar por 2h a 4 °C no escuro, centrífuga e lavar três vezes em PBS.
- Células resuspend com PBS de 0,5 mL, misturam bem e analisam por citometria de fluxo. Defina os canais para medir a fluorescência do FITC.
- Depois de gating em células individuais ao vivo, adquira 20.000 eventos. Use o tubo de controle sem rótulo para definir o portão de positividade FITC e obter a porcentagem de eventos FITC+ (correspondente à ligação de nanopartículas).
- Coloque 5 × 105 células em cada tubo FACS, centrífuga por 10 min a 300 × g, e resuspendido em 0,5 mL de PBS, 0,3% BSA complementado com 0,1 mg/mL das diferentes preparações de nanopartículas (HFn nua, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) previamente rotulado com FITC.
6. Análise estatística e replicações experimentais
- Animais
- Realizar três experimentos independentes de crescimento tumoral e isolamento de CAFs, utilizando 8 animais por único experimento, conforme descrito em 1,1,5. Para otimizar o rendimento de isolamento dos CAFs, divida os tecidos excisados em subgrupos (n=4) e processe-os, seguindo as etapas descritas na seção 2.
- Interação do HFn com células
- Avalie a interação do HFn funcionalizado e não funcionalizado com células-alvo e não-alvo (CAFs e 4T1, respectivamente) em termos do percentual de células manchadas positivamente por nanocagens fluorescentes rotuladas. Relatar os resultados como ± desvio padrão médio de três experimentos independentes.
- Análise estatística
- Para calcular a significância estatística em experimentos de ligação celular com HFn e HFn-FAP, use o teste ANOVA unidirecional comum.
Resultados
Configuração do modelo in vivo para o isolamento ideal dos CAFs
A injeção de 10 células 4T1-luc na almofada de gordura mamária de camundongos BALB/c fêmeas leva ao crescimento de uma massa tumoral detectável em 5 dias após a implantação. Medindo o volume do tumor por pinças e a viabilidade da célula tumoral pela BLI, o crescimento do tumor foi monitorado por um mês após a implantação. Para encontrar uma janela de sacrifício adequada para o isolamento dos CAFs, foi buscado um comprometimento ideal entre maior tamanho do tumor e BLI por um lado e uma ulceração e necrose tumoral emergentes por outro lado(Figura 1). Como um núcleo necrosado aparece 20 dias após a implantação, e aumenta aos 25 e 30 dias (conforme documentado pelas imagens bli na Figura 1C), o dia 20 foi definido como o ponto de tempo para otimizar a recuperação celular após o processo de isolamento. Mesmo depois de remover cuidadosamente todas as áreas necróticas visíveis durante os primeiros passos do tratamento do tumor ex vivo,uma alta porcentagem de células mortas foi encontrada no final da dissociação em células únicas(Tabela 1). Como esse percentual pode ser relevante, especialmente com o aumento do tamanho do tumor, a remoção de células mortas é sempre necessária ao trabalhar com o modelo 4T1.
Otimização do procedimento de isolamento, cultura e caracterização dos CAFs
Mais duas passagens são necessárias para isolar a população de CAFs (CD90.2+ CD45-) do painel de células viáveis coletadas: o esgotamento de fibroblastos não associados ao tumor e o enriquecimento de fibroblastos associados ao tumor(Figura 2). O coquetel de contas de esgotamento remove eficientemente células CD45+ (representando 67,35% e 0,69% do total de células pré e pós-esgotamento, respectivamente, Tabela 2), e sempre foi usado para processar um único tumor em cada coluna. Como mostrado na Tabela 1, o número de células elucidadas caiu de uma média de 3 × 106 para 1 × 105 após a etapa de esgotamento. Devido a essa diminuição maciça no número total de células, é conveniente juntar as células coletadas de pelo menos 2 a um máximo de 4 tumores em um único tubo antes de prosseguir com a etapa de enriquecimento. Ao fazê-lo, obteve-se um número adequado de células para incubação com contas fibroblastos associadas ao tumor e passou por uma única coluna de separação para obter uma média final de 93% do CD90,2+ CD45- células(Tabela 2).
Uma vez semeadas em placas de cultura tecidual, essas células recuperadas se conectaram ao plástico e revelaram uma grande morfologia em forma de fuso típica de fibroblastos(Figura 3A, B) e diferente das células tumorais 4T1(Figura 3D). Não juntar tumores após o esgotamento faz com que o rendimento celular com microesferas fibroblastos associadas ao tumor seja muito baixo para estabelecer uma cultura. Em outros casos, quando a duração e a temperatura das incubações com microesferas não são cuidadosamente mantidas, algumas ligações não específicas podem ocorrer. Nesses casos, as etapas de enriquecimento foram menos eficientes e maiores percentuais de CD90.2- CD45+ e CD90,2- CD45- células foram recuperadas juntamente com as células CD90.2+ CAFs (5,97 ± 1,5 e 16,75 ± 1,1, respectivamente) (Figura 4 e Tabela 3). Essas células contaminantes provavelmente seriam responsáveis pela presença na cultura de pequenos clones com diferentes morfologias(Figura 4B, pontas de flecha preta) que cresceram mais rápido que os CAFs e prevaleceram sobre a cultura primária do CAF(Figura 4C). Esses resultados subótimos confirmaram a importância de sempre verificar duas vezes tanto a expressão CD90.2 quanto a CD45, bem como a morfologia celular no final do processo de enriquecimento e durante o crescimento celular na cultura.
Uso de células isoladas para avaliar o potencial de segmentação do CAF de nanodrogas projetadas
Os CAFs recém-isolados podem ser usados para várias aplicações que vão desde pesquisas básicas até estudos farmacológicos. O objetivo deste grupo é desenvolver nanocagens HFn que possam especificamente atingir CAFs. O HFn foi funcionalizado com um fragmento de anticorpo anti-FAP específico (HFn-FAP) em duas diferentes proporções de proteínas:anticorpos (uma menor 1:1 e um 1:5 maior), e sua ligação com CAFs foi testada. Como o FAP foi utilizado como biomarcador superficial de CAFs pró-tumorigênicos, foi de fundamental importância verificar a expressão fap em CAFs isolados(Figura 3C). A expressão fap foi seguida ao longo de 5 passagens na cultura para confirmar que a cultura principal do CAF manteve suas características originais.
A funcionalidade fap no HFn foi encontrada para contribuir para uma mudança significativa em relação à segmentação do CAF em comparação com a HFn nua, e a menor quantidade de anticorpos (1:1) foi suficiente para observar esse efeito(Figura 5A). No entanto, isso não foi observado com as células tumorais 4T1 utilizadas para configurar o modelo de tumor in vivo, onde hfn nu mostrou maior ligação do que hfn funcionalizado (Figura 5B). Isso provavelmente deveu-se à ausência de superexpressão fap em células 4T1 e à interação preferencial do HFn com o TfR1, que regula a absorção de HFn nas células, conforme amplamente relatado por este grupo27,33. Esses resultados confirmam a utilidade do uso de culturas primárias de CAFs mamários para examinar preliminarmente a capacidade de segmentação de nanopartículas projetadas para combater o microambiente tumoral.
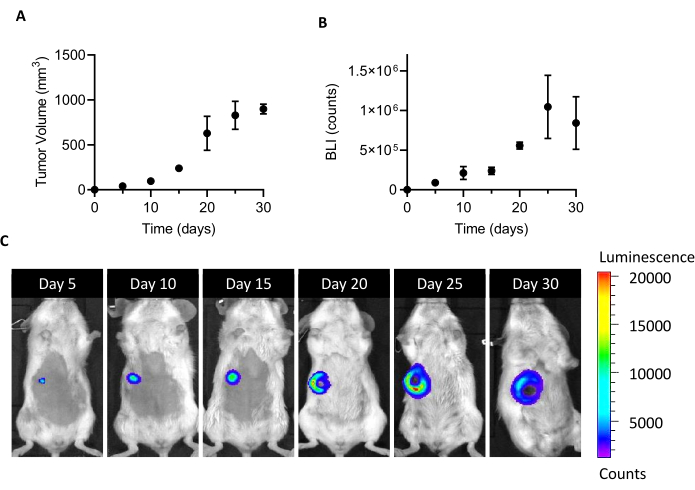
Figura 1: Estabelecimento do modelo de tumor 4T1. As células (105 células/camundongos) foram injetadas na almofada de gordura mamária. O crescimento tumoral foi acompanhado nos dias 5, 10, 15, 20, 25 e 30 após a implantação (A) medindo o volume do tumor com pinças e (B) por bioluminescência por imagem. Os volumes tumorais e bli são expressos como mm3 e conta, respectivamente. Os resultados são relatados como média ± SEM (n=6). (C) Imagens representativas da BLI obtidas 5, 10, 15, 20, 25 e 30 dias após a implantação celular confirmam o crescimento do tumor até o dia 25, quando parece atingir um platô. No último ponto de análise (30 dias), o BLI não aumenta em relação ao dia 25. A partir do dia 20, áreas de necrose e ulceração começam a se tornar visíveis na parte central do tumor. Escala de cores: Min = 1.194, Max = 20.462. Abreviaturas: BLI = bioluminescência por imagem; SEM = erro padrão da média. Clique aqui para ver uma versão maior desta figura.
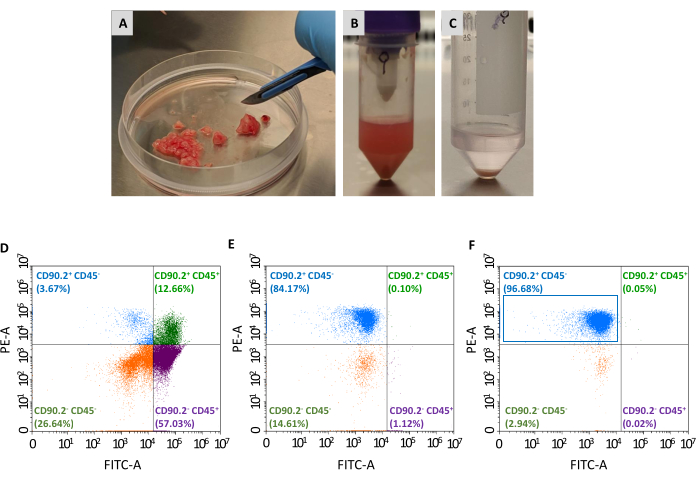
Figura 2: Preparação da amostra de tumores e caracterização da citometria de fluxo de CAFs isolados. Os tumores foram extirpados e reduzidos em (A) pequenos pedaços de aproximadamente 1-2 mm com a ajuda de um bisturi; (B) suspensão celular única após digestão tecidual e dissociação mecânica de um tumor excisado; (C)pelota celular obtida após a lise dos glóbulos vermelhos; (D) análise da citometria de fluxo da expressão CD45 e CD90.2 em células obtidas após a remoção de glóbulos vermelhos e células mortas, (E) após esgotamento de fibroblastos não associados ao câncer, e (F) após o enriquecimento de fibroblastos associados ao câncer, onde a maioria das células são CD90.2+ CD45- (retângulo azul). Abreviaturas: CAFs= fibroblastos associados ao câncer; CD = cluster de diferenciação; PE-A = área de ficoerthrina; FITC-A = áreas de isocitonato de fluoresceína. Clique aqui para ver uma versão maior desta figura.
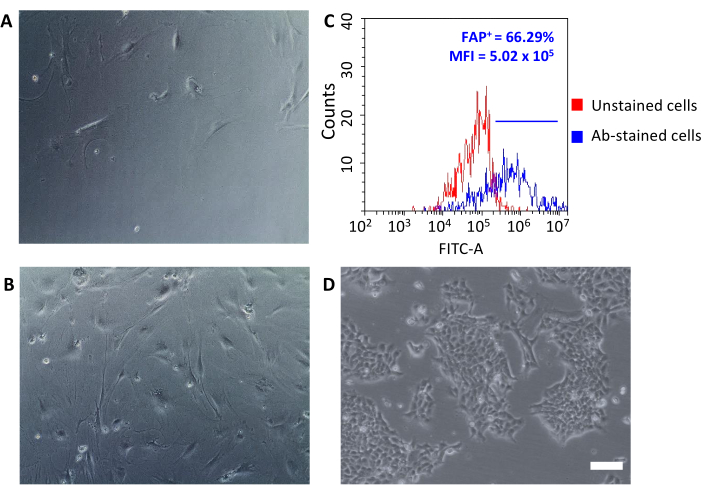
Figura 3: A análise morfológica da expressão CAF e FAP. (A, B) A morfologia dos CAFs foi verificada em todas as passagens da cultura por microscopia óptica (diferentes níveis de confluência na passagem 2 e passagem 5) e comparada com (D) células tumorais 4T1; barras de escala = 10 μm. (C) A expressão da proteína de ativação do fibroblasto (FAP) foi avaliada pela citometria de fluxo no final do processo de isolamento nascélulas CD90.2+ CD45 coletadas para confirmar suas características moleculares. Um limiar de fluorescência foi definido em células de controle não manchadas (gráfico vermelho) para quantificar a intensidade média de fluorescência e a porcentagem de células positivas (FAP+) entre células manchadas de anticorpos (gráfico azul). Abreviaturas: CAFs= fibroblastos associados ao câncer; FAP = proteína de ativação do fibroblasto; CD = cluster de diferenciação; MFI = intensidade média de fluorescência; Ab = anticorpo; FITC-A = área de isocitonato de fluoresceína; FAP+ = Células FAP-positivas. Clique aqui para ver uma versão maior desta figura.

Figura 4: Exemplo de um processo de isolamento de CAFs sub-ideal. (A) Avaliação da citometria de fluxo após a etapa final de isolamento revelou a presença de células de CD90.2- CD45+ e CD90.2- CD45- . (B) Essas células podem ser vistas como clones com pequena morfologia redonda ao semear (pontas de flecha preta e entrada no canto inferior esquerdo do painel) que (C) prevaleceu sobre CAFs após a terceira passagem na cultura. Barras de escala = 10 μm. Abreviaturas: CAF = fibroblasto associado ao câncer; CD = cluster de diferenciação; PE-A = área de ficoerthrina; FITC-A = áreas de isocitonato de fluoresceína. Clique aqui para ver uma versão maior desta figura.
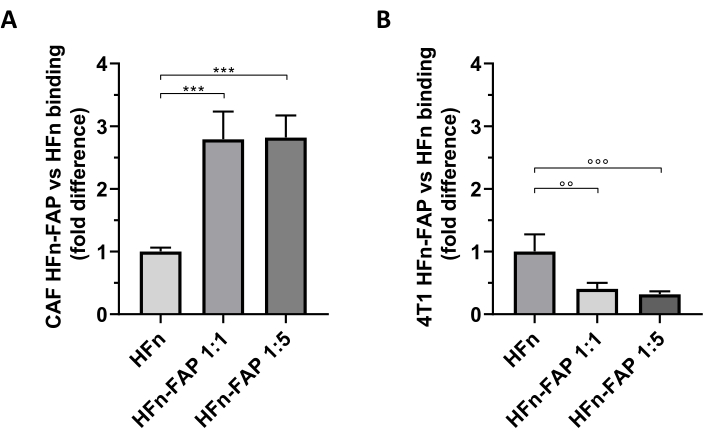
Figura 5: Ligação de nanocagens HFn em CAFs e 4T1. As nanocágens HFn foram rotuladas fluorescentemente com FITC, funcionalizadas com um fragmento de anticorpo anti-FAP (HFn-FAP) em duas diferentes relações proteína-anticorpos (1:1 e 1:5), e incubadas com (A) células alvo e (B) 4T1 a 4 °C por 2 h. A vinculação foi avaliada por citometria de fluxo. (A) A ligação HFn-FAP com CAFs é significativamente aumentada em ambas as concentrações de fragmentos de anticorpos em três vezes em comparação com hfn. (B) nua em contraste, uma ligação significativamente maior de HFn nua foi observada em células 4T1, onde a vinculação não é aprimorada pelo reconhecimento fap. Os resultados são relatados como ± desvio padrão médio de três experimentos independentes. p = 0,0003; °° p = 0,0021 ; °°° p = 0,0008. Abreviaturas: CAFs= fibroblastos associados ao câncer; FAP = proteína de ativação do fibroblasto; HFn = variante recombinante da cadeia pesada de ferritina humana usada como nanopartícula nua ou conjugada; HFN-FAP = Nanopartículas HFn funcionalizadas com a porção variável de um anticorpo anti-FAP preparado a duas razões molar de HFn:Fab@FAP, 1:1 e 1:5. Clique aqui para ver uma versão maior desta figura.
| Número de celular (± médio SD) | Total de rendimento de extração (por passagem) | |
| Tumor excisado (Remoção pós-glóbulos vermelhos) | 1.27 x 108 ± 9,81 x 107 | 100% |
| Tumor excisado (Remoção de células mortas) | 3.01 x 106 ± 9,61 x 105 | 2.38% |
| Coquetel pós esgotamento | 1.15 x 105 ± 4,95 x 104 | 0.11% (3.82%) |
| Pós enriquecimento | 3,00 x 104 ± 1,2 x 104 | 0.027% (26.09%) |
Tabela 1: Contagem total de células após cada etapa de isolamento de fibroblastos associados ao câncer.
| Distribuição celular (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| Tumor excisado (Remoção de células mortas) | 1,81 ± 0,98 | 10.78 ± 4.51 | 56.57 ± 14.05 | 28.20 ± 17.57 |
| Coquetel pós esgotamento | 69.33 ± 16.75 | 0.14 ± 0.13 | 0,55 ± 0,63 | 39.89 ± 30.31 |
| Pós enriquecimento | 93.14 ± 3.3 | 0.09 ± 0.1 | 0.09 ± 0.08 | 6.69 ± 3.4 |
Tabela 2: Distribuição celular de acordo com a expressão de CD90.2 e CD45 após cada passagem de isolamento de fibroblastos associados ao câncer.
| Distribuição celular (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| Pós Enriquecimento (sem pooling) | 75.80 ± 2.9 | 1.49 ± 0.4 | 5.97 ± 1.5 | 16.75 ± 1.1 |
Tabela 3: Expressão CD90.2 e CD45 de células coletadas após um experimento de isolamento fibroblasto associado ao câncer sub-ideal.
Discussão
Os CAFs estão emergindo como atores-chave na remodelação da matriz extracelular, promovendo a progressão da metástase e limitando o acesso de medicamentos ao local do tumor34. No entanto, devido à sua heterogeneidade, seus papéis ainda são controversos — alguns CAFs são tumorigênicos, enquanto alguns outros subtipos parecem ter um papel supressivo do tumor. Nesse contexto, seu isolamento pode ser de extremo interesse para lançar mais luz sobre seu tão debatido papel na progressão do câncer, que terá importantes implicações clínicas12,31. Além disso, a extração bem-sucedida do CAF a partir de modelos de tumor de camundongos humanos e pré-clínicos também facilitaria o desenvolvimento de novos medicamentos direcionados ao CAF. Este artigo relata um método para isolar e cultivar eficientemente cafs primários de um modelo pré-clínico sintônico de câncer de mama. Com base na experiência, três etapas experimentais influenciam principalmente o sucesso do protocolo.
O primeiro está trabalhando rápido para evitar a agregação de suspensões celulares associadas ao risco de coagulação na coluna e efflux celular lento: na verdade, quando as células que passavam pela coluna foram agrupadas, a probabilidade de um processo de isolamento sub-ideal aumentou, e as culturas finais continham clones celulares "contaminantes". A segunda é a junção de células de diferentes tumores após a passagem de esgotamento para garantir que células suficientes sejam passadas na etapa final de enriquecimento. A questão crítica final é emplacar as células extraídas em altas densidades celulares, provavelmente a partir de um único poço da placa de 24 poços para impulsionar o crescimento celular e a expansão da colônia para até 4-5 passagens. Se as células foram semeadas em baixas densidades, elas se expandiram na superfície livre e rapidamente pararam de se replicar.
Vários estudos já descreveram métodos de extração de CAF de origem humana e camundongo, para estudar seu papel na promoção do desenvolvimento do câncer e da invasividade. Isso tem sido feito em muitos tipos de tumores, incluindo câncer de mama, melanoma, colangiocarcinoma e adenocarcinoma pancreático35,36,37,38. No entanto, devido à falta de marcadores específicos do CAF e à sua heterogeneidade, os resultados desses processos ainda são sub-ideais.
Aqui, as células isoladas foram utilizadas para validar a capacidade de direcionamento do CAF de nanocálgenas HFn funcionalizadas com moieties anti-FAP. O uso de culturas primárias de CAFs foi uma vantagem significativa, permitindo a validação da nanostrategy ex vivo com um experimento de ligação muito mais simples e econômico do que fazê-lo diretamente in vivo nesta fase preliminar de otimização de nanodrogas.
Nesse sentido, testes ex vivo em CAFs podem preceder experimentos in vivo animal, permitindo a triagem e seleção das nanopartículas mais promissoras para o direcionamento ideal do CAF. O modelo CAF aqui apresentado também pode ser utilizado para estudos preliminares de eficácia, ao carregar nanopartículas com drogas ativas. Os animais só serão usados mais tarde para avaliar estudos de biodistribução, farmacocinética e eficácia.
Vários nanodrogas alvo de CAF estão sendo desenvolvidas, como nanocálgenas de ferritina para terapia fotodinâmica no câncer de mama e partículas à base de peptídeos para fornecer doxorubicina nos modelos de câncer de próstata39,40. No entanto, poucos estudos se concentraram no isolamento dos CAFs como plataformas celulares para otimização de nanodrogas.
Este protocolo tem algumas limitações. Primeiro, é um protocolo demorado, exigindo a preparação e compra de vários reagentes e materiais. Em segundo lugar, devido à escassez de CAFs no tumor de mama 4T1, seu rendimento é baixo. Os experimentos de nanopartículas devem ser planejados e realizados assim que o número de células necessário for alcançado, uma vez que os CAFs primários sofrem senescência e não podem ser mantidos na cultura por muito tempo. Em conclusão, esse método de isolamento, cultivo e caracterização dos CAFs pode ser uma ferramenta poderosa para acelerar o desenvolvimento de novas nanomedicinas direcionadas na luta contra o câncer.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este estudo foi apoiado pela Associazione Italiana per la Ricerca sul Cancro (AIRC) sob o projeto IG 2017-ID. 20172 – P.I. Corsi Fabio. A SM reconhece o centro de Pesquisa Clínica Pediátrica "Romeu e Enrica Invernizzi" que apoia sua posição. AB agradece airc (projeto ID. 20172) e Universidade de Milão para bolsa de pesquisa. As bolsas de pós-doutorado e doutorado de LS e MS são apoiadas pela Universidade de Milão.
Materiais
| Name | Company | Catalog Number | Comments |
| ACK Lysing buffer | Lonza | 10-548E | Store at +15° to +30 °C. |
| Alexa Fluor 488 goat anti-human antibody | Immunological Science | IS-20022 | Protect from light. |
| Anti-FAP Fab fragment (3F2) | Creative Biolabs | TAB-024WM-F(E) | |
| BALB/c mice | Charles River | 028BALB/C | 7 weeks old female mice |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | Store at 2-8 °C. |
| CD45 antibody | Miltenyi Biotec | 130-110-796 | FITC-conjugated fluorescent antibody; clone REA 737; Store protected from light at 2–8 °C. |
| CD90.2 antibody | Miltenyi Biotec | 130-102-960 | PE-conjugated fluorescent antibody; clone 30-H12; Store protected from light at 2–8 °C. |
| Cell strainers 70 µm | VWR | 732-2758 | |
| CytoFLEX | Beckman Coulter | laser configuration B4-R2-V0 | |
| Dead cell Removal Kit | Miltenyi Biotec | 130-090-101 | contains 10 mL of Dead Cell Removal MicroBeads; 25 mL of 20× Binding Buffer Stock Solution. Store protected from light at 2−8 °C. |
| D-Luciferin | Caliper | 760504 | reagent for in vivo imaging |
| DMEM High Glucose w/o L-Glutamine w/ Sodium Pyruvate | Euroclone | ECB7501L | Warm at 37 °C in a water bath before use. |
| DMSO | Sigma-Aldrich | D2650 | |
| DPBS w/o Calcium, w/o Magnesium | Euroclone | ECB4004L | Keep at room temperature. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E9884 | |
| Fetal Bovine Serum | Euroclone | ECS0180L | Before use, heat at 56 °C for 30 min to kill all the complement proteins. |
| Fluorescein Istothiocyanate isomer I (FITC) | Sigma-Aldrich | F7250 | Store protected from light at 2–8 °C. |
| GentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | They are used in combination with the gentleMACS Dissociator. |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | Two samples can be processed in parallel. Special protocols have been developed for various tissues. |
| Goat serum | Euroclone | ECS0200D | |
| Ham's F12 w/o L-Glutamine | Euroclone | ECB7502L | Warm at 37 °C in a water bath before use. |
| IVIS Lumina II imaging system | Caliper Life Sciences | This imaging system is easy to use for both fluorescent and bioluminescent imaging in vivo. Equipped with a Living Image Software for analysis | |
| LD columns | Miltenyi Biotec | 130-042-901 | Composed of ferromagnetic spheres, designed for stringent depletion of unwanted cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use |
| L-Glutamine | Euroclone | ECB3000D | 200 mM stock |
| Light/fluorescence microscope equipped with camera | Leica Microsystems | DM IL LED Fluo/ ICC50 W CameraModule | inverted microscope for live cells with camera |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Separation Unit | Miltenyi Biotec | 130-090-976 | Position the magnet on appropriate stand before use. |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MS columns | Miltenyi Biotec | 130-042-201 | Composed of ferromagnetic spheres, designed for positive selection of cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use. |
| Mycoplasma Removal Agent | Euroclone | ECMC210A | Dilute in culture medium 1:100. |
| NaHCO3 | Invitrogen | A10235 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000C | |
| Non essential aminoacids | Euroclone | ECB3054D | |
| Penicillin-Streptomycin | Euroclone | ECB3001D | |
| Recombinant Human apoferritin H-homopolymer (HFn) | Molirom | MLR-P018 | |
| RPMI 1640 w/o L-Glutamine | Euroclone | ECB9006L | Warm at 37 °C in a water bath before use. |
| Tumor-Associated Fibroblast Isolation kit | Miltenyi Biotec | 130-116-474 | Contains 1 mL of Non-Tumor-Associated Fibroblast Depletion Cocktail, mouse; 1 mL of CD90.2 (Tumor-Associated Fibroblast) MicroBeads,mouse. Store protected from light at 2-8 °C. |
| Tumor Dissociation Kit | Miltenyi Biotec | 130-096-730 | Contains lyophilized enzymes (D, R, A) and buffer A; reconstitute enzymes according to the manufacturer's instructions, aliquot and store at - 20 °C. |
| Trypan blue 0.4% | Lonza | 17-942E | dilute 1:1 with a sample of cell suspension before counting the cells |
| TrypLE select | Gibco | 12563-029 | use at room temperature |
| Trypsin-EDTA | Lonza | BE17-161E | Warm at 37 °C in a water bath before use |
| T75 Primo TC flask | Euroclone | ET7076 | |
| Zeba Spin Desalting Columns | Thermo Fisher Scientific | 89890 | 7K MWCO, 2 mL |
| 1.5 mL tubes | Biosigma | CL15.002.0500 | |
| 15 mL tubes | Euroclone | ET5015B | |
| 4T1-luc2 | Caliper | Mouse mammary gland cancer cell line stably transfected with firefly luciferase gene | |
| 50 mL tubes | Euroclone | ET5050B |
Referências
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nature Medicine. 19 (11), 1423-1437 (2013).
- Velaei, K., Samadi, N., Barazvan, B., Soleimani Rad, J. Tumor microenvironment-mediated chemoresistance in breast cancer. Breast. 30, 92-100 (2016).
- Cheng, J. D., Weiner, L. M., et al. Tumors and their microenvironments: tilling the soil. Commentary re: A. M. Scott et al., A Phase I dose-escalation study of sibrotuzumab in patients with advanced or metastatic fibroblast activation protein-positive cancer. Clinical Cancer Research. 9 (5), 1690-1695 (2003).
- Hui, L., Chen, Y. Tumor microenvironment: Sanctuary of the devil. Cancer Letters. 368 (1), 7-13 (2015).
- Balkwill, F. R., Capasso, M., Hagemann, T. The tumor microenvironment at a glance. Journal of Cell Science. 125, 5591-5596 (2012).
- Chen, X., Song, E. Turning foes to friends: targeting cancer-associated fibroblasts. Nature Review. Drug Discovery. 18 (2), 99-115 (2019).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Seminars in Cell & Developmental Biology. 21 (1), 33-39 (2010).
- LeBleu, V. S., Kalluri, R. A peek into cancer-associated fibroblasts: origins, functions and translational impact. Disease Models & Mechanisms. 11, (2018).
- Li, X. -. Y., Hu, S. -. Q., Xiao, L. The cancer-associated fibroblasts and drug resistance. European Review for Medical and Pharmacological Sciences. 19 (11), 2112-2119 (2015).
- Luo, H., Tu, G., Liu, Z., Liu, M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Letters. 361 (2), 155-163 (2015).
- Truffi, M., Sorrentino, L., Corsi, F. Fibroblasts in the tumor microenvironment. Advances in Experimental Medicine and Biology. 1234, 15-29 (2020).
- Sugimoto, H., Mundel, T. M., Kieran, M. W., Kalluri, R. Identification of fibroblast heterogeneity in the tumor microenvironment. Cancer Biology & Therapy. 5 (12), 1640-1646 (2006).
- Costa, A., et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell. 33 (3), 463-479 (2018).
- Ishii, G., Ochiai, A., Neri, S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Advances Drug Delivery Reviews. 99, 186-196 (2016).
- Chen, Q., et al. Remodeling the tumor microenvironment with emerging nanotherapeutics. Trends in Pharmacological Sciences. 39 (1), 59-74 (2018).
- Truffi, M., et al. Nano-strategies to target breast cancer-associated fibroblasts: rearranging the tumor microenvironment to achieve antitumor efficacy. International Journal of Molecular Sciences. 20 (6), 1263 (2019).
- Tong, R., Langer, R. Nanomedicines Targeting the Tumor Microenvironment. Cancer Journal. 21 (4), 314-321 (2015).
- Kaps, L., Schuppan, D. Targeting cancer associated fibroblasts in liver fibrosis and liver cancer using nanocarriers. Cells. 9 (9), 2027 (2020).
- Miao, L., et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors. Cancer Research. 77 (3), 719-731 (2017).
- Kelly, T., Huang, Y., Simms, A. E., Mazur, A. Fibroblast activation protein-α: a key modulator of the microenvironment in multiple pathologies. International Review of Cell and Molecular Biology. 297, 83-116 (2012).
- Brennen, W. N., Isaacs, J. T., Denmeade, S. R. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy. Molecular Cancer Therapeutics. 11 (2), 257-266 (2012).
- Juillerat-Jeanneret, L., Tafelmeyer, P., Golshayan, D. Fibroblast activation protein-α in fibrogenic disorders and cancer: more than a prolyl-specific peptidase. Expert Opinion on Therapeutic Targets. 21, 977-991 (2017).
- Falvo, E., et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin. Nanoscale. 5 (24), 12278-12285 (2013).
- Truffi, M., et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research. 107, 57-65 (2016).
- Cai, Y., et al. Enhanced magnetic resonance imaging and staining of cancer cells using ferrimagnetic H-ferritin nanoparticles with increasing core size. International Journal of Nanomedicine. 10, 2619-2634 (2015).
- Heger, Z., Skalickova, S., Zitka, O., Adam, V., Kizek, R. Apoferritin applications in nanomedicine. Nanomedicine. 9 (14), 2233-2245 (2014).
- Mazzucchelli, S., et al. Nanometronomic treatment of 4T1 breast cancer with nanocaged doxorubicin prevents drug resistance and circumvents cardiotoxicity. Oncotarget. 8 (5), 8383-8396 (2017).
- Yu, Q., et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy. Journal of Controlled Release. 321, 564-575 (2020).
- Mertens, J. C., et al. Therapeutic effects of deleting cancer-associated fibroblasts in cholangiocarcinoma. Cancer Research. 73 (2), 897-907 (2013).
- Kovács, D., et al. Core-shell nanoparticles suppress metastasis and modify the tumour-supportive activity of cancer-associated fibroblasts. Journal of Nanobiotechnology. 18, 18 (2020).
- Sharon, Y., Alon, L., Glanz, S., Servais, C., Erez, N. Isolation of normal and cancer-associated fibroblasts from fresh tissues by Fluorescence Activated Cell Sorting (FACS). Journal of Visualized Experiments. (71), e4425 (2013).
- Sitia, L., et al. Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax. Cells. 10 (2), 328 (2021).
- Bellini, M., et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells. Journal of Controlled Release. 196, 184-196 (2014).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nature Reviews Cancer. 20, 174-186 (2020).
- Dvořánková, B., Lacina, L., Smetana, K. Isolation of normal fibroblasts and their cancer-associated counterparts (CAFs) for biomedical research. Methods in Molecular Biology. 1879, 393-406 (2018).
- Calvo, F., Hooper, S., Sahai, E. Isolation and immortalization of fibroblasts from different tumoral stages. Bio-protocol. 4 (7), 1097 (2014).
- Sha, M., et al. Isolation of cancer-associated fibroblasts and its promotion to the progression of intrahepatic cholangiocarcinoma. Cancer Medicine. 7 (9), 4665-4677 (2018).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Zhen, Z., et al. Protein nanocage mediated fibroblast-activation protein targeted photoimmunotherapy to enhance cytotoxic T cell infiltration and tumor control. Nano Letters. 17 (2), 862-869 (2017).
- Ji, T., et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery. Advances Materials. 27 (11), 1865-1873 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados