Method Article
בידוד של פיברובלסטים הקשורים לסרטן ראשוני ממודל מורין סינגני של סרטן השד לחקר חלקיקים ממוקדים
* These authors contributed equally
In This Article
Summary
מאמר זה נועד לספק פרוטוקול לבידוד ותרבות של פיברובלסטים הקשורים לסרטן ראשוני ממודל מורין סינגני של סרטן שד טריפל שלילי ויישומה למחקר פרה-אקליני של חלקיקים חדשניים שנועדו למקד את המיקרו-סביבה של הגידול.
Abstract
פיברובלסטים הקשורים לסרטן (CAFs) הם שחקני מפתח בהקשר של מיקרו-סביבה של הגידול. למרות ירידה במספר בהשוואה לתאי הגידול, CAFs לווסת את התקדמות הגידול ולספק הגנה מפני חסינות antitumor. אסטרטגיות נגד נגדים מתפתחות שואפות לשפץ את המיקרו-סביבה של הגידול באמצעות אבלציה של CAFs פרו-גידוליגני או תכנות מחדש של פונקציות CAFs ומצב ההפעלה שלהם. גישה מבטיחה היא פיתוח של סוכני משלוח nanosized מסוגל למקד CAFs, ובכך לאפשר משלוח ספציפי של תרופות ומולקולות פעילות. בהקשר זה, מודל הסלולר של CAFs עשוי לספק כלי שימושי עבור הקרנת במבחנה וחקירה ראשונית של nanoformulations כאלה.
מחקר זה מתאר את הבידוד והתרבות של CAFs ראשוני מן המודל מורין 4T1 סינרגטי של סרטן שד טריפל שלילי. חרוזים מגנטיים שימשו בתהליך הפרדה דו-שלבי כדי לחלץ CAFs מגידולים מנותקים. בקרת אימונופנוטיפינג בוצעה באמצעות ציטומטריית זרימה לאחר כל מעבר כדי לאמת את תשואת התהליך. CAFs מבודדים ניתן להשתמש כדי ללמוד את יכולת הפילוח של nanoformulations שונים שנועדו להתמודד עם microenvironment הגידול. ננו-חלקיקי H-פריטין שכותרתם פלואורסצנטית שימשו כננו-חלקיקים מועמדים כדי להקים את השיטה. חלקיקים, חשופים או מצומדים עם ליגנד מיקוד, נותחו עבור הכריכה שלהם CAFs. התוצאות מצביעות על כך ex vivo מיצוי של CAFs השד עשוי להיות מערכת שימושית כדי לבדוק ולאמת חלקיקים עבור מיקוד ספציפי של CAFs tumorigenic.
Introduction
במהלך העשורים האחרונים, התברר כי הריגת תאים סרטניים בדרך כלל אינה מספיקה כדי למגר ממאירות, כמו microenvironment הגידול עשוי לגרום להישנות הגידול ולעורר התנגדות טיפולית1,2. לאחר מכן הופיעה פרדיגמה חדשנית: מיקוד סטרומה הגידול כדי לשלול את הגידול של גורמים תומכים ובכך, להגביר את היעילות שלכימותרפיה 3,4,5. בפרט, פיברובלסטים הקשורים לסרטן (CAFs) הם מטרה סטרומה מעניינת בגידולים מוצקים רבים6,7. CAFs הם קבוצה הטרוגנית מאוד של תאים אינטראקציה עם תאים ותאים סרטניים של המערכת החיסונית באמצעות הפרשת גורמי גדילה, ציטוקינים, וכימותרפיה; לבנות ול לשפץ את המטריצה החוץ-תאית; ואפשר היווצרות גרורות8,9,10,11,12. בהתאם לסוג הגידול, CAFs להראות פונקציות פרו-tumorigenic, בעוד תת סוגים אחרים של CAFs נראה שיש פונקציות מדכאות גידול13,14. כדי להבהיר טוב יותר את הדיכוטומיה הזו, חשוב אפיון יסודי של CAFs מגידולים ראשוניים ודרסטטיים.
בהקשר זה, תחום מחקר מתפתח התמקד בפיתוח סוכנים ננו-גדולים שנועדו למקד ו /או להרוס CAFs על ידי אספקת מולקולות ותרופות פעילות מסוגל לשפץ את microenvironment הגידול15,16,17,18. מספר סוגים של חלקיקים תוכננו כדי להשיג אבלציה CAF על ידי תרופות ציטוטוקסיות, כדי לגרום לטיפול פוטודינמי ממוקד CAF, או לתכנת מחדש CAFs על ידי החזרתם למצב של קיפאון או גרימת ביטוי ליגנד הקשורים TNF, אשר גורמת אפופטוזיס של תאים סרטניים שכנים16,19. יתר על כן, הפוטנציאל של חלקיקים רבים למקד באופן פעיל סמנים ביולוגיים ספציפיים מעורר תקווה של בחירת תת קבוצות CAF למקד. למרות הספציפיות המוחלטת שלה עבור CAF עדיין מוטל בספק, חלבון הפעלה פיברובלסט (FAP) הוא אחד היעדים המבטיחים ביותר של סטרומה פרו-tumorigenic והוא מנוצל כדי לנווט משלוח nanodrug, ובכך לסלול את הנתיב להתפתחות של ננו-תרופוטיקה ממוקדת CAF20,21,22.
מאמר זה מתאר את הבידוד של CAFs ראשוני ממודל סינגני של סרטן השד מורין ומדווח על השימוש שלהם בחקר יכולת הפילוח של חלקיקים מהונדס לזהות את סמן CAF, FAP. ננו-שניות של פריטין משמשות כננו-מערכות מועמדות כדי להגדיר את השיטה, שכן הספציפיות שלהם של המסירה עשויה להיות מעוצבת על ידי החשיפה פני השטח של moieties מיקוד23,24. יתר על כן, פריטינים הוכחו בהצלחה להיות מעבורות ביו תואמות מעולה עבור יישומי antitumor, מפעיל הצטברות מהירה של המטען במסת הגידול25,26,27. עד כה, מחקרים פרה-קליניים של מערכות ננו-מיקוד CAF מעורבים בבדיקות במבחנה על קווי תאים פיברובלסט מגורה בתרבות עם שינוי גורם גדילה-בטא כדי לגרום להפעלת התא ואת הביטוי של כמה תכונות אימונופנוטיפיקיות של CAFs28,29. שיטה זו מוחלת בדרך כלל על קווי תאים מונצחים (כגון NIH3T3, LX-2) והיא מהירה ופשוטה למדי, מניבה תאים מופעלים תוך מספר שעות או ימים. מגבלה היא כי למרות גירוי במבחנה גורמת לביטוי של כמה גנים המיוחסים myofibroblasts מופעל, זה לא יכול לגמרי לשחזר את כל התכונות הביולוגיות של CAFs אמיתי, במיוחד ההטרוגניות שלהם ויוו.
אסטרטגיה נוספת כוללת מיצוי CAFs ראשוני מדגימות גידול אנושי או עכבר30,31. זה מבטיח כי הפעלת CAF מתרחשת בהקשר פיזיולוגי, וכי ההטרוגניות של אוכלוסיות CAF נשמרת. על פי מטרת המחקר, CAFs עשוי להיגזר ממקורות שונים, ובכך להציע את האפשרות ללמוד את המצב האמין ביותר. הפרוטוקול שדווח כאן יהיה בעל ערך עבור מדענים המבקשים לבצע הערכה ראשונית של הפונקציונליות של חלקיקים חדשניים שנועדו למקד CAFs ממודל סרטן השד מורין. CAFs מבודד יהיה שימושי עבור הקרנת חלקיקים אלה כי הם מבטיחים מספיק כדי להמשיך להערכת vivo במודלים בעלי חיים של סרטן. זה יהיה רלוונטי בשלבים הראשונים של ייצור ננו-חלקיקים, נהיגה ננוטכנולוגיה לקראת עידון של עיצוב ננו-חלקיקים על ידי התחשבות בעיקר באסטרטגיה של immobilization ליגנד כדי להשיג תכונות מיקוד אופטימליות.
Protocol
1. הקמת מודל 4T1 סינגני של סרטן השד
הערה: הפרוטוקול הנוכחי מתאר את הבידוד של CAFs ראשוני מגידול בשד עכבר 4T1. מחקר בעלי החיים המתואר כאן אושר על ידי משרד הבריאות האיטלקי (מספר 110/2018-יח"צ).
- תרבית תאים סרטניים והשתלה
- להפשיר 1 × 106 תאי 4T1-luc בבקבוק T75 עם 10 מ"ל של רוזוול פארק ממוסד הזיכרון (RPMI) 1640 בינוני בתוספת 10% סרום בקר עוברי (FBS), 1% פניצילין / סטרפטומיצין (P/S), ו 1% L-גלוטמין. הוסף סוכן הסרת Mycoplasma (1:100) במדיום התרבות.
הערה: תאי 4T1-luc מבטאים ליציפראז ביציבות וניתן לדמיין על ידי ביולומינציה (BLI) על גירוי נכון עם D-לוציפרין. זה מאפשר ניטור ויוו של הכדאיות והתפשטות של תאים סרטניים עם ההשתלה בעכברים (איור 1). - לשמור על התאים ב 37 °C (5%) ו 5% CO2 באטמוספרה לחה עד ~ 80% מפגש, על ידי שינוי המדיום כל 2 ימים.
הערה: המשך טיפול עם סוכן הסרת Mycoplasma במשך שבוע אחד (~ 2/3 מעברים) לפני הזרקה בעכברים כדי להבטיח כי תאים מוזרקים הם mycoplasma ללא. - ביום ההליך, לנתק תאים באמצעות 1 מ"ל של טריפסין-אתילנדימינטראטראצטטי חומצה (EDTA) פתרון (טריפסין 1:250) במשך 5 דקות ב 37 °C (5 °F). הפסק פעילות טריפסין על-ידי הוספת מדיום תרבית, ספר את התאים בכחול טריפן (1:1) וחשב את מספר התאים/מ"ל.
- Pipette את הנפח המתאים 1 × 106 תאים וצנטריפוגה במשך 5 דקות ב 400 × גרם. יוצקים את supernatant, ו resuspend הכדור ב 1 מ"ל של RPMI 1640 בסיס בינוני. שמור את התאים על קרח עד מוכן להזרקה.
הערה: עבור כל עכבר, 1 × 105 תאים נדרשים; עם זאת, תמיד לחשב עבור עודף של 2 עכברים (המקביל 2 × 105 תאים) כדי להקל על טעינת מזרק. - יום אחד לפני הניתוח, לגלח את הפרווה של 8 עכברים BALB / c (נקבה, שבעה שבועות) כדי לחשוף את האזור של בלוטות החלב הבטן בצד ימין. השתמש מכונת גילוח חשמלית ולהחיל שכבה דקה של קרם depilatory במשך 4 דקות; לאחר מכן, לשטוף את השמנת עם מים חתיכת נייר.
- לגרום להרדמה על ידי שאיפה מתמשכת של 2% גז איזופלוראן במשך ~ 5 דקות, ולבצע הזרקה תת עורית באזור בלוטות החלב בבטן עם מזרק שחפת 27 G. להפוך את המחט כלפי מעלה כדי להיכנס לעור תת עורית; לאחר מכן, להחזיק את העור כלפי מעלה לאט להזריק 100 μL של השעיית התא (1 × 105 תאים). סובבו מעט את המחט לפני שתבטלו לאט את המזרק.
הערה: זכור להביא את השעיית התא לטמפרטורת החדר 15 דקות לפני ההזרקה.
- להפשיר 1 × 106 תאי 4T1-luc בבקבוק T75 עם 10 מ"ל של רוזוול פארק ממוסד הזיכרון (RPMI) 1640 בינוני בתוספת 10% סרום בקר עוברי (FBS), 1% פניצילין / סטרפטומיצין (P/S), ו 1% L-גלוטמין. הוסף סוכן הסרת Mycoplasma (1:100) במדיום התרבות.
- גידול גידול וניתח
- ב 5 ימים לאחר הזרקת התא, להזריק 150 מ"ג/ק"ג D-לוציפרין תוך-איטראפריטוניאלי (100 μL) 5 דקות לפני הדמיה. לכוד תמונות BLI באמצעות מערכת הדמיה in vivo הגדרת חשיפה 10 s, binning בינוני, ו f / stop ב 4. הגדר את האזור הזוהר של הגידול כאזור העניין (ROI), וכמת את האות הכולל ב- ROI (פוטון/שניה/מ') באמצעות תוכנת הדמיה.
- חזור על הליך ההדמיה (1.2.1) כל 5 ימים מההזרקה כדי לעקוב אחר צמיחת הגידול במונחים של עלייה ב- BLI.
- כדי להקים את נפח הגידול, להחזיק את העכבר ולחשוף את הבטן שלה. השתמש בקליפרים כדי למדוד את אורך הגידול (L) והרוחב (W) פעם בשבוע. חשב את נפח הגידול (V) באמצעות משוואה 1.
[V = (L x W2)/2] (1) - ב 20 ימים לאחר הזרקת התא, להקריב את בעלי החיים על ידי נקע צוואר הרחם, לנתק את הגידולים מן העור עם מספריים, ולאסוף אותם בתמיסת אחסון רקמות (ראה טבלת החומרים).
הערה: ניתן להשתמש באופן מיידי בדגימות גידול לניתוק לתאים בודדים (סעיף 2) או לאחסן אותם ב-4 °C (4 °F) למשך עד 48 שעות.
2. ניתוק הגידול לתאים בודדים
הערה: עבור השלבים הבאים, השתמש ריאגנטים סטריליים וחד פעמיים במכסה המנוע זרימה למינאר. לעבוד עם 4 גידולים בכל פעם.
- מניחים את דגימת הגידול בצלחת פטרי, ומוסרים בזהירות כל שבר של עור, שומן ואזורים נמקיים בעזרת פינצטה ואזמל. לאחר מכן, הפחיתו את הגידול לחתיכות קטנות של כ-1-2 מ"מ והעבירו אותם לצינור(איור 2A).
הערה: גידולי 4T1 הופכים לנמקיים מאוד תוך כדי גידול, עם נטייה לכיב. חשוב להסיר בזהירות את האזורים הנמקיים כדי למנוע כל הפרעה של פסולת עם השלבים הבאים. - הכן תערובת עיכול לניתוק הגידול: לערבב 2.35 מ"ל של RPMI 1640 בינוני, 100 μL של אנזים D, 50 μL של אנזים R, ו 12.5 μL של אנזים A. להשרות את שברי הגידול בתמיסה ולסגור בחוזקה את הצינור.
הערה: הנפחים המצוינים של תערובת העיכול תקפים לגידולים עד 1 גרם וניתן להתאים לגידולים גדולים יותר בהתאם למשקלם. גידולי 4T1 הגדלים במשך 20 יום בדרך כלל נמצאים בטווח של 0.5-0.8 גרם. - הפוך את הצינור, בודק שכל חתיכות הגידול עומדות בתחתית הצינור לכיוון הכובע. חברו את הצינור לדיסוציאטור מכני בדיור הנכון, והפעילו תוכנית דיסוציאציה ספציפית המיועדת לגידולים קשים (ראו הוראות היצרן).
הערה: ייתכן שיידרשו צינורות מיוחדים כדי להתאים לדיסוציאטור. צינורות C לשאת רוטור בתוך הכובע כדי לקדם דיסוציאציה מכנית של הרקמה. - לנתק את הצינור, לשמור אותו הפוך, ודגרה המדגם ב 37 °C (40 °F) במשך 40 דקות עם רועד עדין. לאחר מכן, חברו את הצינור לדיסוציאטור בדיור הנכון, והפעלו את תוכנית הניתוק הספציפית הבאה המיועדת לגידולים קשים פעמיים. ודאו שאין חתיכות גדולות של רקמה בסוף ההליך(איור 2B).
הערה: כדי לנתק את הגידול, קוקטיילים אנזימים אחרים יכולים לשמש כדי לבזות את המטריצה החוץ תאית. עם זאת, בפרוטוקול זה, ערכה מסחרית זמין גידול דיסוציאציה המכיל תערובת אנזימים ממוטבת (אנזימים D, R, A) ודיסוציאטור אוטומטי למחצה כי מכנית dissociaation הרקמה שימשו. שילוב זה הבטיח השפלה נכונה של המטריצה החוץ תאית יחד עם שמירה על שלמות התאים ואפיטופים על פני התא. - לסנן את המדגם דרך מסננת תא 40 מיקרומטר בצינור 50 מ"ל, לשטוף את המסנן עם 10 מ"ל של RPMI 1640 בינוני, ואת צנטריפוגה הצינור במשך 7 דקות ב 300 × גרם. אם גלולה התא נראה אדום, אריתרוציטים lyse על ידי הוספת 1 מ"ל של אמוניום-כלוריד-אשלגן (ACK) חיץ ליסינג במשך 5 דקות בטמפרטורת החדר, לשטוף עם 10 מ"ל של RPMI 1640, להעביר את השעיית התא בצינור 15 מ"ל, וצנטריפוגה שוב.
- resuspend הכדור ב 1 מ"ל של חוצץ PBE מורכב מלוחים חוצץ פוספט (PBS), 0.5% אלבומין סרום בקר (BSA), ו 2 mM EDTA, ולספור את התאים עם כחול טריפן (1:1). במקרה של גושי תאים, לסנן את השעיית התא באמצעות מסננת תא 70 מיקרומטר, בעבר ספוג עם PBS.
הערה: במיוחד כאשר הגידולים גדולים, חשוב לבדוק את ספירת התאים ובסופו של דבר לפצל כל דגימת גידול בצינורות שונים עם לא יותר מ 107 תאים בכל צינור לפני שתמשיך לשלב 2.7. - הכן את מאגר כריכת הסרת התא המת על-ידי דילול תמיסת מאגר המאגר הכריכה 20x (ראה טבלת החומרים ) במים סטריליים מזוקקיםכפולים. לשטוף תאים עם 5 מ"ל של 1× חיץ כריכה (איור 2C).
הערה: שמור את המאגר ב 4 °C (7 °F). - צנטריפוגה במשך 7 דקות ב 300 × גרם, ו resuspend גלולה התא עם 0.1 מ"ל של חיידקים להסרת תאים מתים (ראה טבלת החומרים). מערבבים היטב ודגרה בטמפרטורת החדר במשך 15 דקות.
- במהלך הדגירה עם חרוזים, להכין עמדה מגנטית מתחת למכסה המנוע לתלות עמודי הפרדה פרומגנטיים (עמודה אחת עבור עד 107 תאים) על זה עם טיפים מצביעים למטה. שיד את העמודות עם 0.5 מ"ל של חיץ כריכה קר של 1×. חכה עד שהתמיסה תזרם תחת כוח המשיכה.
הערה: חשוב לא לחרוג ממספר התאים בעמודה כדי למנוע כל סיכון לקרישת מיטת העמודים ולהפחית את תפוקת ההתאוששות. בעת עבודה עם יותר מ- 107 תאים, השתמש בעמודות נוספות בהתאם למספר התאים הכולל או השתמש בעמודות גדולות יותר. במקרים כאלה, התאם את אמצעי האחסון המחודשים המתוארים בשלבים הבאים לאלה שצוינו על-ידי היצרן. - בסוף הדגירה, להוסיף 400 μL של חיץ כריכה 1× קר כדי ההשעיה חרוז / תא, לטעון את כל הנפח על העמודה, ולאסוף את השפך (המתאים לתאים ללא תווית) בצינור 15 מ"ל.
- לשטוף את העמודה ארבע פעמים עם 0.5 מ"ל של חיץ כריכה 1× קר, ולאסוף את השפכים הכולל (המתאים לשבר התא החי) באותו צינור.
- ספרו את התאים בכחול טריפן (1:1). מקם 1 × 105 תאים בשני צינורות עבור מיון תאים מופעל פלואורסצנטי (FACS), ולשמור אותם ב 4 °C עד אימות תהליך (ראה שלב 4.1): להשתמש בצינור הראשון כדי להגדיר את הפרמטרים ניתוח ואת אזורי חיוביות (צינור בקרה) והשני לניתוח סמנים ביולוגיים (צינור מדגם). השתמש בתאים הנותרים להפקת CAFs (ראה סעיף 3).
הערה: הסרת תאים מתים חשובה כדי להפחית תגובות לא ספציפיות עם החיידקים בסעיף 3. עם זאת, כדי לשפר את התשואה, להימנע מהסרת תאים מתים אם שיעור התאים המתים הוא <20%.
3. מיצוי CAFs ראשוני מגידול בשד
הערה: עבור סעיף 3, השתמש בערכת הבידוד הפיברובלסט הקשורה לעכבר המכילה קוקטייל דלדול פיברובלסט שאינו קשור לגידול ומיקרואורגניזמים הקשורים לגידול פיברובלסט המתאימים לתיוג מגנטי של התאים (ראה טבלת החומרים).
- דלדול של פיברובלסטים שאינם קשורים לסרטן
- להחית מסננת תא 70 מיקרומטר עם PBS, ולסנן את ההשעיה התא כדי להסיר כל גושים. לאחר מכן, צנטריפוגות התאים במשך 10 דקות ב 300 × g ולשאף את supernatant.
הערה: אם גידול יחיד חולק לשתי דגימות לשלב 2.7, מאגר השעיית התא שתיים על שתיים לפני שתמשיך בשלב 3.1.2. - יש תוסיפו את הכדור ב-80 מיקרו-אל של חוצץ PBE קר, והוסיפו 20 מיקרו-אל של קוקטייל דלדול פיברובלסט שאינו קשור לגידול. מערבבים היטב ודגרה ב 4 °C (5 °F) במשך 15 דקות בחושך.
- במהלך הדגירה עם חרוזים, להכין עמודות דלדול פרומגנטי (1 לכל מדגם) על מעמד מגנטי, ולתוות את העמודים עם 2 מ"ל של חוצץ PBE קר. המתן עד שהפתרון יזרום.
- בסוף הדגירה, להוסיף 400 μL של חוצץ PBE קר מתלה חרוז / תא, לטעון את כל הנפח על העמודה, ולאסוף את השפכים (המתאים לתאים ללא תווית) בצינור 15 מ"ל.
- לשטוף את העמודה פעמיים עם 2 מ"ל של חוצץ PBE קר, ולאסוף את השפכים הכולל באותו צינור. צנטריפוגה למשך 10 דקות ב 300 × גרם ו resuspend ב 0.1 מ"ל של חוצץ PBE קר.
הערה: דלדול של פיברובלסטים שאינם הקשורים לסרטן מפחית באופן דרסטי את הכמות הכוללת של תאים התאושש. בדרך כלל יש צורך ומומלץ לאגד השעיות תא מארבע דגימות שונות כדי לקבל גלולה גלויה ומספיק תאים לשלב 3.2. זה יבטיח תשואה אופטימלית. - מקם 20 μL של השעיית התא בצינור FACS ולשמור אותו ב 4 °C (ייתכן שלאימות תהליך (ראה סעיף 4). השתמש בתאים הנותרים לבחירת CAF (ראה שלב 3.2).
- להחית מסננת תא 70 מיקרומטר עם PBS, ולסנן את ההשעיה התא כדי להסיר כל גושים. לאחר מכן, צנטריפוגות התאים במשך 10 דקות ב 300 × g ולשאף את supernatant.
- מבחר חיובי של פיברובלסטים הקשורים לסרטן
- הוסף 20 μL של חיידקי פיברובלסט הקשורים לגידול ל 80 μL של השעיית תאים. מערבבים היטב ודגרה ב 4 °C (5 °F) במשך 15 דקות בחושך.
- במהלך הדגירה עם חרוזים, להכין עמודות הפרדה פרומגנטית (1 לכל מדגם) על מעמד מגנטי, ולתוות את העמודים עם 0.5 מ"ל של חוצץ PBE קר. המתן עד שהפתרון יזרום.
- בסוף הדגירה, להוסיף 400 μL של חוצץ PBE קר מתלה חרוז / תא, לטעון את כל הנפח על העמודה, ולתת לתאים ללא תווית לזרום דרך לתוך צינור 15 מ"ל.
- לשטוף את העמודה שלוש פעמים עם 0.5 מ"ל של חוצץ PBE קר, ולאסוף את השפכים הכוללים באותו צינור.
הערה: הזרימה דרך מכיל תאים CD90.2 שליליים ללא תווית, אשר עשוי להיות מושלך כמו פיברובלסטים שאינם הקשורים לסרטן. - הסר את העמודה מהמגנט והנח אותו בצינור 1.5 מ"ל. הוסף 1 מ"ל של PBE קר על העמודה, ומיד לדחוף את הבוכנה לתוך העמודה כדי לשטוף את התאים החוצה.
- צנטריפוגה למשך 10 דקות ב 400 × גרם ו resuspend ב 0.1 מ"ל של חוצץ PBE קר. מקם 20 μL של השעיית תא בצינור FACS ולשמור אותו ב 4 °C (ייתכן שאימות תהליך (ראה סעיף 4).
הערה: לאחר צנטריפוגה, הכדור עשוי להיות בקושי גלוי, במיוחד כאשר הגידולים המקוריים הם קטנים. השתמש צינורות צנטריפוגות תחתון חרוט להיזהר לא לאבד את כל התאים כאשר שואפים supernatant. - לדלל את התאים הנותרים בנפח מתאים של המדיום של DULbecco שונה נשר (DMEM)/Ham של F-12 בתוספת 15% FBS, 2 mM L-גלוטמין, 1% P/S, ו 1% חומצות אמינו לא חיוניות, ולזרוע את התאים בצלחת תרבית רקמות.
- בדוק את צפיפות התא תחת מיקרוסקופ, והצב את הצלחת באינקובטור ב 37 °C (5% CO2 כדי לאפשר לתאים לדבוק ולגדול.
הערה: אם התאים צפופים מדי, לפצל מיד את ההשעיה התאית לשתי בארות של צלחת תרבית הרקמה לפני הצבת הצלחת באינקובטור.
4. אימות תהליכים
- ציטומטריית זרימה
הערה: סעיף 4.1 אינו דורש תנאים סטריליים וניתן לבצעו מחוץ למכסה המנוע. בצע סעיף 4.1 במקביל עבור דגימות שנאספו בשלב 2.11 (גידול מנותק), שלב 3.1.6 (לאחר דלדול של פיברובלסטים שאינם הקשורים לסרטן), ושלב 3.2.6 (לאחר העשרה של פיברובלסטים הקשורים לסרטן).- צנטריפוגות צינורות FACS שהוכנו בשלבים 2.11, 3.1.6, ו 3.2.6 במשך 10 דקות ב 300 × גרם. זרוק את סופר-טבעי.
הערה: הכן לפחות צינור אחד נוסף, המכיל תאים לא נגועים הפועלים כפקד כדי להגדיר את הפרמטרים לניתוח. - בצינורות מדגם, resuspend תאים ב 88 μL של PBE, ולהוסיף 2 μL של נוגדן נגד CD45 מצומד עם פלואורסצין isothiocyanate (FITC, 1:50 דילול, על פי הוראות היצרן) ו 10 μL של נוגדן CD90.2 מצומד עם פיקורייתרין (PE, 1:10 דילול, על פי הוראות היצרן). מערבבים ביסודיות ודגרה במשך 10 דקות ב 4 °C (70 °F) בחושך. בצינור הבקרה (לא נגוע), תאים resuspend ב 100 μL של PBE. דגירה במשך 10 דקות ב 4 °C (5 °F) בחושך כדי לשכפל את ההליך ואחריו עבור תאים מוכתמים בנוגדנים.
הערה: יש לבדוק בקפידה את הטמפרטורה ואת זמן הדגירה, שכן וריאציה במשתנים כאלה עלולה לגרום להכתמה לקויה או לא ספציפית, ובכך לשנות את התוצאות. - לאחר השלמת שלב הדגירה, בצע שטיפה על ידי הוספת 1 מ"ל של PBE. צנטריפוגה למשך 10 דקות ב-300 x גרם. זרוק את סופר-טבעי.
- תאים resuspend (כל הצינורות) ב 500 μL של PBS.
- מערבבים היטב וממשיכים בניתוח ציטומטריית זרימה. הגדר את הערוצים כדי למדוד את הפלואורסצנטיות של הנוגדנים (כלומר, FITC ו- PE).
- מצינור הבקרה, בחר את כל התאים הקינים על-ידי ציור שער ראשון (P1) ב- Plot לעומת Side scatter (FSC לעומת SSC). בתוך P1, קבע שער שני (P2) הכולל תאים בודדים בלבד.
- באמצעות ערוצי הפלואורסצנטיות הספציפיים של הנוגדנים (כלומר, FITC ו- PE), קבעו שערים נכונים כדי להבחין בתאים מוכתמים באופן חיובי.
- התחל את הניתוח ורשום לפחות 10,000 אירועים ב- P2. קרא אותות משני הערוצים בו-זמנית.
הערה: אם המספר הכולל של תאים הוא פחות מהצפוי, זה יכול להיות עדיף לקרוא את הצינור כולו. - (אופציונלי) אם מכתימים עוד יותר בנוגדנים/פלואורופורים נוספים מתוכנתים, קבעו מטריצת פיצוי מתאימה לפני תחילת הניתוח.
- צנטריפוגות צינורות FACS שהוכנו בשלבים 2.11, 3.1.6, ו 3.2.6 במשך 10 דקות ב 300 × גרם. זרוק את סופר-טבעי.
- ניטור מורפולוגיה ומאפיינים של תאים
הערה: לאחר זריעה, יש לטפל בתאים בתנאים סטריליים.- ביום שלאחר הזריעה, דמיינו את התאים תחת מיקרוסקופ אופטי כדי לבדוק הידבקות תאים ומורפולוגיה. שאפו את הסופר-טבעי והחליפו במדיום טרי.
הערה: CAFs הם תאים גדולים בצורת ציר, אשר ניתן להבחין בקלות מן המבנה דמוי אפיתל של תאים סרטניים 4T1. - לשמור על התאים ב 37 °C (5%) ו 5% CO2 באטמוספרה לחה, שינוי המדיום כל 2 ימים.
- כאשר תאים מגיעים ~ 80% מפגש (כ 4-6 ימים לאחר זריעה), לנתק את התאים באמצעות פתרון TrypLE Select (ראה טבלת החומרים)במשך 5 דקות בטמפרטורת החדר. מוסיפים מדיום טרי (4:1), צנטריפוגה מתלה התא ב 400 × גרם במשך 5 דקות, ו resuspend הכדור במדיום טרי.
- לפצל את התאים 1:2, ולהרחיב את התרבות עד מספר התאים הדרושים לניסוי מתקבל.
- בכל מעבר, בדוק מורפולוגיה של תאים וצמיחה תחת מיקרוסקופ אופטי. אם מורפולוגיה של תאים אינה הומוגנית (לדוגמה, שיבוטים של תאים עגולים קטנים המופיעים בתרבית), נתח מדגם של תאים על ידי ציטומטריית זרימה כמתואר בסעיף 4.1. אם הומוגני, להמשיך לשלב 4.2.7.
הערה: שינויים במורפולוגיה של התא עשויים להצביע על זיהום על ידי פיברובלסטים שאינם הקשורים לסרטן, אשר יש להסיר כדי להבטיח טוהר תרבות. - לנתח את תוצאות cytometry הזרימה ולהמשיך לפי אחד התרחישים הבאים: (i) אם זיהום של CD90.2-/CD45- תאים מתרחשים, לאסוף את כל התאים, ולחזור על הבחירה החיובית על ידי הבא שלב 3.2; (ii) אם מתרחש גם זיהום של תאי CD45+, אסוף את כל התאים וחזר על הדלדול בשלב 3.1; (iii) אם לא מתרחש זיהום (רק CD90.2+/CD45- תאים נמצאים), שמור על התאים בתרבית והמשיך ישירות ל- 4.2.7.
הערה: כמו חזרה על תהליך דלדול עם microbeads יפחית את התאוששות התא, מומלץ רק כאשר תאים לא צריך לשמש באופן מיידי. - לספור את התאים עם כחול טריפן (1:1), למקם 5 × 105 תאים בשני צינורות FACS, וצנטריפוגה במשך 10 דקות ב 300 × גרם. השלך את supernatant, ו resuspend הכדור ב 0.5 מ"ל של חוצץ חסימה (PBS בתוספת עם 2% BSA, 2% סרום עז) במשך 15 דקות בטמפרטורת החדר.
הערה: צינור אחד פועל כשליטה המורכבת מתאים לא מזוהמים בלבד, בעוד תאים בצינור השני יהיו מוכתמים לניתוח ציטומטריית זרימה. - צנטריפוגה במשך 10 דקות ב 300 × גרם, להשליך את supernatant ו resuspend ב 99 μL של חסימת חוצץ. הוסף 1 מיקרוגרם של נוגדן נגד FAP לצינור המדגם ו 1 מ"ל של חוצץ חסימה לצינור הבקרה. מערבבים היטב ודגרה במשך 15 דקות בטמפרטורת החדר.
הערה: FAP הוא סמן פני השטח של סטרומה גידול תגובתי וניתן להשתמש בו כדי לזהות ולאפיין CAFs. - יש לשטוף שלוש פעמים עם PBS, צנטריפוגה ודגורה עם הנוגדן המשני המתאים הצמוד בצבע פלואורסצנטי (1 מיקרוגרם) בחסימת חיץ למשך 15 דקות בטמפרטורת החדר.
- לשטוף שלוש פעמים עם PBS, ולנתח על ידי cytometry זרימה (בצע את השלבים 4.1.5 כדי 4.1.7 על ידי הגדרת הערוץ המתאים כדי לזהות את פלואורופור בשימוש). לאחר מכן, השתמש בתאים לניסויים (שלב 5.2).
- (אופציונלי) להקפיא מדגם של תאים ב 1 מ"ל של 90% FBS ו 10% דימתיל גופרתיקס (DMSO); יש לאחסן ב-80 °C (70 °F) לשימוש נוסף.
- ביום שלאחר הזריעה, דמיינו את התאים תחת מיקרוסקופ אופטי כדי לבדוק הידבקות תאים ומורפולוגיה. שאפו את הסופר-טבעי והחליפו במדיום טרי.
5. מיקוד CAFs על ידי חלקיקי פריטין מהונדסים
הערה: גרסה רקומביננטית של שרשרת כבדה פריטין אנושי (HFn) שימש ננו חלקיק חשוף או היה מצומד עם moieties מיקוד. כאן, חלקיקי HFn פונקציונליים עם החלק המשתנה של נוגדן נגד FAP (Fab@FAP) הוכנו על ידי NanoBioLab באוניברסיטת מילאנו-ביקוקה בשני יחסי HFn:Fab@FAP טוחנת, 1:1 ו 1:5, על פי פרוטוקול שתואר בעבר32.
- תיוג פלואורסצנטי של חלקיקי HFn
הערה: הן ננו-ים HFn חשופים ומתפקדים מסומנים באופן פלואורסצנטי עם FITC.- ממיסים את אבקת FITC ב-99% אתנול כדי להשיג ריכוז של 2 מ"ג/מ"ל.
הערה: פתרון זה צריך להיות מוכן טרי. - דגירה 50 μL של הפתרון מוכן (200 מיקרוגרם של FITC) עבור כל 1 מ"ג של חלבון (כלומר, 100 μL של HFn ב 10 מ"ג / מ"ל). הוסף 50 μL של 1 M נתרן ביקרבונט (NaHCO3), ולהתאים את הנפח ל 500 μL עם 0.1 M NaHCO3.
הערה: להגדיל את הנפחים בהתאם לצרכים הניסיוניים. - לדגור על תערובת התגובה בטמפרטורת החדר, בחושך, ועם ערבוב מתמשך במשך 1 שעה.
- הסר את עודף FITC מההצמוד על ידי סינון ג'ל באמצעות עמודת התפלת ספין (7 kDa MWCO).
- להעריך את הריכוז של חלבון שכותרתו התאושש באמצעות ספקטרופוטומטר. הערכת כמויות של חלבון וצבע על ידי מדידת הספיגה ב 280 ננומטר וב 488 ננומטר, בהתאמה.
- ממיסים את אבקת FITC ב-99% אתנול כדי להשיג ריכוז של 2 מ"ג/מ"ל.
- כריכה של חלקיקי HFN ל- CAFs
הערה: השתמש ב- CAFs לא יאוחר ממעברים 4-5 בתרבות.- מקם 5 × 105 תאים בכל צינור FACS, צנטריפוגה במשך 10 דקות ב 300 × גרם, ו resuspend ב 0.5 מ"ל של PBS, 0.3% BSA בתוספת עם 0.1 מ"ג / מ"ל של ההכנות השונות של חלקיקים (HFn חשוף, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) שכותרתו בעבר עם FITC.
הערה: הפעל כל תנאי במשולש. הכן צינור נוסף כדגימה ללא תווית שליטה שאליה לא מתווספים חלקיקים. - דגירה במשך 2 שעות ב 4 °C (5 °F) בחושך, צנטריפוגה, לשטוף שלוש פעמים PBS.
- תאים resuspend עם PBS 0.5 מ"ל, לערבב היטב, ולנתח על ידי ציטומטריה זרימה. הגדר את הערוצים כדי למדוד את הפלואורסצנטיות של FITC.
- לאחר התזדווגות על תאים בודדים חיים, לרכוש 20,000 אירועים. השתמש בצינור הבקרה ללא תווית כדי להגדיר את השער של חיוביות FITC ולקבל את אחוז FITC+ אירועים (המתאים כריכת ננו-חלקיקים).
- מקם 5 × 105 תאים בכל צינור FACS, צנטריפוגה במשך 10 דקות ב 300 × גרם, ו resuspend ב 0.5 מ"ל של PBS, 0.3% BSA בתוספת עם 0.1 מ"ג / מ"ל של ההכנות השונות של חלקיקים (HFn חשוף, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) שכותרתו בעבר עם FITC.
6. ניתוח סטטיסטי ושכפולים ניסיוניים
- חיות
- בצע שלושה ניסויים עצמאיים של גידול גידול ובידוד CAFs, באמצעות 8 בעלי חיים לניסוי יחיד, כפי שתואר ב 1.1.5. כדי למטב את תפוקת הבידוד של CAFs, חלק את הרקמות שנקטעו לקבוצות משנה (n=4) ועיבודן, בהתאם לשלבים המתוארים בסעיף 2.
- אינטראקציה עם HFn עם תאים
- להעריך את האינטראקציה של HFn פונקציונלי ולא פונקציונלי עם תאים היעד ולא היעד (CAFs ו 4T1, בהתאמה) במונחים של אחוז התאים מוכתמים חיובית על ידי nanocages תווית פלואורסצנטית. דווח על התוצאות כסטיית תקן ממוצעת ± של שלושה ניסויים עצמאיים.
- ניתוח סטטיסטי
- כדי לחשב את המשמעות הסטטיסטית בניסויים בכריכה של תאים עם HFn ו- HFn-FAP, השתמש במבחן ANOVA החד-כיווני הרגיל.
תוצאות
הגדרת מודל In vivo לבידוד CAFs אופטימלי
הזרקת 105 תאי 4T1-luc לתוך כרית השומן המאמרי של עכברי BALB/c הנשי מוביל לצמיחה של מסת גידול לגילוי ב 5 ימים לאחר ההשתלה. על ידי מדידת נפח הגידול על ידי calipers ואת הכדאיות של תא הגידול על ידי BLI, גידול היה במעקב במשך חודש לאחר ההשתלה. כדי למצוא חלון הקרבה המתאים לבידוד CAFs, נדרשה פשרה אופטימלית בין גודל גידול גבוה יותר לבין BLI מצד אחד וכיב גידול מתפתח ונמק מצד שני (איור 1). כאשר ליבה נמקית מופיעה 20 יום לאחר ההשתלה, והיא גדלה ב-25 ו-30 יום (כפי שתועד בתמונות BLI באיור 1C),היום ה-20 הוגדר כנקודת הזמן לייעול החלמת התא לאחר תהליך הבידוד. גם לאחר הסרת כל האזורים הנמקיים הנראים לעין במהלך השלבים הראשונים של טיפול בגידול ex vivo, אחוז גבוה של תאים מתים נמצא בסוף הניתוק לתאים בודדים (טבלה 1). כמו אחוז זה עשוי להיות רלוונטי, במיוחד עם הגידול בגודל הגידול, הסרת תאים מתים הוא תמיד הכרחי בעת עבודה עם מודל 4T1.
אופטימיזציה של הליך בידוד CAFs, תרבות ואפיון
נדרשים שני קטעים נוספים כדי לבודד את אוכלוסיית ה- CAFs (CD90.2+ CD45-) מלוח התאים הנאספים: דלדול הפיברובלסטים שאינם קשורים לגידול והעשרת פיברובלסטים הקשורים לגידול (איור 2). קוקטייל חרוזי הדלדול מסיר ביעילות CD45+ תאים (המהווה 67.35% ו-0.69% מכלל התאים לפני ואחרי הדלדול, בהתאמה, טבלה 2), ותמיד שימש לעיבוד גידול אחד בכל עמודה. כפי שמוצג בטבלה 1, מספר התאים האלוטים ירד מממוצע של 3 × 106 ל 1 × 105 לאחר שלב הדלדול. בשל ירידה מסיבית זו במספר התא הכולל, נוח לאגד את התאים שנאספו מלפחות 2 למקסימום של 4 גידולים בצינור אחד לפני שתמשיך בשלב העשרה. בכך, מספר מספיק של תאים הושג עבור דגירה עם חרוזים פיברובלסט הקשורים לגידול ועבר דרך עמודת הפרדה אחת כדי להשיג ממוצע סופי של 93% של CD90.2+ CD45- תאים(טבלה 2).
לאחר שנזרעו על לוחות תרבית הרקמות, תאים אלה התאוששו מחוברים לפלסטיק וחשפו מורפולוגיה גדולה בצורת ציר האופיינית לפיברובלסטים(איור 3A,B)ושונה מתאי הגידול 4T1(איור 3D). אי איגום גידולים לאחר דלדול גורם לתפוקה התאית עם חיידקי פיברובלסט הקשורים לגידול להיות נמוכה מדי כדי ליצור תרבות. במקרים אחרים, כאשר משך והטמפרטורה של הדגירה עם microbeads אינם נשמרים בקפידה, כמה כריכה לא ספציפית עלולה להתרחש. במקרים כאלה, שלבי ההעשרה היו פחות יעילים וגבוהים באחוזים של CD90.2- CD45+ ו- CD90.2- CD45- תאים נמצאו יחד עם CD90.2+ CAFs (5.97 ± 1.5 ו- 16.75 ± 1.1, בהתאמה) (איור 4 ולטבלה 3). תאים מזהמים אלה היו אחראים ככל הנראה לנוכחות בתרבות של שיבוטים קטנים עם מורפולוגיה שונה(איור 4B,ראשי חץ שחורים) שגדלו מהר יותר מ- CAFs וניצחו על תרבות CAF העיקרית(איור 4C). תוצאות תת-אופטימליות אלה אישרו את החשיבות של בדיקה כפולה תמיד הן של ביטוי CD90.2 והן CD45, כמו גם מורפולוגיה של תאים בסוף תהליך ההעשרה ובמהלך צמיחת התאים בתרבות.
שימוש בתאים מבודדים להערכת פוטנציאל פילוח CAF של ננו-דראגים מהונדסים
CAFs מבודד טרי יכול לשמש עבור מספר יישומים החל מחקר בסיסי מחקרים פרמקולוגיים. המטרה של קבוצה זו היא לפתח ננו-ים HFn שיכולים למקד במיוחד CAFs. HFn תפקד עם שבר נוגדן ספציפי נגד FAP (HFn-FAP) בשני חלבונים שונים: יחסי נוגדנים (נמוך יותר 1:1 וגבוה יותר 1:5), והקשירה שלהם עם CAFs נבדקה. מכיוון ש-FAP שימש כסמן ביולוגי על פני השטח של CAFs פרו-גידוליים, היה בעל חשיבות בסיסית לבדוק את ביטוי ה-FAP על CAFs מבודדים (איור 3C). ביטוי FAP היה אחריו מעל 5 קטעים בתרבות כדי לאשר כי תרבות CAF העיקרית שמרה על המאפיינים המקוריים שלה.
פונקציונליזציה FAP על HFn נמצא לתרום לשינוי משמעותי לקראת פילוח CAF בהשוואה HFn חשוף, ואת הכמות הנמוכה יותר של נוגדן (1:1) היה מספיק כדי לצפות בהשפעה זו (איור 5A). עם זאת, זה לא נצפתה עם הגידול 4T1 תאים המשמשים כדי להגדיר את מודל הגידול in vivo, שבו HFn חשוף הראה כריכה גבוהה יותר מאשר HFn פונקציונלי (איור 5B). זה היה ככל הנראה בשל היעדר ביטוי יתר FAP בתאי 4T1 ואת האינטראקציה המועדפת של HFn עם TfR1, אשר מסדיר את ספיגת HFn בתאים, כפי שדווח בהרחבה על ידי קבוצה זו27,33. תוצאות אלה מאשרות את התועלת של שימוש בתרבויות ראשוניות של CAFs השד כדי לסנן מראש את יכולת הפילוח של חלקיקים שנועדו להתמודד עם microenvironment הגידול.
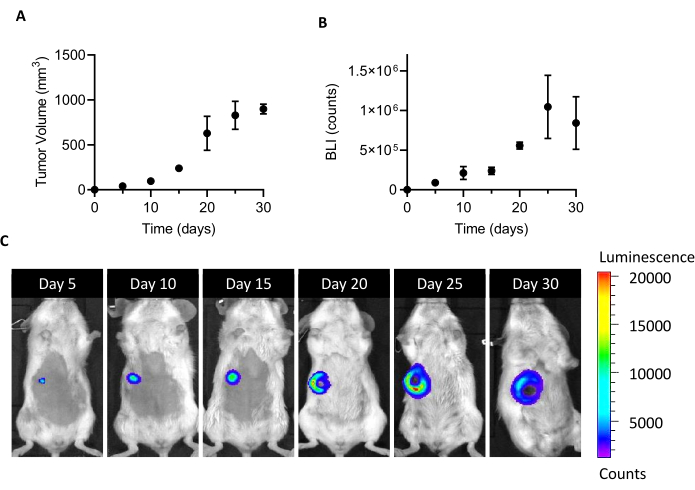
איור 1: הקמת מודל הגידול 4T1. תאים (105 תאים/עכבר) הוזרקו למשטח השומן של המאריים. גידול היה לאחר ימים 5, 10, 15, 20, 25, ו 30 לאחר ההשתלה (A) על ידי מדידת נפח הגידול עם calipers ו (B) על ידי הדמיה ביולומינציה. נפחי הגידול ו- BLI באים לידי ביטוי כמ"מ3 וסופר, בהתאמה. התוצאות מדווחות כממוצע ± SEM (n = 6). (C)תמונות מייצגות BLI התקבלו 5, 10, 15, 20, 25, ו 30 ימים לאחר השתלת התא לאשר צמיחת הגידול עד היום 25, כאשר נראה להגיע לרמה. בנקודת הניתוח האחרונה (30 יום), ה- BLI אינו גדל בהשוואה ליום 25. החל מיום 20, אזורים של נמק וכיב מתחילים להפוך גלויים בחלק המרכזי של הגידול. סולם צבעים: מינימום = 1,194, מקסימום = 20,462. קיצורים: BLI = הדמיית ביולומינציה; SEM = שגיאה סטנדרטית של הממוצע. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
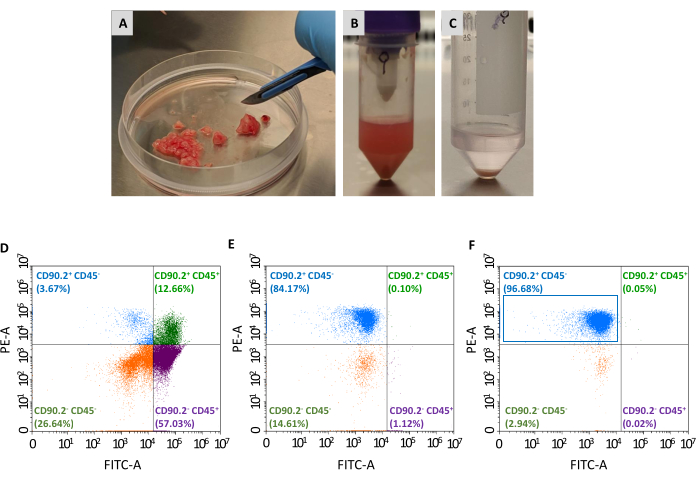
איור 2: הכנת דגימת גידול ואפיון ציטומטריית זרימה של CAFs מבודדים. גידולים נקטעו והופחתולחתיכותקטנות של כ 1-2 מ"מ בעזרת אזמל; (B)השעיית תא בודד לאחר עיכול רקמות וניתוק מכני של גידול מובא; (C)גלולה התא המתקבל לאחר תמותה של תאי דם אדומים; (D)ניתוח ציטומטריית זרימה של ביטוי CD45 ו- CD90.2 בתאים שהושגו לאחר הסרת תאי דם אדומים ותאים מתים, (E) לאחר דלדול של פיברובלסטים שאינם קשורים לסרטן, ו -( F) לאחר העשרה של פיברובלסטים הקשורים לסרטן, שם רוב התאים הם CD90.2+ CD45- (מלבן כחול). קיצורים: CAFs = פיברובלסטים הקשורים לסרטן; CD = אשכול של בידול; PE-A = אזור של פיקוריתרין; FITC-A = אזורים של פלואורסין איזוטיווציאאנט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
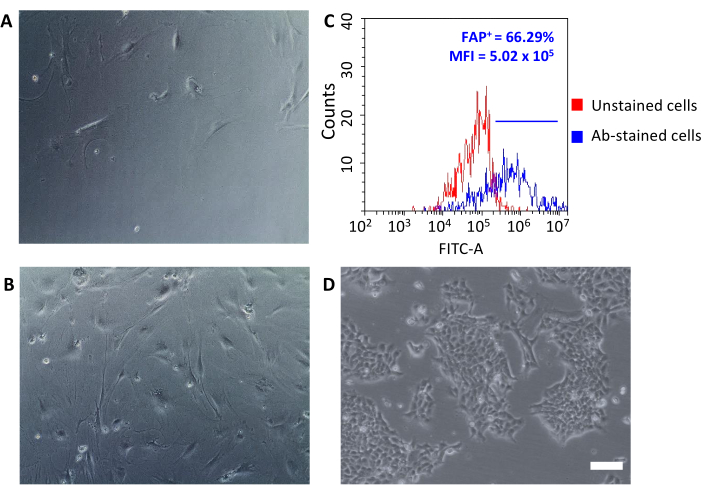
איור 3: ניתוח מורפולוגי של CAFs וביטוי FAP. (A, B)מורפולוגיה של CAFs נבדקה בכל מעברי התרבות על ידי מיקרוסקופיה אופטית (רמות שונות של מפגש במעבר 2 ומעבר 5) ובהשוואה לתאי גידול 4T1 (D) 4T1; סרגלי קנה מידה = 10 מיקרומטר. (C)ביטוי חלבון הפעלה פיברובלסט (FAP) הוערך על ידי ציטומטריית זרימה בסוף תהליך הבידוד על CD90.2+ CD45 שנאסףכדי לאשר את המאפיינים המולקולריים שלהם. סף פלואורסצנטיות נקבע בתאי בקרה לא מזוהמים (גרף אדום) כדי לכמת את עוצמת הפלואורסצנטיות הממוצעת ואת אחוז התאים החיוביים (FAP+) בקרב תאים מוכתמים בנוגדנים (גרף כחול). קיצורים: CAFs = פיברובלסטים הקשורים לסרטן; FAP = חלבון הפעלה פיברובלסט; CD = אשכול של בידול; MFI = עוצמת פלואורסצנטיות ממוצעת; Ab = נוגדן; FITC-A = אזור פלואורסצין איזוטיווציאאנט; FAP+ = תאים חיוביים ל- FAP. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: דוגמה לתהליך בידוד CAFs תת-אופטימלי. (A)הערכת ציטומטריית זרימה לאחר שלב הבידוד הסופי חשפה את נוכחותם של CD90.2 מזהמים- CD45+ ו- CD90.2- CD45- תאים. (B)תאים אלה יכולים להיראות כשיבוטים עם מורפולוגיה עגולה קטנה עם זריעה (ראשי חץ שחורים וחדירה בפינה השמאלית התחתונה של הלוח) כי (C) גבר על CAFs לאחר הקטע השלישי בתרבות. סרגלי קנה מידה = 10 מיקרומטר. קיצורים: CAF = פיברובלסט הקשור לסרטן; CD = אשכול של בידול; PE-A = אזור של פיקוריתרין; FITC-A = אזורים של פלואורסין איזוטיווציאאנט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
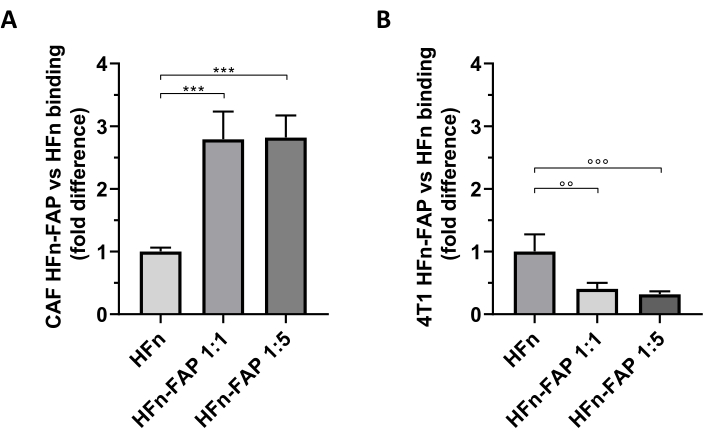
איור 5: כריכת ננו-ים של HFN על CAFs ו-4T1. ננו-גנים של HFN סומנו באופן פלואורסצנטי עם FITC, פונקציונליו עם שבר נוגדן נגד FAP (HFn-FAP) בשני יחסי חלבון-נוגדנים שונים (1:1 ו-1:5), ודגרו עם(A)CAFs יעד ו (B) 4T1 תאים ב 4 °C (2 שעות). כריכה הוערכה על ידי ציטומטריית זרימה. (A)כריכת HFn-FAP עם CAFs גדלה באופן משמעותי בשני ריכוזי שברי הנוגדנים פי שלושה בהשוואה ל- HFn החשוף. (B) לעומת זאת, כריכה גבוהה משמעותית של HFn חשוף נצפתה בתאי 4T1, שם הכריכה אינה משופרת על ידי זיהוי FAP. התוצאות מדווחות כסטיית תקן ממוצעת ± של שלושה ניסויים עצמאיים. p = 0.0003; °° p = 0.0021 ; °°° p = 0.0008. קיצורים: CAFs = פיברובלסטים הקשורים לסרטן; FAP = חלבון הפעלה פיברובלסט; HFn = גרסה רקומביננטית של שרשרת כבדה פריטין אנושי המשמש ננו-חלקיק חשוף או מצומד; HFN-FAP = חלקיקי HFN פונקציונליים עם החלק המשתנה של נוגדן נגד FAP שהוכן בשני יחסי HFn:Fab@FAP טוחנת, 1:1 ו- 1:5. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| מספר תא (ממוצע ± SD) | סה"כ תפוקת מיצוי (לכל מעבר) | |
| גידול מובא (לאחר הסרת תאי דם אדומים) | 1.27 x 108 ± 9.81 x 107 | 100% |
| גידול מובא (לאחר הסרת תאים מתים) | 3.01 x 106 ± 9.61 x 105 | 2.38% |
| קוקטייל לאחר דלדול | 1.15 x 105 ± 4.95 x 104 | 0.11% (3.82%) |
| לאחר העשרה | 3.00 x 104 ± 1.2 x 104 | 0.027% (26.09%) |
טבלה 1: ספירת תאים כוללת לאחר כל שלב של בידוד של פיברובלסטים הקשורים לסרטן.
| התפלגות תאים (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| גידול מובא (לאחר הסרת תאים מתים) | 1.81 ± 0.98 | 10.78 ± 4.51 | 56.57 ± 14.05 | 28.20 ± 17.57 |
| קוקטייל לאחר דלדול | 69.33 ± 16.75 | 0.14 ± 0.13 | 0.55 ± 0.63 | 39.89 ± 30.31 |
| לאחר העשרה | 93.14 ± 3.3 | 0.09 ± 0.1 | 0.09 ± 0.08 | 6.69 ± 3.4 |
טבלה 2: הפצת תאים על פי ביטוי של CD90.2 ו- CD45 לאחר כל מעבר של בידוד של פיברובלסטים הקשורים לסרטן.
| התפלגות תאים (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| לאחר העשרה (ללא איגום) | 75.80 ± 2.9 | 1.49 ± 0.4 | 5.97 ± 1.5 | 16.75 ± 1.1 |
טבלה 3: CD90.2 ו- CD45 ביטוי של תאים שנאספו לאחר ניסוי בידוד פיברובלסט הקשור לסרטן תת-אופטימלי.
Discussion
CAFs מתגלים כשחקני מפתח בשיפוץ מטריצה חוץ תאית, קידום התקדמות גרורות והגבלת הגישה לתרופות לאתר הגידול34. עם זאת, בשל ההטרוגניות שלהם, תפקידיהם עדיין שנויים במחלוקת – חלק מה-CAFs הם גידוליים, בעוד שלתת-סוגים אחרים יש תפקיד מדכא גידולים. בהקשר זה, הבידוד שלהם יכול להיות עניין קיצוני לשפוך אור נוסף על תפקידם השנוי במחלוקת בהתקדמות הסרטן, אשר יהיו השלכות קליניות חשובות12,31. יתר על כן, מיצוי CAF מוצלח ממודלים אנושיים ופרה-אקליניים של גידול עכברים יקל גם על פיתוח תרופות חדשות למיקוד CAF. מאמר זה מדווח על שיטה לבודד ביעילות ותרבות CAFs ראשוני ממודל פרה-אקליני של סרטן השד. בהתבסס על ניסיון, שלושה צעדים ניסיוניים משפיעים בעיקר על הצלחת הפרוטוקול.
הראשון עובד מהר כדי למנוע צבירה של השעיות תאים הקשורים לסיכון של קרישה בעמודה והאטה של שפכים תאים: למעשה, כאשר תאים שעברו דרך העמודה היו מקובצים יחד, ההסתברות של תהליך בידוד תת אופטימלי גדל, ואת התרבויות הסופיות הכילו שיבוטים תאים "מזהמים". השני הוא איגום תאים מגידולים שונים לאחר מעבר הדלדול כדי להבטיח מספיק תאים לעבור בשלב ההעשרה הסופי. הבעיה הקריטית הסופית היא ציפוי התאים שחולצו בצפיפות תאים גבוהה, ככל הנראה החל מבאר אחת של צלחת 24-well כדי להגביר את צמיחת התאים ואת הרחבת המושבה עבור עד 4-5 מעברים. אם התאים נזרעו בצפיפות נמוכה, הם התרחבו על פני השטח החופשיים והפסיקו במהירות לשכפל.
מספר מחקרים כבר תיארו שיטות מיצוי CAF ממוצא אנושי ועכבר, כדי ללמוד את תפקידם בקידום התפתחות סרטן ו פולשניות. זה נעשה בסוגים רבים של גידולים, כולל סרטן השד, מלנומה, cholangiocarcinoma, ואדנוקרצינומההלבלב 35,36,37,38. עם זאת, בשל היעדר סמני CAF ספציפיים ועל ההטרוגניות שלהם, התוצאות של תהליכים אלה עדיין תת אופטימלי.
כאן, התאים המבודדים שימשו לאימות יכולת פילוח CAF של ננו-נצ'ים HFn פונקציונליים עם moieties מיקוד נגד FAP. השימוש בתרבויות ראשוניות של CAFs היה יתרון משמעותי, המאפשר אימות של ex vivo nanostrategy עם ניסוי מחייב הרבה יותר פשוט וחסכוני מאשר לעשות את זה ישירות vivo בשלב ראשוני זה של אופטימיזציה nanodrug.
במובן זה, בדיקות ex vivo על CAFs יכול להקדים בניסויים בבעלי חיים vivo על ידי מתן אפשרות הקרנה ובחירה של חלקיקים מבטיחים ביותר עבור מיקוד אופטימלי של CAF. מודל CAF המוצג כאן עשוי לשמש גם למחקרי יעילות ראשוניים, בעת טעינת חלקיקים עם תרופות פעילות. בעלי חיים ישמשו רק מאוחר יותר להערכת ייחוס ביולוגי, פרמקוקינטיקה, ומחקרי יעילות.
מספר ננו-דראגים ממוקדי CAF מפותחים, כגון ננו-ים של פריטין לטיפול פוטודינמי בסרטן השד וחלקיקים מבוססי פפטיד כדי לספק דוקסורוביצין במודלים של סרטן הערמונית39,40. עם זאת, לא הרבה מחקרים התמקדו בבידוד של CAFs כפלטפורמות תאים עבור אופטימיזציה nanodrug.
לפרוטוקול זה יש כמה מגבלות. ראשית, זהו פרוטוקול גוזל זמן, הדורש הכנה ורכישה של מספר ריאגנטים וחומרים. שנית, בשל המחסור של CAFs בגידול השד 4T1, התשואה שלהם נמוכה. ניסויי ננו-חלקיקים צריכים להיות מתוכננים ומבוצעים ברגע שמספר התא הנדרש מושג, כמו CAFs ראשוני לעבור senescence ולא ניתן לשמור על התרבות במשך זמן רב. לסיכום, שיטה זו של בידוד CAFs, culturing, ואפיון יכול להיות כלי רב עוצמה כדי להאיץ את הפיתוח של nanomedicines ממוקד חדש במאבק נגד סרטן.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי Associazione Italiana per la Ricerca סול Cancro (AIRC) תחת IG 2017-ID. 20172 פרויקט – P.I. קורסי פאביו. SM מכירה במרכז המחקר הקליני לילדים "רומיאו ואנריקה אינברניצי" התומך בעמדתה. AB מודה AIRC (ID. 20172 פרויקט) ואוניברסיטת מילאנו עבור מלגת מחקר. מלגות פוסט-דוקטורט ודו-דוקטורט של LS ותל.אס נתמכות על ידי אוניברסיטת מילאנו.
Materials
| Name | Company | Catalog Number | Comments |
| ACK Lysing buffer | Lonza | 10-548E | Store at +15° to +30 °C. |
| Alexa Fluor 488 goat anti-human antibody | Immunological Science | IS-20022 | Protect from light. |
| Anti-FAP Fab fragment (3F2) | Creative Biolabs | TAB-024WM-F(E) | |
| BALB/c mice | Charles River | 028BALB/C | 7 weeks old female mice |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | Store at 2-8 °C. |
| CD45 antibody | Miltenyi Biotec | 130-110-796 | FITC-conjugated fluorescent antibody; clone REA 737; Store protected from light at 2–8 °C. |
| CD90.2 antibody | Miltenyi Biotec | 130-102-960 | PE-conjugated fluorescent antibody; clone 30-H12; Store protected from light at 2–8 °C. |
| Cell strainers 70 µm | VWR | 732-2758 | |
| CytoFLEX | Beckman Coulter | laser configuration B4-R2-V0 | |
| Dead cell Removal Kit | Miltenyi Biotec | 130-090-101 | contains 10 mL of Dead Cell Removal MicroBeads; 25 mL of 20× Binding Buffer Stock Solution. Store protected from light at 2−8 °C. |
| D-Luciferin | Caliper | 760504 | reagent for in vivo imaging |
| DMEM High Glucose w/o L-Glutamine w/ Sodium Pyruvate | Euroclone | ECB7501L | Warm at 37 °C in a water bath before use. |
| DMSO | Sigma-Aldrich | D2650 | |
| DPBS w/o Calcium, w/o Magnesium | Euroclone | ECB4004L | Keep at room temperature. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E9884 | |
| Fetal Bovine Serum | Euroclone | ECS0180L | Before use, heat at 56 °C for 30 min to kill all the complement proteins. |
| Fluorescein Istothiocyanate isomer I (FITC) | Sigma-Aldrich | F7250 | Store protected from light at 2–8 °C. |
| GentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | They are used in combination with the gentleMACS Dissociator. |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | Two samples can be processed in parallel. Special protocols have been developed for various tissues. |
| Goat serum | Euroclone | ECS0200D | |
| Ham's F12 w/o L-Glutamine | Euroclone | ECB7502L | Warm at 37 °C in a water bath before use. |
| IVIS Lumina II imaging system | Caliper Life Sciences | This imaging system is easy to use for both fluorescent and bioluminescent imaging in vivo. Equipped with a Living Image Software for analysis | |
| LD columns | Miltenyi Biotec | 130-042-901 | Composed of ferromagnetic spheres, designed for stringent depletion of unwanted cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use |
| L-Glutamine | Euroclone | ECB3000D | 200 mM stock |
| Light/fluorescence microscope equipped with camera | Leica Microsystems | DM IL LED Fluo/ ICC50 W CameraModule | inverted microscope for live cells with camera |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Separation Unit | Miltenyi Biotec | 130-090-976 | Position the magnet on appropriate stand before use. |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MS columns | Miltenyi Biotec | 130-042-201 | Composed of ferromagnetic spheres, designed for positive selection of cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use. |
| Mycoplasma Removal Agent | Euroclone | ECMC210A | Dilute in culture medium 1:100. |
| NaHCO3 | Invitrogen | A10235 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000C | |
| Non essential aminoacids | Euroclone | ECB3054D | |
| Penicillin-Streptomycin | Euroclone | ECB3001D | |
| Recombinant Human apoferritin H-homopolymer (HFn) | Molirom | MLR-P018 | |
| RPMI 1640 w/o L-Glutamine | Euroclone | ECB9006L | Warm at 37 °C in a water bath before use. |
| Tumor-Associated Fibroblast Isolation kit | Miltenyi Biotec | 130-116-474 | Contains 1 mL of Non-Tumor-Associated Fibroblast Depletion Cocktail, mouse; 1 mL of CD90.2 (Tumor-Associated Fibroblast) MicroBeads,mouse. Store protected from light at 2-8 °C. |
| Tumor Dissociation Kit | Miltenyi Biotec | 130-096-730 | Contains lyophilized enzymes (D, R, A) and buffer A; reconstitute enzymes according to the manufacturer's instructions, aliquot and store at - 20 °C. |
| Trypan blue 0.4% | Lonza | 17-942E | dilute 1:1 with a sample of cell suspension before counting the cells |
| TrypLE select | Gibco | 12563-029 | use at room temperature |
| Trypsin-EDTA | Lonza | BE17-161E | Warm at 37 °C in a water bath before use |
| T75 Primo TC flask | Euroclone | ET7076 | |
| Zeba Spin Desalting Columns | Thermo Fisher Scientific | 89890 | 7K MWCO, 2 mL |
| 1.5 mL tubes | Biosigma | CL15.002.0500 | |
| 15 mL tubes | Euroclone | ET5015B | |
| 4T1-luc2 | Caliper | Mouse mammary gland cancer cell line stably transfected with firefly luciferase gene | |
| 50 mL tubes | Euroclone | ET5050B |
References
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nature Medicine. 19 (11), 1423-1437 (2013).
- Velaei, K., Samadi, N., Barazvan, B., Soleimani Rad, J. Tumor microenvironment-mediated chemoresistance in breast cancer. Breast. 30, 92-100 (2016).
- Cheng, J. D., Weiner, L. M., et al. Tumors and their microenvironments: tilling the soil. Commentary re: A. M. Scott et al., A Phase I dose-escalation study of sibrotuzumab in patients with advanced or metastatic fibroblast activation protein-positive cancer. Clinical Cancer Research. 9 (5), 1690-1695 (2003).
- Hui, L., Chen, Y. Tumor microenvironment: Sanctuary of the devil. Cancer Letters. 368 (1), 7-13 (2015).
- Balkwill, F. R., Capasso, M., Hagemann, T. The tumor microenvironment at a glance. Journal of Cell Science. 125, 5591-5596 (2012).
- Chen, X., Song, E. Turning foes to friends: targeting cancer-associated fibroblasts. Nature Review. Drug Discovery. 18 (2), 99-115 (2019).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Seminars in Cell & Developmental Biology. 21 (1), 33-39 (2010).
- LeBleu, V. S., Kalluri, R. A peek into cancer-associated fibroblasts: origins, functions and translational impact. Disease Models & Mechanisms. 11, (2018).
- Li, X. -Y., Hu, S. -Q., Xiao, L. The cancer-associated fibroblasts and drug resistance. European Review for Medical and Pharmacological Sciences. 19 (11), 2112-2119 (2015).
- Luo, H., Tu, G., Liu, Z., Liu, M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Letters. 361 (2), 155-163 (2015).
- Truffi, M., Sorrentino, L., Corsi, F. Fibroblasts in the tumor microenvironment. Advances in Experimental Medicine and Biology. 1234, 15-29 (2020).
- Sugimoto, H., Mundel, T. M., Kieran, M. W., Kalluri, R. Identification of fibroblast heterogeneity in the tumor microenvironment. Cancer Biology & Therapy. 5 (12), 1640-1646 (2006).
- Costa, A., et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell. 33 (3), 463-479 (2018).
- Ishii, G., Ochiai, A., Neri, S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Advances Drug Delivery Reviews. 99, Part B 186-196 (2016).
- Chen, Q., et al. Remodeling the tumor microenvironment with emerging nanotherapeutics. Trends in Pharmacological Sciences. 39 (1), 59-74 (2018).
- Truffi, M., et al. Nano-strategies to target breast cancer-associated fibroblasts: rearranging the tumor microenvironment to achieve antitumor efficacy. International Journal of Molecular Sciences. 20 (6), 1263(2019).
- Tong, R., Langer, R. Nanomedicines Targeting the Tumor Microenvironment. Cancer Journal. 21 (4), 314-321 (2015).
- Kaps, L., Schuppan, D. Targeting cancer associated fibroblasts in liver fibrosis and liver cancer using nanocarriers. Cells. 9 (9), 2027(2020).
- Miao, L., et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors. Cancer Research. 77 (3), 719-731 (2017).
- Kelly, T., Huang, Y., Simms, A. E., Mazur, A. Fibroblast activation protein-α: a key modulator of the microenvironment in multiple pathologies. International Review of Cell and Molecular Biology. 297, 83-116 (2012).
- Brennen, W. N., Isaacs, J. T., Denmeade, S. R. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy. Molecular Cancer Therapeutics. 11 (2), 257-266 (2012).
- Juillerat-Jeanneret, L., Tafelmeyer, P., Golshayan, D. Fibroblast activation protein-α in fibrogenic disorders and cancer: more than a prolyl-specific peptidase. Expert Opinion on Therapeutic Targets. 21, 977-991 (2017).
- Falvo, E., et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin. Nanoscale. 5 (24), 12278-12285 (2013).
- Truffi, M., et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research. 107, 57-65 (2016).
- Cai, Y., et al. Enhanced magnetic resonance imaging and staining of cancer cells using ferrimagnetic H-ferritin nanoparticles with increasing core size. International Journal of Nanomedicine. 10, 2619-2634 (2015).
- Heger, Z., Skalickova, S., Zitka, O., Adam, V., Kizek, R. Apoferritin applications in nanomedicine. Nanomedicine. 9 (14), 2233-2245 (2014).
- Mazzucchelli, S., et al. Nanometronomic treatment of 4T1 breast cancer with nanocaged doxorubicin prevents drug resistance and circumvents cardiotoxicity. Oncotarget. 8 (5), 8383-8396 (2017).
- Yu, Q., et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy. Journal of Controlled Release. 321, 564-575 (2020).
- Mertens, J. C., et al. Therapeutic effects of deleting cancer-associated fibroblasts in cholangiocarcinoma. Cancer Research. 73 (2), 897-907 (2013).
- Kovács, D., et al. Core-shell nanoparticles suppress metastasis and modify the tumour-supportive activity of cancer-associated fibroblasts. Journal of Nanobiotechnology. 18, 18(2020).
- Sharon, Y., Alon, L., Glanz, S., Servais, C., Erez, N. Isolation of normal and cancer-associated fibroblasts from fresh tissues by Fluorescence Activated Cell Sorting (FACS). Journal of Visualized Experiments. (71), e4425(2013).
- Sitia, L., et al. Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax. Cells. 10 (2), 328(2021).
- Bellini, M., et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells. Journal of Controlled Release. 196, 184-196 (2014).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nature Reviews Cancer. 20, 174-186 (2020).
- Dvořánková, B., Lacina, L., Smetana, K. Isolation of normal fibroblasts and their cancer-associated counterparts (CAFs) for biomedical research. Methods in Molecular Biology. 1879, 393-406 (2018).
- Calvo, F., Hooper, S., Sahai, E. Isolation and immortalization of fibroblasts from different tumoral stages. Bio-protocol. 4 (7), 1097(2014).
- Sha, M., et al. Isolation of cancer-associated fibroblasts and its promotion to the progression of intrahepatic cholangiocarcinoma. Cancer Medicine. 7 (9), 4665-4677 (2018).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Zhen, Z., et al. Protein nanocage mediated fibroblast-activation protein targeted photoimmunotherapy to enhance cytotoxic T cell infiltration and tumor control. Nano Letters. 17 (2), 862-869 (2017).
- Ji, T., et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery. Advances Materials. 27 (11), 1865-1873 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved