Method Article
Aislamiento de fibroblastos asociados al cáncer primario a partir de un modelo murino singénico de cáncer de mama para el estudio de nanopartículas dirigidas
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo tiene como objetivo proporcionar un protocolo para el aislamiento y cultivo de fibroblastos asociados al cáncer primario a partir de un modelo murino singénico de cáncer de mama triple negativo y su aplicación para el estudio preclínico de nuevas nanopartículas diseñadas para dirigirse al microambiente tumoral.
Resumen
Los fibroblastos asociados al cáncer (CAF) son actores clave en el contexto del microambiente tumoral. A pesar de ser reducidos en número en comparación con las células tumorales, los CAF regulan la progresión del tumor y proporcionan protección contra la inmunidad antitumoral. Las estrategias anticancerígenas emergentes tienen como objetivo remodelar el microambiente tumoral a través de la ablación de CAF pro-tumorigénicos o la reprogramación de las funciones de CAF y su estado de activación. Un enfoque prometedor es el desarrollo de agentes de administración de tamaño nanométrico capaces de dirigirse a los CAF, lo que permite la administración específica de medicamentos y moléculas activas. En este contexto, un modelo celular de CAF puede proporcionar una herramienta útil para el cribado in vitro y la investigación preliminar de tales nanoformulaciones.
Este estudio describe el aislamiento y cultivo de CAF primarios del modelo murino 4T1 singénico de cáncer de mama triple negativo. Se utilizaron perlas magnéticas en un proceso de separación de 2 pasos para extraer CAF de tumores disociados. El control del inmunofenotipado se realizó mediante citometría de flujo después de cada pasaje para verificar el rendimiento del proceso. Se pueden emplear CAF aislados para estudiar la capacidad de orientación de diferentes nanoformulaciones diseñadas para abordar el microambiente tumoral. Se utilizaron nanocirágenas de ferritina H marcados fluorescentemente como nanopartículas candidatas para configurar el método. Las nanopartículas, ya sea desnudas o conjugadas con un ligando dirigido, se analizaron para su unión a los CAF. Los resultados sugieren que la extracción ex vivo de LOS CAF de mama puede ser un sistema útil para probar y validar nanopartículas para la orientación específica de los CAF tumorígenos.
Introducción
Durante las últimas décadas, ha quedado claro que matar las células tumorales generalmente no es suficiente para erradicar la malignidad, ya que el microambiente tumoral puede provocar una recaída tumoral e inducir resistencia terapéutica1,2. Entonces ha surgido un nuevo paradigma: dirigirse al estroma tumoral para privar al tumor de factores de apoyo y, por lo tanto, aumentar la eficacia de la quimioterapéutica3,4,5. En particular, los fibroblastos asociados al cáncer (CAF) son una diana estromal interesante en muchos tumores sólidos6,7. Los CAF son un grupo muy heterogéneo de células que interactúan con las células cancerosas y las células del sistema inmunitario a través de la secreción de factores de crecimiento, citoquinas y quimiocinas; construir y remodelar la matriz extracelular; y permiten la formación de metástasis8,9,10,11,12. Dependiendo del tipo de tumor, los CAF muestran funciones pro-tumorigénicas, mientras que otros subtipos de CAF parecen tener funciones supresoras de tumores13,14. Para aclarar mejor esta dicotomía, es importante una caracterización exhaustiva de los CAF de los tumores primarios y metastásicos.
En este contexto, un campo de investigación emergente se ha centrado en el desarrollo de agentes de tamaño nanométrico diseñados para atacar y/o destruir LOS CAF mediante la entrega de moléculas activas y fármacos capaces de remodelar el microambiente tumoral15,16,17,18. Se han diseñado varios tipos de nanopartículas para lograr la ablación de CAF por fármacos citotóxicos, para inducir la terapia fotodinámica dirigida a CAF, o para reprogramar las CAF revirtiéndolas a un estado de reposo o induciendo la expresión de ligando inducida por apoptosis relacionada con TNF, que induce la apoptosis de las células cancerosas vecinas16,19. Además, el potencial de muchas nanopartículas para dirigirse activamente a marcadores biológicos específicos da lugar a la esperanza de seleccionar subconjuntos de CAF para apuntar. Aunque todavía se cuestiona su especificidad absoluta para CAF, la proteína de activación de fibroblastos (FAP) es uno de los objetivos más prometedores del estroma protumoral y se explota para dirigir la administración de nanofármacos, allanando así el camino para el desarrollo de nanoterapéuticas dirigidas a CAF20,21,22.
Este artículo describe el aislamiento de los CAF primarios de un modelo singénico de cáncer de mama murino e informa de su uso en el estudio de la capacidad de focalización de nanopartículas diseñadas para reconocer el marcador CAF, FAP. Las nanocigas de ferritina se utilizan como nanosistemas candidatos para configurar el método, ya que su especificidad de entrega puede estar determinada por la exposición superficial de las partes objetivo23,24. Además, se ha demostrado con éxito que las ferritinas son excelentes lanzaderas biocompatibles para aplicaciones antitumorales, desencadenando una rápida acumulación de la carga útil en la masa tumoral25,26,27. Hasta la fecha, los estudios preclínicos de nanosistemas dirigidos a CAF han implicado pruebas in vitro en líneas celulares de fibroblastos estimuladas en cultivo con factor de crecimiento transformante beta para inducir la activación celular y la expresión de algunas características inmunofenotípicas de los CAF28,29. Este método se aplica generalmente a líneas celulares inmortalizadas (como NIH3T3, LX-2) y es bastante rápido y simple, produciendo células activadas en unas pocas horas o días. Una limitación es que aunque la estimulación in vitro induce la expresión de algunos genes atribuidos a miofibroblastos activados, no puede recapitular por completo todas las características biológicas de los CAF reales, especialmente su heterogeneidad in vivo.
Otra estrategia consiste en la extracción de CAF primarios de muestras de tumores humanos o deratón 30,31. Esto asegura que la activación de CAF se produce en un contexto fisiológico, y que se mantiene la heterogeneidad de las subpoblaciones de CAF. De acuerdo con el objetivo de la investigación, los CAF pueden derivarse de diferentes fuentes, ofreciendo así la posibilidad de estudiar la condición más confiable. El protocolo reportado aquí sería valioso para los científicos que buscan realizar una evaluación preliminar de la funcionalidad de las nuevas nanopartículas diseñadas para atacar a los CAF de un modelo de cáncer de mama murino. Los CAF aislados serían útiles para examinar aquellas nanopartículas que son lo suficientemente prometedoras como para proceder a la evaluación in vivo en modelos animales de cáncer. Esto será relevante durante los primeros pasos de la producción de nanopartículas, impulsando a los nanotecnólogos hacia el refinamiento del diseño de nanopartículas al considerar principalmente la estrategia de inmovilización de ligandos para lograr propiedades óptimas de focalización.
Protocolo
1. Establecimiento de un modelo singénico 4T1 de cáncer de mama
NOTA: El presente protocolo describe el aislamiento de los CAF primarios de un tumor de mama 4T1 de ratón. El estudio en animales descrito aquí ha sido aprobado por el Ministerio de Salud italiano (número de registro 110/2018-PR).
- Cultivo e implantación de células tumorales
- Descongelar 1 ×10 6 células 4T1-luc en un matraz T75 con 10 ml de medio Roswell Park Memorial Institute (RPMI) 1640 suplementado con suero bovino fetal (FBS) al 10%, penicilina/estreptomicina al 1% (P/S) y L-glutamina al 1%. Añadir el agente de eliminación de micoplasma (1:100) en el medio de cultivo.
NOTA: Las células 4T1-luc expresan de manera estable la luciferasa y pueden visualizarse por bioluminiscencia (BLI) tras la estimulación adecuada con D-luciferina. Esto permite monitorizar in vivo la viabilidad y proliferación de células tumorales tras la implantación en ratones(Figura 1). - Mantenga las células a 37 °C y 5% de CO2 en una atmósfera humidificada hasta ~80% de confluencia, cambiando el medio cada 2 días.
NOTA: Continúe el tratamiento con el agente de eliminación de micoplasma durante 1 semana (~ 2/3 pasajes) antes de la inyección en ratones para asegurarse de que las células inyectadas estén libres de micoplasma. - El día del procedimiento, separe las células utilizando 1 ml de solución de ácido tripsina-etilendiaminatetraacético (EDTA) (tripsina 1:250) durante 5 min a 37 °C. Detenga la actividad de la tripsina agregando medio de cultivo, cuente las células con azul de tripano (1:1) y calcule el número de células/ml.
- Pipetear el volumen correspondiente a 1 × 106 celdas y centrifugar durante 5 min a 400 × g. Vierta el sobrenadante y vuelva a gastar el pellet en 1 ml de medio base RPMI 1640. Mantenga las células en hielo hasta que estén listas para la inyección.
NOTA: Para cada ratón, se necesitan 1 × 105 celdas; sin embargo, siempre calcule para un exceso de 2 ratones (correspondiente a 2 × 105 células) para facilitar la carga de la jeringa. - Un día antes de la operación, afeitar el pelaje de 8 ratones BALB / c (hembra, de siete semanas de edad) para exponer el área de las glándulas mamarias abdominales en el lado derecho. Use una afeitadora eléctrica y aplique una capa delgada de crema depilatoria durante 4 minutos; luego, lava la crema con agua y un pedazo de papel.
- Inducir anestesia por inhalación continua de gas isoflurano al 2% durante ~5 min, y realizar una inyección subcutánea en la región de las glándulas mamarias abdominales con una jeringa de tuberculina de 27 G. Gire la aguja hacia arriba para entrar en la piel por vía subcutánea; luego, sostenga la piel hacia arriba e inyecte lentamente 100 μL de suspensión celular (1 × 105 células). Gire ligeramente la aguja antes de retraer lentamente la jeringa.
NOTA: Recuerde llevar la suspensión celular a temperatura ambiente 15 minutos antes de la inyección.
- Descongelar 1 ×10 6 células 4T1-luc en un matraz T75 con 10 ml de medio Roswell Park Memorial Institute (RPMI) 1640 suplementado con suero bovino fetal (FBS) al 10%, penicilina/estreptomicina al 1% (P/S) y L-glutamina al 1%. Añadir el agente de eliminación de micoplasma (1:100) en el medio de cultivo.
- Crecimiento tumoral y disección
- A los 5 días después de la inyección celular, inyecte 150 mg/kg de D-luciferina por vía intraperitoneal (100 μL) 5 min antes de la toma de imágenes. Capture imágenes BLI utilizando un sistema de imágenes in vivo que establece la exposición de 10 s, el binning medio y el f/stop a 4. Defina el área luminiscente del tumor como la región de interés (ROI) y cuantifique la señal total en el ROI (fotón/seg/m2)utilizando un software de imágenes.
- Repita el procedimiento de obtención de imágenes (1.2.1) cada 5 días a partir de la inyección para controlar el crecimiento del tumor en términos de un aumento de la BLI.
- Para establecer el volumen del tumor, sostenga al ratón y exponga su vientre. Use pinzas para medir la longitud (L) y el ancho (W) del tumor una vez a la semana. Calcular el volumen tumoral (V) usando la ecuación 1.
[V = (L x W2)/2] (1) - A los 20 días después de la inyección celular, sacrifique a los animales por dislocación cervical, disociar los tumores de la piel con tijeras y recogerlos en una solución de almacenamiento de tejido (consulte la Tabla de materiales).
NOTA: Las muestras tumorales pueden utilizarse inmediatamente para la disociación en células individuales (sección 2) o almacenarse a 4 °C durante un tiempo de hasta 48 h.
2. Disociación tumoral en células individuales
NOTA: Para los siguientes pasos, use reactivos estériles y desechables en una campana de flujo laminar. Trabajar con 4 tumores a la vez.
- Coloque la muestra del tumor en una placa de Petri y extraiga cuidadosamente cualquier fragmento de piel, grasa y áreas necróticas con la ayuda de pinzas y bisturí. Luego, reduzca el tumor en pequeños trozos de aproximadamente 1-2 mm y transfiéralos a un tubo(Figura 2A).
NOTA: Los tumores 4T1 se vuelven altamente necróticos mientras crecen, con tendencia a la ulceración. Es importante retirar cuidadosamente las áreas necróticas para evitar cualquier interferencia de escombros con los siguientes pasos. - Prepare una mezcla de digestión para la disociación tumoral: mezcle 2,35 ml de medio RPMI 1640, 100 μL de enzima D, 50 μL de enzima R y 12,5 μL de enzima A. Remoje los fragmentos tumorales en la solución y cierre firmemente el tubo.
NOTA: Los volúmenes indicados de mezcla de digestión son válidos para tumores de hasta 1 g y pueden ajustarse para tumores más grandes según su peso. Los tumores 4T1 cultivados durante 20 días normalmente están en un rango de 0.5 a 0.8 g. - Gire el tubo boca abajo, comprobando que todos los trozos de tumor se encuentran en la parte inferior del tubo hacia la tapa. Conecte el tubo a un disociador mecánico en la carcasa adecuada y ejecute un programa de disociación específico diseñado para tumores difíciles (consulte las instrucciones del fabricante).
NOTA: Es posible que se requieran tubos especiales para encajar en el disociador. Los tubos en C llevan un rotor dentro de la tapa para promover la disociación mecánica del tejido. - Separe el tubo, manténgalo boca abajo e incube la muestra a 37 °C durante 40 min con un suave agitación. Luego, conecte el tubo al disociador en la carcasa adecuada y ejecute el siguiente programa de disociación específico diseñado para tumores difíciles dos veces. Asegúrese de que no haya grandes trozos de tejido al final del procedimiento(Figura 2B).
NOTA: Para disociar el tumor, se podrían usar otros cócteles enzimáticos para degradar la matriz extracelular. Sin embargo, en este protocolo, se utilizó un kit de disociación tumoral disponible comercialmente que contiene una mezcla de enzimas optimizada (enzimas D, R, A) y un disociador semiautomatizado que disocia mecánicamente el tejido. Esta combinación aseguró una degradación adecuada de la matriz extracelular junto con el mantenimiento de la integridad celular y los epítopos de la superficie celular. - Filtre la muestra a través de un colador de células de 40 μm en un tubo de 50 ml, lave el filtro con 10 ml de medio RPMI 1640 y centrífuga el tubo durante 7 minutos a 300 × g. Si el gránulo celular aparece rojo, lise los eritrocitos agregando 1 ml de tampón de lisado de cloruro de amonio-potasio (ACK) durante 5 minutos a temperatura ambiente, lave con 10 ml de RPMI 1640, transfiera la suspensión celular en un tubo de 15 ml y centrífuga nuevamente.
- Resuspend el pellet en 1 mL de tampón PBE compuesto de solución salina tamponada con fosfato (PBS), albúmina sérica bovina (BSA) al 0,5% y EDTA 2 mM, y contar las células con azul de tripano (1:1). En caso de grupos celulares, filtre la suspensión celular a través de un colador celular de 70 μm, previamente empapado con PBS.
NOTA: Especialmente cuando los tumores son grandes, es importante verificar el recuento de células y, finalmente, dividir cada muestra de tumor en diferentes tubos con no más de 107 células en cada tubo antes de proceder al paso 2.7. - Prepare el tampón de unión de eliminación de células muertas diluyendo la solución de almacenamiento intermedio de unión 20x (consulte la Tabla de materiales)con agua estéril de doble destilación. Lavar las celdas con 5 ml de tampón de unión de 1× (Figura 2C).
NOTA: Mantenga el búfer a 4 °C. - Centrifugar durante 7 min a 300 × g, y resuspend el pellet celular con 0,1 mL de microperlas de eliminación de células muertas (ver la Tabla de Materiales). Mezclar bien e incubar a temperatura ambiente durante 15 min.
- Durante la incubación con cuentas, prepare un soporte magnético debajo del capó y cuelgue columnas de separación ferromagnética (una columna para hasta 107 celdas) con las puntas apuntando hacia abajo. Equilibre las columnas con 0,5 ml de búfer de unión frío de 1×. Espere hasta que la solución haya fluido bajo gravedad.
NOTA: Es importante no exceder el número de células por columna para evitar cualquier riesgo de coagulación del lecho de la columna y reducir el rendimiento de recuperación. Cuando trabaje con más de 107 celdas, use más columnas de acuerdo con el número total de celdas o use columnas más grandes. En tales casos, ajuste los volúmenes de reactivo descritos en los siguientes pasos a los indicados por el fabricante. - Al final de la incubación, agregue 400 μL de tampón de unión frío 1× a la suspensión de perlas / células, cargue todo el volumen en la columna y recoja el efluente (correspondiente a células no etiquetadas) en un tubo de 15 ml.
- Lave la columna cuatro veces con 0,5 ml de tampón de unión frío de 1× y recoja el efluente total (correspondiente a la fracción de célula viva) en el mismo tubo.
- Cuente las celdas con azul tripano (1:1). Coloque 1 × 105 celdas en dos tubos para la clasificación celular activada por fluorescencia (FACS) y manténgalas a 4 °C hasta la validación del proceso (consulte el paso 4.1): utilice el primer tubo para establecer los parámetros de análisis y las regiones de positividad (tubo de control) y el otro para el análisis de biomarcadores (tubo de muestra). Utilice las células restantes para la extracción de CAF (ver sección 3).
NOTA: La eliminación de células muertas es importante para reducir las reacciones inespecíficos con las microperlas de la sección 3. Sin embargo, para mejorar el rendimiento, evite la eliminación de células muertas si la proporción de células muertas es <20%.
3. Extracción de CAF primarios del tumor de mama
NOTA: Para la sección 3, utilice el kit de aislamiento de fibroblastos asociado a tumores de ratón que contiene cóctel de agotamiento de fibroblastos no asociado al tumor y microperlas de fibroblastos asociadas al tumor adecuadas para el etiquetado magnético de las células (consulte la Tabla de materiales).
- Agotamiento de fibroblastos no asociados al cáncer
- Humedezca un colador celular de 70 μm con PBS y filtre la suspensión celular para eliminar cualquier grumos. Luego, centrifuga las células durante 10 min a 300 × g y aspira el sobrenadante.
NOTA: Si un solo tumor se dividió en dos muestras para el paso 2.7, auna la suspensión celular de dos en dos antes de continuar con el paso 3.1.2. - Resuspend el pellet en 80 μL de tampón frío de PBE y agregue 20 μL de cóctel de agotamiento de fibroblastos no asociado a tumores. Mezclar bien e incubar a 4 °C durante 15 min en la oscuridad.
- Durante la incubación con perlas, prepare columnas de agotamiento ferromagnético (1 por muestra) en un soporte magnético y equilibre las columnas con 2 ml de tampón de PBE frío. Espere hasta que la solución haya fluido.
- Al final de la incubación, agregue 400 μL de tampón de PBE frío a la suspensión de perlas / células, cargue todo el volumen en la columna y recoja el efluente (correspondiente a células no etiquetadas) en un tubo de 15 ml.
- Lave la columna dos veces con 2 ml de tampón de PBE frío y recoja el efluente total en el mismo tubo. Centrifugar durante 10 min a 300 × g y resuspend en 0,1 mL de tampón PBE frío.
NOTA: El agotamiento de los fibroblastos no asociados al cáncer reduce drásticamente la cantidad total de células recuperadas. En general, es necesario y recomendado agrupar suspensiones celulares de cuatro muestras diferentes para obtener un gránulo visible y suficientes células para el paso 3.2. Esto asegurará un rendimiento óptimo. - Coloque 20 μL de la suspensión celular en un tubo FACS y manténgala a 4 °C para la validación del proceso (ver sección 4). Utilice las celdas restantes para la selección de CAF (consulte el paso 3.2).
- Humedezca un colador celular de 70 μm con PBS y filtre la suspensión celular para eliminar cualquier grumos. Luego, centrifuga las células durante 10 min a 300 × g y aspira el sobrenadante.
- Selección positiva de fibroblastos asociados al cáncer
- Añadir 20 μL de microperlas de fibroblastos asociadas a tumores a 80 μL de suspensión celular. Mezclar bien e incubar a 4 °C durante 15 min en la oscuridad.
- Durante la incubación con perlas, prepare columnas de separación ferromagnética (1 por muestra) en un soporte magnético y equilibre las columnas con 0,5 ml de tampón PBE frío. Espere hasta que la solución haya fluido.
- Al final de la incubación, agregue 400 μL de tampón de PBE frío a la suspensión de perlas / células, cargue todo el volumen en la columna y deje que las células no etiquetadas fluyan a través de un tubo de 15 ml.
- Lave la columna tres veces con 0,5 ml de tampón de PBE frío y recoja el efluente total en el mismo tubo.
NOTA: El flujo continuo contiene células CD90.2 negativas sin etiquetar, que pueden descartarse como fibroblastos no asociados al cáncer. - Retire la columna del imán y colóquela en un tubo de 1,5 ml. Agregue 1 ml de PBE frío a la columna e inmediatamente empuje el émbolo hacia la columna para eliminar las celdas.
- Centrifugar durante 10 min a 400 × g y resuspend en 0,1 mL de tampón PBE frío. Colocar 20 μL de suspensión celular en un tubo FACS y mantenerlo a 4 °C para la validación del proceso (ver sección 4).
NOTA: Después de la centrifugación, el pellet puede ser apenas visible, especialmente cuando los tumores originales son pequeños. Use tubos cónicos de centrífuga inferior y tenga cuidado de no perder ninguna célula cuando aspire al sobrenadante. - Diluya las células restantes en un volumen apropiado de Dulbecco's Modified Eagle's Medium (DMEM)/Ham's F-12 suplementado con 15% de FBS, 2 mM de L-glutamina, 1% de P/S y 1% de aminoácidos no esenciales, y semeque las células en una placa de cultivo de tejidos.
- Verifique la densidad celular bajo un microscopio y coloque la placa en una incubadora a 37 ° C y 5% de CO2 para permitir que las células se adhieran y crezcan.
NOTA: Si las células son demasiado densas, divida inmediatamente la suspensión celular en dos pozos de la placa de cultivo de tejidos antes de colocar la placa en la incubadora.
4. Validación de procesos
- Citometría de flujo
NOTA: La sección 4.1 no requiere condiciones estériles y se puede realizar fuera de la campana laminar. Realizar la sección 4.1 en paralelo para las muestras recogidas en el paso 2.11 (tumor disociado), el paso 3.1.6 (después del agotamiento de los fibroblastos no asociados al cáncer) y el paso 3.2.6 (después del enriquecimiento de los fibroblastos asociados al cáncer).- Centrifugar los tubos FACS preparados en los pasos 2.11, 3.1.6 y 3.2.6 durante 10 min a 300 × g. Deseche el sobrenadante.
NOTA: Prepare al menos un tubo adicional, que contenga células no teñidas que actúen como un control para establecer los parámetros para el análisis. - En los tubos de muestra, resuspenda las células en 88 μL de PBE, y agregue 2 μL de anticuerpo anti-CD45 conjugado con isotiocianato de fluoresceína (FITC, dilución 1:50, según las instrucciones del fabricante) y 10 μL de anticuerpo anti-CD90.2 conjugado con ficoeritirina (PE, dilución 1:10, según las instrucciones del fabricante). Mezclar bien e incubar durante 10 min a 4 °C en la oscuridad. En el tubo de control (sin teñir), resuspend las células en 100 μL de PBE. Incubar durante 10 min a 4 °C en la oscuridad para replicar el procedimiento seguido para las células teñidas con anticuerpos.
NOTA: La temperatura y el tiempo de incubación deben verificarse cuidadosamente, ya que una variación en tales variables podría resultar en una tinción deficiente o inespecífico, alterando así los resultados. - Después de completar el paso de incubación, realice un lavado agregando 1 ml de PBE. Centrífuga durante 10 min a 300 x g. Deseche el sobrenadante.
- Resuspend células (todos los tubos) en 500 μL de PBS.
- Mezclar bien y proceder con el análisis de citometría de flujo. Establezca los canales para medir la fluorescencia de los anticuerpos (es decir, FITC y PE).
- Desde el tubo de control, seleccione todas las celdas viables dibujando una primera puerta (P1) en la gráfica de dispersión hacia adelante versus lado (FSC vs SSC). Dentro de P1, establezca una segunda puerta (P2) que comprenda solo celdas individuales.
- Utilizando los canales de fluorescencia específicos de los anticuerpos (es decir, FITC y PE), establezca las puertas adecuadas para discernir las células teñidas positivamente.
- Inicie el análisis y registre al menos 10,000 eventos en P2. Lea las señales de ambos canales simultáneamente.
NOTA: Si el número total de células es menor de lo esperado, podría ser preferible leer todo el tubo. - (OPCIONAL) Si se programa una tinción adicional con anticuerpos / fluoróforos adicionales, establezca una matriz de compensación adecuada antes de iniciar el análisis.
- Centrifugar los tubos FACS preparados en los pasos 2.11, 3.1.6 y 3.2.6 durante 10 min a 300 × g. Deseche el sobrenadante.
- Seguimiento de la morfología y características celulares
NOTA: Una vez secuestradas, las células deben manipularse en condiciones estériles.- El día después de la siembra, visualice las células bajo un microscopio óptico para verificar la adhesión y la morfología celular. Aspirar el sobrenadante y sustituirlo por medio fresco.
NOTA: Los CAF son células grandes en forma de huso, que se pueden distinguir fácilmente de la estructura epitelial de las células tumorales 4T1. - Mantener las células a 37 °C y 5% de CO2 en atmósfera humidificada, cambiando el medio cada 2 días.
- Cuando las células alcancen ~ 80% de confluencia (aproximadamente 4-6 días después de la siembra), separe las celdas usando la solución TrypLE Select (consulte la Tabla de materiales)durante 5 minutos a temperatura ambiente. Añadir medio fresco (4:1), centrifugar la suspensión celular a 400 × g durante 5 min, y volver a colocar el pellet en medio fresco.
- Divida las células 1:2 y amplíe el cultivo hasta obtener el número de células necesarias para el experimento.
- En cada pasaje, verifique la morfología y el crecimiento celular bajo un microscopio óptico. Si la morfología celular no es homogénea (por ejemplo, clones de pequeñas células de forma redonda que aparecen en cultivo), analice una muestra de células mediante citometría de flujo como se describe en la sección 4.1. Si es homogéneo, continúe con el paso 4.2.7.
NOTA: Los cambios en la morfología celular pueden indicar contaminación por fibroblastos no asociados al cáncer, que deben eliminarse para garantizar la pureza del cultivo. - Analice los resultados de la citometría de flujo y proceda de acuerdo con uno de los siguientes escenarios: (i) si se produce contaminación de las células CD90.2 - / CD45-, recoja todas las células y repita la selección positiva siguiendo el paso 3.2; ii) si también se produce contaminación de células CD45+, recoger todas las células y repetir el agotamiento en la etapa 3.1; iii) si no se produce contaminación (sólo están presentes células CD90.2+/CD45-), mantenga las células en cultivo y proceda directamente a 4.2.7.
NOTA: Como repetir el proceso de agotamiento con microperlas reducirá la recuperación celular, se recomienda solo cuando las células no necesitan usarse de inmediato. - Cuente las células con azul tripano (1:1), coloque 5 × 105 células en dos tubos FACS y centrífuga durante 10 min a 300 × g. Deseche el sobrenadante y vuelva a colocar el pellet en 0,5 ml de tampón de bloqueo (PBS suplementado con BSA al 2%, suero de cabra al 2%) durante 15 min a temperatura ambiente.
NOTA: Un tubo actúa como un control que consiste solo en células no teñidas, mientras que las células en el segundo tubo se teñirán para el análisis de citometría de flujo. - Centrifugar durante 10 min a 300 × g, desechar el sobrenadante y resuspend en 99 μL de tampón de bloqueo. Agregue 1 μg de anticuerpo anti-FAP al tubo de muestra y 1 ml de tampón de bloqueo al tubo de control. Mezclar bien e incubar durante 15 min a temperatura ambiente.
NOTA: FAP es un marcador de superficie del estroma tumoral reactivo y se puede utilizar para identificar y caracterizar LOS CAF. - Lavar tres veces con PBS, centrifugar e incubar con el anticuerpo secundario apropiado conjugado con un colorante fluorescente (1 μg) en tampón de bloqueo durante 15 min a temperatura ambiente.
- Lavar tres veces con PBS, y analizar por citometría de flujo (siga los pasos 4.1.5 a 4.1.7 estableciendo el canal apropiado para detectar el fluoróforo utilizado). A continuación, utilice las celdas para experimentos (paso 5.2).
- (OPCIONAL) Congelar una muestra de células en 1 ml de 90% de FBS y 10% de dimetilsulfóxido (DMSO); conservar a -80 °C para su uso posterior.
- El día después de la siembra, visualice las células bajo un microscopio óptico para verificar la adhesión y la morfología celular. Aspirar el sobrenadante y sustituirlo por medio fresco.
5. Focalización de CAFs por nanopartículas de ferritina diseñadas
NOTA: Una variante recombinante de la cadena pesada de ferritina humana (HFn) se utilizó como nanopartícula desnuda o se conjudicó con las partes objetivo. Aquí, las nanopartículas de HFn funcionalizadas con la porción variable de un anticuerpo anti-FAP (Fab@FAP) fueron preparadas por el NanoBioLab de la Universidad de Milano-Bicocca en dos proporciones molares HFn: Fab@FAP, 1: 1 y 1: 5, de acuerdo con un protocolo previamente descrito32.
- Etiquetado fluorescente de nanopartículas de HFn
NOTA: Tanto las nanociágenas HFn desnudas como las funcionalizadas están etiquetadas fluorescentemente con FITC.- Disolver el polvo FITC en etanol al 99% para obtener una concentración de 2 mg/mL.
NOTA: Esta solución debe prepararse recién preparada. - Incubar 50 μL de la solución preparada (200 μg de FITC) por cada 1 mg de proteína (es decir, 100 μL de HFn a 10 mg/ml). Añadir 50 μL de bicarbonato de sodio 1 M (NaHCO3), y ajustar el volumen a 500 μL con 0,1 M NaHCO3.
NOTA: Amplíe los volúmenes de acuerdo con las necesidades experimentales. - Incubar la mezcla de reacción a temperatura ambiente, en la oscuridad y con agitación continua durante 1 h.
- Eliminar el exceso de FITC del conjugado mediante filtración en gel mediante una columna desarenado de espín (7 kDa MWCO).
- Evaluar la concentración de la proteína etiquetada recuperada mediante el uso de un espectrofotómetro. Estimar las cantidades de proteína y colorante midiendo la absorbancia a 280 nm y a 488 nm, respectivamente.
- Disolver el polvo FITC en etanol al 99% para obtener una concentración de 2 mg/mL.
- Unión de nanopartículas de HFn a CAF
NOTA: Use CAF de no más tarde de los pasajes 4–5 en cultivo.- Coloque 5 × 105 células en cada tubo FACS, centrífuga durante 10 min a 300 × g, y resuspenda en 0.5 mL de PBS, 0.3% BSA suplementada con 0.1 mg / mL de las diferentes preparaciones de nanopartículas (HFn desnudo, HFn-Fab@FAP 1: 1, HFn-Fab@FAP 1: 5) previamente etiquetadas con FITC.
NOTA: Ejecute cada condición por triplicado. Prepare un tubo adicional como una muestra de control sin etiquetar a la que no se agreguen nanopartículas. - Incubar durante 2 h a 4 °C en la oscuridad, centrifugar y lavar tres veces en PBS.
- Resuspend células con 0.5 mL PBS, mezcla bien y analiza por citometría de flujo. Ajuste los canales para medir la fluorescencia de FITC.
- Después de la activación en celdas individuales vivas, adquiera 20,000 eventos. Utilice el tubo de control no etiquetado para establecer la puerta de positividad fitc y obtener el porcentaje de eventos FITC+ (correspondiente a la unión de nanopartículas).
- Coloque 5 × 105 células en cada tubo FACS, centrífuga durante 10 min a 300 × g, y resuspenda en 0.5 mL de PBS, 0.3% BSA suplementada con 0.1 mg / mL de las diferentes preparaciones de nanopartículas (HFn desnudo, HFn-Fab@FAP 1: 1, HFn-Fab@FAP 1: 5) previamente etiquetadas con FITC.
6. Análisis estadístico y réplicas experimentales
- Animales
- Realizar tres experimentos independientes de crecimiento tumoral y aislamiento de CAF, utilizando 8 animales por experimento individual, como se describe en 1.1.5. Para optimizar el rendimiento de aislamiento de los CAF, divida los tejidos extirpados en subgrupos (n=4) y procesarlos, siguiendo los pasos descritos en la sección 2.
- Interacción HFn con las células
- Evaluar la interacción de HFn funcionalizada y no funcionalizada con células diana y no diana (CAF y 4T1, respectivamente) en términos del porcentaje de células teñidas positivamente por nanocijas etiquetadas fluorescentemente. Informe los resultados como desviación estándar promedio ± de tres experimentos independientes.
- Análisis estadístico
- Para calcular la significación estadística en experimentos de unión celular con HFn y HFn-FAP, utilice la prueba ANOVA unidireccional ordinaria.
Resultados
Configuración del modelo in vivo para un aislamiento óptimo de los CAF
La inyección de 105 células 4T1-luc en la almohadilla de grasa mamaria de ratones hembra BALB /c conduce al crecimiento de una masa tumoral detectable a los 5 días después de la implantación. Al medir el volumen tumoral por pinzas y la viabilidad de las células tumorales por BLI, se monitoreó el crecimiento tumoral durante un mes después de la implantación. Para encontrar una ventana de sacrificio que sea adecuada para el aislamiento de LOS CAF, se buscó un compromiso óptimo entre un mayor tamaño del tumor y BLI por un lado y una ulceración y necrosis tumoral emergente por otro lado (Figura 1). Como un núcleo necrótico aparece 20 días después de la implantación, y se agranda a los 25 y 30 días (como lo documentan las imágenes BLI en la Figura 1C),el día 20 se estableció como el punto de tiempo para optimizar la recuperación celular después del proceso de aislamiento. Incluso después de extirpar cuidadosamente todas las áreas necróticas visibles durante los primeros pasos del manejo del tumor ex vivo,se encontró un alto porcentaje de células muertas al final de la disociación en células individuales(Tabla 1). Como este porcentaje puede ser relevante, especialmente con el aumento del tamaño del tumor, la extirpación de células muertas siempre es necesaria cuando se trabaja con el modelo 4T1.
Optimización del procedimiento de aislamiento, cultivo y caracterización de CAF
Se necesitan dos pasajes más para aislar la población de CAF (CD90.2+ CD45-) del panel de células viables recolectadas: el agotamiento de los fibroblastos no asociados al tumor y el enriquecimiento de los fibroblastos asociados al tumor (Figura 2). El cóctel de perlas de agotamiento elimina eficientemente las células CD45+ (que representan el 67,35% y el 0,69% del total de células antes y después del agotamiento, respectivamente, Tabla 2),y siempre se utilizó para procesar un solo tumor en cada columna. Como se muestra en la Tabla 1,el número de células eluidas se redujo de un promedio de 3 ×10 6 a 1 × 105 después de la etapa de agotamiento. Debido a esta disminución masiva en el número total de células, es conveniente agrupar las células recolectadas de al menos 2 a un máximo de 4 tumores en un solo tubo antes de continuar con el paso de enriquecimiento. Al hacerlo, se obtuvo un número adecuado de células para la incubación con perlas de fibroblastos asociadas a tumores y se pasó a través de una sola columna de separación para obtener un promedio final del 93% decélulas CD90.2+ CD45 (Tabla 2).
Una vez secuestadas en placas de cultivo de tejidos, estas recuperaron células adheridas al plástico y revelaron una gran morfología en forma de huso típica de los fibroblastos(Figura 3A,B)y diferente de las células tumorales 4T1(Figura 3D). No agrupar los tumores después del agotamiento hace que el rendimiento celular con las microperlas de fibroblastos asociadas al tumor sea demasiado bajo para establecer un cultivo. En otros casos, cuando la duración y la temperatura de las incubaciones con microperlas no se mantienen cuidadosamente, puede ocurrir alguna unión inespecífico. En tales casos, los pasos de enriquecimiento fueron menos eficientes y se recuperaron mayores porcentajes de células CD90.2- CD45+ y CD90.2 - CD45- junto con las CÉLULAS CD90.2+ (5.97 ± 1.5 y 16.75 ± 1.1, respectivamente)(Figura 4 y Tabla 3). Es probable que estas células contaminantes sean responsables de la presencia en cultivo de pequeños clones con diferentemorfología (Figura 4B,puntas de flecha negras) que crecieron más rápido que los CAF y prevalecieron sobre el cultivo primario de CAF(Figura 4C). Estos resultados subóptimos confirmaron la importancia de verificar siempre la expresión de CD90.2 y CD45, así como la morfología celular al final del proceso de enriquecimiento y durante el crecimiento celular en cultivo.
Uso de células aisladas para evaluar el potencial de los nanodrogas modificados con CAF
Los CAF recién aislados se pueden utilizar para varias aplicaciones que van desde la investigación básica hasta los estudios farmacológicos. El objetivo de este grupo es desarrollar nanojachas HFn que puedan dirigirse específicamente a los CAF. HFn se funcionalizó con un fragmento de anticuerpo anti-FAP específico (HFn-FAP) en dos proporciones diferentes de proteínas: anticuerpos (una inferior 1: 1 y una más alta 1: 5), y se probó su unión con CAF. Como la FAP se utilizó como biomarcador de superficie de los CAF pro-tumorigénicos, fue de fundamental importancia verificar la expresión de FAP en CAF aislados (Figura 3C). Se siguió la expresión de FAP a lo largo de 5 pasajes en cultivo para confirmar que el cultivo primario caf mantuvo sus características originales.
Se encontró que la funcionalización de FAP en HFn contribuyó a un cambio significativo hacia la orientación caf en comparación con HFn desnudo, y la menor cantidad de anticuerpos (1: 1) fue suficiente para observar este efecto(Figura 5A). Sin embargo, esto no se observó con las células tumorales 4T1 utilizadas para establecer el modelo tumoral in vivo, en el que el HFn desnudo mostró una mayor unión que el HFn funcionalizado(Figura 5B). Esto probablemente se debió a la ausencia de sobreexpresión de FAP en las células 4T1 y a la interacción preferencial de HFn con TfR1, que regula la absorción de HFn en las células, según lo ampliamente informado por este grupo27,33. Estos resultados confirman la utilidad del uso de cultivos primarios de CAF de mama para evaluar preliminarmente la capacidad de orientación de las nanopartículas diseñadas para abordar el microambiente tumoral.
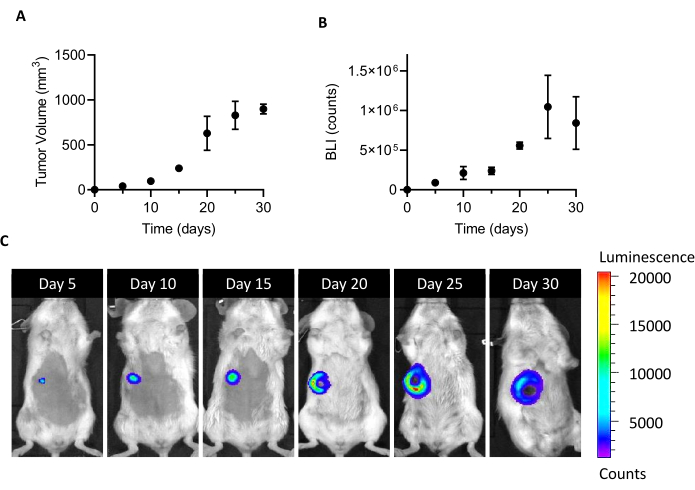
Figura 1: Establecimiento del modelo tumoral 4T1. Se inyectaron células(10 5 células/ratón) en la almohadilla de grasa mamaria. El crecimiento tumoral fue seguido en los días 5, 10, 15, 20, 25 y 30 después de la implantación(A)midiendo el volumen del tumor con pinzas y(B)por imágenes de bioluminiscencia. Los volúmenes tumorales y el BLI se expresan como mm3 y recuentos, respectivamente. Los resultados se reportan como promedio ± SEM (n=6). (C) Las imágenes representativas de BLI obtenidas 5, 10, 15, 20, 25 y 30 días después de la implantación celular confirman el crecimiento tumoral hasta el día 25, cuando parece alcanzar una meseta. En el último punto de tiempo de análisis (30 días), el BLI no aumenta en comparación con el día 25. A partir del día 20, las áreas de necrosis y ulceración comienzan a hacerse visibles en la parte central del tumor. Escala de color: Min = 1,194, Max = 20,462. Abreviaturas: BLI = imágenes de bioluminiscencia; SEM = error estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
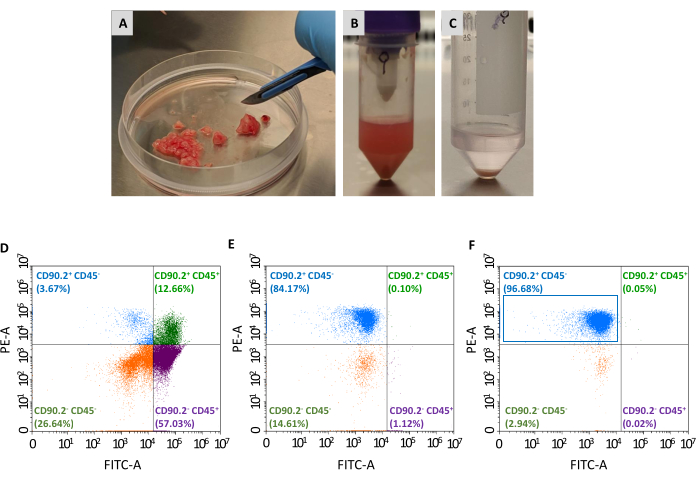
Figura 2: Preparación de muestras tumorales y caracterización por citometría de flujo de CAF aislados. Los tumores fueron extirpados y reducidos en(A)pequeños trozos de aproximadamente 1-2 mm con la ayuda de un bisturí; (B) suspensión unicelular después de la digestión tisular y la disociación mecánica de un tumor extirpado; (C) gránulo de células obtenido después de la lisis de los glóbulos rojos; (D) análisis de citometría de flujo de la expresión de CD45 y CD90.2 en células obtenidas después de la eliminación de glóbulos rojos y células muertas, (E) después del agotamiento de fibroblastos no asociados al cáncer, y (F) después del enriquecimiento de fibroblastos asociados al cáncer, donde la mayoría de las células son CD90.2+ CD45- (rectángulo azul). Abreviaturas: CAF = fibroblastos asociados al cáncer; CD = grupo de diferenciación; PE-A = área de ficoeristrina; FITC-A = áreas de isotiocianato de fluoresceína. Haga clic aquí para ver una versión más grande de esta figura.
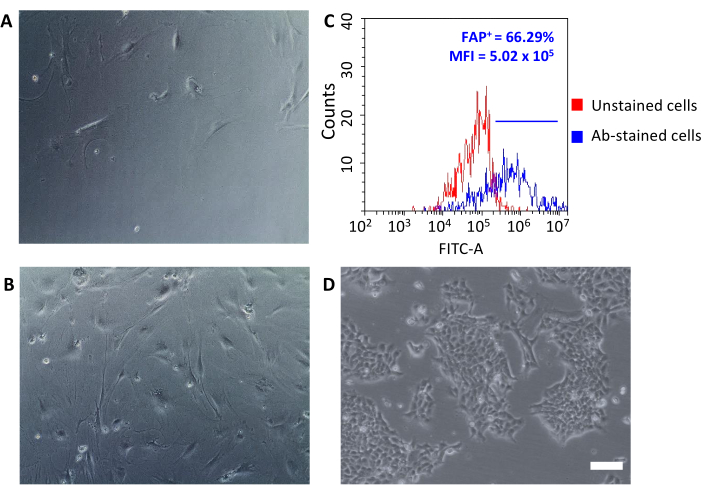
Figura 3: Análisis morfológico de la expresión de CAF y FAP. (A, B) La morfología de los CAF se comprobó en todos los pasajes de cultivo mediante microscopía óptica (diferentes niveles de confluencia en el pasaje 2 y el pasaje 5) y se comparó con (D) células tumorales 4T1; barras de escamas = 10 μm. (C) La expresión de la proteína de activación de fibroblastos (FAP) se evaluó mediante citometría de flujo al final del proceso de aislamiento enlas células CD90.2+ CD45 recolectadas para confirmar sus características moleculares. Se estableció un umbral de fluorescencia en las células de control no teñidas (gráfico rojo) para cuantificar la intensidad media de fluorescencia y el porcentaje de células positivas (FAP+)entre las células teñidas con anticuerpos (gráfico azul). Abreviaturas: CAF = fibroblastos asociados al cáncer; FAP = proteína de activación de fibroblastos; CD = grupo de diferenciación; IMF = intensidad media de fluorescencia; Ab = anticuerpo; FITC-A = área de isotiocianato de fluoresceína; FAP+ = células FAP-positivas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Ejemplo de un proceso de aislamiento de CAF subóptimo. (A) La evaluación de citometría de flujo después de la etapa final de aislamiento reveló la presencia de células contaminantes CD90.2- CD45+ y CD90.2- CD45 . (B) Estas células pueden ser vistas como clones con pequeña morfología redonda al sembrar (puntas de flecha negras y recuadro en la esquina inferior izquierda del panel) que (C) prevalecieron sobre los CAF después del tercer paso en cultivo. Barras de escala = 10 μm. Abreviaturas: CAF = fibroblasto asociado al cáncer; CD = grupo de diferenciación; PE-A = área de ficoeristrina; FITC-A = áreas de isotiocianato de fluoresceína. Haga clic aquí para ver una versión más grande de esta figura.
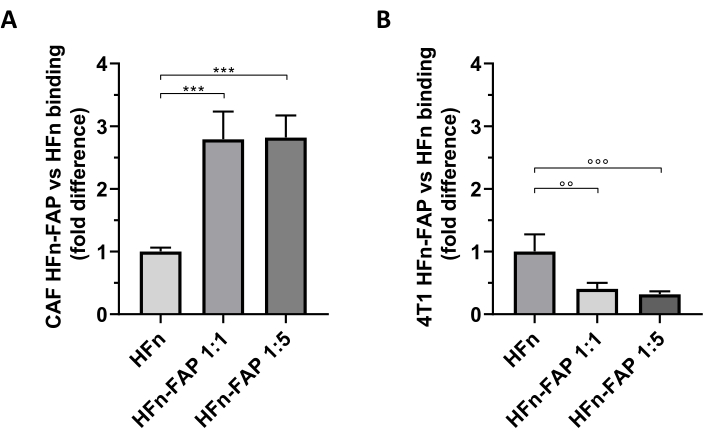
Figura 5: Unión de nanoescasas HFn en CAFs y 4T1. Las nanocijas de HFn se marcaron fluorescentemente con FITC, se funcionalizaron con un fragmento de anticuerpo anti-FAP (HFn-FAP) en dos proporciones diferentes de proteínas-anticuerpos (1: 1 y 1: 5) y se incubaron con(A)CAFs objetivo y (B) 4T1 células a 4 ° C durante 2 h. La unión se evaluó mediante citometría de flujo. (A) La unión de HFn-FAP con CAF aumenta significativamente en ambas concentraciones de fragmentos de anticuerpos en tres veces en comparación con HFn desnudo. (B) en contraste, se observó una unión significativamente mayor de HFn desnudo en células 4T1, donde la unión no se ve reforzada por el reconocimiento de FAP. Los resultados se informan como desviación estándar promedio ± de tres experimentos independientes. p = 0,0003; °° p = 0,0021 ; °°° p = 0,0008. Abreviaturas: CAF = fibroblastos asociados al cáncer; FAP = proteína de activación de fibroblastos; HFn = variante recombinante de la cadena pesada de ferritina humana utilizada como nanopartícula desnuda o conjugada; HFN-FAP = nanopartículas de HFn funcionalizadas con la porción variable de un anticuerpo anti-FAP preparada en dos proporciones molares HFn:Fab@FAP, 1:1 y 1:5. Haga clic aquí para ver una versión más grande de esta figura.
| Número de celda (promedio ± SD) | Rendimiento total de extracción (por pasaje) | |
| Tumor extirpado (después de la extirpación de glóbulos rojos) | 1,27 x 108 ± 9,81 x 107 | 100% |
| Tumor extirpado (extirpación posterior a la extracción de células muertas) | 3,01 x 106 ± 9,61 x 105 | 2.38% |
| Cóctel posterior al agotamiento | 1,15 x 105 ± 4,95 x 104 | 0.11% (3.82%) |
| Post enriquecimiento | 3,00 x 104 ± 1,2 x 104 | 0.027% (26.09%) |
Tabla 1: Recuento total de células después de cada paso de aislamiento de fibroblastos asociados al cáncer.
| Distribución celular (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| Tumor extirpado (extirpación posterior a la extracción de células muertas) | 1,81 ± 0,98 | 10,78 ± 4,51 | 56,57 ± 14.05 | 28.20 ± 17.57 |
| Cóctel posterior al agotamiento | 69,33 ± 16,75 | 0,14 ± 0,13 | 0,55 ± 0,63 | 39,89 ± 30,31 |
| Post enriquecimiento | 93,14 ± 3,3 | 0,09 ± 0,1 | 0,09 ± 0,08 | 6,69 ± 3,4 |
Tabla 2: Distribución celular según expresión de CD90.2 y CD45 después de cada paso de aislamiento de fibroblastos asociados al cáncer.
| Distribución celular (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| Post Enriquecimiento (sin agrupación) | 75,80 ± 2,9 | 1,49 ± 0,4 | 5,97 ± 1,5 | 16,75 ± 1,1 |
Tabla 3: Expresión de CD90.2 y CD45 de células recolectadas después de un experimento de aislamiento de fibroblastos asociado a cáncer subóptimo.
Discusión
Los CAF están emergiendo como actores clave en la remodelación de la matriz extracelular, promoviendo la progresión de la metástasis y limitando el acceso de los medicamentos al sitio del tumor34. Sin embargo, debido a su heterogeneidad, sus funciones siguen siendo controvertidas: algunos CAF son tumorígenos, mientras que otros subtipos parecen tener un papel supresor de tumores. En este contexto, su aislamiento puede ser de extremo interés para arrojar más luz sobre su muy debatido papel en la progresión del cáncer, que tendrá importantes implicaciones clínicas12,31. Además, la extracción exitosa de CAF de modelos de tumores de ratón humanos y preclínicos también facilitaría el desarrollo de nuevos fármacos dirigidos a CAF. Este artículo informa sobre un método para aislar y cultivar eficientemente los CAF primarios de un modelo preclínico singénico de cáncer de mama. Según la experiencia, tres pasos experimentales influyen principalmente en el éxito del protocolo.
El primero es trabajar rápidamente para evitar la agregación de suspensiones celulares asociadas con el riesgo de coagulación en la columna y la desaceleración del flujo celular: de hecho, cuando las células que pasaron a través de la columna se agruparon, la probabilidad de un proceso de aislamiento subóptimo aumentó, y los cultivos finales contenían clones de células "contaminantes". El segundo es agrupar células de diferentes tumores después del paso de agotamiento para garantizar que se pasen suficientes células en el paso final de enriquecimiento. El problema crítico final es el recubrimiento de las células extraídas a altas densidades celulares, muy probablemente a partir de un solo pozo de la placa de 24 pozos para impulsar el crecimiento celular y la expansión de la colonia durante hasta 4-5 pasajes. Si las células se sembraron a bajas densidades, se expandieron en la superficie libre y rápidamente dejaron de replicarse.
Varios estudios ya han descrito métodos de extracción caf de origen humano y ratón, para estudiar su papel en la promoción del desarrollo del cáncer y la invasividad. Esto se ha hecho en muchos tipos de tumores, incluyendo cáncer de mama, melanoma, colangiocarcinoma y adenocarcinoma pancreático35,36,37,38. Sin embargo, debido a la falta de marcadores CAF específicos y a su heterogeneidad, los resultados de estos procesos siguen siendo subóptimos.
Aquí, las células aisladas se utilizaron para validar la capacidad de focalización CAF de las nanocigas HFn funcionalizadas con partes dirigidas a anti-FAP. El uso de cultivos primarios de CAF fue una ventaja significativa, permitiendo la validación de la nanoestrategia ex vivo con un experimento de unión mucho más simple y rentable que hacerlo directamente in vivo en esta fase preliminar de optimización de nanofármacos.
En este sentido, las pruebas ex vivo en CAF pueden preceder a los experimentos in vivo con animales al permitir el cribado y la selección de las nanopartículas más prometedoras para la orientación óptima de CAF. El modelo CAF presentado aquí también puede ser utilizado para estudios preliminares de eficacia, al cargar nanopartículas con fármacos activos. Los animales solo se utilizarán más adelante para evaluar la biodistribución, la farmacocinética y los estudios de eficacia.
Se están desarrollando varios nanofármacos dirigidos a CAF, como las nanograbas de ferritina para la terapia fotodinámica en el cáncer de mama y las partículas basadas en péptidos para administrar doxorrubicina en modelos de cáncer de próstata39,40. Sin embargo, no muchos estudios se han centrado en el aislamiento de los CAF como plataformas celulares para la optimización de nanodrogas.
Este protocolo tiene algunas limitaciones. En primer lugar, es un protocolo que requiere mucho tiempo, que requiere la preparación y compra de varios reactivos y materiales. En segundo lugar, debido a la escasez de CAF en el tumor de mama 4T1, su rendimiento es bajo. Los experimentos con nanopartículas deben planificarse y realizarse tan pronto como se logre el número de células requerido, ya que los CAF primarios se someten a senescencia y no se pueden mantener en cultivo durante mucho tiempo. En conclusión, este método de aislamiento, cultivo y caracterización de LOS CAF puede ser una herramienta poderosa para acelerar el desarrollo de nuevos nanomedicamentos dirigidos en la lucha contra el cáncer.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue apoyado por la Associazione Italiana per la Ricerca sul Cancro (AIRC) bajo el proyecto IG 2017-ID. 20172 – P.I. Corsi Fabio. SM reconoce al centro de Investigación Clínica Pediátrica "Romeo y Enrica Invernizzi" que apoya su posición. AB agradece a AIRC (proyecto ID. 20172) y a la Universidad de Milán por una beca de investigación. Las becas postdoctorales y doctorales de LS y MS son apoyadas por la Universidad de Milán.
Materiales
| Name | Company | Catalog Number | Comments |
| ACK Lysing buffer | Lonza | 10-548E | Store at +15° to +30 °C. |
| Alexa Fluor 488 goat anti-human antibody | Immunological Science | IS-20022 | Protect from light. |
| Anti-FAP Fab fragment (3F2) | Creative Biolabs | TAB-024WM-F(E) | |
| BALB/c mice | Charles River | 028BALB/C | 7 weeks old female mice |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | Store at 2-8 °C. |
| CD45 antibody | Miltenyi Biotec | 130-110-796 | FITC-conjugated fluorescent antibody; clone REA 737; Store protected from light at 2–8 °C. |
| CD90.2 antibody | Miltenyi Biotec | 130-102-960 | PE-conjugated fluorescent antibody; clone 30-H12; Store protected from light at 2–8 °C. |
| Cell strainers 70 µm | VWR | 732-2758 | |
| CytoFLEX | Beckman Coulter | laser configuration B4-R2-V0 | |
| Dead cell Removal Kit | Miltenyi Biotec | 130-090-101 | contains 10 mL of Dead Cell Removal MicroBeads; 25 mL of 20× Binding Buffer Stock Solution. Store protected from light at 2−8 °C. |
| D-Luciferin | Caliper | 760504 | reagent for in vivo imaging |
| DMEM High Glucose w/o L-Glutamine w/ Sodium Pyruvate | Euroclone | ECB7501L | Warm at 37 °C in a water bath before use. |
| DMSO | Sigma-Aldrich | D2650 | |
| DPBS w/o Calcium, w/o Magnesium | Euroclone | ECB4004L | Keep at room temperature. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E9884 | |
| Fetal Bovine Serum | Euroclone | ECS0180L | Before use, heat at 56 °C for 30 min to kill all the complement proteins. |
| Fluorescein Istothiocyanate isomer I (FITC) | Sigma-Aldrich | F7250 | Store protected from light at 2–8 °C. |
| GentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | They are used in combination with the gentleMACS Dissociator. |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | Two samples can be processed in parallel. Special protocols have been developed for various tissues. |
| Goat serum | Euroclone | ECS0200D | |
| Ham's F12 w/o L-Glutamine | Euroclone | ECB7502L | Warm at 37 °C in a water bath before use. |
| IVIS Lumina II imaging system | Caliper Life Sciences | This imaging system is easy to use for both fluorescent and bioluminescent imaging in vivo. Equipped with a Living Image Software for analysis | |
| LD columns | Miltenyi Biotec | 130-042-901 | Composed of ferromagnetic spheres, designed for stringent depletion of unwanted cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use |
| L-Glutamine | Euroclone | ECB3000D | 200 mM stock |
| Light/fluorescence microscope equipped with camera | Leica Microsystems | DM IL LED Fluo/ ICC50 W CameraModule | inverted microscope for live cells with camera |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Separation Unit | Miltenyi Biotec | 130-090-976 | Position the magnet on appropriate stand before use. |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MS columns | Miltenyi Biotec | 130-042-201 | Composed of ferromagnetic spheres, designed for positive selection of cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use. |
| Mycoplasma Removal Agent | Euroclone | ECMC210A | Dilute in culture medium 1:100. |
| NaHCO3 | Invitrogen | A10235 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000C | |
| Non essential aminoacids | Euroclone | ECB3054D | |
| Penicillin-Streptomycin | Euroclone | ECB3001D | |
| Recombinant Human apoferritin H-homopolymer (HFn) | Molirom | MLR-P018 | |
| RPMI 1640 w/o L-Glutamine | Euroclone | ECB9006L | Warm at 37 °C in a water bath before use. |
| Tumor-Associated Fibroblast Isolation kit | Miltenyi Biotec | 130-116-474 | Contains 1 mL of Non-Tumor-Associated Fibroblast Depletion Cocktail, mouse; 1 mL of CD90.2 (Tumor-Associated Fibroblast) MicroBeads,mouse. Store protected from light at 2-8 °C. |
| Tumor Dissociation Kit | Miltenyi Biotec | 130-096-730 | Contains lyophilized enzymes (D, R, A) and buffer A; reconstitute enzymes according to the manufacturer's instructions, aliquot and store at - 20 °C. |
| Trypan blue 0.4% | Lonza | 17-942E | dilute 1:1 with a sample of cell suspension before counting the cells |
| TrypLE select | Gibco | 12563-029 | use at room temperature |
| Trypsin-EDTA | Lonza | BE17-161E | Warm at 37 °C in a water bath before use |
| T75 Primo TC flask | Euroclone | ET7076 | |
| Zeba Spin Desalting Columns | Thermo Fisher Scientific | 89890 | 7K MWCO, 2 mL |
| 1.5 mL tubes | Biosigma | CL15.002.0500 | |
| 15 mL tubes | Euroclone | ET5015B | |
| 4T1-luc2 | Caliper | Mouse mammary gland cancer cell line stably transfected with firefly luciferase gene | |
| 50 mL tubes | Euroclone | ET5050B |
Referencias
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nature Medicine. 19 (11), 1423-1437 (2013).
- Velaei, K., Samadi, N., Barazvan, B., Soleimani Rad, J. Tumor microenvironment-mediated chemoresistance in breast cancer. Breast. 30, 92-100 (2016).
- Cheng, J. D., Weiner, L. M., et al. Tumors and their microenvironments: tilling the soil. Commentary re: A. M. Scott et al., A Phase I dose-escalation study of sibrotuzumab in patients with advanced or metastatic fibroblast activation protein-positive cancer. Clinical Cancer Research. 9 (5), 1690-1695 (2003).
- Hui, L., Chen, Y. Tumor microenvironment: Sanctuary of the devil. Cancer Letters. 368 (1), 7-13 (2015).
- Balkwill, F. R., Capasso, M., Hagemann, T. The tumor microenvironment at a glance. Journal of Cell Science. 125, 5591-5596 (2012).
- Chen, X., Song, E. Turning foes to friends: targeting cancer-associated fibroblasts. Nature Review. Drug Discovery. 18 (2), 99-115 (2019).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Seminars in Cell & Developmental Biology. 21 (1), 33-39 (2010).
- LeBleu, V. S., Kalluri, R. A peek into cancer-associated fibroblasts: origins, functions and translational impact. Disease Models & Mechanisms. 11, (2018).
- Li, X. -. Y., Hu, S. -. Q., Xiao, L. The cancer-associated fibroblasts and drug resistance. European Review for Medical and Pharmacological Sciences. 19 (11), 2112-2119 (2015).
- Luo, H., Tu, G., Liu, Z., Liu, M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Letters. 361 (2), 155-163 (2015).
- Truffi, M., Sorrentino, L., Corsi, F. Fibroblasts in the tumor microenvironment. Advances in Experimental Medicine and Biology. 1234, 15-29 (2020).
- Sugimoto, H., Mundel, T. M., Kieran, M. W., Kalluri, R. Identification of fibroblast heterogeneity in the tumor microenvironment. Cancer Biology & Therapy. 5 (12), 1640-1646 (2006).
- Costa, A., et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell. 33 (3), 463-479 (2018).
- Ishii, G., Ochiai, A., Neri, S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Advances Drug Delivery Reviews. 99, 186-196 (2016).
- Chen, Q., et al. Remodeling the tumor microenvironment with emerging nanotherapeutics. Trends in Pharmacological Sciences. 39 (1), 59-74 (2018).
- Truffi, M., et al. Nano-strategies to target breast cancer-associated fibroblasts: rearranging the tumor microenvironment to achieve antitumor efficacy. International Journal of Molecular Sciences. 20 (6), 1263 (2019).
- Tong, R., Langer, R. Nanomedicines Targeting the Tumor Microenvironment. Cancer Journal. 21 (4), 314-321 (2015).
- Kaps, L., Schuppan, D. Targeting cancer associated fibroblasts in liver fibrosis and liver cancer using nanocarriers. Cells. 9 (9), 2027 (2020).
- Miao, L., et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors. Cancer Research. 77 (3), 719-731 (2017).
- Kelly, T., Huang, Y., Simms, A. E., Mazur, A. Fibroblast activation protein-α: a key modulator of the microenvironment in multiple pathologies. International Review of Cell and Molecular Biology. 297, 83-116 (2012).
- Brennen, W. N., Isaacs, J. T., Denmeade, S. R. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy. Molecular Cancer Therapeutics. 11 (2), 257-266 (2012).
- Juillerat-Jeanneret, L., Tafelmeyer, P., Golshayan, D. Fibroblast activation protein-α in fibrogenic disorders and cancer: more than a prolyl-specific peptidase. Expert Opinion on Therapeutic Targets. 21, 977-991 (2017).
- Falvo, E., et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin. Nanoscale. 5 (24), 12278-12285 (2013).
- Truffi, M., et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research. 107, 57-65 (2016).
- Cai, Y., et al. Enhanced magnetic resonance imaging and staining of cancer cells using ferrimagnetic H-ferritin nanoparticles with increasing core size. International Journal of Nanomedicine. 10, 2619-2634 (2015).
- Heger, Z., Skalickova, S., Zitka, O., Adam, V., Kizek, R. Apoferritin applications in nanomedicine. Nanomedicine. 9 (14), 2233-2245 (2014).
- Mazzucchelli, S., et al. Nanometronomic treatment of 4T1 breast cancer with nanocaged doxorubicin prevents drug resistance and circumvents cardiotoxicity. Oncotarget. 8 (5), 8383-8396 (2017).
- Yu, Q., et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy. Journal of Controlled Release. 321, 564-575 (2020).
- Mertens, J. C., et al. Therapeutic effects of deleting cancer-associated fibroblasts in cholangiocarcinoma. Cancer Research. 73 (2), 897-907 (2013).
- Kovács, D., et al. Core-shell nanoparticles suppress metastasis and modify the tumour-supportive activity of cancer-associated fibroblasts. Journal of Nanobiotechnology. 18, 18 (2020).
- Sharon, Y., Alon, L., Glanz, S., Servais, C., Erez, N. Isolation of normal and cancer-associated fibroblasts from fresh tissues by Fluorescence Activated Cell Sorting (FACS). Journal of Visualized Experiments. (71), e4425 (2013).
- Sitia, L., et al. Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax. Cells. 10 (2), 328 (2021).
- Bellini, M., et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells. Journal of Controlled Release. 196, 184-196 (2014).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nature Reviews Cancer. 20, 174-186 (2020).
- Dvořánková, B., Lacina, L., Smetana, K. Isolation of normal fibroblasts and their cancer-associated counterparts (CAFs) for biomedical research. Methods in Molecular Biology. 1879, 393-406 (2018).
- Calvo, F., Hooper, S., Sahai, E. Isolation and immortalization of fibroblasts from different tumoral stages. Bio-protocol. 4 (7), 1097 (2014).
- Sha, M., et al. Isolation of cancer-associated fibroblasts and its promotion to the progression of intrahepatic cholangiocarcinoma. Cancer Medicine. 7 (9), 4665-4677 (2018).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Zhen, Z., et al. Protein nanocage mediated fibroblast-activation protein targeted photoimmunotherapy to enhance cytotoxic T cell infiltration and tumor control. Nano Letters. 17 (2), 862-869 (2017).
- Ji, T., et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery. Advances Materials. 27 (11), 1865-1873 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados