Method Article
標的ナノ粒子の研究のための乳癌の同質性マウスモデルからの原発癌関連線維芽細胞の分離
* これらの著者は同等に貢献しました
要約
本論文は、三重陰性乳癌の同種マウスモデルからの原発性癌関連線維芽細胞の単離と培養と、腫瘍微小環境を標的とするように設計された新規ナノ粒子の前臨床試験への応用を目的とする。
要約
癌関連線維芽細胞(CAF)は、腫瘍微小環境の文脈における主要なアクターである。腫瘍細胞と比較して数が減少しているにもかかわらず、CAFは腫瘍の進行を調節し、抗腫瘍免疫からの保護を提供する。新たな抗がん戦略は、腫瘍性腫瘍性CAFの切り替えまたはCAF機能の再プログラミングとその活性化状態を通じて腫瘍微小環境を再構築することを目指しています。有望なアプローチは、CAFを標的とすることができるナノサイズの送達剤の開発であり、したがって、薬物および活性分子の特異的な送達を可能にする。この文脈において、CAFの細胞モデルは、そのようなナノ製剤の インビトロ スクリーニングおよび予備調査のための有用なツールを提供し得る。
本研究では、三重陰性乳癌の同種4T1マウスモデルからの原発性CAFの分離と培養について説明する。磁気ビーズは、解離された腫瘍からCADFを抽出するために2段階の分離プロセスで使用された。免疫フェノタイピング制御は、プロセス歩留まりを検証するために各通過後のフローサイトメトリーを用いて行った。分離されたCAFは、腫瘍微小環境に取り組むために設計された異なるナノ製剤の標的化能力を研究するために使用することができる。蛍光標識されたHフェリチンナノケージは、この方法を設定する候補ナノ粒子として使用した。ナノ粒子は、裸または標的リガンドと共役し、CAFへの結合について分析した。この結果は、乳房CAFの ex vivo 抽出が、腫瘍化CAFの特異的標的化についてナノ粒子をテストおよび検証するのに有用なシステムである可能性を示唆している。
概要
過去数十年の間に、腫瘍の微小環境が腫瘍の再発を促し、治療抵抗1,2を誘導する可能性があるため、腫瘍細胞の死滅は悪性腫瘍を根絶するのに十分でないことが明らかになりました。新しいパラダイムが出現しました: 腫瘍の間質を標的にして腫瘍を支持因子から奪い、化学療法の有効性を高める3,4,5.特に、癌関連線維芽細胞(CAF)は、多くの固形腫瘍6,7において興味深い間質標的である。WFは、増殖因子、サイトカイン、ケモカインの分泌を通じて免疫系の癌細胞および細胞と相互作用する細胞の非常に不均一なグループである。細胞外マトリックスを構築し、改造する;転移形成8、9、10、11、12を有効にします。腫瘍の種類に応じて、CAFは腫瘍形成機能を示し、他のサブタイプのCAFは腫瘍抑制機能13,14を有するようだ。この二分法をより明確にするためには、原発性腫瘍および転移性腫瘍からのCAFの完全な特徴付けが重要である。
この文脈において、新たな研究分野は、腫瘍微小環境15、16、17、18を改造することができる活性分子および薬物を送達することによって、CAFを標的および/または破壊するように設計されたナノサイズの薬剤の開発に焦点を当てている。ナノ粒子のいくつかのタイプは、細胞傷害性薬物によるCAFアブレーションを達成し、CAF標的光線力学療法を誘導するか、または静止状態に戻すことによってCAFを再プログラムするか、または隣接する癌細胞16、19のアポトーシスを誘導するTNF関連アポトーシス誘導リガンド発現を誘導するように設計されている。さらに、多くのナノ粒子が特定の生物学的マーカーを積極的に標的とする可能性は、標的とするCAFサブセットを選択する望みを生み出す。CAFに対する絶対的特異性は依然として問われ、線維芽細胞活性化タンパク質(FAP)は、腫瘍性基質の最も有望な標的の1つであり、ナノドラッグの送達を操縦するために利用され、したがって、CAF標的性ナノセラピューティクス20、21、22の開発への道を開く。
本論文では、マウス乳癌の同系モデルからの原発性CAFの分離について述べ、CAFマーカーFAPを認識するように設計されたナノ粒子の標的化能力の研究におけるそれらの使用を報告する。フェリチンナノケージは、その方法を設定する候補ナノシステムとして使用され、その送達の特異性は、ターゲティング部分23、24の表面露光によって形成され得る。さらに、フェリチンは、抗腫瘍剤用途に対して優れた生体適合性シャトルであることが実証されており、腫瘍質量25、26、27にペイロードの急速な蓄積を引き起こす。現在までに、CAF標的ナノシステムの前臨床試験は、細胞活性化およびCAF2の免疫表現機能の発現を誘導する増殖因子βを培養して刺激された線維芽細胞株のvitro試験に関与している。この方法は、通常、不死化細胞株(NIH3T3、LX-2など)に適用され、非常に迅速かつ単純であり、数時間または数日で活性化細胞を得る。制限は、インビトロ刺激は活性化された筋線維芽細胞に起因するいくつかの遺伝子の発現を誘導するが、実際のCAFのすべての生物学的特徴、特に生体内でのそれらの不均一性を完全に再現することはできない。
もう一つの戦略は、ヒトまたはマウス腫瘍サンプル30,31からの原発CAFの抽出を含む。これにより、CAF活性化が生理学的な文脈で起こり、CAF亜集団の不均一性が維持されることを保証する。研究目的によれば、CAFは異なるソースから導出され、最も信頼性の高い状態を研究する可能性を提供する。ここで報告されたプロトコルは、マウス乳癌モデルからCAFを標的にするように設計された新しいナノ粒子の機能性の予備的評価を行おうとする科学者にとって貴重であろう。分離されたCAFは、癌の動物モデルにおける生体内評価を進めるのに十分有望なナノ粒子をスクリーニングするのに有用であろう。これは、ナノ粒子生産の最初のステップで関連し、ナノ技術者は主に最適な標的化特性を達成するためのリガンド固定化の戦略を検討することによって、ナノ粒子設計の洗練に向けて推進する。
プロトコル
乳癌の同系4T1モデルの確立
注: 本プロトコルは、マウス 4T1 乳房腫瘍からのプライマリ ーカフの分離について説明しています。ここに記載されている動物研究は、イタリア保健省(aut. 番号110/2018-PR)によって承認されています。
- 腫瘍細胞培養と移植
- ローズウェルパーク記念研究所(RPMI)1640培地10%胎児ウシ血清(FBS)、1%ペニシリン/ストレプトマイシン(P/S)、および1%L-グルタミンを添加したT75フラスコの10×106 4T1-luc細胞を解凍する。マイコプラズマ除去剤(1:100)を培地に添加する。
注:4T1-luc細胞は、ルシファーゼを安定して発現し、D-ルシフェリンによる適切な刺激時に生物発光(BLI)によって可視化することができます。これにより、マウスに移植した腫瘍細胞の生存率と増殖をインビボでモニタリングできる(図1)。 - 加湿雰囲気下で37°Cおよび5%CO2 で細胞を約80%合流するまで、2日ごとに培地を交換して維持する。
注:マウスに注射する前にマイコプラズマ除去剤で1週間(〜2/3の通路)を使用して治療を続け、注入された細胞がマイコプラズマフリーであることを確認してください。 - 処置の日に、トリプシン-エチレンアミン酸(EDTA)溶液(トリプシン1:250)の1 mLを用いて細胞を37°Cで5分間剥離する。 培地を添加してトリプシン活性を停止し、トリパンブルー(1:1)で細胞を数え、細胞/mLの数を計算する。
- ピペットは、1×106細胞に相当する体積を、遠心分離機を400×gで5分間5分間用した。上清を注ぎ、RPMI 1640塩基培地の1mLでペレットを再懸濁する。射出の準備ができるまで、細胞を氷の上に置いておきます。
注: マウスごとに、1× 105個のセルが必要です。しかし、注射器の負荷を容易にするために、常に2匹の過剰なマウス(2×105細胞に相当)を計算します。 - 手術の1日前に、8匹のBALB/cマウス(雌、7週齢)の毛皮を剃り、右側の腹部乳腺の領域を露出させる。電気剃毛を使用し、4分間脱毛クリームの薄い層を適用します。その後、水と紙でクリームを洗い流します。
- 2%イソフルランガスを約5分間連続吸入して麻酔を誘発し、27Gツベルクリンシリンを用いて腹部乳腺の領域に皮下注射を行う。皮下に入るために針を上に回す;その後、皮膚を上に保持し、ゆっくりと100 μLの細胞懸濁液(1×105細胞)を注入します。 注射器をゆっくりと引っ込める前に、針を少し回します。
注:細胞懸濁液を注入する15分前に室温に持って来ることを忘れないでください。
- ローズウェルパーク記念研究所(RPMI)1640培地10%胎児ウシ血清(FBS)、1%ペニシリン/ストレプトマイシン(P/S)、および1%L-グルタミンを添加したT75フラスコの10×106 4T1-luc細胞を解凍する。マイコプラズマ除去剤(1:100)を培地に添加する。
- 腫瘍の成長と解剖
- 5日間の細胞注入後に、150 mg/kg D-ルシフェリンを腹腔内(100 μL)5分注射してからイメージングします。 in vivo イメージングシステムを使用して、10 s露光、ミディアムビニング、およびf/ストップを4でキャプチャします。腫瘍の発光領域を対象領域(ROI)として定義し、イメージングソフトウェアを使用してROI(光子/秒/m2)の総信号を定量化します。
- BLIの増加の点で腫瘍の成長を監視するために注射から5日ごとにイメージング(1.2.1)の手順を繰り返します。
- 腫瘍の容積を確立するには、マウスを保持し、その腹を露出します。カリパーを使用して、週に1回、腫瘍の長さ(L)と幅(W)を測定します。式1を用いて腫瘍体積(V)を計算する。
[V = (L x W2)/2] (1) - 細胞注射後20日で、子宮頸部脱臼で動物を犠牲にし、はさみで皮膚から腫瘍を解離し、組織貯蔵溶液に集める(材料表を参照)。
注:腫瘍サンプルは、単一細胞(セクション2)への解離のためにすぐに使用されるか、または4°Cで最大48時間保存することができます。
2. 腫瘍単一細胞への解離
注:以下の手順では、積層フローフードに滅菌試薬と使い捨てを使用してください。一度に4つの腫瘍で働く。
- ペトリ皿に腫瘍サンプルを入れ、ピンセットとメスの助けを借りて、皮膚、脂肪、壊死領域の断片を慎重に除去します。次に、腫瘍を約1〜2mmの小片に減らし、チューブに移します(図2A)。
注:4T1腫瘍は、潰瘍を起こしやすい成長しながら、非常に壊死性になります。次のステップで破片の干渉を避けるために、壊死領域を慎重に除去することが重要です。 - 腫瘍解離のための消化ミックスを準備する:RPMI 1640培地の2.35 mL、酵素Dの100 μL、酵素Rの50 μL、および12.5 μLの酵素Aを混合し、腫瘍断片を溶液に浸し、チューブをしっかりと閉じます。
注:示された消化ミックスの量は1 gまでの腫瘍に有効であり、その重量に応じて大きな腫瘍のために調節することができる。4T1腫瘍は通常20日間増殖し、0.5~0.8gの範囲内にある。 - チューブを逆さまにして、腫瘍のすべての部分がチューブの底にキャップに向かって立っていることを確認します。チューブを適切なハウジングの機械的解離器に取り付け、厳しい腫瘍用に設計された特定の解離プログラムを実行します(メーカーの指示を参照)。
注:特殊なチューブは、解離器に収まるように必要な場合があります。Cチューブは、組織の機械的解離を促進するためにキャップの内側にローターを負担します。 - チューブを取り外し、逆さまに保ち、37°Cでサンプルを40分間、穏やかな揺れでインキュベートします。次いで、適切なハウジングの解離器にチューブを取り付け、硬い腫瘍のために設計された以下の特定の解離プログラムを2回実行します。手順の最後に大きな組織が存在しないようにしてください(図2B)。
注:腫瘍の解体を解除するために、他の酵素カクテルを使用して細胞外マトリックスを分解することができます。しかし、このプロトコルでは、最適化酵素ミックス(酵素D、R、A)と組織を機械的に解離する半自動解離剤を含む市販の腫瘍解離キットが使用された。この組み合わせは、細胞完全性および細胞表面エピトープの維持と共に細胞外マトリックスの適切な分解を保証した。 - 50 mLチューブで40μmのセルストレーナーを通してサンプルをフィルターし、10 mLのRPMI 1640培地で洗浄し、300×gで7分間チューブを遠心分離します。細胞ペレットが赤色に現れた場合、アンモニウム-塩化カリウム(ACK)の1mLを室温で5分間ライジングし、RPMI 1640の10mLで洗浄し、細胞懸濁液を15mLチューブに移し、再び遠心分離機を加えて赤血球を再び起用する。
- 1 mLのPBEバッファーにペレットを再懸濁し、リン酸緩衝生理食塩水(PBS)、0.5%のウシ血清アルブミン(BSA)、および2 mM EDTAで構成され、トリパンブルー(1:1)で細胞をカウントします。細胞塊の場合は、70μmの細胞ストレーナーを通して細胞懸濁液を濾過し、以前にPBSで浸した。
注:特に腫瘍が大きい場合は、細胞数を確認し、最終的には各腫瘍サンプルを各チューブ内の10個の細胞 以下で分割してからステップ2.7に進む必要があります。 - 20x結合バッファーのストック溶液(材料表を参照)を滅菌二重蒸留水で希釈して、死細胞除去結合バッファーを調製します。5 mLの1×結合バッファーを有する細胞を洗浄する(図2C)。
メモ:バッファーを4°Cに保ちます。 - 遠心分離機は300×gで7分間、死細胞除去マイクロビーズの0.1 mLで細胞ペレットを再中断する( 材料表を参照)。よく混ぜて室温で15分間インキュベートします。
- ビーズのインキュベーション中に、ボンネットの下に磁気スタンドを用意し、先端を下に向けて強磁性分離カラム(最大107 セル用の1列)を掛けます。0.5 mL のコールド 1× バインディング バッファーで列を平衡化します。溶液が重力下で流れるまで待ちます。
注:カラムベッドを凝固させ、回収収率を低下させるリスクを避けるために、列あたりのセル数を超えないようにすることが重要です。10 個を超える7 個のセルを操作する場合は、セルの総数に応じて列数を増やすか、大きい列を使用します。このような場合は、以下の手順で説明する試薬の容積を、製造元が示すものに調整します。 - インキュベーションの最後に、400 μLのコールド 1×結合バッファーをビーズ/セル懸濁液に加え、ボリューム全体をカラムにロードし、15 mL チューブに流出液(ラベルなし細胞に対応)を収集します。
- 0.5mLの冷水1×結合バッファーでカラムを4回洗浄し、同じチューブ内の総流出(生細胞分画に対応)を収集します。
- セルをトリパンブルー (1:1) で数えます。蛍光活性化細胞ソーティング(FACS)用の2つのチューブに1×105個の細胞を配置し、プロセス検証(ステップ4.1を参照)まで4°Cに保ちます:最初のチューブを使用して、解析パラメータと陽性領域(コントロールチューブ)を設定し、もう1つはバイオマーカー分析(サンプルチューブ)を設定します。残りのセルを使用して、CADF を抽出します (セクション 3 を参照)。
注:死んだ細胞の除去は、セクション3のマイクロビーズとの非特異的反応を減らすために重要です。しかし、収率を向上させるために、死細胞の割合が <20%である場合、死んだ細胞の除去を避ける。
3. 乳腺腫瘍からの原発性CAFの抽出
注:セクション3では、細胞の磁気標識に適した非腫瘍関連線維芽細胞枯渇カクテルおよび腫瘍関連線維芽細胞マイクロビーズを含むマウス腫瘍関連線維芽細胞分離キットを使用してください( 材料表を参照)。
- 非癌関連線維芽細胞の枯渇
- 70 μmの細胞ストレーナーをPBSで湿らせ、細胞懸濁液を濾過して塊を取り除きます。その後、細胞を300×gで10分間遠心し、上清を吸引する。
注: ステップ 2.7 で 1 つの腫瘍が 2 つのサンプルに分割された場合は、ステップ 3.1.2 に進む前に細胞懸濁液を 2 つずつプールします。 - 80 μLの冷たいPBEバッファーでペレットを再懸濁し、20 μLの非腫瘍関連線維芽細胞枯渇カクテルを加えます。よく混ぜ、暗闇の中で15分間4°Cでインキュベートします。
- ビーズでのインキュベーション中に、磁気スタンドに強磁性枯渇カラム(1サンプルあたり1)を用意し、2 mLのコールドPBEバッファーでカラムを平衡化します。ソリューションが流れるまで待ちます。
- インキュベーションの最後に、400 μL のコールド PBE バッファーをビーズ/セル懸濁液に加え、ボリューム全体をカラムにロードし、15 mL チューブに流出物(ラベルなし細胞に対応する)を収集します。
- 2 mLの冷たいPBEバッファーでカラムを2回洗浄し、同じチューブ内の総流出量を回収します。遠心分離機は300×gで10分間、0.1mLの冷PBEバッファーで再中断します。
注:非癌関連線維芽細胞の枯渇は、回復した細胞の総量を大幅に減少させます。一般的に、4つの異なるサンプルから細胞懸濁液をプールして、目に見えるペレットとステップ3.2に十分な細胞を得ることが推奨されます。これにより、最適な歩留まりを保証します。 - FACSチューブに20μLの細胞懸濁液を入れ、工程検証のために4°Cに保ちます(セクション4を参照)。CAF 選択に残りのセルを使用します (ステップ 3.2 を参照)。
- 70 μmの細胞ストレーナーをPBSで湿らせ、細胞懸濁液を濾過して塊を取り除きます。その後、細胞を300×gで10分間遠心し、上清を吸引する。
- 癌関連線維芽細胞の陽性選択
- 腫瘍関連線維芽細胞マイクロビーズの20 μLを80 μLの細胞懸濁液に加えます。よく混ぜ、暗闇の中で15分間4°Cでインキュベートします。
- ビーズとのインキュベーション中に、磁気スタンドに強磁性分離カラム(1サンプルあたり1個)を用意し、0.5 mLのコールドPBEバッファーでカラムを平衡化します。ソリューションが流れるまで待ちます。
- インキュベーションの最後に、400 μL のコールド PBE バッファーをビーズ/セル懸濁液に加え、ボリューム全体をカラムにロードし、ラベルなしのセルを 15 mL チューブに流します。
- 0.5mLの冷たいPBEバッファーでカラムを3回洗浄し、同じチューブ内の総排水量を収集します。
注:フロースルーにはラベルなしCD90.2陰性細胞が含まれており、非癌関連線維芽細胞として廃棄される可能性があります。 - 磁石から柱を取り出し、1.5 mLチューブに入れ。1 mL のコールド PBE を列に追加し、すぐにプランジャーを列に押し込んでセルをフラッシュします。
- 遠心分離機は400×gで10分間、0.1 mLの冷PBEバッファーで再懸濁します。20 μLの細胞懸濁液をFACSチューブに入れ、工程検証のために4°Cに保ちます(セクション4を参照)。
注:遠心分離後、ペレットは、特に元の腫瘍が小さい場合、ほとんど見えないことがあります。円錐状の下遠心管を使用し、上清を熱望するときに細胞を失わないように注意してください。 - 残りの細胞をダルベックの修飾イーグル培地(DMEM)/ハムのF-12の適切な量で希釈し、15%FBS、2 mM L-グルタミン、1%P/S、および1%非必須アミノ酸を補い、組織培養プレートに細胞をシードします。
- 細胞密度を顕微鏡で確認し、37°Cおよび5%CO2のインキュベーターにプレートを入れて、細胞が接着して成長させます。
注:細胞が密すぎる場合は、インキュベーターにプレートを置く前に、すぐに細胞懸濁液を組織培養プレートの2つのウェルに分割します。
4. プロセス検証
- フローサイトメトリー
注:セクション4.1は無菌状態を必要とせず、層状フードの外側で行うことができます。ステップ2.11(解離腫瘍)で採取したサンプルに対して、ステップ3.1.6(非癌関連線維芽細胞の枯渇後)、およびステップ3.2.6(癌関連線維芽細胞の濃縮後)について、セクション4.1を並行して行う。- ステップ2.11、3.1.6、および3.2.6で調製したFACSチューブを300×gで10分間遠心分離します。上清を捨てます。
注: 分析用のパラメータを設定するためのコントロールとして機能する未染色セルを含む、少なくとも 1 つの追加のチューブを準備します。 - サンプルチューブでは、 PBEの88 μLで細胞を再懸濁し、フルオレセインイソチオシアネート(FITC、1:50希釈、メーカーの指示に従って希釈)とフィコエリスリン(PE、1:10)と共役する抗CD45抗体の2μLを加える。十分に混ぜ合わせ、暗闇の中で4°Cで10分間インキュベートします。コントロールチューブ(未染色)で、PBEの100 μLで細胞を再懸濁する。暗い4°Cで10分間インキュベートし、抗体染色細胞に対する手順を複製する。
注: 温度とインキュベーションの時間は、そのような変数の変動が不十分なまたは非特異的な染色を生じ、結果を変更する可能性があるため、慎重にチェックする必要があります。 - インキュベーションステップを完了した後、PBEを1 mL添加して洗浄を行います。遠心分離機 300 x g で 10 分間上清を捨てます。
- PBS 500 μL で細胞(全チューブ)を再懸濁します。
- よく混合し、フローサイトメトリー分析を進めます。抗体の蛍光を測定するチャネルを設定します(すなわち、FITCおよびPE)。
- コントロール チューブから、前方対側散布(FSC vs SSC)プロットの第 1 ゲート(P1)を描画して、すべての生存可能なセルを選択します。P1内で、単一細胞のみからなる第2ゲート(P2)を設定する。
- 抗体の特異的蛍光チャネル(すなわち、FITCおよびPE)を用いて、正に染色された細胞を識別するために適切なゲートを設定する。
- 分析を開始し、P2 に少なくとも 10,000 個のイベントを記録します。両方のチャンネルからの信号を同時に読み取ります。
注: セルの総数が予想より少ない場合は、チューブ全体を読み取る方が望ましい場合があります。 - (オプション)さらに追加の抗体/フルオロフォアで染色する場合は、分析を開始する前に適切な補償マトリックスを設定してください。
- ステップ2.11、3.1.6、および3.2.6で調製したFACSチューブを300×gで10分間遠心分離します。上清を捨てます。
- 細胞形態と特性のモニタリング
注:一度播種すると、細胞は無菌条件下で処理する必要があります。- 播種後の日に、光学顕微鏡下で細胞を可視化し、細胞の接着と形態を確認します。上清を吸引し、新鮮な培地に交換してください。
注:CAFは大きな紡錘形細胞であり、4T1腫瘍細胞の上皮状構造と容易に区別することができる。 - 加湿雰囲気で37°C、5%CO2で細胞を維持し、2日ごとに培地を変化させる。
- 細胞が約80%合流(播種後約4~6日)に達したら、TrypLE Select溶液( 材料表参照)を使用して細胞を室温で5分間取り外します。新鮮な培地(4:1)を加え、400×gで細胞懸濁液を5分間遠心し、ペレットを新鮮な培地に再懸濁する。
- 細胞を1:2に分割し、実験に必要な細胞数が得られるまで培養を展開する。
- 各通路で、細胞の形態と成長を光学顕微鏡で確認します。細胞の形態が均質でない場合(例えば、培養中に現れる小さな丸い形の細胞のクローン)、セクション4.1に記載されているようにフローサイトメトリーによって細胞のサンプルを分析する。同種の場合は、ステップ 4.2.7 に進みます。
注:細胞形態の変化は、培養物の純度を確保するために除去する必要がある非癌関連線維芽細胞による汚染を示す可能性があります。 - フローサイトメトリーの結果を分析し、次のシナリオのいずれかに従って進めます: (i) CD90.2-/CD45-細胞の汚染が発生した場合、すべての細胞を収集し、ステップ3.2に従って正の選択を繰り返します。(ii) CD45+細胞の汚染も発生した場合は、すべての細胞を収集し、ステップ3.1で枯渇を繰り返します。(iii) 汚染が発生しない場合 (CD90.2+/CD45- 細胞のみが存在する)、細胞を培養したままにして、直接 4.2.7 に進みます。
注:マイクロビーズで枯渇プロセスを繰り返すと細胞の回復が減るため、細胞をすぐに使用する必要がない場合にのみ推奨されます。 - トリパンブルー(1:1)で細胞を数え、2つのFACSチューブに5×105 細胞を入れ、遠心分離機を300×gで10分間遠心分離します。上清を捨て、0.5mLのブロッキングバッファー(PBSは2%BSA、2%ヤギ血清を補う)で、室温で15分間再懸濁する。
注: 1 つのチューブは、染色されていない細胞のみからなるコントロールとして機能し、2 番目のチューブのセルはフロー サイトメトリー解析のために染色されます。 - 遠心分離機は300×gで10分間、上清を捨て、99μLのブロッキングバッファで再中断します。サンプルチューブに1μgの抗FAP抗体を加え、ブロックバッファーを1 mLでコントロールチューブに加えます。十分に混ぜ合わせ、室温で15分間インキュベートします。
注: FAP は反応性腫瘍間質の表面マーカーであり、CAF の識別と特性化に使用できます。 - PBS、遠心分離機で3回洗浄し、蛍光色素(1 μg)を適切な二次抗体と共役して、室温で15分間ブロッキングバッファーにインキュベートします。
- PBSで3回洗浄し、フローサイトメトリーで分析します(使用したフルオロフォアを検出するための適切なチャネルを設定して、手順4.1.5〜4.1.7に従ってください)。次に、実験のために細胞を使用する(ステップ5.2)。
- (オプション)90%FBSおよび10%ジメチルスルホキシド(DMSO)の1 mLで細胞のサンプルを凍結;さらに使用するために-80 °Cで保管してください。
- 播種後の日に、光学顕微鏡下で細胞を可視化し、細胞の接着と形態を確認します。上清を吸引し、新鮮な培地に交換してください。
5. 設計されたフェリチンナノ粒子によるCAFターゲティング
注:ヒトフェリチン重鎖(HFn)の組換え変異体を裸ナノ粒子として使用するか、ターゲティング部分と共役しました。ここで、抗FAP抗体の可変部分で機能化したHFnナノ粒子(Fab@FAP)は、ミラノ・ビコッカ大学でNanoBioLabにより2つのHFn:Fab@FAPモル比、1:1および1:5で調製した、先に説明したプロトコル32に従った。
- HFnナノ粒子の蛍光標識
注意:裸で機能したHFnナノケージは、いずれもFITCで蛍光表示されています。- FITC粉末を99%エタノールに溶かし、2mg/mLの濃度を得る。
注:このソリューションは、新たに準備する必要があります。 - 調製した溶液の50 μL(FITCの200 μg)をタンパク質1mg(すなわち、10mg/mLで100μLのHFn)ごとにインキュベートします。50 μLの 1 M 重炭酸ナトリウム (NaHCO3)を加え、0.1 M NaHCO3で 500 μL に調整します。
メモ:実験のニーズに合わせてボリュームをスケールアップします。 - 反応混合物を室温、暗闇の中、および1時間連続撹拌してインキュベートする。
- スピン脱塩カラム(7kDa MWCO)を用いてゲル濾過により、結合体からFITCの過剰を除去します。
- 分光光度計を用いて、回収された標識タンパク質の濃度を評価する。280 nm で吸光度を測定し、488 nm でそれぞれタンパク質と色素の量を推定します。
- FITC粉末を99%エタノールに溶かし、2mg/mLの濃度を得る。
- HFnナノ粒子のCAFへの結合
注意: 文化の中で 4 から 5 までの後の CAF を使用してください。- 各FACSチューブに5×5個 の細胞を、300×gで10分間遠心分離し、0.5mLのPBSで再懸濁し、0.3%BSAにナノ粒子の異なる調製物の0.1mg/mLを補充した(裸HFn、HFn-Fab@FAP 1:1、HFn-Fab@FAP 1:5)。
注: 各条件を三重で実行します。ナノ粒子を添加しないコントロール非ラベルサンプルとして、追加のチューブを用意します。 - 暗い4°Cで2時間インキュベートし、遠心分離機を、PBSで3回洗浄します。
- 0.5 mL PBSで細胞を再懸濁し、よく混合し、フローサイトメトリーで分析します。FITCの蛍光を測定するチャンネルを設定します。
- 生きた単一細胞での格言の後、20,000のイベントを獲得する。FITCの陽性のゲートを設定し、FITC+ イベント(ナノ粒子結合に対応する)の割合を取得するために、コントロールのラベルなしチューブを使用します。
- 各FACSチューブに5×5個 の細胞を、300×gで10分間遠心分離し、0.5mLのPBSで再懸濁し、0.3%BSAにナノ粒子の異なる調製物の0.1mg/mLを補充した(裸HFn、HFn-Fab@FAP 1:1、HFn-Fab@FAP 1:5)。
6. 統計解析と実験複製
- 動物
- 腫瘍の成長とCAFの分離の3つの独立した実験を、1.1.5で説明したように、1回の実験につき8匹の動物を使用して行う。CADf の分離収率を最適化するには、切除された組織をサブグループ (n=4) に分割し、セクション 2 で説明した手順に従って処理します。
- 細胞とのHFn相互作用
- 蛍光標識されたナノケージによる正染色細胞の割合に関して、機能化された非機能化されたHFnと標的細胞と非標的細胞(それぞれCAFおよび4T1)の相互作用を評価する。3つの独立した実験の平均±標準偏差として結果を報告する。
- 統計分析
- HFnおよびHFn-FAPを用いた細胞結合実験で統計的有意性を計算するには、通常の一方向ANOVA検定を使用します。
結果
最適な CAF 分離のための In vivoモデルのセットアップ
雌BALB/cマウスの乳腺脂肪パッドに105 4T1-luc細胞を注入すると、移植後5日で検出可能な腫瘍塊の増殖を導く。BLIによるキャリパーによる腫瘍体積および腫瘍細胞の生存率を測定することにより、腫瘍の増殖を移植後1ヶ月間モニタリングした。CAFの分離に適した犠牲ウィンドウを見つけるために、一方では腫瘍サイズとBLIの増加と、一方では新たな腫瘍潰瘍と壊死との間で最適な妥協が求められた(図1)。壊死性コアが移植後20日に現れ、25日および30日( 図1CのBLI画像で文書化されているように)で拡大し、20日目は、分離プロセス後の細胞回収を最適化するタイムポイントとして設定した。 ex vivoの腫瘍処理の第1ステップ中に目に見える壊死領域をすべて注意深く除去した後でさえ、単一細胞への解離の終わりに死細胞の高い割合が見つかった(表1)。この割合は、特に腫瘍サイズの増加に関連する可能性があるため、4T1モデルを使用する場合、死細胞除去が常に必要です。
CAF の分離手順、カルチャ、および特性評価の最適化
収集した生存細胞のパネルからCAF(CD90.2+ CD45-)の集団を分離するには、さらに2つの通路が必要です:非腫瘍関連線維芽細胞の枯渇と腫瘍関連線維芽細胞の濃縮(図2)。枯渇ビーズカクテルは、効率的にCD45+細胞を除去し(それぞれ、完全な細胞の67.35%および0.69%を占め、全細胞の前および後の枯渇を占める、表2)、そして常にすべての列の1つの腫瘍を処理するために使用された。表1に示すように、溶出した細胞の数は、除食ステップ後の平均×106から1×105の平均から減少した。 総細胞数のこの大規模な減少のために、集めた細胞を、濃縮工程に進む前に、1つのチューブ内の少なくとも2から最大4個の腫瘍までプールするのが便利です。そうすることにより、腫瘍関連線維芽細胞ビーズによるインキュベーションのために十分な数の細胞が得られ、単一の分離カラムを通過してCD90.2+ CD45-細胞の最終平均93%を得た(表2)。
組織培養プレートに播種すると、これらの回収された細胞はプラスチックに付着し、線維芽細胞の典型的な大きな紡錘形形態を明らかにした(図3A、B)および4T1腫瘍細胞とは異なる(図3D)。枯渇後に腫瘍をプールしないと、腫瘍関連線維芽細胞マイクロビーズを伴う細胞収量が低すぎて培養を確立できない。他の場合、マイクロビーズとのインキュベーションの持続時間および温度が注意深く維持されない場合、いくつかの非特異的結合が生じることがある。このような場合、濃縮ステップは効率が悪く、CD90.2- CD45 +および CD90.2- CD45-セルはCD90.2+ CAF(5.97 ± 1.5 および 1.1)と共 ±に回収された(図4および表3)。これらの汚染物質細胞は、異なる形態を有する小クローンの培養における存在を担う可能性が高かった(図4B、黒矢印)、CAFよりも速く成長し、主要なCAF培養物に勝った(図4C)。これらの最適でない結果は、濃縮プロセスの終わりと培養中の細胞増殖時に、CD90.2およびCD45発現の両方を常に再検査することの重要性を確認した。
分離細胞を用い、工学的ナノドラッグのCAF標的化ポテンシャルを評価
新たに分離されたCAFは、基礎研究から薬理学的研究に至るまで、いくつかの用途に使用することができます。このグループの目的は、特にCAFを標的にできるHFnナノケージを開発することです。HFnは、2つの異なるタンパク質で特異的な抗FAP抗体断片(HFn-FAP)で機能化した:抗体比(低い1:1および高い1:5)、およびそれらのCAFとの結合を試験した。FAPは、腫瘍性腫瘍性CAFの表面バイオマーカーとして使用されていたため、単離されたCAFに対するFAP発現をチェックすることが基本的に重要であった(図3C)。FAP発現は、培養中の5箇所にわたって続き、主要なCAF培養が本来の特徴を維持していることを確認した。
HFnに対するFAP機能化は、裸のHFnと比較してCAF標的化に向けた有意なシフトに寄与することが判明し、抗体の量(1:1)の低下はこの効果を観察するのに十分であった(図5A)。しかし、これはインビボ腫瘍モデルを設定するために使用される腫瘍4T1細胞では認められなかったが、ここで裸HFnは機能化されたHFnよりも高い結合を示した(図5B)。これは、このグループ27,33によって広く報告されているように、4T1細胞におけるFAP過剰発現の欠如と、細胞におけるHFn取り込み調節を調節するTfR1とのHFnの優遇相互作用が原因で最も可能性が高かった。これらの結果は、乳房CAFの一次培養物を使用して、腫瘍微小環境に取り組むために設計されたナノ粒子の標的化能力を予備的にスクリーニングすることの有用性を確認した。
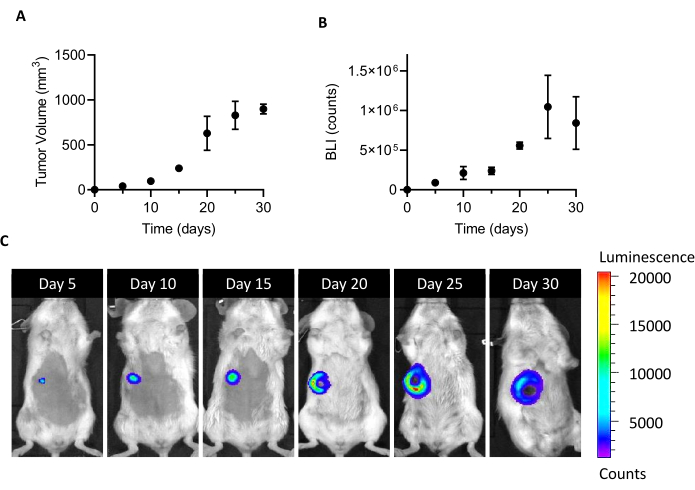
図1 :4T1腫瘍モデルの確立細胞(105細胞/マウス)を乳腺脂肪パッドに注入した。腫瘍増殖は、移植後5日目、10日目、15日目、20日、25日、25日、30日目(A)で、カリパーによる腫瘍体積を測定し、(B)生物発光イメージングにより続いた。腫瘍容積とBLIはそれぞれmm3とカウントとして表される。結果は平均±SEM(n=6)として報告されます。(C)BLI代表的画像は、細胞移植後5、10、15、20、25、および30日目に得られ、25日目まで腫瘍の増殖を確認し、高原に達したと思われる。最後の分析時点(30日)では、BLIは25日目と比較して増加しません。20日目から、壊死および潰瘍の領域が腫瘍の中央部に見えるようになり始める。カラースケール: 最小 = 1,194、最大 = 20,462。略語: BLI = 生物発光イメージング;SEM = 平均の標準誤差。この図の大きなバージョンを表示するには、ここをクリックしてください。
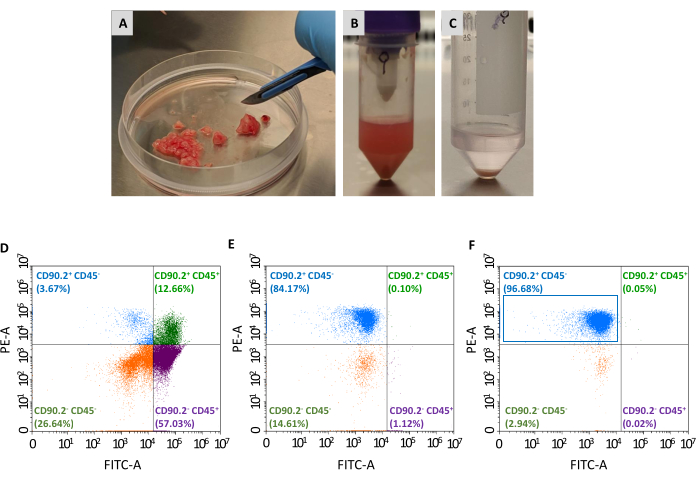
図2:腫瘍試料調製および分離されたCAFのフローサイトメトリー特性測定腫瘍は、メスの助けを借りて、約1〜2mmの小片に切除され、減少した。(B)組織消化後の単細胞懸濁液および切除腫瘍の機械的解離;(C)赤血球のリシス後に得られる細胞ペレット;(D) 赤血球および死細胞の除去後に得られた細胞におけるCD45およびCD90.2発現のフローサイトメトリー解析、(E)非癌関連線維芽細胞の枯渇後、および(F)癌関連線維芽細胞の濃縮後、大多数の細胞がCD90.2+ CD45-(青色長方形)略語: CAF= 癌関連線維芽細胞;CD = 分化のクラスター;PE-A = フィコエリスリンの領域;FITC-A = フルオレセインイソチオシアネートの領域この図の大きなバージョンを表示するには、ここをクリックしてください。
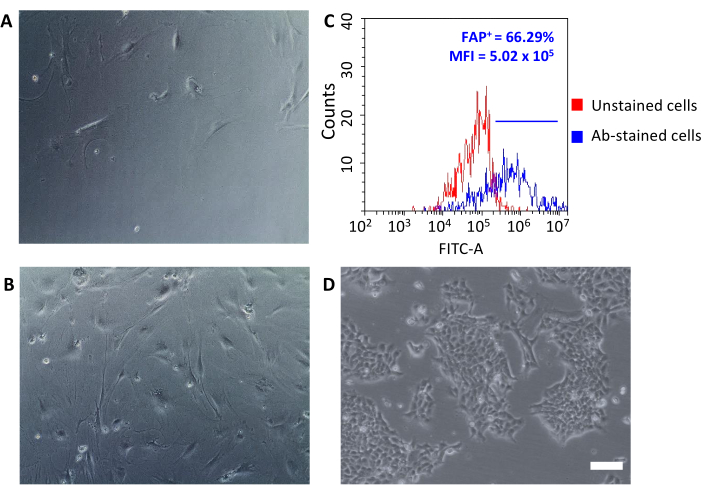
図3:CAFsおよびFAP発現の形態学的解析(A,B)の形態学的形態は、光学顕微鏡(通過2および通過5における異なる合流レベル)によって培養のすべての通路全体でチェックされ、(D)4T1腫瘍細胞と比較した。スケールバー=10μm(C)線維芽細胞活性化タンパク質(FAP)発現を、採取したCD90.2+CD45-細胞上の分離プロセスの終了時にフローサイトメトリーにより評価し、それらの分子特性を確認した。蛍光閾値を未染色対照細胞(赤色グラフ)に設定し、抗体染色細胞の平均蛍光強度と陽性細胞の割合(FAP+)を定量化した(青グラフ)。略語: CAF= 癌関連線維芽細胞;FAP =線維芽細胞活性化タンパク質;CD = 分化のクラスター;MFI = 平均蛍光強度;Ab = 抗体;FITC-A = フルオレセインイソチオシアネートの領域;FAP+ = FAP陽性細胞。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4: 最適でないCAF分離プロセスの例( A)最終分離工程後のフローサイトメトリー評価は、汚染物質CD90.2-CD45+およびCD90.2-CD45-細胞の存在を明らかにした。 (B)これらの細胞は、培養中の3回目の通過後にCAFに勝った(パネルの左下隅に黒い矢印と差し込み)播種時に小さな丸い形態を持つクローンとして見ることができる。スケールバー= 10 μm略語: CAF = 癌関連線維芽細胞;CD = 分化のクラスター;PE-A = フィコエリスリンの領域;FITC-A = フルオレセインイソチオシアネートの領域この図の大きなバージョンを表示するには、ここをクリックしてください。
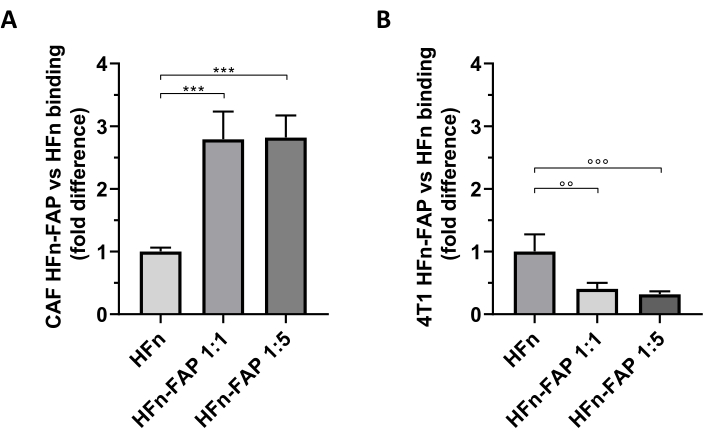
図5: カフスと4T1上のHFnナノケージの結合HFnナノケージをFITCで蛍光標識し、2つの異なるタンパク質抗体比(1:1および1:5)で抗FAP抗体断片(HFn-FAP)で機能し、4°Cで(A)標的CAFおよび(B)4T1細胞で2時間インキュベートした。結合はフローサイトメトリーで評価した。(A)HFn-FAP結合は、両方の抗体断片濃度において、裸のHFnと比較して3倍に有意に増加し、対照的に、4T1細胞において、VF認識によって結合が増強されない、裸のHFnの有意に高い結合が認められた。結果は、3つの独立した実験の平均±標準偏差として報告される。p = 0.0003;°° p = 0.0021 ;°°°p = 0.0008.略語: CAF= 癌関連線維芽細胞;FAP =線維芽細胞活性化タンパク質;HFn = 裸ナノ粒子または共役として使用されるヒトフェリチン重鎖の組換え変異体;HFN-FAP =HFnナノ粒子は、2つのHFn:Fab@FAPモル比、1:1および1:5で調製された抗FAP抗体の可変部分で機能化した。この図の大きなバージョンを表示するには、ここをクリックしてください。
| セル番号(平均±SD) | 抽出収量合計(1節あたり) | |
| 摘出された腫瘍(ポスト赤血球除去) | 1.27 x 108 ± 9.81 x 107 | 100% |
| 摘出された腫瘍(死細胞除去後) | 3.01 x 106 ± 9.61 x 105 | 2.38% |
| 枯渇後のカクテル | 1.15 x 105 ± 4.95 x 104 | 0.11% (3.82%) |
| 投稿のエンリッチメント | 3.00 x 104 ± 1.2 x 104 | 0.027% (26.09%) |
表1:癌関連線維芽細胞の分離の各ステップ後の総細胞数。
| 細胞分布(%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| 摘出された腫瘍(死細胞除去後) | 1.81 ± 0.98 | 10.78 ± 4.51 | 56.57 ± 14.05 | 28.20 ± 17.57 |
| 枯渇後のカクテル | 69.33 ± 16.75 | 0.14 ± 0.13 | 0.55 ± 0.63 | 39.89 ± 30.31 |
| 投稿のエンリッチメント | 93.14 ± 3.3 | 0.09 ± 0.1 | 0.09 ± 0.08 | 6.69 ± 3.4 |
表2:癌関連線維芽細胞の分離の各通過後のCD90.2およびCD45の発現に従った細胞分布。
| 細胞分布(%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| 投稿のエンリッチメント (プーリングなし) | 75.80 ± 2.9 | 1.49 ± 0.4 | 5.97 ± 1.5 | 16.75 ± 1.1 |
表3:CD90.2およびCD45発現は、最適でない癌関連線維芽細胞単離実験の後に収集した。
ディスカッション
CAFは、細胞外マトリックスのリモデリング、転移進行の促進、および腫瘍部位34への薬物アクセスの制限における主要なプレーヤーとして浮上している。しかし、その異質性のために、その役割は依然として議論の余地があり、一部のCAFは腫瘍性であるのに対し、他のサブタイプは腫瘍抑制的な役割を持っているようだ。この文脈では、彼らの孤立は、重要な臨床的意味を持つ癌進行における彼らの多くの議論の役割にもっと光を当てることに極度の関心を持つことができます。さらに、ヒトおよび前臨床マウス腫瘍モデルからのCAF抽出が成功すれば、新しいCAF標的薬の開発も容易になるだろう。本論文は、乳がんの同系前臨床モデルから原発CAFを効率的に分離し培養する方法を報告する。経験に基づいて、3つの実験的なステップは、主にプロトコルの成功に影響を与えます。
1つ目は、カラム内で凝固し、細胞流出を遅らせるリスクに関連する細胞懸濁液の凝集を避けるために速く働いている:実際、カラムを通過した細胞が一緒に集まったとき、最適な分離プロセスの確率が増加し、最終的な培養物には「汚染物質」細胞クローンが含まれていた。2つ目は、最終的な濃縮ステップで十分な細胞を通過させるために、枯渇通過後に異なる腫瘍から細胞をプールすることです。最終的な重要な問題は、抽出された細胞を高い細胞密度でめっきすることですが、おそらく24ウェルプレートの単一のウェルから始まり、細胞の成長とコロニーの拡張を最大4〜5回の通路にまで高めます。細胞が低密度で播種された場合、彼らは自由表面に膨張し、すぐに複製を停止しました。
いくつかの研究は、すでにヒトとマウスの両方の由来のCAF抽出方法を説明しています, 癌の発達と侵襲性を促進する上でのそれらの役割を研究します..これは、乳癌、黒色腫、胆管癌、および膵腺癌35、36、37、38を含む多くのタイプの腫瘍において行われてきた。しかし、特定のCAFマーカーの欠如とその不均一性のために、これらのプロセスの結果は依然として最適ではありません。
ここで、単離された細胞を用いて、抗FAP標的部分で機能化したHFnナノケージのCAF標的化能力を検証した。CADfの一次培養物の使用は、ナノ医薬品最適化のこの予備段階で直接in vivoで行うよりもはるかに簡単で費用対効果の高い結合実験でナノストラテジー ex vivoの検証を可能にする、重要な利点でした。
この意味で、CAFの ex vivo 試験は、CAFの最適な標的化のための最も有望なナノ粒子のスクリーニングおよび選択を可能にすることによって 、生体内 動物実験に先行することができる。ここで提示されるCAFモデルは、活性薬物を用いたナノ粒子をロードする際の予備的有効性研究にも使用することができる。動物は、バイオディストリビューション、薬物動態、および有効性の研究を評価するために後で使用されます。
乳癌における光力学療法のためのフェリチンナノケージや、前立腺癌モデル39,40でドキソルビシンを送達するペプチド系粒子など、いくつかのCAFターゲティングナノ医薬品が開発されている。しかし、ナノドラッグ最適化のための細胞プラットフォームとしてのCAFの分離に焦点を当てた研究はあまりありません。
このプロトコルには、いくつかの制限があります。第一に、それはいくつかの試薬および材料の準備および購入を要求する時間のかかる議定書である。第二に、4T1乳房腫瘍におけるCAFの不足のために、その収率は低い。一次CAFは老化を受け、培養中に長期間維持できないため、必要な細胞数が達成されるとすぐにナノ粒子実験を計画し、実行する必要があります。結論として、このCAの分離、培養、および特徴付けの方法は、がんとの闘いにおける新しい標的ナノ医薬品の開発を加速するための強力なツールとなり得る。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、IG 2017-ID. 20172 プロジェクト – P.I. コルシ ファビオの下でラ・リセルカ・スル・カンクロあたりアソシアツィオーネイタリアーナによってサポートされました。SMは、彼女の地位を支える小児臨床研究センター「ロミオとエンリカ・インヴェルニッツィ」を認めています。ABは、研究フェローシップのためのAIRC(ID. 20172プロジェクト)とミラノ大学に感謝します。LSとMSのポスドクと博士のフェローシップは、ミラノ大学によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| ACK Lysing buffer | Lonza | 10-548E | Store at +15° to +30 °C. |
| Alexa Fluor 488 goat anti-human antibody | Immunological Science | IS-20022 | Protect from light. |
| Anti-FAP Fab fragment (3F2) | Creative Biolabs | TAB-024WM-F(E) | |
| BALB/c mice | Charles River | 028BALB/C | 7 weeks old female mice |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | Store at 2-8 °C. |
| CD45 antibody | Miltenyi Biotec | 130-110-796 | FITC-conjugated fluorescent antibody; clone REA 737; Store protected from light at 2–8 °C. |
| CD90.2 antibody | Miltenyi Biotec | 130-102-960 | PE-conjugated fluorescent antibody; clone 30-H12; Store protected from light at 2–8 °C. |
| Cell strainers 70 µm | VWR | 732-2758 | |
| CytoFLEX | Beckman Coulter | laser configuration B4-R2-V0 | |
| Dead cell Removal Kit | Miltenyi Biotec | 130-090-101 | contains 10 mL of Dead Cell Removal MicroBeads; 25 mL of 20× Binding Buffer Stock Solution. Store protected from light at 2−8 °C. |
| D-Luciferin | Caliper | 760504 | reagent for in vivo imaging |
| DMEM High Glucose w/o L-Glutamine w/ Sodium Pyruvate | Euroclone | ECB7501L | Warm at 37 °C in a water bath before use. |
| DMSO | Sigma-Aldrich | D2650 | |
| DPBS w/o Calcium, w/o Magnesium | Euroclone | ECB4004L | Keep at room temperature. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E9884 | |
| Fetal Bovine Serum | Euroclone | ECS0180L | Before use, heat at 56 °C for 30 min to kill all the complement proteins. |
| Fluorescein Istothiocyanate isomer I (FITC) | Sigma-Aldrich | F7250 | Store protected from light at 2–8 °C. |
| GentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | They are used in combination with the gentleMACS Dissociator. |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | Two samples can be processed in parallel. Special protocols have been developed for various tissues. |
| Goat serum | Euroclone | ECS0200D | |
| Ham's F12 w/o L-Glutamine | Euroclone | ECB7502L | Warm at 37 °C in a water bath before use. |
| IVIS Lumina II imaging system | Caliper Life Sciences | This imaging system is easy to use for both fluorescent and bioluminescent imaging in vivo. Equipped with a Living Image Software for analysis | |
| LD columns | Miltenyi Biotec | 130-042-901 | Composed of ferromagnetic spheres, designed for stringent depletion of unwanted cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use |
| L-Glutamine | Euroclone | ECB3000D | 200 mM stock |
| Light/fluorescence microscope equipped with camera | Leica Microsystems | DM IL LED Fluo/ ICC50 W CameraModule | inverted microscope for live cells with camera |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Separation Unit | Miltenyi Biotec | 130-090-976 | Position the magnet on appropriate stand before use. |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MS columns | Miltenyi Biotec | 130-042-201 | Composed of ferromagnetic spheres, designed for positive selection of cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use. |
| Mycoplasma Removal Agent | Euroclone | ECMC210A | Dilute in culture medium 1:100. |
| NaHCO3 | Invitrogen | A10235 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000C | |
| Non essential aminoacids | Euroclone | ECB3054D | |
| Penicillin-Streptomycin | Euroclone | ECB3001D | |
| Recombinant Human apoferritin H-homopolymer (HFn) | Molirom | MLR-P018 | |
| RPMI 1640 w/o L-Glutamine | Euroclone | ECB9006L | Warm at 37 °C in a water bath before use. |
| Tumor-Associated Fibroblast Isolation kit | Miltenyi Biotec | 130-116-474 | Contains 1 mL of Non-Tumor-Associated Fibroblast Depletion Cocktail, mouse; 1 mL of CD90.2 (Tumor-Associated Fibroblast) MicroBeads,mouse. Store protected from light at 2-8 °C. |
| Tumor Dissociation Kit | Miltenyi Biotec | 130-096-730 | Contains lyophilized enzymes (D, R, A) and buffer A; reconstitute enzymes according to the manufacturer's instructions, aliquot and store at - 20 °C. |
| Trypan blue 0.4% | Lonza | 17-942E | dilute 1:1 with a sample of cell suspension before counting the cells |
| TrypLE select | Gibco | 12563-029 | use at room temperature |
| Trypsin-EDTA | Lonza | BE17-161E | Warm at 37 °C in a water bath before use |
| T75 Primo TC flask | Euroclone | ET7076 | |
| Zeba Spin Desalting Columns | Thermo Fisher Scientific | 89890 | 7K MWCO, 2 mL |
| 1.5 mL tubes | Biosigma | CL15.002.0500 | |
| 15 mL tubes | Euroclone | ET5015B | |
| 4T1-luc2 | Caliper | Mouse mammary gland cancer cell line stably transfected with firefly luciferase gene | |
| 50 mL tubes | Euroclone | ET5050B |
参考文献
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nature Medicine. 19 (11), 1423-1437 (2013).
- Velaei, K., Samadi, N., Barazvan, B., Soleimani Rad, J. Tumor microenvironment-mediated chemoresistance in breast cancer. Breast. 30, 92-100 (2016).
- Cheng, J. D., Weiner, L. M., et al. Tumors and their microenvironments: tilling the soil. Commentary re: A. M. Scott et al., A Phase I dose-escalation study of sibrotuzumab in patients with advanced or metastatic fibroblast activation protein-positive cancer. Clinical Cancer Research. 9 (5), 1690-1695 (2003).
- Hui, L., Chen, Y. Tumor microenvironment: Sanctuary of the devil. Cancer Letters. 368 (1), 7-13 (2015).
- Balkwill, F. R., Capasso, M., Hagemann, T. The tumor microenvironment at a glance. Journal of Cell Science. 125, 5591-5596 (2012).
- Chen, X., Song, E. Turning foes to friends: targeting cancer-associated fibroblasts. Nature Review. Drug Discovery. 18 (2), 99-115 (2019).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Seminars in Cell & Developmental Biology. 21 (1), 33-39 (2010).
- LeBleu, V. S., Kalluri, R. A peek into cancer-associated fibroblasts: origins, functions and translational impact. Disease Models & Mechanisms. 11, (2018).
- Li, X. -. Y., Hu, S. -. Q., Xiao, L. The cancer-associated fibroblasts and drug resistance. European Review for Medical and Pharmacological Sciences. 19 (11), 2112-2119 (2015).
- Luo, H., Tu, G., Liu, Z., Liu, M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Letters. 361 (2), 155-163 (2015).
- Truffi, M., Sorrentino, L., Corsi, F. Fibroblasts in the tumor microenvironment. Advances in Experimental Medicine and Biology. 1234, 15-29 (2020).
- Sugimoto, H., Mundel, T. M., Kieran, M. W., Kalluri, R. Identification of fibroblast heterogeneity in the tumor microenvironment. Cancer Biology & Therapy. 5 (12), 1640-1646 (2006).
- Costa, A., et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell. 33 (3), 463-479 (2018).
- Ishii, G., Ochiai, A., Neri, S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Advances Drug Delivery Reviews. 99, 186-196 (2016).
- Chen, Q., et al. Remodeling the tumor microenvironment with emerging nanotherapeutics. Trends in Pharmacological Sciences. 39 (1), 59-74 (2018).
- Truffi, M., et al. Nano-strategies to target breast cancer-associated fibroblasts: rearranging the tumor microenvironment to achieve antitumor efficacy. International Journal of Molecular Sciences. 20 (6), 1263 (2019).
- Tong, R., Langer, R. Nanomedicines Targeting the Tumor Microenvironment. Cancer Journal. 21 (4), 314-321 (2015).
- Kaps, L., Schuppan, D. Targeting cancer associated fibroblasts in liver fibrosis and liver cancer using nanocarriers. Cells. 9 (9), 2027 (2020).
- Miao, L., et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors. Cancer Research. 77 (3), 719-731 (2017).
- Kelly, T., Huang, Y., Simms, A. E., Mazur, A. Fibroblast activation protein-α: a key modulator of the microenvironment in multiple pathologies. International Review of Cell and Molecular Biology. 297, 83-116 (2012).
- Brennen, W. N., Isaacs, J. T., Denmeade, S. R. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy. Molecular Cancer Therapeutics. 11 (2), 257-266 (2012).
- Juillerat-Jeanneret, L., Tafelmeyer, P., Golshayan, D. Fibroblast activation protein-α in fibrogenic disorders and cancer: more than a prolyl-specific peptidase. Expert Opinion on Therapeutic Targets. 21, 977-991 (2017).
- Falvo, E., et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin. Nanoscale. 5 (24), 12278-12285 (2013).
- Truffi, M., et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research. 107, 57-65 (2016).
- Cai, Y., et al. Enhanced magnetic resonance imaging and staining of cancer cells using ferrimagnetic H-ferritin nanoparticles with increasing core size. International Journal of Nanomedicine. 10, 2619-2634 (2015).
- Heger, Z., Skalickova, S., Zitka, O., Adam, V., Kizek, R. Apoferritin applications in nanomedicine. Nanomedicine. 9 (14), 2233-2245 (2014).
- Mazzucchelli, S., et al. Nanometronomic treatment of 4T1 breast cancer with nanocaged doxorubicin prevents drug resistance and circumvents cardiotoxicity. Oncotarget. 8 (5), 8383-8396 (2017).
- Yu, Q., et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy. Journal of Controlled Release. 321, 564-575 (2020).
- Mertens, J. C., et al. Therapeutic effects of deleting cancer-associated fibroblasts in cholangiocarcinoma. Cancer Research. 73 (2), 897-907 (2013).
- Kovács, D., et al. Core-shell nanoparticles suppress metastasis and modify the tumour-supportive activity of cancer-associated fibroblasts. Journal of Nanobiotechnology. 18, 18 (2020).
- Sharon, Y., Alon, L., Glanz, S., Servais, C., Erez, N. Isolation of normal and cancer-associated fibroblasts from fresh tissues by Fluorescence Activated Cell Sorting (FACS). Journal of Visualized Experiments. (71), e4425 (2013).
- Sitia, L., et al. Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax. Cells. 10 (2), 328 (2021).
- Bellini, M., et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells. Journal of Controlled Release. 196, 184-196 (2014).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nature Reviews Cancer. 20, 174-186 (2020).
- Dvořánková, B., Lacina, L., Smetana, K. Isolation of normal fibroblasts and their cancer-associated counterparts (CAFs) for biomedical research. Methods in Molecular Biology. 1879, 393-406 (2018).
- Calvo, F., Hooper, S., Sahai, E. Isolation and immortalization of fibroblasts from different tumoral stages. Bio-protocol. 4 (7), 1097 (2014).
- Sha, M., et al. Isolation of cancer-associated fibroblasts and its promotion to the progression of intrahepatic cholangiocarcinoma. Cancer Medicine. 7 (9), 4665-4677 (2018).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Zhen, Z., et al. Protein nanocage mediated fibroblast-activation protein targeted photoimmunotherapy to enhance cytotoxic T cell infiltration and tumor control. Nano Letters. 17 (2), 862-869 (2017).
- Ji, T., et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery. Advances Materials. 27 (11), 1865-1873 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved