Method Article
Isolement de fibroblastes primaires associés au cancer à partir d’un modèle murin syngénique du cancer du sein pour l’étude de nanoparticules ciblées
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article vise à fournir un protocole pour l’isolement et la culture de fibroblastes primaires associés au cancer à partir d’un modèle murin syngénique du cancer du sein triple négatif et leur application pour l’étude préclinique de nouvelles nanoparticules conçues pour cibler le microenvironnement tumoral.
Résumé
Les fibroblastes associés au cancer (CAF) sont des acteurs clés dans le contexte du microenvironnement tumoral. Bien qu’ils soient réduits en nombre par rapport aux cellules tumorales, les CAF régulent la progression tumorale et offrent une protection contre l’immunité antitumorale. Les stratégies anticancéreux émergentes visent à remodeler le microenvironnement tumoral par l’ablation des CAF pro-tumorigènes ou la reprogrammation des fonctions des CAF et de leur statut d’activation. Une approche prometteuse est le développement d’agents d’administration nanométriques capables de cibler les CAF, permettant ainsi l’administration spécifique de médicaments et de molécules actives. Dans ce contexte, un modèle cellulaire de CAF peut fournir un outil utile pour le dépistage in vitro et l’étude préliminaire de ces nanoformulations.
Cette étude décrit l’isolement et la culture des CAF primaires à partir du modèle murin syngénique 4T1 du cancer du sein triple négatif. Les billes magnétiques ont été utilisées dans un processus de séparation en 2 étapes pour extraire les CAF des tumeurs dissociées. Le contrôle de l’immunophénotypage a été effectué à l’aide de la cytométrie en flux après chaque passage pour vérifier le rendement du processus. Des CAF isolés peuvent être utilisés pour étudier la capacité de ciblage de différentes nanoformulations conçues pour s’attaquer au microenvironnement tumoral. Des nanocages de H-ferritine marqués par fluorescence ont été utilisés comme nanoparticules candidates pour mettre en place la méthode. Les nanoparticules, nues ou conjuguées avec un ligand de ciblage, ont été analysées pour leur liaison aux CAF. Les résultats suggèrent que l’extraction ex vivo des CAF du sein peut être un système utile pour tester et valider les nanoparticules pour le ciblage spécifique des CAF tumorigènes.
Introduction
Au cours des dernières décennies, il est devenu clair que tuer les cellules tumorales n’est généralement pas suffisant pour éradiquer la malignité, car le microenvironnement tumoral peut provoquer une rechute tumorale et induire une résistance thérapeutique1,2. Un nouveau paradigme a alors émergé : cibler le stroma tumoral pour priver la tumeur de facteurs de soutien et ainsi, augmenter l’efficacité des agents chimiothérapeutiques3,4,5. En particulier, les fibroblastes associés au cancer (CAF) sont une cible stromale intéressante dans de nombreuses tumeurs solides6,7. Les CAF sont un groupe très hétérogène de cellules qui interagissent avec les cellules cancéreuses et les cellules du système immunitaire par la sécrétion de facteurs de croissance, de cytokines et de chimiokines; construire et remodeler la matrice extracellulaire; et permettre la formation de métastases8,9,10,11,12. Selon le type de tumeur, les CAF montrent des fonctions pro-tumorigènes, tandis que d’autres sous-types de CAF semblent avoir des fonctions suppressives de tumeur13,14. Pour mieux clarifier cette dichotomie, une caractérisation approfondie des CAF des tumeurs primaires et métastatiques est importante.
Dans ce contexte, un domaine de recherche émergent s’est concentré sur le développement d’agents nanométriques conçus pour cibler et/ou détruire les CAF en délivrant des molécules actives et des médicaments capables de remodeler le microenvironnement tumoral15,16,17,18. Plusieurs types de nanoparticules ont été conçus pour réaliser l’ablation CAF par des médicaments cytotoxiques, pour induire une thérapie photodynamique ciblée par CAF, ou pour reprogrammer les CAF en les ramenant à un état de repos ou en induisant l’expression de ligand induite par l’apoptose liée au TNF, qui induit l’apoptose des cellules cancéreuses voisines16,19. De plus, le potentiel de nombreuses nanoparticules à cibler activement des marqueurs biologiques spécifiques donne lieu à l’espoir de sélectionner des sous-ensembles CAF à cibler. Bien que sa spécificité absolue pour le CAF soit encore remise en question, la protéine d’activation des fibroblastes (FAP) est l’une des cibles les plus prometteuses du stroma pro-tumorigène et est exploitée pour orienter l’administration de nanomédicaments, ouvrant ainsi la voie au développement de nanothérapies ciblant les CAF20,21,22.
Cet article décrit l’isolement des CAF primaires à partir d’un modèle syngénique du cancer du sein murin et rapporte leur utilisation dans l’étude de la capacité de ciblage des nanoparticules conçues pour reconnaître le marqueur CAF, FAP. Les nanocages de ferritine sont utilisés comme nanosystèmes candidats pour mettre en place la méthode, car leur spécificité d’administration peut être façonnée par l’exposition de surface des fractions de ciblage23,24. De plus, les ferritines se sont avérées être d’excellentes navettes biocompatibles pour les applications antitumorales, déclenchant une accumulation rapide de la charge utile dans la masse tumorale25,26,27. À ce jour, des études précliniques de nanosystèmes ciblant les FAC ont impliqué des tests in vitro sur des lignées cellulaires de fibroblastes stimulées en culture avec un facteur de croissance transformant bêta pour induire l’activation cellulaire et l’expression de certaines caractéristiques immunophénotypes des CAF28,29. Cette méthode est généralement appliquée aux lignées cellulaires immortalisées (telles que NIH3T3, LX-2) et est assez rapide et simple, produisant des cellules activées en quelques heures ou quelques jours. Une limitation est que bien que la stimulation in vitro induise l’expression de certains gènes attribués aux myofibroblastes activés, elle ne peut pas récapituler entièrement toutes les caractéristiques biologiques des CAF réels, en particulier leur hétérogénéité in vivo.
Une autre stratégie consiste à extraire des CAF primaires à partir d’échantillons de tumeurs humaines ou de souris30,31. Cela garantit que l’activation des FAC se produit dans un contexte physiologique et que l’hétérogénéité des sous-populations des FAC est maintenue. Selon l’objectif de recherche, les CAF peuvent provenir de différentes sources, offrant ainsi la possibilité d’étudier la condition la plus fiable. Le protocole présenté ici serait précieux pour les scientifiques qui cherchent à effectuer une évaluation préliminaire de la fonctionnalité de nouvelles nanoparticules conçues pour cibler les CAF à partir d’un modèle murin de cancer du sein. Les CAF isolés seraient utiles pour le dépistage des nanoparticules suffisamment prometteuses pour procéder à une évaluation in vivo dans des modèles animaux de cancer. Cela sera pertinent lors des premières étapes de la production de nanoparticules, conduisant les nanotechnologues vers le raffinement de la conception des nanoparticules en considérant principalement la stratégie d’immobilisation des ligands pour atteindre des propriétés de ciblage optimales.
Protocole
1. Établissement d’un modèle syngénique 4T1 du cancer du sein
REMARQUE: Le présent protocole décrit l’isolement des CAF primaires d’une tumeur mammaire 4T1 chez la souris. L’étude animale décrite ici a été approuvée par le ministère italien de la Santé (numéro d’autorité 110/2018-PR).
- Culture et implantation de cellules tumorales
- Décongeler 1 ×10 6 cellules de 4T1-luc dans une fiole T75 avec 10 mL de milieu Roswell Park Memorial Institute (RPMI) 1640 complété par 10% de sérum fœtal bovin (FBS), 1% de pénicilline / streptomycine (P / S) et 1% de L-glutamine. Ajouter l’agent d’élimination des mycoplasmes (1:100) dans le milieu de culture.
REMARQUE: Les cellules 4T1-luc expriment de manière stable la luciférase et peuvent être visualisées par bioluminescence (BLI) lors d’une stimulation appropriée avec de la D-luciférine. Cela permet une surveillance in vivo de la viabilité et de la prolifération des cellules tumorales lors de l’implantation chez la souris (Figure 1). - Maintenir les cellules à 37 °C et 5 % deCO2 dans une atmosphère humidifiée jusqu’à ~80 % de confluence, en changeant le milieu tous les 2 jours.
REMARQUE: Continuer le traitement avec un agent d’élimination des mycoplasmes pendant 1 semaine (~ 2/3 passages) avant l’injection chez la souris pour s’assurer que les cellules injectées sont exemptes de mycoplasmes. - Le jour de l’intervention, détacher les cellules à l’aide de 1 mL de solution d’acide trypsine-éthylènediaminetétraacétique (EDTA) (trypsine 1:250) pendant 5 min à 37 °C. Arrêtez l’activité de la trypsine en ajoutant un milieu de culture, comptez les cellules avec du bleu de trypan (1:1) et calculez le nombre de cellules/mL.
- Pipette le volume correspondant à 1 × 106 cellules et centrifuger pendant 5 min à 400 × g. Versez le surnageant et resuspendez la pastille dans 1 mL de milieu de base RPMI 1640. Gardez les cellules sur la glace jusqu’à ce qu’elles entraitent prêtes pour l’injection.
REMARQUE: Pour chaque souris, 1 × 105 cellules sont nécessaires; cependant, calculez toujours pour un excès de 2 souris (correspondant à 2 × 105 cellules) pour faciliter le chargement de la seringue. - Un jour avant l’opération, rasez la fourrure de 8 souris BALB/c (femelle, âgées de sept semaines) pour exposer la zone des glandes mammaires abdominales du côté droit. Utilisez un rasoir électrique et appliquez une fine couche de crème dépilatoire pendant 4 min; ensuite, lavez la crème avec de l’eau et un morceau de papier.
- Induire l’anesthésie par inhalation continue de gaz isoflurane à 2% pendant environ 5 min, et effectuer une injection sous-cutanée dans la région des glandes mammaires abdominales avec une seringue à tuberculine de 27 G. Tournez l’aiguille vers le haut pour pénétrer dans la peau par voie sous-cutanée; ensuite, maintenez la peau vers le haut et injectez lentement 100 μL de suspension cellulaire (1 × 105 cellules). Tournez légèrement l’aiguille avant de rétracter lentement la seringue.
REMARQUE: N’oubliez pas de porter la suspension cellulaire à température ambiante 15 minutes avant l’injection.
- Décongeler 1 ×10 6 cellules de 4T1-luc dans une fiole T75 avec 10 mL de milieu Roswell Park Memorial Institute (RPMI) 1640 complété par 10% de sérum fœtal bovin (FBS), 1% de pénicilline / streptomycine (P / S) et 1% de L-glutamine. Ajouter l’agent d’élimination des mycoplasmes (1:100) dans le milieu de culture.
- Croissance tumorale et dissection
- 5 jours après l’injection cellulaire, injecter 150 mg/kg de D-lucifératonéalement (100 μL) 5 min avant l’imagerie. Capturez des images BLI à l’aide d’un système d’imagerie in vivo réglant une exposition de 10 s, un binning moyen et un f/stop à 4. Définissez la zone luminescente de la tumeur comme la région d’intérêt (ROI) et quantifiez le signal total dans le ROI (photon/ sec / m2)à l’aide d’un logiciel d’imagerie.
- Répétez la procédure d’imagerie (1.2.1) tous les 5 jours à partir de l’injection pour surveiller la croissance tumorale en termes d’augmentation du BLI.
- Pour établir le volume de la tumeur, tenez la souris et exposez son ventre. Utilisez des étriers pour mesurer la longueur (L) et la largeur de la tumeur (W) une fois par semaine. Calculer le volume tumoral (V) à l’aide de l’équation 1.
[V = (L x L2)/2] (1) - À 20 jours après l’injection de cellules, sacrifier les animaux par luxation cervicale, dissocier les tumeurs de la peau avec des ciseaux et les recueillir dans une solution de stockage de tissus (voir le tableau des matériaux).
REMARQUE: Les échantillons tumoraux peuvent être utilisés immédiatement pour la dissociation en cellules individuelles (section 2) ou stockés à 4 °C jusqu’à 48 h.
2. Dissociation tumorale en cellules uniques
REMARQUE: Pour les étapes suivantes, utilisez des réactifs stériles et des produits jetables dans une hotte à flux laminaire. Travailler avec 4 tumeurs à la fois.
- Placez l’échantillon de tumeur dans une boîte de Pétri et retirez soigneusement tout fragment de peau, de graisse et de zones nécrotiques à l’aide d’une pince à épiler et d’un scalpel. Ensuite, réduisez la tumeur en petits morceaux d’environ 1 à 2 mm et transférez-les dans un tube(Figure 2A).
REMARQUE: Les tumeurs 4T1 deviennent très nécrotiques en croissance, avec une tendance à l’ulcération. Il est important d’enlever soigneusement les zones nécrotiques pour éviter toute interférence de débris avec les étapes suivantes. - Préparer un mélange de digestion pour la dissociation tumorale: mélanger 2,35 mL de milieu RPMI 1640, 100 μL d’enzyme D, 50 μL d’enzyme R et 12,5 μL d’enzyme A. Faire tremper les fragments de tumeur dans la solution et fermer fermement le tube.
REMARQUE: Les volumes indiqués de mélange de digestion sont valables pour les tumeurs jusqu’à 1 g et peuvent être ajustés pour les tumeurs plus grandes en fonction de leur poids. Les tumeurs 4T1 cultivées pendant 20 jours normalement sont dans une plage de 0,5 à 0,8 g. - Tournez le tube à l’envers, en vérifiant que tous les morceaux de tumeur se trouvent dans le bas du tube vers le capuchon. Fixez le tube à un dissociateur mécanique dans le boîtier approprié et exécutez un programme de dissociation spécifique conçu pour les tumeurs dures (voir les instructions du fabricant).
REMARQUE: Des tubes spéciaux peuvent être nécessaires pour s’insérer dans le dissociateur. Les tubes en C portent un rotor à l’intérieur du capuchon pour favoriser la dissociation mécanique du tissu. - Détachez le tube, maintenez-le à l’envers et incubez l’échantillon à 37 °C pendant 40 min en le secouant doucement. Ensuite, fixez le tube au dissociateur dans le boîtier approprié et exécutez deux fois le programme de dissociation spécifique suivant conçu pour les tumeurs dures. Assurez-vous qu’il n’y a pas de gros morceaux de tissu à la fin de la procédure (Figure 2B).
REMARQUE: Pour dissocier la tumeur, d’autres cocktails enzymatiques pourraient être utilisés pour dégrader la matrice extracellulaire. Cependant, dans ce protocole, un kit de dissociation tumorale disponible dans le commerce contenant un mélange d’enzymes optimisé (enzymes D, R, A) et un dissociateur semi-automatisé qui dissocie mécaniquement le tissu ont été utilisés. Cette combinaison a assuré une dégradation appropriée de la matrice extracellulaire ainsi que le maintien de l’intégrité cellulaire et des épitopes de surface cellulaire. - Filtrer l’échantillon à travers une passoire cellulaire de 40 μm dans un tube de 50 mL, laver le filtre avec 10 mL de milieu RPMI 1640 et centrifuger le tube pendant 7 min à 300 × g. Si la pastille cellulaire apparaît rouge, lyse érythrocytes en ajoutant 1 mL de tampon de lysage ammonium-chlorure-potassium (ACK) pendant 5 min à température ambiante, laver avec 10 mL de RPMI 1640, transférer la suspension cellulaire dans un tube de 15 mL et centrifuger à nouveau.
- Resuspensez la pastille dans 1 mL de tampon PBE composé d’une solution saline tamponnée au phosphate (PBS), d’albumine sérique bovine (BSA) à 0,5 % et de 2 mM d’EDTA, et comptez les cellules avec du bleu de trypan (1:1). En cas d’amas cellulaires, filtrer la suspension cellulaire à travers une passoire cellulaire de 70 μm, préalablement imbibée de PBS.
REMARQUE: Surtout lorsque les tumeurs sont grosses, il est important de vérifier le nombre de cellules et éventuellement de diviser chaque échantillon de tumeur dans différents tubes avec pas plus de 107 cellules dans chaque tube avant de passer à l’étape 2.7. - Préparer le tampon de liaison d’élimination des cellules mortes en diluant la solution tampon de liaison 20x (voir le tableau des matériaux)avec de l’eau stérile double distillée. Laver les cellules avec 5 mL de tampon de liaison de 1×(Figure 2C).
REMARQUE : Maintenez le tampon à 4 °C. - Centrifuger pendant 7 min à 300 × g, et ressuspender la pastille cellulaire avec 0,1 mL de microbilles d’élimination des cellules mortes (voir le Tableau des matériaux). Bien mélanger et incuber à température ambiante pendant 15 min.
- Pendant l’incubation avec des billes, préparez un support magnétique sous le capot et accrochez des colonnes de séparation ferromagnétique (une colonne pour un nombre de 107 cellules) dessus avec les pointes pointant vers le bas. Équilibrez les colonnes avec 0,5 mL de tampon de liaison froid 1×. Attendez que la solution ait coulé sous la gravité.
REMARQUE: Il est important de ne pas dépasser le nombre de cellules par colonne pour éviter tout risque de coagulation du lit de la colonne et de réduire le rendement de récupération. Lorsque vous travaillez avec plus de 107 cellules, utilisez plus de colonnes en fonction du nombre total de cellules ou utilisez des colonnes plus grandes. Dans de tels cas, ajustez les volumes de réactif décrits dans les étapes suivantes à ceux indiqués par le fabricant. - À la fin de l’incubation, ajouter 400 μL de tampon de liaison froid de 1× à la suspension perle/cellule, charger tout le volume sur la colonne et recueillir l’effluent (correspondant aux cellules non étiquetées) dans un tube de 15 mL.
- Lavez la colonne quatre fois avec 0,5 mL de tampon de liaison froid 1× et recueillez l’effluent total (correspondant à la fraction cellulaire vivante) dans le même tube.
- Comptez les cellules avec le bleu trypan (1:1). Placez 1 × 105 cellules dans deux tubes pour le tri cellulaire activé par fluorescence (FACS), et maintenez-les à 4 °C jusqu’à la validation du procédé (voir étape 4.1) : utilisez le premier tube pour définir les paramètres d’analyse et les régions de positivité (tube témoin) et l’autre pour l’analyse des biomarqueurs (tube échantillon). Utilisez les cellules restantes pour l’extraction des CAF (voir rubrique 3).
REMARQUE: L’élimination des cellules mortes est importante pour réduire les réactions non spécifiques avec les microbilles de la rubrique 3. Cependant, pour améliorer le rendement, évitez l’élimination des cellules mortes si la proportion de cellules mortes est de <20%.
3. Extraction des CAF primaires de la tumeur du sein
REMARQUE: Pour la section 3, utilisez le kit d’isolement de fibroblastes associés à la tumeur de souris contenant un cocktail d’épuisement des fibroblastes non associés à la tumeur et des microbilles de fibroblastes associées à la tumeur adaptées au profilage magnétique des cellules (voir la table des matériaux).
- Épuisement des fibroblastes non associés au cancer
- Humidifiez une passoire cellulaire de 70 μm avec du PBS et filtrez la suspension cellulaire pour éliminer les amas. Ensuite, centrifugez les cellules pendant 10 min à 300 × g et aspirez le surnageant.
REMARQUE: Si une seule tumeur a été divisée en deux échantillons pour l’étape 2.7, remettez en commun la suspension cellulaire deux par deux avant de passer à l’étape 3.1.2. - Resuspendez la pastille dans 80 μL de tampon PBE froid et ajoutez 20 μL de cocktail d’épuisement des fibroblastes non associés à la tumeur. Bien mélanger et incuber à 4 °C pendant 15 min dans l’obscurité.
- Pendant l’incubation avec des billes, préparer des colonnes d’épuisement ferromagnétiques (1 par échantillon) sur un support magnétique et équilibrer les colonnes avec 2 mL de tampon PBE froid. Attendez que la solution soit passée.
- À la fin de l’incubation, ajouter 400 μL de tampon PBE froid à la suspension perle/cellule, charger tout le volume sur la colonne et recueillir l’effluent (correspondant aux cellules non étiquetées) dans un tube de 15 mL.
- Lavez la colonne deux fois avec 2 mL de tampon PBE froid et collectez l’effluent total dans le même tube. Centrifuger pendant 10 min à 300 × g et mettre en réserve dans 0,1 mL de tampon PBE froid.
REMARQUE: L’épuisement des fibroblastes non associés au cancer réduit considérablement la quantité totale de cellules récupérées. Il est généralement nécessaire et recommandé de regrouper les suspensions cellulaires de quatre échantillons différents pour obtenir une pastille visible et suffisamment de cellules pour l’étape 3.2. Cela garantira un rendement optimal. - Placer 20 μL de la suspension cellulaire dans un tube FACS et la maintenir à 4 °C pour la validation du procédé (voir rubrique 4). Utilisez les cellules restantes pour la sélection CAF (voir étape 3.2).
- Humidifiez une passoire cellulaire de 70 μm avec du PBS et filtrez la suspension cellulaire pour éliminer les amas. Ensuite, centrifugez les cellules pendant 10 min à 300 × g et aspirez le surnageant.
- Sélection positive des fibroblastes associés au cancer
- Ajouter 20 μL de microbilles de fibroblastes associées à la tumeur à 80 μL de suspension cellulaire. Bien mélanger et incuber à 4 °C pendant 15 min dans l’obscurité.
- Pendant l’incubation avec des billes, préparer des colonnes de séparation ferromagnétique (1 par échantillon) sur un support magnétique et équilibrer les colonnes avec 0,5 mL de tampon PBE froid. Attendez que la solution soit passée.
- À la fin de l’incubation, ajoutez 400 μL de tampon PBE froid à la suspension perle/cellule, chargez tout le volume sur la colonne et laissez les cellules non étiquetées s’écouler dans un tube de 15 mL.
- Lavez la colonne trois fois avec 0,5 mL de tampon PBE froid et collectez l’effluent total dans le même tube.
REMARQUE: Le flux contient des cellules CD90.2 négatives non étiquetées, qui peuvent être jetées comme fibroblastes non associés au cancer. - Retirez la colonne de l’aimant et placez-la dans un tube de 1,5 mL. Ajoutez 1 mL de PBE froid sur la colonne et poussez immédiatement le piston dans la colonne pour rincer les cellules.
- Centrifuger pendant 10 min à 400 × g et mettre en réserve dans 0,1 mL de tampon PBE froid. Placer 20 μL de suspension cellulaire dans un tube FACS et le maintenir à 4 °C pour la validation du procédé (voir rubrique 4).
REMARQUE: Après la centrifugation, la pastille peut être à peine visible, surtout lorsque les tumeurs d’origine sont petites. Utilisez des tubes centrifuges à fond conique et veillez à ne pas perdre de cellules lorsque vous aspirez le surnageant. - Diluer les cellules restantes dans un volume approprié de Milieu d’Aigle Modifié (DMEM) de Dulbecco/F-12 de Ham complété par 15% de FBS, 2 mM de L-glutamine, 1% de P/S et 1% d’acides aminés non essentiels, et ensemencer les cellules dans une plaque de culture tissulaire.
- Vérifiez la densité cellulaire au microscope et placez la plaque dans un incubateur à 37 °C et 5 % de CO2 pour laisser les cellules adhérer et se développer.
REMARQUE: Si les cellules sont trop denses, divisez immédiatement la suspension cellulaire en deux puits de la plaque de culture tissulaire avant de placer la plaque dans l’incubateur.
4. Validation du processus
- Cytométrie en flux
REMARQUE: La section 4.1 ne nécessite pas de conditions stériles et peut être effectuée à l’extérieur de la hotte laminaire. Effectuer la rubrique 4.1 en parallèle pour les échantillons prélevés à l’étape 2.11 (tumeur dissociée), à l’étape 3.1.6 (après épuisement des fibroblastes non associés au cancer) et à l’étape 3.2.6 (après enrichissement des fibroblastes associés au cancer).- Centrifugez les tubes FACS préparés aux étapes 2.11, 3.1.6 et 3.2.6 pendant 10 min à 300 × g. Jetez le surnageant.
REMARQUE: Préparez au moins un tube supplémentaire, qui contient des cellules non colorées agissant comme un contrôle pour définir les paramètres pour l’analyse. - Dans les tubes d’échantillonnage, resussuspendez les cellules dans 88 μL de PBE et ajoutez 2 μL d’anticorps anti-CD45 conjugués avec de l’isothiocyanate de fluorescéine (FITC, dilution 1:50, selon les instructions du fabricant) et 10 μL d’anticorps anti-CD90.2 conjugués avec de la phycoérythrine (PE, dilution 1:10, selon les instructions du fabricant). Bien mélanger et incuber pendant 10 min à 4 °C dans l’obscurité. Dans le tube témoin (non coloré), ressuspendez les cellules dans 100 μL de PBE. Incuber pendant 10 min à 4 °C dans l’obscurité pour reproduire la procédure suivie pour les cellules colorées par anticorps.
REMARQUE: La température et le temps d’incubation doivent être vérifiés avec soin, car une variation de ces variables pourrait entraîner une coloration médiocre ou non spécifique, modifiant ainsi les résultats. - Après avoir terminé l’étape d’incubation, effectuez un lavage en ajoutant 1 mL de PBE. Centrifuger pendant 10 min à 300 x g. Jetez le surnageant.
- Resuspendez les cellules (tous les tubes) dans 500 μL de PBS.
- Bien mélanger et procéder à l’analyse de cytométrie en flux. Réglez les canaux pour mesurer la fluorescence des anticorps (c.-à-d. FITC et PE).
- À partir du tube de commande, sélectionnez toutes les cellules viables en dessinant une première porte (P1) sur le tracé de dispersion avant ou latérale (FSC vs SSC). Dans P1, définissez une deuxième porte (P2) comprenant uniquement des cellules individuelles.
- En utilisant les canaux de fluorescence spécifiques des anticorps (c.-à-d. FITC et PE), définissez des portes appropriées pour discerner les cellules colorées positivement.
- Commencez l’analyse et enregistrez au moins 10 000 événements dans P2. Lisez les signaux des deux canaux simultanément.
REMARQUE: Si le nombre total de cellules est inférieur à celui prévu, il pourrait être préférable de lire le tube entier. - (FACULTATIF) Si d’autres colorations avec des anticorps/fluorophores supplémentaires sont programmées, définissez une matrice de compensation appropriée avant de commencer l’analyse.
- Centrifugez les tubes FACS préparés aux étapes 2.11, 3.1.6 et 3.2.6 pendant 10 min à 300 × g. Jetez le surnageant.
- Surveillance de la morphologie et des caractéristiques des cellules
REMARQUE: Une fois ensemencées, les cellules doivent être manipulées dans des conditions stériles.- Le lendemain de l’ensemencement, visualisez les cellules au microscope optique pour vérifier l’adhésion et la morphologie des cellules. Aspirer le surnageant et le remplacer par un milieu frais.
REMARQUE: Les CAF sont de grandes cellules en forme de fuseau, qui peuvent être facilement distinguées de la structure épithéliale des cellules tumorales 4T1. - Maintenir les cellules à 37 °C et 5% de CO2 dans une atmosphère humidifiée, en changeant le milieu tous les 2 jours.
- Lorsque les cellules atteignent environ 80% de confluence (environ 4 à 6 jours après l’ensemencement), détachez les cellules à l’aide de la solution TrypLE Select (voir le tableau des matériaux)pendant 5 minutes à température ambiante. Ajouter le milieu frais (4:1), centrifuger la suspension cellulaire à 400 × g pendant 5 min et ressuspener la pastille dans un milieu frais.
- Divisez les cellules 1:2 et développez la culture jusqu’à ce que le nombre de cellules nécessaires à l’expérience soit obtenu.
- À chaque passage, vérifiez la morphologie et la croissance des cellules au microscope optique. Si la morphologie cellulaire n’est pas homogène (par exemple, des clones de petites cellules de forme ronde apparaissant en culture), analyser un échantillon de cellules par cytométrie en flux comme décrit à la rubrique 4.1. S’il est homogène, passez à l’étape 4.2.7.
REMARQUE: Les changements dans la morphologie cellulaire peuvent indiquer une contamination par des fibroblastes non associés au cancer, qui doivent être enlevés pour assurer la pureté de la culture. - Analyser les résultats de la cytométrie en flux et procéder selon l’un des scénarios suivants : (i) en cas de contamination des cellules CD90.2-/CD45-, prélever toutes les cellules et répéter la sélection positive en suivant l’étape 3.2; ii) si des cellules CD45+ sont également contaminées, prélever toutes les cellules et répéter l’épuisement à l’étape 3.1; iii) s’il n’y a pas de contamination (seules des cellules CD90.2+/CD45- sont présentes), garder les cellules en culture et passer directement au point 4.2.7.
REMARQUE: Comme la répétition du processus d’épuisement avec des microbilles réduira la récupération cellulaire, il n’est recommandé que lorsque les cellules n’ont pas besoin d’être utilisées immédiatement. - Comptez les cellules avec du bleu de trypan (1:1), placez 5 ×10 5 cellules dans deux tubes FACS et centrifugez pendant 10 min à 300 × g. Jeter le surnageant et ressusser la pastille dans 0,5 mL de tampon bloquant (PBS complété par 2% de BSA, 2% de sérum de chèvre) pendant 15 min à température ambiante.
REMARQUE: Un tube agit comme un contrôle composé uniquement de cellules non colorées, tandis que les cellules du deuxième tube seront colorées pour l’analyse de cytométrie en flux. - Centrifuger pendant 10 min à 300 × g, jeter le surnageant et ressuspender dans 99 μL de tampon bloquant. Ajouter 1 μg d’anticorps anti-FAP au tube d’échantillonnage et 1 mL de tampon bloquant au tube témoin. Bien mélanger et incuber pendant 15 min à température ambiante.
REMARQUE: FAP est un marqueur de surface du stroma tumoral réactif et peut être utilisé pour identifier et caractériser les CAF. - Laver trois fois avec du PBS, centrifuger et incuber avec l’anticorps secondaire approprié conjugué avec un colorant fluorescent (1 μg) dans un tampon bloquant pendant 15 min à température ambiante.
- Laver trois fois avec du PBS et analyser par cytométrie en flux (suivre les étapes 4.1.5 à 4.1.7 en réglant le canal approprié pour détecter le fluorophore utilisé). Ensuite, utilisez les cellules pour des expériences (étape 5.2).
- (FACULTATIF) Congeler un échantillon de cellules dans 1 mL de 90 % de FBS et de 10 % de diméthylsulfoxyde (DMSO); conserver à -80 °C pour une utilisation ultérieure.
- Le lendemain de l’ensemencement, visualisez les cellules au microscope optique pour vérifier l’adhésion et la morphologie des cellules. Aspirer le surnageant et le remplacer par un milieu frais.
5. CAF ciblant par des nanoparticules de ferritine modifiées
REMARQUE: Une variante recombinante de la chaîne lourde de ferritine humaine (HFn) a été utilisée comme nanoparticule nue ou a été conjuguée avec des fractions de ciblage. Ici, les nanoparticules HFn fonctionnalisées avec la partie variable d’un anticorps anti-FAP (Fab@FAP) ont été préparées par le NanoBioLab de l’Université de Milan-Bicocca à deux rapports molaires HFn:Fab@FAP, 1:1 et 1:5, selon un protocole32décrit précédemment.
- Marquage fluorescent des nanoparticules HFn
REMARQUE: Les nanocages HFn nus et fonctionnalisés sont marqués par fluorescence avec FITC.- Dissoudre la poudre de FITC dans de l’éthanol à 99 % pour obtenir une concentration de 2 mg/mL.
REMARQUE: Cette solution doit être préparée fraîchement. - Incuber 50 μL de la solution préparée (200 μg de FITC) pour 1 mg de protéine (c.-à-d. 100 μL de HFn à 10 mg/mL). Ajouter 50 μL de 1 M de bicarbonate de sodium (NaHCO3),et régler le volume à 500 μL avec 0,1 M de NaHCO3.
REMARQUE: Augmentez les volumes en fonction des besoins expérimentaux. - Incuber le mélange réactionnel à température ambiante, dans l’obscurité et sous agitation continue pendant 1 h.
- Éliminer l’excès de FITC du conjugué par filtration sur gel à l’aide d’une colonne de dessalement par spin (7 kDa MWCO).
- Évaluer la concentration de la protéine marquée récupérée à l’aide d’un spectrophotomètre. Estimer les quantités de protéines et de colorants en mesurant l’absorbance à 280 nm et à 488 nm, respectivement.
- Dissoudre la poudre de FITC dans de l’éthanol à 99 % pour obtenir une concentration de 2 mg/mL.
- Liaison des nanoparticules de HFn aux CAF
REMARQUE : Utilisez des CAF d’au plus tard les passages 4 à 5 dans culture.- Placer 5 × 10 5 cellules danschaque tube FACS, centrifuger pendant 10 min à 300 × g, et resuspenter dans 0,5 mL de PBS, 0,3% de BSA complété par 0,1 mg/mL des différentes préparations de nanoparticules (HFn nu, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) préalablement étiquetées avec FITC.
REMARQUE : Exécutez chaque condition en trois exemplaires. Préparer un tube supplémentaire comme échantillon témoin non étiqueté auquel aucune nanoparticule n’est ajoutée. - Incuber pendant 2 h à 4 °C dans l’obscurité, centrifuger et laver trois fois dans du PBS.
- Resuspendez les cellules avec 0,5 mL de PBS, mélangez bien et analysez par cytométrie en flux. Définissez les canaux pour mesurer la fluorescence du FITC.
- Après avoir râté sur des cellules individuelles vivantes, acquérez 20 000 événements. Utilisez le tube témoin non étiqueté pour définir la porte de positivité FITC et obtenir le pourcentage d’événements FITC+ (correspondant à la liaison aux nanoparticules).
- Placer 5 × 10 5 cellules danschaque tube FACS, centrifuger pendant 10 min à 300 × g, et resuspenter dans 0,5 mL de PBS, 0,3% de BSA complété par 0,1 mg/mL des différentes préparations de nanoparticules (HFn nu, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) préalablement étiquetées avec FITC.
6. Analyse statistique et réplications expérimentales
- Animaux
- Effectuer trois expériences indépendantes de croissance tumorale et d’isolement des CAF, en utilisant 8 animaux par expérience, comme décrit au point 1.1.5. Pour optimiser le rendement d’isolement des CAF, divisez les tissus excisés en sous-groupes (n = 4) et traitez-les en suivant les étapes décrites à la section 2.
- Interaction HFn avec les cellules
- Évaluer l’interaction des HFn fonctionnalisées et non fonctionnalisées avec les cellules cibles et non ciblées (CAF et 4T1, respectivement) en termes de pourcentage de cellules colorées positivement par des nanocages marqués par fluorescence. Déclarez les résultats sous forme d’écart-type moyen ± de trois expériences indépendantes.
- Analyse statistique
- Pour calculer la signification statistique dans les expériences de liaison cellulaire avec HFn et HFn-FAP, utilisez le test ANOVA unidirectionnelle ordinaire.
Résultats
Configuration de modèles in vivo pour une isolation optimale des CAF
L’injection de 105 cellules 4T1-luc dans le coussinet adipeux mammaire de souris FEMELLEs BALB/c conduit à la croissance d’une masse tumorale détectable 5 jours après l’implantation. En mesurant le volume tumoral par étriers et la viabilité des cellules tumorales par BLI, la croissance tumorale a été surveillée pendant un mois après l’implantation. Pour trouver une fenêtre de sacrifice adéquate pour l’isolement des CAF, un compromis optimal a été recherché entre une taille tumorale plus élevée et une BLI d’une part et une ulcération tumorale émergente et une nécrose d’autre part (Figure 1). Comme un noyau nécrotique apparaît 20 jours après l’implantation et qu’il s’agrandit à 25 et 30 jours (comme le documentent les images BLI de la figure 1C),le jour 20 a été défini comme point temporel pour optimiser la récupération cellulaire après le processus d’isolement. Même après avoir soigneusement enlevé toutes les zones nécrotiques visibles au cours des premières étapes de la manipulation de la tumeur ex vivo,un pourcentage élevé de cellules mortes a été trouvé à la fin de la dissociation en cellules uniques (Tableau 1). Comme ce pourcentage peut être pertinent, en particulier avec l’augmentation de la taille de la tumeur, l’élimination des cellules mortes est toujours nécessaire lorsque vous travaillez avec le modèle 4T1.
Optimisation de la procédure d’isolement, de la culture et de la caractérisation des CAF
Deux autres passages sont nécessaires pour isoler la population de CAF (CD90.2+ CD45-) du panel de cellules viables collectées: l’épuisement des fibroblastes non associés à la tumeur et l’enrichissement des fibroblastes associés à la tumeur (Figure 2). Le cocktail de billes d’épuisement élimine efficacement les cellules CD45+ (représentant respectivement 67,35% et 0,69% du total des cellules avant et après l’épuisement, respectivement, tableau 2),et a toujours été utilisé pour traiter une seule tumeur dans chaque colonne. Comme le montre le tableau 1,le nombre de cellules éluées est passé d’une moyenne de 3 × 106 à 1 × 105 après l’étape d’épuisement. En raison de cette diminution massive du nombre total de cellules, il est pratique de regrouper les cellules collectées d’au moins 2 à un maximum de 4 tumeurs dans un seul tube avant de procéder à l’étape d’enrichissement. Ce faisant, un nombre adéquat de cellules a été obtenu pour l’incubation avec des billes de fibroblastes associées à la tumeur et passé à travers une seule colonne de séparation pour obtenir une moyenne finale de 93% de cellules CD90.2+ CD45( Tableau 2).
Une fois ensemencées sur des plaques de culture tissulaire, ces cellules récupérées attachées au plastique et ont révélé une grande morphologie en forme de fuseau typique des fibroblastes(Figure 3A,B)et différente des cellules tumorales 4T1(Figure 3D). Ne pas mettre en commun les tumeurs après l’épuisement entraîne un rendement cellulaire avec des microbilles de fibroblastes associées à la tumeur trop faible pour établir une culture. Dans d’autres cas, lorsque la durée et la température des incubations avec des microbilles ne sont pas soigneusement maintenues, une certaine liaison non spécifique peut se produire. Dans de tels cas, les étapes d’enrichissement étaient moins efficaces et des pourcentages plus élevés de cellules CD90,2- CD45+ et CD90,2- CD45 - ont été récupérés avec les CELLULES CD90,2+ CAF (5,97 ± 1,5 et 16,75 ± 1,1, respectivement)(figure 4 et tableau 3). Ces cellules contaminantes étaient susceptibles d’être responsables de la présence en culture de petits clones de morphologie différente(Figure 4B,pointes de flèches noires) qui ont grandi plus vite que les CAF et ont prévalu sur la culture primaire de CAF (Figure 4C). Ces résultats sous-optimaux ont confirmé l’importance de toujours revérifier l’expression de CD90.2 et de CD45, ainsi que la morphologie cellulaire à la fin du processus d’enrichissement et pendant la croissance cellulaire en culture.
Utilisation de cellules isolées pour évaluer le potentiel de ciblage CAF des nanomédicaments modifiés
Les CAF fraîchement isolés peuvent être utilisés pour plusieurs applications allant de la recherche fondamentale aux études pharmacologiques. L’objectif de ce groupe est de développer des nanocages HFn capables de cibler spécifiquement les CAF. HFn a été fonctionnalisé avec un fragment d’anticorps anti-FAP spécifique (HFn-FAP) à deux rapports protéines/anticorps différents (un 1:1 inférieur et un 1:5 supérieur), et leur liaison avec les CAF a été testée. Comme le FAP était utilisé comme biomarqueur de surface des CAF pro-tumorigènes, il était d’une importance fondamentale de vérifier l’expression du FAP sur des CAF isolés (Figure 3C). L’expression du FAP a été suivie sur 5 passages dans la culture pour confirmer que la culture primaire des FAC a conservé ses caractéristiques d’origine.
La fonctionnalisation de la PAF sur HFn s’est avérée contribuer à un changement significatif vers le ciblage CAF par rapport au HFn nu, et la quantité plus faible d’anticorps (1:1) était suffisante pour observer cet effet(Figure 5A). Cependant, cela n’a pas été observé avec les cellules tumorales 4T1 utilisées pour mettre en place le modèle tumoral in vivo, dans lequel HFn nu a montré une liaison plus élevée que HFn fonctionnalisé (Figure 5B). Cela était probablement dû à l’absence de surexpression de FAP dans les cellules 4T1 et à l’interaction préférentielle de HFn avec TfR1, qui régule l’absorption de HFn dans les cellules, comme largement rapporté par ce groupe27,33. Ces résultats confirment l’utilité d’utiliser des cultures primaires de CAF du sein pour dépister de manière préliminaire la capacité de ciblage des nanoparticules conçues pour s’attaquer au microenvironnement tumoral.
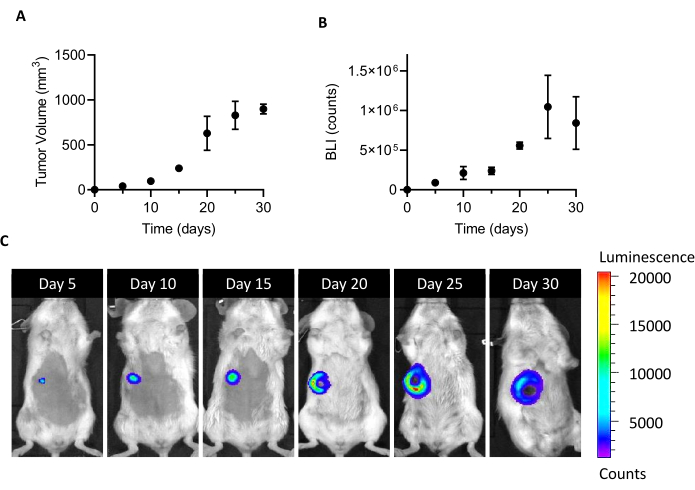
Figure 1: Mise en place du modèle tumoral 4T1. Des cellules (10à 5 cellules/souris) ont été injectées dans le coussinet adipeux mammaire. La croissance tumorale a été suivie aux jours 5, 10, 15, 20, 25 et 30 après l’implantation (A) en mesurant le volume tumoral avec des étriers et (B) par imagerie par bioluminescence. Les volumes tumoraux et les BLI sont exprimés en mm3 et en nombre, respectivement. Les résultats sont présentés comme moyens ± SEM (n = 6). (C) Les images représentatives de BLI obtenues 5, 10, 15, 20, 25 et 30 jours après l’implantation cellulaire confirment la croissance tumorale jusqu’au jour 25, quand elle semble atteindre un plateau. Au dernier point d’analyse (30 jours), le BLI n’augmente pas par rapport au jour 25. À partir du jour 20, les zones de nécrose et d’ulcération commencent à devenir visibles dans la partie centrale de la tumeur. Échelle de couleur: Min = 1 194, Max = 20 462. Abréviations : BLI = imagerie par bioluminescence; SEM = erreur-type de la moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
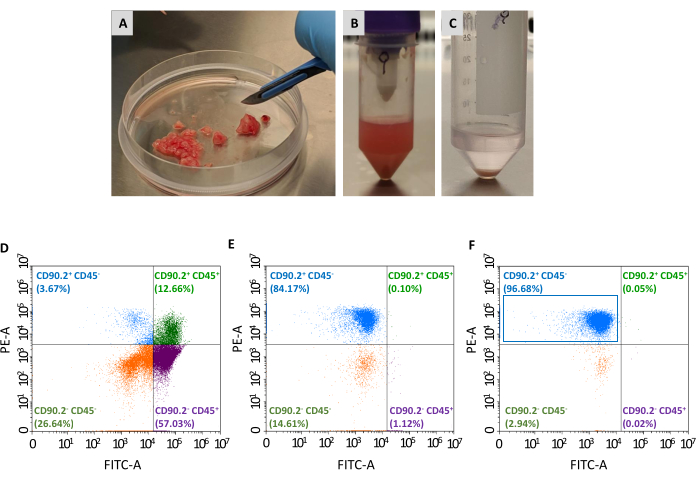
Figure 2: Préparation d’échantillons tumoraux et caractérisation par cytométrie en flux de CAF isolés. Les tumeurs ont été excisées et réduites en(A)petits morceaux d’environ 1–2 mm à l’aide d’un scalpel; (B) suspension unicellulaire après digestion tissulaire et dissociation mécanique d’une tumeur excisée; C)pastille de cellules obtenue après lyse des globules rouges; (D) analyse par cytométrie en flux de l’expression de CD45 et CD90.2 dans les cellules obtenues après élimination des globules rouges et des cellules mortes, (E) après épuisement des fibroblastes non associés au cancer, et (F) après enrichissement des fibroblastes associés au cancer, où la majorité des cellules sont CD90.2+ CD45- (rectangle bleu). Abréviations : CAF= fibroblastes associés au cancer; CD = groupe de différenciation; PE-A = aire de phycoérythrine; FITC-A = zones d’isothiocyanate de fluorescéine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
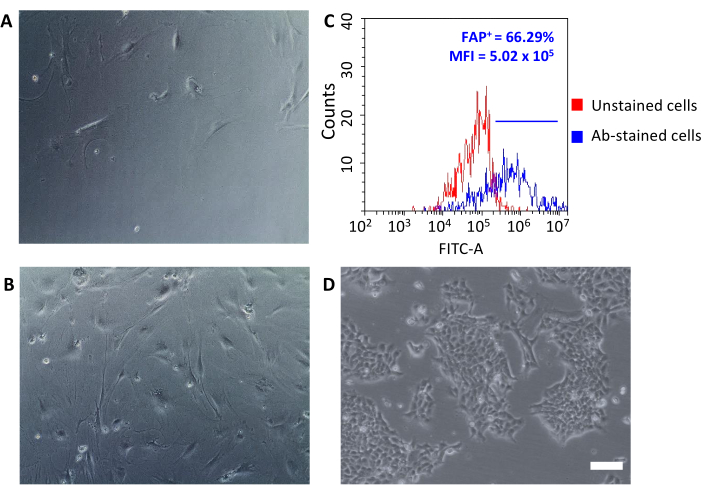
Figure 3: Analyse morphologique de l’expression des FACS et des FAP. (A, B) La morphologie des CAF a été vérifiée dans tous les passages de culture par microscopie optique (différents niveaux de confluence au passage 2 et au passage 5) et comparée à(D)les cellules tumorales 4T1; barres d’échelle = 10 μm. (C) L’expression de la protéine d’activation des fibroblastes (FAP) a été évaluée par cytométrie en flux à la fin du processus d’isolement sur les cellules CD90.2+ CD45collectées pour confirmer leurs caractéristiques moléculaires. Un seuil de fluorescence a été fixé sur les cellules témoins non colorées (graphique rouge) pour quantifier l’intensité moyenne de fluorescence et le pourcentage de cellules positives (FAP+)parmi les cellules colorées par anticorps (graphique bleu). Abréviations : CAF= fibroblastes associés au cancer; FAP = protéine d’activation des fibroblastes; CD = groupe de différenciation; IFD = intensité moyenne de fluorescence; Ab = anticorps; FITC-A = aire d’isothiocyanate de fluorescéine; FAP+ = cellules FAP positives. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4: Exemple d’un procédé d’isolement sous-optimal des CAF. (A) L’évaluation de la cytométrie en flux après l’étape finale d’isolement a révélé la présence de cellules CD90.2- CD45+ et CD90.2- CD45. (B) Ces cellules peuvent être vues comme des clones avec une petite morphologie ronde lors de l’ensemencement (pointes de flèches noires et encart dans le coin inférieur gauche du panneau) qui (C) ont prévalu sur les CAF après le troisième passage en culture. Barres d’échelle = 10 μm. Abréviations : CAF = fibroblaste associé au cancer; CD = groupe de différenciation; PE-A = aire de phycoérythrine; FITC-A = zones d’isothiocyanate de fluorescéine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
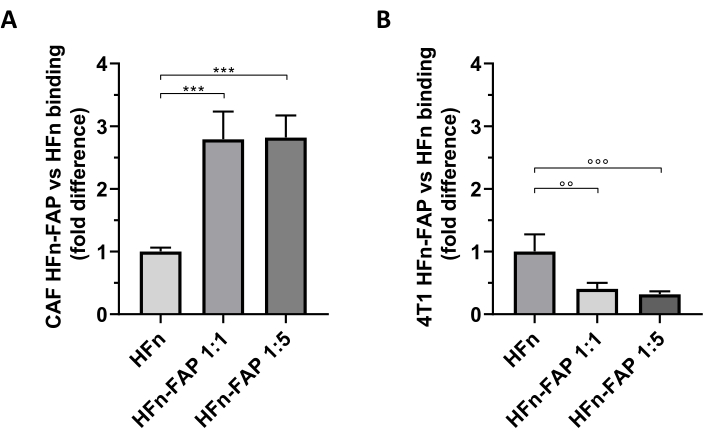
Figure 5: Liaison des nanocages HFn sur les CAF et 4T1. Les nanocages HFn ont été marqués par fluorescence avec fitC, fonctionnalisés avec un fragment d’anticorps anti-FAP (HFn-FAP) à deux rapports protéine-anticorps différents (1:1 et 1:5), et incubés avec des CAF cibles(A)et(B)des cellules 4T1 à 4 °C pendant 2 h. La liaison a été évaluée par cytométrie en flux. (A) La liaison HFn-FAP avec les CAF est significativement augmentée à la concentration des deux fragments d’anticorps par trois fois par rapport au HFn nu. (B) en revanche, une liaison significativement plus élevée de HFn nu a été observée dans les cellules 4T1, où la liaison n’est pas améliorée par la reconnaissance FAP. Les résultats sont présentés comme moyens ±'écart-type de trois expériences indépendantes. p = 0,0003; °° p = 0,0021 ; °°° p = 0,0008. Abréviations : CAF= fibroblastes associés au cancer; FAP = protéine d’activation des fibroblastes; HFn = variante recombinante de la chaîne lourde de ferritine humaine utilisée comme nanoparticule nue ou conjuguée; HFN-FAP = nanoparticules HFn fonctionnalisées avec la portion variable d’un anticorps anti-FAP préparé à deux rapports molaires HFn:Fab@FAP, 1:1 et 1:5. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Numéro de cellule (moyenne ± SD) | Rendement d’extraction total (par passage) | |
| Tumeur excisée (post-élimination des globules rouges) | 1,27 x 108 ± 9,81 x 107 | 100% |
| Tumeur excisée (post-élimination des cellules mortes) | 3,01 x 106 ± 9,61 x 105 | 2.38% |
| Cocktail post-épuisement | 1,15 x 105 ± 4,95 x 104 | 0.11% (3.82%) |
| Post-enrichissement | 3,00 x 104 ± 1,2 x 104 | 0.027% (26.09%) |
Tableau 1 : Nombre total de cellules après chaque étape d’isolement des fibroblastes associés au cancer.
| Distribution cellulaire (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| Tumeur excisée (post-élimination des cellules mortes) | 1,81 ± 0,98 | 10,78 ± 4,51 | 56,57 ± 14,05 | 28 h 20 ± 17 h 57 |
| Cocktail post-épuisement | 69,33 ± 16,75 | 0,14 ± 0,13 | 0,55 ± 0,63 | 39,89 ± 30,31 |
| Post-enrichissement | 93,14 ± 3,3 | 0,09 ± 0,1 | 0,09 ± 0,08 | 6,69 ± 3,4 |
Tableau 2 : Distribution cellulaire selon l’expression de CD90.2 et CD45 après chaque passage d’isolement des fibroblastes associés au cancer.
| Distribution cellulaire (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| Post-enrichissement (pas de mise en commun) | 75,80 ± 2,9 | 1,49 ± 0,4 | 5,97 ± 1,5 | 16,75 ± 1,1 |
Tableau 3 : Expression cd90.2 et CD45 des cellules prélevées après une expérience d’isolement des fibroblastes sous-optimale associée au cancer.
Discussion
Les CAF apparaissent comme des acteurs clés dans le remodelage de la matrice extracellulaire, la promotion de la progression des métastases et la limitation de l’accès aux médicaments au site tumoral34. Cependant, en raison de leur hétérogénéité, leurs rôles sont encore controversés – certains CAF sont tumorigènes, tandis que d’autres sous-types semblent avoir un rôle suppresseur de tumeurs. Dans ce contexte, leur isolement peut être d’un intérêt extrême pour faire la lumière sur leur rôle très débattu dans la progression du cancer, qui aura d’importantes implications cliniques12,31. De plus, l’extraction réussie de CAF à partir de modèles tumoraux humains et précliniques de souris faciliterait également le développement de nouveaux médicaments ciblant les CAF. Cet article présente une méthode permettant d’isoler et de mettre en culture efficacement les CAF primaires à partir d’un modèle préclinique syngénique du cancer du sein. Sur la base de l’expérience, trois étapes expérimentales influencent principalement le succès du protocole.
La première consiste à travailler rapidement pour éviter l’agrégation des suspensions cellulaires associées au risque de coagulation dans la colonne et de ralentissement de l’efflux cellulaire: en fait, lorsque les cellules qui ont traversé la colonne ont été regroupées, la probabilité d’un processus d’isolement sous-optimal a augmenté et les cultures finales contenaient des clones de cellules « contaminantes ». La seconde consiste à mettre en commun les cellules de différentes tumeurs après le passage de l’épuisement pour garantir suffisamment de cellules à traverser dans l’étape finale d’enrichissement. Le dernier problème critique est le placage des cellules extraites à des densités cellulaires élevées, probablement à partir d’un seul puits de la plaque de 24 puits pour stimuler la croissance cellulaire et l’expansion des colonies jusqu’à 4 à 5 passages. Si les cellules étaient ensemencées à de faibles densités, elles se dilataient sur la surface libre et cessaient rapidement de se répliquer.
Plusieurs études ont déjà décrit les méthodes d’extraction des FAC d’origine humaine et souris, afin d’étudier leur rôle dans la promotion du développement du cancer et de l’invasivité. Cela a été fait dans de nombreux types de tumeurs, y compris le cancer du sein, le mélanome, le cholangiocarcinome et l’adénocarcinome pancréatique35,36,37,38. Cependant, en raison de l’absence de marqueurs CAF spécifiques et de leur hétérogénéité, les résultats de ces processus sont encore sous-optimaux.
Ici, les cellules isolées ont été utilisées pour valider la capacité de ciblage CAF des nanocages HFn fonctionnalisés avec des fractions de ciblage anti-FAP. L’utilisation de cultures primaires de CAF a été un avantage significatif, permettant la validation de la nanostratégie ex vivo avec une expérience de liaison beaucoup plus simple et rentable que de le faire directement in vivo à cette phase préliminaire de l’optimisation des nanomédicaments.
En ce sens, les essais ex vivo sur les CAF peuvent précéder les expérimentations animales in vivo en permettant le criblage et la sélection des nanoparticules les plus prometteuses pour le ciblage optimal des FAC. Le modèle CAF présenté ici peut également être utilisé pour des études préliminaires d’efficacité, lors du chargement de nanoparticules avec des médicaments actifs. Les animaux ne seront utilisés que plus tard pour évaluer la biodistribution, la pharmacocinétique et les études d’efficacité.
Plusieurs nanomédicaments ciblant les FAC sont en cours de développement, tels que des nanocages de ferritine pour la thérapie photodynamique dans le cancer du sein et des particules à base de peptides pour délivrer de la doxorubicine dans les modèles de cancer de la prostate39,40. Cependant, peu d’études se sont concentrées sur l’isolement des CAF en tant que plates-formes cellulaires pour l’optimisation des nanomédicaments.
Ce protocole présente certaines limites. Tout d’abord, il s’agit d’un protocole qui prend beaucoup de temps, nécessitant la préparation et l’achat de plusieurs réactifs et matériaux. Deuxièmement, en raison de la rareté des CAF dans la tumeur mammaire 4T1, leur rendement est faible. Les expériences sur les nanoparticules doivent être planifiées et réalisées dès que le nombre de cellules requis est atteint, car les CAF primaires subissent une sénescence et ne peuvent pas être maintenues en culture pendant une longue période. En conclusion, cette méthode d’isolement, de culture et de caractérisation des CAF peut être un outil puissant pour accélérer le développement de nouveaux nanomédicaments ciblés dans la lutte contre le cancer.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été soutenue par l’Associazione Italiana per la Ricerca sul Cancro (AIRC) dans le cadre du projet IG 2017-ID. 20172 – P.I. Corsi Fabio. SM reconnaît le centre de recherche clinique pédiatrique « Romeo and Enrica Invernizzi » qui soutient sa position. AB remercie l’AIRC (projet ID. 20172) et l’Université de Milan pour leur bourse de recherche. Les bourses postdoctorales et doctorales LS et MS sont soutenues par l’Université de Milan.
matériels
| Name | Company | Catalog Number | Comments |
| ACK Lysing buffer | Lonza | 10-548E | Store at +15° to +30 °C. |
| Alexa Fluor 488 goat anti-human antibody | Immunological Science | IS-20022 | Protect from light. |
| Anti-FAP Fab fragment (3F2) | Creative Biolabs | TAB-024WM-F(E) | |
| BALB/c mice | Charles River | 028BALB/C | 7 weeks old female mice |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | Store at 2-8 °C. |
| CD45 antibody | Miltenyi Biotec | 130-110-796 | FITC-conjugated fluorescent antibody; clone REA 737; Store protected from light at 2–8 °C. |
| CD90.2 antibody | Miltenyi Biotec | 130-102-960 | PE-conjugated fluorescent antibody; clone 30-H12; Store protected from light at 2–8 °C. |
| Cell strainers 70 µm | VWR | 732-2758 | |
| CytoFLEX | Beckman Coulter | laser configuration B4-R2-V0 | |
| Dead cell Removal Kit | Miltenyi Biotec | 130-090-101 | contains 10 mL of Dead Cell Removal MicroBeads; 25 mL of 20× Binding Buffer Stock Solution. Store protected from light at 2−8 °C. |
| D-Luciferin | Caliper | 760504 | reagent for in vivo imaging |
| DMEM High Glucose w/o L-Glutamine w/ Sodium Pyruvate | Euroclone | ECB7501L | Warm at 37 °C in a water bath before use. |
| DMSO | Sigma-Aldrich | D2650 | |
| DPBS w/o Calcium, w/o Magnesium | Euroclone | ECB4004L | Keep at room temperature. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E9884 | |
| Fetal Bovine Serum | Euroclone | ECS0180L | Before use, heat at 56 °C for 30 min to kill all the complement proteins. |
| Fluorescein Istothiocyanate isomer I (FITC) | Sigma-Aldrich | F7250 | Store protected from light at 2–8 °C. |
| GentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | They are used in combination with the gentleMACS Dissociator. |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | Two samples can be processed in parallel. Special protocols have been developed for various tissues. |
| Goat serum | Euroclone | ECS0200D | |
| Ham's F12 w/o L-Glutamine | Euroclone | ECB7502L | Warm at 37 °C in a water bath before use. |
| IVIS Lumina II imaging system | Caliper Life Sciences | This imaging system is easy to use for both fluorescent and bioluminescent imaging in vivo. Equipped with a Living Image Software for analysis | |
| LD columns | Miltenyi Biotec | 130-042-901 | Composed of ferromagnetic spheres, designed for stringent depletion of unwanted cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use |
| L-Glutamine | Euroclone | ECB3000D | 200 mM stock |
| Light/fluorescence microscope equipped with camera | Leica Microsystems | DM IL LED Fluo/ ICC50 W CameraModule | inverted microscope for live cells with camera |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Separation Unit | Miltenyi Biotec | 130-090-976 | Position the magnet on appropriate stand before use. |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MS columns | Miltenyi Biotec | 130-042-201 | Composed of ferromagnetic spheres, designed for positive selection of cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use. |
| Mycoplasma Removal Agent | Euroclone | ECMC210A | Dilute in culture medium 1:100. |
| NaHCO3 | Invitrogen | A10235 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000C | |
| Non essential aminoacids | Euroclone | ECB3054D | |
| Penicillin-Streptomycin | Euroclone | ECB3001D | |
| Recombinant Human apoferritin H-homopolymer (HFn) | Molirom | MLR-P018 | |
| RPMI 1640 w/o L-Glutamine | Euroclone | ECB9006L | Warm at 37 °C in a water bath before use. |
| Tumor-Associated Fibroblast Isolation kit | Miltenyi Biotec | 130-116-474 | Contains 1 mL of Non-Tumor-Associated Fibroblast Depletion Cocktail, mouse; 1 mL of CD90.2 (Tumor-Associated Fibroblast) MicroBeads,mouse. Store protected from light at 2-8 °C. |
| Tumor Dissociation Kit | Miltenyi Biotec | 130-096-730 | Contains lyophilized enzymes (D, R, A) and buffer A; reconstitute enzymes according to the manufacturer's instructions, aliquot and store at - 20 °C. |
| Trypan blue 0.4% | Lonza | 17-942E | dilute 1:1 with a sample of cell suspension before counting the cells |
| TrypLE select | Gibco | 12563-029 | use at room temperature |
| Trypsin-EDTA | Lonza | BE17-161E | Warm at 37 °C in a water bath before use |
| T75 Primo TC flask | Euroclone | ET7076 | |
| Zeba Spin Desalting Columns | Thermo Fisher Scientific | 89890 | 7K MWCO, 2 mL |
| 1.5 mL tubes | Biosigma | CL15.002.0500 | |
| 15 mL tubes | Euroclone | ET5015B | |
| 4T1-luc2 | Caliper | Mouse mammary gland cancer cell line stably transfected with firefly luciferase gene | |
| 50 mL tubes | Euroclone | ET5050B |
Références
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nature Medicine. 19 (11), 1423-1437 (2013).
- Velaei, K., Samadi, N., Barazvan, B., Soleimani Rad, J. Tumor microenvironment-mediated chemoresistance in breast cancer. Breast. 30, 92-100 (2016).
- Cheng, J. D., Weiner, L. M., et al. Tumors and their microenvironments: tilling the soil. Commentary re: A. M. Scott et al., A Phase I dose-escalation study of sibrotuzumab in patients with advanced or metastatic fibroblast activation protein-positive cancer. Clinical Cancer Research. 9 (5), 1690-1695 (2003).
- Hui, L., Chen, Y. Tumor microenvironment: Sanctuary of the devil. Cancer Letters. 368 (1), 7-13 (2015).
- Balkwill, F. R., Capasso, M., Hagemann, T. The tumor microenvironment at a glance. Journal of Cell Science. 125, 5591-5596 (2012).
- Chen, X., Song, E. Turning foes to friends: targeting cancer-associated fibroblasts. Nature Review. Drug Discovery. 18 (2), 99-115 (2019).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Seminars in Cell & Developmental Biology. 21 (1), 33-39 (2010).
- LeBleu, V. S., Kalluri, R. A peek into cancer-associated fibroblasts: origins, functions and translational impact. Disease Models & Mechanisms. 11, (2018).
- Li, X. -. Y., Hu, S. -. Q., Xiao, L. The cancer-associated fibroblasts and drug resistance. European Review for Medical and Pharmacological Sciences. 19 (11), 2112-2119 (2015).
- Luo, H., Tu, G., Liu, Z., Liu, M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Letters. 361 (2), 155-163 (2015).
- Truffi, M., Sorrentino, L., Corsi, F. Fibroblasts in the tumor microenvironment. Advances in Experimental Medicine and Biology. 1234, 15-29 (2020).
- Sugimoto, H., Mundel, T. M., Kieran, M. W., Kalluri, R. Identification of fibroblast heterogeneity in the tumor microenvironment. Cancer Biology & Therapy. 5 (12), 1640-1646 (2006).
- Costa, A., et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell. 33 (3), 463-479 (2018).
- Ishii, G., Ochiai, A., Neri, S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Advances Drug Delivery Reviews. 99, 186-196 (2016).
- Chen, Q., et al. Remodeling the tumor microenvironment with emerging nanotherapeutics. Trends in Pharmacological Sciences. 39 (1), 59-74 (2018).
- Truffi, M., et al. Nano-strategies to target breast cancer-associated fibroblasts: rearranging the tumor microenvironment to achieve antitumor efficacy. International Journal of Molecular Sciences. 20 (6), 1263 (2019).
- Tong, R., Langer, R. Nanomedicines Targeting the Tumor Microenvironment. Cancer Journal. 21 (4), 314-321 (2015).
- Kaps, L., Schuppan, D. Targeting cancer associated fibroblasts in liver fibrosis and liver cancer using nanocarriers. Cells. 9 (9), 2027 (2020).
- Miao, L., et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors. Cancer Research. 77 (3), 719-731 (2017).
- Kelly, T., Huang, Y., Simms, A. E., Mazur, A. Fibroblast activation protein-α: a key modulator of the microenvironment in multiple pathologies. International Review of Cell and Molecular Biology. 297, 83-116 (2012).
- Brennen, W. N., Isaacs, J. T., Denmeade, S. R. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy. Molecular Cancer Therapeutics. 11 (2), 257-266 (2012).
- Juillerat-Jeanneret, L., Tafelmeyer, P., Golshayan, D. Fibroblast activation protein-α in fibrogenic disorders and cancer: more than a prolyl-specific peptidase. Expert Opinion on Therapeutic Targets. 21, 977-991 (2017).
- Falvo, E., et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin. Nanoscale. 5 (24), 12278-12285 (2013).
- Truffi, M., et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research. 107, 57-65 (2016).
- Cai, Y., et al. Enhanced magnetic resonance imaging and staining of cancer cells using ferrimagnetic H-ferritin nanoparticles with increasing core size. International Journal of Nanomedicine. 10, 2619-2634 (2015).
- Heger, Z., Skalickova, S., Zitka, O., Adam, V., Kizek, R. Apoferritin applications in nanomedicine. Nanomedicine. 9 (14), 2233-2245 (2014).
- Mazzucchelli, S., et al. Nanometronomic treatment of 4T1 breast cancer with nanocaged doxorubicin prevents drug resistance and circumvents cardiotoxicity. Oncotarget. 8 (5), 8383-8396 (2017).
- Yu, Q., et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy. Journal of Controlled Release. 321, 564-575 (2020).
- Mertens, J. C., et al. Therapeutic effects of deleting cancer-associated fibroblasts in cholangiocarcinoma. Cancer Research. 73 (2), 897-907 (2013).
- Kovács, D., et al. Core-shell nanoparticles suppress metastasis and modify the tumour-supportive activity of cancer-associated fibroblasts. Journal of Nanobiotechnology. 18, 18 (2020).
- Sharon, Y., Alon, L., Glanz, S., Servais, C., Erez, N. Isolation of normal and cancer-associated fibroblasts from fresh tissues by Fluorescence Activated Cell Sorting (FACS). Journal of Visualized Experiments. (71), e4425 (2013).
- Sitia, L., et al. Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax. Cells. 10 (2), 328 (2021).
- Bellini, M., et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells. Journal of Controlled Release. 196, 184-196 (2014).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nature Reviews Cancer. 20, 174-186 (2020).
- Dvořánková, B., Lacina, L., Smetana, K. Isolation of normal fibroblasts and their cancer-associated counterparts (CAFs) for biomedical research. Methods in Molecular Biology. 1879, 393-406 (2018).
- Calvo, F., Hooper, S., Sahai, E. Isolation and immortalization of fibroblasts from different tumoral stages. Bio-protocol. 4 (7), 1097 (2014).
- Sha, M., et al. Isolation of cancer-associated fibroblasts and its promotion to the progression of intrahepatic cholangiocarcinoma. Cancer Medicine. 7 (9), 4665-4677 (2018).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Zhen, Z., et al. Protein nanocage mediated fibroblast-activation protein targeted photoimmunotherapy to enhance cytotoxic T cell infiltration and tumor control. Nano Letters. 17 (2), 862-869 (2017).
- Ji, T., et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery. Advances Materials. 27 (11), 1865-1873 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon