Method Article
Hedeflenen Nanopartiküllerin Çalışması için Meme Kanserinin Singeneik Murine Modelinden Primer Kanserle İlişkili Fibroblastların İzolasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makale, üçlü negatif meme kanserinin singeneik bir murine modelinden primer kanser ilişkili fibroblastların izolasyonu ve kültürü ve tümör mikroçevrimini hedeflemek için tasarlanmış yeni nanopartiküllerin preklinik çalışması için uygulanması için bir protokol sağlamayı amaçlamaktadır.
Özet
Kanserle ilişkili fibroblastlar (CAL' ler) tümör mikroçevrim bağlamında önemli aktörlerdir. Tümör hücrelerine göre sayı olarak azalmasına rağmen, CAL'ler tümörün ilerlemesini düzenler ve antitümör bağışıklığından koruma sağlar. Ortaya çıkan antikanser stratejileri, pro-tümörijenik CAL'lerin ablasyonu veya CAL işlevlerinin yeniden programlanması ve aktivasyon durumları yoluyla tümör mikroçevricisini yeniden şekillendirmeyi amaçlamaktadır. Umut verici bir yaklaşım, CAL'leri hedefleyebilen nanosize teslimat ajanlarının geliştirilmesidir, böylece ilaçların ve aktif moleküllerin spesifik olarak teslimine izin verir. Bu bağlamda, BIR hücresel CAF modeli in vitro tarama ve bu tür nanoformülasyonların ön araştırılması için yararlı bir araç sağlayabilir.
Bu çalışma, primer CAL'lerin üç negatif meme kanserinin singeneik 4T1 murine modelinden izolasyonu ve kültürünü açıklar. Manyetik boncuklar, ayrışmış tümörlerden CAL'leri çıkarmak için 2 aşamalı bir ayırma işleminde kullanıldı. Proses verimini doğrulamak için her geçişten sonra akış sitometrisi kullanılarak immünofenotiran kontrol gerçekleştirildi. tümör mikroçevrimi ile başa çıkmak için tasarlanmış farklı nanoformülasyonların hedefleme kapasitesini incelemek için izole CAF'ler kullanılabilir. Floresan etiketli H-ferritin nanokabutlar, yöntemi kurmak için aday nanopartiküller olarak kullanılmıştır. Çıplak veya hedefleme ligand ile eşleştirilmiş nanopartiküller, CAL'lere bağlanması için analiz edildi. Sonuçlar, meme CAL'lerinin ex vivo ekstraksiyonunun, tümörojenik CAL'lerin spesifik hedeflemesi için nanopartikülleri test etmek ve doğrulamak için yararlı bir sistem olabileceğini göstermektedir.
Giriş
Son on yıllarda, tümör mikroçevrasyonu tümörün nüksetmesine neden olabileceğinden ve terapötik direnci tetikleyebileceği için tümör hücrelerini öldürmenin genellikle maligniteyi ortadan kaldırmak için yeterli olmadığı ortaya çıktı1,2. Daha sonra yeni bir paradigma ortaya çıktı: tümörü destekleyici faktörlerden mahrum bırakmak ve böylece kemoterapötiklerin etkinliğini artırmak için tümör stromasını hedeflemek3,4,5. Özellikle, kanserle ilişkili fibroblastlar (CAL'ler) birçok katı tümörde ilginç bir stromal hedeftir6,7. CAL'ler, büyüme faktörleri, sitokinler ve kemokinlerin salgılanması yoluyla kanser hücreleri ve bağışıklık sisteminin hücreleriyle etkileşime giren çok heterojen bir hücre grubudur; hücre dışı matrisi oluşturmak ve yeniden şekillendirmek; ve metastaz oluşumunu etkinleştirin8,9,10,11,12. Tümör tipine bağlı olarak, CAL'ler pro-tümörijenik fonksiyonlar gösterirken, DIĞER CAL alt tipleri tümör baskılayıcı işlevlere sahip gibi görünmektedir13,14. Bu ikiliği daha iyi netleştirmek için, primer ve metastatik tümörlerden GELEN CAL'lerin kapsamlı bir karakterizasyonu önemlidir.
Bu bağlamda, gelişmekte olan bir araştırma alanı, tümör mikroçevrimini yeniden şekillendirebilen aktif moleküller ve ilaçlar sunarak CAL'leri hedeflemek ve/ veya yok etmek için tasarlanmış nanosize ajanların geliştirilmesine odaklanmıştır15,16,17,18. Çeşitli nanopartikül türleri, sitotoksik ilaçlarla CAF ablasyonunu elde etmek, CAF hedefli fotodinamik tedaviyi teşvik etmek veya CAL'leri sessiz bir duruma geri döndürerek veya komşu kanser hücrelerinin apoptozunu tetikleyen TNF ile ilgili apoptoz kaynaklı ligand ekspresyonunu indükle ederek yeniden programlamak için tasarlanmıştır16,19. Ayrıca, birçok nanopartiküllerin belirli biyolojik belirteçleri aktif olarak hedefleme potansiyeli, hedefe caf alt kümelerini seçme umudunu doğurmaktadır. CAF için mutlak özgüllüğü hala sorgulansa da, fibroblast aktivasyon proteini (FAP) pro-tümörijenik stromanın en umut verici hedeflerinden biridir ve nanodrug teslimatını yönlendirmek için sömürülür, böylece CAF hedefli nanoterapötiklerin geliştirilmesi için yol açmaktadır20,21,22.
Bu makale, birincil CAL'lerin singeneik bir murine meme kanseri modelinden izolasyonu açıklanmaktadır ve CAF işaretleyicisi FAP'ı tanımak için tasarlanmış nanopartiküllerin hedefleme yeteneğinin incelenmesinde kullanımlarını raporlamaktadır. Ferritin nanokaveleri yöntemi kurmak için aday nanosistemler olarak kullanılır, çünkü teslimat özellikleri hedefleme moieties23,24'ünyüzeye maruz kalmasıyla şekillenebilir. Ayrıca, ferritinlerin antitümör uygulamalar için mükemmel biyouyumlu mekikler olduğu başarıyla kanıtlanmıştır, bu da yükün tümör kütlesinde hızlı birikmesini tetikler25,26,27. Bugüne kadar, CAF hedefleme nanosistemlerinin preklinik çalışmaları, hücre aktivasyonunu teşvik etmek için büyüme faktörü-beta'yı dönüştürmek ve CAF'lerin bazı immünofenotipik özelliklerinin ifade edilmesi ile kültürde uyarılan fibroblast hücre hatları üzerinde vitro testlere dahil28,29. Bu yöntem genellikle ölümsüzleştirilmiş hücre hatlarına (NIH3T3, LX-2 gibi) uygulanır ve oldukça hızlı ve basittir, birkaç saat veya gün içinde aktif hücreler verir. Bir sınırlama, in vitro stimülasyonun aktif miyofibroblastlara atfedilen bazı genlerin ekspresyonunu teşvik etmesine rağmen, gerçek CAL'lerin tüm biyolojik özelliklerini, özellikle de heterojenliklerini tamamen yeniden yakalayamamasıdır.
Başka bir strateji, birincil CAL'lerin insan veya fare tümörü örneklerinden çıkarılmasını içerir30,31. Bu, CAF aktivasyonunun fizyolojik bir bağlamda gerçekleşmesini ve CAF alt nüfuslarının heterojenliğinin korunmasını sağlar. Araştırma amacına göre, CAL'ler farklı kaynaklardan türetilebilir, böylece en güvenilir koşulu inceleme imkanı sunar. Burada bildirilen protokol, bir murine meme kanseri modelinden CAL'leri hedeflemek için tasarlanmış yeni nanopartiküllerin işlevselliğinin ön değerlendirmesini yapmak isteyen bilim adamları için değerli olacaktır. İzole CAL'ler, kanserin hayvan modellerinde in vivo değerlendirmeye devam etmek için yeterince umut verici nanopartiküllerin taranmasını sağlamak için yararlı olacaktır. Bu, nanopartikül üretiminin ilk adımları sırasında, nanoteknologları nanopartikül tasarımının iyileştirilmesine yönlendirerek, esas olarak optimum hedefleme özellikleri elde etmek için ligand hareketsizleştirme stratejisini göz önünde bulundurarak ilgili olacaktır.
Protokol
1. Meme kanserinin singeneik 4T1 modelinin oluşturulması
NOT: Mevcut protokol, birincil CAL'lerin fare 4T1 meme tümöründen izolasyonu açıklanmaktadır. Burada açıklanan hayvan çalışması İtalya Sağlık Bakanlığı (aut. sayı 110/2018-PR) tarafından onaylanmıştır.
- Tümör hücre kültürü ve implantasyonu
- Roswell Park Memorial Institute (RPMI) 1640 mL'lik 1640 mL'lik bir T75 şişesinde %10 fetal sığır serumu (FBS), %1 penisilin/streptomisin (P/S) ve %1 L-glutamin ile desteklenmiş 1 × 106 4T1-luc hücrelerini çözün. Kültür ortamına Mycoplasma kaldırma aracısı (1:100) ekleyin.
NOT: 4T1-luc hücreleri luciferaz eksprese ve D-luciferin ile uygun stimülasyon üzerine biyolüminesans (BLI) ile görselleştirilebilir. Bu, farelerde implantasyon üzerine tümör hücrelerinin canlılığının ve çoğalmasının in vivo izlenmesini sağlar(Şekil 1). - Ortamı her 2 günde bir değiştirerek hücreleri 37 °C ve%5 CO 2'de nemli bir atmosferde ~%80 izdihama kadar koruyun.
NOT: Enjekte edilen hücrelerin mikoplazmadan arındırılmasını sağlamak için farelere enjeksiyondan önce 1 hafta boyunca (~2/3 pasajlar) Mycoplasma kaldırma maddesi ile tedaviye devam edin. - İşlem gününde, hücreleri 37 °C'de 5 dakika boyunca 1 mL tripsin-etylenediaminetetraasetik asit (EDTA) çözeltisi (tripin 1:250) kullanarak ayırın. Kültür ortamı ekleyerek tripsin etkinliğini durdurun, trippan mavisi olan hücreleri sayın (1:1) ve hücre/mL sayısını hesaplayın.
- Pipet hacmi 1 × 106 hücreye ve santrifüj 5 dakika boyunca 400 × g. Süpernatantı dökün ve peletin 1 mL RPMI 1640 baz ortasına yeniden harcayın. Enjeksiyona hazır olana kadar hücreleri buzda tutun.
NOT: Her fare için 1 × 105 hücre gereklidir; bununla birlikte, şırınna yüklemesini kolaylaştırmak için her zaman 2 farenin (2 ×10 5 hücreye karşılık gelen) fazlalığını hesaplayın. - Ameliyattan bir gün önce, sağ taraftaki karın meme bezlerinin alanını ortaya çıkarmak için 8 BALB / c faresinin (dişi, yedi haftalık) kürklerini tıraş edin. Elektrikli bir tıraş makinesi kullanın ve 4 dakika boyunca ince bir depilasyon kremi tabakası uygulayın; ardından kremayı su ve bir parça kağıtla yıkayın.
- ~5 dakika boyunca % 2 izofluran gazının sürekli solunmasıyla anesteziye neden olun ve 27 G tüberkülin şırıng ile abdominal meme bezlerinin bölgesinde deri altı enjeksiyonu gerçekleştirin. Deri içine deri altından girmek için iğneyi yukarı doğru çevirin; ardından, cildi yukarı doğru tutun ve yavaşça 100 μL hücre süspansiyonu (1 × 105 hücre) enjekte edin. Şırıngayı yavaşça geri çekmeden önce iğneyi hafifçe çevirin.
NOT: Hücre süspansiyonu enjeksiyondan 15 dakika önce oda sıcaklığına getirmeyi unutmayın.
- Roswell Park Memorial Institute (RPMI) 1640 mL'lik 1640 mL'lik bir T75 şişesinde %10 fetal sığır serumu (FBS), %1 penisilin/streptomisin (P/S) ve %1 L-glutamin ile desteklenmiş 1 × 106 4T1-luc hücrelerini çözün. Kültür ortamına Mycoplasma kaldırma aracısı (1:100) ekleyin.
- Tümör büyümesi ve diseksiyonu
- Hücre enjeksiyonundan 5 gün sonra, görüntülemeden 5 dakika önce intraperitoneally (100 μL) 150 mg/kg D-luciferin enjekte edin. 10 s pozlama, orta binning ve 4'te f/stop ayarını kullanarak BLI görüntülerini yakalayın. Tümörün parlaklık alanını ilgi alanı (ROI) olarak tanımlayın ve görüntüleme yazılımını kullanarak yatırım getirislerindeki toplam sinyali (foton/sn/m2)ölçün.
- BLI'deki artış açısından tümör büyümesini izlemek için enjeksiyondan itibaren her 5 günde bir görüntüleme prosedürünü (1.2.1) tekrarlayın.
- Tümör hacmini oluşturmak için fareyi tutun ve karnını açığa çıkarın. Tümör uzunluğunu (L) ve genişliğini (W) haftada bir kez ölçmek için kaliper kullanın. Denklem 1 kullanarak tümör hacmini (V) hesaplayın.
[V = (L x W2)/2] (1) - Hücre enjeksiyonundan 20 gün sonra, hayvanları servikal çıkık ile kurban edin, tümörleri deriden makasla çözün ve bir doku depolama çözeltisinde toplayın (Bkz. Malzeme Tablosu).
NOT: Tümör örnekleri tek hücreye (bölüm 2) ayrışmak için hemen kullanılabilir veya 48 saate kadar 4 °C'de saklanabilir.
2. Tümörlerin tek hücrelere ayrışması
NOT: Aşağıdaki adımlar için laminer akış davlumbazında steril reaktifler ve tek kullanımlıklar kullanın. Aynı anda 4 tümörle çalışın.
- Tümör örneğini bir Petri kabına yerleştirin ve cımbız ve neşter yardımıyla cilt, yağ ve nekrotik alanların herhangi bir parçasını dikkatlice çıkarın. Daha sonra, tümörü yaklaşık 1-2 mm'lik küçük parçalara bölün ve bir tüpe aktarın (Şekil 2A).
NOT: 4T1 tümörleri büyürken ülserasyon eğilimi ile yüksek oranda nekrotik hale gelir. Sonraki adımlarla enkazın herhangi bir müdahalesini önlemek için nekrotik alanları dikkatlice çıkarmak önemlidir. - Tümör ayrışması için bir sindirim karışımı hazırlayın: 2.35 mL RPMI 1640 orta, 100 μL enzim D, 50 μL enzim R ve 12.5 μL enzim A karıştırın.
NOT: Belirtilen sindirim karışımı hacimleri 1 g'a kadar olan tümörler için geçerlidir ve ağırlıklarına göre daha büyük tümörler için ayarlanabilir. Normalde 20 gün boyunca yetişen 4T1 tümörler 0.5–0.8 g aralığındadır. - Tüpü ters çevirin, tüm tümör parçalarının tüpün altında kapağa doğru durduğunu kontrol edin. Tüpü uygun gövdedeki mekanik bir ayrışmaya takın ve sert tümörler için tasarlanmış belirli bir ayrışma programı çalıştırın (üreticinin talimatlarına bakın).
NOT: Dissosiyatöre sığacak özel tüpler gerekebilir. C tüpleri, dokunun mekanik ayrışmasını teşvik etmek için kapağın içinde bir rotor taşır. - Tüpü ayırın, baş aşağı saklayın ve numuneyi 37 °C'de hafifçe sallayarak 40 dakika kuluçkaya yatırın. Ardından, tüpü uygun gövdedeki ayrıştırıcıya takın ve sert tümörler için tasarlanmış aşağıdaki spesifik ayrışma programını iki kez çalıştırın. İşlemin sonunda büyük doku parçaları olmadığından emin olun(Şekil 2B).
NOT: Tümörü ayrıştırmak için hücre dışı matrisi bozmak için başka enzim kokteylleri kullanılabilir. Bununla birlikte, bu protokolde, optimize edilmiş bir enzim karışımı (D, R, A enzimleri) içeren ticari olarak mevcut bir Tümör Ayrıştırma kiti ve dokuyu mekanik olarak ayrıştıran yarı otomatik bir ayrıştırıcı kullanılmıştır. Bu kombinasyon, hücre bütünlüğü ve hücre yüzeyi epitoplarının bakımı ile birlikte hücre dışı matrisin uygun bir şekilde bozulmasını sağladı. - Numuneyi 50 mL'lik bir tüpte 40 μm hücre süzgeçten geçirin, filtreyi 10 mL RPMI 1640 orta ile yıkayın ve tüpü 300 × g'da 7 dakika santrifüjleyin. Hücre peletı kırmızı görünürse, oda sıcaklığında 5 dakika boyunca 1 mL Amonyum-Klorür-Potasyum (ACK) liz tamponu ekleyerek eritrositleri, 10 mL RPMI 1640 ile yıkayın, hücre süspansiyonunu 15 mL'lik bir tüpe aktarın ve tekrar santrifüjün.
- Peleti fosfat tamponlu salin (PBS), %0,5 sığır serum albümin (BSA) ve 2 mM EDTA'dan oluşan 1 mL PBE tamponunda yeniden biriktirin ve trippan mavisi olan hücreleri sayın (1:1). Hücre kümeleri durumunda, hücre süspansiyonunu daha önce PBS ile ıslatılmış 70 μm hücre süzgecinden filtreleyin.
NOT: Özellikle tümörler büyük olduğunda, hücre sayısını kontrol etmek ve sonunda2.7. - 20x bağlayıcı tampon stok çözeltisini (Bkz. Malzeme Tablosu)steril çift damıtılmış su ile seyrelterek ölü hücre kaldırma bağlama tamponunu hazırlayın. Hücreleri 5 mL 1× bağlayıcı tamponlayıkayın ( Şekil 2C).
NOT: Tamponu 4 °C'de tutun. - 300 × g'da 7 dakika santrifüj ve hücre peletini 0,1 mL ölü hücre temizleme mikropları ile yeniden ıslatın (Bkz. Malzeme Tablosu). İyice karıştırın ve oda sıcaklığında 15 dakika kuluçkaya yatırarak.
- Boncuklarla inkübasyon sırasında, kaputun altına manyetik bir stand hazırlayın ve üzerine uçları aşağıyı işaret ederek ferromanyetik ayırma sütunlarını(10 7 hücreye kadar bir sütun) asın. Sütunları 0,5 mL soğuk 1× bağlama arabelleği ile aşındırın. Çözelti yerçekimi altında akana kadar bekleyin.
NOT: Kolon yatağının pıhtılaşması ve geri kazanım veriminin azaltılması riskini önlemek için sütun başına hücre sayısını aşmamak önemlidir. 107'den fazla hücreyle çalışırken, toplam hücre sayısına göre daha fazla sütun kullanın veya daha büyük sütunlar kullanın. Bu gibi durumlarda, aşağıdaki adımlarda açıklanan reaktif hacimlerini üretici tarafından belirtilenlere ayarlayın. - Kuluçkanın sonunda, boncuk / hücre süspansiyonuna 400 μL soğuk 1× bağlayıcı tampon ekleyin, tüm hacmi sütuna yükleyin ve atık suyu (etiketlenmemiş hücrelere karşılık gelen) 15 mL'lik bir tüpte toplayın.
- Sütunu 0,5 mL soğuk 1× bağlama tamponu ile dört kez yıkayın ve toplam atık suyu (canlı hücre fraksiyonuna karşılık gelen) aynı tüpte toplayın.
- Trypan mavisi olan hücreleri sayın (1:1). Floresan Aktif Hücre Sıralama (FACS) için 1 ×10 5 hücreyi iki tüpe yerleştirin ve proses doğrulamasına kadar 4 °C'de tutun (bkz. adım 4.1): analiz parametrelerini ve pozitiflik bölgelerini (kontrol tüpü) ayarlamak için ilk tüpü ve diğeri biyobelirteç analizi (numune tüpü) için kullanın. CAL ayıklama için kalan hücreleri kullanın (bkz. bölüm 3).
NOT: Bölüm 3'teki mikrobeadlarla spesifik olmayan reaksiyonları azaltmak için ölü hücrelerin çıkarılması önemlidir. Bununla birlikte, verimi artırmak için, ölü hücrelerin oranı% <20 ise ölü hücrelerin çıkarılmasından kaçının.
3. Birincil CAL'lerin meme tümöründen çıkarılması
NOT: Bölüm 3 için, hücrelerin manyetik etiketlemesi için uygun Tümörle İlişkili Olmayan Fibroblast Tükenme Kokteyli ve Tümörle İlişkili Fibroblast Mikrobeadları içeren Tümörle İlişkili Fibroblast İzolasyon kitini kullanın (Bkz. Malzeme Tablosu).
- Kanserle ilişkili olmayan fibroblastların tükenmesi
- PBS ile 70 μm hücre süzgecini nemlendirin ve kümeleri çıkarmak için hücre süspansiyonunu filtreleyin. Daha sonra, hücreleri 300 g'da 10 dakika × ve süpernatantı aspire edin.
NOT: Tek bir tümör adım 2.7 için iki örneğe ayrılmışsa, 3.1.2 adımına geçmeden önce hücre süspansiyonu ikiye iki havuz. - Peleti 80 μL soğuk PBE tamponunda yeniden depoleyin ve 20 μL Tümörle İlişkili Olmayan Fibroblast Tükenme Kokteyli ekleyin. İyice karıştırın ve karanlıkta 15 dakika boyunca 4 °C'de kuluçkaya yatırın.
- Boncuklarla inkübasyon sırasında, manyetik bir stand üzerinde ferromanyetik tükenme sütunları (örnek başına 1) hazırlayın ve sütunları 2 mL soğuk PBE tamponu ile dengeler. Çözüm akana kadar bekleyin.
- Kuluçkanın sonunda, boncuk / hücre süspansiyonuna 400 μL soğuk PBE tamponu ekleyin, tüm hacmi sütuna yükleyin ve atık suyu (etiketlenmemiş hücrelere karşılık gelen) 15 mL'lik bir tüpte toplayın.
- Sütunu 2 mL soğuk PBE tamponu ile iki kez yıkayın ve toplam atık suyu aynı tüpte toplayın. 300 × g'da 10 dakika santrifüj ve 0,1 mL soğuk PBE tamponunda yeniden depola.
NOT: Kanserle ilişkili olmayan fibroblastların tükenmesi, kurtarılan toplam hücre miktarını büyük ölçüde azaltır. Genellikle gereklidir ve görünür bir pelet ve adım 3.2 için yeterli hücre elde etmek için dört farklı örnekten hücre süspansiyonlarının havuza alınması önerilir. Bu, optimum verim sağlayacaktır. - Hücre süspansiyonunun 20 μL'sini bir FACS tüpüne yerleştirin ve işlem doğrulaması için 4 °C'de tutun (bkz. bölüm 4). CAF seçimi için kalan hücreleri kullanın (bkz. adım 3.2).
- PBS ile 70 μm hücre süzgecini nemlendirin ve kümeleri çıkarmak için hücre süspansiyonunu filtreleyin. Daha sonra, hücreleri 300 g'da 10 dakika × ve süpernatantı aspire edin.
- Kanserle ilişkili fibroblastların pozitif seçimi
- 80 μL hücre süspansiyonu için 20 μL Tümörle İlişkili Fibroblast Mikrobürüs ekleyin. İyice karıştırın ve karanlıkta 15 dakika boyunca 4 °C'de kuluçkaya yatırın.
- Boncuklarla inkübasyon sırasında, manyetik bir stand üzerinde ferromanyetik ayırma sütunları (örnek başına 1) hazırlayın ve sütunları 0,5 mL soğuk PBE tamponu ile dengeler. Çözüm akana kadar bekleyin.
- Kuluçkanın sonunda, boncuk / hücre süspansiyonuna 400 μL soğuk PBE tamponu ekleyin, tüm hacmi sütuna yükleyin ve etiketlenmemiş hücrelerin 15 mL'lik bir tüpe akmasını bekleyin.
- Sütunu 0,5 mL soğuk PBE tamponu ile üç kez yıkayın ve toplam atık suyu aynı tüpte toplayın.
NOT: Akış, kanserle ilişkili olmayan fibroblastlar olarak atılabilen etiketsiz CD90.2 negatif hücreler içerir. - Kolonu mıknatıstan çıkarın ve 1,5 mL'lik bir tüpe yerleştirin. Sütuna 1 mL soğuk PBE ekleyin ve hücreleri boşaltmak için pistonu hemen sütuna itin.
- 400 × g'da 10 dakika santrifüj ve 0,1 mL soğuk PBE tamponunda yeniden depola. 20 μL hücre süspansiyonu bir FACS tüpüne yerleştirin ve proses doğrulaması için 4 °C'de tutun (bkz. bölüm 4).
NOT: Santrifüjlemeden sonra, özellikle orijinal tümörler küçük olduğunda pelet neredeyse hiç görünmeyebilir. Konik alt santrifüj tüpleri kullanın ve süpernatantı adederek herhangi bir hücre kaybetmemeye dikkat edin. - Kalan hücreleri% 15 FBS, 2 mM L-glutamin, % 1 P / S ve% 1 esansiyel olmayan amino asitlerle desteklenmiş Uygun bir Hacimde Dulbecco'nun Modifiye Kartal Ortası (DMEM)/Ham'ın F-12'sinde seyreltin ve hücreleri bir doku kültürü plakasına tohumladı.
- Mikroskop altında hücre yoğunluğunu kontrol edin ve hücrelerin yapışmasını ve büyümesini sağlamak için plakayı 37 °C ve% 5 CO2'de bir inkübatöre yerleştirin.
NOT: Hücreler çok yoğunsa, plakayı inkübatöre yerleştirmeden önce hücre süspansiyonu derhal doku kültürü plakasının iki kuyusuna bölün.
4. Süreç doğrulaması
- Akış sitometrisi
NOT: Bölüm 4.1 steril koşullar gerektirmez ve laminar davlumbazın dışında yapılabilir. Bölüm 4.1'i 2.11 (ayrışmış tümör), adım 3.1.6 (kanserle ilişkili olmayan fibroblastların tükenmesi sonrasında) ve 3.2.6 adımında (kanserle ilişkili fibroblastların zenginleştirilmesinden sonra) toplanan örneklere paralel olarak gerçekleştirin.- 2.11, 3.1.6 ve 3.2.6 adımlarında hazırlanan FACS tüplerini 300 × g'da 10 dakika boyunca santrifüj edin. Üstnatant atın.
NOT: Analiz parametrelerini ayarlamak için bir kontrol görevi gören, lekesiz hücreler içeren en az bir ek tüp hazırlayın. - Numune tüplerinde, 88 μL PBE'de hücreleri yeniden kullanın, ve floresan izotiyosiyanat ile konjuge 2 μL anti-CD45 antikoru (FITC, üreticinin talimatlarına göre 1:50 seyreltme) ve fitoerythrin ile konjuge 10 μL anti-CD90.2 antikor ekleyin (PE, 1:10 seyreltme, üreticinin talimatlarına göre). İyice karıştırın ve karanlıkta 4 °C'de 10 dakika kuluçkaya yatırın. Kontrol tüpünde (kullanılmamış), 100 μL PBE'de hücreleri yeniden biriktirin. Antikor lekeli hücreler için izlenen prosedürü çoğaltmak için karanlıkta 4 °C'de 10 dakika kuluçkaya yatırın.
NOT: Bu tür değişkenlerdeki bir değişiklik zayıf veya spesifik olmayan lekelenmeye neden olabileceğinden, sıcaklık ve kuluçka süresi dikkatlice kontrol edilmelidir, böylece sonuçlar değiştirilebilir. - Kuluçka adımını tamamladıktan sonra, 1 mL PBE ekleyerek bir yıkama gerçekleştirin. 300 x g'da 10 dakika santrifüj. Üstnatant atın.
- Hücreleri (tüm tüpleri) 500 μL PBS'de yeniden biriktirin.
- İyice karıştırın ve akış sitometrisi analizine devam edin. Antikorların floresanını (fitc ve PE) ölçmek için kanalları ayarlayın.
- Kontrol tüpünden, İleri ve Yan dağılım (FSC vs SSC) çiziminde bir ilk kapı (P1) çizerek tüm uygulanabilir hücreleri seçin. P1 içinde, yalnızca tek hücreli ikinci bir kapı (P2) ayarlayın.
- Antikorların spesifik floresan kanallarını (fitc ve PE) kullanarak, pozitif lekeli hücreleri ayırt etmek için uygun kapıları ayarlayın.
- Analizi başlatın ve P2'de en az 10.000 olay kaydedin. Her iki kanaldan gelen sinyalleri aynı anda okuyun.
NOT: Genel hücre sayısı beklenenden azsa, tüpün tamamını okumak tercih edilebilir. - (İsteğE BAĞLI) Ek antikorlar/floroforlarla daha fazla boyama programlanırsa, analizi başlatmadan önce uygun bir kompanzasyon matrisi ayarlayın.
- 2.11, 3.1.6 ve 3.2.6 adımlarında hazırlanan FACS tüplerini 300 × g'da 10 dakika boyunca santrifüj edin. Üstnatant atın.
- Hücre morfolojisinin ve özelliklerinin izlenmesi
NOT: Tohumlandıktan sonra, hücreler steril koşullar altında ele alınmalıdır.- Tohumlamadan sonraki gün, hücre yapışıklık ve morfolojisini kontrol etmek için hücreleri optik mikroskop altında görselleştirin. Süpernatantı aspire edin ve taze ortamla değiştirin.
NOT: CAL'ler, 4T1 tümör hücrelerinin epitel benzeri yapısından kolayca ayırt edilebilen büyük iğ şeklindeki hücrelerdir. - Hücreleri nemli bir atmosferde 37 °C ve%5 CO2'de tutarak ortamı her 2 günde bir değiştirebilirsiniz.
- Hücreler ~%80 izdihama ulaştığında (tohumlamadan yaklaşık 4-6 gün sonra), hücreleri oda sıcaklığında 5 dakika boyunca TrypLE Select çözeltisini (Malzeme Tablosunabakın) kullanarak ayırın. Taze orta (4:1) ekleyin, hücre süspansiyonu 400 × g'da 5 dakika santrifüjleyin ve peletin taze ortamda yeniden ıslatın.
- Hücreleri 1:2 bölün ve deneme için gereken hücre sayısı elde edilene kadar kültürü genişletin.
- Her pasajda, hücre morfolojisi ve büyümesini optik mikroskop altında kontrol edin. Hücre morfolojisi homojen değilse (örneğin, kültürde görünen küçük yuvarlak şekilli hücrelerin klonları), bölüm 4.1'de açıklandığı gibi akış sitometrisine göre bir hücre örneğini analiz edin. Homojense, adım 4.2.7'ye geçin.
NOT: Hücre morfolojislerindeki değişiklikler, kültür saflığını sağlamak için çıkarılması gereken kanserle ilişkili olmayan fibroblastların kontaminasyona işaret edebilir. - Akış sitometrisi sonuçlarını analiz edin ve aşağıdaki senaryolardan birine göre devam edin: (i) CD90.2-/CD45- hücrelerinin kirlenmesi meydana gelirse, tüm hücreleri toplayın ve 3.2 adımını izleyerek pozitif seçimi tekrarlayın; (ii) CD45+ hücrelerinin kirlenmesi de meydana gelirse, tüm hücreleri toplayın ve 3.1. (iii) herhangi bir kirlenme meydana gelmezse (sadece CD90.2+/CD45- hücreler mevcutsa), hücreleri kültürde tutun ve doğrudan 4.2.7'ye ilerleyin.
NOT: Tükenme işleminin mikrobeadlarla tekrarlanması hücre iyileşmesini azaltacağından, yalnızca hücrelerin hemen kullanılması gerekmediğinde önerilir. - Trippan mavisi (1:1) ile hücreleri sayın, iki FACS tüpüne 5 ×10 5 hücre yerleştirin ve 300 × g'da 10 dakika santrifüj. Üstnatantı atın ve peleti oda sıcaklığında 15 dakika boyunca 0,5 mL blokaj tamponunda (%2 BSA, %2 keçi serumu ile desteklenmiş PBS) yeniden depolayın.
NOT: Bir tüp sadece yersiz hücrelerden oluşan bir kontrol görevi görürken, ikinci tüpteki hücreler akış sitometri analizi için lekelenir. - 300 × g'da 10 dakika santrifüj, süpernatantı atın ve 99 μL bloklama tamponunda yeniden dirildi. Numune tüpüne 1 μg anti-FAP antikoru ve kontrol tüpüne 1 mL blokaj tamponu ekleyin. İyice karıştırın ve oda sıcaklığında 15 dakika kuluçkaya yatırarak.
NOT: FAP reaktif tümör stromasının bir yüzey belirtecidir ve CAL'leri tanımlamak ve karakterize etmek için kullanılabilir. - Pbs, santrifüj ile üç kez yıkayın ve oda sıcaklığında 15 dakika boyunca bloke tamponunda floresan boya (1 μg) ile konjuge edilen uygun ikincil antikorla kuluçkaya yatırın.
- PBS ile üç kez yıkayın ve akış sitometrisine göre analiz edin (kullanılan floroforu tespit etmek için uygun kanalı ayarlayarak 4.1.5 ila 4.1.7 adımlarını izleyin). Ardından, deneyler için hücreleri kullanın (adım 5.2).
- (İsteğE BAĞLI) Bir hücre örneğini 1 mL%90 FBS ve %10 dimetil sülfit (DMSO) içinde dondurun; daha fazla kullanım için -80 °C'de saklayın.
- Tohumlamadan sonraki gün, hücre yapışıklık ve morfolojisini kontrol etmek için hücreleri optik mikroskop altında görselleştirin. Süpernatantı aspire edin ve taze ortamla değiştirin.
5. Mühendislik Ferritin nanopartikülleri tarafından hedeflenen CAL'ler
NOT: İnsan ferritin ağır zincirinin (HFn) rekombinant bir varyantı çıplak nanopartikül olarak kullanıldı veya hedefleme moieties ile eşleştirilmiştir. Burada, bir anti-FAP antikorunun değişken kısmıyla işlevsel hale getirilen HFn nanopartikülleri (Fab@FAP), Milano-Bicocca Üniversitesi'ndeki NanoBioLab tarafından daha önce açıklanan bir protokole göre 1:1 ve 1:5 olmak üzere iki HFn:Fab@FAP molar oranındahazırlandı.
- HFn nanopartiküllerinin floresan etiketlemesi
NOT: Hem çıplak hem de işlevselleştirilmiş HFn nanokaçamları floresan olarak FITC ile etiketlenmiştir.- FITC tozunun % 99 etanol içinde çözülerek 2 mg/mL konsantrasyon elde edin.
NOT: Bu çözüm taze olarak hazırlanmalıdır. - Her 1 mg protein için hazırlanan çözeltinin 50 μL'sini (200 μg FITC) kuluçkaya yatırın (yani, 10 mg/mL'de 100 μL HFn). 50 μL 1 M sodyum bikarbonat (NaHCO3)ekleyin ve 0,1 M NaHCO 3 ile hacmi 500 μL'yeayarlayın.
NOT: Hacimleri deneysel ihtiyaçlara göre ölçeklendirin. - Reaksiyon karışımını oda sıcaklığında, karanlıkta ve 1 saat boyunca sürekli karıştırarak kuluçkaya yatırın.
- Bir spin tuzdan arındırma sütunu (7 kDa MWCO) kullanarak jel filtrasyonu ile FITC'nin fazlalığını konjugeden çıkarın.
- Bir spektrofotometre kullanarak geri kazanılan etiketli proteinin konsantrasyonunu değerlendirin. Absorbansı sırasıyla 280 nm ve 488 nm olarak ölçerek protein ve boya miktarlarını tahmin edin.
- FITC tozunun % 99 etanol içinde çözülerek 2 mg/mL konsantrasyon elde edin.
- HFn nanopartiküllerinin CAL'lere bağlanması
NOT: Kültürde en geç 4-5 numaralı pasajlardan CAL'ler kullanın.- Her FACS tüpüne 5 ×10 5 hücre yerleştirin, 300 × g'da 10 dakika santrifüj, ve 0.5 mL PBS'de resuspend, 0.3% BSA nanopartiküllerin farklı preparatlarının 0.1 mg / mL ile desteklenmiştir (çıplak HFn, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) daha önce FITC ile etiketlenmiştir.
NOT: Her koşulu üç taraflı olarak çalıştırın. Nanopartiküllerin eklenmediği bir kontrol etiketsiz numunesi olarak ek bir tüp hazırlayın. - Karanlıkta 4 °C'de 2 saat kuluçkaya yaslanın, santrifüjlayın ve PBS'de üç kez yıkayın.
- Hücreleri 0,5 mL PBS ile yeniden biriktirin, iyice karıştırın ve akış sitometrisine göre analiz edin. FITC'nin floresanını ölçmek için kanalları ayarlayın.
- Canlı tek hücreye geçtikten sonra 20.000 etkinlik elde edin. FITC pozitiflik kapısını ayarlamak ve FITC+ olaylarının yüzdesini elde etmek için (nanopartikül bağlamaya karşılık gelen) kontrol etiketsiz tüpü kullanın.
- Her FACS tüpüne 5 ×10 5 hücre yerleştirin, 300 × g'da 10 dakika santrifüj, ve 0.5 mL PBS'de resuspend, 0.3% BSA nanopartiküllerin farklı preparatlarının 0.1 mg / mL ile desteklenmiştir (çıplak HFn, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5) daha önce FITC ile etiketlenmiştir.
6. İstatistiksel analiz ve deneysel çoğaltmalar
- Hayvan
- 1.1.5'te açıklandığı gibi, tek bir deney başına 8 hayvan kullanarak tümör büyümesi ve CAL izolasyonu için üç bağımsız deney gerçekleştirin. CAL'lerin yalıtım verimini en iyi duruma getirmek için, ekscislenmiş dokuları alt gruplara (n=4) bölün ve bölüm 2'de açıklanan adımları izleyerek bunları işleyin.
- Hücrelerle HFn etkileşimi
- fonksiyonelleştirilmiş ve işlevselleştirilmemiş HFn'nin hedef ve hedef olmayan hücrelerle (sırasıyla CAL'ler ve 4T1) etkileşimini floresan etiketli nanokageler tarafından pozitif lekeli hücrelerin yüzdesi açısından değerlendirin. Sonuçları üç bağımsız deneyin ortalama ± standart sapması olarak bildirin.
- İstatistiksel analiz
- HFn ve HFn-FAP ile hücre bağlama deneylerinde istatistiksel önemi hesaplamak için sıradan tek yönlü ANOVA testini kullanın.
Sonuçlar
En iyi CAL yalıtımı için in vivo model kurulumu
Dişi BALB/c farelerinin meme yağ yastığına 10 adet5 adet 4T1-luc hücresinin enjekte edilmesi implantasyondan 5 gün sonra saplanabilen bir tümör kitlesinin büyümesine yol açar. Tümör hacmi kaliperlere göre, tümör hücre canlılığı ise BLI ile ölçülerek implantasyon sonrası bir ay boyunca tümör büyümesi izlendi. CAL izolasyonu için yeterli bir kurban penceresi bulmak için, bir yandan daha yüksek tümör büyüklüğü ve BLI ile diğer yandan ortaya çıkan tümör ülserasyon ve nekroz arasında optimal bir uzlaşma arandı (Şekil 1). Nekrotik bir çekirdek implantasyondan 20 gün sonra ortaya çıktığı ve 25 ve 30 günde genişlediği için (Şekil 1C'dekiBLI görüntülerinde belge edildiği gibi), 20. gün izolasyon işleminden sonra hücre iyileşmesini optimize etmek için zaman noktası olarak ayarlanmıştır. Tümör elleçleme ex vivo'nunilk adımları sırasında tüm görünür nekrotik alanları dikkatlice çıkardıktan sonra bile, tek hücrelere ayrışma sonunda yüksek oranda ölü hücre bulundu(Tablo 1). Bu yüzde alakalı olabileceğinden, özellikle tümör boyutunun artmasıyla, 4T1 modeli ile çalışırken ölü hücre çıkarılması her zaman gereklidir.
CAL'lerin yalıtım prosedürünün, kültürünün ve karakterizasyonunun optimizasyonu
CAF popülasyonu (CD90.2+ CD45-) toplanabilir hücrelerin panelinden izole etmek için iki pasaj daha gereklidir: tümörle ilişkili olmayan fibroblastların tükenmesi ve tümörle ilişkili fibroblastların zenginleştirilmesi (Şekil 2). Tükenme boncuk kokteyli CD45+ hücrelerini verimli bir şekilde kaldırır (sırasıyla, tablo 2 öncesi ve sonrası toplam hücrelerin% 67.35'ini ve% 0.69'unu oluşturur) ve her zaman her sütunda tek bir tümörü işlemek için kullanılmıştır. Tablo 1'degösterildiği gibi, geçen hücrelerin sayısı tükenme adımından sonra ortalama 3 × 106'dan 1'e ×10 5'e düştü. Toplam hücre sayısındaki bu büyük azalma nedeniyle, toplanan hücreleri zenginleştirme adımına geçmeden önce tek bir tüpte en az 2 ila en fazla 4 tümör arasında bir araya getirmek uygundur. Bunu yaparak tümörle ilişkili fibroblast boncukları ile inkübasyon için yeterli sayıda hücre elde edildi ve CD90.2+ CD45- hücrelerin son ortalamasını elde etmek için tek bir ayırma kolonundan geçirildi (Tablo 2).
Doku kültürü plakalarına tohumlandıktan sonra, bu geri kazanılan hücreler plastiğe bağlı ve fibroblastların tipik büyük bir iğ şeklinde morfolojisini ortaya çıkardı (Şekil 3A, B) ve 4T1 tümör hücrelerinden farklı ( Şekil3D). Tükenmeden sonra tümörlerin bir araya alınmaması, tümörle ilişkili fibroblast mikrobeadlarla hücresel verimin bir kültür oluşturamayacak kadar düşük olmasına neden olur. Diğer durumlarda, mikrobeadlarla inkübasyonların süresi ve sıcaklığı dikkatlice korunmadığında, spesifik olmayan bazı bağlamalar meydana gelebilir. Bu gibi durumlarda, zenginleştirme adımları CD90.2- CD45+ ve CD90.2- CD45 ' in daha az verimli ve daha yüksek yüzdeleriydi- CD90.2+ CAL'ler (sırasıyla 5.97 ± 1.5 ve 16.75 ± 1.1) ile birlikte hücreler kurtarıldı (Şekil 4 ve Tablo 3). Bu kirletici hücrelerin, CAL'lerden daha hızlı büyüyen ve birincil CAF kültürüne üstün gelen farklı morfolojiye(Şekil 4B, siyah ok uçları) sahip küçük klonların kültüründeki varlığından sorumlu olması muhtemeldir (Şekil 4C). Bu yetersiz sonuçlar, hem CD90.2 hem de CD45 ekspresyonunun yanı sıra zenginleştirme sürecinin sonunda ve kültürde hücre büyümesi sırasında hücre morfolojisini her zaman çift kontrol ederek önemini doğruladı.
Mühendislik nanodruglarının CAF hedefleme potansiyelini değerlendirmek için izole hücrelerin kullanımı
Yeni izole edilmiş CAL'ler, temel araştırmalardan farmakolojik çalışmalara kadar çeşitli uygulamalar için kullanılabilir. Bu grubun amacı, özellikle CAL'leri hedef alabilen HFn nanokaveleri geliştirmektir. HFn, iki farklı proteinde (daha düşük 1:1 ve daha yüksek 1:5) spesifik bir anti-FAP antikor parçası (HFn-FAP) ile işlevselleştirildi ve CAL'lerle bağlanmaları test edildi. FAP, pro-tümörojenik CAL'lerin yüzey biyobelirteci olarak kullanıldığından, izole EDILMIŞ CAL'lerde FAP ekspresyonunun kontrol etmek temel öneme sahiptir (Şekil 3C). FAP ifadesi, birincil CAF kültürünün orijinal özelliklerini koruduğunu doğrulamak için kültürde 5 pasajdan fazla izlendi.
HFn'deki FAP fonksiyonelizasyonunun, çıplak HFn ile karşılaştırıldığında CAF hedeflemesine önemli bir kaymaya katkıda bulunduğu bulunmuştur ve daha düşük antikor miktarı (1:1) bu etkiyi gözlemlemek için yeterli bulunmuştur (Şekil 5A). Bununla birlikte, bu, in vivo tümör modelini kurmak için kullanılan tümör 4T1 hücreleri ile gözlenmedi, burada çıplak HFn fonksiyonelleştirilmiş HFn'den daha yüksek bağlama gösterdi (Şekil 5B). Bu büyük olasılıkla 4T1 hücrelerinde FAP aşırı ifadesinin olmaması ve HFn'nin hücrelerde HFn alımını düzenleyen TfR1 ile tercihli etkileşimi nedeniyle, bu grup tarafından yaygın olarak bildirildiği gibi27,33. Bu sonuçlar, tümör mikroçevrimi ile başa çıkmak için tasarlanmış nanopartiküllerin hedefleme yeteneğini önceden taramak için meme CAL'lerinin birincil kültürlerini kullanmanın yararlılığını doğrulamamaktadır.
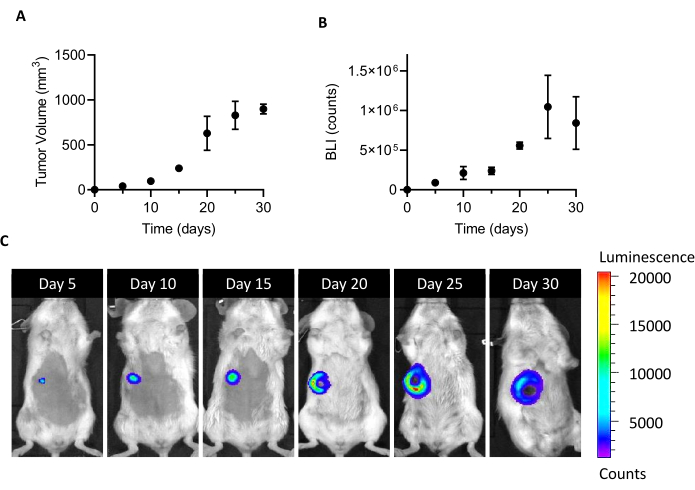
Şekil 1: 4T1 tümör modelinin kurulması. Meme yağ yastığına hücreler(10 5 hücre/fare) enjekte edildi. Tümör büyümesi implantasyondan sonra 5, 10, 15, 20, 25ve 30. Tümör hacimleri ve BLI sırasıyla mm3 ve sayı olarak ifade edilir. Sonuçlar ortalama ± SEM (n=6) olarak bildirilmektedir. (C) Hücre implantasyonundan 5, 10, 15, 20, 25 ve 30 gün sonra elde edilen BLI temsili görüntüleri, tümör büyümesini platoya ulaştığı 25. güne kadar doğrular. Analizin son zaman noktasında (30 gün), BLI 25. güne göre artmaz. 20. günden itibaren tümörün orta kısmında nekroz ve ülserasyon bölgeleri belirginleşmeye başlar. Renk Ölçeği: Min = 1.194, Maks = 20.462. Kısaltmalar: BLI = biyolüminesans görüntüleme; SEM = ortalamanın standart hatası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
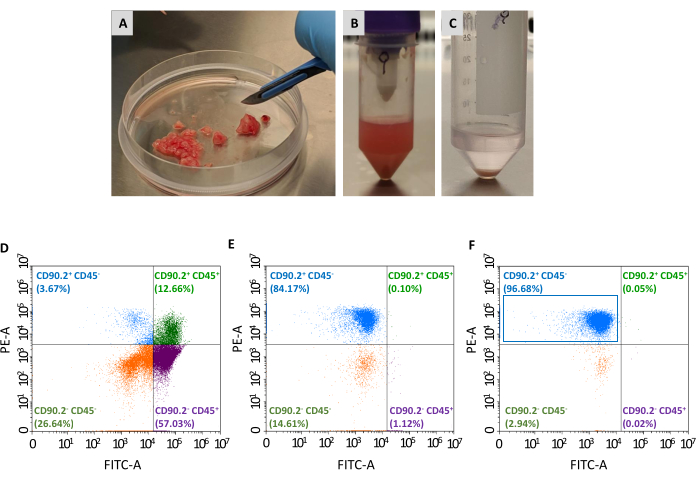
Şekil 2: İzole YFO'ların tümör örneklem hazırlama ve akış sitometrisi karakterizasyonu. Tümörler neşter yardımıyla yaklaşık 1-2 mm'lik(A)küçük parçalara çıkarıldı; (B) doku sindirimi ve eksizyon tümörün mekanik ayrışması sonrası tek hücreli süspansiyon; (C) kırmızı kan hücrelerinin lizizden sonra elde edilen hücre pelezi; (D) kırmızı kan hücrelerinin ve ölü hücrelerin çıkarılmasından sonra elde edilen hücrelerde CD45 ve CD90.2 ekspresyonunun akış sitometrisi analizi, (E) kanserle ilişkili olmayan fibroblastların tükenmesi ve (F) hücrelerin çoğunluğunun CD90.2+ CD45- (mavi dikdörtgen) olduğu kanserle ilişkili fibroblastların zenginleştirilmesinden sonra. Kısaltmalar: CAL'ler= kanserle ilişkili fibroblastlar; CD = farklılaşma kümesi; PE-A = fitoerythrin alanı; FITC-A = floresan izotiyosiyanat alanları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
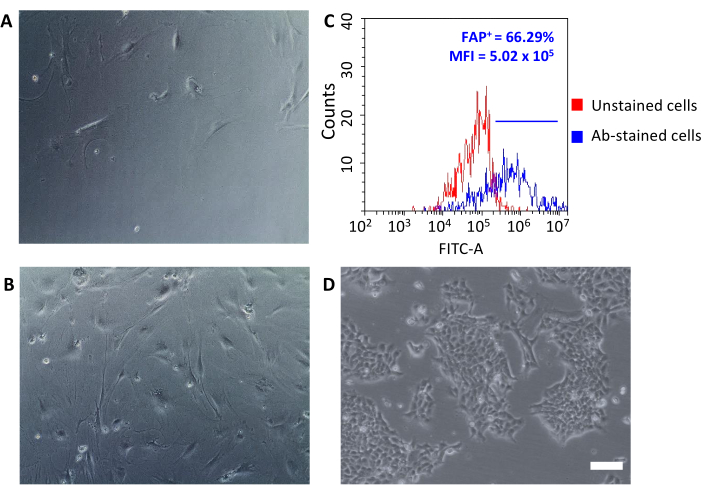
Şekil 3: CAF'ların morfolojik analizi ve FAP ekspresyolojisi. (A, B) CALFs morfolojisi, kültürün tüm pasajlarında optik mikroskopi (2. ve geçiş 5 geçişlerinde farklı düzeyde iz bırakma) ve(D) 4T1 tümör hücreleri ile karşılaştırıldığında kontrol edildi; ölçek çubukları = 10 μm. (C) Fibroblast aktivasyon proteini (FAP) ekspresyonu, toplanan CD90.2+ CD45hücrelerinde izolasyon sürecinin sonunda moleküler özelliklerini doğrulamak için akış sitometrisi ile değerlendirildi. Antikor lekeli hücreler (mavi grafik) arasında ortalama floresan yoğunluğunu ve pozitif hücrelerin yüzdesini (FAP+) ölçmek için bozulmamış kontrol hücrelerine (kırmızı grafik) floresan eşiği ayarlandı. Kısaltmalar: CAL'ler= kanserle ilişkili fibroblastlar; FAP = fibroblast aktivasyon proteini; CD = farklılaşma kümesi; MFI = ortalama floresan yoğunluğu; Ab = antikor; FITC-A = floresan izotiyosiyanat alanı; FAP+ = FAP pozitif hücreler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: En uygun alt CAF'ler izolasyon işlemi örneği. (A) Son izolasyon adımından sonra akış sitometrisi değerlendirmesi, kirletici CD90.2- CD45+ ve CD90.2 - CD45- hücrelerinin varlığını ortaya koydu. (B) Bu hücreler, (C) kültürdeki üçüncü pasajdan sonra CAL'lere üstün gelen tohumlama üzerine küçük yuvarlak morfolojiye sahip klonlar (panelin sol alt köşesinde siyah ok uçları ve inset) olarak görülebilir. Ölçek çubukları = 10 μm. Kısaltmalar: CAF = kanserle ilişkili fibroblast; CD = farklılaşma kümesi; PE-A = fitoerythrin alanı; FITC-A = floresan izotiyosiyanat alanları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
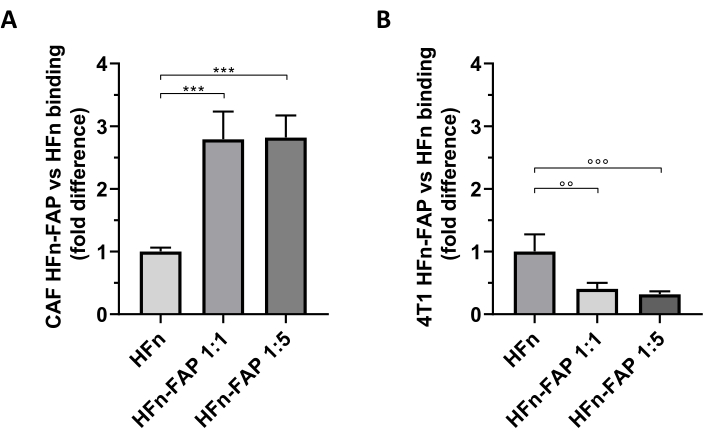
Şekil 5: HFn nanokaçalarının CAL'lere bağlanması ve 4T1. HFn nanokageleri FLORESAN olarak FITC ile etiketlendi, iki farklı protein-antikor oranında (1:1 ve 1:5) bir anti-FAP antikor parçası (HFn-FAP) ile işlevselleştirildi ve(A)hedef CAL'ler ve (B) 4T1 hücreleri ile 4 °C'de 2 saat boyunca inkübe edildi. Bağlama akış sitometrisi ile değerlendirildi. (A) CAL'lerle HFn-FAP bağlanması, her iki antikor parçası konsantrasyonunda da çıplak HFn'ye kıyasla üç kat artmıştır. Sonuçlar, üç bağımsız deneyin ortalama ± standart sapması olarak bildirilmektedir. p = 0.0003; °° p = 0,0021 ; °°° p = 0,0008. Kısaltmalar: CAL'ler= kanserle ilişkili fibroblastlar; FAP = fibroblast aktivasyon proteini; HFn = çıplak nanopartikül veya konjuge olarak kullanılan insan ferritin ağır zincirinin rekombinant varyantı; HFN-FAP = HFn nanopartikülleri, 1:1 ve 1:5 olmak üzere iki HFn:Fab@FAP molar oranında hazırlanan bir anti-FAP antikorunun değişken kısmı ile işlevsel hale getirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Hücre Numarası (ortalama ± SD) | Ekstraksiyon Verim Toplamı (geçiş başına) | |
| Eksist tümör (Kırmızı kan hücresi çıkarılması sonrası) | 1,27 x 108 ± 9,81 x 107 | 100% |
| Eksist tümör (Ölü hücre sonrası çıkarma sonrası) | 3,01 x 106 ± 9,61 x 105 | 2.38% |
| Tükenme sonrası kokteyl | 1,15 x 105 ± 4,95 x 104 | 0.11% (3.82%) |
| Zenginleştirme sonrası | 3,00 x 104 ± 1,2 x 104 | 0.027% (26.09%) |
Tablo 1: Kanserle ilişkili fibroblastların izolasyonunun her adımından sonra toplam hücre sayısı.
| Hücre Dağılımı (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| Eksist tümör (Ölü hücre sonrası çıkarma sonrası) | 1,81 ± 0,98 | 10,78 ± 4,51 | 56,57 ± 14,05 | 28.20 ± 17.57 |
| Tükenme sonrası kokteyl | 69,33 ± 16,75 | 0,14 ± 0,13 | 0,55 ± 0,63 | 39,89 ± 30,31 |
| Zenginleştirme sonrası | 93.14 ± 3.3 | 0,09 ± 0,1 | 0,09 ± 0,08 | 6,69 ± 3,4 |
Tablo 2: Kanserle ilişkili fibroblastların izolasyonunun her geçişinden sonra CD90.2 ve CD45 ekspresyonlarına göre hücre dağılımı.
| Hücre Dağılımı (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| Zenginleştirme Sonrası (havuz yok) | 75,80 ± 2,9 | 1,49 ± 0,4 | 5,97 ± 1,5 | 16,75 ± 1,1 |
Tablo 3: Cd90.2 ve CD45 alt optimal kanser ilişkili fibroblast izolasyon deneyi sonrasında toplanan hücrelerin ekspresyasyonu.
Tartışmalar
CAL'ler hücre dışı matrisin yeniden şekillendirilmesinde, metastaz ilerlemesinin teşvikinde ve tümör bölgesine ilaç erişiminin sınırlandırılmasında kilit oyuncular olarak ortaya çıkıyor34. Bununla birlikte, heterojenlikleri nedeniyle rolleri hala tartışmalıdır - bazı CAL'ler tümörijeniktir, diğer bazı alt tipler ise tümör baskılayıcı bir role sahiptir. Bu bağlamda, izolasyonları, kanser ilerlemesinde çok tartışılan rollerine daha fazla ışık tutmak için aşırı ilgi çekici olabilir, bu da önemli klinik etkileri olacaktır12,31. Ayrıca, insan ve preklinik fare tümörü modellerinden başarılı CAF ekstraksiyonu, yeni CAF hedefli ilaçların geliştirilmesini de kolaylaştıracaktır. Bu makale, birincil CAL'leri meme kanserinin singeneik preklinik modelinden verimli bir şekilde izole etmek ve kültürlemek için bir yöntem bildirmektedir. Deneyime dayanarak, üç deneysel adım çoğunlukla protokolün başarısını etkiler.
Birincisi, sütunda pıhtılaşma ve hücre eflüsünün yavaşlama riski ile ilişkili hücre süspansiyonlarının toplanmasını önlemek için hızlı bir şekilde çalışıyor: aslında, sütundan geçen hücreler birlikte kümelendiğinde, en uygun izolasyon sürecinin altı olasılığı arttı ve son kültürler "kirletici" hücre klonları içeriyordu. İkincisi, son zenginleştirme adımında geçilecek yeterli hücreyi garanti etmek için tükenme geçişinden sonra farklı tümörlerden hücreleri bir araya getirmektir. Son kritik konu, çıkarılan hücreleri yüksek hücre yoğunluklarında kaplamaktır, büyük olasılıkla hücre büyümesini ve koloni genişlemesini 4-5 pasaja kadar artırmak için 24 kuyu plakasının tek bir kuyusundan başlayarak. Hücreler düşük yoğunluklarda tohumlanmışsa, serbest yüzeyde genişlediler ve hızla çoğalmayı durdurdular.
Çeşitli çalışmalar, kanser gelişimini ve istilacılığı teşvik etmedeki rollerini incelemek için hem insan hem de fare kökenli CAF ekstraksiyon yöntemlerini tanımlamaktadır. Bu, meme kanseri, melanom, kolanjiokarsinom ve pankreas adenokarsinom35 , 36 , 37,38dahil olmak üzere birçok tümör türünde yapılmıştır. Bununla birlikte, belirli CAF belirteçlerinin olmaması ve heterojenlikleri nedeniyle, bu süreçlerin sonuçları hala en uygunun altındadır.
Burada, izole edilmiş hücreler, anti-FAP hedefleme moieties ile işlevsel hale getirilen HFn nanokagelerinin CAF hedefleme yeteneğini doğrulamak için kullanılmıştır. CAF'lerin birincil kültürlerinin kullanımı, nanostrateji ex vivo'nun nanodrug optimizasyonunun bu ön aşamasında doğrudan vivo olarak yapmaktan çok daha basit ve uygun maliyetli bir bağlama deneyi ile doğrulanmasına izin vererek önemli bir avantajdı.
Bu anlamda, CAF'lar üzerinde ex vivo testi, CAF'ın en iyi şekilde hedeflenebilmesi için en umut verici nanopartiküllerin taranmasına ve seçilmesine izin vererek in vivo hayvan deneylerinden önce gelebilir. Burada sunulan CAF modeli, nanopartikülleri aktif ilaçlarla yüklerken ön etkinlik çalışmaları için de kullanılabilir. Hayvanlar daha sonra biyodistribasyon, farmakokinetik ve etkinlik çalışmalarını değerlendirmek için kullanılacaktır.
Meme kanserinde fotodinamik tedavi için ferritin nanokabu ve prostat kanseri modellerinde doxorubicin sağlamak için peptit bazlı parçacıklar gibi çeşitli CAF hedefli nanodruglar geliştirilmektedir39,40. Bununla birlikte, nanodrug optimizasyonu için hücre platformları olarak CAL'lerin izolasyonuna odaklanan çok fazla çalışma yok.
Bu protokolün bazı sınırlamaları vardır. İlk olarak, birkaç reaktif ve malzemenin hazırlanmasını ve satın alınmasını gerektiren zaman alıcı bir protokoldür. İkincisi, 4T1 meme tümöründeki CAL'lerin azlığı nedeniyle verimleri düşüktür. Nanopartikül deneyleri, birincil CAL'ler senescence geçirdiğinden ve kültürde uzun süre sürdürülemediğinden, gerekli hücre sayısı elde edilirlenmez planlanmalı ve yapılmalıdır. Sonuç olarak, bu CAF izolasyonu, kültleştirme ve karakterizasyon yöntemi, kanserle mücadelede yeni hedeflenen nanotıpların gelişimini hızlandırmak için güçlü bir araç olabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma, IG 2017-ID. 20172 projesi – P.I. Corsi Fabio kapsamında Associazione Italiana per la Ricerca sul Cancro (AIRC) tarafından desteklenmiştir. SM, konumunu destekleyen Pediatrik Klinik Araştırma merkezi "Romeo ve Enrica Invernizzi"yi kabul ediyor. AB, airc (ID. 20172 projesi) ve Milano Üniversitesi'ne araştırma bursu için teşekkür ediyor. LS ve MS doktora sonrası ve doktora bursları Milano Üniversitesi tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ACK Lysing buffer | Lonza | 10-548E | Store at +15° to +30 °C. |
| Alexa Fluor 488 goat anti-human antibody | Immunological Science | IS-20022 | Protect from light. |
| Anti-FAP Fab fragment (3F2) | Creative Biolabs | TAB-024WM-F(E) | |
| BALB/c mice | Charles River | 028BALB/C | 7 weeks old female mice |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | Store at 2-8 °C. |
| CD45 antibody | Miltenyi Biotec | 130-110-796 | FITC-conjugated fluorescent antibody; clone REA 737; Store protected from light at 2–8 °C. |
| CD90.2 antibody | Miltenyi Biotec | 130-102-960 | PE-conjugated fluorescent antibody; clone 30-H12; Store protected from light at 2–8 °C. |
| Cell strainers 70 µm | VWR | 732-2758 | |
| CytoFLEX | Beckman Coulter | laser configuration B4-R2-V0 | |
| Dead cell Removal Kit | Miltenyi Biotec | 130-090-101 | contains 10 mL of Dead Cell Removal MicroBeads; 25 mL of 20× Binding Buffer Stock Solution. Store protected from light at 2−8 °C. |
| D-Luciferin | Caliper | 760504 | reagent for in vivo imaging |
| DMEM High Glucose w/o L-Glutamine w/ Sodium Pyruvate | Euroclone | ECB7501L | Warm at 37 °C in a water bath before use. |
| DMSO | Sigma-Aldrich | D2650 | |
| DPBS w/o Calcium, w/o Magnesium | Euroclone | ECB4004L | Keep at room temperature. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E9884 | |
| Fetal Bovine Serum | Euroclone | ECS0180L | Before use, heat at 56 °C for 30 min to kill all the complement proteins. |
| Fluorescein Istothiocyanate isomer I (FITC) | Sigma-Aldrich | F7250 | Store protected from light at 2–8 °C. |
| GentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | They are used in combination with the gentleMACS Dissociator. |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | Two samples can be processed in parallel. Special protocols have been developed for various tissues. |
| Goat serum | Euroclone | ECS0200D | |
| Ham's F12 w/o L-Glutamine | Euroclone | ECB7502L | Warm at 37 °C in a water bath before use. |
| IVIS Lumina II imaging system | Caliper Life Sciences | This imaging system is easy to use for both fluorescent and bioluminescent imaging in vivo. Equipped with a Living Image Software for analysis | |
| LD columns | Miltenyi Biotec | 130-042-901 | Composed of ferromagnetic spheres, designed for stringent depletion of unwanted cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use |
| L-Glutamine | Euroclone | ECB3000D | 200 mM stock |
| Light/fluorescence microscope equipped with camera | Leica Microsystems | DM IL LED Fluo/ ICC50 W CameraModule | inverted microscope for live cells with camera |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Separation Unit | Miltenyi Biotec | 130-090-976 | Position the magnet on appropriate stand before use. |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MS columns | Miltenyi Biotec | 130-042-201 | Composed of ferromagnetic spheres, designed for positive selection of cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use. |
| Mycoplasma Removal Agent | Euroclone | ECMC210A | Dilute in culture medium 1:100. |
| NaHCO3 | Invitrogen | A10235 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000C | |
| Non essential aminoacids | Euroclone | ECB3054D | |
| Penicillin-Streptomycin | Euroclone | ECB3001D | |
| Recombinant Human apoferritin H-homopolymer (HFn) | Molirom | MLR-P018 | |
| RPMI 1640 w/o L-Glutamine | Euroclone | ECB9006L | Warm at 37 °C in a water bath before use. |
| Tumor-Associated Fibroblast Isolation kit | Miltenyi Biotec | 130-116-474 | Contains 1 mL of Non-Tumor-Associated Fibroblast Depletion Cocktail, mouse; 1 mL of CD90.2 (Tumor-Associated Fibroblast) MicroBeads,mouse. Store protected from light at 2-8 °C. |
| Tumor Dissociation Kit | Miltenyi Biotec | 130-096-730 | Contains lyophilized enzymes (D, R, A) and buffer A; reconstitute enzymes according to the manufacturer's instructions, aliquot and store at - 20 °C. |
| Trypan blue 0.4% | Lonza | 17-942E | dilute 1:1 with a sample of cell suspension before counting the cells |
| TrypLE select | Gibco | 12563-029 | use at room temperature |
| Trypsin-EDTA | Lonza | BE17-161E | Warm at 37 °C in a water bath before use |
| T75 Primo TC flask | Euroclone | ET7076 | |
| Zeba Spin Desalting Columns | Thermo Fisher Scientific | 89890 | 7K MWCO, 2 mL |
| 1.5 mL tubes | Biosigma | CL15.002.0500 | |
| 15 mL tubes | Euroclone | ET5015B | |
| 4T1-luc2 | Caliper | Mouse mammary gland cancer cell line stably transfected with firefly luciferase gene | |
| 50 mL tubes | Euroclone | ET5050B |
Referanslar
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nature Medicine. 19 (11), 1423-1437 (2013).
- Velaei, K., Samadi, N., Barazvan, B., Soleimani Rad, J. Tumor microenvironment-mediated chemoresistance in breast cancer. Breast. 30, 92-100 (2016).
- Cheng, J. D., Weiner, L. M., et al. Tumors and their microenvironments: tilling the soil. Commentary re: A. M. Scott et al., A Phase I dose-escalation study of sibrotuzumab in patients with advanced or metastatic fibroblast activation protein-positive cancer. Clinical Cancer Research. 9 (5), 1690-1695 (2003).
- Hui, L., Chen, Y. Tumor microenvironment: Sanctuary of the devil. Cancer Letters. 368 (1), 7-13 (2015).
- Balkwill, F. R., Capasso, M., Hagemann, T. The tumor microenvironment at a glance. Journal of Cell Science. 125, 5591-5596 (2012).
- Chen, X., Song, E. Turning foes to friends: targeting cancer-associated fibroblasts. Nature Review. Drug Discovery. 18 (2), 99-115 (2019).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Seminars in Cell & Developmental Biology. 21 (1), 33-39 (2010).
- LeBleu, V. S., Kalluri, R. A peek into cancer-associated fibroblasts: origins, functions and translational impact. Disease Models & Mechanisms. 11, (2018).
- Li, X. -. Y., Hu, S. -. Q., Xiao, L. The cancer-associated fibroblasts and drug resistance. European Review for Medical and Pharmacological Sciences. 19 (11), 2112-2119 (2015).
- Luo, H., Tu, G., Liu, Z., Liu, M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Letters. 361 (2), 155-163 (2015).
- Truffi, M., Sorrentino, L., Corsi, F. Fibroblasts in the tumor microenvironment. Advances in Experimental Medicine and Biology. 1234, 15-29 (2020).
- Sugimoto, H., Mundel, T. M., Kieran, M. W., Kalluri, R. Identification of fibroblast heterogeneity in the tumor microenvironment. Cancer Biology & Therapy. 5 (12), 1640-1646 (2006).
- Costa, A., et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell. 33 (3), 463-479 (2018).
- Ishii, G., Ochiai, A., Neri, S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Advances Drug Delivery Reviews. 99, 186-196 (2016).
- Chen, Q., et al. Remodeling the tumor microenvironment with emerging nanotherapeutics. Trends in Pharmacological Sciences. 39 (1), 59-74 (2018).
- Truffi, M., et al. Nano-strategies to target breast cancer-associated fibroblasts: rearranging the tumor microenvironment to achieve antitumor efficacy. International Journal of Molecular Sciences. 20 (6), 1263 (2019).
- Tong, R., Langer, R. Nanomedicines Targeting the Tumor Microenvironment. Cancer Journal. 21 (4), 314-321 (2015).
- Kaps, L., Schuppan, D. Targeting cancer associated fibroblasts in liver fibrosis and liver cancer using nanocarriers. Cells. 9 (9), 2027 (2020).
- Miao, L., et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors. Cancer Research. 77 (3), 719-731 (2017).
- Kelly, T., Huang, Y., Simms, A. E., Mazur, A. Fibroblast activation protein-α: a key modulator of the microenvironment in multiple pathologies. International Review of Cell and Molecular Biology. 297, 83-116 (2012).
- Brennen, W. N., Isaacs, J. T., Denmeade, S. R. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy. Molecular Cancer Therapeutics. 11 (2), 257-266 (2012).
- Juillerat-Jeanneret, L., Tafelmeyer, P., Golshayan, D. Fibroblast activation protein-α in fibrogenic disorders and cancer: more than a prolyl-specific peptidase. Expert Opinion on Therapeutic Targets. 21, 977-991 (2017).
- Falvo, E., et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin. Nanoscale. 5 (24), 12278-12285 (2013).
- Truffi, M., et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research. 107, 57-65 (2016).
- Cai, Y., et al. Enhanced magnetic resonance imaging and staining of cancer cells using ferrimagnetic H-ferritin nanoparticles with increasing core size. International Journal of Nanomedicine. 10, 2619-2634 (2015).
- Heger, Z., Skalickova, S., Zitka, O., Adam, V., Kizek, R. Apoferritin applications in nanomedicine. Nanomedicine. 9 (14), 2233-2245 (2014).
- Mazzucchelli, S., et al. Nanometronomic treatment of 4T1 breast cancer with nanocaged doxorubicin prevents drug resistance and circumvents cardiotoxicity. Oncotarget. 8 (5), 8383-8396 (2017).
- Yu, Q., et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy. Journal of Controlled Release. 321, 564-575 (2020).
- Mertens, J. C., et al. Therapeutic effects of deleting cancer-associated fibroblasts in cholangiocarcinoma. Cancer Research. 73 (2), 897-907 (2013).
- Kovács, D., et al. Core-shell nanoparticles suppress metastasis and modify the tumour-supportive activity of cancer-associated fibroblasts. Journal of Nanobiotechnology. 18, 18 (2020).
- Sharon, Y., Alon, L., Glanz, S., Servais, C., Erez, N. Isolation of normal and cancer-associated fibroblasts from fresh tissues by Fluorescence Activated Cell Sorting (FACS). Journal of Visualized Experiments. (71), e4425 (2013).
- Sitia, L., et al. Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax. Cells. 10 (2), 328 (2021).
- Bellini, M., et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells. Journal of Controlled Release. 196, 184-196 (2014).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nature Reviews Cancer. 20, 174-186 (2020).
- Dvořánková, B., Lacina, L., Smetana, K. Isolation of normal fibroblasts and their cancer-associated counterparts (CAFs) for biomedical research. Methods in Molecular Biology. 1879, 393-406 (2018).
- Calvo, F., Hooper, S., Sahai, E. Isolation and immortalization of fibroblasts from different tumoral stages. Bio-protocol. 4 (7), 1097 (2014).
- Sha, M., et al. Isolation of cancer-associated fibroblasts and its promotion to the progression of intrahepatic cholangiocarcinoma. Cancer Medicine. 7 (9), 4665-4677 (2018).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Zhen, Z., et al. Protein nanocage mediated fibroblast-activation protein targeted photoimmunotherapy to enhance cytotoxic T cell infiltration and tumor control. Nano Letters. 17 (2), 862-869 (2017).
- Ji, T., et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery. Advances Materials. 27 (11), 1865-1873 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır