Method Article
将原发性癌症相关纤维细胞与乳腺癌的合成素 Murine 模型分离,用于靶向纳米粒子的研究
* 这些作者具有相同的贡献
摘要
本文旨在为三阴性乳腺癌的同步粘膜模型中原发性癌症相关成纤维细胞的分离与培养提供协议,并应用于旨在针对肿瘤微环境的新型纳米粒子的临床前研究。
摘要
癌症相关成纤维细胞 (CAF) 是肿瘤微环境中的关键角色。尽管与肿瘤细胞相比数量减少,但CAF可以调节肿瘤进展,并提供抗肿瘤免疫保护。新兴的抗癌策略旨在通过消融亲肿瘤的CAF或重新编程CAF功能及其激活状态来重塑肿瘤微环境。一种很有前途的方法是开发纳米化输送剂,能够瞄准CAF,从而允许药物和活性分子的特定输送。在这方面,CAF的细胞模型可以为 体外 筛选和这种纳米形态的初步研究提供有用的工具。
本研究描述了原发性CAF与三阴性乳腺癌的合成4T1粘膜模型的分离和文化。磁珠用于两步分离过程,从分离的肿瘤中提取CAF。免疫表型控制在每次通过后使用流细胞测量来验证过程产量。可利用分离的CAF来研究用于处理肿瘤微环境的不同纳米成形物的瞄准能力。荧光标记的H-铁蛋白纳米穴被用作候选纳米粒子来建立这种方法。对纳米粒子进行分析,分析其是否与目标配体结合,以增强其与CAF的结合性。结果表明,乳房CAF的 体外 提取可能是测试和验证纳米粒子的一个有用的系统,用于肿瘤性CAF的特定靶向。
引言
在过去的几十年里,很明显,杀死肿瘤细胞通常不足以消除恶性肿瘤,因为肿瘤微环境可能促使肿瘤复发并诱导治疗耐药性1,2。一个新的范式已经出现:瞄准肿瘤频闪剥夺肿瘤的支撑因子,从而,提高化疗的疗效3,4,5。特别是,癌症相关的成纤维细胞(CAFs)是许多固体肿瘤6,7有趣的频闪靶点。CAF是一组非常异质的细胞,通过生长因子、细胞因子和化疗因子的分泌与癌细胞和免疫系统细胞相互作用:建立和改造细胞外矩阵;并启用转移形成8,9,10,11,12。根据肿瘤类型,CAF显示亲肿瘤功能,而其他亚型的CAF似乎有肿瘤抑制功能13,14。为了更好地澄清这种二分法,从原发性肿瘤和转移性肿瘤中彻底描述CAF是很重要的。
在这方面,一个新兴的研究领域侧重于纳米化剂的开发,旨在通过提供活性分子和药物来瞄准和/或摧毁CAF,从而能够重塑肿瘤微环境15、16、17、18。几种类型的纳米粒子被设计成通过细胞毒性药物实现CAF消融,诱导CAF靶向光动力治疗,或通过将CAF恢复到静止状态或诱导TNF相关凋亡诱导配体表达,从而诱导邻近癌细胞16、19的凋亡。此外,许多纳米粒子积极瞄准特定生物标记的潜力,使人们希望选择CAF子集作为目标。虽然它对CAF的绝对特异性仍然受到质疑,但成纤维细胞活化蛋白(FAP)是亲肿瘤频闪最有前途的目标之一,并被利用来引导纳米药物的输送,从而为CAF靶向纳米疗法20、21、22的发展铺平了道路。
本文描述了原发性CAF与乳腺癌的合成模型的分离,并报告了它们在研究纳米粒子的靶向能力时所用,该粒子旨在识别CAF标记,FAP。铁蛋白纳米穴被用作候选纳米系统来建立这种方法,因为其交付特异性可能由目标moieties23,24的表面暴露所塑造。此外,铁蛋白已被成功证明是抗肿瘤应用的优秀生物相容穿梭体,触发肿瘤质量25、26、27的有效载荷的快速积累。迄今为止,CAF靶向纳米系统临床前研究已经涉及对培养中刺激的成纤维细胞系进行体外测试,通过转化生长因子β来诱导细胞活化和CAFs28、29的一些免疫表型特征的表达。这种方法通常应用于不朽的细胞系(如NIH3T3,LX-2),并且非常快速和简单,在几个小时或几天内产生激活的细胞。一个限制是,虽然体外刺激诱导一些基因的表达归因于激活肌纤维细胞,它不能完全回顾所有生物特征的真正的CAF,特别是其异质性在体内。
另一项策略是从人类或小鼠肿瘤样本中提取原发性CAF,30,31。这确保了 CAF 激活发生在生理环境中,并且保持 CAF 子群的异质性。根据研究目标,CAF可能来自不同的来源,从而提供了研究最可靠的条件的可能性。这里报道的协议对于寻求对新型纳米粒子的功能进行初步评估的科学家来说很有价值,这些纳米粒子旨在从乳腺癌模型中瞄准CAF。分离的CAF对于筛选那些有希望进行癌症动物模型体内评估的纳米粒子是有用的。这将在纳米粒子生产的第一步中具有相关性,通过主要考虑配体固定策略,以实现最佳目标特性,推动纳米技术专家向纳米粒子设计的精细化迈进。
研究方案
1. 建立乳腺癌的同步4T1模型
注:本协议描述了从小鼠4T1乳腺肿瘤中分离原发性CAF。这里描述的动物研究已经得到意大利卫生部的批准(第110/2018-PR号)。
- 肿瘤细胞培养和植入
- 解冻 1 × 106 4T1 luc 细胞在 T75 烧瓶与 10 mL 罗斯韦尔公园纪念研究所 (RPMI) 1640 中等补充 10% 胎儿牛血清 (FBS), 1% 青霉素/链霉素 (P/S) 和 1% L-谷氨酰胺.在培养介质中添加支原体去除剂 (1:100)。
注:4T1-luc细胞稳定地表达荧光素酶,可通过生物发光(BLI)在D-露西弗林的适当刺激下可视化。这允许在小鼠植入肿瘤细胞后进行体内监测的生存能力和增殖(图1)。 - 通过每2 天更换一次介质,在潮湿的大气中将细胞保持在 37 °C 和 5% CO 2 状态,直到 +80% 汇合。
注意:在小鼠注射之前,继续使用支原体切除剂进行1周(+2/3通道)的治疗,以确保注射细胞不含支原体。 - 在手术当天,分离细胞使用1 mL的二甲基乙酰胺酸(EDTA)溶液(试丁二烯酸1:250),在37°C下5分钟。 通过添加培养介质来停止试用素活性,用尝试蓝(1:1)计算细胞,并计算细胞/mL 的数量。
- 派佩特体积对应1×106 细胞和离心机5分钟在400×克。倒出超高音,在RPMI 1640基介质的1 mL中重新吸收颗粒。将细胞放在冰上,直到准备好注射。
注:每只小鼠需要1×105 个细胞:但是,始终计算超过 2 只小鼠(对应 2 × 105 个细胞),以减轻注射器的负荷。 - 手术前一天,剃掉8只BALB/c小鼠(雌性,7周大)的毛皮,露出右侧腹部乳腺区域。使用电动剃须刀,涂抹薄薄层脱皮霜4分钟:然后,用水和一张纸洗掉奶油。
- 通过连续吸入2%异黄酮气体诱导麻醉+5分钟,并使用27G块管注射器在腹乳腺区域进行皮下注射。向上转动针头,皮下进入皮肤;然后,保持皮肤向上,慢慢注射100微升的细胞悬浮(1×105 细胞)。稍微转动针头,然后慢慢收回注射器。
注意:请记住在注射前 15 分钟将细胞悬浮到室温。
- 解冻 1 × 106 4T1 luc 细胞在 T75 烧瓶与 10 mL 罗斯韦尔公园纪念研究所 (RPMI) 1640 中等补充 10% 胎儿牛血清 (FBS), 1% 青霉素/链霉素 (P/S) 和 1% L-谷氨酰胺.在培养介质中添加支原体去除剂 (1:100)。
- 肿瘤生长和解剖
- 在细胞注射后5天,在成像前5分钟注射150毫克/千克D-露西芬腹膜内(100微升)。使用 体内 成像系统捕获 BLI 图像,该系统将 10 s 曝光、中等装箱和 f/stop 设置为 4。将肿瘤的发光区域定义为感兴趣区域 (ROI),并使用成像软件量化 ROI(光子/秒/m2)中的总信号。
- 从注射开始,每 5 天重复一次成像过程 (1.2.1),以监测 BLI 增加的肿瘤生长情况。
- 要建立肿瘤体积,抓住小鼠并露出它的腹部。使用卡钳测量肿瘤长度 (L) 和宽度 (W) 每周一次。使用方程 1 计算肿瘤体积 (V)。
[V = (L x W2)/2] (1) - 在细胞注射后的20天,通过颈椎错位来牺牲动物,用剪刀将肿瘤与皮肤分离,并收集在组织储存溶液中(见材料表)。
注:肿瘤样本可立即用于分离成单细胞(第 2 节),或在 4 °C 下存储长达 48 小时。
2. 肿瘤分离成单细胞
注意:对于以下步骤,请在层压流罩中使用无菌试剂和一次性用品。一次处理4个肿瘤。
- 将肿瘤样本放入培养皿中,在钳子和手术刀的帮助下小心地去除皮肤、脂肪和坏死部位的任何片段。然后,将肿瘤缩小到约1°2毫米的小块,并转移到管(图2A)。
注:4T1肿瘤在生长过程中会变得非常坏死,并有溃疡倾向。重要的是要小心地清除坏死区域,以避免碎片干扰下一步。 - 为肿瘤分离准备消化组合:混合 RPMI 1640 中等 2.35 mL、D 酶 100 μL、酶 R 50 μL 和酶 A.12.5 μL。将肿瘤片段浸泡在溶液中并紧紧关闭管子。
注:所指示的消化混合量对肿瘤有效,最高可达1克,可根据其重量调整为较大肿瘤。4T1 肿瘤生长 20 天通常在 0.5 到 0.8 克的范围。 - 将管子倒置,检查所有肿瘤片段是否都站在管子底部朝向盖子。将管子连接到适当的外壳中的机械分离器上,并运行专为硬肿瘤设计的特定分离程序(参见制造商的说明)。
注:可能需要特殊管子才能安装到分离器中。C 管在盖内带有转子,以促进组织的机械分离。 - 分离管子,将其倒置,并在 37 °C 下孵育样品 40 分钟,轻轻摇晃。然后,将管子连接到适当的外壳中的分离器上,并运行以下专为硬肿瘤设计的特定分离程序两次。确保手术结束时没有大块组织(图2B)。
注:为了分离肿瘤,其他酶鸡尾酒可用于降解细胞外基质。然而,在这个协议中,使用了一个商业上可用的肿瘤分离套件,其中包含优化的酶混合物(酶D、R、A)和机械分离组织的半自动分离器。这种组合确保了细胞外基质的适当降解,同时保持了细胞完整性和细胞表面表位。 - 在 50 mL 管中通过 40 μm 细胞过滤器过滤样品,用 RPMI 1640 介质的 10 mL 清洗过滤器,在 300 ×克时离心 7 分钟。如果细胞颗粒呈红色,通过在室温下加入 1 mL 的氯化铵-钾 (ACK) 裂解缓冲 5 分钟,用 10 mL 的 RPMI 1640 清洗,在 15 mL 管中转移细胞悬浮液,然后再次离心机来清洗。
- 将颗粒重新沉积在 1 mL 的 PBE 缓冲器中,由磷酸盐缓冲盐水 (PBS)、0.5% 牛血清白蛋白 (BSA) 和 2 mM EDTA 组成,并用尝试蓝 (1:1) 计算细胞。在细胞团的情况下,通过以前浸泡在PBS中的70μm细胞过滤器过滤细胞悬浮。
注意:特别是当肿瘤很大时,检查细胞计数并最终将每个肿瘤样本分成每个管子中,每个管子中不超过 107 个细胞,然后再进行步骤 2.7。 - 使用无菌双蒸馏水稀释 20 倍绑定缓冲器库存溶液(参见 材料表),准备死细胞去除结合缓冲器。用 5 mL 的 1×绑定缓冲器 (图 2C)清洗电池。
注意:将缓冲保持在 4 °C。 - 离心7分钟,300×克,用0.1兆L的死细胞去除微珠重新使用细胞颗粒(见 材料表)。混合良好,在室温下孵育15分钟。
- 在与珠子的孵育过程中,在引擎盖下准备一个磁立柱,并在其上悬挂铁磁分离柱(一列最多107 个细胞),并指向下。用 0.5 mL 的冷 1×绑定缓冲器使柱子等价。等到溶液在重力过。
注:重要的是不要超过每列细胞的数量,以避免任何风险凝结柱床和降低恢复率。当使用超过 107 个单元格时,要么根据细胞总数使用更多的列,要么使用更大的列。在这种情况下,将以下步骤中描述的试剂体积调整为制造商指示的试剂体积。 - 在孵化结束时,在珠子/细胞悬架中加入 400 μL 的冷 1×绑定缓冲器,将整个体积加载到柱子上,并在 15 mL 管中收集污水(对应于未标记的电池)。
- 用 0.5 mL 的冷 1×绑定缓冲器清洗柱子四次,并在同一管中收集总污水(对应活细胞分数)。
- 用尝试蓝(1:1)数细胞。将 1 × 105 个细胞放入两个管中进行荧光激活细胞排序 (FACS),并将它们保持在 4 °C,直到过程验证(参见步骤 4.1):使用第一根管设置分析参数和正向区域(控制管),另一个用于生物标志物分析(示例管)。使用剩余的细胞进行CAF提取(见第3节)。
注:去除死细胞对于减少第3节中微珠的非特异性反应非常重要。然而,为了提高产量,如果死细胞的比例<20%,避免去除死细胞。
3. 从乳腺肿瘤中提取原发性CAF
注:对于第3节,使用小鼠肿瘤相关成纤维细胞隔离套件,其中含有非肿瘤相关成纤维细胞耗竭鸡尾酒和肿瘤相关成纤维细胞微珠,适合细胞的磁性标记(见 材料表)。
- 非癌症相关成纤维细胞的耗竭
- 用 PBS 润湿 70 μm 细胞过滤器,并过滤细胞悬浮以去除任何团块。然后,在300×克时离心细胞10分钟,并吸气超高分子。
注:如果单个肿瘤被分成两个样本进行第 2.7 步,则将细胞悬浮二个单元集合为二,然后继续执行步骤 3.1.2。 - 将颗粒重新吸进 80 μL 的冷 PBE 缓冲器中,并加入 20 μL 的非肿瘤相关纤维细胞消耗鸡尾酒。在 4 °C 下混合并孵育,在黑暗中 15 分钟。
- 在与珠子孵育期间,在磁架上准备铁磁耗竭柱(每个样本1个),并将柱子与2兆升的冷PBE缓冲器平滑。等到解决方案流过。
- 在孵化结束时,在珠子/细胞悬架中加入 400 μL 的冷 PBE 缓冲器,将整个体积加载到柱子上,并在 15 mL 管中收集污水(对应于未标记的电池)。
- 用 2 mL 的冷 PBE 缓冲器清洗柱子两次,并在同一管中收集总污水。离心机 10 分钟, 300 ×克, 在 0.1 ml 的冷 Pbe 缓冲器中重新悬浮。
注:非癌症相关成纤维细胞的耗竭会大大减少恢复的细胞总量。通常有必要并建议从四个不同的样本中收集细胞悬浮物,以获得可见颗粒和足够的细胞,用于步骤 3.2。这将确保最佳收益。 - 将 20 μL 的电池悬架放入 FACS 管中,并将其保持在 4 °C 以进行过程验证(参见第 4 节)。使用剩余的单元格进行 CAF 选择(参见步骤 3.2)。
- 用 PBS 润湿 70 μm 细胞过滤器,并过滤细胞悬浮以去除任何团块。然后,在300×克时离心细胞10分钟,并吸气超高分子。
- 癌症相关成纤维细胞的阳性选择
- 将 20 μL 的肿瘤相关成纤维细胞微珠添加到 80 μL 的细胞悬浮。在 4 °C 下混合并孵育,在黑暗中 15 分钟。
- 在与珠子孵育过程中,在磁架上准备铁磁分离柱(每个样本1个),并用0.5兆升的冷PBE缓冲器使柱子平滑。等到解决方案流过。
- 在孵化结束时,在珠子/细胞悬架中加入 400 μL 的冷 PBE 缓冲器,将整个体积加载到柱子上,让未标记的细胞流进 15 mL 管中。
- 用 0.5 mL 的冷 PBE 缓冲器清洗柱子三次,并在同一管中收集总污水。
注:流经包含未标记的 CD90.2 阴性细胞,这些细胞可能被丢弃为非癌症相关成纤维细胞。 - 从磁铁中取出柱子,放入 1.5 mL 管中。在柱子上加入 1 mL 的冷 PBE,并立即将柱塞推入柱子以冲洗出细胞。
- 离心机 10 分钟, 400 × 克, 在 0.1 ml 的冷 Pbe 缓冲器中重新悬浮。将 20 μL 的电池悬浮件放入 FACS 管中,并将其保持在 4 °C 以进行过程验证(参见第 4 节)。
注意:离心后,颗粒可能几乎看不见,尤其是当原始肿瘤很小时。使用锥形底部离心机管,在有抱负的超高分子时小心不要失去任何细胞。 - 将剩余的细胞稀释在杜尔贝科的改良鹰中(DMEM)/哈姆的F-12的适当体积中,辅以15%的FBS、2m L-谷氨酰胺、1%的P/S和1%的非必需氨基酸,并将细胞播种在组织培养板中。
- 在显微镜下检查细胞密度,并将板置于 37 °C 和 5% CO2 的培养池中,让细胞粘附并生长。
注意:如果细胞密度过高,立即将细胞悬浮分解成组织培养板的两口井,然后将板放入培养箱。
4. 过程验证
- 流细胞学
注:第 4.1 节不需要无菌条件,可以在层罩外执行。对第 2.11 步(分离肿瘤)、第 3.1.6 步(非癌症相关成纤维细胞耗尽后)和步骤 3.2.6(富集与癌症相关的成纤维细胞后)收集的样本同时执行第 4.1 节。- 以 300 ×克为步骤 2.11、3.1.6 和 3.2.6 的 10 分钟离心的 FACS 管。丢弃超高纳特。
注:准备至少一个额外的管子,其中包含未受污染的细胞作为控制,以设置参数进行分析。 - 在示例管中,在 88 μL 的 PBE 中重新悬浮细胞, 并加入2微升抗CD45抗体与荧光素异氰酸酯(FITC,1:50稀释,根据制造商的说明)和10μL的抗CD90.2抗体结合植物红素(PE,1:10稀释,根据制造商的说明)。在黑暗中 4 °C 时彻底混合并孵育 10 分钟。在控制管(未染色)中,在 100 μL 的 PBE 中重新悬念电池。在黑暗中在 4 °C 下孵育 10 分钟,以复制抗体染色细胞遵循的程序。
注:必须仔细检查孵化的温度和时间,因为此类变量的变化可能导致不良或非特定污渍,从而改变结果。 - 完成孵化步骤后,通过添加 1 mL 的 PBE 进行洗涤。离心机 10 分钟,300 x g。丢弃超高纳特。
- 在 500 μL 的 PBS 中重新悬念电池(所有管子)。
- 混合好,继续进行流细胞学分析。设置通道来测量抗体的荧光(即FITC和PE)。
- 从控制管中,通过在前向和侧散射 (FSC vs SSC) 图上绘制第一个门 (P1) 来选择所有可行的单元格。在 P1 中,设置仅由单个单元格组成的第二个门 (P2)。
- 使用抗体的特定荧光通道(即FITC和PE),设置适当的门来辨别正染色细胞。
- 开始分析并记录 P2 中至少 10,000 个事件。同时阅读来自两个通道的信号。
注意:如果细胞总数低于预期,最好读取整个管子。 - (可选)如果进一步染色与额外的抗体/氟化物被编程,设置适当的补偿矩阵之前启动分析。
- 以 300 ×克为步骤 2.11、3.1.6 和 3.2.6 的 10 分钟离心的 FACS 管。丢弃超高纳特。
- 细胞形态和特征监测
注:一旦播种,细胞必须在无菌条件下处理。- 播种后的第二天,在光学显微镜下可视化细胞,以检查细胞粘附和形态。吸气超高,代之以新鲜的介质。
注:CAF是大主轴状细胞,可以很容易地区别于4T1肿瘤细胞的上皮状结构。 - 在潮湿的大气中将细胞保持在 37 °C 和 5% CO2, 每 2 天更换一次介质。
- 当细胞达到 +80% 汇合(播种后约 4-6 天)时,使用 TrypLE 选择解决方案(参见 材料表)分离细胞,在室温下 5 分钟。加入新鲜介质(4:1),将细胞悬浮离心在400×克5分钟,并在新鲜介质中重新使用颗粒。
- 将细胞拆分1:2,并扩大培养,直到获得实验所需的细胞数量。
- 在每一段,检查细胞形态和生长在光学显微镜下。如果细胞形态不是同质的(例如,培养物中出现的小圆形细胞的克隆),则按第 4.1 节中描述的流动细胞学分析细胞样本。如果同质,则继续第 4.2.7 步。
注:细胞形态的变化可能表明非癌症相关成纤维细胞的污染,需要去除这些污染以确保培养纯度。 - 分析流细胞学结果,并根据以下情景之一进行:(i) 如果发生 CD90.2-/CD45 细胞污染,收集所有细胞,并按照以下步骤 3.2 重复正选择:(二) 如果CD45+细胞也发生污染,收集所有细胞,并在第3.1步重复耗竭;(三) 如果没有发生污染(只有CD90.2+/CD45-细胞存在),将细胞保持培养,并直接进入4.2.7。
注:由于用微珠重复耗竭过程会减少细胞恢复,因此建议只有在不需要立即使用细胞时才建议使用。 - 用锥形蓝色(1:1)计算细胞,将5个×105 个细胞放入两个FACS管中,离心机在300×克下放置10分钟。丢弃超高纳特,在室温下将颗粒重新沉积在 0.5 mL 的阻塞缓冲区(PBS 辅以 2% BSA,2% 山羊血清)15 分钟。
注:一个管子仅充当由未受污染的细胞组成的控制,而第二个管中的细胞将被染色用于流细胞学分析。 - 离心机 10 分钟,300 ×克,丢弃超高分子,在 99 μL 的阻塞缓冲器中重新悬浮。在样品管中加入 1 μg 的抗 FAP 抗体,在控制管中加入 1 mL 的阻塞缓冲器。在室温下彻底混合并孵育15分钟。
注:FAP 是活性肿瘤频闪的表面标记,可用于识别和描述 CAF。 - 用PBS、离心机洗三次澡,在室温下用荧光染料(1 μg)结合的适当的二级抗体孵育15分钟。
- 使用 PBS 洗涤三次,然后通过流细胞学进行分析(通过设置适当的通道来检测使用的荧光素,遵循步骤 4.1.5 到 4.1.7)。然后,使用细胞进行实验(步骤 5.2)。
- (可选)将细胞样本冻结在 1 mL 中,90% FBS 和 10% 二甲基硫氧化物 (DMSO);存储在 -80 °C 以供进一步使用。
- 播种后的第二天,在光学显微镜下可视化细胞,以检查细胞粘附和形态。吸气超高,代之以新鲜的介质。
5. 工程费里丁纳米粒子瞄准的CAF
注:人类铁蛋白重链(HFn)的重组变种被用作裸露的纳米粒子,或与靶向摩尔结合。根据先前描述的协议32,米兰-比科卡大学的NanoBioLab以两个HFn:Fab@FAP摩尔比(1:1和1:5)编制了HFn纳米粒子,其功能与抗FAP抗体(Fab@FAP)的可变部分有关。
- HFn 纳米粒子的荧光标签
注:裸露和功能化的 HFn 纳米穴都带有 FITC 荧光标签。- 溶解 99% 乙醇中的 FITC 粉末,获得 2 毫克/mL 的浓度。
注意:此解决方案应重新准备。 - 每1毫克蛋白质(即100微升HFn,10毫克/毫升)孵育50微升预制溶液(200微克FITC)。加入 50 μL 的 1 M 碳酸氢钠 (NaHCO3),并将体积调整为 500 μL 与 0.1 M NaHCO3.
注:根据实验需求放大卷。 - 在室温下、黑暗中,连续搅拌1小时,培育反应混合物。
- 使用自旋脱盐柱(7 kDa MWCO)通过凝胶过滤将过量的 FITC 从结合体中取出。
- 使用光谱光度计评估回收的标签蛋白质的浓度。通过分别测量 280 nm 和 488 nm 的吸收量来估计蛋白质和染料的含量。
- 溶解 99% 乙醇中的 FITC 粉末,获得 2 毫克/mL 的浓度。
- HFn 纳米粒子与 CAF 的结合
注:在文化中使用不迟于段落 4-5 的 CAF。- 将 5 × 105 个细胞放入每个 FACS 管中,离心机放置 10 分钟,300 ×克, 和重新悬浮在0.5mL的PBS,0.3%的BSA补充0.1毫克/mL的纳米粒子的不同制剂(裸HFn,HFn-Fab@FAP 1:1,HFn-Fab@FAP 1:5)以前标有FITC。
注:在三重状态下运行每个条件。准备一个额外的管作为控制无标签样品,没有添加纳米粒子。 - 在黑暗中,在 4 °C 的暗中孵育 2 小时,在离心机中洗三次。
- 使用 0.5 mL PBS 的再悬架细胞,混合良好,并通过流细胞学进行分析。设置通道来测量 FITC 的荧光。
- 在活单细胞上盖住后,获得 20,000 个事件。使用控制无标记管设置 FITC 积极性之门,并获取 FITC+ 事件的百分比(对应纳米粒子结合)。
- 将 5 × 105 个细胞放入每个 FACS 管中,离心机放置 10 分钟,300 ×克, 和重新悬浮在0.5mL的PBS,0.3%的BSA补充0.1毫克/mL的纳米粒子的不同制剂(裸HFn,HFn-Fab@FAP 1:1,HFn-Fab@FAP 1:5)以前标有FITC。
6. 统计分析和实验复制
- 动物
- 执行三个独立的肿瘤生长和CAF分离实验,每个实验使用8只动物,如1.1.5中所述。为了优化 CAF 分离产量,将切除的组织分成子组(n=4),并按照第 2 节中描述的步骤进行处理。
- HFn 与细胞的相互作用
- 评估功能化和非功能化 HFn 与目标细胞(CAF 和 4T1)的相互作用,按荧光标记纳米穴的正染色细胞百分比进行评估。将结果报告为三个独立实验的平均±标准偏差。
- 统计分析
- 要计算 HFn 和 HFn-FAP 细胞结合实验中的统计意义,请使用普通的单向 ANOVA 测试。
结果
用于 最佳 CAF 隔离的体内模型设置
将10个5 4T1-luc细胞注射到雌性BALB/c小鼠的乳腺脂肪垫中,可在植入后5天导致可检测肿瘤质量的生长。通过通过卡钳测量肿瘤体积和 BLI 测量肿瘤细胞的生存能力,在植入后监测肿瘤生长一个月。为了找到一个牺牲窗口,足以为CAFs隔离,寻求最佳妥协之间的肿瘤大小和BLI一方面,另一方面新兴的肿瘤溃疡和坏死(图1)。由于坏死核在植入后20天出现,并在25天和30天( 图1C中的BLI图像记录)放大,因此将第20天设定为隔离过程后优化细胞恢复的时间点。即使在肿瘤处理 前体内的第一步仔细切除所有可见的坏死区域后,在分离成单细胞的末端也发现了高比例的死细胞(表1)。由于这个百分比可能相关,特别是随着肿瘤大小的增加,在处理4T1模型时,死细胞切除总是必要的。
优化 CAF 隔离程序、培养和特征
还需要两段话来分离CAF(CD90.2+ CD45-)的种群,从收集的可行细胞面板中分离出:非肿瘤相关成纤维细胞的耗竭和肿瘤相关成纤维细胞的富集(图2)。耗竭珠鸡尾酒可有效去除CD45+细胞(分别占消耗前和衰竭后细胞总数的67.35%和0.69%),并且始终用于处理每列单个肿瘤。如表1所示,在耗竭步骤后,被精化的细胞数量从平均3×106下降到1×105。由于细胞总数大幅减少,在进行浓缩步骤之前,将收集的细胞从至少 2 个集中到单个管中最多 4 个肿瘤是很方便的。通过这样做,获得足够数量的细胞与肿瘤相关的成纤维细胞珠孵育,并通过一个单一的分离列获得CD90.2+ CD45-细胞的93%的最终平均值(表2)。
一旦播种到组织培养板上,这些恢复的细胞附着在塑料上,并揭示了一个大型主轴形状的形态典型的成纤维细胞(图3A,B),不同于4T1肿瘤细胞(图3D)。耗竭后不汇集肿瘤会导致与肿瘤相关的成纤维细胞微珠的细胞产量过低,无法建立培养。在其他情况下,当微珠孵化的持续时间和温度没有仔细维护时,可能会发生一些非特定的结合。在这种情况下,浓缩步骤效率较低,与 CD90.2+ CD45+和 CD90.2- CD45-细胞的百分比较低,以及 CD90.2= CAF(分别为 5.97 ± 1.5 和 16.75 ± 1.1)(图 4和表 3)。这些污染物细胞可能是不同形态的小克隆(图4B,黑色箭头)在培养中出现的原因,这些克隆的生长速度比CAF快,并战胜了主要的CAF培养物(图4C)。这些次优结果证实了始终仔细检查 CD90.2 和 CD45 表达式以及浓缩过程结束时和培养细胞生长过程中的细胞形态的重要性。
使用分离细胞来评估工程纳米药物的CAF靶向潜力
新分离的CAF可用于从基础研究到药理学研究等多个应用。这个小组的目标是开发能够专门针对CAF的HFn纳米穴。HFn 的功能与特定的抗 FAP 抗体片段 (HFn-FAP) 在两种不同的蛋白质: 抗体比 (较低的 1:1 和更高的 1:5), 并与 CAF 的结合进行了测试。由于FAP被用作亲肿瘤CAF的表面生物标志物,因此在分离的CAF(图3C)上检查FAP表达是至关重要的。遵循了5段以上的文化表达,以确认主要的CAF文化保持了其原始特征。
发现与裸HFn相比,HFn的FAP功能化有助于向CAF靶向的重大转变,而抗体(1:1)的降低足以观察这种效应(图5A)。然而,这并没有观察到肿瘤4T1细胞用于建立体内肿瘤模型,其中裸HFn显示比功能化HFn(图5B)更高的结合性。这很可能是由于4T1细胞中没有FAP过度表达,以及HFn与TFR1的优先相互作用,TfR1调节细胞中的HFn吸收,正如该组27,33广泛报道的那样。这些结果证实了使用乳房CAF的初级培养物来初步筛选纳米粒子的靶向能力,旨在解决肿瘤微环境的有用性。
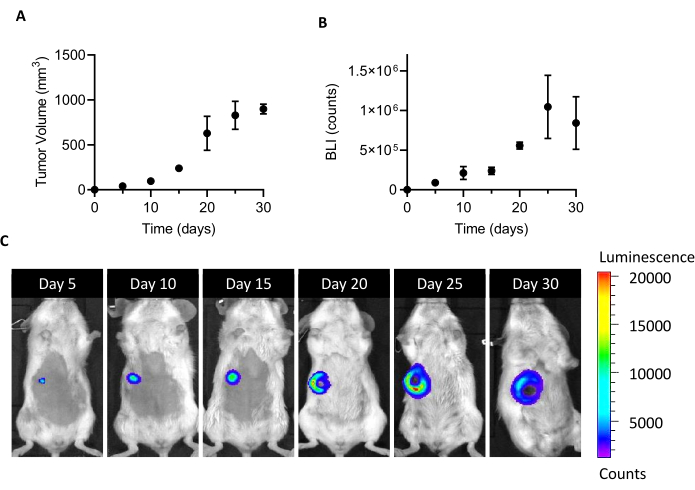
图1:4T1肿瘤模型的建立。细胞(105个细胞/小鼠)被注射到乳腺脂肪垫中。植入后(A)通过用卡钳测量肿瘤体积,通过生物发光成像测量肿瘤体积(B),在植入后第5天、第10天、第15天、第20天、第25天和第30天跟踪肿瘤生长。肿瘤体积和 BLI 分别表示为 mm3和计数。结果报告为平均± SEM (n=6)。(C) BLI代表性图像获得5,10,15,20,25和30天后,细胞植入确认肿瘤生长,直到第25天,当它似乎达到一个高原。在最后一次分析点(30 天)中,BLI 不会比第 25 天增加。从第20天开始,坏死和溃疡区域开始在肿瘤的中心部分变得可见。颜色刻度: 最小 = 1,194, 最大 = 20,462.缩写:BLI = 生物发光成像;SEM = 平均值的标准错误。请单击此处查看此图的较大版本。
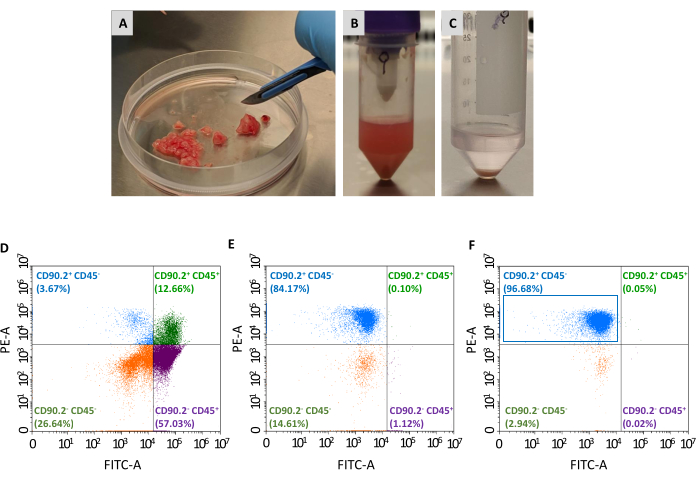
图2:孤立CAF的肿瘤样本制备和流细胞学特征。肿瘤被切除,并减少到(A) 小块约 1+2 毫米的帮助下,手术刀:(B) 切除肿瘤组织消化和机械分离后单细胞悬浮:(C) 红血球裂解后获得的细胞颗粒:(D) 红血球和死细胞切除后获得的细胞中的CD45和CD90.2表达的流动细胞学分析,(E) 非癌症相关成纤维细胞耗尽后,以及(F) 富集与癌症相关的成纤维细胞后,其中大多数细胞为CD90.2× CD45- (蓝色矩形)。缩写:CAF® 癌症相关成纤维细胞;CD = 差异化集群;PE-A = 植物红素区域;FITC-A = 荧光素异氰酸酯区域。请单击此处查看此图的较大版本。
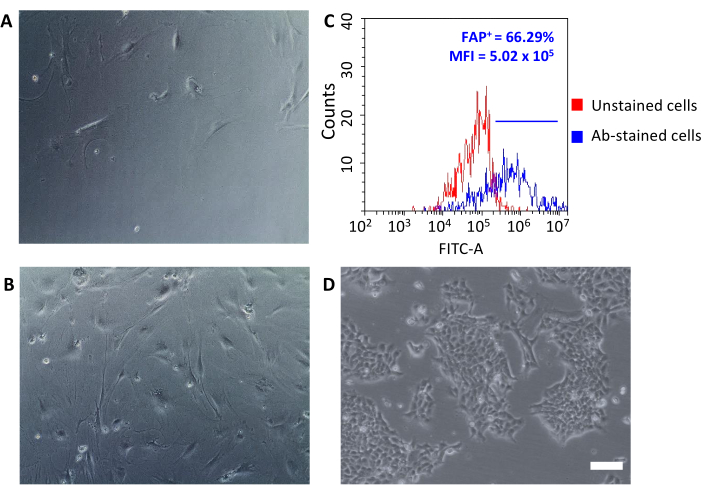
图3:通过光学显微镜(第2段和第5段的不同汇合水平),与(D)4T1肿瘤细胞相比,通过光学显微镜检查了CAF和FAP表达的形态分析。(A、B)CAF形态在培养的所有段落中进行了检查:比例杆 = 10μm.(C)纤维细胞活化蛋白 (FAP) 表达在收集的 CD90.2= CD45 的隔离过程结束时通过流细胞测量进行评估,以确认其分子特征。在未染色的控制细胞(红色图)上设置了荧光阈值,以量化平均荧光强度和抗体染色细胞中阳性细胞 (FAP+)的百分比(蓝色图)。缩写:CAF® 癌症相关成纤维细胞;FAP = 成纤维细胞激活蛋白;CD = 差异化集群;MFI = 平均荧光强度;Ab = 抗体;FITC-A = 氟辛异氰酸酯区域;FAP® = FAP 阳性细胞。请单击此处查看此图的较大版本。

图4:CFS隔离过程的次优示例。(A ) 在最后隔离步骤后进行流细胞学评估,发现存在污染物CD90.2- CD45+和CD90.2- CD45-细胞。(B) 这些细胞在播种时可被视为具有小圆形态的克隆(黑色箭头和镶板左下角的嵌入),(C)在培养的第三段之后战胜了CAF。秤杆 = 10μm。缩写: CAF = 癌症相关成纤维细胞;CD = 差异化集群;PE-A = 植物红素区域;FITC-A = 荧光素异氰酸酯区域。请单击此处查看此图的较大版本。
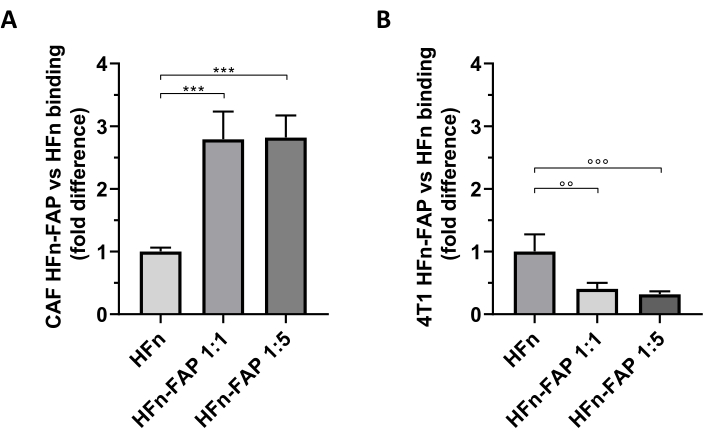
图5:HFn纳米卡在CAF和4T1上的绑定。HFn 纳米穴在荧光标记上 FITC,在两种不同的蛋白质抗体比率(1:1 和 1:5)下使用抗 FAP 抗体片段 (HFn-FAP) 功能,并在 2 小时的 4 °C 下与(A)目标 CAF 和(B) 4T1 细胞一起孵育。绑定通过流细胞测量进行评估。(A) 与裸HFn相比,HFn-FAP与CAF的结合显著增加三倍,相比之下,在4T1细胞中观察到裸HFn的结合性显著提高,而FAP识别不会增强其结合性。结果报告为三个独立实验的平均±标准偏差。p = 0.0003;•p = 0.0021 ;•+p = 0.0008。缩写:CAF® 癌症相关成纤维细胞;FAP = 成纤维细胞激活蛋白;HFn = 人类铁氧体重链的重组变种,用作裸纳米粒子或结合;HFN-FAP – HFn 纳米粒子功能与抗 FAP 抗体的可变部分,在两个 HFn:Fab@FAP 摩尔比,1:1 和 1:5。请单击此处查看此图的较大版本。
| 细胞数(平均±SD) | 提取产量总计(每段) | |
| 切除肿瘤(红细胞切除后) | 1.27 x 108 ± 9.81 x 107 | 100% |
| 切除肿瘤(死细胞切除后) | 3.01 x 106 ± 9.61 x 105 | 2.38% |
| 消耗后鸡尾酒 | 1.15 x 105 ± 4.95 x 104 | 0.11% (3.82%) |
| 浓缩后 | 3.00 x 104 ± 1.2 x 104 | 0.027% (26.09%) |
表1:癌症相关成纤维细胞分离的每一步后细胞总数。
| 细胞分布 (%) | CD90.2= CD45- | CD90.2= CD45| | CD90.2- CD45| | CD90.2- CD45- |
| 切除肿瘤(死细胞切除后) | 1.81 ± 0.98 | 10.78 ± 4.51 | 56.57 ± 14.05 | 28.20 ± 17.57 |
| 消耗后鸡尾酒 | 69.33 ± 16.75 | 0.14 ± 0.13 | 0.55 ± 0.63 | 39.89 ± 30.31 |
| 浓缩后 | 93.14 ± 3.3 | 0.09 ± 0.1 | 0.09 ± 0.08 | 6.69 ± 3.4 |
表2:每次通过癌症相关成纤维细胞分离后,根据CD90.2和CD45的表达方式进行细胞分布。
| 细胞分布 (%) | CD90.2= CD45- | CD90.2= CD45| | CD90.2- CD45| | CD90.2- CD45- |
| 浓缩后(无池) | 75.80 ± 2.9 | 1.49 ± 0.4 | 5.97 ± 1.5 | 16.75 ± 1.1 |
表3:CD90.2和CD45表达细胞在亚最佳癌症相关成纤维细胞分离实验后收集。
讨论
CAF正在成为重塑细胞外基质、促进转移进展和限制药物进入肿瘤位点34的关键角色。然而,由于它们的异质性,它们的作用仍然是有争议的,一些CAF是肿瘤原性的,而其他一些亚型似乎具有肿瘤抑制作用。在这种情况下,他们的隔离可以是极为感兴趣的,以揭示他们备受争议的作用,在癌症的进展,这将具有重要的临床影响12,31。此外,从人类和临床前小鼠肿瘤模型中成功提取CAF也将促进新的CAF靶向药物的开发。本文报告了一种有效分离和培养原发性CAF与乳腺癌的同步临床前模型的方法。根据经验,三个实验步骤主要影响协议的成功。
第一种是快速工作,以避免与列中凝固和减缓细胞排泄的风险相关的细胞悬浮聚合:事实上,当通过列的细胞聚集在一起时,亚最佳隔离过程的概率增加,最终培养物包含"污染物"细胞克隆。第二种是消耗通过后从不同肿瘤中汇集细胞,以保证在最后的浓缩步骤中通过足够的细胞。最后一个关键问题是将提取的细胞电镀在高细胞密度下,很可能从24井板的一口井开始,以促进细胞生长和菌落扩张长达4+5段。如果细胞以低密度播种,它们就会在自由表面扩张并迅速停止复制。
一些研究已经描述了人类和小鼠起源的CAF提取方法,以研究它们在促进癌症发展和侵入性方面的作用。这在许多类型的肿瘤中都做过,包括乳腺癌、黑色素瘤、胆囊癌和胰腺癌35、36、37、38。然而,由于缺乏特定的CAF标记及其异质性,这些过程的结果仍然不尽如人意。
在这里,分离的细胞被用来验证HFn纳米穴的CAF靶向能力,该纳米穴具有抗FAP靶向护身盆功能。CAFs 初级培养物的使用是一个显著优势,它使纳米策略 前体内 的验证具有比在纳米药物优化的这个初步阶段直接 在体内 进行简单且具有成本效益的结合实验。
从这个意义上说,CAF的前 体内 测试可以在 活体 动物实验中先行,允许筛选和选择最有前途的纳米粒子,以最佳定位CAF。此处介绍的 CAF 模型也可用于初步疗效研究,当将纳米粒子加载到活性药物时。动物以后将只用于评估生物分布、药理动力学和疗效研究。
几个CAF靶向纳米药物正在开发中,如用于乳腺癌光动力治疗的铁氧体纳米卡和基于肽的颗粒,以在前列腺癌模型39,40中提供多索鲁比辛。然而,没有多少研究集中在隔离CAF作为细胞平台的纳米药物优化。
此协议有一些限制。首先,这是一个耗时的程序,需要准备和购买几个试剂和材料。其次,由于4T1乳腺肿瘤中CAF的稀缺性,其产量较低。纳米粒子实验应在达到所需细胞数后立即进行,因为初级CAF会衰老,不能在培养中长期维持。总之,这种CAF分离、培养和定性的方法可以成为加速开发新的靶向纳米药物对抗癌症的有力工具。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了意大利协会的支持, 根据 Ig 2017 - id. 20172 项目 - P. i. 科西 · 法比奥。SM承认儿科临床研究中心"罗密欧和恩里卡因弗尼齐",支持她的立场。AB感谢AIRC(ID.20172项目)和米兰大学的研究奖学金。LS 和 MS 博士后和博士奖学金由米兰大学提供支持。
材料
| Name | Company | Catalog Number | Comments |
| ACK Lysing buffer | Lonza | 10-548E | Store at +15° to +30 °C. |
| Alexa Fluor 488 goat anti-human antibody | Immunological Science | IS-20022 | Protect from light. |
| Anti-FAP Fab fragment (3F2) | Creative Biolabs | TAB-024WM-F(E) | |
| BALB/c mice | Charles River | 028BALB/C | 7 weeks old female mice |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | Store at 2-8 °C. |
| CD45 antibody | Miltenyi Biotec | 130-110-796 | FITC-conjugated fluorescent antibody; clone REA 737; Store protected from light at 2–8 °C. |
| CD90.2 antibody | Miltenyi Biotec | 130-102-960 | PE-conjugated fluorescent antibody; clone 30-H12; Store protected from light at 2–8 °C. |
| Cell strainers 70 µm | VWR | 732-2758 | |
| CytoFLEX | Beckman Coulter | laser configuration B4-R2-V0 | |
| Dead cell Removal Kit | Miltenyi Biotec | 130-090-101 | contains 10 mL of Dead Cell Removal MicroBeads; 25 mL of 20× Binding Buffer Stock Solution. Store protected from light at 2−8 °C. |
| D-Luciferin | Caliper | 760504 | reagent for in vivo imaging |
| DMEM High Glucose w/o L-Glutamine w/ Sodium Pyruvate | Euroclone | ECB7501L | Warm at 37 °C in a water bath before use. |
| DMSO | Sigma-Aldrich | D2650 | |
| DPBS w/o Calcium, w/o Magnesium | Euroclone | ECB4004L | Keep at room temperature. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E9884 | |
| Fetal Bovine Serum | Euroclone | ECS0180L | Before use, heat at 56 °C for 30 min to kill all the complement proteins. |
| Fluorescein Istothiocyanate isomer I (FITC) | Sigma-Aldrich | F7250 | Store protected from light at 2–8 °C. |
| GentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | They are used in combination with the gentleMACS Dissociator. |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | Two samples can be processed in parallel. Special protocols have been developed for various tissues. |
| Goat serum | Euroclone | ECS0200D | |
| Ham's F12 w/o L-Glutamine | Euroclone | ECB7502L | Warm at 37 °C in a water bath before use. |
| IVIS Lumina II imaging system | Caliper Life Sciences | This imaging system is easy to use for both fluorescent and bioluminescent imaging in vivo. Equipped with a Living Image Software for analysis | |
| LD columns | Miltenyi Biotec | 130-042-901 | Composed of ferromagnetic spheres, designed for stringent depletion of unwanted cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use |
| L-Glutamine | Euroclone | ECB3000D | 200 mM stock |
| Light/fluorescence microscope equipped with camera | Leica Microsystems | DM IL LED Fluo/ ICC50 W CameraModule | inverted microscope for live cells with camera |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Separation Unit | Miltenyi Biotec | 130-090-976 | Position the magnet on appropriate stand before use. |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MS columns | Miltenyi Biotec | 130-042-201 | Composed of ferromagnetic spheres, designed for positive selection of cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use. |
| Mycoplasma Removal Agent | Euroclone | ECMC210A | Dilute in culture medium 1:100. |
| NaHCO3 | Invitrogen | A10235 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000C | |
| Non essential aminoacids | Euroclone | ECB3054D | |
| Penicillin-Streptomycin | Euroclone | ECB3001D | |
| Recombinant Human apoferritin H-homopolymer (HFn) | Molirom | MLR-P018 | |
| RPMI 1640 w/o L-Glutamine | Euroclone | ECB9006L | Warm at 37 °C in a water bath before use. |
| Tumor-Associated Fibroblast Isolation kit | Miltenyi Biotec | 130-116-474 | Contains 1 mL of Non-Tumor-Associated Fibroblast Depletion Cocktail, mouse; 1 mL of CD90.2 (Tumor-Associated Fibroblast) MicroBeads,mouse. Store protected from light at 2-8 °C. |
| Tumor Dissociation Kit | Miltenyi Biotec | 130-096-730 | Contains lyophilized enzymes (D, R, A) and buffer A; reconstitute enzymes according to the manufacturer's instructions, aliquot and store at - 20 °C. |
| Trypan blue 0.4% | Lonza | 17-942E | dilute 1:1 with a sample of cell suspension before counting the cells |
| TrypLE select | Gibco | 12563-029 | use at room temperature |
| Trypsin-EDTA | Lonza | BE17-161E | Warm at 37 °C in a water bath before use |
| T75 Primo TC flask | Euroclone | ET7076 | |
| Zeba Spin Desalting Columns | Thermo Fisher Scientific | 89890 | 7K MWCO, 2 mL |
| 1.5 mL tubes | Biosigma | CL15.002.0500 | |
| 15 mL tubes | Euroclone | ET5015B | |
| 4T1-luc2 | Caliper | Mouse mammary gland cancer cell line stably transfected with firefly luciferase gene | |
| 50 mL tubes | Euroclone | ET5050B |
参考文献
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nature Medicine. 19 (11), 1423-1437 (2013).
- Velaei, K., Samadi, N., Barazvan, B., Soleimani Rad, J. Tumor microenvironment-mediated chemoresistance in breast cancer. Breast. 30, 92-100 (2016).
- Cheng, J. D., Weiner, L. M., et al. Tumors and their microenvironments: tilling the soil. Commentary re: A. M. Scott et al., A Phase I dose-escalation study of sibrotuzumab in patients with advanced or metastatic fibroblast activation protein-positive cancer. Clinical Cancer Research. 9 (5), 1690-1695 (2003).
- Hui, L., Chen, Y. Tumor microenvironment: Sanctuary of the devil. Cancer Letters. 368 (1), 7-13 (2015).
- Balkwill, F. R., Capasso, M., Hagemann, T. The tumor microenvironment at a glance. Journal of Cell Science. 125, 5591-5596 (2012).
- Chen, X., Song, E. Turning foes to friends: targeting cancer-associated fibroblasts. Nature Review. Drug Discovery. 18 (2), 99-115 (2019).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Seminars in Cell & Developmental Biology. 21 (1), 33-39 (2010).
- LeBleu, V. S., Kalluri, R. A peek into cancer-associated fibroblasts: origins, functions and translational impact. Disease Models & Mechanisms. 11, (2018).
- Li, X. -Y., Hu, S. -Q., Xiao, L. The cancer-associated fibroblasts and drug resistance. European Review for Medical and Pharmacological Sciences. 19 (11), 2112-2119 (2015).
- Luo, H., Tu, G., Liu, Z., Liu, M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Letters. 361 (2), 155-163 (2015).
- Truffi, M., Sorrentino, L., Corsi, F. Fibroblasts in the tumor microenvironment. Advances in Experimental Medicine and Biology. 1234, 15-29 (2020).
- Sugimoto, H., Mundel, T. M., Kieran, M. W., Kalluri, R. Identification of fibroblast heterogeneity in the tumor microenvironment. Cancer Biology & Therapy. 5 (12), 1640-1646 (2006).
- Costa, A., et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell. 33 (3), 463-479 (2018).
- Ishii, G., Ochiai, A., Neri, S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Advances Drug Delivery Reviews. 99, Part B 186-196 (2016).
- Chen, Q., et al. Remodeling the tumor microenvironment with emerging nanotherapeutics. Trends in Pharmacological Sciences. 39 (1), 59-74 (2018).
- Truffi, M., et al. Nano-strategies to target breast cancer-associated fibroblasts: rearranging the tumor microenvironment to achieve antitumor efficacy. International Journal of Molecular Sciences. 20 (6), 1263(2019).
- Tong, R., Langer, R. Nanomedicines Targeting the Tumor Microenvironment. Cancer Journal. 21 (4), 314-321 (2015).
- Kaps, L., Schuppan, D. Targeting cancer associated fibroblasts in liver fibrosis and liver cancer using nanocarriers. Cells. 9 (9), 2027(2020).
- Miao, L., et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors. Cancer Research. 77 (3), 719-731 (2017).
- Kelly, T., Huang, Y., Simms, A. E., Mazur, A. Fibroblast activation protein-α: a key modulator of the microenvironment in multiple pathologies. International Review of Cell and Molecular Biology. 297, 83-116 (2012).
- Brennen, W. N., Isaacs, J. T., Denmeade, S. R. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy. Molecular Cancer Therapeutics. 11 (2), 257-266 (2012).
- Juillerat-Jeanneret, L., Tafelmeyer, P., Golshayan, D. Fibroblast activation protein-α in fibrogenic disorders and cancer: more than a prolyl-specific peptidase. Expert Opinion on Therapeutic Targets. 21, 977-991 (2017).
- Falvo, E., et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin. Nanoscale. 5 (24), 12278-12285 (2013).
- Truffi, M., et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research. 107, 57-65 (2016).
- Cai, Y., et al. Enhanced magnetic resonance imaging and staining of cancer cells using ferrimagnetic H-ferritin nanoparticles with increasing core size. International Journal of Nanomedicine. 10, 2619-2634 (2015).
- Heger, Z., Skalickova, S., Zitka, O., Adam, V., Kizek, R. Apoferritin applications in nanomedicine. Nanomedicine. 9 (14), 2233-2245 (2014).
- Mazzucchelli, S., et al. Nanometronomic treatment of 4T1 breast cancer with nanocaged doxorubicin prevents drug resistance and circumvents cardiotoxicity. Oncotarget. 8 (5), 8383-8396 (2017).
- Yu, Q., et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy. Journal of Controlled Release. 321, 564-575 (2020).
- Mertens, J. C., et al. Therapeutic effects of deleting cancer-associated fibroblasts in cholangiocarcinoma. Cancer Research. 73 (2), 897-907 (2013).
- Kovács, D., et al. Core-shell nanoparticles suppress metastasis and modify the tumour-supportive activity of cancer-associated fibroblasts. Journal of Nanobiotechnology. 18, 18(2020).
- Sharon, Y., Alon, L., Glanz, S., Servais, C., Erez, N. Isolation of normal and cancer-associated fibroblasts from fresh tissues by Fluorescence Activated Cell Sorting (FACS). Journal of Visualized Experiments. (71), e4425(2013).
- Sitia, L., et al. Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax. Cells. 10 (2), 328(2021).
- Bellini, M., et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells. Journal of Controlled Release. 196, 184-196 (2014).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nature Reviews Cancer. 20, 174-186 (2020).
- Dvořánková, B., Lacina, L., Smetana, K. Isolation of normal fibroblasts and their cancer-associated counterparts (CAFs) for biomedical research. Methods in Molecular Biology. 1879, 393-406 (2018).
- Calvo, F., Hooper, S., Sahai, E. Isolation and immortalization of fibroblasts from different tumoral stages. Bio-protocol. 4 (7), 1097(2014).
- Sha, M., et al. Isolation of cancer-associated fibroblasts and its promotion to the progression of intrahepatic cholangiocarcinoma. Cancer Medicine. 7 (9), 4665-4677 (2018).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Zhen, Z., et al. Protein nanocage mediated fibroblast-activation protein targeted photoimmunotherapy to enhance cytotoxic T cell infiltration and tumor control. Nano Letters. 17 (2), 862-869 (2017).
- Ji, T., et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery. Advances Materials. 27 (11), 1865-1873 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。