Method Article
Isolierung primärer krebsseziensässiger Fibroblasten aus einem syngenen murinen Modell von Brustkrebs zur Untersuchung gezielter Nanopartikel
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Arbeit zielt darauf ab, ein Protokoll für die Isolierung und Kultur von primären krebsassoziierten Fibroblasten aus einem syngenen murinen Modell von dreifach negativem Brustkrebs und deren Anwendung für die präklinische Untersuchung neuartiger Nanopartikel bereitzustellen, die auf die Tumormikroumgebung abzielen.
Zusammenfassung
Krebsassoziierte Fibroblasten (CAFs) sind Schlüsselakteure im Kontext der Tumormikroumgebung. Obwohl sie im Vergleich zu Tumorzellen in der Anzahl reduziert sind, regulieren CAFs die Tumorprogression und bieten Schutz vor Antitumorimmunität. Neue Antikrebsstrategien zielen darauf ab, die Tumormikroumgebung durch die Ablation protumorigener CAFs oder die Reprogrammierung von CAFs-Funktionen und deren Aktivierungsstatus umzugestalten. Ein vielversprechender Ansatz ist die Entwicklung von nanoskaligen Abgabemitteln, die in der Lage sind, CAFs anzusprechen und so die spezifische Abgabe von Medikamenten und aktiven Molekülen zu ermöglichen. In diesem Zusammenhang kann ein zelluläres Modell von CAFs ein nützliches Werkzeug für das In-vitro-Screening und die Voruntersuchung solcher Nanoformulierungen sein.
Diese Studie beschreibt die Isolierung und Kultur primärer CAFs aus dem syngenen 4T1-Murinmodell von dreifach negativem Brustkrebs. Magnetische Perlen wurden in einem 2-stufigen Trennprozess verwendet, um CAFs aus dissoziierten Tumoren zu extrahieren. Die Immunphänotypisierungskontrolle wurde nach jeder Passage mittels Durchflusszytometrie durchgeführt, um die Prozessausbeute zu überprüfen. Isolierte CAFs können verwendet werden, um die Targeting-Fähigkeit verschiedener Nanoformulationen zu untersuchen, die zur Bekämpfung der Tumormikroumgebung entwickelt wurden. Fluoreszierend markierte H-Ferritin-Nanocages wurden als Kandidaten-Nanopartikel verwendet, um die Methode einzurichten. Nanopartikel, entweder blank oder konjugiert mit einem Zielliganden, wurden auf ihre Bindung an CAFs analysiert. Die Ergebnisse deuten darauf hin, dass die Ex-vivo-Extraktion von Brust-CAFs ein nützliches System sein könnte, um Nanopartikel für das spezifische Targeting von tumorigenen CAFs zu testen und zu validieren.
Einleitung
In den letzten Jahrzehnten hat sich klargestellt, dass das Abtöten von Tumorzellen in der Regel nicht ausreicht, um Malignität auszurotten, da die Tumormikroumgebung einen Tumorrückfall auslösen und therapeutische Resistenzen induzieren kann1,2. Ein neuartiges Paradigma hat sich dann herauskristallisiert: Tumorstroma anzugreifen, um dem Tumor unterstützende Faktoren zu entziehen und so die Wirksamkeit von Chemotherapeutika zu steigern3,4,5. Insbesondere krebsassoziierte Fibroblasten (CAFs) sind ein interessantes stromales Ziel in vielen soliden Tumoren6,7. CAFs sind eine sehr heterogene Gruppe von Zellen, die mit Krebszellen und Zellen des Immunsystems durch die Sekretion von Wachstumsfaktoren, Zytokinen und Chemokinen interagieren; Aufbau und Umbau der extrazellulären Matrix; und ermöglichen metastasieren Bildung8,9,10,11,12. Je nach Tumortyp zeigen CAFs pro-tumorigene Funktionen, während andere Subtypen von CAFs tumorsuppressive Funktionen zu haben scheinen13,14. Um diese Dichotomie besser zu klären, ist eine gründliche Charakterisierung von CAFs aus primären und metastasierten Tumoren wichtig.
In diesem Zusammenhang hat sich ein aufstrebendes Forschungsgebiet auf die Entwicklung von nanoskaligen Wirkstoffen konzentriert, die CAFs anvisieren und / oder zerstören sollen, indem aktive Moleküle und Medikamente in der Lagesind,die Tumormikroumgebung umzugestalten15,16,17,18. Mehrere Arten von Nanopartikeln wurden entwickelt, um eine CAF-Ablation durch zytotoxische Medikamente zu erreichen, eine CAF-zielgerichtete photodynamische Therapie zu induzieren oder CAFs umzuprogrammieren, indem sie in einen Ruhezustand zurückverwiesen oder eine TNF-bedingte Apoptose-induzierte Ligandenexpression induziert, die die Apoptose benachbarter Krebszellen induziert16,19. Darüber hinaus gibt das Potenzial vieler Nanopartikel, aktiv auf bestimmte biologische Marker abzuzielen, Anlass zur Hoffnung, CAF-Untergruppen auszuwählen, auf die zielgerichtet werden soll. Obwohl seine absolute Spezifität für CAF immer noch in Frage gestellt wird, ist das Fibroblastenaktivierungsprotein (FAP) eines der vielversprechendsten Ziele des protumorigenen Stromas und wird zur Steuerung der Nanodrug-Abgabe genutzt, wodurch der Weg für die Entwicklung von CAF-targetingden Nanotherapeutika20,21,22geebnet wird.
Dieser Artikel beschreibt die Isolierung primärer CAFs aus einem syngenen Modell von murinem Brustkrebs und berichtet über ihre Verwendung bei der Untersuchung der Targeting-Fähigkeit von Nanopartikeln, die zur Erkennung des CAF-Markers FAP entwickelt wurden. Ferritin-Nanokäfige werden als Kandidaten-Nanosysteme verwendet, um die Methode einzurichten, da ihre Spezifität der Abgabe durch die Oberflächenexposition der Zielseifität der Zielsegemälde23,24geformt werden kann. Darüber hinaus haben sich Ferritine erfolgreich als ausgezeichnete biokompatible Shuttles für Antitumoranwendungen erwiesen, die eine schnelle Ansammlung der Nutzlast in der Tumormasse25,26,27auslösen . Bisher haben präklinische Studien von CAF-targeting-Nanosystemen In-vitro-Tests an Fibroblasten-Zelllinien durchgeführt, die in Kultur mit transformierendem Wachstumsfaktor-Beta stimuliert wurden, um die Zellaktivierung und die Expression einiger immunphänotypischer Merkmale von CAFs zu induzieren28,29. Diese Methode wird normalerweise auf immortalisierte Zelllinien (wie NIH3T3, LX-2) angewendet und ist ziemlich schnell und einfach und liefert aktivierte Zellen in wenigen Stunden oder Tagen. Eine Einschränkung besteht darin, dass die In-vitro-Stimulation zwar die Expression einiger Gene induziert, die aktivierten Myofibroblasten zugeschrieben werden, aber nicht alle biologischen Merkmale realer CAFs vollständig rekapitulieren kann, insbesondere ihre Heterogenität in vivo.
Eine weitere Strategie beinhaltet die Extraktion von primären CAFs aus tumorproben von Menschen oder Mäusen30,31. Dadurch wird sichergestellt, dass die CAF-Aktivierung in einem physiologischen Kontext erfolgt und die Heterogenität der CAF-Subpopulationen erhalten bleibt. Entsprechend dem Forschungsziel können CAFs aus verschiedenen Quellen abgeleitet werden und bieten so die Möglichkeit, die zuverlässigste Bedingung zu untersuchen. Das hier berichtete Protokoll wäre wertvoll für Wissenschaftler, die eine vorläufige Bewertung der Funktionalität neuartiger Nanopartikel durchführen möchten, die auf CAFs aus einem murinen Brustkrebsmodell abzielen. Isolierte CAFs wären nützlich, um nanopartikel zu untersuchen, die vielversprechend genug sind, um für die In-vivo-Bewertung in Tiermodellen von Krebs fortzufahren. Dies wird während der ersten Schritte der Nanopartikelproduktion relevant sein und Nanotechnologen zur Verfeinerung des Nanopartikeldesigns antreiben, indem sie hauptsächlich die Strategie der Ligandenimmobilisierung berücksichtigen, um optimale Zieleigenschaften zu erzielen.
Protokoll
1. Etablierung eines syngenen 4T1-Modells für Brustkrebs
HINWEIS: Das vorliegende Protokoll beschreibt die Isolierung primärer CAFs aus einem 4T1-Brusttumor der Maus. Die hier beschriebene Tierstudie wurde vom italienischen Gesundheitsministerium genehmigt (Aut. Nummer 110/2018-PR).
- Tumorzellkultur und Implantation
- Tauen Sie 1 × 106 4T1-luc-Zellen in einem T75-Kolben mit 10 ml Roswell Park Memorial Institute (RPMI) 1640 Medium auf, ergänzt mit 10% fetalem Rinderserum (FBS), 1% Penicillin / Streptomycin (P / S) und 1% L-Glutamin. Fügen Sie Mykoplasmenentfernungsmittel (1:100) in das Kulturmedium hinzu.
HINWEIS: 4T1-luc-Zellen exprimieren stabil Luciferase und können durch Biolumineszenz (BLI) bei richtiger Stimulation mit D-Luciferin visualisiert werden. Dies ermöglicht die In-vivo-Überwachung der Lebensfähigkeit und Proliferation von Tumorzellen bei der Implantation in Mäuse (Abbildung 1). - Halten Sie die Zellen bei 37 °C und 5% CO2 in einer befeuchteten Atmosphäre bis zum Zusammenfluss von ~80%, indem Sie das Medium alle 2 Tage wechseln.
HINWEIS: Setzen Sie die Behandlung mit Mycoplasma-Entfernungsmittel für 1 Woche (~ 2/3 Passagen) vor der Injektion in Mäuse fort, um sicherzustellen, dass die injizierten Zellen mykoplasmenfrei sind. - Am Tag des Eingriffs die Zellen mit 1 ml Trypsin-Ethylendiamintetraessigsäurelösung (EDTA) (Trypsin 1:250) für 5 min bei 37 °C lösen. Stoppen Sie die Trypsinaktivität durch Zugabe von Kulturmedium, zählen Sie die Zellen mit Trypanblau (1:1) und berechnen Sie die Anzahl der Zellen / ml.
- Pipette das Volumen entsprechend 1 × 106 Zellen und Zentrifuge für 5 min bei 400 × g. Gießen Sie den Überstand ab und schalten Sie das Pellet in 1 ml RPMI 1640 Basismedium wieder auf. Halten Sie die Zellen auf Eis, bis sie zur Injektion bereit sind.
HINWEIS: Für jede Maus werden 1 × 105 Zellen benötigt; Rechnen Sie jedoch immer für einen Überschuss von 2 Mäusen (entsprechend 2 × 105 Zellen), um die Spritzenbelastung zu erleichtern. - Rasieren Sie einen Tag vor der Operation das Fell von 8 BALB / c-Mäusen (weiblich, sieben Wochen alt), um den Bereich der Abdominalbrustdrüsen auf der rechten Seite freizulegen. Verwenden Sie einen Elektrorasierer und tragen Sie eine dünne Schicht Enthaarungscreme für 4 minuten auf; Dann waschen Sie die Creme mit Wasser und einem Blatt Papier weg.
- Induzieren Sie die Anästhesie durch kontinuierliche Inhalation von 2% Isoflurangas für ~ 5 min und führen Sie eine subkutane Injektion im Bereich der Abdominalbrummdrüsen mit einer 27 G Tuberkulinspritze durch. Drehen Sie die Nadel nach oben, um subkutan in die Haut einzudringen; Halten Sie dann die Haut nach oben und injizieren Sie langsam 100 μL Zellsuspension (1 × 105 Zellen). Drehen Sie die Nadel leicht um, bevor Sie die Spritze langsam zurückziehen.
HINWEIS: Denken Sie daran, die Zellsuspension 15 Minuten vor der Injektion auf Raumtemperatur zu bringen.
- Tauen Sie 1 × 106 4T1-luc-Zellen in einem T75-Kolben mit 10 ml Roswell Park Memorial Institute (RPMI) 1640 Medium auf, ergänzt mit 10% fetalem Rinderserum (FBS), 1% Penicillin / Streptomycin (P / S) und 1% L-Glutamin. Fügen Sie Mykoplasmenentfernungsmittel (1:100) in das Kulturmedium hinzu.
- Tumorwachstum und Dissektion
- 5 Tage nach der Zellinjektion 150 mg/kg D-Luciferin intraperitoneal (100 μL) 5 min vor der Bildgebung injizieren. Erfassen Sie BLI-Bilder mit einem In-vivo-Bildgebungssystem, das 10 s Belichtung, Medium Binning und f / Stop bei 4 einstellt. Definieren Sie den Lumineszenzbereich des Tumors als Region of Interest (ROI) und quantifizieren Sie das Gesamtsignal im ROI (Photon / sec / m2) mithilfe einer Bildgebungssoftware.
- Wiederholen Sie den Bildvorgang (1.2.1) alle 5 Tage nach der Injektion, um das Tumorwachstum in Bezug auf einen Anstieg des BLI zu überwachen.
- Um das Tumorvolumen zu bestimmen, halten Sie die Maus und legen Sie ihren Bauch frei. Verwenden Sie Messschieber, um die Tumorlänge (L) und -breite (W) einmal pro Woche zu messen. Berechnen Sie das Tumorvolumen (V) mit Gleichung 1.
[V = (L x B2)/2] (1) - Opfern Sie die Tiere 20 Tage nach der Zellinjektion durch zervikale Dislokation, dissoziieren Sie die Tumore mit einer Schere von der Haut und sammeln Sie sie in einer Gewebespeicherlösung (siehe Materialtabelle ).
HINWEIS: Tumorproben können sofort zur Dissoziation in einzelne Zellen (Abschnitt 2) verwendet oder bei 4 °C bis zu 48 h gelagert werden.
2. Tumordissoziation in einzelne Zellen
HINWEIS: Verwenden Sie für die folgenden Schritte sterile Reagenzien und Einwegartikel in einer Laminar-Flow-Haube. Arbeiten Sie mit 4 Tumoren gleichzeitig.
- Legen Sie die Tumorprobe in eine Petrischale und entfernen Sie vorsichtig alle Haut-, Fett- und nekrotischen Bereiche mit Hilfe von Pinzette und Skalpell. Dann reduzieren Sie den Tumor in kleine Stücke von ca. 1-2 mm und übertragen Sie sie in ein Röhrchen (Abbildung 2A).
HINWEIS: 4T1-Tumoren werden während des Wachstums stark nekrotisch, mit einer Tendenz zu Ulzerationen. Es ist wichtig, die nekrotischen Bereiche sorgfältig zu entfernen, um eine Störung von Trümmern bei den nächsten Schritten zu vermeiden. - Bereiten Sie eine Verdauungsmischung für die Tumordissoziation vor: Mischen Sie 2,35 ml RPMI 1640 Medium, 100 μL Enzym D, 50 μL Enzym R und 12,5 μL Enzym A. Tränken Sie die Tumorfragmente in der Lösung und schließen Sie das Röhrchen fest.
HINWEIS: Die angegebenen Volumen der Verdauungsmischung gelten für Tumore bis zu 1 g und können für größere Tumoren entsprechend ihrem Gewicht angepasst werden. 4T1-Tumoren, die 20 Tage lang gewachsen sind, liegen normalerweise in einem Bereich von 0,5-0,8 g. - Drehen Sie die Röhre auf den Kopf und überprüfen Sie, ob alle Tumorstücke im Boden der Röhre in Richtung der Kappe stehen. Befestigen Sie das Röhrchen an einem mechanischen Dissoziator im richtigen Gehäuse und führen Sie ein spezifisches Dissoziationsprogramm durch, das für zähe Tumore entwickelt wurde (siehe Herstelleranleitung).
HINWEIS: Es können spezielle Schläuche erforderlich sein, um in den Dissoziator zu passen. C-Röhren tragen einen Rotor in der Kappe, um die mechanische Dissoziation des Gewebes zu fördern. - Lösen Sie das Röhrchen, halten Sie es kopfüber und inkubieren Sie die Probe bei 37 °C für 40 min unter sanftem Schütteln. Befestigen Sie dann das Röhrchen am Dissoziator im richtigen Gehäuse und führen Sie das folgende spezifische Dissoziationsprogramm für zähe Tumore zweimal aus. Stellen Sie sicher, dass sich am Ende des Verfahrens keine großen Gewebestücke befinden (Abbildung 2B).
HINWEIS: Um den Tumor zu dissoziieren, könnten andere Enzymcocktails verwendet werden, um die extrazelluläre Matrix abzubauen. In diesem Protokoll wurde jedoch ein kommerziell erhältliches Tumordissoziationskit verwendet, das eine optimierte Enzymmischung (Enzyme D, R, A) und einen halbautomatischen Dissoziator enthält, der das Gewebe mechanisch dissoziiert. Diese Kombination gewährleistete einen ordnungsgemäßen Abbau der extrazellulären Matrix zusammen mit der Aufrechterhaltung der Zellintegrität und der Epitope der Zelloberfläche. - Filtern Sie die Probe durch ein 40 μm Zellsieb in einem 50 ml Röhrchen, waschen Sie den Filter mit 10 ml RPMI 1640 Medium und zentrifugieren Sie das Röhrchen für 7 min bei 300 × g. Wenn das Zellpellet rot erscheint, lysieren Sie die Erythrozyten durch Zugabe von 1 ml Ammonium-Chlorid-Kalium (ACK) Lysingpuffer für 5 min bei Raumtemperatur, waschen Sie mit 10 ml RPMI 1640, übertragen Sie die Zellsuspension in einem 15 mL Röhrchen und zentrifugieren Sie erneut.
- Resuspendieren Sie das Pellet in 1 ml PBE-Puffer, der aus phosphatgepufferter Kochsalzlösung (PBS), 0,5% Rinderserumalbumin (BSA) und 2 mM EDTA besteht, und zählen Sie die Zellen mit Trypanblau (1:1). Bei Zellklumpen filtern Sie die Zellsuspension durch ein 70 μm Zellsieb, das zuvor mit PBS getränkt war.
HINWEIS: Besonders wenn Tumore groß sind, ist es wichtig, die Zellzahl zu überprüfen und schließlich jede Tumorprobe in verschiedene Röhrchen mit nicht mehr als 107 Zellen in jedem Röhrchen aufzuteilen, bevor Sie mit Schritt 2.7 fortfahren. - Bereiten Sie den Bindungspuffer zur Entfernung toter Zellen vor, indem Sie die 20-fache Bindungspufferlösung (siehe Materialtabelle)mit sterilem doppelt destilliertem Wasser verdünnen. Waschzellen mit 5 mL 1× Bindungspuffer (Abbildung 2C).
HINWEIS: Halten Sie den Puffer bei 4 °C. - Zentrifugieren Sie für 7 min bei 300 × g und resuspendieren Sie das Zellpellet mit 0,1 ml toter Zellentfernungsmikroben (siehe Materialtabelle). Gut mischen und bei Raumtemperatur 15 min inkubieren.
- Bereiten Sie während der Inkubation mit Perlen einen magnetischen Ständer unter der Haube vor und hängen Sie ferromagnetische Trennsäulen (eine Säule für bis zu10 7 Zellen) mit den Nach unten zeigenden Spitzen darauf. Gleichgewichten Sie die Säulen mit 0,5 mL kaltem 1× Bindungspuffer. Warten Sie, bis die Lösung unter Schwerkraft durchgeflossen ist.
HINWEIS: Es ist wichtig, die Anzahl der Zellen pro Säule nicht zu überschreiten, um das Risiko einer Gerinnung des Säulenbettes und einer Verringerung der Erholungsausbeute zu vermeiden. Wenn Sie mit mehr als 107 Zellen arbeiten, verwenden Sie entweder mehr Spalten entsprechend der Gesamtzahl der Zellen oder verwenden Sie größere Spalten. Passen Sie in solchen Fällen die in den folgenden Schritten beschriebenen Reagenzienvolumina an die vom Hersteller angegebenen an. - Am Ende der Inkubation 400 μL kaltes 1× Bindungspuffer in die Wulst/Zellsuspension geben, das gesamte Volumen auf die Säule laden und das Abwasser (entsprechend nicht markierten Zellen) in einem 15-ml-Röhrchen sammeln.
- Waschen Sie die Säule viermal mit 0,5 ml kaltem 1× Bindungspuffer und sammeln Sie das Gesamteinfluss (entsprechend der Lebendzellfraktion) im selben Röhrchen.
- Zählen Sie die Zellen mit Trypanblau (1:1). Legen Sie 1 × 105 Zellen in zwei Röhrchen für die Fluoreszenzaktivierte Zellsortierung (FACS) und halten Sie sie bis zur Prozessvalidierung bei 4 °C (siehe Schritt 4.1): Verwenden Sie das erste Röhrchen, um die Analyseparameter und die Bereiche der Positivität einzustellen (Kontrollröhrchen) und das andere für die Biomarkeranalyse (Probenröhrchen). Verwenden Sie die verbleibenden Zellen für die CAFs-Extraktion (siehe Abschnitt 3).
HINWEIS: Die Entfernung abgestorbener Zellen ist wichtig, um unspezifische Reaktionen mit den Mikroperlen in Abschnitt 3 zu reduzieren. Um die Ausbeute zu verbessern, vermeiden Sie jedoch die Entfernung abgestorbener Zellen, wenn der Anteil der toten Zellen <20% beträgt.
3. Extraktion von primären CAFs aus Brusttumoren
HINWEIS: Verwenden Sie für Abschnitt 3 das Maus-Tumor-Associated Fibroblast Isolation Kit mit Non-Tumor-Associated Fibroblast Depletion Cocktail und Tumor-Associated Fibroblast Microbeads, die für die magnetische Markierung der Zellen geeignet sind (siehe Materialtabelle).
- Erschöpfung von nicht-krebs-assoziierten Fibroblasten
- Befeuchten Sie ein 70 μm Zellsieb mit PBS und filtern Sie die Zellsuspension, um Klumpen zu entfernen. Dann zentrifugieren Sie die Zellen für 10 min bei 300 × g und saugen den Überstand an.
HINWEIS: Wenn ein einzelner Tumor für Schritt 2.7 in zwei Proben aufgeteilt wurde, bündeln Sie die Zellsuspension zwei mal zwei, bevor Sie mit Schritt 3.1.2 fortfahren. - Resuspendieren Sie das Pellet in 80 μL kaltem PBE-Puffer und fügen Sie 20 μL nicht-tumorassoziierten Fibroblasten-Depletion Cocktail hinzu. Gut vermischen und bei 4 °C 15 min im Dunkeln inkubieren.
- Bereiten Sie während der Inkubation mit Perlen ferromagnetische Depletionssäulen (1 pro Probe) auf einem magnetischen Ständer vor und gleichen Sie die Säulen mit 2 ml kaltem PBE-Puffer aus. Warten Sie, bis die Lösung durchgeflossen ist.
- Am Ende der Inkubation 400 μL kalten PBE-Puffer in die Perlen-/Zellsuspension geben, das gesamte Volumen auf die Säule laden und das Abwasser (entsprechend unmarkierten Zellen) in einem 15-ml-Röhrchen sammeln.
- Waschen Sie die Säule zweimal mit 2 ml kaltem PBE-Puffer und sammeln Sie das gesamte Abwasser im selben Röhrchen. Zentrifuge für 10 min bei 300 × g und resuspend in 0,1 mL kaltem PBE-Puffer.
HINWEIS: Die Erschöpfung von nicht krebsbedingten Fibroblasten reduziert die Gesamtmenge der wiederhergestellten Zellen drastisch. Es ist im Allgemeinen notwendig und empfohlen, Zellsuspensionen aus vier verschiedenen Proben zu poolen, um ein sichtbares Pellet und genügend Zellen für Schritt 3.2 zu erhalten. Dies sorgt für einen optimalen Ertrag. - Legen Sie 20 μL der Zellsuspension in ein FACS-Röhrchen und halten Sie es zur Prozessvalidierung bei 4 °C (siehe Abschnitt 4). Verwenden Sie die verbleibenden Zellen für die CAF-Auswahl (siehe Schritt 3.2).
- Befeuchten Sie ein 70 μm Zellsieb mit PBS und filtern Sie die Zellsuspension, um Klumpen zu entfernen. Dann zentrifugieren Sie die Zellen für 10 min bei 300 × g und saugen den Überstand an.
- Positive Selektion krebs-assoziierter Fibroblasten
- Fügen Sie 20 μL tumorassoziierte Fibroblasten-Mikroperlen zu 80 μL Zellsuspension hinzu. Gut vermischen und bei 4 °C 15 min im Dunkeln inkubieren.
- Bereiten Sie während der Inkubation mit Perlen ferromagnetische Trennsäulen (1 pro Probe) auf einem magnetischen Ständer vor und gleichen Sie die Säulen mit 0,5 ml kaltem PBE-Puffer aus. Warten Sie, bis die Lösung durchgeflossen ist.
- Am Ende der Inkubation 400 μL kalten PBE-Puffer in die Wulst-/Zellsuspension geben, das gesamte Volumen auf die Säule laden und die unmarkierten Zellen in ein 15-ml-Röhrchen fließen lassen.
- Waschen Sie die Säule dreimal mit 0,5 ml kaltem PBE-Puffer und sammeln Sie das gesamte Abwasser im selben Röhrchen.
HINWEIS: Der Durchfluss enthält unmarkierte CD90.2-negative Zellen, die als nicht krebsindiente Fibroblasten verworfen werden können. - Entfernen Sie die Säule vom Magneten und legen Sie sie in ein 1,5-ml-Rohr. Fügen Sie 1 ml kaltes PBE auf die Säule hinzu und drücken Sie den Kolben sofort in die Säule, um die Zellen auszuspülen.
- Zentrifuge für 10 min bei 400 × g und Resuspend in 0,1 ml kaltem PBE-Puffer. Legen Sie 20 μL Zellsuspension in ein FACS-Röhrchen und halten Sie es zur Prozessvalidierung bei 4 °C (siehe Abschnitt 4).
HINWEIS: Nach dem Zentrifugieren kann das Pellet kaum sichtbar sein, besonders wenn die ursprünglichen Tumoren klein sind. Verwenden Sie konische Bodenzentrifugenröhrchen und achten Sie darauf, dass beim Anstreben des Überstands keine Zellen verloren gehen. - Verdünnen Sie die verbleibenden Zellen in einem geeigneten Volumen von Dulbeccos Modified Eagle's Medium (DMEM) / Ham's F-12, ergänzt mit 15% FBS, 2 mM L-Glutamin, 1% P / S und 1% nicht essentiellen Aminosäuren, und säen Sie die Zellen in einer Gewebekulturplatte.
- Überprüfen Sie die Zelldichte unter einem Mikroskop und legen Sie die Platte in einen Inkubator bei 37 °C und 5% CO2, damit die Zellen anhaften und wachsen können.
HINWEIS: Wenn die Zellen zu dicht sind, teilen Sie die Zellsuspension sofort in zwei Vertiefungen der Gewebekulturplatte auf, bevor Sie die Platte in den Inkubator legen.
4. Prozessvalidierung
- Durchflusszytometrie
HINWEIS: Abschnitt 4.1 erfordert keine sterilen Bedingungen und kann außerhalb der laminaren Motorhaube durchgeführt werden. Führen Sie Abschnitt 4.1 parallel für Proben durch, die in Schritt 2.11 (dissoziierter Tumor), Schritt 3.1.6 (nach Erschöpfung nicht krebsassoziierter Fibroblasten) und Schritt 3.2.6 (nach Anreicherung krebsassoziierter Fibroblasten) entnommen wurden.- Zentrifugieren Sie die in den Schritten 2.11, 3.1.6 und 3.2.6 vorbereiteten FACS-Röhrchen für 10 min bei 300 × g. Verwerfen Sie den Überstand.
HINWEIS: Bereiten Sie mindestens ein zusätzliches Röhrchen vor, das ungefärbte Zellen enthält, die als Kontrolle fungieren, um die Parameter für die Analyse festzulegen. - In Probenröhrchen die Zellen in 88 μL PBE resuspendieren und 2 μL Anti-CD45-Antikörper hinzufügen, der mit Fluoresceinisothiocyanat konjugiert ist (FITC, 1:50 Verdünnung, gemäß den Anweisungen des Herstellers) und 10 μL Anti-CD90.2-Antikörper, konjugiert mit Phycoerythrin (PE, 1:10 Verdünnung, gemäß den Anweisungen des Herstellers). Gründlich mischen und 10 min bei 4 °C im Dunkeln inkubieren. Im Steuerröhrchen (ungefärbt) werden die Zellen in 100 μL PBE resuspendiert. 10 Minuten bei 4 °C im Dunkeln inkubieren, um das Verfahren für antikörpergefärbte Zellen zu replizieren.
HINWEIS: Temperatur und Zeitpunkt der Inkubation müssen sorgfältig überprüft werden, da eine Variation solcher Variablen zu einer schlechten oder unspezifischen Färbung führen und somit die Ergebnisse verändern kann. - Führen Sie nach Abschluss des Inkubationsschritts eine Wäsche durch, indem Sie 1 ml PBE hinzufügen. Zentrifuge für 10 min bei 300 x g. Verwerfen Sie den Überstand.
- Resuspend Zellen (alle Röhrchen) in 500 μL PBS.
- Gut mischen und mit der Durchflusszytometrie-Analyse fortfahren. Stellen Sie die Kanäle ein, um die Fluoreszenz der Antikörper (z. B. FITC und PE) zu messen.
- Wählen Sie aus dem Steuerrohr alle lebensfähigen Zellen aus, indem Sie ein erstes Gate (P1) im Diagramm Vorwärts- und Seitenstreuung (FSC vs. SSC) zeichnen. Legen Sie innerhalb von P1 ein zweites Gate (P2) fest, das nur aus einzelnen Zellen besteht.
- Setzen Sie mit den spezifischen Fluoreszenzkanälen der Antikörper (z. B. FITC und PE) die richtigen Tore, um positiv gefärbte Zellen zu erkennen.
- Starten Sie die Analyse und zeichnen Sie mindestens 10.000 Ereignisse in P2 auf. Lesen Sie Signale von beiden Kanälen gleichzeitig.
HINWEIS: Wenn die Gesamtzahl der Zellen geringer ist als erwartet, könnte es vorzuziehen sein, die gesamte Röhre zu lesen. - (OPTIONAL) Wenn eine weitere Färbung mit zusätzlichen Antikörpern/Fluorophoren programmiert ist, legen Sie vor Beginn der Analyse eine geeignete Kompensationsmatrix fest.
- Zentrifugieren Sie die in den Schritten 2.11, 3.1.6 und 3.2.6 vorbereiteten FACS-Röhrchen für 10 min bei 300 × g. Verwerfen Sie den Überstand.
- Überwachung der Zellmorphologie und -merkmale
HINWEIS: Nach der Aussaat müssen die Zellen unter sterilen Bedingungen gehandhabt werden.- Visualisieren Sie am Tag nach der Aussaat die Zellen unter einem optischen Mikroskop, um die Zelladhäsion und Morphologie zu überprüfen. Saugen Sie den Überstand an und ersetzen Sie ihn durch frisches Medium.
HINWEIS: CAFs sind große spindelförmige Zellen, die leicht von der epithelartigen Struktur von 4T1-Tumorzellen unterschieden werden können. - Halten Sie die Zellen bei 37 °C und 5% CO2 in einer befeuchteten Atmosphäre und wechseln Sie das Medium alle 2 Tage.
- Wenn die Zellen ~ 80% Konfluenz erreichen (ca. 4-6 Tage nach der Aussaat), lösen Sie die Zellen mit TrypLE Select-Lösung (siehe Materialtabelle)für 5 minuten bei Raumtemperatur. Frisches Medium (4:1) hinzufügen, die Zellsuspension bei 400 × g für 5 min zentrifugieren und das Pellet in frischem Medium wieder aufschnurnen.
- Teilen Sie die Zellen 1:2 und erweitern Sie die Kultur, bis die für das Experiment benötigte Anzahl von Zellen erhalten ist.
- Überprüfen Sie bei jeder Passage die Zellmorphologie und das Zellwachstum unter einem optischen Mikroskop. Wenn die Zellmorphologie nicht homogen ist (z. B. Klone kleiner runder Zellen, die in Kultur vorkommen), analysieren Sie eine Zellprobe mittels Durchflusszytometrie wie in Abschnitt 4.1 beschrieben. Wenn homogen, fahren Sie mit Schritt 4.2.7 fort.
HINWEIS: Veränderungen in der Zellmorphologie können auf eine Kontamination durch nicht krebsbezogene Fibroblasten hinweisen, die entfernt werden müssen, um die Reinheit der Kultur zu gewährleisten. - Analysieren Sie die Ergebnisse der Durchflusszytometrie und gehen Sie nach einem der folgenden Szenarien vor: (i) Wenn eine Kontamination von CD90.2-/CD45-Zellen auftritt, sammeln Sie alle Zellen und wiederholen Sie die positive Selektion, indem Sie Schritt 3.2 befolgen; (ii) wenn auch eine Kontamination von CD45+-Zellen auftritt, alle Zellen sammeln und die Erschöpfung in Schritt 3.1 wiederholen; (iii) wenn keine Kontamination auftritt (nur CD90.2+/CD45-Zellen sind vorhanden), die Zellen in Kultur halten und direkt mit 4.2.7 fortfahren.
HINWEIS: Da die Wiederholung des Erschöpfungsprozesses mit Mikroperlen die Zellerholung reduziert, wird dies nur empfohlen, wenn die Zellen nicht sofort verwendet werden müssen. - Zählen Sie die Zellen mit Trypanblau (1:1), legen Sie 5 × 105 Zellen in zwei FACS-Röhrchen und zentrifugieren Sie 10 Minuten bei 300 × g. Entsorgen Sie den Überstand und resuspendieren Sie das Pellet in 0,5 ml Sperrpuffer (PBS ergänzt mit 2% BSA, 2% Ziegenserum) für 15 min bei Raumtemperatur.
HINWEIS: Ein Röhrchen dient als Kontrolle, das nur aus nicht gefärbten Zellen besteht, während Zellen im zweiten Röhrchen für die Durchflusszytometrie-Analyse gefärbt werden. - Zentrifuge für 10 min bei 300 × g, den Überstand entsorgen und in 99 μL Blockierpuffer wieder auffüllen. 1 μg Anti-FAP-Antikörper in das Probenröhrchen und 1 ml Blockierpuffer in das Kontrollröhrchen geben. Gründlich mischen und 15 min bei Raumtemperatur inkubieren.
HINWEIS: FAP ist ein Oberflächenmarker für reaktives Tumorstroma und kann zur Identifizierung und Charakterisierung von CAFs verwendet werden. - Dreimal mit PBS waschen, zentrifugieren und mit dem entsprechenden sekundären Antikörper, konjugiert mit einem fluoreszierenden Farbstoff (1 μg) im Sperrpuffer, für 15 min bei Raumtemperatur inkubieren.
- Dreimal mit PBS waschen und mittels Durchflusszytometrie analysieren (schritte 4.1.5 bis 4.1.7, indem Sie den entsprechenden Kanal zum Nachweis des verwendeten Fluorophors einstellen). Verwenden Sie dann die Zellen für Experimente (Schritt 5.2).
- (OPTIONAL) Gefrieren Sie eine Zellprobe in 1 ml 90% FBS und 10% Dimethylsulfoxid (DMSO); bei -80 °C zur weiteren Verwendung lagern.
- Visualisieren Sie am Tag nach der Aussaat die Zellen unter einem optischen Mikroskop, um die Zelladhäsion und Morphologie zu überprüfen. Saugen Sie den Überstand an und ersetzen Sie ihn durch frisches Medium.
5. CAFs, die auf technisch hergestellte Ferritin-Nanopartikel abzielen
HINWEIS: Eine rekombinante Variante der schweren Ferritinkette (HFn) wurde als blankes Nanopartikel verwendet oder mit Zielteilen konjugiert. Hier wurden HFn-Nanopartikel, die mit dem variablen Anteil eines Anti-FAP-Antikörpers (Fab@FAP) funktionalisiert wurden, vom NanoBioLab der Universität Mailand-Bicocca bei zwei HFn:Fab@FAP Molarenverhältnissen, 1:1 und 1:5, nach einem zuvor beschriebenen Protokoll32hergestellt.
- Fluoreszierende Markierung von HFn-Nanopartikeln
HINWEIS: Sowohl blanke als auch funktionalisierte HFn-Nanocages werden mit FITC fluoreszierend markiert.- Lösen Sie das FITC-Pulver in 99% Ethanol auf, um eine Konzentration von 2 mg/ml zu erhalten.
HINWEIS: Diese Lösung sollte frisch zubereitet werden. - 50 μL der hergestellten Lösung (200 μg FITC) pro 1 mg Protein (d. h. 100 μL HFn bei 10 mg/ml) werden inkubiert. Fügen Sie 50 μL 1 M Natriumbicarbonat (NaHCO3)hinzu und stellen Sie das Volumen auf 500 μL mit 0,1 M NaHCO3ein.
HINWEIS: Skalieren Sie die Volumina entsprechend den experimentellen Anforderungen. - Inkubieren Sie das Reaktionsgemisch bei Raumtemperatur, im Dunkeln und unter kontinuierlichem Rühren für 1 h.
- Entfernen Sie den Überschuss an FITC aus dem Konjugat durch Gelfiltration mit einer Spin-Entsalzungssäule (7 kDa MWCO).
- Beurteilen Sie die Konzentration des zurückgewonnenen markierten Proteins mit einem Spektralphotometer. Schätzen Sie die Mengen an Protein und Farbstoff, indem Sie die Absorption bei 280 nm bzw. bei 488 nm messen.
- Lösen Sie das FITC-Pulver in 99% Ethanol auf, um eine Konzentration von 2 mg/ml zu erhalten.
- Bindung von HFn-Nanopartikeln an CAFs
HINWEIS: Verwenden Sie CAFs aus den Abschnitten 4–5 in Kultur.- 5 × 105 Zellen in jedes FACS-Röhrchen geben, 10 min bei 300 × g zentrifugieren und in 0,5 ml PBS resuspendieren, 0,3% BSA ergänzt mit 0,1 mg/ml der verschiedenen Zubereitungen von Nanopartikeln (blankes HFn, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5), die zuvor mit FITC markiert waren.
HINWEIS: Führen Sie jede Bedingung in dreifacher Ausfertigung aus. Bereiten Sie ein zusätzliches Röhrchen als unmarkierte Kontrollprobe vor, der keine Nanopartikel zugesetzt werden. - 2 h bei 4 °C im Dunkeln inkubieren, zentrifugieren und dreimal in PBS waschen.
- Resuspend Zellen mit 0,5 ml PBS, gut mischen und durch Durchflusszytometrie analysieren. Stellen Sie die Kanäle ein, um die Fluoreszenz von FITC zu messen.
- Nachdem Sie auf lebenden Einzelzellen gating haben, erwerben Sie 20.000 Ereignisse. Verwenden Sie das unmarkierte Kontrollröhrchen, um das Gatter der FITC-Positivität einzustellen und den Prozentsatz der FITC+-Ereignisse (entsprechend der Nanopartikelbindung) zu erhalten.
- 5 × 105 Zellen in jedes FACS-Röhrchen geben, 10 min bei 300 × g zentrifugieren und in 0,5 ml PBS resuspendieren, 0,3% BSA ergänzt mit 0,1 mg/ml der verschiedenen Zubereitungen von Nanopartikeln (blankes HFn, HFn-Fab@FAP 1:1, HFn-Fab@FAP 1:5), die zuvor mit FITC markiert waren.
6. Statistische Analyse und experimentelle Replikate
- Tiere
- Führen Sie drei unabhängige Experimente zum Tumorwachstum und zur CAFs-Isolierung mit 8 Tieren pro Einzelexperiment durch, wie in 1.1.5 beschrieben. Um die Isolationsausbeute der CAFs zu optimieren, teilen Sie die herausgeschnittenen Gewebe in Untergruppen (n=4) auf und verarbeiten sie gemäß den in Abschnitt 2 beschriebenen Schritten.
- HFn-Interaktion mit Zellen
- Bewerten Sie die Interaktion von funktionalisiertem und nicht funktionalisiertem HFn mit Ziel- und Nicht-Zielzellen (CAFs bzw. 4T1) in Bezug auf den Prozentsatz positiv gefärbter Zellen durch fluoreszierend markierte Nanokäfige. Melden Sie die Ergebnisse als durchschnittliche ± Standardabweichung von drei unabhängigen Experimenten.
- Statistische Analyse
- Um die statistische Signifikanz in Zellbindungsexperimenten mit HFn und HFn-FAP zu berechnen, verwenden Sie den gewöhnlichen Einweg-ANOVA-Test.
Ergebnisse
In-vivo-Modell-Setup für optimale CAFs-Isolierung
Die Injektion von 105 4T1-luc-Zellen in das Brustfettpolster weiblicher BALB/c-Mäuse führt 5 Tage nach der Implantation zum Wachstum einer nachweisbaren Tumormasse. Durch die Messung des Tumorvolumens durch Messschieber und der Tumorzelllebensfähigkeit durch BLI wurde das Tumorwachstum einen Monat nach der Implantation überwacht. Um ein Opferfenster zu finden, das für die CAFs-Isolierung ausreichend ist, wurde ein optimaler Kompromiss zwischen höherer Tumorgröße und BLI auf der einen Seite und einer auftretenden Tumorulzeration und Nekrose auf der anderen Seite gesucht (Abbildung 1). Da ein nekrotischer Kern 20 Tage nach der Implantation erscheint und sich nach 25 und 30 Tagen vergrößert (wie durch BLI-Bilder in Abbildung 1Cdokumentiert), wurde Tag 20 als Zeitpunkt für die Optimierung der Zellerholung nach dem Isolationsprozess festgelegt. Auch nach sorgfältiger Entfernung aller sichtbaren nekrotischen Bereiche während der ersten Schritte der Tumorbehandlung ex vivowurde am Ende der Dissoziation in einzelne Zellen ein hoher Prozentsatz toter Zellen gefunden (Tabelle 1). Da dieser Prozentsatz relevant sein kann, insbesondere bei der Zunahme der Tumorgröße, ist bei der Arbeit mit dem 4T1-Modell immer eine Entfernung abgestorbener Zellen erforderlich.
Optimierung des Isolationsverfahrens, der Kultur und der Charakterisierung von CAFs
Zwei weitere Passagen werden benötigt, um die Population von CAFs (CD90.2+ CD45-) aus dem Panel der gesammelten lebensfähigen Zellen zu isolieren: die Erschöpfung von nicht-tumorassoziierten Fibroblasten und die Anreicherung von tumorassoziierten Fibroblasten (Abbildung 2). Der Depletion Bead Cocktail entfernt effizient CD45+ Zellen (67,35% bzw. 0,69% der Gesamtzellen vor und nach der Depletion, Tabelle 2)und wurde immer verwendet, um einen einzigen Tumor in jeder Säule zu verarbeiten. Wie in Tabelle 1gezeigt, sank die Anzahl der eluierten Zellen nach dem Erschöpfungsschritt von durchschnittlich 3 ×10 6 auf 1 ×10 5. Aufgrund dieser massiven Abnahme der Gesamtzellzahl ist es praktisch, die gesammelten Zellen von mindestens 2 bis maximal 4 Tumoren in einem einzigen Röhrchen zu bündeln, bevor mit dem Anreicherungsschritt fortgefahren wird. Auf diese Weise wurde eine ausreichende Anzahl von Zellen für die Inkubation mit tumorassoziierten Fibroblastenperlen erhalten und durch eine einzige Trennsäule geleitet, um einen endgültigen Durchschnitt von 93% der CD90.2+ CD45-Zellen zu erhalten (Tabelle 2).
Einmal auf Gewebekulturplatten ausgesät, befestigten sich diese zellen wieder am Kunststoff und zeigten eine große spindelförmige Morphologie, die typisch für Fibroblasten ist (Abbildung 3A, B) und sich von 4T1-Tumorzellen unterscheidet ( Abbildung3D). Das Nichtpoolen von Tumoren nach der Erschöpfung führt dazu, dass die zelluläre Ausbeute mit tumorassoziierten Fibroblasten-Mikroperlen zu niedrig ist, um eine Kultur aufzubauen. In anderen Fällen, wenn die Dauer und Temperatur der Inkubationen mit Mikroperlen nicht sorgfältig eingehalten werden, kann eine unspezifische Bindung auftreten. In solchen Fällen waren die Anreicherungsschritte weniger effizient und es wurden höhere Prozentsätze von CD90.2- CD45+ und CD90.2- CD45- Zellen zusammen mit den CD90.2+ CAFs (5,97 ± 1,5 bzw. 16,75 ± 1,1) wiederhergestellt (Abbildung 4 und Tabelle 3). Diese Kontaminantenzellen waren wahrscheinlich für das Vorhandensein kleiner Klone mit unterschiedlicher Morphologie in Kultur verantwortlich (Abbildung 4B, schwarze Pfeilspitzen), die schneller wuchsen als CAFs und sich gegenüber der primären CAF-Kultur durchsetzten (Abbildung 4C). Diese suboptimalen Ergebnisse bestätigten, wie wichtig es ist, sowohl die CD90.2- und CD45-Expression als auch die Zellmorphologie am Ende des Anreicherungsprozesses und während des Zellwachstums in Kultur immer zu überprüfen.
Einsatz isolierter Zellen zur Bewertung des CAF-Targeting-Potenzials von technisch hergestellten Nanorugs
Die frisch isolierten CAFs können für verschiedene Anwendungen eingesetzt werden, die von der Grundlagenforschung bis hin zu pharmakologischen Studien reichen. Ziel dieser Gruppe ist es, HFn-Nanocages zu entwickeln, die speziell auf CAFs abzielen können. HFn wurde mit einem spezifischen Anti-FAP-Antikörperfragment (HFn-FAP) bei zwei verschiedenen Protein:Antikörper-Verhältnissen (ein niedrigeres 1:1 und ein höheres 1:5) funktionalisiert und ihre Bindung mit CAFs getestet. Da FAP als Oberflächenbiomarker protumorigener CAFs verwendet wurde, war es von grundlegender Bedeutung, die FAP-Expression auf isolierten CAFs zu überprüfen (Abbildung 3C). Der FAP-Ausdruck wurde über 5 Passagen in der Kultur befolgt, um zu bestätigen, dass die primäre CAF-Kultur ihre ursprünglichen Eigenschaften beibehielt.
Es wurde festgestellt, dass die FAP-Funktionalisierung auf HFn zu einer signifikanten Verschiebung in Richtung CAF-Targeting im Vergleich zu nacktem HFn beiträgt, und die geringere Menge an Antikörpern (1:1) reichte aus, um diesen Effekt zu beobachten (Abbildung 5A). Dies wurde jedoch nicht bei den Tumor-4T1-Zellen beobachtet, die zum Aufbau des In-vivo-Tumormodells verwendet wurden, wobei nacktes HFn eine höhere Bindung aufwies als funktionalisiertes HFn (Abbildung 5B). Dies war höchstwahrscheinlich auf das Fehlen einer FAP-Überexpression in 4T1-Zellen und die bevorzugte Interaktion von HFn mit TfR1 zurückzuführen, die die HFn-Aufnahme in Zellen reguliert, wie von dieser Gruppe27,33weithin berichtet . Diese Ergebnisse bestätigen die Nützlichkeit der Verwendung von Primärkulturen von Brust-CAFs, um die Targeting-Fähigkeit von Nanopartikeln, die zur Bekämpfung der Tumormikroumgebung entwickelt wurden, vorläufig zu screenen.
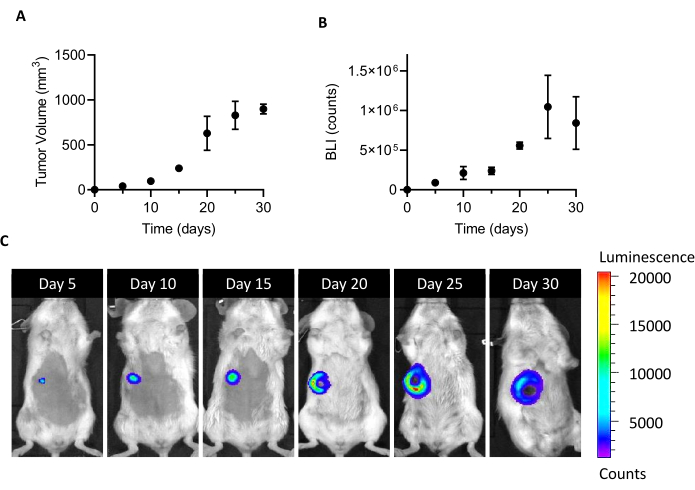
Abbildung 1: Etablierung des 4T1-Tumormodells. Zellen (105 Zellen/Maus) wurden in das Brustfettpolster injiziert. Das Tumorwachstum wurde an den Tagen 5, 10, 15, 20, 25 und 30 nach der Implantation (A) durch Messung des Tumorvolumens mit Messschiebern und (B) durch Biolumineszenzbildgebung verfolgt. Tumorvolumina und BLI werden alsmm3 bzw. Anzahl ausgedrückt. Die Ergebnisse werden als durchschnittliche ± SEM (n=6) angegeben. (C) BLI repräsentative Bilder, die 5, 10, 15, 20, 25 und 30 Tage nach der Zellimplantation erhalten wurden, bestätigen das Tumorwachstum bis zum 25. Tag, wenn es ein Plateau zu erreichen scheint. Zum letzten Zeitpunkt der Analyse (30 Tage) steigt der BLI im Vergleich zu Tag 25 nicht an. Ab Tag 20 werden Bereiche der Nekrose und Ulzeration im zentralen Teil des Tumors sichtbar. Farbskala: Min = 1.194, Max = 20.462. Abkürzungen: BLI = bioluminescence imaging; SEM = Standardfehler des Mittelwerts. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
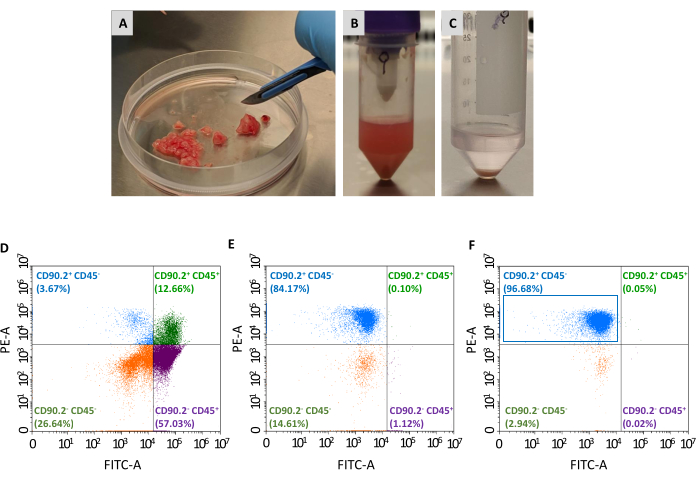
Abbildung 2: Tumorprobenvorbereitung und Durchflusszytometrie charakterisierung isolierter CAFs. Tumore wurden herausgeschnitten und mit Hilfe eines Skalpells in(A)kleine Stücke von etwa 1–2 mm reduziert; (B) Einzelzellsuspension nach Gewebeverdauung und mechanischer Dissoziation eines herausgeschnittenen Tumors; (C) Zellpellet, das nach Lyse der roten Blutkörperchen gewonnen wird; (D) Durchflusszytometrie-Analyse der CD45- und CD90.2-Expression in Zellen, die nach Entfernung von roten Blutkörperchen und toten Zellen erhalten wurden, (E) nach Erschöpfung von nicht krebs-assoziierten Fibroblasten und (F) nach Anreicherung von krebs-assoziierten Fibroblasten, wobei die Mehrheit der Zellen CD90.2+ CD45- (blaues Rechteck) sind. Abkürzungen: CAFs= krebsintezidierte Fibroblasten; CD = Cluster der Differenzierung; PE-A = Fläche von Phycoerythrin; FITC-A = Bereiche von Fluoresceinisothiocyanat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
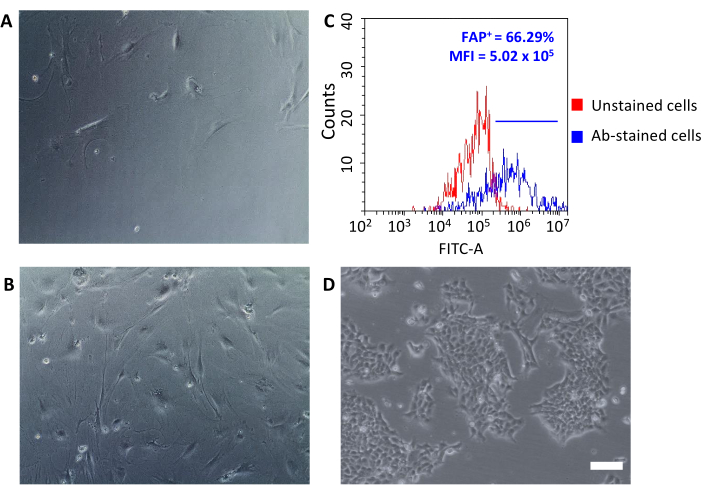
Abbildung 3: Morphologische Analyse der CAF-s- und FAP-Expression. (A, B) Die Morphologie der CAFs wurde in allen Passagen der Kultur durch optische Mikroskopie (unterschiedliche Konfluenzniveaus an Passage 2 und Passage 5) überprüft und mit (D) 4T1-Tumorzellen verglichen; Skala Riegel = 10 μm. (C) Die Expression des Fibroblastenaktivierungsproteins (FAP) wurde am Ende des Isolationsprozesses an den gesammelten CD90.2+ CD45-Zellen mittels Durchflusszytometrie bewertet, um ihre molekularen Eigenschaften zu bestätigen. Für nicht gefärbte Kontrollzellen wurde eine Fluoreszenzschwelle festgelegt (rote Grafik), um die mittlere Fluoreszenzintensität und den Prozentsatz positiver Zellen (FAP+)unter antikörpergefärbten Zellen zu quantifizieren (blaue Grafik). Abkürzungen: CAFs= krebsintezidierte Fibroblasten; FAP = Fibroblasten-Aktivierungsprotein; CD = Cluster der Differenzierung; MFI = mittlere Fluoreszenzintensität; Ab = Antikörper; FITC-A = Fläche von Fluoresceinisothiocyanat; FAP+ = FAP-positive Zellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Beispiel für einen suboptimalen CAFs-Isolationsprozess. (A) Die Auswertung der Durchflusszytometrie nach dem letzten Isolationsschritt ergab das Vorhandensein von cd90.2- CD45+ und CD90.2- CD45- Zellen. (B) Diese Zellen können als Klone mit kleiner runder Morphologie bei der Aussaat (schwarze Pfeilspitzen und Einschub in der unteren linken Ecke des Panels) gesehen werden, die (C) nach der dritten Passage in Kultur gegenüber CAFs vorherrschten. Maßstabsbalken = 10 μm. Abkürzungen: CAF = krebs-assoziierter Fibroblast; CD = Cluster der Differenzierung; PE-A = Fläche von Phycoerythrin; FITC-A = Bereiche von Fluoresceinisothiocyanat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
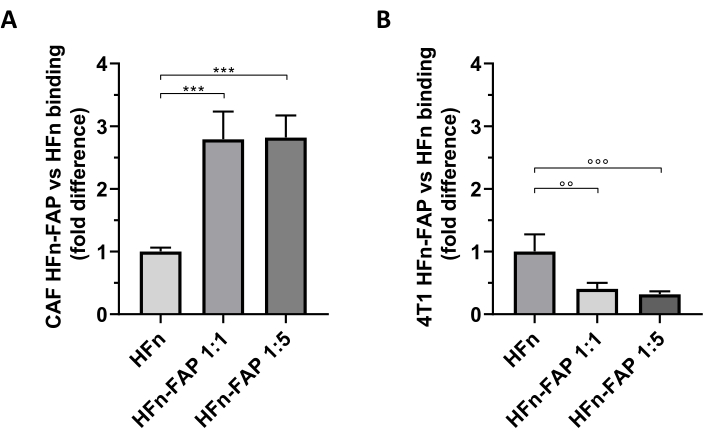
Abbildung 5: Bindung von HFn-Nanocages an CAFs und 4T1. HFn-Nanocages wurden fluoreszierend mit FITC markiert, mit einem Anti-FAP-Antikörperfragment (HFn-FAP) bei zwei verschiedenen Protein-Antikörper-Verhältnissen (1:1 und 1:5) funktionalisiert und mit (A) Ziel-CAFs und (B) 4T1-Zellen bei 4 °C für 2 h inkubiert. Die Bindung wurde mittels Durchflusszytometrie ausgewertet. (A) Die HFn-FAP-Bindung mit CAFs ist bei beiden Antikörperfragmentkonzentrationen im Vergleich zu nacktem HFn signifikant um das Dreifache erhöht. (B) Im Gegensatz dazu wurde eine signifikant höhere Bindung von nacktem HFn in 4T1-Zellen beobachtet, wo die Bindung nicht durch FAP-Erkennung verstärkt wird. Die Ergebnisse werden als durchschnittliche ± Standardabweichung von drei unabhängigen Experimenten angegeben. p = 0,0003; °° p = 0,0021 ; °°° p = 0,0008. Abkürzungen: CAFs= krebsintezidierte Fibroblasten; FAP = Fibroblasten-Aktivierungsprotein; HFn = rekombinante Variante der schweren Ferritinkette des Menschen, die als blankes Nanopartikel oder konjugiert verwendet wird; HFN-FAP = HFn-Nanopartikel, funktionalisiert mit dem variablen Anteil eines Anti-FAP-Antikörpers, der bei zwei HFn:Fab@FAP Molarenverhältnissen, 1:1 und 1:5, hergestellt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Zellennummer (durchschnittliche ± SD) | Extraktionsertrag Gesamt (pro Durchgang) | |
| Herausgeschnittener Tumor (Entfernung roter Blutkörperchen) | 1,27 x 108 ± 9,81 x 107 | 100% |
| Herausgeschnittener Tumor (Entfernung nach toter Zelle) | 3,01 x 106 ± 9,61 x 105 | 2.38% |
| Cocktail nach der Erschöpfung | 1,15 x 105 ± 4,95 x 104 | 0.11% (3.82%) |
| Nachanreicherung | 3,00 x 104 ± 1,2 x 104 | 0.027% (26.09%) |
Tabelle 1: Gesamtzellzahl nach jedem Schritt der Isolierung von krebsinseziierten Fibroblasten.
| Zellverteilung (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| Herausgeschnittener Tumor (Entfernung nach toter Zelle) | 1,81 ± 0,98 | 10,78 ± 4,51 | 56.57 ± 14.05 | 28.20 ± 17.57 Uhr |
| Cocktail nach der Erschöpfung | 69,33 ± 16,75 | 0,14 ± 0,13 | 0,55 ± 0,63 | 39.89 ± 30.31 |
| Nachanreicherung | 93.14 ± 3.3 | 0,09 ± 0,1 | 0,09 ± 0,08 | 6.69 ± 3.4 |
Tabelle 2: Zellverteilung nach Expression von CD90.2 und CD45 nach jeder Passage der Isolierung von krebsinteziierten Fibroblasten.
| Zellverteilung (%) | CD90.2+ CD45- | CD90.2+ CD45+ | CD90.2- CD45+ | CD90.2- CD45- |
| Post Enrichment (kein Pooling) | 75,80 ± 2,9 | 1,49 ± 0,4 | 5,97 ± 1,5 | 16.75 ± 1.1 |
Tabelle 3: CD90.2- und CD45-Expression von Zellen, die nach einem suboptimalen krebsinteziierten Fibroblasten-Isolationsexperiment gesammelt wurden.
Diskussion
CAFs entwickeln sich zu Schlüsselakteuren bei der Umgestaltung der extrazellulären Matrix, der Förderung der Metastasenprogression und der Begrenzung des Arzneimittelzugangs zur Tumorstelle34. Aufgrund ihrer Heterogenität sind ihre Rollen jedoch immer noch umstritten - einige CAFs sind tumorigen, während einige andere Subtypen eine tumorunterdrückende Rolle zu spielen scheinen. In diesem Zusammenhang kann ihre Isolation von extremem Interesse sein, um mehr Licht auf ihre viel diskutierte Rolle bei der Krebsprogression zu werfen, die wichtige klinische Auswirkungen haben wird12,31. Darüber hinaus würde eine erfolgreiche CAF-Extraktion aus menschlichen und präklinischen Maustumormodellen auch die Entwicklung neuer CAF-targeting-Medikamente erleichtern. Dieser Artikel berichtet über eine Methode zur effizienten Isolierung und Kultion primärer CAFs aus einem syngenen präklinischen Modell von Brustkrebs. Erfahrungsgemäß beeinflussen drei experimentelle Schritte meist den Erfolg des Protokolls.
Die erste arbeitet schnell, um die Aggregation von Zellsuspensionen zu vermeiden, die mit dem Risiko der Gerinnung in der Säule und der Verlangsamung des Zellausflusses verbunden sind: In der Tat, wenn Zellen, die durch die Säule gingen, zusammengeballt wurden, erhöhte sich die Wahrscheinlichkeit eines suboptimalen Isolationsprozesses, und die endgültigen Kulturen enthielten "kontaminierende" Zellklone. Die zweite besteht darin, Zellen aus verschiedenen Tumoren nach der Depletion-Passage zu bündeln, um zu garantieren, dass genügend Zellen im letzten Anreicherungsschritt durchlaufen werden. Das letzte kritische Problem ist die Beschichtung der extrahierten Zellen bei hohen Zelldichten, höchstwahrscheinlich ausgehend von einer einzigen Vertiefung der 24-Well-Platte, um das Zellwachstum und die Kolonieexpansion für bis zu 4-5 Passagen zu fördern. Wenn die Zellen mit geringer Dichte ausgesät wurden, dehnten sie sich auf der freien Oberfläche aus und hörten schnell auf, sich zu replizieren.
Mehrere Studien haben bereits CAF-Extraktionsmethoden sowohl menschlichen als auch mausischen Ursprungs beschrieben, um ihre Rolle bei der Förderung der Krebsentwicklung und Invasivität zu untersuchen. Dies wurde bei vielen Arten von Tumoren durchgeführt, einschließlich Brustkrebs, Melanom, Cholangiokarzinom und Pankreas-Adenokarzinom35,36,37,38. Aufgrund des Fehlens spezifischer CAF-Marker und ihrer Heterogenität sind die Ergebnisse dieser Prozesse jedoch immer noch suboptimal.
Hier wurden die isolierten Zellen verwendet, um die CAF-Targeting-Fähigkeit von HFn-Nanocages zu validieren, die mit Anti-FAP-Targeting-Anteilen funktionalisiert wurden. Die Verwendung von Primärkulturen von CAFs war ein wesentlicher Vorteil, der die Validierung der Nanostrategie ex vivo mit einem viel einfacheren und kostengünstigeren Bindungsexperiment ermöglichte, als dies direkt in vivo in dieser Vorphase der Nanodrug-Optimierung zu tun.
In diesem Sinne können Ex-vivo-Tests an CAFs In-vivo-Tierversuchen vorausgehen, indem sie das Screening und die Auswahl der vielversprechendsten Nanopartikel für das optimale Targeting von CAF ermöglichen. Das hier vorgestellte CAF-Modell kann auch für vorläufige Wirksamkeitsstudien verwendet werden, wenn Nanopartikel mit Wirkstoffen beladen werden. Tiere werden erst später verwendet, um Bioverteilung, Pharmakokinetik und Wirksamkeitsstudien zu bewerten.
Mehrere CAF-targeting-Nanodrugs werden entwickelt, wie Ferritin-Nanokäfige für die photodynamische Therapie bei Brustkrebs und peptidbasierte Partikel zur Abgabe von Doxorubicin in Prostatakrebsmodellen39,40. Allerdings haben sich nicht viele Studien auf die Isolierung von CAFs als Zellplattformen zur Nanodrug-Optimierung konzentriert.
Dieses Protokoll hat einige Einschränkungen. Erstens ist es ein zeitaufwendiges Protokoll, das die Vorbereitung und den Kauf mehrerer Reagenzien und Materialien erfordert. Zweitens ist aufgrund der Knappheit von CAFs im 4T1-Brusttumor ihre Ausbeute gering. Nanopartikelexperimente sollten geplant und durchgeführt werden, sobald die erforderliche Zellzahl erreicht ist, da primäre CAFs eine Seneszenz durchlaufen und nicht lange in Kultur gehalten werden können. Zusammenfassend lässt sich sagen, dass diese Methode der Isolierung, Kultivierung und Charakterisierung von CAFs ein leistungsfähiges Werkzeug sein kann, um die Entwicklung neuer zielgerichteter Nanomedikamente im Kampf gegen Krebs zu beschleunigen.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Studie wurde von der Associazione Italiana per la Ricerca sul Cancro (AIRC) im Rahmen des Projekts IG 2017-ID. 20172 – P.I. Corsi Fabio – unterstützt. SM erkennt das pädiatrische klinische Forschungszentrum "Romeo und Enrica Invernizzi" an, das ihre Position unterstützt. AB dankt AIRC (ID. 20172 Projekt) und der Universität Mailand für das Forschungsstipendium. LS- und MS-Postdoc- und Promotionsstipendien werden von der Universität Mailand unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| ACK Lysing buffer | Lonza | 10-548E | Store at +15° to +30 °C. |
| Alexa Fluor 488 goat anti-human antibody | Immunological Science | IS-20022 | Protect from light. |
| Anti-FAP Fab fragment (3F2) | Creative Biolabs | TAB-024WM-F(E) | |
| BALB/c mice | Charles River | 028BALB/C | 7 weeks old female mice |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | Store at 2-8 °C. |
| CD45 antibody | Miltenyi Biotec | 130-110-796 | FITC-conjugated fluorescent antibody; clone REA 737; Store protected from light at 2–8 °C. |
| CD90.2 antibody | Miltenyi Biotec | 130-102-960 | PE-conjugated fluorescent antibody; clone 30-H12; Store protected from light at 2–8 °C. |
| Cell strainers 70 µm | VWR | 732-2758 | |
| CytoFLEX | Beckman Coulter | laser configuration B4-R2-V0 | |
| Dead cell Removal Kit | Miltenyi Biotec | 130-090-101 | contains 10 mL of Dead Cell Removal MicroBeads; 25 mL of 20× Binding Buffer Stock Solution. Store protected from light at 2−8 °C. |
| D-Luciferin | Caliper | 760504 | reagent for in vivo imaging |
| DMEM High Glucose w/o L-Glutamine w/ Sodium Pyruvate | Euroclone | ECB7501L | Warm at 37 °C in a water bath before use. |
| DMSO | Sigma-Aldrich | D2650 | |
| DPBS w/o Calcium, w/o Magnesium | Euroclone | ECB4004L | Keep at room temperature. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E9884 | |
| Fetal Bovine Serum | Euroclone | ECS0180L | Before use, heat at 56 °C for 30 min to kill all the complement proteins. |
| Fluorescein Istothiocyanate isomer I (FITC) | Sigma-Aldrich | F7250 | Store protected from light at 2–8 °C. |
| GentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | They are used in combination with the gentleMACS Dissociator. |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | Two samples can be processed in parallel. Special protocols have been developed for various tissues. |
| Goat serum | Euroclone | ECS0200D | |
| Ham's F12 w/o L-Glutamine | Euroclone | ECB7502L | Warm at 37 °C in a water bath before use. |
| IVIS Lumina II imaging system | Caliper Life Sciences | This imaging system is easy to use for both fluorescent and bioluminescent imaging in vivo. Equipped with a Living Image Software for analysis | |
| LD columns | Miltenyi Biotec | 130-042-901 | Composed of ferromagnetic spheres, designed for stringent depletion of unwanted cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use |
| L-Glutamine | Euroclone | ECB3000D | 200 mM stock |
| Light/fluorescence microscope equipped with camera | Leica Microsystems | DM IL LED Fluo/ ICC50 W CameraModule | inverted microscope for live cells with camera |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Separation Unit | Miltenyi Biotec | 130-090-976 | Position the magnet on appropriate stand before use. |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MS columns | Miltenyi Biotec | 130-042-201 | Composed of ferromagnetic spheres, designed for positive selection of cells. Position the required number of columns on the magnetic Separation Unit and equilibrate with buffer before use. |
| Mycoplasma Removal Agent | Euroclone | ECMC210A | Dilute in culture medium 1:100. |
| NaHCO3 | Invitrogen | A10235 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000C | |
| Non essential aminoacids | Euroclone | ECB3054D | |
| Penicillin-Streptomycin | Euroclone | ECB3001D | |
| Recombinant Human apoferritin H-homopolymer (HFn) | Molirom | MLR-P018 | |
| RPMI 1640 w/o L-Glutamine | Euroclone | ECB9006L | Warm at 37 °C in a water bath before use. |
| Tumor-Associated Fibroblast Isolation kit | Miltenyi Biotec | 130-116-474 | Contains 1 mL of Non-Tumor-Associated Fibroblast Depletion Cocktail, mouse; 1 mL of CD90.2 (Tumor-Associated Fibroblast) MicroBeads,mouse. Store protected from light at 2-8 °C. |
| Tumor Dissociation Kit | Miltenyi Biotec | 130-096-730 | Contains lyophilized enzymes (D, R, A) and buffer A; reconstitute enzymes according to the manufacturer's instructions, aliquot and store at - 20 °C. |
| Trypan blue 0.4% | Lonza | 17-942E | dilute 1:1 with a sample of cell suspension before counting the cells |
| TrypLE select | Gibco | 12563-029 | use at room temperature |
| Trypsin-EDTA | Lonza | BE17-161E | Warm at 37 °C in a water bath before use |
| T75 Primo TC flask | Euroclone | ET7076 | |
| Zeba Spin Desalting Columns | Thermo Fisher Scientific | 89890 | 7K MWCO, 2 mL |
| 1.5 mL tubes | Biosigma | CL15.002.0500 | |
| 15 mL tubes | Euroclone | ET5015B | |
| 4T1-luc2 | Caliper | Mouse mammary gland cancer cell line stably transfected with firefly luciferase gene | |
| 50 mL tubes | Euroclone | ET5050B |
Referenzen
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nature Medicine. 19 (11), 1423-1437 (2013).
- Velaei, K., Samadi, N., Barazvan, B., Soleimani Rad, J. Tumor microenvironment-mediated chemoresistance in breast cancer. Breast. 30, 92-100 (2016).
- Cheng, J. D., Weiner, L. M., et al. Tumors and their microenvironments: tilling the soil. Commentary re: A. M. Scott et al., A Phase I dose-escalation study of sibrotuzumab in patients with advanced or metastatic fibroblast activation protein-positive cancer. Clinical Cancer Research. 9 (5), 1690-1695 (2003).
- Hui, L., Chen, Y. Tumor microenvironment: Sanctuary of the devil. Cancer Letters. 368 (1), 7-13 (2015).
- Balkwill, F. R., Capasso, M., Hagemann, T. The tumor microenvironment at a glance. Journal of Cell Science. 125, 5591-5596 (2012).
- Chen, X., Song, E. Turning foes to friends: targeting cancer-associated fibroblasts. Nature Review. Drug Discovery. 18 (2), 99-115 (2019).
- Franco, O. E., Shaw, A. K., Strand, D. W., Hayward, S. W. Cancer associated fibroblasts in cancer pathogenesis. Seminars in Cell & Developmental Biology. 21 (1), 33-39 (2010).
- LeBleu, V. S., Kalluri, R. A peek into cancer-associated fibroblasts: origins, functions and translational impact. Disease Models & Mechanisms. 11, (2018).
- Li, X. -Y., Hu, S. -Q., Xiao, L. The cancer-associated fibroblasts and drug resistance. European Review for Medical and Pharmacological Sciences. 19 (11), 2112-2119 (2015).
- Luo, H., Tu, G., Liu, Z., Liu, M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Letters. 361 (2), 155-163 (2015).
- Truffi, M., Sorrentino, L., Corsi, F. Fibroblasts in the tumor microenvironment. Advances in Experimental Medicine and Biology. 1234, 15-29 (2020).
- Sugimoto, H., Mundel, T. M., Kieran, M. W., Kalluri, R. Identification of fibroblast heterogeneity in the tumor microenvironment. Cancer Biology & Therapy. 5 (12), 1640-1646 (2006).
- Costa, A., et al. Fibroblast heterogeneity and immunosuppressive environment in human breast cancer. Cancer Cell. 33 (3), 463-479 (2018).
- Ishii, G., Ochiai, A., Neri, S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Advances Drug Delivery Reviews. 99, Part B 186-196 (2016).
- Chen, Q., et al. Remodeling the tumor microenvironment with emerging nanotherapeutics. Trends in Pharmacological Sciences. 39 (1), 59-74 (2018).
- Truffi, M., et al. Nano-strategies to target breast cancer-associated fibroblasts: rearranging the tumor microenvironment to achieve antitumor efficacy. International Journal of Molecular Sciences. 20 (6), 1263(2019).
- Tong, R., Langer, R. Nanomedicines Targeting the Tumor Microenvironment. Cancer Journal. 21 (4), 314-321 (2015).
- Kaps, L., Schuppan, D. Targeting cancer associated fibroblasts in liver fibrosis and liver cancer using nanocarriers. Cells. 9 (9), 2027(2020).
- Miao, L., et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors. Cancer Research. 77 (3), 719-731 (2017).
- Kelly, T., Huang, Y., Simms, A. E., Mazur, A. Fibroblast activation protein-α: a key modulator of the microenvironment in multiple pathologies. International Review of Cell and Molecular Biology. 297, 83-116 (2012).
- Brennen, W. N., Isaacs, J. T., Denmeade, S. R. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy. Molecular Cancer Therapeutics. 11 (2), 257-266 (2012).
- Juillerat-Jeanneret, L., Tafelmeyer, P., Golshayan, D. Fibroblast activation protein-α in fibrogenic disorders and cancer: more than a prolyl-specific peptidase. Expert Opinion on Therapeutic Targets. 21, 977-991 (2017).
- Falvo, E., et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin. Nanoscale. 5 (24), 12278-12285 (2013).
- Truffi, M., et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer. Pharmacological Research. 107, 57-65 (2016).
- Cai, Y., et al. Enhanced magnetic resonance imaging and staining of cancer cells using ferrimagnetic H-ferritin nanoparticles with increasing core size. International Journal of Nanomedicine. 10, 2619-2634 (2015).
- Heger, Z., Skalickova, S., Zitka, O., Adam, V., Kizek, R. Apoferritin applications in nanomedicine. Nanomedicine. 9 (14), 2233-2245 (2014).
- Mazzucchelli, S., et al. Nanometronomic treatment of 4T1 breast cancer with nanocaged doxorubicin prevents drug resistance and circumvents cardiotoxicity. Oncotarget. 8 (5), 8383-8396 (2017).
- Yu, Q., et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy. Journal of Controlled Release. 321, 564-575 (2020).
- Mertens, J. C., et al. Therapeutic effects of deleting cancer-associated fibroblasts in cholangiocarcinoma. Cancer Research. 73 (2), 897-907 (2013).
- Kovács, D., et al. Core-shell nanoparticles suppress metastasis and modify the tumour-supportive activity of cancer-associated fibroblasts. Journal of Nanobiotechnology. 18, 18(2020).
- Sharon, Y., Alon, L., Glanz, S., Servais, C., Erez, N. Isolation of normal and cancer-associated fibroblasts from fresh tissues by Fluorescence Activated Cell Sorting (FACS). Journal of Visualized Experiments. (71), e4425(2013).
- Sitia, L., et al. Selective targeting of cancer-associated fibroblasts by engineered H-ferritin nanocages loaded with navitoclax. Cells. 10 (2), 328(2021).
- Bellini, M., et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in cancer cells. Journal of Controlled Release. 196, 184-196 (2014).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nature Reviews Cancer. 20, 174-186 (2020).
- Dvořánková, B., Lacina, L., Smetana, K. Isolation of normal fibroblasts and their cancer-associated counterparts (CAFs) for biomedical research. Methods in Molecular Biology. 1879, 393-406 (2018).
- Calvo, F., Hooper, S., Sahai, E. Isolation and immortalization of fibroblasts from different tumoral stages. Bio-protocol. 4 (7), 1097(2014).
- Sha, M., et al. Isolation of cancer-associated fibroblasts and its promotion to the progression of intrahepatic cholangiocarcinoma. Cancer Medicine. 7 (9), 4665-4677 (2018).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Zhen, Z., et al. Protein nanocage mediated fibroblast-activation protein targeted photoimmunotherapy to enhance cytotoxic T cell infiltration and tumor control. Nano Letters. 17 (2), 862-869 (2017).
- Ji, T., et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery. Advances Materials. 27 (11), 1865-1873 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten